Method Article
הקרנת תפוקה גבוהה של תרכובות כימיות כדי להבהיר את השפעתם על התמדה חיידקית
In This Article
Summary
בנייר שיטה זה, אנו מציגים אסטרטגיית סינון בתפוקה גבוהה לזיהוי תרכובות כימיות, כגון אוסמוליטים, שיש להן השפעה משמעותית על התמדה חיידקית.
Abstract
מתמידי חיידקים מוגדרים כתת-אוכלוסיות קטנות של גרסאות פנוטיפיות עם היכולת לסבול ריכוזים גבוהים של אנטיביוטיקה. הם דאגה בריאותית חשובה כפי שהם קושרו עם זיהומים כרוניים חוזרים ונשנים. למרות הדינמיקה סטוכסטי ודטרמיניסטי של מנגנונים הקשורים ללחץ ידועים לשחק תפקיד משמעותי בהתמדה, מנגנונים שבבסיס המעבר פנוטיפי אל / ממצב ההתמדה אינם מובנים לחלוטין. בעוד גורמי התמדה המופעלים על ידי אותות סביבתיים (למשל, דלדול של מקורות פחמן, חנקן וחמצן) נחקרו בהרחבה, ההשפעות של osmolytes על התמדה עדיין לא נקבעו. באמצעות microarrays (כלומר, 96 לוחות באר המכילים כימיקלים שונים), עיצבנו גישה כדי להבהיר את ההשפעות של osmolytes שונים על Escherichia coli התמדה באופן תפוקה גבוהה. גישה זו היא טרנספורמטיבית כפי שהוא יכול להיות מותאם בקלות עבור מערכי הקרנה אחרים, כגון לוחות סמים וספריות נוקאאוט גנים.
Introduction
תרביות חיידקים מכילות תת-אוכלוסיות קטנות של תאים מתמידים הסובלניים באופן זמני לרמות גבוהות במיוחד של אנטיביוטיקה. תאים מתמידים זהים גנטית לקינס הרגישים לאנטיביוטיקה שלהם, והישרדותם יוחסה לעיכוב גדילה חולף1. תאים מתמידים התגלו לראשונה על ידי גלדיסתחביב 2 אבל המונח שימש לראשונה על ידי ג'וזף ביגר כאשר הוא זיהה אותם בתרבויות פיוגנס סטפילוקוקוס שטופלו פניצילין3. מחקר מכונן שפורסם על ידי Balaban et al.4 גילה שני סוגים מתמידים: גרסאות מסוג I הנוצרות בעיקר על ידי מעבר דרך השלב הנייח, וגרסאות סוג II הנוצרות ברציפות במהלך הצמיחה המעריכית. מתמידים מזוהים על ידי מבחני הישרדות קלונוגניים, שבהם דגימות תרבות נלקחות במרווחי זמן שונים במהלך טיפולים אנטיביוטיים, שטופים, מצופים על מדיום צמיחה טיפוסי לספור את התאים ששרדו שיכולים להתיישב בהעדר אנטיביוטיקה. קיומם של מתמידים בתרבית התא מוערך על ידי עקומת להרוג biphasic4,5 שבו הריקבון המעריכי הראשוני מציין את מותם של תאים רגישים לאנטיביוטיקה. עם זאת, מגמת ההרג פוחתת עם הזמן, ובסופו של דבר מובילה לאזור מישור המייצג את התאים המתמשכים ששרדו.
תאים מתמידים קושרו עם מחלות שונות כגון שחפת6, סיסטיק פיברוזיס7, קנדידה8 ודלקות בדרכי השתן9. כמעט כל המיקרואורגניזמים שנבדקו עד כה נמצאו כדי ליצור פנוטיפים מתמידים, כולל שחפת מיקובקטריוםפתוגנית מאוד6, סטפילוקוקוס אוראוס10, פסאודומונס aeruginosa7 ו קנדידה אלביקנס8. מחקרים אחרונים מספקים גם ראיות לעלייתם של מוטנטים עמידים multidrug מתת-אוכלוסיות מתמידות11,12. מאמצים ניכרים בתחום זה גילו כי מנגנוני ההתמדה מורכבים ומגוונים ביותר; הן גורמים סטוכסטיים ודטרמיניסטיים הקשורים לתגובת SOS13,14, מיני חמצן תגובתי (ROS)15, מערכות רעלן/אנטיטוקסין (ת"א)16, אוטופגיה או עיכול עצמי17 ותגובה מחמירה הקשורה ל- ppGpp18 ידועים כמקלים על היווצרות מתמשכת.
למרות התקדמות משמעותית בהבנת פנוטיפ ההתמדה, ההשפעות של אוסמוליטים על התמדה חיידקית לא הובנו במלואן. מאז השמירה על לחץ אוסמוטי אופטימלי הוא הכרח לצמיחה של התאים, תפקוד תקין והישרדות, מחקר מעמיק של osmolytes יכול להוביל מטרות פוטנציאליות עבור אסטרטגיות אנטי מתמיד. למרות מייגע, סינון תפוקה גבוהה היא גישה יעילה מאוד לזיהוי מטבוליטים וכימיקלים אחרים הממלאים תפקיד מכריע בפנוטיפ התמדה19,20. בעבודה זו, נדון בשיטה שפורסמהשלנו 19, שם השתמשנו microarrays, כלומר, 96 לוחות באר המכילים osmolytes שונים (למשל, נתרן כלורי, אוריאה, נתרן חנקתי, נתרן חנקתי, אשלגן כלורי), כדי לזהות osmolytes המשפיעים באופן משמעותי E. coli התמדה.
Protocol
1. הכנת מדיום צמיחה, פתרון אולוקסאצין ומניות תאי E. coli
- מדיום לוריא-ברטני רגיל (LB): הוסף 10 גרם/ליטר של טריפטון, 10 גרם/ליטר של נתרן כלורי (NaCl) ו-5 גרם/ליטר של תמצית שמרים במים שעברו דה-יון (DI). לעקר את המדיום על ידי autoclaving.
- צלחות אגר LB: להוסיף 10 גרם / ליטר של טריפטון, 10 גרם / L של NaCl, 5 גרם / L של תמצית שמרים ו 15 גרם / L אגר במים DI לעקר את המדיום על ידי autoclaving. בטמפרטורה הרצויה (~ 55 מעלות צלזיוס), יוצקים ~ 30 מ"ל של אגר בינוני לתוך צלחות מרובעות (10 x 10 ס"מ). יבש את הצלחות ולאחסן ב 4 מעלות צלזיוס.
- בינוני LB שונה: להוסיף 10 גרם / ליטר של טריפטון ו 5 g / L של תמצית שמרים במים DI. לעקר את המדיום על ידי autoclaving.
- מדיום LB שונה כולל אוסמוליט: מערבבים מדיום LB שונה 2x עם פתרון osmolyte 2x בכמויות שוות. כדי להכין 2x שונה LB בינוני, להוסיף 20 גרם / ליטר של טריפטון ו 10 g / L של תמצית שמרים במים DI לעקר על ידי autoclaving. כדי להכין את הפתרון osmolyte 2x, להמיס את osmolyte של עניין (כמות 2x) במים DI, ולאחר מכן לסנן לעקר את הפתרון.
הערה: ניתן לקבוע את אוסמוליט העניין וריכוזיו ממאמרי ההקרנה של פנוטיפ מיקרו-ארי (ראה פרוטוקול 4). עם זאת, osmolyte נבדק ואת הריכוז 2x הקשורים ניתן להתאים בהתאם לאופי המחקר. לדוגמה, כדי ללמוד את ההשפעה של 1 mM נתרן כלורי, פתרון osmolyte 2x יהיה פתרון נתרן כלורי 2m. - פתרון מלאי Ofloxacin (5 מ"ג / מ"ל): להוסיף 5 מ"ג של מלח ofloxacin (OFX) ב 1 מ"ל של מים DI. הוסף 10 μL של 10 M נתרן הידרוקסידי כדי להגדיל את המסיסות של OFX במים, ולאחר מכן לסנן לעקר את הפתרון. הכינו aliquots ולאחסן ב -20 מעלות צלזיוס.
הערה: Ofloxacin היא אנטיביוטיקה quinolone כי כבר בשימוש נרחב עבור תאים חיידקיים גדל ולא גדל14,21. הריכוז המעכב המינימלי (MIC) של OFX לתאי E. coli MG1655 נמצא בטווח של 0.039-0.078 מיקרוגרם / מ"ל19,20. כמו כן שים לב כי אנטיביוטיקה אחרים כגון אמפיצילין ו kanamycin משמשים בדרך כלל במחקר מתמיד. הבחירה באנטיביוטיקה תלויה באופי המחקר. - אי קולי מניות תא MG1655: לחסן 2 מ"ל של מדיום LB רגיל עם מושבה אחת במבחנה 14 מ"ל (snap-capped) ותרבות התאים בשייקר מסלולית ב 250 סל"ד ו 37 °C (67 °F). כאשר התאים מגיעים לשלב הנייח, מערבבים 500 μL של תרבות התא עם 500 μL של 50% גליצרול (סטרילי) בבקבוקון קריוגני ולאחסן ב -80 מעלות צלזיוס.
2. הפצת תאים כדי לחסל מתמידים קיימים
- כדי להכין תרבות לילה, לגרד כמות קטנה של תאים ממלאי תא קפוא עם קצה פיפטה סטרילי (לא להפשיר את מלאי תא גליצרול), ולחסן את התאים ב 2 מ"ל של מדיום LB שונה במבחנה 14 מ"ל snap-capped. תרבות התאים בשייקר מסלולית ב 250 סל"ד ו 37 °C (69 °F) עבור 12 שעות.
- הפצה ראשונה
- לאחר 12 שעות, להעביר 250 μL של תרבות הלילה ל 25 מ"ל של מדיום LB שונה טרי בבקבוק 250 מ"ל מבולבל מכוסה רדיד אלומיניום סטרילי.
- הגדל את תרבית התאים בשייקר מסלולי במהירות של 250 סל"ד ו- 37 °C (600 סל"ד) עד שהתאים יגיעו לשלב המעריכי האמצעי (OD600 = 0.5).
- למדוד את הצפיפות האופטית ב 600 ננומטר (OD600) באמצעות קורא microplate כל 30 דקות.
- הפצה שנייה
- ב OD600 = 0.5, לדלל 250 μL של תרבות התא מן הבקבוק הראשון לתוך 25 מ"ל של מדיום LB שונה טרי בבקבוק 250 מ"ל מבולבל.
- הגדל את תרבות התאים השנייה בשייקר מסלולי במהירות של 250 סל"ד ו- 37 °C (600 אובדנית) עדOD 600=0.5.
- למדוד את הצפיפות האופטית כל 30 דקות.
הערה: תרבות לילה עשויה להיות כמות משמעותית של תאים מתמידים4,5,22. שיטת מחזור דילול / צמיחה5 המתואר לעיל ניתן להשתמש כדי לחסל אלה מתמידים קיימים לפני העברת התאים microarrays. ניתן לאמת את חיסולם על ידי כימות רמות מתמשכות של תרבויות לילה עם ההסתעפות המתוארת בפרוטוקול 3. שיטה זו כבר אומתה במחקר קודם19.
3. אימות חיסול של תאים מתמידים קיימים
- לאחר ההפצה השנייה (ראה שלב 2.3), לדלל 250 μL של תרבות התא (OD600 = 0.5) ב 25 מ"ל של מדיום LB שונה טרי בבקבוק 250 מ"ל מבולבל.
הערה: עבור פקדים, לדלל 250 μL של תרבות הלילה (ראה שלב 2.1) ב 25 מ"ל של מדיום LB שונה טרי בבקבוק 250 מ"ל מבולבל. לפני העברת התאים לבקבוקון, יש להתאים את צפיפות התאים של תרבות הלילה במדיום LB שונה טרי כדי להשיג OD600 = 0.5. - הוסף 25 μL של פתרון מניית OFX (5 מ"ג / מ"ל) לתוך ההשעיה התא ולנער את הבקבוק בעדינות כדי להפוך את תרבות התספורת הומוגנית. הריכוז הסופי של OFX הוא 5 מיקרוגרם / מ"ל בתרבות ההסתעפות.
- דגירה את תרבות מבחני במסלול שייקר ב 250 סל"ד ו 37 °C (69 °F).
- בכל שעה במהלך הטיפול (כולל 0 שעות, נקודת הזמן לפני הוספת OFX לתרבות ההסתעפות), להעביר 1 מ"ל של תרבות ההסתעפות מהבקבוק לצינור מיקרוצנטריפוגה 1.5 מ"ל.
- צנטריפוגה תרבות ההסתעפות בצינור microcentrifuge ב 17,000 x g במשך 3 דקות.
- בזהירות להסיר 950 μL של supernatant מבלי להפריע גלולה התא.
- הוסף 950 μL של תמיסת מלח אגירה פוספט (PBS) לתוך הצינור microcentrifuge.
- חזור על שלבי הכביסה 3.5-3.7 עבור 3x בסך הכל עד ריכוז אנטיביוטי הוא מתחת לריכוז המעכב המינימלי (MIC).
- לאחר הכביסה הסופית, resuspend גלולת התא ב 100 μL של פתרון PBS, וכתוצאה מכך מדגם מרוכז 10x.
- קח 10 μL של השעיית התא באופן סדרתי לדלל שש פעמים ב 90 μL של פתרון PBS באמצעות צלחת 96 גם עגול התחתון.
- ספוט 10 μL של השעיות תא מדולל על צלחות אגר טרי ללא אנטיביוטיקה. כדי להגדיל את מגבלת הגילוי, צלחת 90 μL הנותרים של השעיית תא על צלחת אגר טרי.
- דגירה צלחות אגר ב 37 °C (60 °F) עבור 16 שעות, ולאחר מכן לספור את יחידות יוצרות המושבה (CFUs). חשבון עבור שיעורי הדילול בעת חישוב המספר הכולל של CFUs ב 1 מ"ל של תרבות assay. עקומות להרוג נוצרים על ידי התוויית ערכי CFU לוגריתמי ביחס למשך הטיפול האנטיביוטי.
הערה: טיפול OFX 6 שעות מספיק כדי להשיג עקומת להרוג biphasic עבור E. coli תאים19,20. הרמה המתמשכת של תאים מופצים (כפי שנמדד על ידי ספירת CFU ב 6 שעות) צריך להיות נמוך משמעותית מזה של תרבות הלילה. ניתן לבצע את ההליכים המתוארים בפרוטוקול 2 ו- 3 עם LB רגיל בהתאם לעיצוב המחקר.
4. הקרנות צלחת Microarray
- הכנת תרביות מיקרו-תאיות
- העבר 250 μL של תאים אקספוננציאליים פאזה ל 25 מ"ל של מדיום LB שונה טרי בצינור צנטריפוגה 50 מ"ל. מערבבים בעדינות את השעיית התא כדי להפוך אותו הומוגני.
הערה: תאי השלב המעריכי (OD600 = 0.5) מתקבלים משלב ההפצה השני (ראה שלב 2.3). - להעביר את המתלה תא מדולל לתוך מאגר סטרילי 50 מ"ל.
- באמצעות פיפטה רב ערוצית, להעביר 150 μL של השעיית התא לכל באר של microarray, כלומר, צלחת 96 גם המכיל osmolytes שונים.
הערה: בארות שאין להן אוסמוליטים משמשות כפקדים. - כסו את המיקרו-ראי בקרום איטום חדיר לגז.
- דגירה את הצלחת בשייקר מסלולי ב 37 °C (69 °F) ו 250 סל"ד עבור 24 שעות.
הערה: בניסויים אלה נעשה שימוש בלוחות מסחריים זמינים, כגון Phenotype Microarrays (PM-9 ו- PM-10) הכוללים מגוון רחב של אוסמוליטים, מאגרי pH וכימיקלים אחרים במצב מיובש בריכוזים שונים. microarrays אלה נמצאים במחצית שטח 96 פורמטים צלחת היטב. יש להתאים את נפחי התרבות בהתאם לסוג הלוחות הנמצאים בשימוש. Microarrays יכול גם להיווצר באופן ידני (ראה להלן).
- העבר 250 μL של תאים אקספוננציאליים פאזה ל 25 מ"ל של מדיום LB שונה טרי בצינור צנטריפוגה 50 מ"ל. מערבבים בעדינות את השעיית התא כדי להפוך אותו הומוגני.
- הכנה ידנית של צלחות מיקרו-ראי
- העבר 75 μL של פתרונות osmolyte 2x לתוך בארות של חצי שטח 96 צלחת היטב.
- העבר 500 μL של תאים אקספוננציאליים פאזה ל 25 מ"ל של 2x שונה LB בינוני בצינור צנטריפוגה 50 מ"ל. מערבבים בעדינות את השעיית התא כדי להפוך אותו הומוגני.
הערה: קצב החיסון הותאם כך שיהיה עקבי עם פרוטוקול המיון של המיקרו-קרינה המתואר ב- 4.1. - הוסף 75 μL של השעיית התא לתוך כל באר של חצי אזור 96 צלחת היטב המכילה פתרונות osmolyte 2x.
- דגירה את הצלחת בשייקר מסלולי ב 37 °C (69 °F) ו 250 סל"ד עבור 24 שעות.
- הכנת לוחות מבחנים מתמידים
- הכן 25 מ"ל של מדיום LB שונה המכיל 5 מיקרוגרם / מ"ל של OFX בצינור צנטריפוגה 50 מ"ל ולהעביר מדיום זה למאגר סטרילי.
- העבר 190 μL של מדיום LB שונה עם OFX מהמאגר לתוך כל באר של צלחת גנרית שטוחה תחתון 96 היטב (צלחת מתמיד-assay) באמצעות פיפטה רב ערוצית.
- הסר את microarray מן שייקר (לאחר culturing עבור 24 שעות) ולהעביר 10 μL של תרביות התא מן microarray אל בארות של צלחת מתמיד-assay, המכיל מדיום LB שונה עם OFX.
- קח 10 μL של השעיות תאים מלוח ההשעיה-assay באופן סדרתי לדלל שלוש פעמים ב 290 μL של פתרון PBS באמצעות צלחת עגולה למטה 96 גם פיפטה רב ערוצית.
- בעקבות הדילול הסדרתי, ספוט 10 μL של כל השעיות תאים בדילול סדרתי על צלחות אגר טרי ללא אנטיביוטיקה באמצעות פיפטה רב ערוצית.
- דגירה צלחת מתמיד-assay (מוכן בשלב 4.3.3) בשייקר מסלולית ב 37 מעלות צלזיוס ו 250 סל"ד עבור 6 שעות לאחר כיסוי הצלחת עם קרום איטום חדיר גז.
- לאחר 6 שעות דגירה בשייקר, לקחת את צלחת מתמיד-assay החוצה ולחזור על השלבים 4.3.4-4.3.5.
- דגירה צלחות אגר עבור 16 שעות ב 37 °C (69 °F), ולאחר מכן לספור CFUs. רמות CFU לפני ו 6 שעות לאחר הטיפול האנטיביוטי לאפשר לחשב את השבר מתמיד בכל באר. CFU נחשב לפני הטיפול OFX גם לעזור להעריך את ההשפעות של osmolytes ועל הכדאיות E. coli.
5. אימות התנאים שזוהו
- העבר 250 μL של תאי פאזה מעריכיים משלב 2.3 עד 25 מ"ל של מדיום LB שונה טרי המכיל את osmolyte מזוהה מן ההקרנה microarray (ראה פרוטוקול 4).
- דגירה הבקבוק בשייקר מסלולית ב 250 סל"ד ו 37 °C (69 °F) עבור 24 שעות.
- לאחר 24 שעות, להסיר את הבקבוק מן שייקר ולהעביר 250 μL של תרבות התא ל 25 מ"ל של מדיום LB שונה טרי בבקבוק 250 מ"ל מבולבל.
- הוסף 25 μL של פתרון מניית OFX (5 מ"ג / מ"ל) בהשעיית התא ולנער את הבקבוק בעדינות כדי להפוך את תרבות התספורת הומוגנית. דגירה את הבקבוק בשייקר ב 37 °C (60 °F) ו 250 סל"ד.
- בכל שעה במהלך הטיפול, להעביר 1 מ"ל של תרבות התסעפות מן הבקבוק לצינור microcentrifuge 1.5 מ"ל.
- צנטריפוגה תרבות ההסתעפות בצינור microcentrifuge ב 17,000 x g במשך 3 דקות.
- הסר 950 μL של supernatant ולהוסיף 950 μL של PBS.
- חזור על שלבי הכביסה 5.6 ו- 5.7 עבור 3x.
- לאחר הכביסה הסופית, resuspend גלולת התא ב 100 μL של פתרון PBS.
- קח 10 μL של השעיית התא באופן סדרתי לדלל 6x ב 90 μL של פתרון PBS באמצעות צלחת 96 גם עגול התחתון.
- ספוט 10 μL של השעיות תא מדולל על צלחת אגר טרי ללא אנטיביוטיקה. כדי להגדיל את מגבלת הגילוי, צלחת 90 μL הנותרים של השעיית תא על צלחת אגר טרי.
- דגירה צלחת אגר ב 37 °C (60 °F) עבור 16 שעות, ולאחר מכן לספור CFUs.
תוצאות
איור 1 מתאר את הפרוטוקול הניסיוני שלנו. ניסויי מחזור הדילול/צמיחה (ראו פרוטוקול 2) הותאמו ממחקר שערכה קרן ואח'5 כדי לחסל את המתמידים שמקורם בתרבויות הלילה. איור 2A הוא תמונה מייצגת של לוחות אגר המשמשים לקביעת רמות CFU של תרביות תאים לפני ואחרי טיפול OFX. בניסויים אלה, תאים היו תרבית במדיום LB שונה עם osmolytes במחצית שטח 96 לוחות באר כמתואר בשלב 4.2. לאחר דגירה של הצלחת בשייקר מסלולי במשך 24 שעות, ההסתעפות המתמשכת בוצעה באמצעות צלחת גנרית שטוחה 96 באר (ראה שלב 4.3). osmolytes ואת הריכוז שנבדק כאן נבחרו על סמך המחקר הקודם שלנו19, שבו ביצענו שלבים 4.1 ו 4.3 באמצעות צלחת PM-9 הכולל אוסמוליטים שונים בריכוזים שונים (נתרן כלורי, אשלגן כלורי, נתרן גופרתי, אתילן גליקול, נתרן פורמט, אוריאה, נתרן לקטט, נתרן פוספט, נתרן בנזואט, אמוניום גופרתי, נתרן ניטריט ונתרן חנקתי). העמודה הראשונה באיור 2A מציגה את ספירות ה- CFU של קבוצת הביקורת. העמודה השנייה מייצגת מצב שבו התאים היו בתרבית של 100 מ"מ נתרן חנקתי; מצב זה נמצא בעבר כדי להגדיל במעט את רמות מתמיד19. העמודה השלישית מייצגת מצב שבו התאים היו תרבית 60 mM נתרן ניטריט, ומצב זה נמצא בעבר כדי להקטין באופן משמעותי את רמות מתמיד לעומת פקדים19. איור 2B הוא ייצוג גרפי של נתוני CFU המתקבלים מלוחות אגר. איור 2C מציג את השברים המתמשכים של תרביות התאים שנבדקו ב-96 לוחות באר. כדי לחשב את השברים, ספירות מתמידים היו מנורמלים לספירת התאים שהושגו לפני הטיפולים האנטיביוטיים. איור 3 מציג את עקומות ההרג הדו-צדדיות ואת השברים המתמשכים, בהתאמה, עבור תרבויות ההסתעפות המבוצעות בבקבוקונים מבולבלים. בניסויים אלה, התאים היו תרבית לראשונה 25 מ"ל של מדיום LB שונה עם osmolytes המצוין ב 250 מ"ל בקבוקים מבולבלים במשך 24 שעות, ולאחר מכן התאים הועברו צלושי מתמיד-assay לספירה מתמיד כמתואר בפרוטוקול 5.
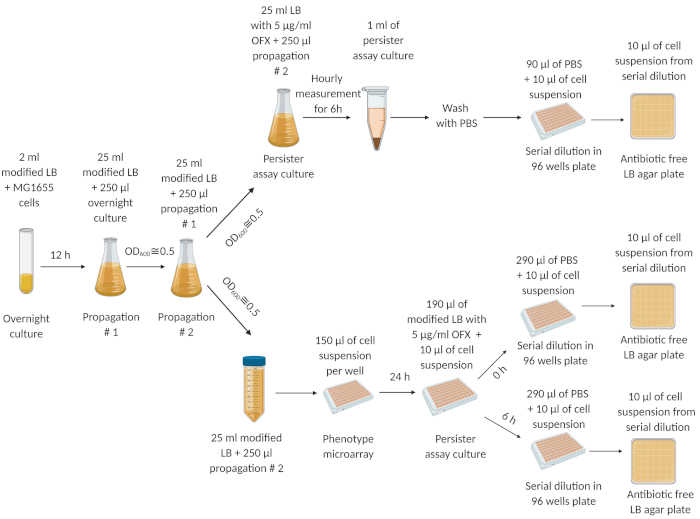
איור 1: ההליך הניסיוני. תאים ממלאי תאים קפואים גדלו בן לילה (12 שעות) במדיום LB טרי. ב 12 שעות, תרבות הלילה היה מדולל (1:100) ב 25 מ"ל של מדיום LB שונה וגדל עד OD600=0.5. שלב התפשטות זה חזר על עצמו פעמיים. לאחר שלב ההפצה הסופי, תאי הפאזה המעריכיים (ב OD600=0.5) היו מדוללים (1:100) במדיום LB שונה טרי בבקבוקון מבולבל של 250 מ"ל וצינור צנטריפוגה של 50 מ"ל, בהתאמה. השעיית התא בבקבוק 250 מ"ל מבולבל טופלה עם 5 מיקרוגרם / מ"ל של OFX לכמת מתמידים. המתלה התא בצינור צנטריפוגה 50 מ"ל הועבר microarrays ודגר במשך 24 שעות בשייקר מסלולית ב 250 סל"ד ו 37 °C (69 °F). התאים מהמיקרו-אראים הועברו לצלחות מתמידות כדי לכמת מתמידים. איור זה נוצר באמצעות biorender.com. נתון זה שונה מהפרסום הקודם שלנו19. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: ניסויים במיקרו-סדרה. (A)תאים גדלו לראשונה במדיום LB שונה עם או בלי osmolytes המצוין במחצית שטח 96 צלחת היטב במשך 24 שעות. התאים הועברו לאחר מכן לצלחת גנרית שטוחה תחתון 96 היטב וטופלו 5 מיקרוגרם / מ"ל של OFX עבור 6 שעות. לפני ואחרי טיפול 6 שעות, התאים היו מדוללים באופן סדרתי PBS, מצופה על צלחות אגר דגירה ב 37 מעלות צלזיוס במשך 16 שעות. לכל תנאי יש 8 שכפולים טכניים. (B) מדידות CFU בוצעו כדי להעריך את ההשפעות של osmolytes על הכדאיות וההתמדה של התא, בהתאמה. הקו הישר מציין את מגבלת הזיהוי (600 יחידות CFUs). (C) הגרף מייצג את השברים המתמשכים של תרביות התאים, המחושבים על ידי לקיחת היחס בין ספירת ה- CFU לאחר ולפני הטיפול ב- OFX. החלק המתמיד של תרבות התא שיש לו 60 מ"מ נתרן ניטריט לא חושב כמו רמת מתמיד שלה הוא מתחת לגבול הגילוי. כל נקודת נתונים הייתה מסומנת על-ידי ערך ממוצע ± סטיית תקן, שחושבה מתוך 8 שכפולים טכניים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
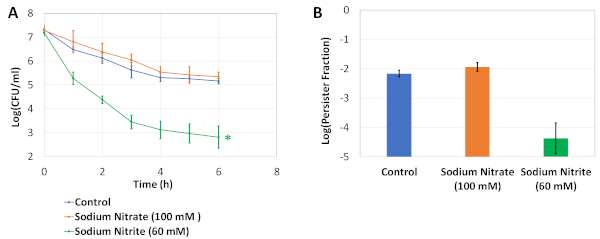
איור 3: ניסויי אימות. (A)תאים בשלב אקספוננציאלי הועברו 25 מ"ל של מדיום LB שונה טרי עם osmolytes המצוין ב 250 מ"ל צלושי מבולבל ותרבית במשך 24 שעות. לאחר מכן, התאים היו מדוללים (1:100) ב 250 מ"ל בקבוקים מבולבלים המכילים 25 מ"ל של בינוני LB שונה וטופלו 5 מיקרוגרם / מ"ל OFX עבור 6 שעות. ספירות CFU בתרבויות מבחנים היו במעקב לפי שעה כדי ליצור עקומות להרוג biphasic. * מציין את המצב המשפיע באופן משמעותי על רמות התמדה OFX לעומת פקדים ללא osmolyte (שתי זנבות לא שוויונית סטייה t-test, p<0.05). (ב)הגרף מייצג את השברים המתמשכים של התרבויות. כל נקודת נתונים הייתה מסומנת לפי ערך ממוצע ± סטיית תקן, שחושבה מתוך 3 משכפלים ביולוגיים. נתון זה שונה מהפרסום הקודם שלנו19. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
תפוקה גבוהה מתמיד assay המתואר כאן פותחה כדי להבהיר את ההשפעות של כימיקלים שונים על התמדה E. coli. בנוסף ללוחות PM מסחריים, microarrays ניתן לבנות באופן ידני כמתואר בשלב 4.2. יתר על כן, הפרוטוקול המוצג כאן הוא גמיש והוא יכול לשמש כדי לסנן microarrays אחרים, כגון לוחות סמים וספריות תאים, כי הם 96 פורמטים צלחת היטב. ניתן להתאים את התנאים הניסיוניים הכוללים את שלב הגדילה, קצב החיסון והבינוני לבדיקת ספריות אלה. לדוגמה, אם אחד רוצה להקרין ספריית תאים, כגון Keio E. coli אוסף נוקאאוט23, הם יכולים תחילה להעביר את הזנים מהספרייה ל 96 לוחות באר הכוללים מדיה טרייה, באמצעות פיפטה רב ערוצית. ברגע שהתאים מגיעים לשלב הגדילה הרצוי (למשל, שלב אקספוננציאלי או נייח), התאים מועברים ללוחות מתמידים כמתואר בשלב 4.3 כדי למנות את הרמות המתמשכות של זני הנוקאאוט. באופן דומה, אסטרטגיה זו יכולה לשמש כדי להקרין את אוסף E. coli Promoter 24 (ספרייה של זנים כתב פלואורסצנטי ב 96 פורמטים צלחת היטב) כדי לזהות מקדמים המופעלים על ידי אנטיביוטיקה. מקדמים אלה יכולים להיות מזוהים בקלות על ידי מדידת אותות פלואורסצנטיות של זנים בצלחות מתמיד-assay במהלך הטיפול האנטיביוטי.
בניסויים שלנו, השתמשנו LB שונה (חסר NaCl) כדי למנוע כל השפעה נוספת שיכולה לנבוע NaCl, בהתחשב בכך microarrays כבר יש osmolytes שונים. למרות NaCl במדיום LB רגיל ידוע להיות טוב לשמירה על שלמות הממברנה של תאים, דווח כי NaCl ב 0-1% טווח יש השפעה מינימלית על צמיחת תאים25. יתר על כן, תוצאות של propidium יודיד (PI) מכתים ומתמידים מבחנים במחקר הקודם שלנו הראו כי היעדר NaCl אינו משפיע באופן משמעותי על שלמות הממברנה ואת ההתמדה של E. coli תאים19. שינוי זה נעשה במיוחד כדי לטפל בחששות במחקר שלנו וניתן לשנותו בהתאם לאופי המחקר.
כמו כן, התאמנו שיטה שפותחה על ידי קרן ואח '5 כדי לחסל מתמידים קיימים בתרביות התאים שלנו לפני החיסון לתוך microarrays. סוג אני מתמידים ידועים להיווצר במהלך השלב הנייח; לכן, החיסון הישיר של התאים מתרביות לילה ללוחות microarray יעביר מספר משמעותי של מתמידים, אשר עלול לעכב את ההשפעות של osmolytes. עם ניסויי מחזור דילול /צמיחה (ראה פרוטוקול 2), הצלחנו להפחית באופן משמעותי את המתמידים המקדמים הנובעים מתרבויות הלילה19. נציין כי יש לנו תרבית התאים בלוחות microarray במשך 24 שעות כדי להיות מסוגל לספור את כל מתמידים, כולל גרסאות מסוג I שנוצרו במהלך השלב הנייח בנוכחות osmolytes. עם זאת, טכניקות מותאמות אלה תמיד ניתן לשנות בהתאם לאופי המחקר.
טיפלנו בתאים במיקרו-אסטרים עם 5 מיקרוגרם/ מ"ל OFX כדי למנות את המתמידים. מאז הליך הכביסה כדי להסיר את האנטיביוטיקה מ 96 דגימות יהיה מאוד עבודה אינטנסיבית, תאים לאחר הטיפול היו מדוללים באופן סדרתי PBS ללא כביסה (ראה שלב 4.2). הליך זה דילל את ריכוז OFX יותר מפי 30. השעיות התא המדולל היו אז מצופה על צלחות אגר ללא אנטיביוטיקה שבו OFX היה מפוזר עוד יותר. המחקרים הראשוניים שלנו שבהם חזרנו על ניסויים אלה עם וללא כביסה אימתו כי שיטת דילול סדרתי זה לא השפיע על רמות מתמיד19.
במהלך pipetting רב ערוצי ב 96 לוחות באר, יש לערבב בזהירות את המתלים התא כדי לשמור על חלוקת תא הומוגני. כדי לעשות זאת, בהתאם לנפח העבודה, זה יהיה מועיל לציין את המספר המינימלי של pipetting כי יש צורך להפוך את הפתרון הומוגני. לשם כך, ערכנו ניסוי בקרה פשוט שבו ניטרנו את הצינור (למעלה ולמטה) על ידי פיזור מולקולת צבע ב- PBS ובינוני בתנאים הנלמדים כאן. בנוסף, אם עובדים עם סביבות מורכבות יותר כגון מאגרי pH, היינו ממליצים למדוד את ה- pH של תרבות התאים לפני ובמהלך הדגירה בשייקר מכיוון שתרבות התאים נוטה להיות מאוד אלקליין (pH ≈ 8) לאורך זמן. זה יכול לתת מושג על האיכות, כמו גם את טווח ה- pH של המאגר בשימוש. בנוסף, על מנת לקבל CFUs לספור על לוחות אגר ממבחני תפוקה גבוהה, תנאים מסוימים, כגון קצב חיסון התא, גיל התרבויות, ופרמטרים דילול סדרתי (נפח PBS, שיעורי דילול ומספר שלבי דילול, וכו ') צריך להיות אופטימיזציה לפני בדיקת microarrays. לבסוף, התוצאות המתקבלות microarrays צריך להיות מאומת עוד יותר צלוחיות כמו נפח התרבות, שטח הפנים ואת האוויר בצלחת 96 גם יכול להיות השפעות נוספות על התוצאות שנצפו.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות לחברי מעבדת אורמן על התשומות החשובות שלהם במהלך מחקר זה. מחקר זה מומן על ידי פרס המעבר לקריירה של NIH/NIAID K22AI125468 ומענק סטארט-אפ מאוניברסיטת יוסטון.
Materials
| Name | Company | Catalog Number | Comments |
| 14-ml test tube | Fisher Scientific | 14-959-1B | |
| E. coli strain MG1655 | Princeton University | Obtained from Brynildsen lab | |
| Flat-bottom 96-well plate | USA Scientific | 5665-5161 | |
| Gas permeable sealing membrane | VWR | 102097-058 | Sterilized by gamma irradiation and free of cytotoxins |
| Half-area flat-bottom 96-well plate | VWR | 82050-062 | |
| LB agar | Fisher Scientific | BP1425-2 | Molecular genetics grade |
| Ofloxacin salt | VWR | 103466-232 | HPLC ≥97.5 |
| Phenotype microarray (PM-9 and PM-10) | Biolog | N/A | PM-9 and PM-10 plates contained various osmolytes and buffers respectively |
| Round-bottom 96-well plate | USA Scientific | 5665-0161 | |
| Sodium chloride | Fisher Scientific | S271-500 | Certified ACS grade |
| Sodium nitrate | Fisher Scientific | AC424345000 | ACS reagent grade |
| Sodium nitrite | Fisher Scientific | AAA186680B | 98% purity |
| Square petri dish | Fisher Scientific | FB0875711A | |
| Tryptone | Fisher Scientific | BP1421-500 | Molecular genetics grade |
| Varioskan lux multi mode microplate reader | Thermo Fisher Scientific | VLBL00D0 | Used for optical density measurement at 600 nm |
| Yeast extract | Fisher Scientific | BP1422-100 | Molecular genetics grade |
References
- Lewis, K. Persister cells, dormancy and infectious disease. Nature Reviews Microbiology. 5 (1), 48-56 (2007).
- Hobby, G. L., Meyer, K., Chaffee, E. Observations on the Mechanism of Action of Penicillin. Experimental Biology and Medicine. 50 (2), 281-285 (1942).
- Bigger, J. Treatment of staphylococcal infections with penicillin by intermittent sterilisation. The Lancet. 244 (6320), 497-500 (1944).
- Balaban, N. Q., Merrin, J., Chait, R., Kowalik, L., Leibler, S. Bacterial persistence as a phenotypic switch. Science. 305 (5690), 1622-1625 (2004).
- Keren, I., Kaldalu, N., Spoering, A., Wang, Y., Lewis, K. Persister cells and tolerance to antimicrobials. FEMS Microbiology Letters. 230 (1), 13-18 (2004).
- Keren, I., Minami, S., Rubin, E., Lewis, K. Characterization and transcriptome analysis of mycobacterium tuberculosis persisters. mBio. 2 (3), (2011).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa Strains Producing High Levels of Persister Cells in Patients with Cystic Fibrosis. Journal of Bacteriology. 192 (23), 6191-6199 (2010).
- LaFleur, M. D., Kumamoto, C. A., Lewis, K. Candida albicans biofilms produce antifungal-tolerant persister cells. Antimicrobial Agents and Chemotherapy. 50 (11), 3839-3846 (2006).
- Allison, K. R., Brynildsen, M. P., Collins, J. J. Metabolite-enabled eradication of bacterial persisters by aminoglycosides. Nature. 473 (7346), 216-220 (2011).
- Lechner, S., Lewis, K., Bertram, R. Staphylococcus aureus persisters tolerant to bactericidal antibiotics. Journal of Molecular Microbiology and Biotechnology. 22 (4), 235-244 (2012).
- Barrett, T. C., Mok, W. W. K., Murawski, A. M., Brynildsen, M. P. Enhanced antibiotic resistance development from fluoroquinolone persisters after a single exposure to antibiotic. Nature Communications. 10 (1), 1177 (2019).
- Windels, E. M., et al. Bacterial persistence promotes the evolution of antibiotic resistance by increasing survival and mutation rates. ISME Journal. 13 (5), 1239-1251 (2019).
- Dörr, T., Lewis, K., Vulić, M. SOS response induces persistence to fluoroquinolones in Escherichia coli. PLoS Genetics. 5 (12), 1000760 (2009).
- Völzing, K. G., Brynildsen, M. P. Stationary-phase persisters to ofloxacin sustain DNA damage and require repair systems only during recovery. mBio. 6 (5), (2015).
- Grant, S. S., Kaufmann, B. B., Chand, N. S., Haseley, N., Hung, D. T. Eradication of bacterial persisters with antibiotic-generated hydroxyl radicals. Proceedings of the National Academy of Sciences. 109 (30), 12147-12152 (2012).
- Gerdes, K., Maisonneuve, E. Bacterial Persistence and Toxin-Antitoxin Loci. Annual Review of Microbiology. 66 (1), 103-123 (2012).
- Orman, M. A., Brynildsen, M. P. Inhibition of stationary phase respiration impairs persister formation in E. coli. Nature Communications. 6 (1), 7983 (2015).
- Korch, S. B., Henderson, T. A., Hill, T. M. Characterization of the hipA7 allele of Escherichia coli and evidence that high persistence is governed by (p)ppGpp synthesis. Molecular Microbiology. 50 (4), 1199-1213 (2003).
- Karki, P., Mohiuddin, S. G., Kavousi, P., Orman, M. A. Investigating the effects of osmolytes and environmental ph on bacterial persisters. Antimicrobial Agents and Chemotherapy. 64 (5), 02393 (2020).
- Mohiuddin, S. G., Hoang, T., Saba, A., Karki, P., Orman, M. A. Identifying Metabolic Inhibitors to Reduce Bacterial Persistence. Frontiers in Microbiology. 11, 472 (2020).
- Brooun, A., Liu, S., Lewis, K. A dose-response study of antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrobial Agents and Chemotherapy. 44 (3), 640-646 (2000).
- Luidalepp, H., Jõers, A., Kaldalu, N., Tenson, T. Age of inoculum strongly influences persister frequency and can mask effects of mutations implicated in altered persistence. Journal of Bacteriology. 193 (14), 3598-3605 (2011).
- Baba, T., et al. Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: The Keio collection. Molecular Systems Biology. 2, 0008 (2006).
- Zaslaver, A., et al. A comprehensive library of fluorescent transcriptional reporters for Escherichia coli. Nature Methods. 3 (8), 623-628 (2006).
- Hajmeer, M., Ceylan, E., Marsden, J. L., Fung, D. Y. C. Impact of sodium chloride on Escherichia coli O157:H7 and Staphylococcus aureus analysed using transmission electron microscopy. Food Microbiology. 23 (5), 446-452 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved