Method Article
Detección de alto rendimiento de compuestos químicos para dilucidar sus efectos sobre la persistencia bacteriana
En este artículo
Resumen
En este documento de método, presentamos una estrategia de cribado de alto rendimiento para identificar compuestos químicos, como los osmolitos, que tienen un impacto significativo en la persistencia bacteriana.
Resumen
Los persistentes bacterianos se definen como una pequeña subpoblación de variantes fenotípicas con la capacidad de tolerar altas concentraciones de antibióticos. Son un problema de salud importante, ya que se han asociado con infecciones crónicas recurrentes. Aunque se sabe que la dinámica estocástica y determinista de los mecanismos relacionados con el estrés juega un papel significativo en la persistencia, los mecanismos subyacentes al cambio fenotípico hacia / desde el estado de persistencia no se entienden completamente. Si bien los factores de persistencia desencadenados por las señales ambientales (por ejemplo, el agotamiento de las fuentes de carbono, nitrógeno y oxígeno) han sido ampliamente estudiados, los impactos de los osmolitos en la persistencia aún no se han determinado. Utilizando microarrays (es decir, 96 placas de pozo que contienen diversos productos químicos), hemos diseñado un enfoque para dilucidar los efectos de varios osmolitos en la persistencia de Escherichia coli de una manera de alto rendimiento. Este enfoque es transformador, ya que se puede adaptar fácilmente para otras matrices de cribado, como paneles de medicamentos y bibliotecas de eliminación de genes.
Introducción
Los cultivos bacterianos contienen una pequeña subpoblación de células persistentes que son temporalmente tolerantes a niveles inusualmente altos de antibióticos. Las células persistentes son genéticamente idénticas a sus parientes sensibles a los antibióticos, y su supervivencia se ha atribuido a la inhibición transitoria del crecimiento1. Las células persistentes fueron descubiertas por primera vez por Gladys Hobby2, pero el término fue utilizado por primera vez por Joseph Bigger cuando las identificó en cultivos de Staphylococcus pyogenes tratados con penicilina3. Un estudio seminal publicado por Balaban et al.4 descubrió dos tipos persistentes: variantes de tipo I que se forman principalmente por paso a través de la fase estacionaria, y variantes de tipo II que se generan continuamente durante el crecimiento exponencial. Los persistentes son detectados por ensayos clonogénicos de supervivencia, en los que se toman muestras de cultivo a varios intervalos durante los tratamientos con antibióticos, se lavan y se platean en un medio de crecimiento típico para contar las células sobrevivientes que pueden colonizarse en ausencia de antibióticos. La existencia de persistientes en un cultivo celular se evalúa mediante una curva de muerte bifásica4,5 donde la desintegración exponencial inicial indica la muerte de células sensibles a los antibióticos. Sin embargo, la tendencia a matar disminuye con el tiempo, lo que eventualmente conduce a una región de meseta que representa las células persistentes sobrevivientes.
Las células persistentes se han asociado con diversas enfermedades como la tuberculosis6,la fibrosis quística7,la candidiasis8 y las infecciones del tracto urinario9. Se encontró que casi todos los microorganismos analizados hasta el momento generan fenotipos persistentes, incluyendo Mycobacterium tuberculosis6altamente patógena, Staphylococcus aureus10, Pseudomonas aeruginosa7 y Candida albicans8. Estudios recientes también proporcionan evidencia del aumento de mutantes multirresistentes de subpoblaciones persistentes11,12. Los esfuerzos sustanciales en esta esfera han revelado que los mecanismos de persistencia son muy complejos y diversos; Se sabe que tanto los factores estocásticos como los deterministas asociados con la respuesta SOS13,14,las especies reactivas de oxígeno (ROS)15,los sistemas toxina/antitoxina (TA)16,la autofagia o autogestión17 y la respuesta rigurosa relacionada con ppGpp18 son conocidos por facilitar la formación de persistidores.
A pesar del progreso significativo en la comprensión del fenotipo de persistencia, los efectos de los osmolitos sobre la persistencia bacteriana no se han entendido completamente. Dado que el mantenimiento de la presión osmótica óptima es una necesidad para el crecimiento, el funcionamiento adecuado y la supervivencia de las células, un estudio en profundidad de los osmolitos podría conducir a posibles objetivos para las estrategias anti-persistentes. Aunque laborioso, la detección de alto rendimiento es un enfoque muy eficaz para identificar metabolitos y otras sustancias químicas que desempeñan un papel crucial en el fenotipo de persistencia19,20. En este trabajo, discutiremos nuestro método publicado19,donde hemos utilizado microarrays, es decir, 96 placas de pozo que contienen varios osmolitos (por ejemplo, cloruro de sodio, urea, nitrito de sodio, nitrato de sodio, cloruro de potasio), para identificar osmolitos que influyen significativamente en la persistencia de E. coli.
Protocolo
1. Preparación de medio de crecimiento, solución de ofloxacina y acciones de células de E. coli
- Medio regular Luria-Bertani (LB): Añadir 10 g/L de triptona, 10 g/L de cloruro de sodio (NaCl) y 5 g/L de extracto de levadura en agua desionizada (DI). Esterilizar el medio por autoclave.
- Placas de agar LB: Añadir 10 g/L de triptona, 10 g/L de NaCl, 5 g/L de extracto de levadura y 15 g/L de agar en agua DI y esterilizar el medio por autoclave. A la temperatura deseada (~55 °C), verter ~30 mL de agar medio en placas cuadradas (10 x 10 cm). Secar las placas y conservar a 4 °C.
- Medio LB modificado: Añadir 10 g/L de triptona y 5 g/L de extracto de levadura en agua DI. Esterilizar el medio por autoclave.
- Medio LB modificado incluyendo un osmolito: Mezcle 2x medio LB modificado con una solución de osmolito 2x en volúmenes iguales. Para preparar 2x medio LB modificado, añadir 20 g/L de triptona y 10 g/L de extracto de levadura en agua DI y esterilizar por autoclave. Para preparar la solución de osmillo 2x, disuelva el osmolito de interés (cantidad 2x) en agua DI y luego filtre la solución.
NOTA: El osmolito de interés y sus concentraciones pueden determinarse a partir de los ensayos de cribado de microarrays de fenotipo (véase el Protocolo 4). Sin embargo, el osmolito probado y la concentración 2x asociada se pueden ajustar dependiendo de la naturaleza de la investigación. Por ejemplo, para estudiar el impacto del cloruro de sodio de 1 mM, una solución de osmolito 2x sería una solución de cloruro de sodio de 2 mM. - Solución común de ofloxacina (5 mg/mL): Añadir 5 mg de sal de ofloxacina (OFX) en 1 mL de agua di. Añadir 10 μL de hidróxido de sodio 10 M para aumentar la solubilidad de OFX en agua, y luego filtrar esterilizar la solución. Preparar las alícuotas y conservar a -20 °C.
NOTA: La ofloxacina es un antibiótico quinolona que ha sido ampliamente utilizado tanto para células bacterianas en crecimiento como para células bacterianas en crecimiento14,21. La concentración inhibitoria mínima (MIC) de OFX para las células mg1655 de E. coli está dentro del rango de 0,039–0,078 μg/mL19,20. También tenga en cuenta que otros antibióticos como la ampicilina y la kanamicina se utilizan comúnmente en la investigación persistente. La elección de los antibióticos depende de la naturaleza del estudio. - E. coli Poblaciones celulares MG1655: Inocular 2 mL de medio LB regular con una sola colonia en un tubo de ensayo de 14 mL (a presión) y cultivar las células en una coctelera orbital a 250 rpm y 37 °C. Cuando las células alcancen la fase estacionaria, mezcle 500 μL del cultivo celular con 500 μL de glicerol al 50% (estéril) en un vial criogénico y guárdelo a -80 °C.
2. Propagación de células para eliminar persistidores preexistentes
- Para preparar un cultivo nocturno, raspe una pequeña cantidad de células de una culata de células congeladas con una punta de pipeta estéril (no descongele la culata de células de glicerol) e inoculte las células en 2 mL de medio LB modificado en un tubo de ensayo de 14 mL con tapa a presión. Cultite las células en una coctelera orbital a 250 rpm y 37 °C durante 12 h.
- Primera propagación
- Después de 12 h, transferir 250 μL de cultivo nocturno a 25 mL de medio LB fresco modificado en un matraz desconcertado de 250 ml cubierto con un papel de aluminio estéril.
- Crezca el cultivo celular en una coctelera orbital a 250 rpm y 37 °C hasta que las células alcancen la fase exponencial media (OD600 = 0,5).
- Mida la densidad óptica a 600 nm (OD600)utilizando un lector de microplacas cada 30 min.
- Segunda propagación
- A600 OD = 0,5, diluir 250 μL de cultivo celular del primer matraz en 25 mL de medio LB fresco modificado en un matraz desconcertado de 250 ml.
- Cultivar el segundo cultivo celular en una coctelera orbital a 250 rpm y 37 °C hasta OD600=0,5.
- Mida la densidad óptica cada 30 min.
NOTA: Un cultivo nocturno puede tener una cantidad significativa de células persistentes4,5,22. El método de ciclo de dilución/crecimiento5 descrito anteriormente se puede utilizar para eliminar estos persistentes preexistentes antes de transferir las células a microarrays. Su eliminación puede validarse cuantificando los niveles persistentes de cultivos nocturnos con el ensayo descrito en el Protocolo 3. Este método ya ha sido validado en un estudio anterior19.
3. Validación de la eliminación de celdas persistentes preexistentes
- Después de la segunda propagación (véase el paso 2.3), diluir 250 μL del cultivo celular (OD600 = 0,5) en 25 ml de medio LB fresco modificado en un matraz desconcertado de 250 ml.
NOTA: Para los controles, diluya 250 μL de cultivo nocturno (véase el paso 2.1) en 25 mL de medio LB fresco modificado en un matraz desconcertado de 250 ml. Antes de transferir las células al matraz, la densidad celular del cultivo nocturno debe ajustarse en medio LB fresco modificado para obtener OD600 = 0,5. - Añadir 25 μL de solución madre de OFX (5 mg/mL) en la suspensión celular y agitar suavemente el matraz para que el cultivo ensay sea homogéneo. La concentración final de OFX es de 5 μg/mL en el cultivo de ensayo.
- Incubar el cultivo de ensayo en una coctelera orbital a 250 rpm y 37 °C.
- En cada hora durante el tratamiento (incluyendo 0 h, el punto de tiempo antes de agregar OFX en el cultivo de ensayo), transfiera 1 mL del cultivo de ensayo desde el matraz a un tubo de microcentrífuga de 1,5 ml.
- Centrífuga el cultivo de ensayo en el tubo de microcentrífuga a 17.000 x g durante 3 min.
- Retire cuidadosamente 950 μL del sobrenadante sin alterar el pellet celular.
- Añadir 950 μL de solución salina tamponada con fosfato (PBS) en el tubo de microcentrífuga.
- Repita los pasos de lavado 3.5-3.7 por 3x en total hasta que la concentración de antibióticos esté por debajo de la concentración inhibitoria mínima (MIC).
- Después del lavado final, resuspend el pellet celular en 100 μL de solución de PBS, resultando en una muestra concentrada 10x.
- Tomar 10 μL de la suspensión celular y diluir en serie seis veces en 90 μL de solución de PBS usando una placa inferior redonda de 96 pozos.
- Detecte 10 μL de suspensiones de células diluidas en placas de agar fresco sin antibióticos. Para aumentar el límite de detección, platee los 90 μL restantes de suspensión celular en una placa de agar fresco.
- Incubar las placas de agar a 37 °C durante 16 h, y luego contar las unidades formadoras de colonias (UFC). Tenga en cuenta las tasas de dilución mientras calcula el número total de UFC en 1 mL de cultivo de ensayo. Las curvas de muerte se generan trazando los valores logarítmicos de UFC con respecto a la duración del tratamiento con antibióticos.
NOTA: Un tratamiento ofx de 6 h es suficiente para obtener una curva de muerte bifásica para las células de E. coli 19,20. El nivel persistente de células propagadas (según lo medido por las cuentas de CFU en 6 h) debe ser perceptiblemente menos que el de la cultura de noche. Los procedimientos descritos en los Protocolos 2 y 3 se pueden realizar con LB regular dependiendo del diseño de la investigación.
4. Cribados de placas de microarrays
- Preparación de cultivos celulares de microarrays
- Transferir 250 μL de células en fase exponencial a 25 mL de medio LB fresco modificado en un tubo centrífugo de 50 mL. Mezcle suavemente la suspensión celular para hacerla homogénea.
NOTA: Las celdas de fase exponencial (OD600 = 0.5) se obtienen a partir del segundo paso de propagación (ver paso 2.3). - Transfiera la suspensión de la célula diluida a un depósito estéril de 50 mL.
- Usando una pipeta multicanal, transfiera 150 μL de la suspensión celular a cada pozo de un microarray, es decir, una placa de 96 pozos que contiene varios osmolitos.
NOTA: Los pozos que no tienen osmolitos sirven como controles. - Cubra el microarray con una membrana de sellado permeable al gas.
- Incubar la placa en una coctelera orbital a 37 °C y 250 rpm durante 24 h.
NOTA: En estos experimentos, se utilizaron placas disponibles en el mercado, como los microarrays de fenotipo (PM-9 y PM-10) que incluyen una amplia gama de osmolitos, tampones de pH y otros productos químicos en un estado seco a diversas concentraciones. Estos microarrays están en formatos de placa de medio área 96 pozos. Los volúmenes de cultivo deben ajustarse en función del tipo de placas que se utilicen. Los microarrays también se pueden generar manualmente (ver más abajo).
- Transferir 250 μL de células en fase exponencial a 25 mL de medio LB fresco modificado en un tubo centrífugo de 50 mL. Mezcle suavemente la suspensión celular para hacerla homogénea.
- Preparación manual de placas de microarrays
- Transfiera 75 μL de 2x soluciones de osmolito a los pozos de una placa de medio área de 96 pozos.
- Transferir 500 μL de células en fase exponencial a 25 mL de medio LB modificado 2x en un tubo centrífugo de 50 mL. Mezcle suavemente la suspensión celular para hacerla homogénea.
NOTA: La tasa de inoculación se ajustó para ser consistente con el protocolo de cribado de microarrays descrito en 4.1. - Añadir 75 μL de la suspensión celular en cada pozo de la placa de medio área 96 pozos que contiene 2x soluciones de osmolito.
- Incubar la placa en una coctelera orbital a 37 °C y 250 rpm durante 24 h.
- Preparación de placas de ensayo persistentes
- Preparar 25 mL de medio LB modificado que contenga 5 μg/mL de OFX en un tubo centrífugo de 50 mL y transferir este medio a un depósito estéril.
- Transferir 190 μL de medio LB modificado con OFX desde el depósito a cada pozo de una placa genérica de fondo plano de 96 pozos (placa de ensayo persistente) utilizando una pipeta multicanal.
- Retire el microarray de la coctelera (después de cultivar durante 24 h) y transfiera 10 μL de cultivos celulares del microarray a los pozos de la placa de ensayo persistente, que contiene el medio LB modificado con OFX.
- Tome 10 μL de suspensiones celulares de la placa de ensayo persistente y diluya en serie tres veces en 290 μL de solución de PBS utilizando una placa de 96 pozos de fondo redondo y una pipeta multicanal.
- Después de la dilución en serie, detecte 10 μL de todas las suspensiones celulares diluidas en serie en placas de agar fresco sin antibióticos utilizando una pipeta multicanal.
- Incubar la placa de ensayo persistente (preparada en el paso 4.3.3) en una coctelera orbital a 37 °C y 250 rpm durante 6 h después de cubrir la placa con una membrana de sellado permeable al gas.
- Después de la incubación de 6 h en una coctelera, saque la placa de ensayo persistente y repita los pasos 4.3.4-4.3.5.
- Incubar las placas de agar durante 16 h a 37 °C, y luego contar las UFC. Los niveles de UFC antes y 6 h después del tratamiento antibiótico permiten calcular la fracción persistente en cada pozo. Los recuentos de UFC antes del tratamiento con OFX también ayudan a evaluar los efectos de los osmolitos y sobre la viabilidad de E. coli.
5. Validación de las condiciones identificadas
- Transferir 250 μL de las células de fase exponencial del paso 2,3 a 25 mL de medio LB fresco modificado que contiene el osmlito identificado a partir del cribado de microarrays (ver Protocolo 4).
- Incubar el matraz en una coctelera orbital a 250 rpm y 37 °C durante 24 h.
- Después de 24 h, retire el matraz de la coctelera y transfiera 250 μL del cultivo celular a 25 mL de medio LB fresco modificado en un matraz desconcertado de 250 ml.
- Añadir 25 μL de solución madre de OFX (5 mg/mL) en la suspensión celular y agitar suavemente el matraz para que el cultivo ensay sea homogéneo. Incubar el matraz en una coctelera a 37 °C y 250 rpm.
- En cada hora durante el tratamiento, transfiera 1 mL del cultivo de ensayo desde el matraz a un tubo de microcentrífuga de 1,5 mL.
- Centrífuga el cultivo de ensayo en el tubo de microcentrífuga a 17.000 x g durante 3 min.
- Retire 950 μL de sobrenadante y agregue 950 μL de PBS.
- Repita los pasos de lavado 5.6 y 5.7 para 3x.
- Después del lavado final, resuspend el pellet celular en 100 μL de solución de PBS.
- Tome 10 μL de la suspensión celular y diluya en serie 6x en 90 μL de solución de PBS usando una placa inferior redonda de 96 pozos.
- Detecte 10 μL de las suspensiones de células diluidas en una placa de agar fresco libre de antibióticos. Para aumentar el límite de detección, platee los 90 μL restantes de suspensión celular en una placa de agar fresco.
- Incubar la placa de agar a 37 °C durante 16 h, y luego contar las UFC.
Resultados
La Figura 1 describe nuestro protocolo experimental. Los experimentos del ciclo de dilución/crecimiento (ver Protocolo 2) fueron adaptados de un estudio realizado por Keren et al.5 para eliminar los persistidores originarios de los cultivos nocturnos. La Figura 2A es una imagen representativa de las placas de agar utilizadas para determinar los niveles de UFC de los cultivos celulares antes y después del tratamiento con OFX. En estos experimentos, las células se cultivaron en medio LB modificado con osmolitos en placas de medio área 96 pozos como se describe en el paso 4.2. Después de incubar la placa en una coctelera orbital durante 24 h, el ensayo persistente se realizó utilizando una placa genérica de fondo plano de 96 pozos (ver paso 4.3). Los osmolitos y la concentración que se está probando aquí se eligieron en base a nuestro estudio previo19,donde realizamos los pasos 4.1 y 4.3 utilizando la placa PM-9 que incluye varios osmolitos a diferentes concentraciones (cloruro de sodio, cloruro de potasio, sulfato de sodio, etilenglicol, formiato de sodio, urea, lactato de sodio, fosfato de sodio, benzoato de sodio, sulfato de amonio, nitrito de sodio y nitrato de sodio). La primera columna de la Figura 2A muestra los recuentos de UFC del grupo de control. La segunda columna representa una condición donde las células fueron cultivadas en nitrato de sodio de 100 milímetros; esta condición fue encontrada previamente para aumentar levemente los niveles persistentes19. La tercera columna representa una condición donde las células fueron cultivadas en el nitrito de sodio de 60 milímetros, y esta condición fue encontrada previamente para disminuir perceptiblemente los niveles persistentes comparados a los controles19. La Figura 2B es una representación gráfica de los datos de la UFC obtenidos de las placas de agar. La Figura 2C muestra las fracciones persistentes de los cultivos celulares ensayados en 96 placas de pozos. Para calcular las fracciones, los recuentos persistentes se normalizaron a los recuentos celulares obtenidos antes de los tratamientos antibióticos. La Figura 3 muestra las curvas de muerte bifásicas y las fracciones persistentes, respectivamente, para los cultivos de ensayo realizados en matraces desconcertados. En estos experimentos, las células primero se cultivaron en 25 ml de medio LB modificado con los osmolitos indicados en frascos desconcertados de 250 ml durante 24 h, y luego las células se transfirieron a frascos de ensayo persistente para la enumeración persistente como se describe en el Protocolo 5.
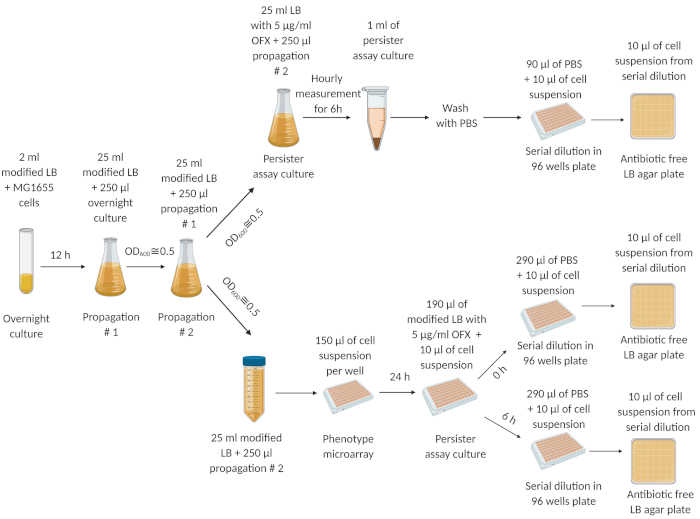
Figura 1: El procedimiento experimental. Las células de una acción congelada de la célula fueron crecidas durante la noche (12 h) en medio fresco de la libra. A las 12 h, el cultivo nocturno se diluyó (1:100) en 25 mL de medio LB modificado y creció hasta OD600=0,5. Este paso de propagación se repitió dos veces. Después de la etapa final de propagación, las células de fase exponencial (a OD600= 0,5) se diluyeron (1:100) en medio LB modificado fresco en un matraz desconcertado de 250 ml y un tubo centrífugo de 50 ml, respectivamente. La suspensión celular en el matraz desconcertado de 250 ml se trató con 5 μg/mL de OFX para cuantificar los persistentes. La suspensión celular en el tubo de centrífuga de 50 mL se transfirió a microarrays y se incubó durante 24 h en una coctelera orbital a 250 rpm y 37 °C. Las células de los microarrays entonces fueron transferidas a las placas del persister-análisis para cuantificar persisters. Esta figura se creó utilizando biorender.com. Esta cifra ha sido modificada de nuestra publicación anterior19. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 2: Experimentos de microarrays. (A)Las células se cultivaron por primera vez en medio LB modificado con osmolitos indicados en una placa de medio área de 96 pozos durante 24 h. Las células se transfirieron a una placa genérica de fondo plano de 96 pozos y se trataron con 5 μg/mL de OFX durante 6 h. Antes y después del tratamiento de 6 h, las células fueron diluidas en serie en PBS, plateadas en placas de agar e incubadas a 37 °C durante 16 h. Cada condición tiene 8 réplicas técnicas. (B)las medidas de CFU fueron realizadas para evaluar los efectos de osmolytes sobre viabilidad y persistencia de la célula, respectivamente. La línea recta indica el límite de detección (600 UFC). (C)El gráfico representa las fracciones persistentes de los cultivos celulares, calculadas tomando la relación de los recuentos de UFC después y antes del tratamiento con OFX. La fracción persistente del cultivo celular que tiene nitrito de sodio de 60 mM no se calculó ya que su nivel persistente está por debajo del límite de detección. Cada punto de datos se denotó por el valor medio ± desviación estándar, calculado a partir de 8 réplicas técnicas. Haga clic aquí para ver una versión más amplia de esta figura.
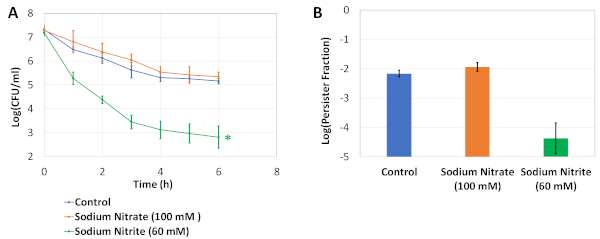
Figura 3: Experimentos de validación. (A)Las células en fase exponencial se transfirieron a 25 ml de medio LB fresco modificado con osmolitos indicados en frascos desconcertados de 250 ml y se cultivaron durante 24 h. A continuación, las células se diluyeron (1:100) en matraces desconcertados de 250 ml que contenían 25 ml de medio LB modificado y se trataron con 5 μg/mL de OFX durante 6 h. Los recuentos de UFC en los cultivos de ensayo se monitorearon cada hora para generar curvas de muerte bifásicas. * indica la condición que afecta significativamente a los niveles persistentes de OFX en comparación con los controles sin osmolíticos (prueba t de varianza desigual de dos colas, p<0,05). (B) El gráfico representa las fracciones persistentes de los cultivos. Cada punto de datos se denotó por el valor medio ± desviación estándar, calculado a partir de 3 réplicas biológicas. Esta cifra ha sido modificada de nuestra publicación anterior19. Haga clic aquí para ver una versión más amplia de esta figura.
Discusión
El ensayo persistente de alto rendimiento descrito aquí se desarrolló para dilucidar los efectos de varios productos químicos sobre la persistencia de E. coli. Además de las placas PM comerciales, los microarrays se pueden construir manualmente como se describe en el paso 4.2. Además, el protocolo presentado aquí es flexible y se puede utilizar para examinar otros microarrays, como paneles de medicamentos y bibliotecas celulares, que están en formatos de placa de 96 pozos. Las condiciones experimentales, incluida la fase de crecimiento, la tasa de inoculación y el medio, se pueden ajustar para probar estas bibliotecas. Por ejemplo, si uno quiere examinar una biblioteca celular, como la colecciónde knockouts 23de Keio E. coli, primero pueden transferir las cepas de la biblioteca a placas de 96 pozos que incluyen medios frescos, utilizando una pipeta multicanal. Una vez que las células alcanzan la fase de crecimiento deseada (por ejemplo, fase exponencial o estacionaria), las células se transfieren a placas de ensayo persistente como se describe en el paso 4.3 para enumerar los niveles persistentes de las cepas knockout. Del mismo modo, esta estrategia se puede utilizar para examinar la colección E. coli Promoter 24 (una biblioteca de cepas de reportero fluorescente en formatos de placa de 96 pocillos) para identificar los promotores que son activados por antibióticos. Estos promotores se pueden detectar fácilmente midiendo las señales de fluorescencia de las cepas en las placas de ensayo persistente durante el tratamiento con antibióticos.
En nuestros experimentos, utilizamos un LB modificado (carente de NaCl) para evitar cualquier efecto adicional que pudiera surgir del NaCl, teniendo en cuenta que los microarrays ya tienen varios osmolitos. Aunque se sabe que el NaCl en el medio lb regular es bueno para preservar la integridad de la membrana de las células, se ha reportado que el NaCl en el rango de 0-1% tiene un efecto mínimo sobre el crecimiento celular25. Por otra parte, los resultados de las tinciones de yoduro de propidio (PI) y de los ensayos persistentes en nuestro estudio anterior han demostrado que la ausencia de NaCl no afecta significativamente la integridad de la membrana y la persistencia de las células de E. coli 19. Esta modificación se realizó específicamente para abordar las preocupaciones en nuestro estudio y se puede cambiar en función de la naturaleza de la investigación.
También hemos adaptado un método desarrollado por Keren et al.5 para eliminar los persistentes preexistentes en nuestros cultivos celulares antes de la inoculación en los microarrays. Se sabe que los persistentes de tipo I se generan durante la fase estacionaria; por lo tanto, la inoculación directa de las células de cultivos nocturnos en placas de microarrays transferiría un número significativo de persistentes, lo que puede dificultar los efectos de los osmolitos. Con los experimentos del ciclo de dilución/crecimiento (ver Protocolo 2), pudimos reducir significativamente estos persistidores preexistentes derivados de los cultivos nocturnos19. Observamos que hemos cultivado las células en placas de microarrays durante 24 h para poder contar todos los persistidores, incluyendo las variantes de tipo I que se forman durante la fase estacionaria en presencia de osmolitos. Sin embargo, estas técnicas adaptadas siempre pueden modificarse dependiendo de la naturaleza del estudio.
Se trataron las células en microarrays con 5 μg/mL OFX para enumerar los persistores. Dado que el procedimiento de lavado para eliminar el antibiótico de 96 muestras sería muy laborioso, las células después del tratamiento se diluyeron en serie en PBS sin lavado (ver paso 4.2). Este procedimiento diluyó la concentración de OFX más de 30 veces. Las suspensiones diluidas de la célula entonces fueron plateadas en las placas antibiótico-libres del agar donde el OFX fue dispersado más a fondo. Nuestros estudios preliminares donde repetimos estos experimentos con y sin lavado han verificado que este método de dilución en serie no afectó a los niveles persistentes19.
Durante el pipeteo multicanal en 96 placas de pozos, se deben mezclar cuidadosamente las suspensiones celulares para mantener una distribución celular homogénea. Para ello, dependiendo del volumen de trabajo, sería beneficioso tener en cuenta el número mínimo de pipeteo que se necesita para que la solución sea homogénea. Para ello, realizamos un sencillo experimento de control en el que se monitorizó el pipeteo (arriba y abajo) mediante la dispersión de una molécula de colorante en PBS y medio en las condiciones aquí estudiadas. Además, si se trabaja con ambientes más complejos como los tampones de pH, sugerimos medir el pH del cultivo celular antes y durante la incubación en una coctelera, ya que el cultivo celular tiende a ser muy alcalino (pH ≈ 8) con el tiempo. Esto puede dar una idea de la calidad, así como el rango de pH del tampón utilizado. Además, para obtener UFC contables en placas de agar a partir de los ensayos de alto rendimiento, se deben optimizar ciertas condiciones, como la tasa de inoculación celular, la edad de los cultivos y los parámetros de dilución en serie (volumen de PBS, tasas de dilución y el número de pasos de dilución, etc.) antes de probar los microarrays. Por último, los resultados obtenidos de los microarrays deben validarse aún más en matraces, ya que el volumen del cultivo, la superficie y la oneración en una placa de 96 pozos podrían tener efectos adicionales en los resultados observados.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a los miembros de Orman Lab por sus valiosos aportes durante este estudio. Este estudio fue financiado por el premio de transición profesional K22AI125468 de los NIH/NIAID y una beca de inicio de la Universidad de Houston.
Materiales
| Name | Company | Catalog Number | Comments |
| 14-ml test tube | Fisher Scientific | 14-959-1B | |
| E. coli strain MG1655 | Princeton University | Obtained from Brynildsen lab | |
| Flat-bottom 96-well plate | USA Scientific | 5665-5161 | |
| Gas permeable sealing membrane | VWR | 102097-058 | Sterilized by gamma irradiation and free of cytotoxins |
| Half-area flat-bottom 96-well plate | VWR | 82050-062 | |
| LB agar | Fisher Scientific | BP1425-2 | Molecular genetics grade |
| Ofloxacin salt | VWR | 103466-232 | HPLC ≥97.5 |
| Phenotype microarray (PM-9 and PM-10) | Biolog | N/A | PM-9 and PM-10 plates contained various osmolytes and buffers respectively |
| Round-bottom 96-well plate | USA Scientific | 5665-0161 | |
| Sodium chloride | Fisher Scientific | S271-500 | Certified ACS grade |
| Sodium nitrate | Fisher Scientific | AC424345000 | ACS reagent grade |
| Sodium nitrite | Fisher Scientific | AAA186680B | 98% purity |
| Square petri dish | Fisher Scientific | FB0875711A | |
| Tryptone | Fisher Scientific | BP1421-500 | Molecular genetics grade |
| Varioskan lux multi mode microplate reader | Thermo Fisher Scientific | VLBL00D0 | Used for optical density measurement at 600 nm |
| Yeast extract | Fisher Scientific | BP1422-100 | Molecular genetics grade |
Referencias
- Lewis, K. Persister cells, dormancy and infectious disease. Nature Reviews Microbiology. 5 (1), 48-56 (2007).
- Hobby, G. L., Meyer, K., Chaffee, E. Observations on the Mechanism of Action of Penicillin. Experimental Biology and Medicine. 50 (2), 281-285 (1942).
- Bigger, J. Treatment of staphylococcal infections with penicillin by intermittent sterilisation. The Lancet. 244 (6320), 497-500 (1944).
- Balaban, N. Q., Merrin, J., Chait, R., Kowalik, L., Leibler, S. Bacterial persistence as a phenotypic switch. Science. 305 (5690), 1622-1625 (2004).
- Keren, I., Kaldalu, N., Spoering, A., Wang, Y., Lewis, K. Persister cells and tolerance to antimicrobials. FEMS Microbiology Letters. 230 (1), 13-18 (2004).
- Keren, I., Minami, S., Rubin, E., Lewis, K. Characterization and transcriptome analysis of mycobacterium tuberculosis persisters. mBio. 2 (3), (2011).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa Strains Producing High Levels of Persister Cells in Patients with Cystic Fibrosis. Journal of Bacteriology. 192 (23), 6191-6199 (2010).
- LaFleur, M. D., Kumamoto, C. A., Lewis, K. Candida albicans biofilms produce antifungal-tolerant persister cells. Antimicrobial Agents and Chemotherapy. 50 (11), 3839-3846 (2006).
- Allison, K. R., Brynildsen, M. P., Collins, J. J. Metabolite-enabled eradication of bacterial persisters by aminoglycosides. Nature. 473 (7346), 216-220 (2011).
- Lechner, S., Lewis, K., Bertram, R. Staphylococcus aureus persisters tolerant to bactericidal antibiotics. Journal of Molecular Microbiology and Biotechnology. 22 (4), 235-244 (2012).
- Barrett, T. C., Mok, W. W. K., Murawski, A. M., Brynildsen, M. P. Enhanced antibiotic resistance development from fluoroquinolone persisters after a single exposure to antibiotic. Nature Communications. 10 (1), 1177 (2019).
- Windels, E. M., et al. Bacterial persistence promotes the evolution of antibiotic resistance by increasing survival and mutation rates. ISME Journal. 13 (5), 1239-1251 (2019).
- Dörr, T., Lewis, K., Vulić, M. SOS response induces persistence to fluoroquinolones in Escherichia coli. PLoS Genetics. 5 (12), 1000760 (2009).
- Völzing, K. G., Brynildsen, M. P. Stationary-phase persisters to ofloxacin sustain DNA damage and require repair systems only during recovery. mBio. 6 (5), (2015).
- Grant, S. S., Kaufmann, B. B., Chand, N. S., Haseley, N., Hung, D. T. Eradication of bacterial persisters with antibiotic-generated hydroxyl radicals. Proceedings of the National Academy of Sciences. 109 (30), 12147-12152 (2012).
- Gerdes, K., Maisonneuve, E. Bacterial Persistence and Toxin-Antitoxin Loci. Annual Review of Microbiology. 66 (1), 103-123 (2012).
- Orman, M. A., Brynildsen, M. P. Inhibition of stationary phase respiration impairs persister formation in E. coli. Nature Communications. 6 (1), 7983 (2015).
- Korch, S. B., Henderson, T. A., Hill, T. M. Characterization of the hipA7 allele of Escherichia coli and evidence that high persistence is governed by (p)ppGpp synthesis. Molecular Microbiology. 50 (4), 1199-1213 (2003).
- Karki, P., Mohiuddin, S. G., Kavousi, P., Orman, M. A. Investigating the effects of osmolytes and environmental ph on bacterial persisters. Antimicrobial Agents and Chemotherapy. 64 (5), 02393 (2020).
- Mohiuddin, S. G., Hoang, T., Saba, A., Karki, P., Orman, M. A. Identifying Metabolic Inhibitors to Reduce Bacterial Persistence. Frontiers in Microbiology. 11, 472 (2020).
- Brooun, A., Liu, S., Lewis, K. A dose-response study of antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrobial Agents and Chemotherapy. 44 (3), 640-646 (2000).
- Luidalepp, H., Jõers, A., Kaldalu, N., Tenson, T. Age of inoculum strongly influences persister frequency and can mask effects of mutations implicated in altered persistence. Journal of Bacteriology. 193 (14), 3598-3605 (2011).
- Baba, T., et al. Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: The Keio collection. Molecular Systems Biology. 2, 0008 (2006).
- Zaslaver, A., et al. A comprehensive library of fluorescent transcriptional reporters for Escherichia coli. Nature Methods. 3 (8), 623-628 (2006).
- Hajmeer, M., Ceylan, E., Marsden, J. L., Fung, D. Y. C. Impact of sodium chloride on Escherichia coli O157:H7 and Staphylococcus aureus analysed using transmission electron microscopy. Food Microbiology. 23 (5), 446-452 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados