Method Article
高通量化学化合物筛选,以阐明其对细菌持久性的影响
摘要
在本方法论文中,我们提出了一种高通量筛选策略,以识别对细菌持久性有重大影响的化合物,如渗透物。
摘要
细菌持久性被定义为具有耐受高浓度抗生素能力的表型变种的一小部分。它们是一个重要的健康问题,因为它们与复发性慢性感染有关。虽然已知压力相关机制的随机和决定性动力学在持久性中起着重要作用,但表型转换到/从持久状态切换到/从持久状态背后的机制并不完全了解。虽然广泛研究了由环境信号(例如碳、氮和氧源耗尽)引发的持久性因素,但渗透物对持久性的影响尚未确定。我们使用微阵骨(即含有各种化学物质的96个井板),设计了一种方法,以高吞吐量的方式阐明各种渗透物对 大肠杆菌 持久性的影响。这种方法具有变革性,因为它可以很容易地适应其他筛选阵列,如药物面板和基因淘汰库。
引言
细菌培养物中含有少量的持久细胞,它们暂时对异常高浓度的抗生素产生耐受性。持久细胞在基因上与抗生素敏感的基因相同,其存活率归因于瞬时生长抑制1。坚持细胞最初是由格拉迪斯爱好2发现,但这个词是第一次由约瑟夫·比格使用时,他发现他们在青霉素处理葡萄球菌培养物3。Balaban等人发表的一项开创性研究发现了两种持久性类型:主要通过静止阶段形成的I型变种,以及在指数增长过程中连续产生的II型变种。坚持者通过致克隆生存检测检测,在抗生素治疗期间,每隔一段时间采集培养样本,清洗并镀在典型的生长介质上,以计算在没有抗生素的情况下可以殖民的存活细胞。细胞培养中持久性者的存在由双相杀灭曲线4,5来评估,其中最初的指数衰变表示抗生素敏感细胞的死亡。然而,随着时间的流长,杀伤趋势会减少,最终导致一个高原区域,代表幸存的持久细胞。
坚持细胞已与各种疾病,如结核病6,囊性纤维化7,念珠菌病8和尿路感染9。迄今测试的几乎所有微生物都被发现产生持久性表型,包括高致病性结核分枝杆菌6、金黄色葡萄球菌10、伪多莫纳斯阿鲁吉诺萨7和坎迪达白化病8。最近的研究也提供了证据,证明耐多药突变体从持久性亚人口11,12上升。这一领域的大量努力表明,持久机制非常复杂和多样化:与SOS反应13、14、活性氧(ROS)15、毒素/抗毒素(TA)系统16、自噬或自我消化17和ppGpp相关的严格反应18的随机和决定性因素均已知有助于持久性形成。
尽管在理解持久性表型方面取得了重大进展,但骨质素对细菌持久性的影响尚未得到充分理解。由于维持最佳渗透压力是细胞生长、正常功能和生存的必要条件,深入研究渗透物可导致抗持久策略的潜在目标。虽然费力,高通量筛选是一个非常有效的方法,以确定代谢物和其他化学物质,在持久表型19,20起关键作用。在这项研究中,我们将讨论我们已发表的方法19,其中我们使用了微阵列,即含有各种硅酸盐的96个井板(如氯化钠、尿素、亚硝酸钠、硝酸钠、氯化钾),以识别对大肠杆菌持久性有重大影响的渗透物。
研究方案
1. 准备生长介质、氯辛溶液和 大肠杆菌 细胞库存
- 常规 Luria-Bertani (LB) 介质:在除离子 (DI) 水中加入 10 克/升的三氯酮、10 克/升氯化钠 (NaCl) 和 5 克/升酵母提取物。通过自动切割对介质进行消毒。
- LB agar 板:在 DI 水中加入 10 克/升的 tryptone、10 克/升的 NaCl、5 克/升的酵母提取物和 15 克/升的 agar,并通过自动杀菌对介质进行消毒。在所需的温度(+55°C)下,将约30毫升的阿加中等度体倒入方板(10 x 10厘米)。干燥盘子,储存在4°C。
- 改性 LB 介质:在 DI 水中加入 10 克/升的 tryptone 和 5 克/升酵母提取物。通过自动切割对介质进行消毒。
- 修改后的 LB 介质(包括骨解质):将 2 倍修改后的 LB 介质与 2 倍的骨解质溶液混合,体积相等。要准备 2 倍改良的 LB 介质,请在 DI 水中加入 20 克/升的 tryptone 和 10 g/L 酵母提取物,并通过自杀灭菌进行灭菌。要准备 2x 骨解质溶液,溶解 DI 水中感兴趣的骨质(2 倍量),然后过滤消毒溶液。
注:兴趣的骨质及其浓度可以从表型微阵骨筛选分析中确定(见第4号议定书)。但是,测试的骨解质和相关的 2 倍浓度可以根据研究的性质进行调整。例如,为了研究1mM氯化钠的影响,2倍的溶液将是2mM氯化钠溶液。 - 奥氯萨辛库存溶液(5毫克/mL):在1mL的DI水中加入5毫克的洛萨辛(OFX)盐。加入10微L的10M氢氧化钠,以增加水中的 OFX 溶液的溶性,然后过滤消毒溶液。准备阿里报价,并存储在-20°C。
注:Ofloxacin是一种奎诺酮抗生素,已广泛用于生长和非生长的细菌细胞14,21。大肠杆菌MG1655细胞的 OFX 最低抑制浓度 (MIC) 在 0.039×0.078 μg/mL19,20范围内。还要注意,其他抗生素,如安皮林和卡那霉素,通常用于持久性研究。抗生素的选择取决于研究的性质。 - 大肠杆菌 MG1655 细胞库存:在 14 mL 试管中接种 2 mL 常规 LB 介质,并在 250 rpm 和 37 °C 的轨道摇床中培养细胞。 当细胞达到静止阶段时,将细胞培养物的 500 μL 与 500 μL 的 500 μL 混合在低温小瓶中,并储存在 -80 °C。
2. 传播细胞以消除预先存在的坚持者
- 为了准备通宵培养,用无菌移液器尖端从冷冻细胞群中刮出少量细胞(不要解冻甘油细胞群),并在 14 mL 的快速封顶试管中将细胞接种 2 mL 改性 LB 介质。在轨道摇床中以 250 rpm 和 37 °C 培养 12 小时的细胞。
- 第一次传播
- 12 小时后,将 250 μL 的隔夜培养物转移到 25 mL 的新鲜改性 LB 介质中,在 250 毫升的迷惑烧瓶中覆盖着无菌铝箔。
- 在轨道摇床中以 250 rpm 和 37 °C 的速度增长细胞培养,直到细胞达到指数期中(OD600 = 0.5)。
- 每 30 分钟使用微板读卡器测量600 nm (OD 600)的光学密度。
- 第二次传播
- 在 OD600 = 0.5 时,在 250 毫升的困惑烧瓶中,将第一个烧瓶中的 250 μL 细胞培养稀释为 25 mL 的新鲜改性 LB 介质。
- 在轨道摇床中以 250 rpm 和 37 °C 的速度增长第二个细胞培养,直到 OD600=0.5。
- 每 30 分钟测量一次光学密度。
注:一夜之间培养可能有大量的坚持细胞4,5,22。上述5种稀释/生长周期方法可用于在将细胞转移到微阵道之前消除这些预先存在的坚持者。可以通过用第3号议定书中描述的分析来量化隔夜文化的持久性水平来验证它们的消除。这种方法已经在先前的研究19中得到证实。
3. 验证消除预先存在的持久细胞
- 第二次传播后(见步骤 2.3),在 250 mL 的迷茫烧瓶中稀释 250 μL 的细胞培养物 (OD600 = 0.5)中的 25 mL 新鲜改性 LB 介质。
注意:有关控制,请在 250 mL 的迷惑烧瓶中稀释 250 μL 的隔夜培养物(参见步骤 2.1)中的 25 mL 新鲜改性 LB 介质。在将细胞转移到烧瓶之前,应以新修改的LB介质调整隔夜培养物的细胞密度,以获得OD600 = 0.5。 - 将 25 μL 的 OFX 库存溶液 (5 毫克/mL) 添加到细胞悬架中,轻轻摇动烧瓶,使检测培养物均匀。在检测培养中,OFX 的最终浓度为 5μg/mL。
- 在轨道摇床中以 250 rpm 和 37 °C 将测定培养。
- 在治疗期间的每一小时(包括 0 h,将 OFX 添加到检测培养物中之前的时间点),将 1 mL 的检测培养物从烧瓶转移到 1.5 mL 微中轴管。
- 在微中微管中分中心培养的离心机在17,000 x g 下3分钟。
- 小心地去除超细剂的 950 μL,而不会干扰细胞颗粒。
- 将 950μL 的磷酸盐缓冲盐水 (PBS) 溶液添加到微中福管中。
- 重复洗涤步骤 3.5-3.7,共 3 倍,直到抗生素浓度低于最低抑制浓度 (MIC)。
- 最后洗涤后,将细胞颗粒重新喷入 100 μL 的 PBS 溶液中,从而产生 10 倍的浓缩样品。
- 使用 96 圆底板,在 90 μL 的 PBS 解决方案中,使用 10 μL 的细胞悬架并连续稀释 6 次。
- 在无抗生素的新鲜阿加板上发现 10 μL 稀释细胞悬浮物。为了增加检测限制,将剩余的 90 μL 细胞悬浮板放在新鲜的 agar 板上。
- 在 37 °C 下孵化 16 小时的 agar 板,然后计算形成殖民地的单位 (CF)。在计算 1 mL 检测文化中的 CFUS 总数时,考虑稀释率。杀死曲线是通过绘制抗生素治疗持续时间的对数CFU值生成的。
注:6小时 OFX治疗足以获得大肠杆菌细胞19,20的双相杀伤曲线。繁殖细胞的持久水平(按CFU计数在6小时测量)应明显低于隔夜培养。协议 2 和 3 中描述的程序可以根据研究设计与常规 LB 一起执行。
4. 微阵拉盘筛选
- 准备微阵细胞培养
- 将 250 μL 的指数相细胞转移到 50 mL 离心管中 25 mL 的新鲜改性 LB 介质。轻轻地混合细胞悬架,使其均匀。
注:指数相细胞(OD600 = 0.5)来自第二个繁殖步骤(参见步骤 2.3)。 - 将稀释后的细胞悬架转移到无菌的 50 mL 储液池中。
- 使用多通道移液器,将细胞悬架的 150 μL 转移到微阵骨的每口井,即包含各种渗透物的 96 井板。
注:没有渗透剂的井充当控制。 - 用透气密封膜覆盖微阵骨。
- 在轨道摇床中以 37 °C 和 250 rpm 的 24 小时将板孵化。
注意:在这些实验中,使用了市售板,如表型微阵骨(PM-9和PM-10),其中包括各种渗透物、pH缓冲器和其他不同浓度干燥状态的化学品。这些微阵线采用半区域 96 井板格式。文化量应根据使用的板类型进行调整。微型阵拉也可以手动生成(见下文)。
- 将 250 μL 的指数相细胞转移到 50 mL 离心管中 25 mL 的新鲜改性 LB 介质。轻轻地混合细胞悬架,使其均匀。
- 微阵盘的手动制备
- 将 75 μL 的 2x 骨解质溶液转移到半区域 96 井板的井中。
- 将 500 μL 的指数相细胞转移到 50 mL 离心管中 25 mL 的 2 倍修改 LB 介质。轻轻地混合细胞悬架,使其均匀。
注:接种率调整为与4.1中描述的微阵拉筛查方案一致。 - 将 75 μL 的细胞悬浮加入半区域 96 井板的每口井中,其中含有 2 倍骨解质溶液。
- 在轨道摇床中以 37 °C 和 250 rpm 的 24 小时将板孵化。
- 准备持久性检测板
- 在 50 毫升离心管中准备 25 毫升的经过改进的 LB 介质,其中含有 5μg/mL 的 OFX,并将该介质转移到无菌储液库。
- 使用多通道移液器将 190 μL 的改性 LB 介质与 OFX 从储层转移到通用平底 96 井板(持久分析板)的每口井中。
- 从摇床中取出微阵拉(在培养24小时后),将10μL的细胞培养物从微阵拉转移到持久分析板的井中,其中含有带有OX的改性LB介质。
- 从持久分析板中取出 10 μL 的细胞悬架,使用圆底 96 井板和多通道移液器在 290 μL 的 PBS 溶液中连续稀释三次。
- 在连续稀释后,使用多通道移液器在无抗生素的新鲜 agar 板上发现所有连续稀释细胞悬架的 10 μL。
- 在轨道摇床中以 37 °C 和 250 rpm 的 6 小时将持久性分析板(按步骤 4.3.3 制备)在用气体渗透密封膜覆盖板后,在 6 小时内进行孵化。
- 在摇床中孵化 6 小时后,将坚持分析板取出并重复步骤 4.3.4-4.3.5。
- 在 37 °C 时将 agar 板孵化 16 小时,然后计算 CFI。抗生素治疗前后的CFU水平和6小时可计算每口油井中的持久性分数。在 OFX 治疗之前,CFU 计数还有助于评估渗透物和 大肠杆菌 生存能力的影响。
5. 验证已确定的条件
- 将指数相细胞的 250 μL 从步骤 2.3 转移到 25 mL 的新鲜改性 LB 介质中,其中含有从微阵道筛选中识别的骨解质(参见协议 4)。
- 在轨道摇床中以 250 rpm 和 37 °C 在 24 小时内孵化烧瓶。
- 24 小时后,从摇床中取出烧瓶,在 250 mL 的迷惑烧瓶中将细胞培养物的 250 μL 转移到 25 mL 的新鲜改性 LB 介质中。
- 在细胞悬架中加入 25μL 的 OFX 库存溶液 (5 毫克/mL),轻轻摇动烧瓶,使检测培养物均匀。在 37 °C 和 250 rpm 的摇床中孵化烧瓶。
- 在治疗过程中,每小时将1 mL的检测培养物从烧瓶转移到1.5mL微中微管。
- 在微中微管中分中心培养的离心机在17,000 x g 下3分钟。
- 去除 950 μL 的超自然,并添加 950 μL 的 PBS。
- 重复洗涤步骤 5.6 和 5.7 为 3 倍。
- 最后洗涤后,将细胞颗粒重新用 100 μL 的 PBS 溶液进行。
- 使用 96 圆底板,使用 90 μL 的 PBS 解决方案,使用 10 μL 的细胞悬架和连续稀释 6 倍。
- 在无抗生素的新鲜阿加板上发现稀释细胞悬浮物的 10 μL。为了增加检测限制,将剩余的 90 μL 细胞悬浮板放在新鲜的 agar 板上。
- 在 37 °C 下孵化 16 小时,然后计算 CFI。
结果
图1 描述了我们的实验协议。稀释/生长周期实验(见第2号议定书)是根据Keren等人5 号进行的一项研究改编的,旨在消除源自隔夜文化的坚持者。 图2A 是用于确定OX治疗前后细胞培养CFU水平的阿加板块的代表性图像。在这些实验中,细胞在修改后的LB介质中培养,在半区域96井板中含有渗透物,如第4.2步所述。在轨道摇床中孵化板 24 小时后,使用通用的平底 96 井板进行持久性检测(参见步骤 4.3)。这里正在测试的渗透物和浓度是根据我们先前的研究19选择的,我们使用PM-9板执行步骤4.1和4.3,其中包括不同浓度的各种渗透物(氯化钠, 氯化钾、硫酸钠、乙二醇、甲酸钠、尿素、乳酸钠、磷酸钠、苯甲酸钠、硫酸铵、亚硝酸钠和硝酸钠) 图 2A 中的第一列显示了对照组的 CFU 计数。第二列表示细胞在100m硝酸钠中培养的条件:这种情况以前被发现略有增加坚持者水平19。第三列表示细胞在60mM亚硝酸钠中培养的条件,与对照组19相比,该情况先前被发现可显著降低坚持者水平。 图 2B 是从 agar 板中获取的 CFU 数据的图形表示。 图2C 显示了在96个井板中测试的细胞培养物的持久性分数。为了计算分数,坚持者计数与抗生素治疗前获得的细胞计数正常化。 图3 分别显示了在困惑的烧瓶中执行的测定培养物的双相杀伤曲线和持续分数。在这些实验中,细胞首先在25毫升的改性LB介质中培养,在250毫升的糊状烧瓶中用指示的骨解质培养24小时,然后细胞被转移到坚持分析烧瓶中,以便按照第5号议定书所述进行持久性列举。
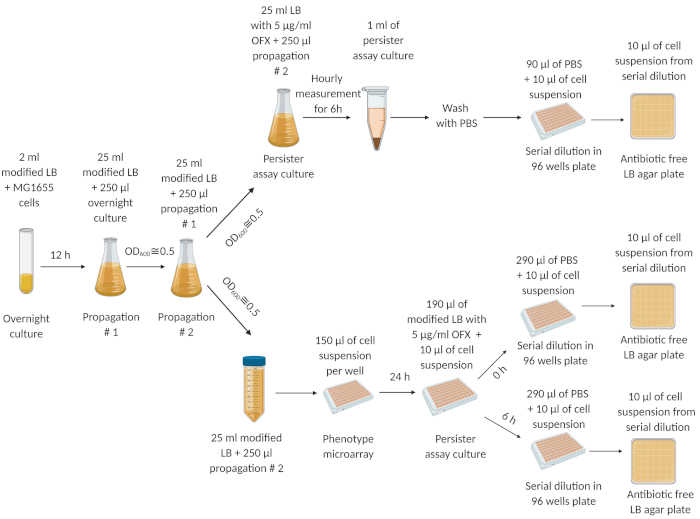
图1:实验程序。 冷冻细胞存量的细胞在新鲜的LB介质中一夜之间(12小时)生长。在 12 h 时,隔夜文化在 25 mL 的改性 LB 介质中稀释 (1:100),并一直生长到 OD600=0.5。此传播步骤重复了两次。在最后的繁殖步骤后,指数相细胞(在OD600+0.5)分别在250毫升的迷茫烧瓶和50毫升离心管中用新鲜改性LB介质稀释(1:100)。250 mL 迷惑烧瓶中的细胞悬架使用 5μg/mL 的 OFX 进行处理,以量化坚持者。50 mL离心机管中的细胞悬架被转移到微阵列,在轨道摇床中以250转/米和37°C孵育24小时。 然后,来自微阵圈的细胞被转移到持久分析板中,以量化持久性。此图是使用 biorender.com 创建的。这个数字已由我们先前的十九本修订。 请单击此处查看此图的较大版本。

图2:微阵拉实验。 (A) 细胞最初生长在经过修改的LB介质中,无论是否指示,在半面积96井板中以24小时为下。然后,这些细胞被转移到一个通用的平底96井板,并以5微克/mL的 OFX处理6小时。在6小时治疗前后,细胞在PBS中连续稀释,镀在阿加板上,在37°C孵育16小时。每个条件有 8 个技术复制。(B) 分别进行CFU测量,以评估渗透物对细胞生存能力和持久性的影响。直线表示检测限制(600 CFUs)。(C) 该图表示细胞培养的持久性分数,通过在 OFX 治疗后和之前计算 CFU 计数的比例来计算。含有 60 mM 亚硝酸钠的细胞培养物的持久性部分没有计算出来,因为它的持久性水平低于检测极限。每个数据点都由平均值±标准偏差表示,从 8 个技术复制品中计算。 请单击此处查看此图的较大版本。
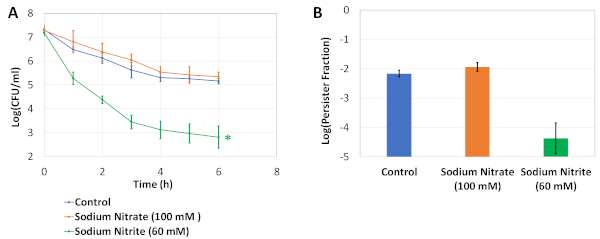
图3:验证实验。 (A) 指数相细胞被转移到25毫升的新鲜改性LB介质与指示的渗透物在250毫升困惑的烧瓶和培养24小时。然后,在含有 25 mL 改性 LB 介质的 25 mL 的迷惑烧瓶中稀释细胞(1:100),用 5μg/mL OFX 处理 6 小时。检测培养物中的 CFU 计数每小时进行监控,以生成双相杀伤曲线。* 表示与无骨质控制相比,显著影响 OFX 持久性水平的情况(双尾不均等方差 t 测试,p<0.05)。(B) 该图表示文化的持久部分。每个数据点都由平均值表示,±标准偏差,从 3 个生物复制品中计算。这个数字已由我们先前的十九本修订。 请单击此处查看此图的较大版本。
讨论
此处描述的高吞吐量持久性检测是为了阐明各种化学物质对 大肠杆菌 持久性的影响而开发的。除了商用 PM 板外,还可以按照步骤 4.2 中描述的手动构建微型阵拉。此外,此处提出的协议是灵活的,可用于筛选其他微阵拉,如药物面板和细胞库,这些微阵都是 96 个井板格式。可以调整实验条件,包括生长阶段、接种率和中等,以测试这些库。例如,如果想要筛选细胞库,如 Keio E. 大肠杆菌 淘汰赛收集23,他们可以首先使用多通道移液器将菌株从库转移到 96 个井板,其中包括新鲜介质。一旦细胞达到所需的生长阶段(例如指数或静止阶段),细胞将被转移到步骤4.3中描述的持久分析板,以列举淘汰菌株的持久水平。同样,此策略可用于筛选 大肠杆菌促进剂 系列24(96 井板格式的荧光记者菌株库),以识别由抗生素激活的促进剂。通过测量抗生素治疗期间坚持检测板中菌株的荧光信号,可以很容易地检测出这些促进剂。
在我们的实验中,我们使用修改后的LB(缺乏NaCl)来避免从NaCl中产生任何额外的影响,因为微阵骨已经具有各种渗透。虽然常规LB介质中的NaCl已知对保持细胞膜完整性有好处,但据报道,NaCl在0-1%的范围内对细胞生长的影响最小。此外,我们先前研究的碘化丙胺(PI)染色和坚持者检测结果表明,NaCl的缺乏不会显著影响膜的完整性和 大肠杆菌 细胞19的持久性。这一修改是专门为解决我们研究中的问题而做出的,可以根据研究的性质进行修改。
我们还调整了Keren等人5 开发的方法,在接种到微阵列之前消除我们细胞培养中预先存在的坚持者。已知在静止阶段生成 I 型坚持器:因此,将细胞从隔夜培养物直接接种到微阵骨板中,将转移大量持久性细胞,这可能阻碍渗透物的影响。通过稀释/生长周期实验(见协议2),我们能够显著减少这些由隔夜文化19引起的预先存在的坚持者。我们注意到,我们已经在微阵骨板中培养细胞24小时,以便能够计算所有坚持者,包括在静止阶段在渗透物存在的情况下形成的I型变种。但是,这些适应的技术总是可以根据研究的性质进行修改。
我们用5微克/mL OFX治疗微阵列中的细胞,以列举坚持者。由于从 96 个样本中去除抗生素的洗涤程序将非常耗费力,治疗后的细胞在 PBS 中连续稀释,无需清洗(参见第 4.2 步)。此过程稀释了 30 倍以上的 OFX 浓度。稀释后的细胞悬架随后被镀在无抗生素的阿加板上,在那里 OFX 进一步分散。我们的初步研究,我们重复这些实验,有和不洗已经证实,这种串行稀释方法没有影响坚持水平19。
在96个井板的多通道管道输送过程中,应小心地混合细胞悬架,以保持细胞的均匀分布。要做到这一点,根据工作量,最好注意使解决方案均匀所需的最小管道数量。为此,我们进行了一个简单的控制实验,通过在此处研究的条件下分散 PBS 和介质中的染料分子来监控管道(向上和向下)。此外,如果与更复杂的环境(如pH缓冲器)配合使用,我们建议在摇床孵化前和孵化过程中测量细胞培养的pH度,因为随着时间的推移,细胞培养往往非常碱性(pH≈ 8)。这可以给出缓冲器的质量以及 pH 范围的概念。此外,为了从高通量检测中获取 agar 板上的可计数 CFUs,在测试微阵罗之前应优化某些条件,如细胞接种率、培养年龄和序列稀释参数(PBS 体积、稀释率和稀释步骤数等)。最后,应进一步验证从微阵拉中获得的结果,因为96井板中的培养物、表面积和通风量可能对观测结果产生额外影响。
披露声明
作者没有什么可透露的。
致谢
我们要感谢奥曼实验室的成员在这项研究中所做的宝贵意见。这项研究由NIH/NIAID K22AI125468职业转型奖和休斯顿大学创业基金资助。
材料
| Name | Company | Catalog Number | Comments |
| 14-ml test tube | Fisher Scientific | 14-959-1B | |
| E. coli strain MG1655 | Princeton University | Obtained from Brynildsen lab | |
| Flat-bottom 96-well plate | USA Scientific | 5665-5161 | |
| Gas permeable sealing membrane | VWR | 102097-058 | Sterilized by gamma irradiation and free of cytotoxins |
| Half-area flat-bottom 96-well plate | VWR | 82050-062 | |
| LB agar | Fisher Scientific | BP1425-2 | Molecular genetics grade |
| Ofloxacin salt | VWR | 103466-232 | HPLC ≥97.5 |
| Phenotype microarray (PM-9 and PM-10) | Biolog | N/A | PM-9 and PM-10 plates contained various osmolytes and buffers respectively |
| Round-bottom 96-well plate | USA Scientific | 5665-0161 | |
| Sodium chloride | Fisher Scientific | S271-500 | Certified ACS grade |
| Sodium nitrate | Fisher Scientific | AC424345000 | ACS reagent grade |
| Sodium nitrite | Fisher Scientific | AAA186680B | 98% purity |
| Square petri dish | Fisher Scientific | FB0875711A | |
| Tryptone | Fisher Scientific | BP1421-500 | Molecular genetics grade |
| Varioskan lux multi mode microplate reader | Thermo Fisher Scientific | VLBL00D0 | Used for optical density measurement at 600 nm |
| Yeast extract | Fisher Scientific | BP1422-100 | Molecular genetics grade |
参考文献
- Lewis, K. Persister cells, dormancy and infectious disease. Nature Reviews Microbiology. 5 (1), 48-56 (2007).
- Hobby, G. L., Meyer, K., Chaffee, E. Observations on the Mechanism of Action of Penicillin. Experimental Biology and Medicine. 50 (2), 281-285 (1942).
- Bigger, J. Treatment of staphylococcal infections with penicillin by intermittent sterilisation. The Lancet. 244 (6320), 497-500 (1944).
- Balaban, N. Q., Merrin, J., Chait, R., Kowalik, L., Leibler, S. Bacterial persistence as a phenotypic switch. Science. 305 (5690), 1622-1625 (2004).
- Keren, I., Kaldalu, N., Spoering, A., Wang, Y., Lewis, K. Persister cells and tolerance to antimicrobials. FEMS Microbiology Letters. 230 (1), 13-18 (2004).
- Keren, I., Minami, S., Rubin, E., Lewis, K. Characterization and transcriptome analysis of mycobacterium tuberculosis persisters. mBio. 2 (3), (2011).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa Strains Producing High Levels of Persister Cells in Patients with Cystic Fibrosis. Journal of Bacteriology. 192 (23), 6191-6199 (2010).
- LaFleur, M. D., Kumamoto, C. A., Lewis, K. Candida albicans biofilms produce antifungal-tolerant persister cells. Antimicrobial Agents and Chemotherapy. 50 (11), 3839-3846 (2006).
- Allison, K. R., Brynildsen, M. P., Collins, J. J. Metabolite-enabled eradication of bacterial persisters by aminoglycosides. Nature. 473 (7346), 216-220 (2011).
- Lechner, S., Lewis, K., Bertram, R. Staphylococcus aureus persisters tolerant to bactericidal antibiotics. Journal of Molecular Microbiology and Biotechnology. 22 (4), 235-244 (2012).
- Barrett, T. C., Mok, W. W. K., Murawski, A. M., Brynildsen, M. P. Enhanced antibiotic resistance development from fluoroquinolone persisters after a single exposure to antibiotic. Nature Communications. 10 (1), 1177 (2019).
- Windels, E. M., et al. Bacterial persistence promotes the evolution of antibiotic resistance by increasing survival and mutation rates. ISME Journal. 13 (5), 1239-1251 (2019).
- Dörr, T., Lewis, K., Vulić, M. SOS response induces persistence to fluoroquinolones in Escherichia coli. PLoS Genetics. 5 (12), 1000760 (2009).
- Völzing, K. G., Brynildsen, M. P. Stationary-phase persisters to ofloxacin sustain DNA damage and require repair systems only during recovery. mBio. 6 (5), (2015).
- Grant, S. S., Kaufmann, B. B., Chand, N. S., Haseley, N., Hung, D. T. Eradication of bacterial persisters with antibiotic-generated hydroxyl radicals. Proceedings of the National Academy of Sciences. 109 (30), 12147-12152 (2012).
- Gerdes, K., Maisonneuve, E. Bacterial Persistence and Toxin-Antitoxin Loci. Annual Review of Microbiology. 66 (1), 103-123 (2012).
- Orman, M. A., Brynildsen, M. P. Inhibition of stationary phase respiration impairs persister formation in E. coli. Nature Communications. 6 (1), 7983 (2015).
- Korch, S. B., Henderson, T. A., Hill, T. M. Characterization of the hipA7 allele of Escherichia coli and evidence that high persistence is governed by (p)ppGpp synthesis. Molecular Microbiology. 50 (4), 1199-1213 (2003).
- Karki, P., Mohiuddin, S. G., Kavousi, P., Orman, M. A. Investigating the effects of osmolytes and environmental ph on bacterial persisters. Antimicrobial Agents and Chemotherapy. 64 (5), 02393 (2020).
- Mohiuddin, S. G., Hoang, T., Saba, A., Karki, P., Orman, M. A. Identifying Metabolic Inhibitors to Reduce Bacterial Persistence. Frontiers in Microbiology. 11, 472 (2020).
- Brooun, A., Liu, S., Lewis, K. A dose-response study of antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrobial Agents and Chemotherapy. 44 (3), 640-646 (2000).
- Luidalepp, H., Jõers, A., Kaldalu, N., Tenson, T. Age of inoculum strongly influences persister frequency and can mask effects of mutations implicated in altered persistence. Journal of Bacteriology. 193 (14), 3598-3605 (2011).
- Baba, T., et al. Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: The Keio collection. Molecular Systems Biology. 2, 0008 (2006).
- Zaslaver, A., et al. A comprehensive library of fluorescent transcriptional reporters for Escherichia coli. Nature Methods. 3 (8), 623-628 (2006).
- Hajmeer, M., Ceylan, E., Marsden, J. L., Fung, D. Y. C. Impact of sodium chloride on Escherichia coli O157:H7 and Staphylococcus aureus analysed using transmission electron microscopy. Food Microbiology. 23 (5), 446-452 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。