Method Article
فحص عالي الإنتاجية للمركبات الكيميائية لتوضيح آثارها على الثبات البكتيري
In This Article
Summary
في ورقة الطريقة هذه، نقدم استراتيجية فحص عالية الإنتاجية لتحديد المركبات الكيميائية، مثل الأوسموليت، التي لها تأثير كبير على الثبات البكتيري.
Abstract
وتعرف الثوابر البكتيرية بأنها مجموعة فرعية صغيرة من المتغيرات الظاهرية مع القدرة على تحمل تركيزات عالية من المضادات الحيوية. وهي مصدر قلق صحي مهم لأنها ارتبطت بالتهابات مزمنة متكررة. على الرغم من أن الديناميات العشوائية والحتمية للآليات المرتبطة بالإجهاد معروفة بلعب دور كبير في المثابرة ، إلا أن الآليات الكامنة وراء التحول الظاهري إلى / من حالة المثابرة ليست مفهومة تماما. وفي حين أن عوامل الثبات الناجمة عن الإشارات البيئية (مثل استنفاد الكربون والنيتروجين ومصادر الأكسجين) قد درست على نطاق واسع، فإن آثار الأوسموليت على الثبات لم تحدد بعد. باستخدام microarrays (أي 96 لوحات الآبار التي تحتوي على مواد كيميائية مختلفة)، قمنا بتصميم نهج لتوضيح آثار مختلف الأوسموليت على استمرار الإشريكية القولونية بطريقة عالية الإنتاجية. هذا النهج هو تحويلي حيث يمكن تكييفه بسهولة للصفائف الفحص الأخرى، مثل لوحات المخدرات ومكتبات خروج المغلوب الجينات.
Introduction
تحتوي الثقافات البكتيرية على عدد صغير من الخلايا الدائمة التي تتحمل مؤقتا مستويات عالية بشكل غير عادي من المضادات الحيوية. الخلايا Persister متطابقة وراثيا إلى جلودهم الحساسة للمضادات الحيوية، ويعزى بقائهم على قيد الحياة إلى تثبيط النمو العابر1. تم اكتشاف الخلايا Persister لأول مرة من قبل غلاديس هواية2 ولكن تم استخدام هذا المصطلح لأول مرة من قبل جوزيف أكبر عندما حدد لهم في الثقافات المكورات العنقودية المعالجة البنسلين3. اكتشفت دراسة أساسية نشرها بالابان وآخرون4 نوعين من الثبات: المتغيرات من النوع الأول التي تتشكل في المقام الأول عن طريق المرور عبر المرحلة الثابتة، والمتغيرات من النوع الثاني التي يتم إنشاؤها باستمرار خلال النمو الأسي. يتم الكشف عن Persisters من خلال مقايسات البقاء على قيد الحياة كلونوجينيك، التي تؤخذ عينات الثقافة على فترات مختلفة أثناء العلاج بالمضادات الحيوية، وغسلها، ومطلي على وسيلة نمو نموذجية لحساب الخلايا الناجية التي يمكن أن تستعمر في غياب المضادات الحيوية. يتم تقييم وجود المستمرين في ثقافة الخلية من خلال منحنى قتل ثنائي الطور4،5 حيث يشير الاضمحلال الأسي الأولي إلى وفاة الخلايا الحساسة للمضادات الحيوية. ومع ذلك ، فإن اتجاه القتل ينخفض مع مرور الوقت ، مما يؤدي في نهاية المطاف إلى منطقة هضبة تمثل الخلايا الثامرة الباقية على قيد الحياة.
وقد ارتبطت الخلايا persister مع أمراض مختلفة مثل السل6, التليف الكيسي7, داء المبيضات8 والتهابات المسالك البولية9. تم العثور على جميع الكائنات الحية الدقيقة تقريبا التي تم اختبارها حتى الآن لتوليد الأنماط الظاهرية المستمرة ، بما في ذلك البكتيريا الفطرية المسببة للأمراض للغاية السل6، المكورات العنقودية أوريوس10، Pseudomonas aeruginosa7 وكانديدا ألبيكانز8. كما تقدم الدراسات الحديثة أدلة على صعود المسوخ المقاومة للأدوية المتعددة من الخلايا الفرعية الدائمة11،12. وقد كشفت الجهود الكبيرة المبذولة في هذا المجال أن آليات الثبات معقدة ومتنوعة للغاية؛ وأن الآليات التي لا يمكن أن تكون أكثر تعقيدا من أي بلد آخر، لا سيما في مجال مكافحة الهجمات، لا سيما في مجال الآليات التي لا يمكن أن تكون لها أهمية في مجال الجهود كل من العوامل العشوائية والحتمية المرتبطة استجابة SOS13،14، أنواع الأكسجين التفاعلي (ROS)15، أنظمة السموم / مضادات السموم (TA)16، autophagy أو الهضم الذاتي17 والاستجابة الصارمة ذات الصلة ppGpp18 معروفة لتسهيل تشكيل أكثر استمرارا.
على الرغم من التقدم الكبير في فهم النمط الظاهري المثابرة ، لم يتم فهم آثار الأوسموليت على الثبات البكتيري بشكل كامل. وبما أن الحفاظ على الضغط التناضحي الأمثل هو ضرورة لنمو الخلايا وحسن سير عملها وبقائها على قيد الحياة، فإن إجراء دراسة متعمقة للنحلات يمكن أن يؤدي إلى أهداف محتملة للاستراتيجيات المضادة للاستمرار. على الرغم من شاقة, فحص عالية الإنتاجية هو نهج فعال جدا لتحديد الأيض والمواد الكيميائية الأخرى التي تلعب دورا حاسما في النمط الظاهري استمرار19,20. في هذا العمل، سنناقش طريقتنا المنشورة19،حيث استخدمنا microarrays، أي 96 لوحة بئر تحتوي على أوزموليتات مختلفة (على سبيل المثال، كلوريد الصوديوم، اليوريا، نيتريت الصوديوم، نترات الصوديوم، كلوريد البوتاسيوم)، لتحديد الأوسموليت التي تؤثر بشكل كبير على استمرار الإشريكية القولونية.
Protocol
1. إعداد متوسط النمو، محلول أوفساسين وأسهم خلايا الإشريكية القولونية
- العادية لوريا-بيرتاني (LB) المتوسطة: إضافة 10 غرام / لتر من تريبتون، 10 غرام / لتر من كلوريد الصوديوم (NaCl) و 5 غرام / لتر من استخراج الخميرة في الماء deionized (DI). تعقيم الوسط عن طريق الالاستعباد التلقائي.
- LB أجار لوحات: إضافة 10 غرام / لتر من تريبتون، 10 غرام / لتر من NaCl، 5 غرام / لتر من استخراج الخميرة و 15 غرام / لتر أجار في الماء DI وتعقيم المتوسطة عن طريق الالاستعباد التلقائي. في درجة الحرارة المطلوبة (~ 55 درجة مئوية)، صب ~ 30 مل من المتوسط أجار في لوحات مربعة (10 × 10 سم). جفف الأطباق وخزنها عند درجة حرارة 4 درجات مئوية.
- تعديل LB المتوسطة: إضافة 10 غرام / لتر من تريبتون و 5 غرام / لتر من استخراج الخميرة في الماء DI. تعقيم الوسط عن طريق الالاستعباد التلقائي.
- تعديل LB المتوسطة بما في ذلك osmolyte: مزيج 2x تعديل LB المتوسطة مع حل osmolyte 2x في وحدات التخزين متساوية. لإعداد 2x تعديل LB المتوسطة، إضافة 20 غرام / لتر من تريبتون و 10 غرام / لتر من استخراج الخميرة في الماء DI وتعقيمها عن طريق الالاستعباد التلقائي. لإعداد محلول osmolyte 2x، حل osmolyte من الفائدة (2x كمية) في المياه DI، ومن ثم تصفية تعقيم الحل.
ملاحظة: يمكن تحديد التناضح من الفائدة وتركيزاته من مقايسات الفحص المجهري النمط الظاهري (انظر البروتوكول 4). ومع ذلك ، يمكن تعديل الأوسموليت المختبر وتركيز 2x المرتبط به اعتمادا على طبيعة البحث. على سبيل المثال، لدراسة تأثير كلوريد الصوديوم 1 mM، محلول osmolyte 2x سيكون محلول كلوريد الصوديوم 2M. - محلول مخزون Ofloxacin (5 ملغم / مل): أضف 5 ملغ من ملح أوفلوكساسين (OFX) في 1 مل من ماء DI. إضافة 10 ميكرولتر من هيدروكسيد الصوديوم 10 M لزيادة قابلية الذوبان OFX في الماء، ومن ثم تصفية تعقيم الحل. إعداد aliquots وتخزينها في -20 درجة مئوية.
ملاحظة: أوفلوكساسين هو مضاد حيوي الكينولون الذي تم استخدامه على نطاق واسع لكل من الخلايا البكتيرية المتنامية وغير المتنامية14،21. الحد الأدنى للتركيز المثبط (MIC) OFX لخلايا E. coli MG1655 يقع ضمن نطاق 0.039-0.078 ميكروغرام/مل19،20. لاحظ أيضا أن المضادات الحيوية الأخرى مثل أمبيسلين وكاناميسين تستخدم عادة في البحوث المستمرة. يعتمد اختيار المضادات الحيوية على طبيعة الدراسة. - الإشريكية القولونية مخزون الخلايا MG1655: تلقيح 2 مل من المتوسط LB العادية مع مستعمرة واحدة في أنبوب اختبار 14 مل (المفاجئة توج) والثقافة الخلايا في شاكر المداري في 250 دورة في الدقيقة و 37 درجة مئوية. عندما تصل الخلايا إلى المرحلة الثابتة، اخلط 500 ميكرولتر من زراعة الخلية مع 500 ميكرولتر من 50٪ من الجلسيرول (معقم) في قارورة مبردة وتخزينها عند -80 درجة مئوية.
2. انتشار الخلايا للقضاء على استمرار موجودة من قبل
- لإعداد ثقافة بين عشية وضحاها، كشط كمية صغيرة من الخلايا من مخزون الخلية المجمدة مع طرف ماصة معقمة (لا إذابة مخزون خلية الجلسرين)، وتطعيم الخلايا في 2 مل من المتوسط LB المعدلة في أنبوب اختبار المفاجئة توج 14 مل. زراعة الخلايا في شاكر المداري في 250 دورة في الدقيقة و 37 درجة مئوية لمدة 12 ساعة.
- الانتشار الأول
- بعد 12 ساعة، نقل 250 ميكرولتر من الثقافة بين عشية وضحاها إلى 25 مل من المتوسط LB المعدلة الطازجة في قارورة حيرة 250 مل مغطاة رقائق الألومنيوم العقيمة.
- زراعة زراعة الخلية في شاكر المداري في 250 دورة في الدقيقة و 37 درجة مئوية حتى تصل الخلايا إلى المرحلة المتوسطة الأسية (OD600 = 0.5).
- قياس الكثافة البصرية في 600 نانومتر (OD600)باستخدام قارئ microplate كل 30 دقيقة.
- الانتشار الثاني
- في OD600 = 0.5، تمييع 250 ميكرولتر من ثقافة الخلية من القارورة الأولى إلى 25 مل من متوسط LB المعدل الطازج في قارورة محيرة سعة 250 مل.
- زراعة زراعة الخلية الثانية في شاكر المداري في 250 دورة في الدقيقة و 37 درجة مئوية حتى OD600= 0.5.
- قياس الكثافة البصرية كل 30 دقيقة.
ملاحظة: قد يكون لثقافة بين عشية وضحاها كمية كبيرة من الخلايا الدائمة4و5و22. يمكن استخدام طريقة دورة التخفيف / النمو5 الموصوفة أعلاه للقضاء على هذه المستمرة الموجودة مسبقا قبل نقل الخلايا إلى microarrays. ويمكن التحقق من صحتها عن طريق تحديد المستويات الدائمة للثقافات بين عشية وضحاها بالوصف الوارد في البروتوكول 3. تم التحقق من صحة هذه الطريقة بالفعل في دراسة سابقة19.
3. التحقق من القضاء على الخلايا القائمة مسبقا persister
- بعد الانتشار الثاني (انظر الخطوة 2.3)، تمييع 250 ميكرولتر من ثقافة الخلية (OD600 = 0.5) في 25 مل من متوسط LB المعدل الطازج في قارورة محيرة سعة 250 مل.
ملاحظة: بالنسبة للضوابط، تخفيف 250 ميكرولتر من الثقافة بين عشية وضحاها (انظر الخطوة 2.1) في 25 مل من المتوسط LB المعدلة الطازجة في قارورة حيرة 250 مل. قبل نقل الخلايا إلى القارورة، يجب تعديل كثافة الخلية للثقافة بين عشية وضحاها في المتوسط LB المعدلة الطازجة للحصول على OD600 = 0.5. - إضافة 25 ميكرولتر من محلول الأسهم OFX (5 ملغ / مل) في تعليق الخلية ويهز قارورة بلطف لجعل ثقافة المقايسة متجانسة. التركيز النهائي OFX هو 5 ميكروغرام / مل في ثقافة المقايسة.
- احتضان ثقافة المقايسة في شاكر المداري في 250 دورة في الدقيقة و 37 درجة مئوية.
- في كل ساعة أثناء العلاج (بما في ذلك 0 ساعة، النقطة الزمنية قبل إضافة OFX إلى ثقافة المقايسة)، نقل 1 مل من ثقافة المقايسة من القارورة إلى أنبوب طرد دقيق سعة 1.5 مل.
- الطرد المركزي ثقافة المقايسة في أنبوب الطرد المركزي الدقيق في 17000 × غرام لمدة 3 دقائق.
- إزالة بعناية 950 ميكرولتر من supernatant دون إزعاج بيليه الخلية.
- أضف 950 ميكرولتر من محلول ملحي عازل بالفوسفات (PBS) إلى أنبوب الطرد المركزي الدقيق.
- كرر خطوات الغسيل 3.5-3.7 ل3x في المجموع حتى تركيز المضادات الحيوية هو أقل من الحد الأدنى للتركيز المثبطة (MIC).
- بعد الغسيل النهائي ، أعيد إنفاق بيليه الخلية في 100 ميكرولتر من محلول PBS ، مما أدى إلى عينة مركزة 10x.
- تأخذ 10 ميكرولتر من تعليق الخلية وتمييع المسلسل ست مرات في 90 ميكرولتر من محلول PBS باستخدام لوحة 96 جولة أسفل بشكل جيد.
- بقعة 10 ميكرولتر من تعليق الخلايا المخففة على لوحات أجار الطازجة الخالية من المضادات الحيوية. لزيادة الحد الأقصى للكشف، لوحة المتبقية 90 ميكرولتر من تعليق الخلية على لوحة أجار جديدة.
- احتضان لوحات أجار في 37 درجة مئوية لمدة 16 ساعة، ومن ثم عد وحدات تشكيل مستعمرة (CFUs). حساب معدلات التخفيف أثناء حساب العدد الإجمالي ل CFUs في 1 مل من ثقافة المقايسة. يتم إنشاء منحنيات القتل عن طريق رسم قيم CFU اللوغاريتمية فيما يتعلق بمدة العلاج بالمضادات الحيوية.
ملاحظة: A 6 ساعة OFX العلاج يكفي للحصول على منحنى قتل ثنائي الطور لخلايا القولونية 19,20. وينبغي أن يكون المستوى الواقف للخلايا المنشرة (مقيسا بحسابات CFU عند 6 ساعات) أقل بكثير من مستوى الثقافة بين عشية وضحاها. يمكن تنفيذ الإجراءات الموضحة في البروتوكول 2 و3 مع LB العادية اعتمادا على تصميم البحث.
4. ميكروراي لوحة الفحوصات
- إعداد ثقافات الخلايا المجهرية
- نقل 250 ميكرولتر من خلايا المرحلة الأسية إلى 25 مل من متوسط LB المعدل الطازج في أنبوب طرد مركزي سعة 50 مل. امزج تعليق الخلية بلطف لجعله متجانسا.
ملاحظة: يتم الحصول على خلايا المرحلة الأسية (OD600 = 0.5) من خطوة الانتشار الثانية (راجع الخطوة 2.3). - نقل تعليق الخلية المخفف إلى خزان معقم 50 مل.
- باستخدام ماصة متعددة القنوات، نقل 150 ميكرولتر من تعليق الخلية إلى كل بئر من microarray، أي لوحة بئر 96 تحتوي على osmolytes مختلفة.
ملاحظة: الآبار التي ليس لديها osmolytes بمثابة عناصر التحكم. - قم بتغطية الميكروي بغشاء ختم نفاذي للغاز.
- احتضان لوحة في شاكر المدارية في 37 درجة مئوية و 250 دورة في الدقيقة لمدة 24 ساعة.
ملاحظة: في هذه التجارب، تم استخدام لوحات متاحة تجاريا، مثل الميكرويات النمط الظاهري (PM-9 و PM-10) التي تشمل مجموعة واسعة من الأوسموليت، ومخازن الحموضة وغيرها من المواد الكيميائية في حالة المجففة بتركيزات مختلفة. هذه microarrays هي في نصف المنطقة 96 شكل لوحة البئر. يجب تعديل أحجام الثقافة اعتمادا على نوع اللوحات المستخدمة. يمكن أيضا إنشاء microarrays يدويا (انظر أدناه).
- نقل 250 ميكرولتر من خلايا المرحلة الأسية إلى 25 مل من متوسط LB المعدل الطازج في أنبوب طرد مركزي سعة 50 مل. امزج تعليق الخلية بلطف لجعله متجانسا.
- إعداد يدوي للوحات ميكروراي
- نقل 75 ميكرولتر من حلول osmolyte 2x في آبار نصف منطقة 96 لوحة بئر.
- نقل 500 ميكرولتر من خلايا المرحلة الأسية إلى 25 مل من 2x تعديل LB المتوسطة في أنبوب الطرد المركزي 50 مل. امزج تعليق الخلية بلطف لجعله متجانسا.
ملاحظة: تم تعديل معدل التطعيم ليكون متسقا مع بروتوكول الفحص المجهري الموصوف في 4.1. - إضافة 75 ميكرولتر من تعليق الخلية في كل بئر من نصف المنطقة 96 لوحة بئر تحتوي على حلول osmolyte 2x.
- احتضان لوحة في شاكر المدارية في 37 درجة مئوية و 250 دورة في الدقيقة لمدة 24 ساعة.
- إعداد لوحات المقايسة الوازبرة
- إعداد 25 مل من متوسط LB المعدل الذي يحتوي على 5 ميكروغرام /مل من OFX في أنبوب طرد مركزي سعة 50 مل ونقل هذه الوسيلة إلى خزان معقم.
- نقل 190 ميكرولتر من المتوسط LB المعدلة مع OFX من الخزان إلى كل بئر من لوحة بئر عامة مسطحة القاع 96 (لوحة الفحص persister) باستخدام ماصة متعددة القنوات.
- إزالة microarray من شاكر (بعد زراعة لمدة 24 ساعة) ونقل 10 ميكرولتر من ثقافات الخلية من microarray إلى آبار لوحة المستمر- المقايسة، التي تحتوي على تعديل LB المتوسطة مع OFX.
- خذ 10 ميكرولتر من تعليق الخلايا من لوحة الفحص المستمر وتمييع المسلسل ثلاث مرات في 290 ميكرولتر من محلول PBS باستخدام لوحة بئر 96 مستديرة القاع وماصة متعددة القنوات.
- بعد التخفيف التسلسلي ، بقعة 10 ميكرولتر من جميع تعليق الخلايا المخففة بشكل متسلسل على لوحات أجار طازجة خالية من المضادات الحيوية باستخدام ماصة متعددة القنوات.
- احتضان لوحة الفحص المستمر (المعدة في الخطوة 4.3.3) في شاكر مداري عند 37 درجة مئوية و 250 دورة في الدقيقة لمدة 6 ساعة بعد تغطية اللوحة بغشاء ختم نفاذية للغاز.
- بعد 6 ساعة حضانة في شاكر، واتخاذ لوحة الثبات- المقايسة خارج وتكرار الخطوات 4.3.4-4.3.5.
- احتضان لوحات أجار لمدة 16 ساعة في 37 درجة مئوية، ومن ثم عد CFUs. مستويات CFU قبل و 6 ساعة بعد العلاج بالمضادات الحيوية تمكين لحساب كسر persister في كل بئر. كما يساعد تعداد CFU قبل علاج OFX في تقييم آثار الأوسموليت وعلى قابلية الإشريكية القولونية للاستدامة.
5. التحقق من الشروط المحددة
- نقل 250 ميكرولتر من خلايا المرحلة الأسية من الخطوة 2.3 إلى 25 مل من متوسط LB المعدل الطازج الذي يحتوي على الأوسموليت المحدد من فحص microarray (انظر البروتوكول 4).
- احتضان القارورة في شاكر المداري في 250 دورة في الدقيقة و 37 درجة مئوية لمدة 24 ساعة.
- بعد 24 ساعة، قم بإزالة القارورة من شاكر ونقل 250 ميكرولتر من ثقافة الخلية إلى 25 مل من المتوسط LB المعدل الطازج في قارورة محيرة سعة 250 مل.
- إضافة 25 ميكرولتر من محلول الأسهم OFX (5 ملغ / مل) في تعليق الخلية ويهز القارورة بلطف لجعل ثقافة المقايسة متجانسة. احتضان القارورة في شاكر في 37 درجة مئوية و 250 دورة في الدقيقة.
- في كل ساعة أثناء العلاج، نقل 1 مل من ثقافة المقايسة من القارورة إلى أنبوب الطرد المركزي الدقيق 1.5 مل.
- الطرد المركزي ثقافة المقايسة في أنبوب الطرد المركزي الدقيق في 17000 × غرام لمدة 3 دقائق.
- إزالة 950 ميكرولتر من supernatant وإضافة 950 ميكرولتر من برنامج تلفزيوني.
- كرري خطوات الغسيل 5.6 و5.7 ل 3x.
- بعد الغسيل النهائي ، أعيد إنفاق بيليه الخلية في 100 ميكرولتر من محلول PBS.
- خذ 10 ميكرولتر من تعليق الخلية وتمييع 6x في 90 ميكرولتر من محلول PBS باستخدام لوحة قاع مستديرة 96 جيدا.
- بقعة 10 ميكرولتر من تعليق الخلية المخففة على لوحة أجار طازجة خالية من المضادات الحيوية. لزيادة الحد الأقصى للكشف، لوحة المتبقية 90 ميكرولتر من تعليق الخلية على لوحة أجار جديدة.
- احتضان لوحة أجار في 37 درجة مئوية لمدة 16 ساعة، ومن ثم عد CFUs.
النتائج
الشكل 1 يصف بروتوكولنا التجريبي. وقد اقتبست تجارب دورة التخفيف/النمو (انظر البروتوكول 2) من دراسة أجراها كيرين وآخرون5 للقضاء على الثوام الناشئين عن الثقافات بين عشية وضحاها. الشكل 2A هو صورة تمثيلية من لوحات أجار المستخدمة لتحديد مستويات CFU من ثقافات الخلايا قبل وبعد العلاج OFX. في هذه التجارب، تم استزراع الخلايا في متوسط LB معدل مع osmolytes في نصف المنطقة 96 لوحات الآبار كما هو موضح في الخطوة 4.2. بعد احتضان اللوحة في شاكر مداري لمدة 24 ساعة ، تم إجراء الفحص المستمر باستخدام لوحة بئر مسطحة عامة 96 (انظر الخطوة 4.3). تم اختيار الأوسموليت والتركيز الذي يتم اختباره هنا بناء على دراستنا السابقة19، حيث قمنا بتنفيذ الخطوتين 4.1 و 4.3 باستخدام لوحة PM-9 التي تشمل مختلف الأوسموليت بتركيزات مختلفة (كلوريد الصوديوم ، كلوريد البوتاسيوم، كبريتات الصوديوم، غليكول الإيثيلين، فورت الصوديوم، اليوريا، لاكتات الصوديوم، فوسفات الصوديوم، بنزوات الصوديوم، كبريتات الأمونيوم، نيتريت الصوديوم ونترات الصوديوم). يظهر العمود الأول في الشكل 2A تعدادات CFU لمجموعة التحكم. يمثل العمود الثاني حالة حيث تم استزراع الخلايا في نترات الصوديوم 100 mM; تم العثور على هذا الشرط سابقا لزيادة طفيفة في مستويات persister19. العمود الثالث يمثل حالة حيث تم استزراع الخلايا في نيتريت الصوديوم 60 mM، وكان هذا الشرط وجدت سابقا إلى انخفاض كبير في مستويات استمرار مقارنة مع الضوابط19. الشكل 2B هو تمثيل رسومي لبيانات CFU التي تم الحصول عليها من لوحات أجار. ويبين الشكل 2C الكسور المستمرة من ثقافات الخلايا التي تم اختبارها في 96 لوحة بئر. لحساب الكسور، تم تطبيع العد المستمر لأعداد الخلايا التي تم الحصول عليها قبل العلاج بالمضادات الحيوية. ويبين الشكل 3 منحنيات القتل ثنائية الطور والكسور الدائمة، على التوالي، لثقافات المقايسة التي يتم إجراؤها في قوارير محيرة. في هذه التجارب، تم استزراع الخلايا لأول مرة في 25 مل من متوسط LB المعدل مع الأوسموليتات المشار إليها في قوارير محيرة سعة 250 مل لمدة 24 ساعة، ثم تم نقل الخلايا إلى قوارير ثابتة للتعداد المستمر كما هو موضح في البروتوكول 5.
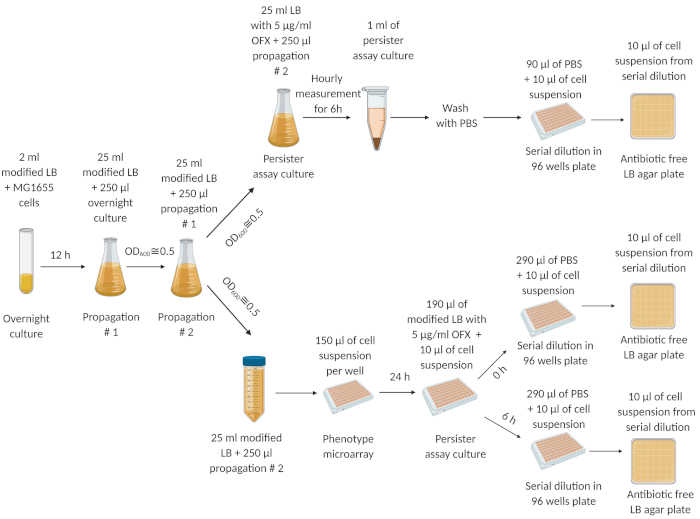
الشكل 1: الإجراء التجريبي. نمت الخلايا من مخزون الخلية المجمدة بين عشية وضحاها (12 ساعة) في المتوسط LB الطازجة. في 12 ساعة، تم تخفيف الثقافة بين عشية وضحاها (1:100) في 25 مل من المتوسط LB المعدلة ونمت حتى OD600= 0.5. تكررت خطوة الانتشار هذه مرتين. بعد خطوة الانتشار النهائية، تم تخفيف خلايا المرحلة الأسية (في OD600= 0.5) (1:100) في وسط LB معدل جديد في قارورة محيرة سعة 250 مل وأنبوب طرد مركزي سعة 50 مل على التوالي. وعولج تعليق الخلية في القارورة المحيرة التي سعة 250 مل ب 5 ميكروغرام/مل من OFX لتحديد كميا الاستمرارية. تم نقل تعليق الخلية في أنبوب الطرد المركزي 50 مل إلى microarrays واحتضانها لمدة 24 ساعة في شاكر المداري في 250 دورة في الدقيقة و 37 درجة مئوية. ثم تم نقل الخلايا من microarrays إلى لوحات الفحص المستمر لتحديد استمرارية. تم إنشاء هذا الرقم باستخدام biorender.com. تم تعديل هذا الرقم من منشورنا السابق19. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تجارب ميكرواراي. (أ)نمت الخلايا لأول مرة في المتوسط LB المعدلة مع أو بدون osmolytes المشار إليها في نصف منطقة 96 لوحة بئر لمدة 24 ساعة. ثم تم نقل الخلايا إلى لوحة عامة مسطحة القاع 96 جيدا وعولجت مع 5 ميكروغرام / مل من OFX لمدة 6 ساعة. قبل وبعد العلاج 6 ساعة، تم تخفيف الخلايا بشكل متسلسل في برنامج تلفزيوني، مطلي على لوحات أجار واحتضانها في 37 درجة مئوية لمدة 16 ساعة. كل شرط لديه 8 نسخ متماثلة التقنية. (ب)أجريت قياسات CFU لتقييم آثار osmolytes على صلاحية الخلية والمثابرة، على التوالي. يشير الخط المستقيم إلى حد الكشف (600 CFUs). (ج) يمثل الرسم البياني الكسور المستمرة من ثقافات الخلية، محسوبة بأخذ نسبة عدد CFU بعد وقبل علاج OFX. لم يتم حساب الكسر المستمر من ثقافة الخلية التي تحتوي على نيتريت الصوديوم 60 مليون متر لأن مستوى استمراره أقل من حد الكشف. تم الإشارة إلى كل نقطة بيانات حسب متوسط القيمة ± الانحراف المعياري، محسوبة من 8 نسخ متماثلة تقنية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
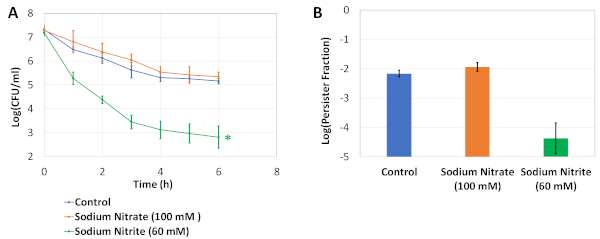
الشكل 3: تجارب التحقق من الصحة. (أ)تم نقل خلايا المرحلة الأسية إلى 25 مل من المتوسط LB المعدلة الطازجة مع osmolytes المشار إليها في 250 مل قوارير حائرة ومثقفة لمدة 24 ساعة. ثم تم تخفيف الخلايا (1:100) في 250 مل من القوارير المحيرة التي تحتوي على 25 مل من متوسط LB المعدلة وعولجت ب 5 ميكروغرام / مل OFX لمدة 6 ساعة. تم رصد تعداد CFU في ثقافات المقايسة كل ساعة لتوليد منحنيات القتل ثنائية الطور. * يشير إلى الشرط الذي يؤثر بشكل كبير على مستويات OFX استمرار مقارنة مع عدم وجود osmolyte الضوابط (اثنين الذيل التباين غير المتكافئ تي اختبار، p<0.05). (ب)يمثل الرسم البياني الكسور الدائمة للثقافات. وقد تمت الإشارة إلى كل نقطة بيانات حسب متوسط القيمة ± الانحراف المعياري، محسوبا من 3 نسخ بيولوجية متماثلة. تم تعديل هذا الرقم من منشورنا السابق19. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم تطوير المقايسة المستمرة عالية الإنتاجية الموصوفة هنا لتوضيح آثار المواد الكيميائية المختلفة على استمرار الإشريكية القولونية. بالإضافة إلى لوحات PM التجارية، يمكن إنشاء microarrays يدويا كما هو موضح في الخطوة 4.2. وعلاوة على ذلك، فإن البروتوكول المعروض هنا مرن ويمكن استخدامه لفحص الميكروبات الأخرى، مثل ألواح المخدرات ومكتبات الخلايا، الموجودة في 96 شكل لوحة بئر. ويمكن تعديل الشروط التجريبية بما في ذلك مرحلة النمو ومعدل التطعيم والمتوسط لاختبار هذه المكتبات. على سبيل المثال، إذا كان أحد يريد أن يفحص مكتبة الخلية، مثل مجموعة كيو E. coli بالضربة القاضية23،فإنها يمكن أن تنقل أولا سلالات من المكتبة إلى 96 لوحات الآبار التي تشمل وسائل الإعلام الطازجة، وذلك باستخدام ماصة متعددة القنوات. بمجرد أن تصل الخلايا إلى مرحلة النمو المرغوبة (على سبيل المثال، المرحلة الأسية أو الثابتة)، يتم نقل الخلايا بعد ذلك إلى لوحات الفحص المستمر كما هو موضح في الخطوة 4.3 لتعداد المستويات المستمرة لسلالات خروج المغلوب. وبالمثل، يمكن استخدام هذه الاستراتيجية لفحص مجموعة E. coli Promoter 24 (مكتبة من سلالات المراسلات الفلورية في 96 تنسيقا للوحة البئر) لتحديد المروجين الذين يتم تنشيطهم بواسطة المضادات الحيوية. يمكن اكتشاف هؤلاء المروجين بسهولة عن طريق قياس إشارات الفلورسينس للسلالات في لوحات الفحص المستمر أثناء العلاج بالمضادات الحيوية.
في تجاربنا، استخدمنا LB معدلة (تفتقر إلى NaCl) لتجنب أي تأثير إضافي يمكن أن تنشأ من NaCl، معتبرا أن microarrays لديها بالفعل osmolytes مختلفة. على الرغم من أن NaCl في المتوسط LB العادية ومن المعروف أن تكون جيدة للحفاظ على سلامة الغشاء من الخلايا, وقد أفيد أن NaCl في نطاق 0-1٪ له تأثير ضئيل على نمو الخلايا25. وعلاوة على ذلك، أظهرت نتائج تلطيخ يوديد البروبيديوم (PI) و المقايسات المستمرة في دراستنا السابقة أن غياب NaCl لا يؤثر بشكل كبير على سلامة الغشاء واستمرار خلايا الإشريكية القولونية 19. تم إجراء هذا التعديل خصيصا لمعالجة المخاوف في دراستنا ويمكن تغييره استنادا إلى طبيعة البحث.
كما قمنا بتكييف طريقة طورها كيرين وآخرون5 للقضاء على المثابرين الموجودين من قبل في ثقافات خلايانا قبل التطعيم في الميكروبات. ومن المعروف أن النوع الأول persisters أن تتولد خلال المرحلة الثابتة؛ لذلك ، فإن التطعيم المباشر للخلايا من الثقافات بين عشية وضحاها إلى لوحات microarray نقل عدد كبير من persisters ، والتي قد تعوق آثار osmolytes. مع تجارب دورة التخفيف / النمو (انظر البروتوكول 2) ، تمكنا من الحد بشكل كبير من هذه المثابرة الموجودة مسبقا الناشئة عن الثقافات بين عشية وضحاها19. نلاحظ أننا قمنا باستزراع الخلايا في لوحات ميكرواراي لمدة 24 ساعة لتكون قادرة على عد جميع المثابرين ، بما في ذلك المتغيرات من النوع الأول التي يتم تشكيلها خلال المرحلة الثابتة في وجود الأوسموليت. ومع ذلك ، يمكن دائما تعديل هذه التقنيات المكيفة اعتمادا على طبيعة الدراسة.
عالجنا الخلايا في microarrays مع 5 ميكروغرام / مل OFX لتعداد persisters. وبما أن إجراء الغسيل لإزالة المضاد الحيوي من 96 عينة سيكون كثيف العمالة للغاية ، فقد تم تخفيف الخلايا بعد العلاج بشكل متسلسل في PBS دون غسل (انظر الخطوة 4.2). هذا الإجراء خفف تركيز OFX أكثر من 30 مرة. ثم تم طلاء تعليق الخلايا المخففة على لوحات أجار خالية من المضادات الحيوية حيث تم تشتيت OFX بشكل أكبر. وقد تحققت دراساتنا الأولية حيث كررنا هذه التجارب مع وبدون غسل أن هذه الطريقة المسلسل تخفيف لم يؤثر على مستويات استمرار19.
أثناء الأنابيب متعددة القنوات في 96 لوحات البئر، ينبغي للمرء أن يكون خلط بعناية تعليق الخلية للحفاظ على توزيع الخلايا متجانسة. للقيام بذلك، اعتمادا على وحدة التخزين العمل، سيكون من المفيد ملاحظة الحد الأدنى لعدد pipetting المطلوبة لجعل الحل متجانسة. لهذا الغرض، أجرينا تجربة بسيطة للتحكم حيث قمنا بمراقبة الأنابيب (صعودا وهبوطا) عن طريق تشتيت جزيء صبغ في برنامج تلفزيوني ومتوسط في ظل الظروف التي تمت دراستها هنا. بالإضافة إلى ذلك ، إذا كان العمل مع بيئات أكثر تعقيدا مثل مخازن الرقم الحموضة ، نقترح قياس درجة الحموضة في ثقافة الخلية قبل وأثناء الحضانة في شاكر حيث تميل ثقافة الخلية إلى أن تكون قلوية جدا (درجة الحموضة ≈ 8) بمرور الوقت. هذا يمكن أن يعطي فكرة عن الجودة وكذلك نطاق pH من المخزن المؤقت المستخدم. بالإضافة إلى ذلك ، من أجل الحصول على وحدات الكربون الكلورية فلورية يمكن عدها على لوحات أجار من المقايسات عالية الإنتاجية ، يجب تحسين بعض الشروط ، مثل معدل تلقيح الخلايا ، وعمر الثقافات ، ومعلمات التخفيف التسلسلي (حجم PBS ، ومعدلات التخفيف وعدد خطوات التخفيف ، وما إلى ذلك) قبل اختبار microarrays. وأخيرا، ينبغي مواصلة التحقق من صحة النتائج التي تم الحصول عليها من الميكروبات في القوارير لأن حجم الثقافة والمساحة السطحية والتأيير في صفيحة بئر 96 يمكن أن يكون له آثار إضافية على النتائج الملاحظة.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نود أن نشكر أعضاء مختبر أورمان على مساهماتهم القيمة خلال هذه الدراسة. تم تمويل هذه الدراسة من قبل المعاهد القومية للصحة / NIAID K22AI125468 جائزة الانتقال الوظيفي ومنحة بدء التشغيل في جامعة هيوستن.
Materials
| Name | Company | Catalog Number | Comments |
| 14-ml test tube | Fisher Scientific | 14-959-1B | |
| E. coli strain MG1655 | Princeton University | Obtained from Brynildsen lab | |
| Flat-bottom 96-well plate | USA Scientific | 5665-5161 | |
| Gas permeable sealing membrane | VWR | 102097-058 | Sterilized by gamma irradiation and free of cytotoxins |
| Half-area flat-bottom 96-well plate | VWR | 82050-062 | |
| LB agar | Fisher Scientific | BP1425-2 | Molecular genetics grade |
| Ofloxacin salt | VWR | 103466-232 | HPLC ≥97.5 |
| Phenotype microarray (PM-9 and PM-10) | Biolog | N/A | PM-9 and PM-10 plates contained various osmolytes and buffers respectively |
| Round-bottom 96-well plate | USA Scientific | 5665-0161 | |
| Sodium chloride | Fisher Scientific | S271-500 | Certified ACS grade |
| Sodium nitrate | Fisher Scientific | AC424345000 | ACS reagent grade |
| Sodium nitrite | Fisher Scientific | AAA186680B | 98% purity |
| Square petri dish | Fisher Scientific | FB0875711A | |
| Tryptone | Fisher Scientific | BP1421-500 | Molecular genetics grade |
| Varioskan lux multi mode microplate reader | Thermo Fisher Scientific | VLBL00D0 | Used for optical density measurement at 600 nm |
| Yeast extract | Fisher Scientific | BP1422-100 | Molecular genetics grade |
References
- Lewis, K. Persister cells, dormancy and infectious disease. Nature Reviews Microbiology. 5 (1), 48-56 (2007).
- Hobby, G. L., Meyer, K., Chaffee, E. Observations on the Mechanism of Action of Penicillin. Experimental Biology and Medicine. 50 (2), 281-285 (1942).
- Bigger, J. Treatment of staphylococcal infections with penicillin by intermittent sterilisation. The Lancet. 244 (6320), 497-500 (1944).
- Balaban, N. Q., Merrin, J., Chait, R., Kowalik, L., Leibler, S. Bacterial persistence as a phenotypic switch. Science. 305 (5690), 1622-1625 (2004).
- Keren, I., Kaldalu, N., Spoering, A., Wang, Y., Lewis, K. Persister cells and tolerance to antimicrobials. FEMS Microbiology Letters. 230 (1), 13-18 (2004).
- Keren, I., Minami, S., Rubin, E., Lewis, K. Characterization and transcriptome analysis of mycobacterium tuberculosis persisters. mBio. 2 (3), (2011).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa Strains Producing High Levels of Persister Cells in Patients with Cystic Fibrosis. Journal of Bacteriology. 192 (23), 6191-6199 (2010).
- LaFleur, M. D., Kumamoto, C. A., Lewis, K. Candida albicans biofilms produce antifungal-tolerant persister cells. Antimicrobial Agents and Chemotherapy. 50 (11), 3839-3846 (2006).
- Allison, K. R., Brynildsen, M. P., Collins, J. J. Metabolite-enabled eradication of bacterial persisters by aminoglycosides. Nature. 473 (7346), 216-220 (2011).
- Lechner, S., Lewis, K., Bertram, R. Staphylococcus aureus persisters tolerant to bactericidal antibiotics. Journal of Molecular Microbiology and Biotechnology. 22 (4), 235-244 (2012).
- Barrett, T. C., Mok, W. W. K., Murawski, A. M., Brynildsen, M. P. Enhanced antibiotic resistance development from fluoroquinolone persisters after a single exposure to antibiotic. Nature Communications. 10 (1), 1177 (2019).
- Windels, E. M., et al. Bacterial persistence promotes the evolution of antibiotic resistance by increasing survival and mutation rates. ISME Journal. 13 (5), 1239-1251 (2019).
- Dörr, T., Lewis, K., Vulić, M. SOS response induces persistence to fluoroquinolones in Escherichia coli. PLoS Genetics. 5 (12), 1000760 (2009).
- Völzing, K. G., Brynildsen, M. P. Stationary-phase persisters to ofloxacin sustain DNA damage and require repair systems only during recovery. mBio. 6 (5), (2015).
- Grant, S. S., Kaufmann, B. B., Chand, N. S., Haseley, N., Hung, D. T. Eradication of bacterial persisters with antibiotic-generated hydroxyl radicals. Proceedings of the National Academy of Sciences. 109 (30), 12147-12152 (2012).
- Gerdes, K., Maisonneuve, E. Bacterial Persistence and Toxin-Antitoxin Loci. Annual Review of Microbiology. 66 (1), 103-123 (2012).
- Orman, M. A., Brynildsen, M. P. Inhibition of stationary phase respiration impairs persister formation in E. coli. Nature Communications. 6 (1), 7983 (2015).
- Korch, S. B., Henderson, T. A., Hill, T. M. Characterization of the hipA7 allele of Escherichia coli and evidence that high persistence is governed by (p)ppGpp synthesis. Molecular Microbiology. 50 (4), 1199-1213 (2003).
- Karki, P., Mohiuddin, S. G., Kavousi, P., Orman, M. A. Investigating the effects of osmolytes and environmental ph on bacterial persisters. Antimicrobial Agents and Chemotherapy. 64 (5), 02393 (2020).
- Mohiuddin, S. G., Hoang, T., Saba, A., Karki, P., Orman, M. A. Identifying Metabolic Inhibitors to Reduce Bacterial Persistence. Frontiers in Microbiology. 11, 472 (2020).
- Brooun, A., Liu, S., Lewis, K. A dose-response study of antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrobial Agents and Chemotherapy. 44 (3), 640-646 (2000).
- Luidalepp, H., Jõers, A., Kaldalu, N., Tenson, T. Age of inoculum strongly influences persister frequency and can mask effects of mutations implicated in altered persistence. Journal of Bacteriology. 193 (14), 3598-3605 (2011).
- Baba, T., et al. Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: The Keio collection. Molecular Systems Biology. 2, 0008 (2006).
- Zaslaver, A., et al. A comprehensive library of fluorescent transcriptional reporters for Escherichia coli. Nature Methods. 3 (8), 623-628 (2006).
- Hajmeer, M., Ceylan, E., Marsden, J. L., Fung, D. Y. C. Impact of sodium chloride on Escherichia coli O157:H7 and Staphylococcus aureus analysed using transmission electron microscopy. Food Microbiology. 23 (5), 446-452 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved