Method Article
Yaşlanma Sırasında Caenorhabditis elegans'ta Çözünmeyen Protein Agregasyonunun Yeni Bir Veriden Bağımsız Edinim İş Akışı ile Miktar Tayini
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu yeni iş akışı, kantitatif diferansiyel proteomik analiz için minimum başlangıç materyali ile Caenorhabditis elegans'tan SDS'de çözünmeyen proteinleri (çözünmez) verimli bir şekilde çıkarır ve izole eder. Protokol, yaşlanma mekanizmaları ve patolojileri hakkında biyolojik içgörüler elde etmek için çözünmez ve biyoinformatik analizi ölçmek için kapsamlı bir veriden bağımsız edinim kütle spektrometresi analizi kullanır.
Özet
Biz ve diğerleri, yaşlanma sürecinin proteom çapında çözünmeyen protein birikimi ile sonuçlandığını gösterdik. Çözünmeyen proteinleri kodlayan genlerin zamanın% 40'ından fazlasının parçalanması, C. elegans'ta yaşam süresinin uzamasına neden olur ve bu proteinlerin çoğunun yaşlanma sürecinin temel belirleyicileri olduğunu düşündürür. Bu çözünmeyen proteinlerin izolasyonu ve kantitatif olarak tanımlanması, yaşlanma sırasında meydana gelen temel biyolojik süreçleri anlamak için çok önemlidir. Burada, yeni bir etiketsiz kantitatif proteomik analiz yoluyla kütle spektrometrik iş akışlarını kolaylaştırmak için SDS'de çözünmeyen proteinlerin (çözünmez) C. elegans'tan daha verimli bir şekilde nasıl çıkarılacağını ve izole edileceğini ayrıntılarıyla anlatan değiştirilmiş ve geliştirilmiş bir protokol sunuyoruz. Bu geliştirilmiş protokol, protein ekstraksiyonu için verimliliği büyük ölçüde artıran ve önceki protokollere göre (tipik olarak en az 40.000 solucan kullanarak) önemli ölçüde daha az başlangıç materyali (yaklaşık 3.000 solucan) kullanmamıza izin veren solucan lizisi için yüksek verimli bir sonikatör kullanır. Çözünmezin müteakip kantitatif proteomik analizi, protein keşfi ve tanımlanması için veriye bağlı edinim (DDA) ve kapsamlı ve daha doğru protein kantitasyonu için veriden bağımsız edinim (DIA) kullanılarak gerçekleştirildi. Kantitatif proteinlerin biyoinformatik analizi, C. elegans'ta diğer moleküler yöntemlerle kolayca takip edilebilecek potansiyel adaylar sağlar. Bu iş akışı ile rutin olarak 1000'den fazla proteini tanımlıyor ve 500'den fazla proteini ölçüyoruz. Bu yeni protokol, C. elegans ile verimli bileşik taramayı mümkün kılar. Burada, bu geliştirilmiş protokolü yabani tip C. elegans N2-Bristol suşuna doğruladık ve uyguladık ve yaşlı 10. gün N2 solucanlarının, 2. gün genç solucanlara göre daha fazla çözünmez birikimi gösterdiğini doğruladık.
Giriş
Protein homeostazı yaşlanma ile giderek azalır ve protein agregasyonunun artmasına neden olur 1,2,3. Protein agregasyonu, Alzheimer hastalığı, Parkinson hastalığı, Huntington hastalığı ve amyotrofik lateral skleroz4 dahil olmak üzere çeşitli nörodejeneratif hastalıklarla ilişkilidir. Yaşlanma, protein agregasyonu ile ilişkili nörodejeneratif bozuklukların başlangıcı için temel bir risk faktörü olarak kabul edilir. Çözünmeyen agregalar oluşturmaya eğilimli proteinler genellikle hücresel toksisite ve doku disfonksiyonu ile bağlantılıdır, bu da diğer proteinlerintoplanmasını daha da hızlandırabilir 5,6,7. Alternatif olarak, çözünmeyen protein agregatları, proteinin toksik oligomerik formlarını sistemden uzaklaştırmak için hücresel savunma mekanizmalarını aktive edebilir. Çözünmeyen proteinleri kodlayan seçilmiş genlerin parçalanması, hem yaşa bağlı hastalık hem de normal yaşlanma bağlamında Caenorhabditis elegans'ın (C. elegans) ömrünü modüle eder 5,8,9. Bu nedenle, protein agregasyonunun hücresel ve moleküler mekanizmalarını incelemek, yaşlanmayı anlamak için çok önemlidir ve sonuçta nörodejeneratif hastalıkların tedavisi için yaklaşımlara yol açabilir.
Nematod C. elegans , göreceli kısa bir yaşam süresi (yaklaşık 2 hafta), yetiştirme kolaylığı ve genetik manipülasyon gibi benzersiz özellikleri nedeniyle yaşlanma ve yaşa bağlı hastalıklarda protein agregasyonunu incelemek için en yaygın kullanılan model organizmalardan biri haline gelmiştir.
Çözünmeyen proteinleri ekstrakte etme ve karakterize etme yeteneği, C. elegans modellerinde protein agregasyonu ile ilişkili yaşa bağlı değişikliklerin belirlenmesinde kritik bir rol oynamıştır. Protein agregasyonunun normal yaşlanma süreçlerine katkısını araştırmak için, biz5 ve diğerleri2, daha önce genç ve yaşlı C. elegans'ın çözünmezliğini ekstrakte ettik ve proteolitik olarak sindirdik, iTRAQ reaktifleri kullanılarak kimyasal olarak etiketlendi ('bağıl ve mutlak miktar tayini için izobarik etiketleme') ve daha sonra MS tabanlı yöntemler kullanılarak nicelleştirildi. İzobarik bir etiketleme yöntemi ve 120 mg ıslak solucan (yaklaşık 40.000 solucan) kullanarak, önemli miktarda protein çözünmez derinliği ve kapsama alanı elde edebildik5. Kantitatif analiz, tanımlanan 1200 proteinden 203'ünün, genç solucanlardan elde edilen benzer çözünmez fraksiyonlarına kıyasla yaşlı C. elegans'ın çözünmezliğinde önemli ölçüde zenginleştirildiğini göstermiştir5. Bağımsız olarak, David ve ark. normal yaşlanma ile protein agregatlarındaki değişiklikleri incelemek için bir iTRAQ LC-MS/MS iş akışı da kullandı2. Yaklaşık 300 mg solucanla başlayarak, iki biyolojik kopya kullanarak ~ 1000 çözünmeyen protein tanımladılar ve yaklaşık 1000 proteinden ~ 700'ünün genç solucanlara kıyasla yaşla birlikte 1.5 kat veya daha fazla biriktiğini belirlediler2. Genel olarak, bu bağımsız sonuçlar, yaygın protein çözünmezliği ve agregasyonunun normal yaşlanmanın doğal bir parçası olduğunu ve hem yaşam süresini hem de nörodejeneratif hastalık insidansını etkileyebileceğini göstermektedir 2,5.
Çözünmezi incelemek, çevresel etkilerin yaşlanma sürecini nasıl hızlandırabileceğini veya yavaşlatabileceğini belirlememize izin vermişti. Klang ve ark. metallostazın uzun ömürlülükteki rolünü araştırmak için C. elegans'ta etiketsiz proteomik iş akışları oluşturdu10. Bu çalışmada, insolublom 10'u çıkarmak için en az40.000 solucan kullanıldı. Veriler, demir, bakır, kalsiyum ve manganez seviyelerinin yaşlanmayla birlikte arttığını ve solucanların yüksek demir içeren bir diyetle beslenmesinin, çözünmeyen proteinlerin yaşa bağlı birikimini önemli ölçüde hızlandırdığını göstermiştir10. D vitamininin C. elegans'ın çözünmezliği üzerindeki etkilerini incelemek için aynı iş akışı kullanılarak, genç solucanlarda 38 protein (2. gün) ve yaşlı solucanlarda (8. gün) 721 protein ölçüldü. D vitamini beslemesi, yaşlı solucanların çözünmezliğini 721'den 371 proteine önemli ölçüde azalttı11. Daha fazla araştırma, D vitamini ile beslenmenin yaşla birlikte protein çözünmezliğini baskıladığını, protein homeostazını desteklediğini ve C.elegans N2 yabani tip solucanlarda yaşam süresini uzattığını ortaya koydu11. Bu nedenle, insolublomu incelemek, yaşlanma ve yaşa bağlı hastalıkların yeni modülatörlerini tanımlamaya yardımcı olabilir.
Çözünücü maddenin incelenmesi, yaşlanma sürecinin anlaşılmasında paha biçilmez olsa da, büyük miktarlarda başlangıç numunesi materyali toplama gereksinimi nedeniyle engellenmiştir. Groh ve ark. yakın zamanda yaşlanma ile birlikte C. elegans'taki doğal protein agregasyon değişikliklerini incelemek için etiketsiz bir proteomik miktar tayini iş akışı tanıttı; Bununla birlikte, büyük miktarlarda başlangıç materyali (350 mg yer solucanı) gerektiriyordu12. Bu raporda, geliştirilmiş yeni bir ekstraksiyon ve izolasyon protokolü oluşturduk (Şekil 1). Solucan lizisi sırasında yüksek verimli sonikatörün kullanılması, ekstraksiyon verimliliğini önemli ölçüde artırdı ve daha sonra ihtiyaç duyulan başlangıç materyali miktarını 40.000'den 3.000 solucana düşürdü. Bu yeni insolublome izolasyon protokolünü, etiketsiz, veriden bağımsız edinim (DIA) kütle spektrometrik iş akışıyla birleştirmek, protein derinliğini ve kapsamını önemli ölçüde iyileştirdi. Burada sunulan protokol uygun maliyetlidir ve diğer model sistemlerde çözünmez analizlerinin performansına izin vermek için kolayca değiştirilebilir.
Protokol
NOT: Deneysel prosedürün daha iyi anlaşılması için, iş akışının şeması için Şekil 1'e bakın.
1. Senkronize yaşlanma C. elegans'ın kitle kültürü
- Plaka hazırlama
- Her 90 mm'lik plakaya 50 mM florodeoksiüridin (FUdR) içeren veya içermeyen 30 mL NGM agar dökün ve plakaları kültür başlıklarında 2 gün kurumaya bırakın.
- NGM agar plakasının tohumlanmasından bir gün önce, OP50 bakteri suşunun 50 μL'lik donmuş gliserol stoğunu 2 L'lik bir şişede 1 L önceden otoklavlanmış LB ortamına aşılayın.
- Bakterileri 37 °C'de 250 rpm'de 16 saat boyunca çalkalanan bir inkübatörde büyütün.
- 16 saat sonra, bakteri kültürlerini 10 dakika boyunca 5.000 x g hızında santrifüjleyin.
- Süpernatanı atın ve 25x konsantreOP50E. coli kültürünü oluşturmak için bakteri peletini 40 mL otoklavlanmış S-bazal solüsyonunda (50 mM K 3 PO4, suda 100 mM NaCl içeren) tamamen yeniden süspanse edin.
- Her bir NGM agar plakasına 25x konsantre bakteri kültüründen 2 mL dağıtın ve bakteri kültürü tüm agar yüzeyini kaplayacak şekilde eşit şekilde yayın.
- Plakalar düzgün bir şekilde kuruyana kadar 2-3 saat boyunca bir bakteri kültürü davlumbazındaki plakalardan kapakları çıkarın.
NOT: Plakaları her 15 dakikada bir döndürerek bakterileri eşit şekilde dağıttığınızdan emin olun. Bu önemlidir, çünkü bakteriler plakanın bir tarafında yoğunlaşma eğilimindedir ve bu da düşük bakteri yoğunluğuna sahip bölgelere neden olur. - Plakalar kuruduktan sonra, kapakları kapatın ve OP50 E. coli besin kaynağının tamamen kurumasını sağlamak için plakaları 48 saat oda sıcaklığında bırakın.
NOT: Plakalar 2 hafta önceden hazırlanabilir ve kullanmadan önce 4 °C'de saklanabilir.
- C. elegans'ın senkronize kohortlarının bakımı ve hazırlanması
- SDS'de çözünmeyen fraksiyonun izolasyonu için gerekli protein lizat (1.0-1.5 mg) girişini elde etmek için, numune başına yaklaşık 3.000 senkronize solucan kullanın.
- ~ 100 N2 yabani tip gravid yetişkin solucanlarını bir NGM 25x OP50 E. coli tohumlu plakaya aktarın ve solucanları 20 ° C'de ~ 72 saat boyunca plaka gravid yetişkin solucanlarla dolana kadar tutun.
- Her plakaya ~ 10 mL S-bazal solüsyon pipetleyin ve tüm solucanları 15 mL'lik bir tüpe toplayın.
NOT: Uç yüzeylerine yapışma nedeniyle herhangi bir solucan kaybını önlemek için bu ve solucan toplamayı içeren sonraki tüm adımlar sırasında düşük tutma noktalı uçlar veya Pasteur pipetleri kullanmak önemlidir. - Numuneyi 30 saniye boyunca 520 x g'da döndürün. Döndürdükten sonra süpernatanı çıkarın. Herhangi bir OP50 E. coli'yi ortadan kaldırmak için, pelete 10 mL S-bazal solüsyon ekleyin ve tekrar döndürün, ardından süpernatantın çıkarılması devam eder. Bu adımı tekrarlayın.
- 15 mL'lik konik bir tüpte solucan peletine 10 mL sodyum hipoklorit ağartma çözeltisi (suda 0.5 M KOH ve %0.48 sodyum hipoklorit içeren) ekleyin ve oda sıcaklığında 2 dakika kuvvetlice girdap yapın.
- Tam olarak çözünmemiş solucan gövdelerini ve yumurtaları döndürmek için oda sıcaklığında 30 saniye boyunca 520 x g'da santrifüjleyin. Ardından süpernatanı çıkarın.
- Tüm solucan gövdelerinin tamamen çıkarılmasını ve yumurtaların serbest bırakılmasını sağlamak için 1.2.5 ve 1.2.6 adımlarını tekrarlayın (emin olmak için tüpü mikroskop altında görüntüleyin).
- Çamaşır suyu çözeltisinin tamamen çıkarılmasını sağlamak için yumurta peletini en az 4 kez 10 mL S-bazal solüsyonu ile yıkayın.
NOT: Çamaşır suyunun tamamen çıkarılması önemlidir, çünkü kalan ağartıcı yumurtaların çatlamasını engelleyebilir. - Yumurtaları 15 mL'lik bir tüpte 5 mL S-bazal ortamda yeniden süspanse edilmiş halde bırakın ve yumurtaların çatlamasını sağlamak için 24 saat boyunca 20 ° C'de rotora yerleştirin.
- 24 saat sonra, içindeki solucan sayısını saymak için 10 μL S-bazal larva çözeltisi alın. Solucan sayısının çoğaltılması için 10 μL S-bazal larva çözeltisinin en az üç ayrı alikotunu kullanın. Üç larva konsantrasyonunun ortalamasını hesaplayın. Ortalama konsantrasyona bağlı olarak, 200 μL çözelti başına ~ 3.000 larva elde etmek için solucan çözeltisini seyreltin.
NOT: Larvalar rahatsız edilmeden bırakılırsa yerleşme eğiliminde olduğundan ve bu larva sayısını etkileyebileceğinden, tüpü ters çevirerek hafifçe salladığınızdan emin olun. - İyice karıştırın ve 90 mm'lik NGM bakteri tohumlu plakaların her birine 200 μL S-bazal larva çözeltisi ekleyin.
NOT: Belirli noktalardan bakteri tükenmesini önlemek için larvaların eşit dağılımı için plaka boyunca damla S-bazal larva çözeltisi ekleyin. - S-bazal solüsyonun kurumasını bekleyin ve ardından plakaları 48 saat boyunca 20 ° C'lik bir inkübatöre ters çevrilmiş olarak yerleştirin.
- 48 saat sonra, solucanları plakadan S-bazal solüsyonda toplayın ve bunları 50 mM FUDR içeren taze NGM tohumlu bir plakaya aktarın ve plakaları 20 ° C'de inkübe edin.
NOT: FUDR verimliliğini sağlamak için solucanları L4 aşamasının erken aşamalarında transfer etmek önemlidir. - Plakaya 10 mL S-bazal solüsyonu ekleyerek ve solüsyonu 15 mL'lik bir tüpe aktararak 48 saat sonra 2. gün genç yetişkin örneklerini toplayın. Solucanların yerçekimi ile yerleşmesine izin verin ve berraklaştıktan sonra S-bazal çözeltisini çıkarın.
- Bağlı bakterileri uzaklaştırmak için solucan peletini 2-3x 5 mL S-bazal solüsyonunda yıkayın. Mümkün olduğu kadar çok S-bazal çözeltisini çıkarın ve solucan peletini (15 mL'lik tüplerde) kuru bir buz/etanol banyosunda dondurun. Dondurulmuş numuneler -80 °C'de saklanır.
- Numune solucanlarını 10. güne kadar her alternatif günde bir FUDR içeren taze bir NGM OP50 E. coli plakasına aktarın. Solucanları adım 1.2.14 ve 1.2.15'te açıklandığı gibi toplayın ve dondurun.
NOT: Transfer ve oyuk açma nedeniyle solucan sayısındaki herhangi bir kaybı hesaba katmak için 10 günlük numuneler için daha fazla sayıda solucanla başlayın.
2. Solucanlardan SDS'de çözünmeyen fraksiyonun ekstraksiyonu
- 20 mM Tris bazı, pH 7.4, 100 mM NaCl, 1 mM MgCl2 ve EDTA içermeyen proteaz inhibitörü içeren 900 μL buz gibi solucan lizis tampon kokteyli varlığında donmuş solucan peletini buz üzerinde çözdürün. Lizis tamponunda solucan peletinin tamamen yeniden süspansiyonunu sağlamak için numuneleri kısaca vorteksleyin.
- 15 mL tüpleri sonikasyon banyosuna yerleştirin ve yüksek yoğunlukta 10 sonikasyon döngüsü (her döngü için 30 s açık ve 30 s kapalı) için ayarlayın. Beş döngüye kadar tekrarlayın (solucanların tamamen parçalandığından emin olun).
- Lizatı soğuk odada 4 dakika boyunca 3.000 x g'da döndürün. Santrifüjlemeden sonra, herhangi bir solucan kalıntısı içeren peleti atın ve süpernatanı buz üzerinde önceden soğutulmuş taze 1.5 mL santrifüj tüplerine dikkatlice aktarın.
- BCA testini kullanarak protein konsantrasyonunu ölçün. Tipik olarak yaklaşık 1 mg protein içeren lizat alikotlarını önceden soğutulmuş taze 1.5 mL santrifüj tüplerine aktarın.
- Protein lizatını soğuk odada 20.000 x g'da 15 dakika santrifüjleyin.
- Peleti bozmadan, süpernatanı 1.5 mL'lik taze bir santrifüj tüpüne aktarın ve suda çözünür protein fraksiyonu olarak saklayın.
- Önceki adımdaki peleti oda sıcaklığında %1 SDS içeren 500 μL solucan lizis tamponunda yıkayın ve oda sıcaklığında 15 dakika boyunca 20.000 x g'da santrifüjleyin. Süpernatanı çıkarın ve SDS'de çözünür fraksiyon olarak kaydedin. SDS'de çözünür fraksiyonu çıkarmak için bu yıkama adımını iki kez tekrarlayın. Üçüncü yıkama turundan sonra kalan pelet, %1 SDS'de çözünmeyen protein fraksiyonu olarak tanımlanır.
- SDS'de çözünmeyen protein peletini 60 μL %70 formik asit içinde yeniden süspanse edin ve proteinleri çözmek için kuvvetlice girdaplayın. Peleti çözmek için kuvvetli girdaplamayı gerektiği kadar tekrarlayın.
- Peletleri oda sıcaklığında bir ultrasonicator su banyosunda 30 dakika boyunca sonikate.
NOT: SDS'de çözünmeyen peletin tamponda çözülmesi tipik olarak zordur. Bununla birlikte, sonunda tüm pelet bu adımda çözülmelidir. - Formik asit çözeltisini tamamen çıkarmak için numuneleri bir vakum yoğunlaştırıcıda 1 saat kurutun.
- Kurutulmuş pelete 40 μL 1x LDS numune jeli tamponu ekleyin ve numuneyi 10 dakika boyunca 95 °C'ye ısıtın. Numuneleri kısaca girdaplayın ve aşağı doğru döndürün. %4-12 NUPAGE Bis-Tris jel üzerine 13 μL yükleyin ve jeli çalıştırın. Görüntüleme için jeli bir floresan protein boyası ile boyayın. Numunenin geri kalanını kütle spektrometresi (MS) analizi için saklayın.
- Kalan numuneyi %4-12'lik bir Bis-Tris jele yükleyin ve MS jel içi sindirim için yaklaşık 20 dakika çalıştırın.
3. MS analizi için proteinleri izole etmek için tripsin proteaz ile jel içi sindirim
- Aşağıdaki çözeltileri hazırlayın (taze): %50 asetonitrilde (ACN, pH 7-8) 25 mMNH4HCO3 (pH 7-8) ve %50 formik asitte %50 ACN.
- Her bir jel dilimini küçük parçalar halinde (tipik olarak <1 mm2) doğrayın ve bunları 0.65 mL silikonlu tüplere yerleştirin.
- Yaklaşık 100 μL (veya kaplayacak kadar) 25 mM NH4HCO3/50% ACN çözeltisi ekleyin ve oda sıcaklığında 10 dakika vorteksleyin. Süpernatanı çıkarın ve ayrı bir tüpe aktarın (atılmak üzere). Bu adımı iki kez daha tekrarlayın.
- Jel parçalarını bir vakum yoğunlaştırıcıda (~ 20 dakika) tamamen kurutun.
- Taze çözeltiler hazırlayın ve kurutulmuş jel parçalarına 25 mM NH4HCO3'te ~ 100 μL (veya kaplayacak kadar) 10 mM DTT ekleyin (taze hazırlanmış NH4HCO3 kullanın). Girdap ve kısaca döndürün. Reaksiyonun 56 °C'de 1 saat ve bir mikser üzerinde 1400 rpm'de çalkalayarak ilerlemesine izin verin.
- Süpernatanı çıkarın ve jel parçalarına 25 mM NH4HCO3'te 100 μL 55 mM iyodoasetamid (IAA) ekleyin. Girdap ve kısaca döndürün. RT'de reaksiyonun karanlıkta 45 dakika ilerlemesine izin verin.
- Süpernatanı çıkarın ve atın. Jel parçalarını ~ 100 μL 25mM NH4HCO3 ekleyerek ve 10 dakika vorteksleyerek yıkayın. Süpernatanı kısaca döndürün ve çıkarın, ikincisini atın.
- Jel parçalarına ~ 100 μL (veya kaplayacak kadar) 25 mM NH4HCO3'ün % 50 ACN ekleyerek jel parçalarını kurutun ve 10 dakika boyunca vorteksleyin. Ardından, süpernatanı çıkarmak ve atmak için kısaca döndürün. Jel parçalarının daha küçük boyutu ve bulanık beyaz renk ile gösterildiği gibi jel parçaları oldukça kuru değilse, bu adımı iki kez veya hatta üçüncü kez tekrarlayın.
- Jel parçalarını bir vakum yoğunlaştırıcıda (~ 20 dakika) tamamen kurutun.
- Başlangıçta her numuneye 15 μL tripsin çözeltisi (250 ng tripsin) ekleyin ve ardından jel parçalarını (~ 100 μL) kaplamak için yeterli miktarda 25 mMNH4HCO3 ekleyin. 10 dakika boyunca girdap. Daha sonra kısa bir süre döndürün ve soğuk odada 4 °C'de karıştırmadan 30 dakika inkübe edin.
- Jel parçalarını tamamen kaplamak için gerektiği kadar 25 mM NH4HCO3 ekleyin. Bir mikser üzerinde 1400 rpm'de 16-20 saat boyunca gece boyunca 37 °C'de sıkın ve inkübe edin.
- Ertesi gün, kısa bir süre girdap yapın ve sindirimi döndürün. Yaklaşık 100 μL HPLC dereceli su ekleyin, döndürün, tüpü parafilm yapın ve 10 dakika boyunca sürekli olarak sonikasyon yapın. Sonikasyondan sonra kısa bir süre döndürün.
- Sulu ekstraksiyonu temsil eden sindirim solüsyonunu temiz bir 0.65 mL silikonlu tüpe aktarın.
- Jel parçalarına ~ 100 μL %50 ACN /% 5 formik asit ekleyin (üzerlerini kaplayacak kadar), oda sıcaklığında 10 dakika girdaplayın, kısaca döndürün ve çözeltiyi toplayın ve bir kez tekrarlayın. Bu adımdan ve önceki adım 3.13'ten ekstrakte edilen peptitleri içeren tüm çözeltileri tek bir tüpte bir araya getirin.
- Çıkarılan sindirimi girdaplayın. Peptitleri bir vakum yoğunlaştırıcıda (~ 2 saat) tamamen kurutun.
- Peptitleri soğuk odada bir karıştırıcıda 10 dakika boyunca yeniden süspanse etmek için 30 μL% 0.2 formik asit ekleyin.
- Numuneleri oda sıcaklığında 1850 x g'da 5 dakika döndürün. Peptit çözeltisini aspire edin ve yeni, temiz, 0.65 mL silikonlu bir tüpe koyun. Daha sonra C18 tuz giderme uçlarını kullanarak peptit çözeltisini tuzdan arındırın (aşağıya bakın).
4. Sindirilmiş peptitlerin C18 tuzdan arındırma ucu ile tuzdan arındırılması
- Pipeti 10 μL'ye ayarlayın ve C18 tuz giderme ucunu takın. 10 μL %100 ACN'ye kadar pipetleyerek ve ardından atarak tuz giderme ucunu ıslatın. Bu adımı 2 kez tekrarlayın.
- C18 tuz giderme ucunu 10 μL %50 ACN, %49.8 su ve %0.2 FA pipetleyerek ve ardından atarak yıkayın. Bu adımı 2 kez tekrarlayın.
- C18 tuz giderme ucunu, 10 μL %0,2 FA'ya kadar su pipetleyerek ve ardından atarak dengeleyin. Bu adımı 2 kez tekrarlayın.
- Pipeti 10 μL'ye ayarlayın ve sindirilmiş peptitleri reçine boyunca 15 kat yukarı ve aşağı pipetleyerek peptitleri çözeltiden reçineye yükleyin.
NOT: Tekrarlanan işlem, tüm peptitlerin tuz giderme uçlarının reçinesine bağlanmasını sağlayacaktır. - Reçineye bağlı sindirilmiş peptitleri, suya 10 μL% 0.2 FA pipetleyerek ve ardından atarak tuzdan arındırın. Tuzdan arındırma adımını tamamlamak için bu adımı 4 kez tekrarlayın.
- Yeni bir tüpte, peptitleri 10 μL %50 ACN, %49.8 su ve %0.2 FA ile 10 kez yukarı ve aşağı pipetleyerek elüte edin. Protein sindirimini aynı tüpte ikinci kez serbest bırakmak için bu adımı bir kez tekrarlayın.
- Tuzdan arındırılmış peptitleri bir vakum yoğunlaştırıcıda (~ 20 dakika) tamamen kurutun.
- Peptitleri 15 μL% 0.2 FA + 1 μL iRT (indekslenmiş Tutma Süresi) peptitlerinde yeniden süspanse edin. 10 dakika boyunca Voxtex, 2 dakika boyunca 12.000 x g'da santrifüjleyin ve ardından MS analizi için bir otomatik numune alma cihazı şişesine aktarın (aşağıya bakın).
5. DDA ve DIA kullanılarak sindirilmiş peptitlerin kütle spektrometresi analizi
NOT: Numuneler, DDA veya DIA LC-MS/MS yöntemleri kullanılarak analiz edilebilir. Bu çalışmada numuneler, yüksek çözünürlüklü bir kütle spektrometresine bağlı bir nano-LC 2D HPLC sistemi kullanılarak analiz edilmiştir.
- Dört kutuplu bir uçuş süresi kütle spektrometresine doğrudan bağlı çip tabanlı bir HPLC sistemi ile birleştirilmiş bir HPLC sistemi kullanın (diğer LC-MS konfigürasyonları ve sistemleri de kullanılabilir).
- Ters fazlı HPLC-ESI-MS/MS kullanarak numuneleri analiz edin.
- Peptit örneğini bir C18 ön kolon çipine yüklemek için kromatografi protokolünü oluşturun. Yüklenen peptitleri yükleme çözücüsü (% 0.1 formik asit) ile 2 μL / dak akış hızında 10 dakika boyunca yıkayın ve tuzdan arındırın.
- Peptitleri bir analitik kolon C18 çipine aktarın ve mobil faz A (% 2 asetonitril,% 0.1 formik asit) ve B (% 98 asetonitril,% 0.1 formik asit) kullanarak 3 saatlik bir gradyan ile 300 nL / dak akış hızında elüte edin. İlk elüsyon adımı, 80 dakikalık bir süre boyunca %5 B'den %35 B'ye kadar doğrusal bir gradyandan oluşur.
- Mobil faz B'yi 5 dakika boyunca %80'e yükseltin ve ardından sütunu 80 dakika boyunca yeniden dengelemek için %5 B'ye geçmeden önce mobil faz B'yi 25 dakika boyunca %25'te tutun.
- DDA için bir MS cihaz yöntemi ayarlayın ve cihaz parametrelerini aşağıdaki gibi tanımlayın.
- Deney 1 için aşağıdaki parametreleri kullanın:m/z 400–1500'den MS1 öncü iyon taraması (250 ms'lik biriktirme süresi); 2-5 ila 200 sayım arasındaki şarj durumlarındaki iyonlar için MS/MS taramalarını tetiklemek için yoğunluk eşiğini ayarlayın; öncü iyonların dinamik dışlanmasını 60 s'ye ayarlayın).
- Deney 2 için aşağıdaki parametreleri kullanın: m/z 100–1500 arasında bir MS2 tarama aralığına sahip MS/MS ürün iyon taramaları (döngü başına 30 ürün iyon taramasının her biri için 100 ms'lik biriktirme süresi); çarpışma enerjisi yayılımını CES=5 olarak ayarlayın ve 'yüksek hassasiyetli ürün iyon tarama modu' seçeneğini işaretleyin.
NOT: DDA edinme yöntemi, adım 6.3'te açıklandığı gibi spektral kitaplıklar oluşturmak için kullanılır (aşağıya bakın). Burada, döngü başına her MS1 taramasından sonra en bol bulunan 30 öncü iyon için MS/MS spektrumları elde edecektir; Toplam çevrim süresi yaklaşık 3,3 saniyedir.
- DIA'yı edinin. DIA için bir MS enstrüman yöntemi kurun ve enstrümantal parametreleri aşağıdaki gibi tanımlayın.
- Deney 1 için aşağıdaki parametreleri kullanın: m/z 400-1250'den MS1 öncü iyon taraması (250 ms'lik biriktirme süresi).
- Deney 2 için aşağıdaki parametreleri kullanın: m/z 100-1500 arasında bir MS2 tarama aralığına sahip 64 değişken SWATH segmenti için MS/MS ürün iyon taramaları (döngü başına 64 ürün iyon taramasının her biri için 45 msn biriktirme süresi); çarpışma enerjisi yayılımını CES=10 olarak ayarlayın, 'yüksek hassasiyetli ürün iyon tarama modu' seçeneğini işaretleyin.
NOT: Yaklaşık 64 s'lik bir toplam döngü süresi ile etiketsiz niceleme gerçekleştirmek için Schilling ve ark.13 tarafından açıklandığı gibi 3.2 değişkenli pencere DIA/SWATH edinme yöntemini kullanın. DDA edinimi için, dar bir kütle aralığının öncü iyonunu çarpışma hücresine iletmek için Q1 dört kutuplu kullanmak yerine, 64 SWATH segmenti, her segment için 45 ms biriktirme süresi ile tam m/z aralığının (m/z 400-1250) artımlı olarak üzerine çıkmak için bir dizi değişken pencere genişliği (örneğin m/z 5-90) kullanılır, 250 ms biriktirme süresine sahip bir MS1 taraması içeren 3,2 sn'lik bir döngü süresiyle sonuçlanır. Değişken pencere genişliği, bir SCIEX 'değişken pencere hesaplayıcı' algoritması13 kullanılarak belirli bir m/z aralığında gözlemlenen tipik MS1 iyon akımının karmaşıklığına göre ayarlanır ('yoğun' m/z aralıklarına daha dar pencereler uygulanır, daha geniş pencereler az sayıda elüsyonlu öncü iyonla m/z aralıklarına uygulanır). Diğer MS platformlarında, alternatif DIA pencere seçim stratejileri de uygulanabilir.
6. Veri analizi
NOT: Belirli veri analizi ayarları, belirli deneysel koşullara göre uyarlanmalıdır. Örneğin, seçilen protein veri tabanı (fasta dosyası), numunenin hazırlandığı türe bağlı olacaktır (bu protokolde C. elegans kullandık).
- DDA edinimlerini analiz etmek ve proteinleri tanımlamak için bir MS veritabanı arama motoru kullanın. Aşağıdaki gibi bir darabase arama motoru yöntemi oluşturun:
- Örnek Açıklama Parametreleri için Tanımlama'yı seçin; Numune Türü altında, İyodoasetik Asit'i seçin; Sistein Alkilasyonu altında, Tripsin'i seçin; Sindirim altında (lizin ve arginin'de C-terminal bölünmesi varsayarak), Cihaz altında kütle spektrometresinin adını seçin; ve Türler altında Caenorhabditis elegans'ı seçin.
- Belirli İşleme parametreleri için Biyolojik modifikasyonları kontrol edin; ID Focus altında SwissProt'u seçin; Veritabanı altında, Kapsamlı Kimlik'i işaretleyin; Arama Çabası altında, Algılanan Protein Eşiği altında 0,05'i (%10) seçin; tıklayın ve Sonuç Kalitesi altında Yanlış Bulma Oranı Analizini Çalıştır'ı işaretleyin. Arama motoru yöntemini kaydedin ve oluşturulan yöntemi kullanarak MS ham dosyalarını işlenmek üzere veritabanı arama motoruna gönderin.
NOT: Yinelemeli bir süreçte, tüm MS ve MS/MS taramaları, ilk ek açıklamalara ve sonuçlara dayalı olarak arama motoru tarafından otomatik olarak yeniden kalibre edildi.
- Aramayı tamamladıktan sonra Peptit Özetini Dışa Aktar'a tıklayın ve tüm peptit tanımlama sonuçlarını Excel'deki 99 güven eşiğine göre filtreleyin (yanlış keşif oranı (FDR) =% 1).
- DIA ham veri dosyasının daha fazla işlenmesi ve daha fazla göreceli veri ölçümü için MS/MS spektral kitaplıkları oluşturun.
- DIA Kantitatif Analiz Yazılımını açın. Kitaplık sekmesini seçin ve ardından (sayfanın alt kısmında) "Veritabanı Arama Motoru"ndan Spektral Kitaplık Oluştur'a tıklayın ve DDA ham veri dosyası veritabanı arama işleminin bir parçası olarak otomatik olarak oluşturulan bir "Veritabanı Arama Motoru" FDR raporunu (*FDR.xlsx elektronik tablo dosyası) açın.
- İleri'ye tıklayın, Kitaplık Ayarları Şeması'nı seçin ve İleri'ye tıklayın. Veritabanı olarak elegans _proteome Uniprot_Caenorhabditis seçin ve ardından Son'a tıklayın, spektral kitaplık oluşturulacaktır.
- Kapsamlı nispi protein miktar tayini için DIA edinimlerini analiz etmek için DIA Kantitatif Analiz Yazılımını kullanın. DIA veri analizi boru hattı aşağıdaki gibi açıklanmaktadır.
- Peptitleri analiz etmek ve nicelleştirmek için, şablon şemasını kullanarak bir analiz şeması ayarlamak üzere DIA Kantitatif Analiz Yazılımı'nı açın. Şablon şeması, yazılımda Ayarlar'a, ardından DIA Analizi'ne ve son olarak BGS Fabrika Ayarları'na tıklanarak kullanılabilir.
- Şablon şemasındaki parametreleri aşağıdaki gibi ayarlayın:
1) tanımlama altında PTM lokalizasyonunu seçin (olasılık kesme = 0.75).
2) niceleme altında, Toplam peptit miktarı olarak Ana Grup Miktarı'nı seçin, Ana Grup N'yi Maks 7 ve Min 1 olarak ayarlayın, Küçük Grup Miktarı'nı Toplam öncü miktar olarak seçin ve Küçük Grup N'yi Maksimum 10 ve Min 1 olarak ayarlayın ve Veri Filtreleme'yi Qvalue seyrek olarak seçin ve Çapraz Çalıştırma Normalleştirme'yi seçmeyin.
- Bağıl niceleme analizi yapın.
- İşlem Hattı sekmesini seçin, Dosyadan bir DIA Analizi Ayarla'ya tıklayın, ilgilendiğiniz MS DIA ham dosyalarını açın (örneğin: örnek ve kontrol), Spektral Kitaplık Ata'ya tıklayın, 6.3'te oluşturulan kitaplığı seçin, Yükle'ye tıklayın ve son olarak İleri'ye tıklayın.
- 6.5.1'de ayarlanan analiz şemasını seçin ve İleri'ye tıklayın. Uygun veritabanı fasta dosyasını seçin (bu protokolde: Uniprot_Caenorhabditis elegans_proteome) ve İleri'ye tıklayın. Koşul kurulumunu tanımlayın ve örneklere göre farklı koşulları atayın ve İleri'ye tıklayın.
- Analize genel bakışı (deney kurulumunun özeti) gözden geçirin, Çıktı Dizini'ne gidin ve Son'a tıklayın. Son olarak, etiketsiz kantitatif analizi gerçekleştirmek için İşlem Hattını Çalıştır'a tıklayın.
NOT: 'DIA Kantitatif Analiz Yazılımı'ndaki istatistiksel modüller otomatik olarak FDR analizi gerçekleştirir, farklı koşulları karşılaştıran ısı haritaları ve volkan grafikleri oluşturur, tanımlanmış ve niceliksel peptitlerin ve proteinlerin listelerini oluşturur ve farklı koşulları karşılaştıran nispi kat değişiklikleri ile birlikte Q değerleri sağlar. Burada örnek koşullar kurulumu, kontrol olarak iki biyolojik kopyaya sahip 10. gün yaşlı solucanları ve kontrol olarak iki biyolojik kopyaya sahip 2. gün genç solucanları içeriyordu.
Sonuçlar
Geleneksel solucan lizis yöntemlerinin çeşitli dezavantajları vardır. Örneğin, prob bazlı sonikasyon ve boncuk çırpıcı yöntemleri, metal ucun veya boncukların doğrudan numunelerle temasına izin vererek aşırı ısı üretir, bu da değişken protein geri kazanımları ve protein denatürizasyonu ile sonuçlanır. Sıvı azot öğütme ve ardından lizis tamponunda sonikasyon, zaman alıcı olabilir ve çok sayıda solucan gerektirir. Geleneksel solucan parçalama yöntemlerinin sınırlamaları nedeniyle, iTRAQ etiketleme yöntemleri veya çözünmez hakkında nicel bilgi elde etmek için C. elegans model sisteminde tarihsel olarak kullanılan etiketsiz yöntemler gibi önceki MS iş akışları, büyük miktarda başlangıç materyali girişi gerektirir (en az 40.000 solucan). Bu sayıda solucanı elde etmek için zahmetli bir solucan kültürü çalışması gereklidir. Ayrıca, etiketleme yöntemleri pahalı izobarik kimyasal etiketler gerektirir. Etiketsiz miktar tayini yöntemleri uygun maliyetlidir ve daha kolay ve daha anlaşılır numune hazırlama ve etiketleme yöntemlerine sahiptir, ancak yeterli MS analiz kapsamı elde etmek için önemli ölçüde çok sayıda solucan gerektirir.
Kullandığımız sonikatör, çapraz kontaminasyon14 olmadan sıcaklık kontrollü bir su banyosu sonikatöründe aynı anda birden fazla solucan örneğini parçalayarak solucan lizizinin verimliliğini ve tekrarlanabilirliğini büyük ölçüde arttırır, böylece gerekli başlangıç solucan materyali miktarını önemli ölçüde azaltır. Yüksek verimli sonikasyon yöntemini ve kantitatif DIA etiketsiz MS yaklaşımını birleştirerek, ~ 3.000 solucan kullanarak yaşlı ve genç solucanların çözünmezliğini sağlam bir şekilde ölçebildik. Burada protokolün etkinliğini test ettik ve doğruladık ve vahşi tip bir solucan türü olan N2-Bristol C. elegans'tan yaşlı ve genç solucanların çözünmezliğini karşılaştırdık. Bu protokolü, ~ 3.000 yaşlı ve genç N2 C. elegans'tan (her koşul için iki biyolojik kopya) çözünmezi çıkarmak ve izole etmek için uyguladık, ardından dört kutuplu bir uçuş süresi kütle spektrometresi veya protein tanımlama ve miktar tayini için veriye bağlı edinim (DDA) ve veriden bağımsız edinimlerin (DIA/SWATH) bir kombinasyonunu kullanan diğer MS sistemleri ile MS analizi yaptık. Çözünmeyen proteinler ilk olarak, her bir çözünmez numunesindeki protein miktarını belirlemek için bir Bis-Tris %4-12 gradyan jeli üzerinde analiz edildi. Şekil 2'de gösterildiği gibi, N2 yaşlı solucanlardan (şerit 2 ve 3, biyolojik çoğaltma deneyleri) alınan çözünmez örneği, N2 genç solucanlarından alınan örneklerden (şerit 1 ve 4, biyolojik çoğaltma deneyleri) önemli ölçüde daha fazla protein içerir.
Jel içi sindirimden sonra, çözünmeyen maddenin protein profilleri HPLC-MS ile analiz edildi. Bu iş akışını kullanarak, genellikle 1000-1500 proteini tanımlayabilir ve yüksek tekrarlanabilirlik ile SDS'de çözünmeyen fraksiyondan 500-1.000 proteini ölçebiliriz (yayınlanmamış veriler). Burada, DIA verilerini analiz ederek ve fazlalığı ortadan kaldırarak N2-Bristol C. elegans'ın çözünmezinden 989 proteini ölçebildik: 768 protein önemli ölçüde zenginleştirildi ve 27 protein, en az 1.5'lik bir kat değişikliği ve 0.01'den daha düşük bir Q değeri kullanılarak genç (2. gün) ile karşılaştırıldığında, yaşlı N2 solucanının (10. gün) çözünmezinde önemli ölçüde azaldı (Şekil 3A). Histogram grafiğinde görüldüğü gibi (Şekil 3B), önemli ölçüde değişmiş proteinlerin kat değişimi normal bir dağılım gösterir. Yaşlı solucanların insolublom için önemli ölçüde zenginleştirildiği gösterildi: Gözlenen en büyük değişiklik, insolublomdaki nispi protein bolluğunun yaşlı solucanlarda genç solucanlara göre 592 kat daha yüksek olduğunu gösterdi; Ve 32 protein için, insolublomdaki nispi protein bolluğu, yaşlı ve genç solucanlarda >250 kat daha yüksekti, bu da yaşla birlikte dramatik insolublom değişikliklerini gösteriyordu.
Yaşlı solucanlarda önemli ölçüde artan ve solucan tabanı (WS271) tarafından tanımlanan çözünmeyen proteinlerin listesi çıkarıldıktan sonra, bunların yaşlanma ile nasıl ilişkili olduğuna dair biyolojik içgörüler elde etmek için yaşlı çözünmez içinde zenginleştirilmiş yolları belirlemek için KEGG yolu ve Gen Ontolojisi (GO) analizi yapıldı. Bu çalışmada tanımlanan proteinlerin KEGG yolu analizi, ribozomlar, mitokondri, proteazom ve splisozom içeren çeşitli yolların zenginleşmesini göstermektedir (Şekil 4A). Gen ontolojisi analizi, yaşlı solucanlardan gelen çözünmezin, mitokondriyal, gelişimsel, yetişkin ömrünün belirleyicileri ve ribozomal proteinler dahil olmak üzere belirli kategorilerde birçok protein içerdiğini göstermektedir (Şekil 4B ve Ek Tablo 1A). Daha sonra, bu çalışmada tanımlanan proteinlerin listesini, Venn diyagramlarında gösterildiği gibi, David ve ark.2 ve Mark ve ark.11'in daha önce yayınlanmış çalışmalarıyla karşılaştırdık (Şekil 5A, 5B). Karşılaştırma, tanımlanan proteinler 394/721 ve 444/721'in sırasıyla David ve arkadaşları (Şekil 5A) ve Mark ve arkadaşları (Şekil 5B) çalışmaları ile anlamlı bir örtüşme olduğunu gösterdi. Bu çalışmadan elde edilen çözünmezin KEGG analizi ile ortaya çıkan biyolojik yollar da geçmişte tanımlanmıştır ve böylece metodolojimiz doğrulanmıştır (Ek Tablo 1B). Bu yolakların ve proteinlerin tanımlanması, yaşlanma bağlamındaki işlevleriyle ilgili olarak daha fazla biyolojik araştırma için aday olarak hizmet edebileceklerini düşündürmektedir.
Özetle, verimli sonikasyon yönteminin kullanılması, önemli ölçüde daha az başlangıç solucan materyali ile yüksek protein kapsamı elde etmek için iyi kontrol edilen sıcaklıklara ve azaltılmış çapraz kontaminasyona sahip bir ortamda aynı anda birden fazla solucan örneğinin parçalanmasını sağlar. Verimli sonikasyon yöntemini DIA etiketsiz bir protein niceleme iş akışı ile birleştirmek, çözünmeyen solucan proteinlerinin nicelleştirilmesi için güvenilir ve tekrarlanabilir sonuçlar sağlamıştır.

Şekil 1. Protokolün deneysel iş akışı. C. elegans farklı günlerde kültürlenmiş ve toplanmıştır. Bir sonikatör ile solucan lizizinden sonra,% 1 SDS'de çözünmeyen protein fraksiyonu (çözünmez) ekstrakte edildi ve lizattan izole edildi. Çözünmez daha sonra jel içi tripsin sindirimi yoluyla sindirildi ve DIA kütle spektrometresi ile ölçüldü, ardından biyoinformatik analiz yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
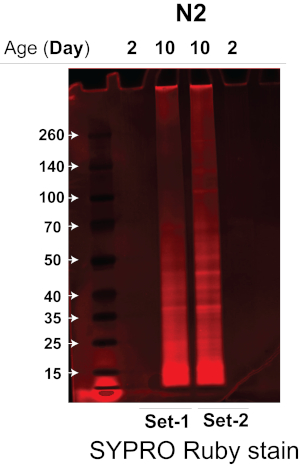
Şekil 2. Çözünmeyen şişmanın SDS-PAGE jeli, N2-Bristol suşunun genç ve yaşlı solucanlarını izole etti. N2-Bristol suşunun genç ve yaşlı solucanlarının çözünmezleri, mevcut protein miktarını belirlemek için SDS-PAGE ile analiz edildi. SDS-PAGE jeli, protein bantlarını görselleştirmek için bir floresan protein boyası ile boyandı. Şerit 1 ve 4: Genç N2 solucanlarının iki biyolojik kopya deneyinden elde edilen çözümsüzlük (2. Gün). Şerit 2 ve 3: Yaşlı N2 solucanlarının iki biyolojik kopya deneyinden elde edilen çözümsüzlük (10. gün). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3. Protein adayları, yaşlı ve genç insolublomda ve bunların kıvrım değişim dağılımlarında önemli değişiklik gösterdiği tespit edildi. (A) Yaşlı ve genç N2-Bristol solucanlarının çözünmezliğinin ölçülmesi için yanardağ grafiği. Mutlak kat değişimi >=1.5 ve Q değeri <0.01 olan adaylar kırmızı nokta olarak gösterilir. (B) Yaşlı ve genç solucan örneklerinde önemli ölçüde zenginleştirilmiş SDS'de çözünmeyen proteinlerin kıvrım değişimi dağılımı için histogram grafiği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4. KEGG yolu ve Gen Ontolojisi (GO) analizi. (A) Üstte gösterilen oldukça önemli yol ile p değerine göre düzenlenmiş gün-10 çözünmez KEGG yolu analizi. (B) Gen Ontolojisi analizi, yaşlı solucanların çözünmezliğinin, mitokondriyal, gelişimsel, yetişkin ömrünün belirleyicileri ve ribozomal proteinler dahil olmak üzere belirli kategorilerdeki birçok protein için zenginleştirildiğini göstermektedir. Dağılım grafiği görünümü, GO terimlerini, daha benzer terimlerin birbirine daha yakın konumlandırıldığı bir "anlamsal uzayda" görselleştirir. Kabarcığın rengi, STRING analizinde elde edilen p değerini yansıtırken, boyutu UniProt-GOA veritabanındaki GO teriminin genelliğini yansıtır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5. Bu çalışmayı (A) David ve ark.2 ve (B) Mark ve ark.11 çalışmaları ile karşılaştıran 10. gün çözünmez proteini örtüşmesi tespit etti. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Tablo 1 (Şekil 4 ve Şekil 5 ile ilgili). (A) Gen ontolojisi (biyolojik süreç) STRING veritabanı ile analiz edilmiştir. (B) Bu çalışmada tanımlanan proteinlerin ve KEGG yolaklarının ayrıntılı listesi, yayınlanmış çalışma ile örtüşmelerini gösteren renk kodları. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde, C. elegans'tan çözünmeyen proteinlerin ekstraksiyonu için geliştirilmiş bir numune hazırlama yöntemi rapor edilmiştir. Geleneksel solucan lizizini (örneğin, prob sonikasyonu veya boncuk çırpıcı teknikleri) verimli sonikatör ile değiştirerek, çözünmeyen protein ekstraksiyonunun verimini artırdık ve etiketsiz MS analizi için gereken solucan sayısını 40.000 solucandan 3.000 solucana düşürdük. DDA verilerinden protein tanımlaması için bir veritabanı arama motoru kullanıldı ve 'DIA Kantitatif Analiz Yazılımı' ve ilgili DDA veritabanı arama sonuçları (veritabanı arama motoru tarafından oluşturulan FDR dosya raporlarının içe aktarılması) kullanılarak C. elegans spektral kütüphanesi oluşturuldu. Yaşlı ve genç C. elegans insolublome verilerinin nispi nicelleştirilmesi, yeni DIA veri setini ve oluşturulan spektral kütüphaneyi işlemek için 'DIA Kantitatif Analiz Yazılımı' kullanılarak gerçekleştirildi.
Protokolde birkaç adım kritik öneme sahiptir. C. elegans'ın kısa ömrü, memeli hücreleri gibi diğer ökaryotlara kıyasla yaşlanmayı incelemek için ideal bir sistem haline getirir, ancak yaşlanma ile ilgili fenomeni incelerken homojen bir solucan popülasyonunu izole etmek çok önemlidir. Bu protokolde senkronize yaşlanan solucanlar elde etmek için FUDR kullanıldı. Etkinliğini sağlamak için solucanları L4 aşamasının başlarında FUDR içeren NGM tohumlu plakaya aktarmak önemlidir. Verimli sonikatör kullanılarak solucan lizisi sırasında, numunelerin aşırı ısınmasını önlemek için su banyosu sıcaklığı 4 ° C'ye ve sonikasyon 30 s AÇIK ve 30 s KAPALI'ya ayarlanmalıdır. 10 döngü (10 dakika) boyunca ilk sonikasyon turundan sonra, tüm solucanların verimli bir şekilde parçalandığından emin olmak için mikroskop altında kontrol etmek önemlidir. Değilse, daha fazla sonikasyon döngüsüne ihtiyaç vardır. Jel içi sindirim işlemi sırasında, her bir jel dilimi uygun boyutta (<1 mm2) parçalara ayrılmalıdır - çok küçükse, numune hazırlama sürecinde kaybolabilirler ve çok büyüklerse, sindirim yetersiz olabilir.
Çok daha az başlangıç malzemesine duyulan ihtiyaç, çözünmeyen analizler için numune elde etmek için solucan kültürü ile ilişkili zahmetli çalışmayı önemli ölçüde azaltır. Bununla birlikte, %1 SDS'de çözünmeyen protein fraksiyonunun ekstraksiyonu ve izolasyonu, birden fazla yıkama adımını içerir ve numune kaybını önlemek ve tekrarlanabilir sonuçlar elde etmek için dikkatli numune kullanımı gereklidir. MS analizi için üretilen malzeme miktarı, sonraki DDA ve DIA analizi için ~ 3 enjeksiyon için yeterlidir, ancak gelecekteki deneyler için tasarruf etmek için yeterli değildir. Ayrıca, potansiyel olarak kafa karıştırıcı etkilerine15 rağmen, yaşlanma sürecinde solucanları sterilize etmek için mümkün olan en düşük FUdR konsantrasyonunu kullandık. Gelecekteki çalışmalar, steril mutantlar kullanarak veya solucanları manuel olarak aktararak ve toplayarak FUdR kullanımını engelleyebilir.
Solucan lizisi için yüksek verimli sonikatörün kullanılması, çözünmezin verimli bir şekilde ekstraksiyonuna izin vererek, iyi protein kapsamına ve büyük ölçüde azaltılmış sayıda solucan kullanarak çözünmeyen blomu ölçmek için uygun maliyetli, etiketsiz DIA MS analizine izin verir. İş yükünü önemli ölçüde azaltır ve deney başına daha fazla koşulun taranmasına olanak tanır. Ek olarak, etiketsiz MS DIA iş akışı uygun maliyetlidir ve iTRAQ, TMT veya SILAC dahil olmak üzere etiketleme yöntemleriyle karşılaştırılabilir seviyelerde protein derinliği ve kapsamı sağlar. C. elegans modeli, yaşlanma araştırmaları için hızlı bir tarama sistemidir. İş akışı, bu ve diğer organizmalarda yaşlanma ve yaşa bağlı hastalık araştırmalarını incelemek için kolayca değiştirilebilir ve uygulanabilir. Örneğin, devam eden çalışmalarda, gelecekteki yüksek verimli ilaç taraması için farklı ilaç müdahaleleri olsun veya olmasın, Abeta, tau ve ikili Abeta/tau solucanları dahil olmak üzere çeşitli Alzheimer hastalığı (AD) C. elegans modellerinde çözünmez ve proteostazın protein profillerini araştırmak için bu iş akışını uyguluyoruz.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, bir TripleTOF sistemi (1S10 OD016281, Buck Institute), NIH hibesi, RF1 AG057358 (GJL, JKA) ve NIH hibe U01AG045844 (GJL) için bir NIH ortak enstrümantasyon hibesi ile desteklenmiştir. XX, bir T32 doktora sonrası bursu tarafından desteklenmektedir (NIH hibesi 5T32AG000266, PI: Judith Campisi ve Lisa Ellerby). MC, Larry L. Hillblom Vakfı'ndan doktora sonrası bir burs ile desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Strains used | |||
| Esherichia coli OP50 | Caenorhabditis Genetics Center (CGC) | ||
| N2 (Bristol) | Caenorhabditis Genetics Center (CGC) | ||
| Buffer/Solution | |||
| NGM (Nematode Growth Media) | Recipe: 3 g/L NaCl, 23 g/L agar; 2.5 g/L peptone; 1 mM CaCl2, 5 mg/L cholesterol, 1 mM MgSO4, 25 mM KH2PO4 | ||
| S-basal solution | Recipe: 5.85 g/L NaCl, 1g/L K2HPO4, 6 g/L KH2PO4, H2O to 1 L | ||
| Sodium hypochlorite bleach solution | Recipe: Mix 0.5 mL 5 N NaOH with 1 ml Sodium hypochlorite (5%) and make volume to 5 mL with H20. | ||
| Material/ Equipment | |||
| Agar | Difco Granulated Agar, BD Biosciences | 90000-782 | |
| Bioruptor Plus sonication device | Diagenode, USA | B01020001 | |
| Cholesterol | Sigma | c8503 | |
| 2'-deoxy-5-fluorouridine | VWR | TCD2235 | |
| Glycerol | Millipore Sigma | 356350-1000ML | |
| LB broth, Miller | Millipore Sigma | 60801-450 | |
| Sodium dodecyl sulfate (SDS? | Sigma | L4509-250G | |
| Sodium chloride | Sigma | 59888 | |
| M880 Ultrasonic bath, 117 V, holds 5.5 gallons | VWR, USA | 89375-458 | |
| Magnesium sulphate | Sigma | M506 | |
| Magnesium chloride | Sigma | 208337 | |
| NGM agar plate | VWR Disposable Petri Dishes | 25384-342 | |
| NuPAGE LDS Sample Buffer (4X) | Thermo Fisher Scientific | NP0007 | |
| NuPAGE protein gels, 4-12% | Invitrogen | NP 0335BOX | |
| Protease inhibiotr cocktail (PIC) | Roche | 11836170001 | |
| Pierce BCA Assay | Thermo Fisher Scientific | 23225 | |
| Sodium hypochlorite 5% | VWR | JT9416-1 | |
| SYPRO Ruby Protein Gel Stain | Thermo Fisher Scientific | S12000 | |
| MS Section | |||
| Acetonitrile, Burdick and Jackson LC-MS | Honeywell International Inc., Charlotte, NC, USA | 36XL66 | |
| Agilent Zorbax 300Extend C18 column | Agilent Technologies Inc., Santa Clara, CA, USA | 770995-902 | |
| Ammonium bicarbonate | Sigma Aldrich, St. Louis, MO, USA | 9830 (1 kg) | |
| Dithiothreitol (DTT) | Sigma Aldrich, St. Louis, MO, USA | D9779-5G | |
| Eppendorf Thermomixer Compact | Eppendorf AG, Hamburg, Germany | T1317-1EA | |
| Formic acid | Sigma Aldrich, St. Louis, MO, USA | F0507-500ML | |
| Indexed retention time (iRT) normalization peptide standard | Biognosys AG, Schlieren, Zurich, Switzerland | Ki-3002-2 | |
| Iodoacetamide (IAA) | Sigma Aldrich, St. Louis, MO, USA | I1149-25G | |
| Methanol, HPLC Grade | Honeywell International Inc., Charlotte, NC, USA | 34885 | |
| Nano cHiPLC Trap ChromXP C18-CL, 200 um x 6 mm, 3 um, 120A. (pre-column chip) (200 um x 6 mm ChromXP C18-CL chip, 3 um, 300 A) | Sciex LLC, Framingham, MA, USA | 804-00006 | |
| Nano cHiPLC ChromXP 75 um by 15cm, C18-CL, 3 um, 120 A (analytical column chip) | Sciex LLC, Framingham, MA, USA | 804-00001 | |
| Orthoganol quadrupole time-of-flight (QqTOF) TripleTOP 6600 mass spectrometer | Sciex LLC, Framingham, MA, USA | Per quote | |
| ProteinPilot 5.0 | Sciex LLC, Framingham, MA, USA | software download Sciex | |
| Savant SPD131DDA Speedvac Concentrator | Thermo Fisher Scientific, Waltham, MA, USA | SPD131DDA-115 | |
| Sequencing-grade lyophilized trypsin | Life Technologies | 23225 | |
| Spectronaut | Biognosys AG, Schlieren, Zurich, Switzerland | Sw-3001 | |
| SWATH 2.0 plugin into PeakView 2.2 | Sciex LLC, Framingham, MA, USA | software download Sciex | |
| Ultra Plus nano-LC 2D HPLC system | Sciex LLC, Eksigent Division, Framingham, MA, USA | Model # 845 | |
| Water, Burdick and Jackson LC-MS | Honeywell International Inc., Charlotte, NC, USA | 600-30-76 | |
| Waters 1525 binary HPLC pump system | Waters Corp., Milford, MA, USA | WAT022939 | |
| Waters 2487 Dual Wavelength UV detector | Waters Corp., Milford, MA, USA | WAT081110 | |
| Waters 717plus Autosampler | Waters Corp., Milford, MA, USA | WAT022939 | |
| Waters Fraction Collector III | Waters Corp., Milford, MA, USA | 186001878 |
Referanslar
- Walther, D. M., et al. Widespread Proteome Remodeling and Aggregation in Aging C. elegans. Cell. , 919-932 (2015).
- David, D. C., et al. Widespread protein aggregation as an inherent part of aging in C. elegans. PLoS Biology. 8 (8), 47-48 (2010).
- Labbadia, J., Morimoto, R. I. The Biology of Proteostasis in Aging and Disease. Annual Review of Biochemistry. (1), 435-464 (2013).
- Ross, C. A., Poirier, M. A. Protein aggregation and neurodegenerative disease. Nature Medicine. , 10-17 (2004).
- Reis-Rodrigues, P., et al. Proteomic analysis of age-dependent changes in protein solubility identifies genes that modulate lifespan. Aging Cell. 11 (1), 120-127 (2012).
- Ayyadevara, S., et al. Proteins that accumulate with age in human skeletal-muscle aggregates contribute to declines in muscle mass and function in Caenorhabditis elegans. Aging. 8 (12), 3486-3497 (2016).
- Huang, C., et al. Intrinsically aggregation-prone proteins form amyloid-like aggregates and contribute to tissue aging in Caenorhabditis elegans. eLife. 8, (2019).
- Morimoto, R. I. Proteotoxic stress and inducible chaperone networks in neurodegenerative disease and aging. Genes and Development. 22 (11), 1427-1438 (2008).
- Morimoto, R. I., Cuervo, A. M. Protein homeostasis and aging: Taking care of proteins from the cradle to the grave. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 64 (2), 167-170 (2009).
- Klang, I. M., et al. Iron promotes protein insolubility and aging in C. elegans. Aging. 6 (11), 975-991 (2014).
- Mark, K. A., et al. Vitamin D Promotes Protein Homeostasis and Longevity via the Stress Response Pathway Genes skn-1, ire-1, and xbp-1. Cell Reports. 17 (5), 1227-1237 (2016).
- Groh, N., et al. Methods to study changes in inherent protein aggregation with age in caenorhabditis elegans. Journal of Visualized Experiments. (129), 1-12 (2017).
- Schilling, B., Gibson, B. W., Hunter, C. L. Generation of High-Quality SWATH((R)) Acquisition Data for Label-free Quantitative Proteomics Studies Using TripleTOF((R)) Mass Spectrometers. Proteomics: Methods and Protocols, Methods in Molecular Biology. 1550, 223-233 (2017).
- Walther, D. M., et al. Widespread proteome remodeling and aggregation in aging C. elegans. Cell. 161 (4), 919-932 (2015).
- Angeli, S., et al. A DNA synthesis inhibitor is protective against proteotoxic stressors via modulation of fertility pathways in Caenorhabditis elegans. Aging. 5 (10), 759-769 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır