Method Article
القياس الكمي لتراكم البروتين غير القابل للذوبان في Caenorhabditis elegans أثناء الشيخوخة مع سير عمل اكتساب جديد مستقل عن البيانات
In This Article
Summary
يستخرج سير العمل الجديد هذا بكفاءة ويعزل البروتينات غير القابلة للذوبان في SDS (insolublome) من Caenorhabditis elegans مع الحد الأدنى من المواد الأولية للتحليل البروتيني التفاضلي الكمي. يستخدم البروتوكول تحليلا شاملا لقياس الطيف الكتلي المستقل عن البيانات لتحديد تحليل المعلوماتية الحيوية لاكتساب رؤى بيولوجية حول آليات الشيخوخة والأمراض.
Abstract
لقد أظهرنا نحن وآخرون أن عملية الشيخوخة تؤدي إلى تراكم البروتينات غير القابلة للذوبان على مستوى البروتين. يؤدي تدمير الجينات التي تشفر البروتينات غير القابلة للذوبان على مدى 40٪ من الوقت إلى إطالة العمر الافتراضي في C. ايليجانس، مما يشير إلى أن العديد من هذه البروتينات هي المحددات الرئيسية لعملية الشيخوخة. يعد العزل والتحديد الكمي لهذه البروتينات غير القابلة للذوبان أمرا بالغ الأهمية لفهم العمليات البيولوجية الرئيسية التي تحدث أثناء الشيخوخة. هنا ، نقدم بروتوكولا معدلا ومحسنا يوضح بالتفصيل كيفية استخراج وعزل البروتينات غير القابلة للذوبان في SDS (insolublome) من C. ايليجانس بشكل أكثر كفاءة لتبسيط سير العمل الطيفي الكتلي عبر تحليل البروتينات الكمي الجديد الخالي من الملصقات. يستخدم هذا البروتوكول المحسن صوتيا عالي الكفاءة لتحلل الديدان الذي يزيد بشكل كبير من كفاءة استخراج البروتين ويسمح لنا باستخدام مواد أولية أقل بكثير (حوالي 3,000 دودة) مقارنة بالبروتوكولات السابقة (عادة باستخدام ما لا يقل عن 40,000 دودة). تم إجراء التحليل البروتيني الكمي اللاحق للإنسولوبلوم باستخدام الاستحواذ المعتمد على البيانات (DDA) لاكتشاف البروتين وتحديده والاستحواذ المستقل عن البيانات (DIA) من أجل القياس الكمي للبروتين بشكل شامل وأكثر دقة. يوفر تحليل المعلوماتية الحيوية للبروتينات الكمية مرشحين محتملين يمكن متابعتهم بسهولة بالطرق الجزيئية الأخرى في C. ايليجانس. من خلال سير العمل هذا ، نحدد بشكل روتيني أكثر من 1000 بروتين ونحدد أكثر من 500 بروتين. يتيح هذا البروتوكول الجديد الفحص المركب الفعال باستخدام C. ايليجانس. هنا ، قمنا بالتحقق من صحة هذا البروتوكول المحسن وتطبيقه على النوع البري C. ايليجانس N2-سلالة بريستول وأكدنا أن الديدان N2 التي يبلغ عمرها 10 أيام أظهرت تراكما أكبر للديدان الصغيرة في اليوم الثاني.
Introduction
ينخفض توازن البروتين تدريجيا مع تقدم العمر ويؤدي إلى زيادة تراكم البروتين1،2،3. يرتبط تراكم البروتين بالعديد من الأمراض التنكسية العصبية بما في ذلك مرض الزهايمر ومرض باركنسون ومرض هنتنغتون والتصلب الجانبيالضموري 4. تعتبر الشيخوخة عامل خطر رئيسي لظهور الاضطرابات التنكسية العصبية المرتبطة بتراكم البروتين. غالبا ما ترتبط البروتينات المعرضة لتكوين مجاميع غير قابلة للذوبان بالسمية الخلوية وخلل الأنسجة ، مما قد يؤدي إلى تسريع تراكم البروتينات الأخرى5،6،7. بدلا من ذلك ، قد تنشط مجاميع البروتين غير القابلة للذوبان آليات الدفاع الخلوية لإزالة أشكال قليلة القلة السامة للبروتين من النظام. يؤدي تدمير الجينات المختارة التي تشفر البروتينات غير القابلة للذوبان إلى تعديل عمر Caenorhabditis elegans (C. elegans) في سياق كل من الأمراض المرتبطة بالعمر والشيخوخة الطبيعية5،8،9. وبالتالي ، فإن دراسة الآليات الخلوية والجزيئية لتجميع البروتين أمر بالغ الأهمية لفهم الشيخوخة وقد تؤدي في النهاية إلى طرق لعلاج الأمراض التنكسية العصبية.
الديدان الخيطية C. ايليجانس أصبحت واحدة من أكثر الكائنات الحية النموذجية استخداما لدراسة تراكم البروتين في الشيخوخة والأمراض المرتبطة بالعمر نظرا لخصائصها الفريدة ، مثل العمر القصير نسبيا (حوالي أسبوعين) ، وسهولة الزراعة والتلاعب الجيني.
لعبت القدرة على استخراج وتوصيف البروتينات غير القابلة للذوبان دورا مهما في تحديد التغيرات المرتبطة بالعمر المرتبطة بتراكم البروتين في C. ايليجانس النماذج. للتحقيق في مساهمة تراكم البروتين في عمليات الشيخوخة الطبيعية ، قمنا5 وآخرون2 مسبقا باستخراجه وهضمه بروتينيا للصغار مقابل كبار السن C. ايليجانس ، تم تصنيفها كيميائيا باستخدام كواشف iTRAQ ("وضع العلامات متساوية الضغط للقياس الكمي النسبي والمطلق") ، ثم تم قياسها كميا باستخدام طرق قائمة على MS. باستخدام طريقة وضع العلامات متساوية الضغط و 120 مجم من الديدان الرطبة (حوالي 40,000 دودة) ، تمكنا من اكتساب عمق وتغطية كبيرة للبروتين5. أظهر التحليل الكمي أن 203 من أصل 1200 بروتين تم تحديدها تم إثرائها بشكل كبير في insolublome من C. ايليجانس المسنين مقارنة بكسور insolublome المماثلة من الديدان الصغيرة5. بشكل مستقل ، ديفيد وآخرون استخدم أيضا سير عمل iTRAQ LC-MS / MS لفحص التغيرات في مجاميع البروتين مع الشيخوخة الطبيعية2. بدءا من حوالي 300 مجم من الديدان ، حددوا ~ 1000 بروتين غير قابل للذوبان باستخدام مكررتين بيولوجيتين وقرروا أن ~ 700 من حوالي 1000 بروتين تراكمت بمقدار 1.5 ضعف أو أكثر مع تقدم العمر مقارنة بالديدان الصغيرة2. بشكل عام ، تشير هذه النتائج المستقلة إلى أن عدم ذوبان البروتين على نطاق واسع وتجميعه جزء لا يتجزأ من الشيخوخة الطبيعية وقد يؤثر على كل من العمر وحدوث المرض التنكسيالعصبي 2،5.
سمحت لنا دراسة insolublome بتحديد كيف يمكن للتأثيرات البيئية أن تسرع أو تبطئ عملية الشيخوخة. Klang et al. أنشأ تدفقات عمل بروتينية خالية من الملصقات في C. ايليجانس للتحقيق في دور داء المعادن في طولالعمر 10. في هذه الدراسة ، تم استخدام ما لا يقل عن 40,000 دودة لاستخراج insolublome10. أظهرت البيانات أن مستويات الحديد والنحاس والكالسيوم والمنغنيز تزداد مع تقدم العمر وأن تغذية الديدان بنظام غذائي مرتفع من الحديد يسرع بشكل كبير من تراكم البروتينات غير القابلة للذوبان المرتبطة بالعمر10. باستخدام نفس سير العمل لفحص تأثيرات فيتامين (د) على عدم الذوبان في C. ايليجانس، تم قياس 38 بروتينا في الديدان الصغيرة (اليوم 2) و 721 بروتينا في الديدان المسنة (اليوم 8). خفضت تغذية فيتامين د بشكل كبير من انحلال الديدان المسنة من 721 إلى 371 بروتين11. كشفت المزيد من التحقيقات أن تغذية فيتامين د قمعت عدم قابلية البروتين للذوبان مع تقدم العمر ، وعززت توازن البروتين ، وأطال العمر الافتراضي في C.elegans N2 الديدان البريةمن النوع البري 11. وبالتالي ، فإن دراسة insolublome يمكن أن تساعد في تحديد معدلات جديدة للشيخوخة والأمراض المرتبطة بالعمر.
في حين أن دراسة insolublome كانت لا تقدر بثمن في تطوير فهم عملية الشيخوخة ، فقد أعاقتها الحاجة إلى جمع كميات كبيرة من مواد العينة الأولية. قدم Groh et al. مؤخرا سير عمل القياس الكمي البروتيني الخالي من الملصقات لدراسة تغيرات تراكم البروتين المتأصل في C. ايليجانس مع الشيخوخة. ومع ذلك ، فقد تطلب كميات كبيرة من المواد الأولية (350 مجم من الديدان المطحونة)12. في هذا التقرير ، أنشأنا بروتوكولا جديدا محسنا للاستخراج والعزل (الشكل 1). أدى استخدام الصوتنة عالية الكفاءة أثناء تحلل الدودة إلى تحسين كفاءة الاستخراج بشكل كبير وبالتالي تقليل كمية المواد الأولية اللازمة ، من 40,000 إلى 3,000 دودة. أدى الجمع بين بروتوكول عزل insolublome الجديد هذا مع سير عمل القياس الطيفي الشامل الخالي من الملصقات (DIA) إلى تحسين عمق البروتين وتغطيته بشكل كبير. البروتوكول المقدم هنا فعال من حيث التكلفة ويمكن تعديله بسهولة للسماح بأداء تحليلات insolublome في الأنظمة النموذجية الأخرى.
Protocol
ملاحظة: للحصول على فهم أفضل للإجراء التجريبي، راجع الشكل 1 للحصول على مخطط لسير العمل.
1. الثقافة الجماعية للشيخوخة المتزامنة C. ايليجانس
- تحضير الطبق
- صب 30 مل من أجار NGM مع أو بدون 50 ملي مولار فلوروديوكسيوريدين (FUdR) في كل صفيحة 90 مم واترك الألواح تجف لمدة يومين في أغطية الثقافة.
- في اليوم السابق لبذر صفيحة أجار NGM ، قم بتلقيح 50 ميكرولتر من مخزون الجلسرين المجمد من السلالة البكتيرية OP50 في 1 لتر من وسط LB المعقم مسبقا في قارورة سعة 2 لتر.
- تنمو البكتيريا عند 37 درجة مئوية في حاضنة اهتزاز عند 250 دورة في الدقيقة لمدة 16 ساعة.
- بعد 16 ساعة ، قم بالطرد المركزي للمزارع البكتيرية بسرعة 5,000 × جم لمدة 10 دقائق.
- تخلص من المادة الطافية وأعد تعليق الحبيبات البكتيرية تماما في 40 مل من محلول S-basal المعقم (يحتوي على 50 ملي مولار K3PO4 ، 100 ملي كلوريد الصوديوم في الماء) لتوليد OP50 بكتريا قولونية مركزة 25x.
- قم بتوزيع 2 مل من المزرعة البكتيرية المركزة 25x على كل صفيحة أجار NGM ووزعها بالتساوي بحيث تغطي المزرعة البكتيرية سطح الأجار بالكامل.
- قم بإزالة الأغطية من الألواح في غطاء مزرعة بكتيرية لمدة 2-3 ساعات حتى تجف الألواح بشكل صحيح.
ملاحظة: تأكد من توزيع البكتيريا بالتساوي عن طريق تحريك الألواح كل 15 دقيقة. هذا مهم لأن البكتيريا تميل إلى التركيز على جانب واحد من الصفيحة مما يؤدي إلى مناطق ذات كثافة بكتيرية منخفضة. - بعد تجفيف الأطباق ، أغلق الأغطية واترك الأطباق في درجة حرارة الغرفة لمدة 48 ساعة لضمان التجفيف الكامل لمصدر غذاء OP50 بكتريا قولونية .
ملاحظة: يمكن تحضير الأطباق قبل أسبوعين وتخزينها في درجة حرارة 4 درجات مئوية قبل الاستخدام.
- صيانة وإعداد مجموعات متزامنة من C. ايليجانس
- للحصول على المدخلات المطلوبة من محللة البروتين (1.0-1.5 مجم) لعزل الجزء غير القابل للذوبان SDS ، استخدم ما يقرب من 3,000 ديدان متزامنة لكل عينة.
- انقل ~ 100 N2 ديدان بالغة من النوع البري إلى صفيحة بذرة القولونية NGM 25x OP50 E. وحافظ على الديدان عند 20 درجة مئوية لمدة ~ 72 ساعة حتى تمتلئ اللوحة بالديدان البالغة الحاملة.
- الماصة ~ 10 مل من المحلول القاعدي S على كل لوحة وجمع كل الديدان في أنبوب سعة 15 مل.
ملاحظة: من المهم استخدام أطراف منخفضة الاحتجاز أو ماصات باستور خلال هذه الخطوات وجميع الخطوات المستقبلية التي تنطوي على تجميع الديدان لمنع أي فقدان للديدان بسبب الالتصاق بأسطح الأطراف. - قم بتدوير العينة عند 520 × جم لمدة 30 ثانية. قم بإزالة المادة الطافية بعد الدوران. للتخلص من أي OP50 بكتريا قولونية ، أضف 10 مل من محلول S-basal إلى الحبيبات وقم بالدوران مرة أخرى متبوعا بإزالة المادة الطافية. كرر هذه الخطوة.
- أضف 10 مل من محلول تبييض هيبوكلوريت الصوديوم (يحتوي على 0.5 M KOH و 0.48٪ هيبوكلوريت الصوديوم في الماء) إلى حبيبات الدودة في أنبوب مخروطي 15 مل ودوامة بقوة لمدة دقيقتين في درجة حرارة الغرفة.
- جهاز طرد مركزي عند 520 × جم لمدة 30 ثانية في درجة حرارة الغرفة لتدوير أي أجسام دودية وبيض غير مذابة تماما. ثم قم بإزالة المادة الطافية.
- كرر الخطوتين 1.2.5 و 1.2.6 لضمان الإزالة الكاملة لجميع أجسام الديدان وإطلاق البويضات (انظر الأنبوب تحت المجهر للتأكد منه).
- اغسل حبيبات البيض 4 مرات على الأقل ب 10 مل من محلول S-basal لضمان الإزالة الكاملة لمحلول التبييض.
ملاحظة: الإزالة الكاملة للتبييض مهمة لأن المبيض المتبقي قد يعيق فقس البيض. - اترك البيض معلقا في 5 مل من الوسط القاعدي S في أنبوب سعة 15 مل وضعه في الدوار عند 20 درجة مئوية لمدة 24 ساعة للسماح للبيض بالفقس.
- بعد 24 ساعة ، خذ 10 ميكرولتر من محلول اليرقات القاعدية S-لحساب عدد الديدان فيه. استخدم ما لا يقل عن ثلاثة حصص منفصلة من 10 ميكرولتر من محلول اليرقات القاعدية S-لتكرار عدد الديدان. احسب متوسط تركيزات اليرقات الثلاثة. بناء على متوسط التركيز ، قم بتخفيف محلول الدودة للحصول على ~ 3,000 يرقة لكل 200 ميكرولتر من المحلول.
ملاحظة: تأكد من هز الأنبوب برفق عن طريق التقليب لأن اليرقات تميل إلى الاستقرار إذا تركت دون إزعاج ويمكن أن يؤثر ذلك على عدد اليرقات. - تخلط جيدا وتضاف 200 ميكرولتر من محلول اليرقات القاعدية على كل من ألواح NGM المصنوعة من بذور البكتيريا مقاس 90 مم.
ملاحظة: أضف قطرات من محلول اليرقات القاعدية S في جميع أنحاء اللوحة لتوزيع اليرقات بشكل متساو لتجنب استنفاد البكتيريا من أماكن معينة. - اترك المحلول القاعدي S يجف ثم ضع الألواح المقلوبة في حاضنة 20 درجة مئوية لمدة 48 ساعة.
- بعد 48 ساعة ، اجمع الديدان من الصفيحة في محلول S-basal وانقلها إلى صفيحة جديدة ببذور NGM تحتوي على 50 ملي مولار FUDR واحتضان الألواح عند 20 درجة مئوية.
ملاحظة: من المهم نقل الديدان في وقت مبكر من المرحلة L4 لضمان كفاءة FUDR. - اجمع عينات من الشباب في اليوم 2 بعد 48 ساعة عن طريق إضافة 10 مل من محلول S-basal على اللوحة ونقل المحلول إلى أنبوب سعة 15 مل. اسمح للديدان بالاستقرار عن طريق الجاذبية وإزالة المحلول القاعدي S بعد أن يصبح صافيا.
- اغسل حبيبات الدودة 2-3x في 5 مل من محلول S-basal لإزالة أي بكتيريا متلتصقة. قم بإزالة أكبر قدر ممكن من المحلول القاعدي S وتجميد حبيبات الدودة (في أنابيب 15 مل) في حمام ثلج جاف / إيثانول. يتم تخزين العينات المجمدة عند -80 درجة مئوية.
- انقل عينة الديدان إلى صفيحة NGM OP50 E. coli جديدة تحتوي على FUDR كل يوم بديل حتى اليوم 10. جمع الديدان وتجميدها كما هو موضح في الخطوتين 1.2.14 و 1.2.15.
ملاحظة: ابدأ بعدد أكبر من الديدان لعينات اليوم 10 لحساب أي خسارة في عدد الديدان بسبب النقل والحفرة.
2. استخراج جزء SDS غير القابل للذوبان من الديدان
- قم بإذابة حبيبات الدودة المجمدة على الجليد في وجود 900 ميكرولتر من كوكتيل عازل تحلل الدودة المثلجة التي تحتوي على 20 ملي مولار من قاعدة تريس ، ودرجة الحموضة 7.4 ، و 100 ملي كلوريد الصوديوم ، و 1 ملي مولار من كلوريدالصوديوم 2 ومثبط البروتياز الخالي من EDTA. عينات دوامة لفترة وجيزة لضمان إعادة التعليق الكامل لحبيبات الدودة في المخزن المؤقت للتحلل.
- ضع أنابيب 15 مل في حمام صوتنة وضبط ل 10 دورات صوتنة (30 ثانية على و 30 ثانية لكل دورة) بكثافة عالية. كرر لمدة تصل إلى خمس دورات (تأكد من تحلل الديدان بالكامل).
- قم بتدوير المحللة على 3,000 × جم لمدة 4 دقائق في الغرفة الباردة. بعد الطرد المركزي ، تخلص من الحبيبات التي تحتوي على أي بقايا دودة وانقل المادة الطافية بعناية إلى أنابيب طرد مركزي جديدة مبردة مسبقا سعة 1.5 مل على الجليد.
- حدد تركيز البروتين باستخدام مقايسة BCA. قم بنقل كميات الليزات ، التي تحتوي عادة على حوالي 1 مجم من البروتين ، إلى أنابيب طرد مركزي جديدة مبردة مسبقا سعة 1.5 مل.
- الطرد المركزي محللة البروتين لمدة 15 دقيقة عند 20,000 × جم في الغرفة الباردة.
- دون إزعاج الحبيبات ، انقل المادة الطافية إلى أنبوب طرد مركزي جديد سعة 1.5 مل واحفظه كجزء البروتين القابل للذوبان في الماء.
- اغسل الحبيبات من الخطوة السابقة في 500 ميكرولتر من محلول تحلل الديدان الذي يحتوي على 1٪ SDS في درجة حرارة الغرفة وجهاز طرد مركزي عند 20,000 × جم لمدة 15 دقيقة في درجة حرارة الغرفة. قم بإزالة المادة الطافية وحفظها كجزء قابل للذوبان في SDS. كرر خطوة الغسيل هذه مرتين لإزالة أي جزء قابل للذوبان في SDS. يتم تعريف الحبيبات المتبقية بعد الجولة الثالثة من الغسيل على أنها جزء البروتين غير القابل للذوبان بنسبة 1٪ SDS.
- أعد تعليق حبيبات البروتين غير القابلة للذوبان SDS في 60 ميكرولتر من حمض الفورميك 70٪ والدوامة بقوة لإذابة البروتينات. كرر الدوامة القوية عدة مرات حسب الضرورة لإذابة الحبيبات.
- Sonicate الحبيبات لمدة 30 دقيقة في حمام مائي بالموجات فوق الصوتية في درجة حرارة الغرفة.
ملاحظة: عادة ما يصعب إذابة الحبيبات غير القابلة للذوبان في المخزن المؤقت. ومع ذلك ، في النهاية يجب إذابة الحبيبات بأكملها في هذه الخطوة. - جفف العينات في مكثف فراغ لمدة 1 ساعة لإزالة محلول حمض الفورميك تماما.
- أضف 40 ميكرولتر من 1x عينة جل المخزن المؤقت LDS إلى الحبيبات المجففة وقم بتسخين العينة إلى 95 درجة مئوية لمدة 10 دقائق. دوامة لفترة وجيزة وتدوير العينات. قم بتحميل 13 ميكرولتر على جل NUPAGE Bis-Tris بنسبة 4-12٪ وقم بتشغيل الجل. تلطخ الجل بصبغة بروتين الفلورسنت للتصوير. احفظ باقي العينة لتحليل قياس الطيف الكتلي (MS).
- قم بتحميل العينة المتبقية في جل Bis-Tris بنسبة 4-12٪ وقم بتشغيله لمدة 20 دقيقة تقريبا لعملية الهضم في الهلام لمرض التصلب العصبي المتعدد.
3. الهضم داخل الهلام مع بروتياز التربسين لعزل البروتينات لتحليل مرض التصلب العصبي المتعدد
- تحضير المحاليل التالية (طازجة): 25 ملي مولار NH4HCO3 (درجة الحموضة 7-8) ، 25 ملي مولار NH4HCO3 في 50٪ أسيتونيتريل (ACN ، درجة الحموضة 7-8) ، و 50٪ ACN في 5٪ حمض الفورميك.
- قم بتقطيع كل شريحة هلام إلى قطع صغيرة (عادة <1 مم2) وضعها في أنابيب سيليكونية سعة 0.65 مل.
- أضف حوالي 100 ميكرولتر (أو ما يكفي للتغطية) من محلول ACN مقاس 25 ملي مولارNH 4HCO3/50٪ ودوامة في درجة حرارة الغرفة لمدة 10 دقائق. استخرج المادة الطافية وانقله إلى أنبوب منفصل (يتم التخلص منه). كرر هذه الخطوة مرتين أخريين.
- جفف قطع الجل تماما في مكثف فراغ (~ 20 دقيقة).
- قم بإعداد محاليل جديدة وأضف ~ 100 ميكرولتر (أو ما يكفي للتغطية) من 10 ملي مولار DTT في 25 ملي NH4HCO3 إلى قطع الجل المجففة (استخدم NH4HCO3 المحضر حديثا). دوامة وتدور لفترة وجيزة. اسمح للتفاعل بالاستمرار عند 56 درجة مئوية لمدة ساعة واحدة مع الاهتزاز عند 1400 دورة في الدقيقة على الخلاط.
- قم بإزالة المادة الطافية وأضف 100 ميكرولتر من 55 ملي مولار من اليودوأسيتاميد (IAA) في 25 ملي مولار NH4HCO3 إلى قطع الجل. دوامة وتدور لفترة وجيزة. اسمح للتفاعل بالاستمرار في الظلام لمدة 45 دقيقة في RT.
- قم بإزالة المادة الطافية وتخلص منها. اغسل قطع الجل بإضافة ~ 100 ميكرولتر من 25 ملي مولار NH4HCO3 والدوامة لمدة 10 دقائق. قم بتدوير وإزالة المادة الطافية لفترة وجيزة ، وتخلص من الأخير.
- قم بتجفيف قطع الجل عن طريق إضافة ~ 100 ميكرولتر (أو ما يكفي للتغطية) من 25 ملي مولار NH4HCO3 في 50٪ ACN إلى قطع الجل والدوامة لمدة 10 دقائق. ثم تدور لفترة وجيزة لإزالة المادة الطافية والتخلص منها. كرر هذه الخطوة مرتين أو حتى ثلاث مرات إذا لم تكن قطع الجل جافة تماما كما يتضح من الحجم الأصغر لقطع الجل واللون الأبيض الغائم.
- جفف قطع الجل تماما في مكثف فراغ (~ 20 دقيقة).
- في البداية أضف 15 ميكرولتر من محلول التربسين (250 نانوغرام من التربسين) إلى كل عينة ، ثم أضف ما يكفي من 25 ملي مولار NH4HCO3 لتغطية قطع الجل (~ 100 ميكرولتر). دوامة لمدة 10 دقائق. ثم قم بالدوران لفترة وجيزة واحتضانها عند 4 درجات مئوية في الغرفة الباردة لمدة 30 دقيقة دون خلط.
- أضف 25 ملي NH4HCO3 حسب الحاجة لتغطية قطع الجل بالكامل. قم بالدوران والتحتضن عند 37 درجة مئوية طوال الليل لمدة 16-20 ساعة عند 1400 دورة في الدقيقة على الخلاط.
- في اليوم التالي ، قم بتدوير الدوامة لفترة وجيزة وتدوير عملية الهضم. أضف حوالي 100 ميكرولتر من الماء من الدرجة HPLC ، وتدور ، وبارافيلم الأنبوب وصوتنة بشكل مستمر لمدة 10 دقائق. تدور لفترة وجيزة بعد الصوتنة.
- انقل محلول الهضم ، الذي يمثل الاستخراج المائي ، إلى أنبوب نظيف من السيليكون سعة 0.65 مل.
- أضف ~ 100 ميكرولتر من 50٪ ACN / 5٪ حمض الفورميك إلى قطع الجل (يكفي لتغطيتها) ، ودوامة لمدة 10 دقائق في درجة حرارة الغرفة ، ثم قم بالدوران لفترة وجيزة واجمع المحلول ، وكرر مرة واحدة. اجمع جميع المحاليل التي تحتوي على الببتيدات المستخرجة من هذه الخطوة والخطوة السابقة 3.13 معا في أنبوب واحد.
- دوامة الهضم المستخرج. جفف الببتيدات تماما في مكثف فراغ (~ 2 ساعة).
- أضف 30 ميكرولتر من حمض الفورميك 0.2٪ لإعادة تعليق الببتيدات في الخلاط في الغرفة الباردة لمدة 10 دقائق.
- قم بتدوير العينات عند 1850 × جم في درجة حرارة الغرفة لمدة 5 دقائق. استنشق محلول الببتيد وانتقل إلى أنبوب سيليكون جديد نظيف سعة 0.65 مل. ثم تحلية محلول الببتيدات باستخدام أطراف تحلية C18 (انظر أدناه).
4. تحلية الببتيدات المهضومة بطرف تحلية C18
- اضبط الماصة على 10 ميكرولتر وقم بتوصيل طرف تحلية المياه C18. بلل طرف تحلية المياه عن طريق سحب 10 ميكرولتر من 100٪ ACN ثم التخلص منه. كرر هذه الخطوة 2x.
- اغسل طرف تحلية المياه C18 عن طريق سحب 10 ميكرولتر من 50٪ ACN و 49.8٪ ماء و 0.2٪ FA ثم التخلص منه. كرر هذه الخطوة 2x.
- قم بموازنة طرف تحلية المياه C18 عن طريق سحب 10 ميكرولتر من 0.2٪ FA في الماء ثم التخلص منه. كرر هذه الخطوة 2x.
- اضبط الماصة على 10 ميكرولتر وقم بتحميل الببتيدات من المحلول إلى الراتنج عن طريق سحب الببتيدات المهضومة عبر الراتنج لأعلى ولأسفل 15 مرة.
ملاحظة: سيضمن الإجراء المتكرر ربط جميع الببتيدات براتنج أطراف تحلية المياه. - قم بتحلية الببتيدات المهضومة المرتبطة بالراتنج عن طريق سحب 10 ميكرولتر من 0.2٪ FA في الماء ثم التخلص منها. كرر هذه الخطوة 4x لإكمال خطوة التحية.
- في أنبوب جديد ، قم بتصفية الببتيدات ب 10 ميكرولتر من 50٪ ACN ، و 49.8٪ ماء ، و 0.2٪ FA عن طريق سحب العينة لأعلى ولأسفل 10 أضعاف. كرر هذه الخطوة مرة واحدة لتصفية هضم البروتين للمرة الثانية في نفس الأنبوب.
- جفف الببتيدات المحلاة تماما في مكثف فراغ (~ 20 دقيقة).
- أعد تعليق الببتيدات في 15 ميكرولتر من 0.2٪ FA + 1 ميكرولتر iRT (وقت الاحتفاظ المفهرس). Voxtex لمدة 10 دقائق ، جهاز طرد مركزي عند 12,000 × جم لمدة دقيقتين ، ثم نقله إلى قارورة أخذ العينات التلقائية لتحليل MS (انظر أدناه).
5. تحليل قياس الطيف الكتلي للببتيدات المهضومة باستخدام DDA و DIA
ملاحظة: يمكن تحليل العينات باستخدام طرق DDA أو DIA LC-MS/MS. في هذه الدراسة ، تم تحليل العينات باستخدام نظام nano-LC 2D HPLC مقترنا بمطياف كتلة عالي الدقة.
- استخدم نظام HPLC جنبا إلى جنب مع نظام HPLC قائم على الرقاقة متصل مباشرة بمطياف كتلة وقت الطيران رباعي الأقطاب (يمكن أيضا استخدام تكوينات وأنظمة LC-MS الأخرى).
- تحليل العينات باستخدام HPLC-ESI-MS/MS في المرحلة العكسية.
- قم ببناء بروتوكول الكروماتوغرافيا لتحميل عينة الببتيدات على شريحة C18 قبل العمود. اغسل وقم بتحلية الببتيدات المحملة بمذيب التحميل (0.1٪ حمض الفورميك) لمدة 10 دقائق بمعدل تدفق 2 ميكرولتر / دقيقة.
- انقل الببتيدات إلى عمود تحليلي C18 رقاقة وقم بإخراجها بمعدل تدفق 300 نانولتر / دقيقة مع تدرج 3 ساعات باستخدام المرحلة المتنقلة A (2٪ أسيتونيتريل ، 0.1٪ حمض الفورميك) و B (98٪ أسيتونيتريل ، 0.1٪ حمض الفورميك). تتكون خطوة الشطف الأولى من تدرج خطي من 5٪ B إلى 35٪ B على مدى 80 دقيقة.
- قم بتكثيف المرحلة المتنقلة B إلى 80٪ خلال 5 دقائق ، ثم حافظ على المرحلة المتنقلة B عند 80٪ لمدة 8 دقائق قبل التغيير إلى 5٪ B لإعادة توازن العمود لمدة 25 دقيقة.
- قم بإعداد طريقة أداة MS ل DDA وحدد معلمات الأداة على النحو التالي.
- استخدم المعلمات التالية للتجربة 1: مسح أيون السليفة MS1 من m / z 400-1500 (وقت تراكم 250 مللي ثانية) ؛ تعيين عتبة الشدة لتشغيل عمليات مسح MS / MS لأيونات حالات الشحن من 2-5 إلى 200 عدد ؛ اضبط الاستبعاد الديناميكي لأيونات السلائف على 60 ثانية).
- استخدم المعلمات التالية للتجربة 2: عمليات المسح الأيوني لمنتج MS / MS مع نطاق مسح MS2 من 100 إلى 1500 (زمن تراكم 100 مللي ثانية لكل من عمليات المسح الأيوني البالغ عددها 30 منتجا لكل دورة) ؛ اضبط انتشار طاقة الاصطدام على CES = 5 ، وحدد "وضع المسح الأيوني عالي الحساسية للمنتج".
ملاحظة: يتم استخدام طريقة اكتساب DDA لبناء مكتبات طيفية كما هو موضح في الخطوة 6.3 (انظر أدناه). هنا ، ستكتسب أطياف MS / MS لأكثر 30 أيونات سلائف وفرة بعد كل فحص MS1 لكل دورة ؛ إجمالي وقت الدورة حوالي 3.3 ثانية.
- احصل على DIA. قم بإعداد طريقة أداة MS ل DIA وحدد المعلمات الآلية على النحو التالي.
- استخدم المعلمات التالية للتجربة 1: مسح أيون السليفة MS1 من m/z 400-1250 (زمن التراكم 250 مللي ثانية).
- استخدام المعلمات التالية للتجربة 2: عمليات المسح الأيوني لمنتج MS/MS ل 64 مقطعا متغيرا من مقاطع SWATH مع نطاق مسح MS2 من m/z 100-1500 (زمن تراكم 45 مللي ثانية لكل من عمليات المسح الأيوني البالغ عددها 64 منتجا لكل دورة)؛ اضبط انتشار طاقة الاصطدام على CES = 10 ، وحدد "وضع المسح الأيوني عالي الحساسية للمنتج".
ملاحظة: استخدم طريقة اكتساب DIA / SWATH ذات 64 متغيرا كما هو موضح من قبل Schilling et al.13 لإجراء القياس الكمي الخالي من الملصقات مع إجمالي وقت دورة يبلغ حوالي 3.2 ثانية. وبالنسبة لاكتساب DDA، بدلا من استخدام رباعي الأقطاب Q1 لإرسال أيون سلائف لنطاق كتلة ضيق إلى خلية التصادم، يستخدم نطاق من عرض النافذة المتغير (على سبيل المثال m/z 5-90) للخطوة تدريجيا فوق المدى الكامل m/z (m/z 400-1250) مع 64 مقطعا SWATH، ووقت تراكم 45 مللي ثانية لكل جزء، مما ينتج عنه وقت دورة يبلغ 3.2 ثانية ، والذي يتضمن مسح MS1 واحد مع وقت تراكم 250 مللي ثانية. يتم ضبط عرض النافذة المتغير وفقا لتعقيد تيار أيون MS1 النموذجي الذي لوحظ ضمن نطاق معين m / z باستخدام خوارزمية SCIEX "حاسبة النافذة المتغيرة"13 (يتم تطبيق النوافذ الأضيق على نطاقات m / z "مشغولة" ، ويتم تطبيق نوافذ أوسع على نطاقات m / z مع عدد قليل من أيونات السلائف المسطحة). على منصات MS الأخرى ، يمكن أيضا تنفيذ استراتيجيات اختيار نافذة DIA البديلة.
6. تحليل البيانات
ملاحظة: يجب أن تكون إعدادات تحليل البيانات المعينة مصممة وفقا لظروف تجريبية محددة. على سبيل المثال ، ستعتمد قاعدة بيانات البروتين (ملف fasta) المحددة على الأنواع التي تم تحضير العينة منها (في هذا البروتوكول استخدمنا C. ايليجانس).
- استخدم محرك بحث قاعدة بيانات MS لتحليل عمليات الاستحواذ على DDA وتحديد البروتينات. قم بإنشاء طريقة محرك بحث darabase على النحو التالي:
- للحصول على معلمات وصف العينة ، حدد تحديد الهوية. ضمن نوع العينة ، حدد حمض اليودوأسيتيك ؛ تحت الألكلة السيستين ، حدد التربسين ؛ تحت الهضم (بافتراض انقسام [ك-ترمين] في ليسين وأرجينين), حدد الاسم من ال [مكس] مطياف كتلة تحت أداة; وحدد Caenorhabditis elegans ضمن الأنواع.
- للحصول على معلمات معالجة محددة ، تحقق من التعديلات البيولوجية ؛ ضمن تركيز المعرف، حدد SwissProt؛ ضمن قاعدة البيانات ، تحقق من معرف شامل ؛ ضمن جهد البحث، حدد 0.05 (10٪) ضمن عتبة البروتين المكتشف؛ وتحقق من تشغيل تحليل معدل الاكتشاف الخاطئ ضمن جودة النتائج. احفظ طريقة محرك البحث وأرسل ملفات MS الأولية إلى محرك بحث قاعدة البيانات للمعالجة ، باستخدام الطريقة التي تم إنشاؤها.
ملاحظة: في عملية تكرارية، تمت إعادة معايرة جميع عمليات فحص MS و MS/MS تلقائيا بواسطة محرك البحث بناء على التعليقات التوضيحية والنتائج الأولية.
- انقر فوق تصدير ملخص الببتيد عند الانتهاء من البحث وقم بتصفية جميع نتائج تحديد الببتيد حسب عتبة الثقة 99 في Excel (معدل الاكتشاف الخاطئ (FDR) = 1٪).
- قم ببناء مكتبات طيفية MS / MS لمزيد من المعالجة لملف البيانات الأولية DIA ، ولمزيد من القياس الكمي للبيانات النسبية.
- افتح برنامج التحليل الكمي DIA. حدد علامة التبويب المكتبة ثم (في أسفل الصفحة) انقر فوق إنشاء مكتبة طيفية من "محرك بحث قاعدة البيانات" وافتح تقرير FDR "محرك بحث قاعدة البيانات" (ملف جدول البيانات * FDR.xlsx) الذي تم إنشاؤه تلقائيا كجزء من عملية البحث في قاعدة بيانات ملف البيانات الأولية DDA.
- انقر فوق التالي، وحدد مخطط إعدادات المكتبة وانقر فوق التالي. حدد Uniprot_Caenorhabditis elegans _proteome كقاعدة بيانات ثم انقر فوق إنهاء ، سيتم إنشاء المكتبة الطيفية.
- استخدم برنامج التحليل الكمي DIA لتحليل عمليات الاستحواذ على DIA لقياس البروتين النسبي الشامل. يتم وصف خط أنابيب تحليل بيانات DIA على النحو التالي.
- لتحليل الببتيدات وتحديدها كميا ، افتح برنامج التحليل الكمي DIA لإعداد مخطط تحليل باستخدام مخطط القالب. يتوفر مخطط القالب في البرنامج بالنقر فوق الإعدادات ، ثم تحليل DIA ، وأخيرا إعدادات مصنع BGS.
- قم بإعداد المعلمات في مخطط القالب على النحو التالي:
1) تحت تحديد تحديد توطين PTM (قطع الاحتمال = 0.75).
2) ضمن القياس الكمي، حدد كمية المجموعة الرئيسية ككمية الببتيد المجمعة، وقم بإعداد المجموعة الرئيسية N كحد أقصى 7 والحد الأدنى 1، وحدد كمية المجموعة الثانوية ككمية مقدمة المجمع، وقم بإعداد المجموعة الثانوية N كحد أقصى 10 والحد الأدنى 1، وحدد تصفية البيانات على أنها Qvalue متناثرة ولا تحدد تسوية التشغيل المتقاطع.
- إجراء تحليل القياس الكمي النسبي.
- حدد علامة التبويب خط أنابيب ، انقر فوق إعداد تحليل DIA من ملف ، وافتح ملفات MS DIA الأولية ذات الأهمية (على سبيل المثال: العينة والتحكم) ، انقر فوق تعيين مكتبة طيفية ، وحدد المكتبة التي تم إنشاؤها في 6.3 ، انقر فوق تحميل ، وأخيرا انقر فوق التالي.
- حدد مخطط التحليل الذي تم إعداده في 6.5.1 وانقر فوق التالي. حدد ملف قاعدة البيانات المناسب fasta (في هذا البروتوكول: Uniprot_Caenorhabditis elegans_proteome) وانقر فوق التالي. حدد إعداد الشرط، وقم بتعيين الشروط المختلفة وفقا للعينات وانقر فوق التالي.
- راجع نظرة عامة على التحليل (ملخص إعداد التجربة) واستعرض وصولا إلى دليل الإخراج وانقر فوق إنهاء. أخيرا ، انقر فوق تشغيل خط أنابيب لإجراء التحليل الكمي الخالي من التسميات.
ملاحظة: تقوم الوحدات الإحصائية في "برنامج التحليل الكمي DIA" تلقائيا بإجراء تحليل FDR ، وإنشاء خرائط حرارية ومخططات براكين تقارن الظروف المختلفة ، وإنشاء قوائم بالببتيدات والبروتينات المحددة والكمية وتوفير قيم Q جنبا إلى جنب مع تغييرات الطيات النسبية مقارنة الظروف المختلفة. تضمنت ظروف العينة هنا الديدان المسنة في اليوم 10 مع اثنين من التكرارات البيولوجية والديدان الصغيرة في اليوم 2 مع اثنين من التكرارات البيولوجية كمراقبة.
النتائج
طرق تحلل الديدان التقليدية لها عيوب مختلفة. على سبيل المثال ، تنتج طرق الصوتنة القائمة على المسبار وضرب الخرز حرارة زائدة عن طريق السماح بملامسة الطرف المعدني أو الخرز مباشرة مع العينات ، مما يؤدي إلى استعادة البروتين المتغير وتمسخ البروتين. طحن النيتروجين السائل متبوعا بالصوتنة في عازلة التحلل ، يمكن أن يستغرق وقتا طويلا ويتطلب عددا كبيرا من الديدان. نظرا لقيود طرق تحلل الديدان التقليدية ، فإن تدفقات عمل MS السابقة ، مثل طرق وضع العلامات iTRAQ أو الطرق الخالية من الملصقات التي تم استخدامها تاريخيا في C. ايليجانس نظام النموذج للحصول على معلومات كمية حول insolublome ، تتطلب مدخلات كبيرة من المواد الأولية (40,000 دودة على الأقل). مطلوب عمل شاق لزراعة الديدان للحصول على هذه الأعداد من الديدان. علاوة على ذلك ، تتطلب طرق وضع العلامات ملصقات كيميائية متساوية الضغط باهظة الثمن. تعد طرق القياس الكمي الخالية من الملصقات فعالة من حيث التكلفة ولها طرق أسهل وأكثر وضوحا لإعداد العينات ووضع العلامات عليها ، ولكنها تتطلب أعدادا كبيرة بكثير من الديدان لتحقيق تغطية كافية لتحليل مرض التصلب العصبي المتعدد.
يزيد جهاز الصوتنة الذي استخدمناه بشكل كبير من كفاءة وقابلية استنساخ تحلل الدودة عن طريق تحلل عينات متعددة من الدودة في وقت واحد في جهاز صوتي لحمام مائي يتم التحكم في درجة حرارته دون تلوث متبادل14 ، وبالتالي تقليل كمية مادة الدودة المطلوبة بشكل كبير. من خلال الجمع بين طريقة صوتنة عالية الكفاءة ونهج التصلب العصبي المتعدد الخالي من الملصقات DIA الكمي ، تمكنا من تحديد كمية الديدان المسنة والصغيرة بقوة باستخدام ~ 3,000 دودة. هنا اختبرنا والتحقق من صحة كفاءة البروتوكول وقارنا insolublome للديدان المسنة والشابة من سلالة دودة من النوع البري ، N2-Bristol C. elegans. قمنا بتطبيق هذا البروتوكول لاستخراج وعزل insolulublome من ~ 3,000 N2 C . ايليجانس من العمر والشباب (مكرران بيولوجيان لكل حالة) ، متبوعا بتحليل MS باستخدام مطياف كتلة وقت الطيران رباعي الأقطاب أو أنظمة MS الأخرى باستخدام مزيج من الاستحواذ المعتمد على البيانات (DDA) والاستحواذ المستقل عن البيانات (DIA / SWATH) لتحديد البروتين وقياسه الكمي. تم تحليل البروتينات غير القابلة للذوبان لأول مرة على هلام متدرج Bis-Tris 4-12٪ لتحديد كمية البروتين في كل عينة من عينة insolublome. كما هو موضح في الشكل 2 ، فإن عينة insolublome من N2 الديدان العمرية (الممرات 2 و 3 ، تجارب التكرار البيولوجي) تحتوي على بروتين أكثر بكثير من عينات من الديدان الصغيرة N2 (الممران 1 و 4 ، تجارب التكرار البيولوجي).
بعد الهضم داخل الهلام ، تم تحليل ملامح البروتين في insolublome بواسطة HPLC-MS. باستخدام سير العمل هذا ، يمكننا بشكل عام تحديد 1000-1500 بروتين وتحديد 500-1,000 بروتين من الجزء غير القابل للذوبان في SDS مع قابلية عالية للتكاثر (بيانات غير منشورة). هنا تمكنا من تحديد 989 بروتينا من insolublome ل N2-Bristol C. ايليجانس من خلال تحليل بيانات DIA وإزالة التكرار: تم إثراء 768 بروتينا بشكل كبير وانخفض 27 بروتينا بشكل ملحوظ في insolublome لدودة N2 المسنة (اليوم 10) مقارنة بالشباب (اليوم 2) باستخدام تغيير أضعاف لا يقل عن 1.5 وقيمة Q أقل من 0.01 (الشكل 3 أ). كما هو موضح في مخطط الرسم البياني (الشكل 3 ب) ، يظهر تغيير الطية للبروتينات المتغيرة بشكل كبير توزيعا طبيعيا. ثبت أن الديدان القديمة مخصبة بشكل كبير للديدان الصغيرة: أظهر التغيير الأكبر الذي لوحظ أن وفرة البروتين النسبية في insolublome أعلى بمقدار 592 مرة في الديدان القديمة مقابل الديدان الصغيرة. وبالنسبة ل 32 بروتينا ، كانت وفرة البروتين النسبية في insolublome أعلى ب >250 مرة في الديدان القديمة مقابل الديدان الصغيرة ، مما يشير إلى تغيرات جذرية مع تقدم العمر.
بعد استخراج قائمة البروتينات غير القابلة للذوبان التي تزداد بشكل كبير في الديدان القديمة وتم تحديدها بواسطة القاعدة الدودية (WS271) ، تم إجراء مسار KEGG وتحليل الأنطولوجيا الجينية (GO) لتحديد المسارات التي يتم إثرائها في insolublome المسن لاكتساب رؤى بيولوجية حول كيفية ارتباطها بالشيخوخة. يظهر تحليل مسار KEGG للبروتينات المحددة في هذه الدراسة إثراء العديد من المسارات التي تشمل الريبوسومات والميتوكوندريا والبروتيازوم والسبليسيوسوم (الشكل 4 أ). يظهر تحليل الأنطولوجيا الجينية أن insolublome من الديدان القديمة يتكون من العديد من البروتينات في فئات معينة بما في ذلك الميتوكوندريا ، والتنموي ، ومحددات عمر البالغين ، والبروتينات الريبوزومية (الشكل 4 ب والجدول التكميلي 1 أ). ثم قارنا قائمة البروتينات المحددة في هذه الدراسة بالعمل المنشور سابقا من David et al.2 و Mark et al.11 كما هو موضح في مخططات Venn (الشكل 5أ ، 5 ب). أظهرت المقارنة تداخلا كبيرا بين البروتينات المحددة 394/721 و 444/721 مع ديفيد وآخرون (الشكل 5 أ) ومارك وآخرون (الشكل 5 ب) دراسة ، على التوالي. كما تم تحديد المسارات البيولوجية التي كشفها تحليل KEGG ل insolublome من هذه الدراسة في الماضي وبالتالي التحقق من صحة منهجيتنا (الجدول التكميلي 1 ب). يشير تحديد هذه المسارات والبروتينات إلى أنها قد تكون بمثابة مرشحين لمزيد من التحقيقات البيولوجية فيما يتعلق بوظيفتها في سياق الشيخوخة.
باختصار ، يتيح استخدام طريقة الصوتنة الفعالة تحلل عينات ديدانية متعددة في نفس الوقت في بيئة ذات درجات حرارة يتم التحكم فيها جيدا وتقليل التلوث المتبادل لتحقيق تغطية عالية للبروتين مع مواد دودة أقل بكثير. أدى الجمع بين طريقة الصوتنة الفعالة مع سير عمل القياس الكمي للبروتين الخالي من الملصقات DIA إلى توفير نتائج موثوقة وقابلة للتكرار للقياس الكمي لبروتينات الدودة غير القابلة للذوبان.

الشكل 1. سير العمل التجريبي للبروتوكول. C. ايليجانس تم استزراعها وجمعها في أيام مختلفة. بعد تحلل الديدان باستخدام مكبر صوتي ، تم استخراج جزء البروتين غير القابل للذوبان بنسبة 1٪ SDS (insolublome) وعزله من المحلل. ثم تم هضم insolublome عن طريق هضم التربسين داخل الهلام وقياسه كميا عن طريق قياس الطيف الكتلي DIA ، متبوعا بتحليل المعلوماتية الحيوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
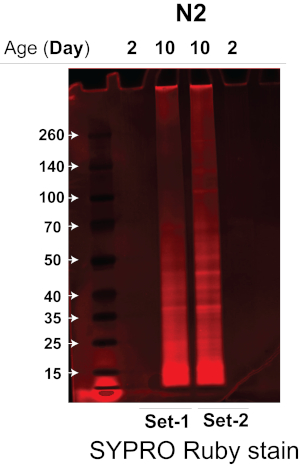
الشكل 2. جل SDS-PAGE من الديدان الصغيرة المعزولة مقابل الديدان القديمة من سلالة N2-Bristol. تم تحليل الزيوت غير القابلة للذوبان للديدان الصغيرة مقابل الديدان القديمة من سلالة N2-Bristol بواسطة SDS-PAGE لتحديد كمية البروتين الموجودة. تم تلطيخ جل SDS-PAGE بصبغة بروتين الفلورسنت لتصور نطاقات البروتين. الممرات 1 و 4: Insolublome من تجربتين بيولوجيتين مكررتين لديدان N2 الصغيرة (اليوم 2). الممرات 2 و 3: Insolublome من تجربتين بيولوجيتين مكررتين لديدان N2 المسنة (اليوم 10). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3. تم تحديد البروتين المرشح على أنه يظهر تغيرا كبيرا في المسنين مقابل الشباب وتوزيعات تغيير الطيات. (أ) مؤامرة بركان لقياس عدم الذوبان بين الديدان المسنة مقابل الديدان N2-Bristol الصغيرة. يتم عرض المرشحين الذين لديهم تغيير الطية المطلق > = 1.5 وقيمة Q <0.01 كنقاط حمراء. (ب) مخطط الرسم البياني لتوزيع تغيير الطيات للبروتينات غير القابلة للذوبان في SDS المخصب بشكل كبير في عينات الديدان المسنة مقابل عينات الديدان الصغيرة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4. مسار KEGG وتحليل الأنطولوجيا الجينية (GO). (أ) تحليل مسار KEGG لليوم 10 مرتبة وفقا لقيمة p مع مسار مهم للغاية موضح في الأعلى. (ب) يظهر تحليل الأنطولوجيا الجينية أن insolublome للديدان المسنة يتم إثرائه للعديد من البروتينات في فئات معينة بما في ذلك الميتوكوندريا ، والتنموي ، ومحددات عمر البالغين ، والبروتينات الريبوزومية. يصور عرض المخطط المبعثر مصطلحات GO في "مساحة دلالية" حيث يتم وضع المصطلحات الأكثر تشابها بالقرب من بعضها البعض. يعكس لون الفقاعة قيمة p التي تم الحصول عليها في تحليل STRING ، بينما يعكس حجمها عمومية مصطلح GO في قاعدة بيانات UniProt-GOA. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5. تم تحديد تداخل بروتين Insolublome في اليوم 10 insolublome مقارنة هذه الدراسة بدراسات (A) David et al.2 و (B) Mark et al.11 . الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي 1 (يتعلق بالشكل 4 والشكل 5). (أ) علم الوجود الجيني (العملية البيولوجية) الذي تم تحليله باستخدام قاعدة بيانات STRING. (ب) قائمة مفصلة بالبروتينات ومسارات KEGG المحددة في هذه الدراسة مع رموز الألوان التي تصور تداخلها مع العمل المنشور. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
في هذا البروتوكول ، أبلغنا عن طريقة محسنة لتحضير العينة لاستخراج البروتينات غير القابلة للذوبان من C. ايليجانس. من خلال استبدال تحلل الديدان التقليدي (على سبيل المثال ، تقنيات صوتنة التحقيق أو مضرب الخرز) بمكبر الصوت الفعال ، قمنا بزيادة غلة استخراج البروتين غير القابل للذوبان وخفضنا عدد الديدان اللازمة لتحليل MS الخالي من الملصقات من 40,000 دودة إلى 3,000 دودة. تم استخدام محرك بحث في قاعدة البيانات لتحديد البروتين من بيانات DDA و C. ايليجانس تم بناء المكتبة الطيفية باستخدام "برنامج التحليل الكمي DIA" ونتائج البحث في قاعدة بيانات DDA المقابلة (استيراد تقارير ملف FDR التي تم إنشاؤها بواسطة محرك بحث قاعدة البيانات). القياس الكمي النسبي لكبار السن والشباب C. ايليجانس تم إجراء بيانات insolublome باستخدام "برنامج التحليل الكمي DIA" لمعالجة مجموعة بيانات DIA الجديدة والمكتبة الطيفية التي تم إنشاؤها.
هناك عدة خطوات حاسمة في البروتوكول. العمر القصير ل C. ايليجانس يجعله نظاما مثاليا لدراسة الشيخوخة ، مقارنة بحقيقيات النوى الأخرى مثل خلايا الثدييات ، ولكن من الضروري عزل مجموعة متجانسة من الديدان عند دراسة الظواهر المرتبطة بالشيخوخة. تم استخدام FUDR في هذا البروتوكول للحصول على ديدان الشيخوخة المتزامنة. من المهم نقل الديدان في وقت مبكر من مرحلة L4 إلى صفيحة بذور NGM التي تحتوي على FUDR لضمان فعاليتها. أثناء تحلل الدودة باستخدام مكبر الصوت الفعال ، يجب ضبط درجة حرارة الحمام المائي على 4 درجات مئوية والصوتنة عند 30 ثانية ON و 30 ثانية OFF لمنع ارتفاع درجة حرارة العينات. بعد الجولة الأولى من الصوتنة لمدة 10 دورات (10 دقائق) ، من المهم التحقق تحت المجهر للتأكد من أن جميع الديدان قد تم تحللها بكفاءة. إذا لم يكن الأمر كذلك ، فهناك حاجة إلى المزيد من دورات الصوتنة. أثناء عملية الهضم داخل الهلام ، يجب تقطيع كل شريحة هلامية إلى قطع بالحجم المناسب (<1 مم2) - إذا كانت صغيرة جدا ، فقد تضيع في عملية تحضير العينة ، وإذا كانت كبيرة جدا ، فقد يكون الهضم غير كاف.
إن الحاجة إلى مواد أولية أقل بكثير تقلل بشكل كبير من العمل الشاق المرتبط بزراعة الديدان للحصول على عينات لتحليلات insolubolome. ومع ذلك ، فإن استخراج وعزل جزء البروتين غير القابل للذوبان بنسبة 1٪ SDS ينطوي على خطوات غسيل متعددة ومطلوب معالجة دقيقة للعينات لتجنب فقدان العينة وضمان نتائج قابلة للتكرار. كمية المواد المتولدة لتحليل التصلب العصبي المتعدد كافية ل ~ 3 حقن لتحليل DDA و DIA اللاحق ولكن ليس لحفظها للتجارب المستقبلية. علاوة على ذلك ، على الرغم من آثاره المربكةالمحتملة 15 ، استخدمنا أقل تركيز ممكن من FUdR لتعقيم الديدان أثناء عملية الشيخوخة. قد تتحايل الدراسات المستقبلية على استخدام FUdR باستخدام طفرات معقمة أو عن طريق نقل الديدان وجمعها يدويا.
يسمح استخدام مكبر الصوت عالي الكفاءة لتحلل الديدان باستخراج فعال للإنسولوبلوم مما يسمح بتغطية جيدة للبروتين وتحليل DIA MS الخالي من الملصقات الفعال من حيث التكلفة لتحديد كمية insolublome باستخدام عدد أقل بكثير من الديدان. إنه يقلل بشكل كبير من عبء العمل مما يسمح بفحص المزيد من الظروف لكل تجربة. بالإضافة إلى ذلك ، فإن سير عمل MS DIA الخالي من الملصقات فعال من حيث التكلفة ويوفر عمقا للبروتين وتغطية بمستويات مماثلة لطرق وضع العلامات بما في ذلك iTRAQ أو TMT أو SILAC. نموذج C. ايليجانس هو نظام فحص سريع لأبحاث الشيخوخة. يمكن تعديل سير العمل وتطبيقه بسهولة لدراسة أبحاث الشيخوخة والأمراض المرتبطة بالعمر في هذا الكائنات الحية وغيرها. على سبيل المثال ، في الدراسات الجارية ، نطبق سير العمل هذا للتحقيق في ملامح البروتين من insolublome و proteostasis في مختلف نماذج C . ايليجانس لمرض الزهايمر (AD) بما في ذلك ديدان Abta و tau و Abeta / tau المزدوجة مع أو بدون تدخلات دوائية مختلفة لفحص الأدوية عالية الإنتاجية في المستقبل.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من خلال منحة الأجهزة المشتركة من المعاهد الوطنية للصحة لنظام TripleTOF (1S10 OD016281 ، معهد باك) ، ومنحة المعاهد الوطنية للصحة ، و RF1 AG057358 (GJL ، JKA) و U01AG045844 منح المعاهد الوطنية للصحة (GJL). XX مدعوم بزمالة ما بعد الدكتوراه T32 (منحة المعاهد الوطنية للصحة 5T32AG000266 ، PI: جوديث كامبيسي وليزا إليربي). MC مدعومة بزمالة ما بعد الدكتوراه من مؤسسة Larry L. Hillblom.
Materials
| Name | Company | Catalog Number | Comments |
| Strains used | |||
| Esherichia coli OP50 | Caenorhabditis Genetics Center (CGC) | ||
| N2 (Bristol) | Caenorhabditis Genetics Center (CGC) | ||
| Buffer/Solution | |||
| NGM (Nematode Growth Media) | Recipe: 3 g/L NaCl, 23 g/L agar; 2.5 g/L peptone; 1 mM CaCl2, 5 mg/L cholesterol, 1 mM MgSO4, 25 mM KH2PO4 | ||
| S-basal solution | Recipe: 5.85 g/L NaCl, 1g/L K2HPO4, 6 g/L KH2PO4, H2O to 1 L | ||
| Sodium hypochlorite bleach solution | Recipe: Mix 0.5 mL 5 N NaOH with 1 ml Sodium hypochlorite (5%) and make volume to 5 mL with H20. | ||
| Material/ Equipment | |||
| Agar | Difco Granulated Agar, BD Biosciences | 90000-782 | |
| Bioruptor Plus sonication device | Diagenode, USA | B01020001 | |
| Cholesterol | Sigma | c8503 | |
| 2'-deoxy-5-fluorouridine | VWR | TCD2235 | |
| Glycerol | Millipore Sigma | 356350-1000ML | |
| LB broth, Miller | Millipore Sigma | 60801-450 | |
| Sodium dodecyl sulfate (SDS? | Sigma | L4509-250G | |
| Sodium chloride | Sigma | 59888 | |
| M880 Ultrasonic bath, 117 V, holds 5.5 gallons | VWR, USA | 89375-458 | |
| Magnesium sulphate | Sigma | M506 | |
| Magnesium chloride | Sigma | 208337 | |
| NGM agar plate | VWR Disposable Petri Dishes | 25384-342 | |
| NuPAGE LDS Sample Buffer (4X) | Thermo Fisher Scientific | NP0007 | |
| NuPAGE protein gels, 4-12% | Invitrogen | NP 0335BOX | |
| Protease inhibiotr cocktail (PIC) | Roche | 11836170001 | |
| Pierce BCA Assay | Thermo Fisher Scientific | 23225 | |
| Sodium hypochlorite 5% | VWR | JT9416-1 | |
| SYPRO Ruby Protein Gel Stain | Thermo Fisher Scientific | S12000 | |
| MS Section | |||
| Acetonitrile, Burdick and Jackson LC-MS | Honeywell International Inc., Charlotte, NC, USA | 36XL66 | |
| Agilent Zorbax 300Extend C18 column | Agilent Technologies Inc., Santa Clara, CA, USA | 770995-902 | |
| Ammonium bicarbonate | Sigma Aldrich, St. Louis, MO, USA | 9830 (1 kg) | |
| Dithiothreitol (DTT) | Sigma Aldrich, St. Louis, MO, USA | D9779-5G | |
| Eppendorf Thermomixer Compact | Eppendorf AG, Hamburg, Germany | T1317-1EA | |
| Formic acid | Sigma Aldrich, St. Louis, MO, USA | F0507-500ML | |
| Indexed retention time (iRT) normalization peptide standard | Biognosys AG, Schlieren, Zurich, Switzerland | Ki-3002-2 | |
| Iodoacetamide (IAA) | Sigma Aldrich, St. Louis, MO, USA | I1149-25G | |
| Methanol, HPLC Grade | Honeywell International Inc., Charlotte, NC, USA | 34885 | |
| Nano cHiPLC Trap ChromXP C18-CL, 200 um x 6 mm, 3 um, 120A. (pre-column chip) (200 um x 6 mm ChromXP C18-CL chip, 3 um, 300 A) | Sciex LLC, Framingham, MA, USA | 804-00006 | |
| Nano cHiPLC ChromXP 75 um by 15cm, C18-CL, 3 um, 120 A (analytical column chip) | Sciex LLC, Framingham, MA, USA | 804-00001 | |
| Orthoganol quadrupole time-of-flight (QqTOF) TripleTOP 6600 mass spectrometer | Sciex LLC, Framingham, MA, USA | Per quote | |
| ProteinPilot 5.0 | Sciex LLC, Framingham, MA, USA | software download Sciex | |
| Savant SPD131DDA Speedvac Concentrator | Thermo Fisher Scientific, Waltham, MA, USA | SPD131DDA-115 | |
| Sequencing-grade lyophilized trypsin | Life Technologies | 23225 | |
| Spectronaut | Biognosys AG, Schlieren, Zurich, Switzerland | Sw-3001 | |
| SWATH 2.0 plugin into PeakView 2.2 | Sciex LLC, Framingham, MA, USA | software download Sciex | |
| Ultra Plus nano-LC 2D HPLC system | Sciex LLC, Eksigent Division, Framingham, MA, USA | Model # 845 | |
| Water, Burdick and Jackson LC-MS | Honeywell International Inc., Charlotte, NC, USA | 600-30-76 | |
| Waters 1525 binary HPLC pump system | Waters Corp., Milford, MA, USA | WAT022939 | |
| Waters 2487 Dual Wavelength UV detector | Waters Corp., Milford, MA, USA | WAT081110 | |
| Waters 717plus Autosampler | Waters Corp., Milford, MA, USA | WAT022939 | |
| Waters Fraction Collector III | Waters Corp., Milford, MA, USA | 186001878 |
References
- Walther, D. M., et al. Widespread Proteome Remodeling and Aggregation in Aging C. elegans. Cell. , 919-932 (2015).
- David, D. C., et al. Widespread protein aggregation as an inherent part of aging in C. elegans. PLoS Biology. 8 (8), 47-48 (2010).
- Labbadia, J., Morimoto, R. I. The Biology of Proteostasis in Aging and Disease. Annual Review of Biochemistry. (1), 435-464 (2013).
- Ross, C. A., Poirier, M. A. Protein aggregation and neurodegenerative disease. Nature Medicine. , 10-17 (2004).
- Reis-Rodrigues, P., et al. Proteomic analysis of age-dependent changes in protein solubility identifies genes that modulate lifespan. Aging Cell. 11 (1), 120-127 (2012).
- Ayyadevara, S., et al. Proteins that accumulate with age in human skeletal-muscle aggregates contribute to declines in muscle mass and function in Caenorhabditis elegans. Aging. 8 (12), 3486-3497 (2016).
- Huang, C., et al. Intrinsically aggregation-prone proteins form amyloid-like aggregates and contribute to tissue aging in Caenorhabditis elegans. eLife. 8, (2019).
- Morimoto, R. I. Proteotoxic stress and inducible chaperone networks in neurodegenerative disease and aging. Genes and Development. 22 (11), 1427-1438 (2008).
- Morimoto, R. I., Cuervo, A. M. Protein homeostasis and aging: Taking care of proteins from the cradle to the grave. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 64 (2), 167-170 (2009).
- Klang, I. M., et al. Iron promotes protein insolubility and aging in C. elegans. Aging. 6 (11), 975-991 (2014).
- Mark, K. A., et al. Vitamin D Promotes Protein Homeostasis and Longevity via the Stress Response Pathway Genes skn-1, ire-1, and xbp-1. Cell Reports. 17 (5), 1227-1237 (2016).
- Groh, N., et al. Methods to study changes in inherent protein aggregation with age in caenorhabditis elegans. Journal of Visualized Experiments. (129), 1-12 (2017).
- Schilling, B., Gibson, B. W., Hunter, C. L. Generation of High-Quality SWATH((R)) Acquisition Data for Label-free Quantitative Proteomics Studies Using TripleTOF((R)) Mass Spectrometers. Proteomics: Methods and Protocols, Methods in Molecular Biology. 1550, 223-233 (2017).
- Walther, D. M., et al. Widespread proteome remodeling and aggregation in aging C. elegans. Cell. 161 (4), 919-932 (2015).
- Angeli, S., et al. A DNA synthesis inhibitor is protective against proteotoxic stressors via modulation of fertility pathways in Caenorhabditis elegans. Aging. 5 (10), 759-769 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved