Method Article
Шпатель Монтевидео Аппарат для витрификации эмбрионов млекопитающих
В этой статье
Резюме
Здесь мы представляем протокол Spatula Montevideo для витрификации предимплантационных эмбрионов мышей и овец, состоящий из самодельного шпателя и использования домашних растворов. Эмбрионы быстро уравновешиваются в двух растворах криопротекторов возрастающей концентрации, загружаются на шпатель, погружаются в жидкий азот и, наконец, запечатываются соломинкой объемом 0,5 мл.
Аннотация
В этом исследовании описывается эффективный и экономичный метод витрификации для криоконсервации эмбрионов мышей и овец, известный как Spatula Montevideo (MVD). В этом протоколе в качестве несущего устройства используется самодельный шпатель, который подготавливается с помощью наконечника для загрузчика геля. Эмбрионы быстро уравновешиваются в двух домашних растворах криопротектора возрастающей концентрации, загружаются в шпатель, а затем непосредственно погружаются в жидкий азот. Примерно 30-40 эмбрионов мышей на предимплантационной стадии могут быть загружены на шпатель, который впоследствии запечатывается соломинкой объемом 0,5 мл. Использование шпателей вместо криопробирок, которые часто используются для хранения витрифицированных эмбрионов, оптимизирует пространство в сосудах с жидким азотом. Кроме того, для процесса согревания требуется только домашний раствор сахарозы в уменьшающейся концентрации для регидратации эмбрионов и восстановления их морфологии. Наша лаборатория уже более 10 лет успешно использует шпатель Монтевидео для предимплантационных эмбрионов мышей и овец. Шпатель Монтевидео продемонстрировал среднюю скорость восстановления (восстановленные/витрифицированные эмбрионы) 84% и выживаемость (жизнеспособные/восстановленные эмбрионы) 97% у эмбрионов мышей. Витрификация эмбрионов мышей дала лучшие результаты, чем медленное замораживание, хотя никаких различий в репродуктивных исходах (беременность, роды и рождаемость) не наблюдалось. У эмбрионов овец были достигнуты аналогичные показатели выживаемости и развития эмбрионов с помощью Spatula Montevideo по сравнению с коммерческим устройством. Хотя частота наступления беременности была выше для коммерческого устройства, выживаемость ягнят существенно не отличалась между устройствами. Метод витрификации Монтевидео — это простой метод криоконсервации, который может быть использован для хранения излишков эмбрионов, резервного копирования генетически модифицированных линий мышей и моделей овец, а также для облегчения обмена ими между исследователями по всему миру.
Введение
Эффективность получения генетически модифицированных (ГМ) животных значительно возросла благодаря развитию методов на основе эндонуклеазы, в частности CRISPR/Cas9. Многие лаборатории по всему миру производят различные линии ГМ-мышей и крыс, которые должны быть криоконсервированы, чтобы предотвратить генетический дрейф и сохранить целостность исходного фенотипа1. Кроме того, архивирование устраняет необходимость в постоянном разведении, что часто приводит к чрезмерной численности животных. Некоторые лаборатории отправляют линии ГМ-мышей в виде криоконсервированных эмбрионов или спермы в международные репозитории, облегчая обмен этими моделями и избегая транспортировки живых животных. Это обеспечивает доступ к линиям без повторяющейся генерации идентичных моделей животных GM2. По этим причинам криоконсервация эмбрионов и спермы имеет первостепенное значение в любом предприятии по выращиванию генетически модифицированных животных. Как правило, криоконсервация эмбрионов предпочтительна для хранения линий ГМ, поскольку эмбрионы содержат полный диплоидный геном с модификациями и могут быть легко восстановлены путем переноса эмбрионов.
Витрификация – это неравновесный процесс, характеризующийся дисбалансом между водой, поступающей в клетку, и водой, образующей вокруг нее внеклеточные кристаллы. Этот метод предотвращает образование внутриклеточных кристаллов льда, в отличие его от метода медленного замораживания (SLF)3 (см. рис. 1). Высокая концентрация криопротекторов и прямой контакт с жидким азотом (LN2) обеспечивают сверхбыстрое охлаждение (~40 °C/с), достигая стекловидного состояния образцов в течение нескольких секунд. Более того, витрификация быстрее, проще и дешевле, чем медленное замораживание4. Он требует минимального LN2 и, как правило, использует простое оборудование, которое можно купить в продажеили сделать домашним 5 (см. Рисунок 1).
Кроме того, процесс нагревания, как правило, быстрый и воспроизводимый. Его следует проводить быстро, чтобы избежать токсичности криопротектора и сохранить стекловидное тело3. При замораживании эмбрионов многие лаборатории учитывают удобство устройства-носителя, его надежность, прочность, удерживающую способность и стоимость.
Для рутинной криоконсервации эмбрионов овец и мышей мы предпочитаем метод витрификации минимального объема шпателем с использованием аппарата Spatula Montevideo (MVD)6. Первоначально мы использовали метод медленной заморозки7 , но быстро перешли на витрификацию. Чтобы создать более простое и компактное устройство для LN2 dewar, мы модифицировали самодельный шпатель от Tsang and Chow (2009)8, который вставляется в криопробирку, чтобы получить шпатель MVD, который герметизируется соломинкой объемом 0,5 мл (см. Таблицу материалов). Шпатель оснащен наконечником загрузчика геля (см. Таблицу материалов), где платформа размером около 1 мм² формируется путем аккуратного плавления наконечника с помощью тонких щипцов, создавая лепесткообразную пластину для загрузки эмбрионов. Эта платформа может вместить до 40 эмбрионов мыши в небольшой капельке витрификации. Стержень для идентификационной пробки (см. Таблицу материалов) вставляется в открытый конец наконечника загрузчика геля.
Целью этого метода является витрификация эмбрионов простым, быстрым и недорогим методом, который, кроме того, экономит место в азотном дьюаре. Эта система успешно используется в течение многих лет, обеспечивая отличные показатели выживаемости эмбрионов (~97%) и репродуктивных результатов, особенно у эмбрионов мышей. Поскольку шпатель МВД готовится в лабораторных условиях, он является малозатратным методом по сравнению с коммерческими приборами9. Кроме того, это экономит место в азотном дьюаре по сравнению с использованием криопробирок 8,10.

Рисунок 1: Сравнение двух основных методов, используемых для криоконсервации эмбрионов. Этот рисунок был изменен с разрешения Crispo et al.1. Создано в BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
Животные, используемые для получения эмбрионов мышей, содержались и обрабатывались в соответствии с национальным законодательством 18.611 и международными рекомендациями по уходу за животными11. Протокол эксперимента (разрешение No #007-18) был своевременно одобрен Комитетом по уходу за животными и их использованию Institut Pasteur de Montevideo (письменное согласие). Экспериментальные протоколы для овечьих ооцитов/эмбрионов были одобрены Комитетом по институциональному уходу за животными Fundación IRAUy (протокол #001-2017), в соответствии с руководящими принципамиARRIVE12 и проводились в соответствии с международными рекомендациями по уходу за животными11.
1. Витрификация (Рисунок 2)
- Подготовка шпателя МВД
- Укоротите наконечник загрузчика геля (см. Таблицу материалов), отрезав первые 10 мм и конус наконечника.
ПРИМЕЧАНИЕ: Это создает более короткий, прямой наконечник, облегчая окончательное уплотнение соломинкой объемом 0,5 мл (см. Таблицу материалов). - Удерживайте конец наконечника загрузчика геля с помощью часовых щипцов #5 (см. Таблицу материалов) примерно в 1,0 см от наконечника. Осторожно поместите наконечник в пламя горелки Бунзена (см. Таблицу материалов) и удерживайте в течение 8-10 с, чтобы образовалась лепестковидная платформа размером примерно 1мм2.
- Снимите с пламени и крепко удерживайте щипцами в течение 5 с.
- С помощью стереомикроскопа (см. Таблицу материалов) проверьте, что лепестковидная платформа (~ 1 мм2) сформирована и дистальный край загерметизирован.
ПРИМЕЧАНИЕ: Платформа должна быть закрыта с дистального конца, чтобы предотвратить проникновение LN2 во время витрификации. Убедитесь, что платформа чистая и на ней нет пластиковых нитей. Если он слишком мал или имеет нитки, обрежьте кончик и повторите процедуру. - Повторите шаги 1.1.1-1.1.4 для подготовки необходимого количества лопаток (1 лопатка = до 40 эмбрионов мыши).
- Простерилизуйте шпатели с помощью ультрафиолетовых (УФ) лучей или окиси этилена и храните их в стерильной пробирке или коробке.
- В день остеклования извлеките лопатки, обрабатывая их с противоположного конца платформы. Вставьте идентификационный стержень (см. Таблицу материалов) в каждый шпатель и поместите его на основание стереомикроскопа. Наклейте на удилище перманентный маркер или жидкую азотостойкую наклейку.
ПРИМЕЧАНИЕ: Всегда избегайте прикосновения к платформе при работе со шпателями. Общая длина комплектного устройства (шпатель + 0,5 мл соломинки + идентификационный стержень) не должна превышать более 1 см длины бокала.
- Укоротите наконечник загрузчика геля (см. Таблицу материалов), отрезав первые 10 мм и конус наконечника.
- Приготовление растворов для остекловывания
- Приготовьте раствор ФС: растворите 1,5 г градиентной среды плотности (см. Таблицу материалов) и 0,85 г сахарозы (см. Таблицу материалов) в 5 мл фосфатно-солевого буфера (PBS; см. Таблицу материалов). Нагрейте на кипящей водяной бане до полного растворения, затем простерилизуйте с помощью фильтра 0,22 мкм (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Этот раствор можно хранить при температуре 4 °C до 6 месяцев. - Приготовьте раствор для предварительной витрификации (PV): в день витрификации смешайте 10% этиленгликоля (см. Таблицу материалов), 10% диметилсульфоксид (см. Таблицу материалов) и 80% среду M2 (см. Таблицу материалов). Общий объем 100 мкл необходим для 5 шпателей.
- Приготовьте раствор для остекловывания (V): В день остекловывания смешайте 15% этиленгликоля, 15% диметилсульфоксида, 10% М2 среды и 60% раствор FS. Общий объем 100 мкл требуется для 5 шпателей.
- Приготовьте раствор ФС: растворите 1,5 г градиентной среды плотности (см. Таблицу материалов) и 0,85 г сахарозы (см. Таблицу материалов) в 5 мл фосфатно-солевого буфера (PBS; см. Таблицу материалов). Нагрейте на кипящей водяной бане до полного растворения, затем простерилизуйте с помощью фильтра 0,22 мкм (см. Таблицу материалов).
- Процесс обезвоживания эмбрионов и витрификации
- Подготовьте LN2: Налейте LN2 в подходящую емкость (например, в изолированный контейнер из полистирола размером 10 см x 30 см x 20 см) и положите столько соломинок объемом 0,5 мл, сколько шпателей для использования.
ПРИМЕЧАНИЕ: Для облегчения визуализации платформы шпателя во время манипуляций под LN2 рекомендуется использовать контейнер из полистирола с цветным дном для создания контрастного эффекта.
ВНИМАНИЕ: Надевайте соответствующие очки и перчатки (см. Таблицу материалов) при работе с LN2. - Приготовьте растворы: На пластиковую чашку Петри диаметром 100 мм (см. Таблицу материалов) нанесите следующие капли: 100 μL M2, 20 μL раствора PV и 20 μL V раствора на каждый шпатель.
- Витрификация эмбрионов: поместите эмбрионы, подлежащие витрификации, в каплю M2. Обрабатывайте 30-40 эмбрионов за один раз, инкубируя их в капле раствора ПВ в течение 30 с, а затем в капле раствора V еще 30 с при комнатной температуре (ОТ).
- Используйте натяжной стеклянный капилляр (см. Таблицу материалов) с аспираторной трубкой в сборе (см. Таблицу материалов). Перед помещением эмбрионов предварительно загрузите в капилляр не менее 1 мкл соответствующего раствора.
ПРИМЕЧАНИЕ: Эмбрионы будут находиться на разной высоте в каплях, поэтому отрегулируйте микроскоп стереомикроскопа, чтобы определить их местонахождение. Извлекайте эмбрионы из каждой капли, когда остается 10 секунд. Все манипуляции с эмбрионами должны проводиться под стереомикроскопом. - Загрузка эмбрионов: Аспирируйте эмбрионы, используя минимальное V-раствор (например, ~ 0,1 μL) и быстро поместите их на платформу для шпателя.
- Погружение в LN2: После загрузки эмбрионов немедленно погрузите платформу шпателя в LN2 на 5 с (удерживая шпатель рукой, за его стержень). Затем, выдерживая шпатель в парах LN2 , запечатайте его соломинкой объемом 0,5 мл с помощью длинного пинцета из нержавеющей стали (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Перед запечатыванием извлеките LN2 из соломинки, чтобы предотвратить расширение во время нагревания. Убедитесь, что шпатель и соломинка правильно выровнены, чтобы избежать контакта между каплей эмбриона и стенкой соломинки. Для удобства герметичные шпатели могут оставаться в контейнере LN2 до тех пор, пока все шпатели не будут загружены эмбрионами, при необходимости заполняя LN2 . - Повторите процедуру: Повторите шаги с 1.3.3 по 1.3.7 для каждой группы эмбрионов, используя свежую пару капель PV и V.
- Хранение: Переложите шпатели в бокалы (см. Таблицу материалов), а затем в накопитель LN2 Dewar (см. Таблицу материалов).
- Подготовьте LN2: Налейте LN2 в подходящую емкость (например, в изолированный контейнер из полистирола размером 10 см x 30 см x 20 см) и положите столько соломинок объемом 0,5 мл, сколько шпателей для использования.

Рисунок 2: Схема процесса остекловывания с помощью шпателя МВД. Подробнее см. в тексте. Создано в BioRender. Мейкл, М. (2025) https://BioRender.com/x96y902. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Согревание (Рисунок 3)
- Приготовление раствора
- Приготовьте 1 М раствор сахарозы, растворив 0,85 г сахарозы в 2,5 мл М2 среды. Стерилизуйте раствор с помощью фильтра 0,22 мкм.
ПРИМЕЧАНИЕ: Этот раствор можно готовить и хранить при температуре 4 °C до 1 недели. - Готовят 0,5 М и 0,25 М растворов сахарозы, разбавляя 1 М раствор сахарозы соответствующим объемом М2 среды.
- Поддерживайте растворы сахарозы при температуре 37 °C на горячей плите (см. Таблицы материалов) до начала нагревания.
- Приготовьте 1 М раствор сахарозы, растворив 0,85 г сахарозы в 2,5 мл М2 среды. Стерилизуйте раствор с помощью фильтра 0,22 мкм.
- Подготовка согревающей плиты
- На пластиковую чашку Петри диаметром 100 мм поместите следующие капли раствора: каплю 0,5 М сахарозы на 500 мкл, каплю 0,5 М сахарозы на 50 мкл и каплю 0,25 М сахарозы на 50 мкл на каждый нагреваемый шпатель. Налейте три капли среды M2 (по 100 мкл каждая) для умывания.
- Процесс прогрева
ПРИМЕЧАНИЕ: Процесс нагревания происходит при RT, например, при 20-22 °C на основе стереомикроскопа.- Достаньте запечатанные шпатели из дьюара. Поместите их в соответствующую емкость с LN2. Смотрите рисунок 3.
- Поместите нагревательную пластину в стереомикроскоп. По очереди придерживайте основание шпателя пинцетом из нержавеющей стали, а рукой в перчатке вытаскивайте идентификационный стержень, а затем соломинку. Быстро окуните платформу, содержащую эмбрионы, в 0,5 М каплю сахарозы объемом 500 мкл.
- Следите за тем, чтобы все эмбрионы попали в каплю; При необходимости аккуратно переместите шпатель, чтобы облегчить их освобождение. Загрузите эмбрионы в вытянутый стеклянный капилляр, поместите их в каплю объемом 50 мкл 0,5 М раствора сахарозы и инкубируйте в течение 2 минут.
- Поместите эмбрионы в каплю объемом 50 мкл 0,25 М раствора сахарозы и инкубируйте еще 2 минуты.
ПРИМЕЧАНИЕ: Перед помещением эмбрионов в каждый раствор предварительно загрузите капилляр раствором, который будет использоваться. - Наконец, промойте эмбрионы три раза в разных каплях среды М2, чтобы удалить сахарозу.
- Инкубируйте эмбрионы в условиях, подходящих для каждого вида, не менее 1 часа перед использованием.
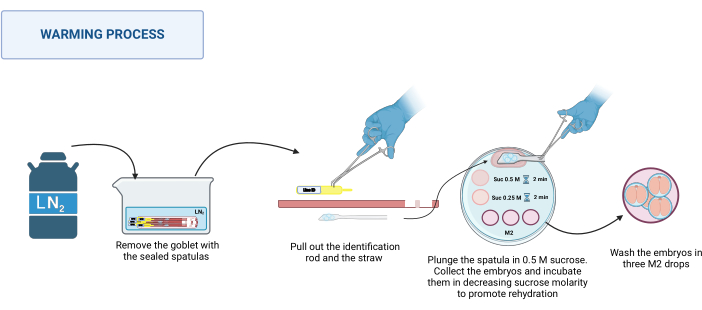
Рисунок 3: Схема процесса прогревания шпателем МВД. Подробнее см. в тексте. Создано в BioRender. Мейкл, М. (2025) https://BioRender.com/k91k191. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Первоначально мы использовали традиционный метод медленной заморозки на основе растворов пропиленгликоля, соломинок и оборудования для заморозки с контролируемой скоростью7. Однако, рассмотрев метод витрификации как потенциально более простой и экономически эффективный вариант, мы провели исследование для сравнения результатов традиционного медленного замораживания (SLF) с MVD Spatula у 8-клеточных эмбрионов in vivo и 2-клеточных эмбрионов in vitro 13 (Таблица 1 и Таблица 2). Результаты представлены в терминах «скорости восстановления», которая определяет количество эмбрионов, извлеченных из устройства после нагревания, по отношению к общему количеству криоконсервированных эмбрионов. «Коэффициент выживаемости» относится к количеству жизнеспособных эмбрионов по сравнению с восстановленными эмбрионами из устройства. Эмбрионы считались жизнеспособными, если бластомеры были интактными (два бластомера у 2-клеточных эмбрионов и не менее четырех бластомеров у 8-клеточных эмбрионов)14. Эти термины используются для оценки того, подходит ли устройство и весь процесс для криоконсервации.
Значительно более высокая выживаемость (Таблица 1 и Таблица 2) и скорость развития через 3,5 дня после коитума (ДПК; например, эмбрионы морул и бластоцист, Таблица 1) были достигнуты для Spatula MVD, чем для группы SLF у эмбрионов мышей. Несмотря на то, что оба метода достигли приемлемой скорости вылупления, она была значительно ниже, чем в контрольной группе свежих эмбрионов, как и ожидалось (невитрифицированные эмбрионы; Таблица 1). Витрифицированные/согретые и контрольные свежие 2-клеточные эмбрионы были перенесены самкам-реципиентам, при этом не было выявлено различий как в частоте наступления беременности (беременных/всего перенесенных самок), так и в частоте рождаемости (рожденные/перенесенные эмбрионы у всего самок-реципиентов; Таблица 2). Эти результаты приводят нас к переходу от метода SLF к витрификации.
| Количество эмбрионов | Выживаемость при 2,5 dpc (жизнеспособные/восстановленные эмбрионы из устройства) | Скорость развития эмбриона при 3,5 dpc (морулы-бластоцисты/жизнеспособные эмбрионы) | Скорость вылупления при 5,5 dpc (вылупившиеся бластоцисты/культивируемые эмбрионы) | |
| Медленная заморозка | 410 | 89,3 % (366/410)а | 91,8 % (336/366)а | 49,7 % (90/181)а |
| Шпатель МВД | 341 | 92.7 % (316/341)b | 97,2 % (307/316)b | 41,0 % (68/166)а |
| Свежие эмбрионы | 458 | - | 98.7 % (452/458)b | 67,8 % (139/205)b |
Таблица 1: Выживаемость и скорость развития in vitro 8-клеточных эмбрионов мышей, подвергнутых витрификации или медленному замораживанию. Эмбрионы 8-клеточных мышей in vivo были криоконсервированы с помощью Spatula MVD или медленной заморозки и сравнены со свежими эмбрионами. Свежие эмбрионы были собраны у самок при 2,5 dpc и культивированы в тех же условиях, что и в других группах. Выживаемость (жизнеспособные/восстановленные эмбрионы из устройства) определяли после нагревания/размораживания. Жизнеспособные эмбрионы культивировали in vitro. Скорость развития эмбрионов (морулы-бластоцисты/жизнеспособные эмбрионы) и скорость вылупления (вылупленные/культивируемые эмбрионы) определяли при 3,5 dpc и 5,5 dpc соответственно. Разные надстрочные индексы указывают на существенные различия (P < 0,05).
| Количество эмбрионов | Скорость восстановления (извлеченных из устройства/криоконсервированных эмбрионов) | Выживаемость (жизнеспособные/восстановленные эмбрионы из устройства) | Частота наступления беременности (беременные/переведенные женщины) | Рождаемость у всего перевезенных самок (рожденных/перенесенных эмбрионов детенышей) | |
| Медленная заморозка | 531 | 88,3 % (469/531)а | 85,1 % (399/469)а | - | - |
| Шпатель МВД | 431 | 84,2 % (363/431)а | 94.7 % (344/363)b | 53,3 % (8/15)а | 17,8 % (47/264)а |
| Свежие эмбрионы | 446 | - | 97,7 % (436/446)b | 53,3 % (8/15)а | 20,6 % (53/257)а |
Таблица 2: Показатели восстановления и выживаемости двухклеточных мышиных эмбрионов, подвергнутых витрификации или медленному замораживанию. Репродуктивные исходы витрифицированных/подогретых эмбрионов по сравнению со свежими.Полученные in vitro 2-клеточные эмбрионы криоконсервировали с помощью Spatula MVD или SLF. Восстановление (извлеченные из устройства/криоконсервированные эмбрионы) и выживаемость (жизнеспособные/восстановленные эмбрионы из устройства) определялись после нагревания или размораживания. Жизнеспособные подогретые и свежие эмбрионы были перенесены самкам-реципиентам (15 самок в группе, ~17 эмбрионов на самку). Определяли частоту наступления беременности (беременных/перенесенных самок) и родов (рожденных/перенесенных эмбрионов). Разные надстрочные индексы указывают на существенные различия (P < 0,05).
Шпатель MVD также был протестирован на витрификацию предварительно имплантационных эмбрионов овец, полученных in vitro , и сравнили с коммерческим устройством6. Результаты представлены в таблице 3. Качество эмбрионов оценивалось по морфологии в соответствии с критериями, рекомендованными Международным обществом эмбриотехнологии (IETS)15, и те превосходные и хорошие эмбрионы 1-го класса были распределены по каждой экспериментальной группе.
Метод витрификации не влиял ни на выживаемость (~70% и ~16%, через 3 ч или 24 ч после потепления соответственно), ни на вылупление эмбрионов на 8-е сутки. Процент бластоцист на 8-й день был ниже при обоих методах витрификации по сравнению с контрольной группой (свежие эмбрионы) (~ 8% против 20,5% соответственно; P < 0,05). Эти результаты свидетельствуют о том, что эмбрионы овец, полученные in vitro , также могут быть витрифицированы с помощью Spatula MVD. Кроме того, предыдущие результаты были дополнены переносом эмбрионов овец, подвергнутых медленной заморозке, Spatula MVD или коммерческим устройством самкам-реципиентам16. Результаты представлены в таблице 4. Между экспериментальными группами оценивали выживаемость эмбрионов (жизнеспособные эмбрионы на 30-й день/перенесенные эмбрионы), частоту наступления беременности (беременные/перенесенные овцы), потерю плода от гестации до рождения (рожденные ягнята, оцененные при рождении/жизнеспособные эмбрионы на 30-й день) и выживаемость ягнят (живые ягнята через 1 неделю после рождения/родившиеся ягнята).
Результаты показали, что выживаемость эмбрионов после переноса эмбрионов была одинаковой для SLF (26,5%) и Spatula MVD (22,2%), но была выше в группе коммерческих устройств (52,0%, P < 0,05). Метод криоконсервации существенно не влиял на репродуктивные исходы (продолжительность беременности, потерю плода, массу тела при рождении и выживаемость ягнят). В целом, Spatula MVD также является подходящим методом для витрификации предимплантационных эмбрионов овец.
| Количество эмбрионов | Выживаемость % (жизнеспособные/криоконсервированные эмбрионы) | Скорость развития % (морулы-бластоцисты на 6-й день/расщепленные эмбрионы) | Процент вылупления, % (вылупившиеся бластоцисты/расщепленные эмбрионы) | ||
| 3 ч | 24 ч | ||||
| Шпатель МВД | 165 | 69,6 ± 2,4А | 14,6 ± 3,5А | 11,1 ± 2,1б | 6,4 ± 1,9б |
| Коммерческое устройство | 165 | 71,3 ± 1,3А | 17,7 ± 4,5А | 12,7 ± 3,2б | 10,2 ± 2,9б |
| Контрольная группа (свежие эмбрионы) | 408 | - | - | 41,3 ± 3,7А | 20,5 ± 4,5А |
Таблица 3: Выживаемость и скорость развития in vitro эмбрионов овец, подвергнутых витрификации с помощью Spatula MVD или коммерческого устройства.Полученные in vitro эмбрионы на 2-8 клеточной стадии (на 2-й день после оплодотворения) витрифицировали с помощью Spatula MVD или коммерческого устройства, а затем нагревали. Выживаемость (жизнеспособная/криоконсервированная) анализировали через 3 ч и 24 ч после нагревания. Скорость развития и вылупления определяли как количество морул и бластоцист, полученных на 6-й день, и количество вылупившихся эмбрионов, соответственно, над количеством расщепленных (2-8 клеток) эмбрионов. Разные верхние индексы в одной и той же колонке указывают на существенные различия (P < 0,05). Данные отображаются как среднее значение ± SEM.
| Выживаемость эмбрионов (жизнеспособные эмбрионы на 30-й день/перенесенные эмбрионы) | Частота стельности (беременные/перенесенные овцы) | Потеря плода (ягнята, рожденные с доступом при рождении / жизнеспособные эмбрионы на 30-й день) | Продолжительность беременности (d) | Масса тела при рождении (г) | Выживаемость ягнят (живые ягнята через неделю после рождения/родившиеся ягнята) | |
| Шпатель МВД | 22.2 %a (28/126) | 32.9 %a (25/76) | 4,0 % в год (1/25) | 150,7 ± 1,8А | 4102 ± 112,4А | 87.5 %a (21/24) |
| Коммерческое устройство | 52,0 %b (91/175) | 66,0 %b (62/94) | 11.0 %a (8/73) | 150,4 ± 1,9А | 3980 ± 221,2А | 83.1 %a (54/65) |
| Медленная заморозка | 26.5 %a (36/136) | 38.3 %a (28/73) | 6.7 %a (2/30) | 150,4 ± 2,1а | 4319 ± 107,3А | 89.3 %a (25/28) |
Таблица 4: Влияние метода криоконсервации на выживаемость эмбрионов после переноса, поддержание беременности и производство ягнят. Морулы к расширенным бластоцистам эмбрионов, полученных in vivo или in vitro , подвергали витрификации/медленному замораживанию и нагреванию/размораживанию и переносили повторнородящим мериносовым синхронизированным овцам. В экспериментальных группах сравнивали выживаемость эмбрионов (жизнеспособные эмбрионы на 30-й день/перенесенные эмбрионы), частоту наступления беременности (беременные/перенесенные овцы), потерю плода от гестации до рождения (ягнята, рожденные при рождении/жизнеспособные эмбрионы на 30-й день), продолжительность беременности (d), вес при рождении (г) и выживаемость ягнят (живые ягнята через неделю после рождения/рожденные ягнята).
Кроме того, генетически модифицированные линии мышей, которые больше не используются на нашем предприятии, были зарезервированы в виде двухклеточных эмбрионов с использованием метода Spatula MVD. Минимум 300 двухклеточных эмбрионов, полученных в основном путем экстракорпорального оплодотворения (или естественного спаривания), были витрифицированы для каждой линии мышей. Контроль качества процесса осуществлялся путем нагревания двух или трех шпателей каждой линии и переноса эмбрионов псевдобеременным женщинам-реципиентам. Репрезентативные результаты различных генетически модифицированных линий мышей представлены в таблице 5. В среднем выздоровление составило 90,4%, а выживаемость – 96,8%. Уровень беременности составил 80%, а рождаемость в среднем 31,5%. Следует отметить, что уровень рождаемости показал широкий диапазон результатов от 12% до 45%, что может быть связано с различными генетическими модификациями, которые могут повлиять на чувствительность эмбрионов и результаты переноса эмбрионов. В целом эти результаты соответствовали ранее полученным на объекте.
| Линия мыши | Количество витрифицированных/подогретых эмбрионов | Скорость восстановления (извлеченных из устройства / криоконсервированных эмбрионов) | Выживаемость (жизнеспособные/восстановленные эмбрионы из устройства) | Частота наступления беременности (беременные/переведенные женщины) | Рождаемость (рожденные/перенесенные эмбрионы) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| Средний | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
Таблица 5: Репрезентативные результаты процесса витрификации контроля качества, выполненного на двухклеточных эмбрионах различных генетически модифицированных линий мышей. Линии мышей ГМ резервировали в виде двухклеточных эмбрионов (минимум 300 эмбрионов) с использованием метода Spatula MVD. Контроль качества процесса осуществлялся путем нагревания двух или трех шпателей каждой линии и переноса эмбрионов псевдобеременным женщинам-реципиентам. Восстановление (извлеченные из устройства/криоконсервированные эмбрионы) и выживаемость (жизнеспособные/восстановленные эмбрионы из устройства) определялись после нагревания. Жизнеспособные подогретые эмбрионы переносили в 2-клеточной стадии самкам-реципиентам (от 1 до 3 самок на линию, ~18 эмбрионов на самку). Определяли частоту наступления беременности (беременных/перенесенных самок) и родов (рожденных/перенесенных эмбрионов).
Наконец, недавно мы провели сравнительную работу, в которой свежие и витрифицированно-подогретые мышиные зиготы были микроинъекционированы реагентами CRISPR, а затем in vitro культивировались или переносились псевдобеременным самкам. Цель исследования состояла в том, чтобы оценить, могут ли витрифицированные зиготы с использованием Spatula MVD быть подходящим источником эмбрионов для микроинъекций в зиготы B6D2F1/J и C57BL/6J. Показатели выздоровления и выживаемости были аналогичны предыдущим результатам, полученным для эмбрионов 2-8 клеточной стадии (табл. 6). В целом, витрифицированные и подогретые зиготы пережили микроинъекцию, развились в вылупившиеся бластоцисты или произвели живых детенышей, а также продемонстрировали мутации, индуцированные системой CRISPR/Cas9. Тем не менее, частота мутаций была значительно ниже в витрифицированных зиготах, чем в свежих. Криобанк зигот, по-видимому, является альтернативным источником эмбрионов для проведения сеансов микроинъекций по требованию, избегая разведения и содержания животных в течение всего года и улучшая внедрение 3R в технологию CRISPR.
| Штамм зиготы | Количество криоконсервированных зигот | Скорость восстановления (извлеченных из аппарата /криоконсервированных эмбрионов) | Выживаемость (жизнеспособные/восстановленные эмбрионы из устройства) |
| Б6Д2Ф1/Дж | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| С57BL/6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
Таблица 6: Восстановление и выживаемость витрифицированно-подогретых зигот B6D2F1/J и C57BL/6J. Зиготы, полученные in vivo, собирали у самок-доноров B6D2F1/J и C57BL/6J, витрифицировали с помощью Spatula MVD и нагревали. Показатели восстановления (извлеченные из устройства/криоконсервированные эмбрионы) и выживаемость (жизнеспособные/восстановленные эмбрионы из устройства) определялись после нагревания.
Обсуждение
Шпатель МВД - это простое в сборке, недорогое, минимальное по объему витрификационное устройство с высокой емкостью удержания эмбрионов и оптимальным содержанием жидкого азота. Этот метод доказал свою простоту, скорость и надежность. В среднем достигнуты не только высокие показатели восстановления эмбрионов и выживаемости витрифицированных эмбрионов (~90%), но и хорошие репродуктивные результаты при проведении переноса эмбрионов у мышей (~80% стельности и ~30% рождаемости), которые сопоставимы с другими методами витрификации минимального объема 18,19,20.
Важнейшие этапы метода витрификации Шпателем МВД включают: (i) Подготовка шпателем. Этот метод требует значительного опыта. Платформа, полученная в наконечнике загрузчика геля путем нагрева щипцами, должна иметь ~1мм2 и должна быть закрыта в конце. Если кончик остается открытым, из-за перепада температур при погружении шпателя в каплю сахарозы в процессе прогрева могут образовываться пузырьки. Пузырьки мешают поиску и восстановлению эмбрионов. ii) инкубация эмбрионов в растворах для витрификации. Из-за высокой плотности эмбрионы задерживаются в каплях на разной высоте. Необходима быстрая аспирация всех эмбрионов. Токсичность ожидается, если эмбрионы остаются в этих растворах в течение более длительного периода времени при комнатной температуре. (iii) Капля для витрификации шпателя. Объем витрификационной капли, содержащей эмбрионы, в платформе должен составлять ~0,5-1,0 μл; Большие объемы криопротекторов влияют на жизнеспособность эмбрионов. Мы рекомендуем использовать подтянутые капилляры с внутренним диаметром, немного превышающим размер эмбриона, который будет нести необходимый объем. Кроме того, большие перепады платформы могут увеличить вероятность застревания в соломе объемом 0,5 мл внутри стены при закрытии системы. (iv) Герметизация шпателем. Особую осторожность следует соблюдать при закрытии шпателя соломинкой объемом 0,5 мл; Оба элемента должны быть выровнены. Капли эмбриона в шпатель нельзя тревожить. (v) Во время прогревания соблюдайте порядок удаления идентификатора стержня и соломинки объемом 0,5 мл. В противном случае идентификатор может быть вытеснен из-за разницы температур.
Эта техника требует обучения операторов на разных этапах. Основным средством устранения неполадок может стать извлечение эмбрионов из шпателя. Если менее 70-80% витрифицированных эмбрионов восстанавливаются при нагревании шпателя, это может быть связано с (i) неполной загрузкой эмбрионов на платформу шпателя или (ii) удержанием эмбрионов во внутренней стенке соломинки объемом 0,5 мл при закрытии системы. Чтобы решить первую проблему, загрузка капли, содержащей эмбрионы, должна быть выполнена под стереомикроскопом с помощью аспираторной трубки и вытянутого капилляра, загруженного криопротекторной средой, содержащей эмбрионы и 2-3 маленьких пузырьков воздуха вдоль капилляра, что обеспечивает правильный поток жидкости. Если во время нагревания на платформе не видно эмбрионов, отрежьте ватную пробку, чтобы открыть соломинку объемом 0,5 мл, и дважды промойте ее 500 мкл сахарозы 0,5 М в М2 (см. раздел 2, шаг 1), выдавливая раствор в чашку для восстановления эмбрионов.
Ограничения метода в основном связаны с уже упомянутыми критическими этапами. Мы считаем, что ключевым моментом является подготовка шпателем. Чтобы хорошо выполнять шпатель, требуется тренировка, но однажды научившись этому, его можно освоить. Поскольку носители являются домашними, этот метод нельзя использовать в клиниках репродукции человека.
Основным преимуществом шпателя МВД является то, что он является недорогим устройством по сравнению с коммерческими9. Кроме того, это экономит место в дьюаре жидкого азота по сравнению с витрификацией в криотрубке8. Мы протестировали его функциональность на эмбрионах мышей и овец на разных стадиях. Он особенно простой, быстрый, экономичный и более эффективный, чем метод медленной заморозки.
Этот метод может быть использован для витрификации эмбрионов различных видов млекопитающих в широком спектре областей исследований.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы благодарим Алехо Менчаку за его вклад в развитие Шпателя МВД. GS получил финансирование от Программы последипломного образования в области биотехнологии - Facultad de Ciencias - Universidad de la República (https://webmasterbiotecnol.wixsite.com/biotec1) (номер гранта: GS 2437 347). GS, MNM и MC получили финансирование от FOCEM - Fondo para la Convergencia Estructural del Mercosur (https://focem.mercosur.int/es/) (номер гранта: COF 03/11). GS и MC являются членами Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Уругвай. (https://www.anii.org.uy/). Спонсоры (Программа последипломного образования в области биотехнологии - Facultad de Ciencias - Universidad de la República; FOCEM - Fondo para la Convergencia Estructural del Mercosur; Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay) не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
Ссылки
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены