Method Article
Spatel Montevideo Gerät für die Vitrifizierung von Säugetierembryonen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir das Spatel-Montevideo-Protokoll für die Vitrifizierung von Präimplantationsembryonen von Mäusen und Schafen vor, das aus einem hausgemachten Spatel und der Verwendung hausgemachter Lösungen besteht. Die Embryonen werden schnell in zwei Kryoprotektiva-Lösungen mit zunehmender Konzentration äquilibriert, auf den Spatel geladen, in flüssigen Stickstoff getaucht und schließlich mit einem 0,5-ml-Strohhalm versiegelt.
Zusammenfassung
Diese Studie beschreibt eine effiziente und kostengünstige Vitrifikationsmethode für die Kryokonservierung von Maus- und Schafembryonen, die als Spatula Montevideo (MVD) bekannt ist. Bei diesem Protokoll wird ein selbstgemachter Spatel als Trägergerät verwendet, der mit einer Gelladerspitze vorbereitet ist. Die Embryonen werden schnell in zwei hausgemachten Kryoprotektiva-Lösungen mit zunehmender Konzentration äquilibriert, in den Spatel geladen und dann direkt in flüssigen Stickstoff getaucht. Etwa 30-40 Mausembryonen aus dem Präimplantationsstadium können auf den Spatel geladen werden, der anschließend mit einem 0,5-ml-Strohhalm verschlossen wird. Die Verwendung von Spateln anstelle von Kryoröhrchen, die häufig zur Lagerung von vitrifizierten Embryonen verwendet werden, optimiert den Platz in den Flüssigstickstoff-Dewars. Darüber hinaus erfordert der Erwärmungsprozess nur eine hausgemachte Saccharoselösung mit abnehmender Konzentration, um die Embryonen zu rehydrieren und ihre Morphologie wiederherzustellen. Unser Labor verwendet den Spatel Montevideo seit über 10 Jahren erfolgreich für Präimplantationsembryonen von Mäusen und Schafen. Der Spatel Montevideo hat bei Mausembryonen eine durchschnittliche Heilungsrate (geborgene/vitrifizierte Embryonen) von 84 % und eine Überlebensrate (lebensfähige/wiedergewonnene Embryonen) von 97 % gezeigt. Die Vitrifikation von murinen Embryonen hat zu besseren Ergebnissen geführt als das langsame Einfrieren, obwohl keine Unterschiede in den Fortpflanzungsergebnissen (Schwangerschaft, Geburt und Geburtenrate) beobachtet wurden. Bei Schafembryonen wurden mit dem Spatel Montevideo im Vergleich zu einem kommerziellen Gerät ähnliche Überlebens- und Embryoentwicklungsraten erzielt. Obwohl die Trächtigkeitsrate bei dem kommerziellen Gerät höher war, unterschied sich die Überlebensrate der Lämmer nicht signifikant zwischen den Geräten. Die Vitrifikationsmethode des Spatels Montevideo ist eine einfache Kryokonservierungstechnik, die zur Lagerung überschüssiger Embryonen, zur Sicherung genetisch veränderter Mauslinien und Schafmodelle und zur Erleichterung ihres Austauschs zwischen Forschern weltweit verwendet werden kann.
Einleitung
Die Effizienz der Erzeugung gentechnisch veränderter (GV) Tiere hat sich durch die Entwicklung von Endonukleasen-basierten Methoden, insbesondere CRISPR/Cas9, erheblich erhöht. Viele Labore weltweit produzieren verschiedene gentechnisch veränderte Maus- und Rattenlinien, die kryokonserviert werden sollten, um genetische Drift zu verhindern und die Integrität des ursprünglichen Phänotyps1 zu erhalten. Darüber hinaus entfällt durch die Archivierung die Notwendigkeit einer ständigen Zucht, die oft zu einer übermäßigen Anzahl von Tieren führt. Einige Laboratorien senden gentechnisch veränderte Mauslinien als kryokonservierte Embryonen oder Spermien an internationale Repositorien, um den Austausch dieser Modelle zu erleichtern und gleichzeitig den Transport lebender Tiere zu vermeiden. Dies gewährleistet die Zugänglichkeit zu den Linien ohne die wiederholte Generierung identischer gentechnisch veränderter Tiermodelle2. Aus diesen Gründen ist die Kryokonservierung von Embryonen und Spermien in jeder GV-Tiereinrichtung von größter Bedeutung. Im Allgemeinen wird die Kryokonservierung von Embryonen für die Lagerung von GV-Linien bevorzugt, da Embryonen das vollständige diploide Genom mit Modifikationen enthalten und leicht durch Embryotransfer gewonnen werden können.
Die Vitrifikation ist ein Nichtgleichgewichtsprozess, der durch ein Ungleichgewicht zwischen Wasser, das in die Zelle eindringt, und Wasser, das extrazelluläre Kristalle um sie herum bildet, gekennzeichnet ist. Diese Methode verhindert die Bildung von intrazellulären Eiskristallen und unterscheidet sie von der Slow Freezing Method (SLF)3 (siehe Abbildung 1). Die hohe Konzentration an Kryoprotektiva und der direkte Kontakt mit flüssigem Stickstoff (LN2) ermöglichen eine ultraschnelle Abkühlung (~40 °C/s), wodurch innerhalb von Sekunden ein glasartiger Zustand der Proben erreicht wird. Darüber hinaus ist die Vitrifikation schneller, einfacher und kostengünstiger als das langsame Einfrieren4. Es werden nur minimale LN2 benötigt und in der Regel einfache Geräte verwendet, die kommerziell erworben oder selbst hergestellt werden können5 (siehe Abbildung 1).
Darüber hinaus ist der Erwärmungsprozess in der Regel schnell und replizierbar. Sie sollte schnell durchgeführt werden, um eine Toxizität des Kryoprotektivums zu vermeiden und den glasartigen Zustandaufrechtzuerhalten 3. Beim Einfrieren von Embryonen berücksichtigen viele Labore die Bequemlichkeit des Trägergeräts, seine Zuverlässigkeit, Robustheit, Haltekapazität und Kosten.
Wir bevorzugen die Vitrifikationsmethode mit Spachtel mit minimalem Volumen für die routinemäßige Kryokonservierung von Schaf- und Mausembryonen mit dem Spatel Montevideo (MVD) 6. Anfangs haben wir die Methode des langsamen Einfrierens7 angewendet, sind aber schnell zur Vitrifikation übergegangen. Um ein einfacheres und platzsparenderes Gerät für den LN2 Dewar zu schaffen, haben wir den selbstgemachten Spatel von Tsang and Chow (2009)8, der in ein Kryoröhrchen gesteckt wird, modifiziert, um den Spatel MVD zu entwickeln, der mit einem 0,5 mL Strohhalm verschlossen wird (siehe Materialtabelle). Der Spatel verfügt über eine Gelladerspitze (siehe Materialtabelle), bei der eine Plattform von ca. 1 mm² gebildet wird, indem die Spitze mit einer feinen Pinzette sanft geschmolzen wird, wodurch eine blütenblattartige Platte zum Laden der Embryonen entsteht. Diese Plattform kann bis zu 40 Mausembryonen in einem kleinen Vitrifikationstropfen aufnehmen. Eine Verschlussstange zur Identifizierung (siehe Materialtabelle) wird in das offene Ende der Gelladerspitze eingeführt.
Ziel dieser Methode ist es, Embryonen auf eine einfache, schnelle und kostengünstige Weise zu vitrifizieren, die zudem Platz im Stickstoffdewar spart. Dieses System wird seit vielen Jahren erfolgreich eingesetzt und bietet hervorragende Überlebensraten (~97%) und Fortpflanzungsergebnisse, insbesondere bei Mausembryonen. Da der Spatel MVD im Labor hergestellt wird, ist er im Vergleich zu kommerziellen Geräten eine kostengünstige Methode9. Darüber hinaus spart es im Vergleich zur Verwendung von Kryoröhrchen 8,10 Platz im Stickstoffdewar.

Abbildung 1: Vergleich der beiden wichtigsten Techniken, die für die Kryokonservierung von Embryonen verwendet werden. Diese Abbildung wurde mit Genehmigung von Crispo et al.1 geändert. Erstellt im BioRender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Tiere, die zur Gewinnung von Mausembryonen verwendet wurden, wurden gemäß dem nationalen Gesetz 18.611 und den internationalen Tierhaltungsrichtlinien11 untergebracht und behandelt. Das Versuchsprotokoll (Genehmigungsnummer #007-18) wurde zu gegebener Zeit vom Ausschuss für Tierpflege und -verwendung des Institut Pasteur de Montevideo genehmigt (schriftliche Zustimmung). Die Versuchsprotokolle für Eizellen/Embryonen von Schafen wurden vom Institutional Animal Care Committee Fundación IRAUy (Protokoll #001-2017) genehmigt, die den ARRIVE-Richtlinien12 entsprechen und in Übereinstimmung mit den internationalen Tierhaltungsrichtlinien11 durchgeführt wurden.
1. Vitrifikation (Abbildung 2)
- Spatel MVD Vorbereitung
- Kürzen Sie die Spitze des Gelladers (siehe Materialtabelle), indem Sie die ersten 10 mm und den Spitzenkegel abschneiden.
HINWEIS: Dadurch entsteht eine kürzere, gerade Spitze, die die endgültige Versiegelung mit dem 0,5-ml-Strohhalm erleichtert (siehe Materialtabelle). - Halten Sie das Ende der Gelladerspitze mit der Pinzette #5 des Uhrmachers (siehe Materialtabelle) ca. 1,0 cm von der Spitze entfernt. Legen Sie die Spitze vorsichtig in die Flamme eines Bunsenbrenners (siehe Materialtabelle) und halten Sie sie 8-10 s lang, um eine blütenblattartige Plattform von ca. 1 mm2 zu bilden.
- Von der Flamme nehmen und mit der Pinzette 5 s fest halten.
- Überprüfen Sie mit einem Stereomikroskop (siehe Materialtabelle), ob die blütenblattartige Plattform (~ 1 mm2) gebildet und der distale Rand versiegelt ist.
HINWEIS: Die Plattform muss am distalen Ende geschlossen werden, um eine Infiltration von LN2 während der Vitrifikation zu verhindern. Stellen Sie sicher, dass die Plattform sauber und frei von Kunststofffäden ist. Wenn es zu klein ist oder Fäden hat, schneiden Sie die Spitze ab und wiederholen Sie den Vorgang. - Wiederholen Sie die Schritte 1.1.1-1.1.4, um die erforderliche Anzahl von Spateln vorzubereiten (1 Spatel = bis zu 40 Mausembryonen).
- Sterilisieren Sie die Spatel mit ultravioletten (UV) Strahlen oder Ethylenoxid und bewahren Sie sie in einer sterilen Tube oder Box auf.
- Nehmen Sie am Tag der Vitrifikation die Spatel und berühren Sie sie vom gegenüberliegenden Ende der Plattform. Führen Sie in jeden Spatel einen Identifikationsstab (siehe Materialtabelle) ein und legen Sie ihn auf die Stereomikroskopbasis. Beschriften Sie den Stab mit einem Permanentmarker oder einem Aufkleber mit flüssigem Stickstoff.
HINWEIS: Vermeiden Sie immer, die Plattform zu berühren, wenn Sie mit den Spateln hantieren. Die Gesamtlänge des gesamten Geräts (Spatel + 0,5 ml Strohhalm + Identifikationsstab) sollte nicht mehr als 1 cm der Länge des Bechers überschreiten.
- Kürzen Sie die Spitze des Gelladers (siehe Materialtabelle), indem Sie die ersten 10 mm und den Spitzenkegel abschneiden.
- Herstellung von Vitrifikationslösungen
- Bereiten Sie die FS-Lösung vor: Lösen Sie 1,5 g Dichtegradientenmedium (siehe Materialtabelle) und 0,85 g Saccharose (siehe Materialtabelle) in 5 mL phosphatgepufferter Kochsalzlösung (PBS; siehe Materialtabelle). In einem kochenden Wasserbad erhitzen, bis es sich vollständig aufgelöst hat, dann mit einem 0,22-μm-Filter sterilisieren (siehe Materialtabelle).
HINWEIS: Diese Lösung kann bis zu 6 Monate bei 4 °C gelagert werden. - Bereiten Sie die Vor-Vitrifikationslösung (PV) vor: Mischen Sie am Tag der Vitrifikation 10 % Ethylenglykol (siehe Materialtabelle), 10 % Dimethylsulfoxid (siehe Materialtabelle) und 80 % M2 Medium (siehe Materialtabelle). Für 5 Spatel wird ein Gesamtvolumen von 100 μL benötigt.
- Bereiten Sie die Vitrifikationslösung (V) vor: Mischen Sie am Tag der Vitrifikation 15 % Ethylenglykol, 15 % Dimethylsulfoxid, 10 % M2 Medium und 60 % FS-Lösung. Für 5 Spatel wird ein Gesamtvolumen von 100 μL benötigt.
- Bereiten Sie die FS-Lösung vor: Lösen Sie 1,5 g Dichtegradientenmedium (siehe Materialtabelle) und 0,85 g Saccharose (siehe Materialtabelle) in 5 mL phosphatgepufferter Kochsalzlösung (PBS; siehe Materialtabelle). In einem kochenden Wasserbad erhitzen, bis es sich vollständig aufgelöst hat, dann mit einem 0,22-μm-Filter sterilisieren (siehe Materialtabelle).
- Dehydrierung und Vitrifikationsprozess des Embryos
- LN2 vorbereiten: Gießen Sie LN2 in ein geeignetes Gefäß (z. B. einen isolierten Styroporbehälter von 10 cm x 30 cm x 20 cm) und legen Sie so viele 0,5-ml-Strohhalme wie Spatel zur Verwendung.
HINWEIS: Um die Visualisierung der Spachtelplattform während der Manipulation unter LN2 zu erleichtern, wird empfohlen, einen farbigen, bodenisolierten Polystyrolbehälter zu verwenden, um einen Kontrasteffekt zu erzielen.
ACHTUNG: Tragen Sie beim Umgang mit LN2 eine geeignete Schutzbrille und Handschuhe (siehe Materialtabelle). - Lösungen vorbereiten: Geben Sie die folgenden Tropfen auf eine 100-mm-Petrischale aus Kunststoff (siehe Materialtabelle): 100 μl M2, 20 μl PV-Lösung und 20 μl V-Lösung für jeden Spatel.
- Vitrifizierende Embryonen: Legen Sie die zu vitrifizierenden Embryonen in den M2-Tropfen. Behandeln Sie 30-40 Embryonen auf einmal, inkubieren Sie sie 30 s lang in der PV-Lösung und dann weitere 30 s bei Raumtemperatur (RT) in der V-Lösung.
- Verwenden Sie eine gezogene Glaskapillare (siehe Materialtabelle) mit einer Aspiratorrohrbaugruppe (siehe Materialtabelle). Belasten Sie die Kapillare mit mindestens 1 μl der jeweiligen Lösung, bevor Sie die Embryonen einsetzen.
HINWEIS: Die Embryonen befinden sich in den Tropfen auf unterschiedlichen Höhen, stellen Sie also das Stereomikroskop-Mikrometer ein, um sie zu lokalisieren. Entnehmen Sie Embryonen aus jedem Tropfen, wenn noch 10 s übrig sind. Alle Manipulationen an Embryonen müssen unter dem Stereomikroskop durchgeführt werden. - Embryonen laden: Aspirieren Sie die Embryonen mit minimaler V-Lösung (z. B. ~ 0,1 μL) und legen Sie sie schnell auf die Spatelplattform.
- Eintauchen in LN2: Nach dem Laden der Embryonen tauchen Sie die Spatelplattform sofort für 5 s in LN2 ein (halten Sie den Spatel mit der Hand, an seinem Stab). Halten Sie den Spatel dann in LN2-Dämpfen und verschließen Sie ihn mit einem 0,5-ml-Strohhalm mit einer langen Pinzette aus Edelstahl (siehe Materialtabelle).
HINWEIS: Entfernen Sie LN2 vor dem Versiegeln aus dem Strohhalm, um eine Ausdehnung während der Erwärmung zu verhindern. Stellen Sie sicher, dass der Spatel und der Strohhalm richtig ausgerichtet sind, um einen Kontakt zwischen dem Embryotropfen und der Strohhalmwand zu vermeiden. Der Einfachheit halber können versiegelte Spatel im LN2-Behälter verbleiben, bis alle Spatel mit Embryonen beladen sind, und bei Bedarf mit LN2 nachgefüllt werden. - Wiederholen Sie das Verfahren: Wiederholen Sie die Schritte 1.3.3 bis 1.3.7 für jede Gruppe von Embryonen mit einem frischen Paar PV- und V-Tropfen.
- Lagerung: Füllen Sie den Spachtel in Becher (siehe Materialtabelle) und dann in einen LN2 Lagerdewar (siehe Materialtabelle).
- LN2 vorbereiten: Gießen Sie LN2 in ein geeignetes Gefäß (z. B. einen isolierten Styroporbehälter von 10 cm x 30 cm x 20 cm) und legen Sie so viele 0,5-ml-Strohhalme wie Spatel zur Verwendung.

Abbildung 2: Schema des Vitrifikationsprozesses mit Spatel MVD. Weitere Informationen finden Sie im Text. Erstellt in BioRender. Meikle, M. (2025) https://BioRender.com/x96y902. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Erwärmung (Abbildung 3)
- Vorbereitung der Lösung
- Bereiten Sie eine 1 M Saccharoselösung vor, die 0,85 g Saccharose in 2,5 ml M2-Medium auflöst. Sterilisieren Sie die Lösung mit einem 0,22-μm-Filter.
HINWEIS: Diese Lösung kann bis zu 1 Woche bei 4 °C zubereitet und gelagert werden. - Bereiten Sie 0,5 M und 0,25 M Saccharoselösungen vor, indem Sie die 1 M Saccharoselösung mit dem entsprechenden Volumen M2 Medium verdünnen.
- Die Saccharoselösungen auf einer heißen Platte (siehe Materialtabellen) bis zum Beginn der Erwärmung bei 37 °C halten.
- Bereiten Sie eine 1 M Saccharoselösung vor, die 0,85 g Saccharose in 2,5 ml M2-Medium auflöst. Sterilisieren Sie die Lösung mit einem 0,22-μm-Filter.
- Vorbereitung der Warmhalteplatte
- Geben Sie auf eine 100 mm Petrischale aus Kunststoff die folgenden Lösungstropfen: einen 500 μl Tropfen 0,5 M Saccharose, einen 50 μl Tropfen 0,5 M Saccharose und einen 50 μl Tropfen 0,25 M Saccharose für jeden zu erwärmenden Spatel. Geben Sie drei Tropfen M2 Medium (je 100 μl) zum Waschen.
- Prozess der Erwärmung
HINWEIS: Der Erwärmungsprozess findet bei RT, z.B. 20-22 °C, an der Basis eines Stereomikroskops statt.- Nehmen Sie die versiegelten Spachtel aus dem Dewar. Platzieren Sie sie in einem geeigneten Behälter mit LN2. Siehe Abbildung 3.
- Legen Sie die Warmhalteplatte auf das Stereomikroskop. Halten Sie den Boden des Spatels nacheinander mit einer Edelstahlpinzette fest und ziehen Sie mit einer behandschuhten Hand den Identifikationsstab und dann den Strohhalm heraus. Tauchen Sie die Plattform mit den Embryonen schnell in den 0,5 M Saccharosetropfen von 500 μl.
- Stellen Sie sicher, dass alle Embryonen in den Tropfen gefallen sind. Bewegen Sie den Spatel bei Bedarf vorsichtig, um das Lösen zu erleichtern. Laden Sie die Embryonen in eine gezogene Glaskapillare, legen Sie sie in den 50-μl-Tropfen 0,5 M Saccharoselösung und inkubieren Sie sie 2 Minuten lang.
- Legen Sie die Embryonen in den 50 μl Tropfen 0,25 M Saccharoselösung und inkubieren Sie weitere 2 Minuten.
HINWEIS: Bevor Sie die Embryonen in jede Lösung legen, laden Sie die Kapillare mit der zu verwendenden Lösung. - Zum Schluss waschen Sie die Embryonen dreimal in verschiedenen Tropfen M2-Medium, um die Saccharose zu entfernen.
- Die Embryonen werden vor der Verwendung mindestens 1 Stunde lang unter für jede Art geeigneten Bedingungen inkubiert.
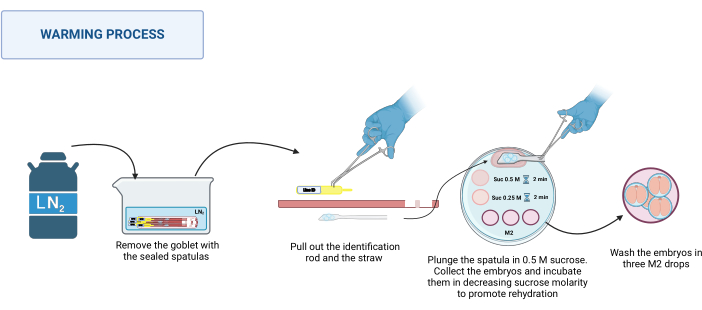
Abbildung 3: Schema des Spatel-MVD-Erwärmungsprozesses. Weitere Informationen finden Sie im Text. Erstellt in BioRender. Meikle, M. (2025) https://BioRender.com/k91k191. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Zunächst verwendeten wir die traditionelle Methode des langsamen Gefrierens, die auf Propylenglykollösungen, Strohhalmen und Gefriergeräten mit kontrollierter Rate basiert7. Nachdem wir jedoch die Vitrifikationsmethode als potenziell einfachere und kostengünstigere Option betrachtet hatten, führten wir eine Studie durch, um die Ergebnisse des traditionellen langsamen Einfrierens (SLF) mit dem MVD des Spatels bei 8-zelligen in vivo abgeleiteten und 2-zelligen in vitro produzierten Mausembryonen zu vergleichen13 (Tabelle 1 und Tabelle 2). Die Ergebnisse werden als "Wiederfindungsrate" dargestellt, die die Anzahl der Embryonen definiert, die nach dem Erwärmen aus dem Gerät gewonnen wurden, über die Gesamtzahl der kryokonservierten Embryonen. "Überlebensrate" bezieht sich auf die Anzahl lebensfähiger Embryonen über den aus dem Gerät gewonnenen Embryonen. Embryonen galten als lebensfähig, wenn die Blastomere intakt waren (zwei Blastomere in 2-zelligen Embryonen und mindestens vier Blastomere in 8-zelligen Embryonen)14. Diese Begriffe werden verwendet, um zu beurteilen, ob das Gerät und der gesamte Prozess für die Kryokonservierung geeignet sind.
Eine signifikant höhere Überlebensrate (Tabelle 1 und Tabelle 2) und Entwicklungsrate 3,5 Tage post coitum (dpc; z.B. Morulae und Blastozystenembryonen, Tabelle 1) wurde für Spachtel MVD erreicht als für die SLF-Gruppe in Mausembryonen. Obwohl beide Methoden eine akzeptable Schlupfrate erreichten, war sie erwartungsgemäß signifikant niedriger als in der Kontroll-Frischegruppe (nicht vitrifizierte Embryonen; Tabelle 1). Vitrifizierte/erwärmte und kontrollierte frische 2-zellige Embryonen wurden auf Empfängerinnen übertragen, wobei keine Unterschiede sowohl in der Schwangerschaftsrate (schwangere/insgesamt übertragene Hündinnen) als auch in der Geburtenrate (geborene/übertragene Jungtiere bei der Gesamtzahl der Empfängerinnen; Tabelle 2). Diese Ergebnisse veranlassen uns, von der SLF-Methode auf die Vitrifikation umzusteigen.
| Anzahl der Embryonen | Überlebensrate bei 2,5 dpc (lebensfähige/aus dem Gerät zurückgewonnene Embryonen) | Embryoentwicklungsrate bei 3,5 dpc (Morulae-Blastozysten/lebensfähige Embryonen) | Schlupfrate bei 5,5 dpc (geschlüpfte Blastozysten/kultivierte Embryonen) | |
| Langsames Einfrieren | 410 | 89,3 % (366/410)a | 91,8 % (336/366)a | 49,7 % (90/181)a |
| Spachtel MVD | 341 | 92,7 % (316/341)b | 97,2 % (307/316)b | 41,0 % (68/166)a |
| Frische Embryonen | 458 | - | 98,7 % (452/458)b | 67,8 % (139/205)b |
Tabelle 1: Überlebens- und In-vitro-Entwicklungsraten von 8-zelligen murinen Embryonen, die vitrifiziert oder langsam eingefroren wurden. In vivo wurden 8-zellige murine Embryonen durch Spatel MVD oder langsames Einfrieren kryokonserviert und mit frischen Embryonen verglichen. Frische Embryonen wurden von Weibchen bei 2,5 dpc entnommen und unter den gleichen Bedingungen wie die anderen Gruppen kultiviert. Die Überlebensrate (lebensfähige/aus dem Gerät gewonnene Embryonen) wurde nach dem Erwärmen/Auftauen bestimmt. Lebensfähige Embryonen wurden in vitro kultiviert. Die Embryoentwicklungsrate (Morulae-Blastozysten/lebensfähige Embryonen) und die Schlupfrate (geschlüpfte/kultivierte Embryonen) wurden mit 3,5 dpc bzw. 5,5 dpc bestimmt. Unterschiedliche hochgestellte Zeichen weisen auf signifikante Unterschiede hin (P < 0,05).
| Anzahl der Embryonen | Wiederfindungsrate (aus dem Gerät/kryokonservierten Embryonen) | Überlebensrate (lebensfähige/aus dem Gerät gewonnene Embryonen) | Schwangerschaftsrate (schwangere/übertragene Hündinnen) | Geburtenrate in der Gesamtzahl der übertragenen Hündinnen (geborene Jungtiere/übertragene Embryonen) | |
| Langsames Einfrieren | 531 | 88,3 % (469/531)a | 85,1 % (399/469)a | - | - |
| Spachtel MVD | 431 | 84,2 % (363/431)a | 94,7 % (344/363)b | 53,3 % (8/15)a | 17,8 % (47/264)a |
| Frische Embryonen | 446 | - | 97,7 % (436/446)b | 53,3 % (8/15)a | 20,6 % (53/257)a |
Tabelle 2: Genesungs- und Überlebensraten von 2-zelligen murinen Embryonen, die vitrifiziert oder langsam eingefroren wurden. Fortpflanzungsergebnisse von vitrifizierten/erwärmten Embryonen im Vergleich zu frischen Embryonen.In vitro hergestellte 2-zellige Embryonen wurden mittels Spatel, MVD oder SLF kryokonserviert. Die Wiederfindung (aus dem Gerät/kryokonservierte Embryonen) und die Überlebensrate (lebensfähige/aus dem Gerät wiedergewonnene Embryonen) wurden nach dem Erwärmen oder Auftauen bestimmt. Lebensfähige, erwärmte und frische Embryonen wurden auf Empfängerinnen übertragen (15 Weibchen pro Gruppe, ~17 Embryonen pro Weibchen). Es wurden die Schwangerschafts- (trächtige/übertragene Hündinnen) und die Geburtsrate (geborene Jungtiere/übertragene Embryonen) bestimmt. Unterschiedliche hochgestellte Zeichen weisen auf signifikante Unterschiede hin (P < 0,05).
Der Spatel MVD wurde auch für die Vitrifikation von in vitro produzierten Präimplantationsembryonen von Schafen getestet und mit einem kommerziellen Gerät verglichen6. Die Ergebnisse sind in Tabelle 3 dargestellt. Die Qualität der Embryonen wurde morphologisch nach den von der International Embryo Technology Society (IETS)15 empfohlenen Kriterien beurteilt, und diese ausgezeichneten und guten Embryonen des Grades 1 wurden jeder Versuchsgruppe zugeteilt.
Weder die Überlebensrate (~70% bzw. ~16%, 3 h bzw. 24 h nach der Erwärmung) noch der Embryonenschlüpf am Tag 8 wurden durch die Vitrifikationsmethode beeinflusst. Der Prozentsatz der Blastozysten am Tag 8 war bei beiden Vitrifikationstechniken niedriger als bei der Kontrollgruppe (frische Embryonen) (~ 8% bzw. 20,5%; P < 0,05). Diese Ergebnisse deuten darauf hin, dass in vitro hergestellte Schafembryonen auch mit dem Spatel MVD vitrifiziert werden können. Darüber hinaus wurden frühere Ergebnisse durch den Transfer von Schafembryonen, die einem langsamen Einfrieren, einem Spatel MVD oder einem kommerziellen Gerät unterzogen wurden, auf Empfängerweibchenergänzt 16. Die Ergebnisse sind in Tabelle 4 dargestellt. Die Überlebensrate der Embryonen (lebensfähige Embryonen am Tag 30/übertragene Embryonen), die Trächtigkeitsrate (trächtige/übertragene Mutterschafe), der Verlust des Fötus von der Trächtigkeit bis zur Geburt (bei der Geburt geborene Lämmer/lebensfähige Embryonen am Tag 30) und die Überlebensrate der Lämmer (lebende Lämmer 1 Woche nach der Geburt/geborene Lämmer) wurden zwischen den Versuchsgruppen bewertet.
Die Ergebnisse zeigten, dass die Überlebensrate des Embryos nach dem Embryotransfer bei SLF (26,5 %) und Spatel MVD (22,2 %) ähnlich war, aber bei der Gruppe der kommerziellen Geräte höher war (52,0 %, P < 0,05). Die Fortpflanzungsergebnisse (Trächtigkeitsdauer, Verlust des Fötus, Geburtsgewicht und Überlebensraten der Lämmer) wurden durch die Kryokonservierungsmethode nicht signifikant beeinflusst. Insgesamt ist der Spatel MVD auch eine geeignete Methode für die Vitrifikation von Präimplantationsembryonen von Schafen.
| Anzahl der Embryonen | Überlebensrate in % (lebensfähige/kryokonservierte Embryonen) | Entwicklungsrate % (Morulae-Blastozysten am Tag 6/gespaltene Embryonen) | Schlupfrate % (geschlüpfte Blastozysten/gespaltene Embryonen) | ||
| 3 h | 24 h | ||||
| Spachtel MVD | 165 | 69,6 ± 2,4A | 14,6 ± 3,5A | 11.1 ± 2.1b | 6,4 ± 1,9b |
| Kommerzielles Gerät | 165 | 71,3 ± 1,3A | 17,7 ± 4,5A | 12,7 ± 3,2b | 10,2 ± 2,9b |
| Kontrollgruppe (frische Embryonen) | 408 | - | - | 41,3 ± 3,7A | 20,5 ± 4,5A |
Tabelle 3: Überlebens- und In-vitro-Entwicklungsraten von Schafembryonen, die einer Vitrifizierung mit einem Spatel MVD oder einem kommerziellen Gerät unterzogen wurden.In vitro produzierte Embryonen im 2-8-Zellstadium (Tag 2 nach der Befruchtung) wurden mit einem Spatel MVD oder einem kommerziellen Gerät vitrifiziert und dann erwärmt. Die Überlebensrate (lebensfähig/kryokonserviert) wurde 3 h und 24 h nach der Erwärmung analysiert. Die Entwicklungs- und Schlupfraten wurden definiert als die Anzahl der Morulae und Blastozysten, die an Tag 6 erhalten wurden, bzw. die Anzahl der geschlüpften Embryonen über der Anzahl der gespaltenen (2-8 Zellen) Embryonen. Unterschiedliche hochgestellte Zeichen in derselben Spalte weisen auf signifikante Unterschiede hin (P < 0,05). Die Daten werden als Mittelwert ± REM angezeigt.
| Überleben der Embryonen (lebensfähige Embryonen am 30. Tag/übertragene Embryonen) | Trächtigkeitsrate (trächtige/übertragene Mutterschafe) | Fetaler Verlust (Lämmer, die bei der Geburt geboren wurden/lebensfähige Embryonen am 30. Tag) | Trächtigkeitslänge (d) | Geburtsgewicht (g) | Überlebensrate der Lämmer (lebende Lämmer eine Woche nach der Geburt/geborene Lämmer) | |
| Spachtel MVD | 22,2 %a (28/126) | 32,9 %a (25/76) | 4,0 %a (1/25) | 150,7 ± 1,8A | 4102 ± 112,4A | 87,5 %a (21/24) |
| Kommerzielles Gerät | 52,0 %b (91/175) | 66,0 %b (62/94) | 11,0 %a (8/73) | 150,4 ± 1,9A | 3980 ± 221,2A | 83,1 %a (54/65) |
| Langsames Einfrieren | 26,5 %a (36/136) | 38,3 %a (28/73) | 6,7 %a (2/30) | 150,4 ± 2,1A | 4319 ± 107,3A | 89,3 %a (25/28) |
Tabelle 4: Wirkung der Kryokonservierungsmethode auf das Überleben der Embryonen nach dem Transfer, die Aufrechterhaltung der Trächtigkeit und die Lammproduktion. Morulae zu expandierten Blastozysten von in vivo oder in vitro produzierten Embryonen wurden vitrifiziert/langsam eingefroren und erwärmt/aufgetaut und auf multipare Merino-synchronisierte Mutterschafe übertragen. Die Überlebensrate der Embryonen (lebensfähige Embryonen am 30. Tag/übertragene Embryonen), die Trächtigkeitsrate (trächtige/übertragene Mutterschafe), der Verlust des Fötus von der Trächtigkeit bis zur Geburt (bei der Geburt geborene Lämmer/lebensfähige Embryonen am 30. Tag), die Trächtigkeitsdauer (d), das Geburtsgewicht (g) und die Überlebensrate der Lämmer (lebende Lämmer eine Woche nach der Geburt/geborene Lämmer) wurden zwischen den Versuchsgruppen verglichen.
Darüber hinaus wurden gentechnisch veränderte Mauslinien, die in unserer Einrichtung nicht mehr verwendet werden, als zweizellige Embryonen mit der Spatula MVD-Methode gesichert. Für jede Mauslinie wurden mindestens 300 zweizellige Embryonen vitrifiziert, die hauptsächlich durch In-vitro-Fertilisation (oder natürliche Paarung) erzeugt wurden. Die Qualitätskontrolle des Prozesses wurde durchgeführt, indem zwei oder drei Spatel jeder Linie erwärmt und die Embryonen auf pseudoschwangere Empfängerinnen übertragen wurden. Repräsentative Ergebnisse verschiedener genetisch veränderter Mauslinien sind in Tabelle 5 dargestellt. Im Durchschnitt lag die Genesungsrate bei 90,4 % und die Überlebensrate bei 96,8 %. Die Schwangerschaftsrate lag bei 80 % und die Geburtenrate bei durchschnittlich 31,5 %. Bemerkenswert ist, dass die Geburtenrate eine breite Palette von Ergebnissen von 12% bis 45% zeigte, was auf die verschiedenen genetischen Veränderungen zurückzuführen sein könnte, die die Empfindlichkeit des Embryos und die Ergebnisse des Embryotransfers beeinflussen können. Im Allgemeinen stimmten diese Ergebnisse mit denen überein, die zuvor in der Anlage erzielt wurden.
| Maus-Linie | Anzahl der vitrifizierten/erwärmten Embryonen | Rückgewinnungsrate (aus dem Gerät gewonnen/ kryokonservierte Embryonen) | Überlebensrate (lebensfähige/aus dem Gerät gewonnene Embryonen) | Schwangerschaftsrate (schwangere/übertragene Hündinnen) | Geburtenrate (geborene/übertragene Jungen) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| Durchschnitt | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
Tabelle 5: Repräsentative Ergebnisse des Vitrifikationsprozesses der Qualitätskontrolle, der an 2-Zell-Embryonen verschiedener genetisch veränderter Mauslinien durchgeführt wurde. Gentechnisch veränderte Mauslinien wurden als zweizellige Embryonen (mindestens 300 Embryonen) mit der Spatula MVD-Methode gesichert. Die Qualitätskontrolle des Prozesses wurde durchgeführt, indem zwei oder drei Spatel jeder Linie erwärmt und die Embryonen auf pseudoschwangere Empfängerinnen übertragen wurden. Die Wiederfindung (aus dem Gerät gewonnen/kryokonservierte Embryonen) und die Überlebensrate (lebensfähige/aus dem Gerät wiedergewonnene Embryonen) wurden nach der Erwärmung bestimmt. Lebensfähige erwärmte Embryonen wurden im 2-Zell-Stadium auf Empfänger-Weibchen übertragen (1 bis 3 Weibchen pro Linie, ~18 Embryonen pro Weibchen). Es wurden die Schwangerschafts- (trächtige/übertragene Hündinnen) und die Geburtsrate (geborene Jungtiere/übertragene Embryonen) bestimmt.
Schließlich haben wir kürzlich eine Vergleichsarbeit durchgeführt, in der frische und vitrifiziert erwärmte Mauszygoten mit CRISPR-Reagenzien mikroinjiziert und dann in vitro kultiviert oder auf pseudoschwangere Weibchen übertragen wurden17. Ziel war es, zu bewerten, ob vitrifizierte Zygoten - unter Verwendung von Spatel MVD - eine geeignete Quelle für Embryonen für die Mikroinjektion in B6D2F1/J- und C57BL/6J-Zygoten sein könnten. Die Heilungs- und Überlebensraten waren ähnlich wie bei den vorherigen Ergebnissen für Embryonen im 2-8-Zellstadium (Tabelle 6). Insgesamt überlebten vitrifiziert erwärmte Zygoten die Mikroinjektion, entwickelten sich zu geschlüpften Blastozysten oder produzierten lebende Jungtiere und zeigten Mutationen, die durch das CRISPR/Cas9-System induziert wurden. Allerdings war die Mutationsrate bei vitrifizierten Zygoten signifikant niedriger als bei frischen. Das Kryobanking von Zygote scheint eine alternative Quelle für Embryonen zu sein, um bei Bedarf Mikroinjektionssitzungen durchzuführen, die die Zucht und Pflege von Tieren während des ganzen Jahres zu vermeiden und die Implementierung von 3R in der CRISPR-Technologie zu verbessern.
| Stamm Zygote | Anzahl der kryokonservierten Zygoten | Wiederfindungsrate (aus dem Gerät zurückgewonnen / kryokonservierte Embryonen) | Überlebensrate (lebensfähige/aus dem Gerät gewonnene Embryonen) |
| B6D2F1/J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL/6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
Tabelle 6: Erholungs- und Überlebensraten von vitrifiziert erwärmten B6D2F1/J- und C57BL/6J-Zygoten. In vivo produzierte Zygoten wurden von B6D2F1/J- und C57BL/6J-Spenderinnen gesammelt, mit Spatel MVD vitrifiziert und erwärmt. Die Raten der Wiederfindung (aus dem Gerät gewonnen/kryokonservierte Embryonen) und der Überlebensraten (lebensfähige/aus dem Gerät wiederhergestellte Embryonen) wurden nach der Erwärmung bestimmt.
Diskussion
Der Spatel MVD ist ein einfach zu montierendes, kostengünstiges Vitrifikationsgerät mit minimalem Volumen mit hoher Embryoaufnahmekapazität und optimaler Flüssigstickstoff-Dewar-Belegung. Diese Methode hat sich als einfach, schnell und robust erwiesen. Im Durchschnitt haben wir nicht nur eine hohe Embryogenesungs- und Überlebensrate von vitrifizierten Embryonen (~90%) erzielt, sondern auch gute Reproduktionsergebnisse beim Embryotransfer bei Mäusen (~80% Schwangerschaftsrate und ~30% Geburtenrate), die mit anderen Vitrifikationsmethoden mit minimalem Volumen vergleichbar sind 18,19,20.
Zu den kritischen Schritten bei der Spatel-MVD-Vitrifikationsmethode gehören: (i) Spatelvorbereitung. Diese Technik erfordert viel Fachwissen. Die Plattform, die in der Gelladerspitze durch Erhitzen mit einer Pinzette hergestellt wird, sollte ~ 1mm2 betragen und muss am Ende geschlossen werden. Bleibt die Spitze offen, kann es beim Eintauchen des Spatels in den Saccharosetropfen während des Erwärmungsprozesses aufgrund von Temperaturunterschieden zu Blasen kommen. Blasen stören die Suche und Genesung von Embryonen. (ii) Inkubation des Embryos in Vitrifikationslösungen. Aufgrund der hohen Dichte bleiben die Embryonen in den Tropfen auf unterschiedlichen Höhen. Eine schnelle Aspiration aller Embryonen ist erforderlich. Eine Toxizität ist zu erwarten, wenn Embryonen längere Zeit bei Raumtemperatur in diesen Lösungen verbleiben. (iii) Tropfen der Pfannenwender-Vitrifikation. Das Volumen des Vitrifikationstropfens, der die Embryonen enthält, sollte ~0,5-1,0 μl betragen; Größere Volumina von Kryoprotektiva beeinflussen die Lebensfähigkeit des Embryos. Wir empfehlen, gezogene Kapillaren mit einem Innendurchmesser zu verwenden, der etwas breiter ist als die Größe eines Embryos, die das benötigte Volumen tragen würden. Darüber hinaus können größere Stürze in der Plattform die Wahrscheinlichkeit erhöhen, dass sie beim Schließen des Systems im 0,5-ml-Strohhalm in der Wand stecken bleiben. (iv) Spachtelversiegelung. Besondere Vorsicht ist geboten, wenn der Spatel mit dem 0,5-ml-Strohhalm verschlossen wird. Beide Elemente müssen aufeinander abgestimmt sein. Embryotropfen im Spatel dürfen nicht gestört werden. (v) Während der Erwärmung ist die Reihenfolge der Entfernung des Stäbchenkennzeichens und des 0,5-ml-Strohhalms einzuhalten. Andernfalls kann der Identifikator durch die Temperaturdifferenz ausgestoßen werden.
Diese Technik erfordert eine Bedienerschulung in verschiedenen Phasen. Die wichtigste Fehlerbehebung könnte die Entnahme der Embryonen aus dem Spatel sein. Wenn weniger als 70-80% der vitrifizierten Embryonen beim Erwärmen des Spatels gewonnen werden, kann dies darauf zurückzuführen sein, dass (i) die Embryonen unvollständig auf die Spatelplattform geladen wurden oder (ii) die Embryonen in der 0,5-ml-Strohinnenwand zurückgehalten werden, wenn das System geschlossen ist. Um das erste Problem zu lösen, muss die Beladung des Tropfens mit den Embryonen unter dem Stereomikroskop mit einer Aspiratorröhrchenbaugruppe und einer gezogenen Kapillare erfolgen, die mit dem Kryoprotektivum beladen ist, das die Embryonen und 2-3 kleine Luftbläschen entlang der Kapillare enthält, was einen korrekten Fluss der Flüssigkeit ermöglicht. Für das zweite Problem: Wenn während der Erwärmung keine Embryonen auf der Plattform sichtbar sind, schneiden Sie den Wattestopfen ab, um den 0,5-ml-Strohhalm zu öffnen, und waschen Sie ihn zweimal mit 500 μl 0,5 M Saccharose in M2 (siehe Abschnitt 2, Schritt 1), und stoßen Sie die Lösung zur Embryonengewinnung in einer Schale aus.
Die Grenzen der Methode beziehen sich hauptsächlich auf die bereits erwähnten kritischen Phasen. Wir glauben, dass der entscheidende Punkt die Spachtelvorbereitung ist. Es braucht Training, um einen guten Spatel auszuführen, aber wenn man ihn einmal gelernt hat, kann er gemeistert werden. Da die Medien hausgemacht sind, kann diese Methode nicht in Kliniken für menschliche Reproduktion angewendet werden.
Der Hauptvorteil des Spatels MVD besteht darin, dass es sich um ein kostengünstiges Gerät im Vergleich zu kommerziellen Gerätenhandelt 9. Darüber hinaus spart es im Vergleich zur Kryoröhrchen-Vitrifikation8 Platz im Flüssigstickstoff-Dewar. Wir haben seine Funktionalität an Maus- und Schafembryonen in verschiedenen Stadien getestet. Es ist besonders einfacher, schneller, wirtschaftlicher und effektiver als das langsame Einfrieren.
Mit dieser Methode können Embryonen verschiedener nicht-menschlicher Säugetierarten in einer Vielzahl von Forschungsbereichen vitrifiziert werden.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Wir danken Alejo Menchaca für seinen Beitrag zur Entwicklung des Spatels MVD. GS erhielt eine Förderung durch das Postgraduiertenprogramm Biotechnologie - Facultad de Ciencias - Universidad de la República (https://webmasterbiotecnol.wixsite.com/biotec1) (Fördernummer: GS 2437 347). GS, MNM und MC erhielten eine Finanzierung durch FOCEM - Fondo para la Convergencia Estructural del Mercosur (https://focem.mercosur.int/es/) (Fördernummer: COF 03/11). GS und MC sind Stipendiaten des Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay. (https://www.anii.org.uy/). Die Geldgeber (Postgraduiertenprogramm für Biotechnologie - Facultad de Ciencias - Universidad de la República; FOCEM - Fondo para la Convergencia Estructural del Mercosur; Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay) spielte keine Rolle bei der Konzeption der Studie, der Datenerhebung und -analyse, der Entscheidung über die Veröffentlichung oder der Vorbereitung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
Referenzen
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten