Method Article
用于哺乳动物胚胎玻璃化的 Spatula Montevideo 装置
摘要
在这里,我们提出了用于玻璃化小鼠和绵羊植入前胚胎的 Spatula Montevideo 方案,包括自制刮刀和利用自制解决方案。胚胎在两种浓度递增的冷冻保护剂溶液中快速平衡,加载到抹刀上,浸入液氮中,最后用 0.5 mL 吸管密封。
摘要
本研究描述了一种用于小鼠和绵羊胚胎冷冻保存的高效且具有成本效益的玻璃化方法,称为蒙得维的亚刮刀 (MVD)。该协议使用自制刮刀作为载体装置,其用凝胶装载器尖端制备。胚胎在两种浓度递增的自制冷冻保护剂溶液中快速平衡,装入刮刀中,然后直接浸入液氮中。大约 30-40 个植入前阶段的小鼠胚胎可以加载到刮刀上,然后用 0.5 mL 吸管密封。使用刮刀代替经常用于储存玻璃化胚胎的冷冻管,优化了液氮杜瓦瓶中的空间。此外,加热过程只需要浓度递减的自制蔗糖溶液即可使胚胎再水化并恢复其形态。我们的实验室已成功将 Spatula Montevideo 用于小鼠和绵羊植入前胚胎超过 10 年。蒙得维的亚刮刀已证明小鼠胚胎的平均恢复率(恢复/玻璃化胚胎)为 84%,存活率(存活/恢复胚胎)为 97%。小鼠胚胎的玻璃化处理比缓慢冷冻产生了更好的结果,尽管没有观察到生殖结果(怀孕、分娩和出生率)的差异。在绵羊胚胎中,与商用设备相比,使用 Spatula Montevideo 实现了相似的存活率和胚胎发育率。尽管商用设备的妊娠率较高,但不同设备的羔羊存活率没有显著差异。抹刀蒙得维的亚玻璃化法是一种简单的冷冻保存技术,可用于储存多余的胚胎,备份转基因小鼠品系和绵羊模型,并促进它们在全球研究人员之间的交流。
引言
由于基于核酸内切酶的方法,特别是 CRISPR/Cas9 的发展,转基因 (GM) 动物生成的效率显著提高。世界各地的许多实验室生产各种转基因小鼠和大鼠品系,应将其冷冻保存以防止遗传漂变并保持原始表型1 的完整性。此外,存档消除了持续繁殖的需要,这通常会导致动物数量过多。一些实验室将转基因小鼠品系作为冷冻保存的胚胎或精子送到国际储存库,以促进这些模型的交换,同时避免运输活体动物。这确保了对生产线的可访问性,而不会重复生成相同的 GM 动物模型2。由于这些原因,胚胎和精子的冷冻保存在任何转基因动物设施中都至关重要。通常,胚胎冷冻保存是储存 GM 品系的首选,因为胚胎包含经过修饰的完整二倍体基因组,并且可以通过胚胎移植轻松恢复。
玻璃化是一种非平衡过程,其特征是进入细胞的水与在其周围形成细胞外晶体的水之间不平衡。这种方法可以防止细胞内冰晶的形成,将其与慢速冷冻法 (SLF) 区分开来3 (见 图 1)。高浓度的冷冻保护剂和与液氮 (LN2) 的直接接触可实现超快速冷却 (~40 °C/s),在几秒钟内实现样品的玻璃体状态。此外,玻璃化冷冻比缓慢冷冻更快、更容易、更便宜4。它需要最少的 LN2 ,通常使用简单的设备,这些设备可以商业购买或自制5 (见 图 1)。
此外,变暖过程通常是快速且可复制的。应快速进行,以避免冷冻保护剂毒性并保持玻璃体状态3.在冷冻胚胎时,许多实验室会考虑载体装置的便利性、可靠性、稳健性、容纳能力和成本。
我们更喜欢使用 Spatula Montevideo (MVD) 设备6 对绵羊和小鼠胚胎进行常规冷冻保存的最小体积刮刀玻璃化方法。最初,我们采用慢速冷冻法7 ,但很快过渡到玻璃化。为了为 LN2 杜瓦瓶制造更简单、更节省空间的设备,我们修改了 Tsang 和 Chow (2009)8 的自制刮刀,将其插入冷冻管,以开发用 0.5 mL 吸管密封的刮刀 MVD(参见 材料表)。刮刀具有凝胶装载器尖端(参见 材料表),其中通过用细镊子轻轻熔化尖端形成约 1 mm² 的平台,形成一个花瓣状板用于加载胚胎。该平台可在一个小玻璃化液滴中容纳多达 40 个小鼠胚胎。将识别塞杆(参见 材料表)插入凝胶上样器尖端的开口端。
这种方法的目的是以一种简单、快速且廉价的方法玻璃化胚胎,此外,还可以节省氮杜瓦瓶中的空间。该系统已成功使用多年,提供了出色的胚胎存活率 (~97%) 和繁殖结果,尤其是在小鼠胚胎中。由于 Spatula MVD 是在实验室制备的,因此与商业设备相比,它是一种低成本的方法9。此外,与使用低温管相比,它节省了氮气杜瓦瓶中的空间 8,10。

图 1:用于胚胎冷冻保存的两种主要技术的比较。 此数字经 Crispo 等人许可修改。创建于 BioRender.com。 请单击此处查看此图的较大版本。
研究方案
用于获取小鼠胚胎的动物根据国家法律 18.611 和国际动物护理准则11 进行饲养和处理。实验方案(许可证编号 #007-18)适时地得到了蒙得维的亚巴斯德研究所动物护理和使用委员会的批准(已给予书面同意)。绵羊卵母细胞/胚胎的实验方案由机构动物护理委员会 Fundación IRAUy 批准(协议 #001-2017),符合 ARRIVE 指南12 ,并按照国际动物护理指南11 进行。
1. 玻璃化(图 2)
- 抹刀 MVD 制备
- 通过切掉前 10 mm 和吸头锥来缩短凝胶加载器尖端(参见 材料表)。
注:这将产生一个更短的直头,便于使用 0.5 mL 吸管进行最终密封(参见 材料表)。 - 用 Watchmaker 的 #5 镊子(参见 材料表)握住凝胶加载器尖端的末端,距离尖端约 1.0 厘米。轻轻地将尖端放入本生灯的火焰中(参见 材料表)并保持 8-10 秒,形成约 1 mm2 的花瓣状平台。
- 从火焰中取出并用镊子紧紧握住 5 秒。
- 使用立体显微镜(见 材料表),检查花瓣状平台(~ 1 mm2)是否形成并且远端边缘是否密封。
注意:平台必须在远端关闭,以防止玻璃化过程中 LN2 浸润。确保平台清洁且没有塑料线。如果它太小或有螺纹,请修剪尖端并重复该过程。 - 重复步骤 1.1.1-1.1.4 以准备必要数量的刮刀(1 个刮刀 = 最多 40 个小鼠胚胎)。
- 使用紫外线 (UV) 或环氧乙烷对刮刀进行消毒,并将其存放在无菌管或盒子中。
- 在玻璃化手术当天,取回抹刀,从平台的另一端处理它们。将识别杆(参见 材料表)插入每个刮刀中,然后将它们放在立体显微镜底座上。用永久性记号笔或耐液氮贴纸标签标记杆。
注意: 处理抹刀时,请务必避免触摸平台。整个装置的总长度(抹刀 + 0.5 mL 吸管 + 识别杆)不应超过高脚杯长度的 1 厘米。
- 通过切掉前 10 mm 和吸头锥来缩短凝胶加载器尖端(参见 材料表)。
- 玻璃化溶液的制备
- 制备 FS 溶液:将 1.5 g 密度梯度培养基(参见 材料表)和 0.85 g 蔗糖(参见 材料表)溶解在 5 mL 磷酸盐缓冲盐水 (PBS;参见 材料表) 中。在沸水浴中加热直至完全溶解,然后使用 0.22 μm 过滤器消毒(参见 材料表)。
注意:该溶液可在 4 °C 下储存长达 6 个月。 - 准备玻璃化前溶液 (PV):在玻璃化当天,混合 10% 乙二醇(见 材料表)、10% 二甲基亚砜(见 材料表)和 80% M2 培养基(见 材料表)。5 个刮刀需要 100 μL 的总体积。
- 制备玻璃化溶液 (V):玻璃化当天,混合 15% 乙二醇、15% 二甲基亚砜、10% M2 培养基和 60% FS 溶液。5 个刮刀需要 100 μL 的总体积。
- 制备 FS 溶液:将 1.5 g 密度梯度培养基(参见 材料表)和 0.85 g 蔗糖(参见 材料表)溶解在 5 mL 磷酸盐缓冲盐水 (PBS;参见 材料表) 中。在沸水浴中加热直至完全溶解,然后使用 0.22 μm 过滤器消毒(参见 材料表)。
- 胚胎脱水和玻璃化过程
- 准备 LN2:将 LN2 倒入合适的容器(例如,10 cm x 30 cm x 20 cm 的绝缘聚苯乙烯容器)中,并放置尽可能多的 0.5 mL 吸管作为要使用的刮刀。
注意:为了在 LN2 下作期间便于刮刀平台的可视化,建议使用彩色底部绝缘聚苯乙烯容器来产生对比效果。
注意: 处理 LN2 时,请佩戴合适的护目镜和手套(参见材料表)。 - 准备溶液:在 100 mm 塑料培养皿上(参见 材料表),滴入以下液滴:每个刮刀 100 μL M2、20 μL PV 溶液和 20 μL V 溶液。
- 玻璃化胚胎:将要玻璃化的胚胎放入 M2 滴中。一次处理 30-40 个胚胎,将它们在 PV 溶液滴中孵育 30 秒,然后在室温 (RT) 下在 V 溶液滴中再孵育 30 秒。
- 将拉拉玻璃毛细管(参见 材料表)与吸气管组件(参见 材料表)一起使用。在放置胚胎之前,在毛细管中预加载至少 1 μL 的相应溶液。
注意:胚胎在液滴中将处于不同的高度,因此请调整立体显微镜千分尺以定位它们。当剩余 10 秒时,从每滴中取回胚胎。所有胚胎作必须在立体显微镜下进行。 - 加载胚胎:使用最少的 V 溶液(例如,~ 0.1 μL)吸出胚胎,并将它们快速放在刮刀平台上。
- 浸入 LN2:加载胚胎后,立即将刮刀平台浸入 LN2 中 5 秒(用手握住刮刀,用杆)。然后,在将刮刀保持在 LN2 蒸汽中的同时,使用不锈钢长镊子用 0.5 mL 吸管密封(参见 材料表)。
注意:密封前从吸管中取出 LN2 ,以防止在加热过程中膨胀。确保刮刀和吸管正确对齐,以避免胚胎滴和吸管壁接触。为方便起见,密封的刮刀可以留在 LN2 容器中,直到所有刮刀都装满胚胎,必要时重新填充 LN2 。 - 重复程序:对每组胚胎重复步骤 1.3.3 至 1.3.7,使用一对新的 PV 和 V 滴剂。
- 储存:将抹刀转移到高脚杯中(参见 材料表),然后转移到 LN2 仓储杜瓦瓶中(参见 材料表)。
- 准备 LN2:将 LN2 倒入合适的容器(例如,10 cm x 30 cm x 20 cm 的绝缘聚苯乙烯容器)中,并放置尽可能多的 0.5 mL 吸管作为要使用的刮刀。

图 2:使用 Spatula MVD 的玻璃化过程示意图。 有关更多详细信息,请参阅文本。在 BioRender 中创建。梅克尔,M. (2025) https://BioRender.com/x96y902。请单击此处查看此图的较大版本。
2. 变暖(图 3)
- 溶液制备
- 制备 1 M 蔗糖溶液,将 0.85 g 蔗糖溶解在 2.5 mL M2 培养基中。用 0.22 μm 过滤器对溶液进行消毒。
注意:该溶液可以制备并在 4 °C 下储存长达 1 周。 - 用适当体积的 M2 培养基稀释 1 M 蔗糖溶液,制备 0.5 M 和 0.25 M 蔗糖溶液。
- 将蔗糖溶液保持在 37 °C 的热板上(参见 材料表),直到开始升温。
- 制备 1 M 蔗糖溶液,将 0.85 g 蔗糖溶解在 2.5 mL M2 培养基中。用 0.22 μm 过滤器对溶液进行消毒。
- 加热板准备
- 在 100 mm 塑料培养皿上,放置以下溶液滴:每个待加热的刮刀滴 500 μL 0.5 M 蔗糖、50 μL 0.5 M 蔗糖和 50 μL 0.25 M 蔗糖。放置三滴 M2 培养基(每滴 100 μL)进行洗涤。
- 升温过程
注意:加热过程在 RT 下进行,例如,在立体显微镜的底座上 20-22 °C。- 从杜瓦瓶中取出密封的抹刀。将它们放入装有 LN2 的适当容器中。参见 图 3。
- 将加热板放在立体显微镜上。用不锈钢镊子握住抹刀的底部,用戴手套的手拉出识别杆,然后拉出吸管。将含有胚胎的平台快速浸入 500 μL 的 0.5 M 蔗糖滴中。
- 确保所有胚胎都已落入液滴中;如有必要,轻轻移动抹刀以帮助它们释放。将胚胎加载到拉动的玻璃毛细管中,将它们放入 50 μL 的 0.5 M 蔗糖溶液中,孵育 2 分钟。
- 将胚胎放入 50 μL 的 0.25 M 蔗糖溶液中,再孵育 2 分钟。
注:在将胚胎放入每种溶液中之前,请在毛细管中预装要使用的溶液。 - 最后,在不同的 M2 培养基中洗涤胚胎 3 次以去除蔗糖。
- 使用前,在适合每个物种的条件下孵育胚胎至少 1 小时。
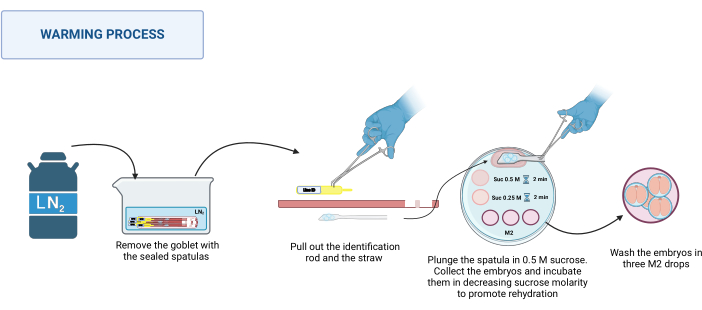
图 3:Spatula MVD 加热过程的示意图。有关更多详细信息,请参阅文本。 在 BioRender 中创建。梅克尔,M. (2025) https://BioRender.com/k91k191。请单击此处查看此图的较大版本。
结果
我们最初使用基于丙二醇溶液、吸管和控速冷冻设备的传统慢速冷冻方法7.然而,在考虑到玻璃化方法可能是一种更简单且更具成本效益的选择后,我们进行了一项研究,以比较传统慢速冷冻 (SLF) 与刮刀 MVD 在 8 细胞 体内 衍生和 2 细胞 体外 产生的小鼠胚胎中的结果13(表 1 和表 2)。结果以“恢复率”表示,该比率定义了加热后从设备中恢复的胚胎数量与冷冻保存胚胎总数之比。“存活率”是指从设备中回收的胚胎中存活胚胎的数量。如果卵裂球完整(2 细胞胚胎中有 2 个卵裂球,8 细胞胚胎中至少有 4 个卵裂球),则认为胚胎是可行的14。这些术语用于评估设备和整个过程是否适合冷冻保存。
在小鼠胚胎中,刮刀 MVD 的存活率 (表 1 和 表 2) 和后 3.5 天的发育率 (dpc;例如,桑椹和囊胚胚胎, 表 1) 显著高于 SLF 组。尽管两种方法都达到了可接受的孵化率,但正如预期的那样,它显着低于对照新鲜组(非玻璃化胚胎; 表 1)。将玻璃化/加热和对照新鲜的 2 细胞胚胎移植给受体雌性,显示妊娠率(怀孕/移植的雌性总数)和出生率(出生/移植的胚胎的幼崽在受体雌性总数中)没有差异; 表 2)。这些结果导致我们从 SLF 方法转向玻璃化法。
| 胚胎数量 | 2.5 dpc 时的存活率(从设备中存活/回收的胚胎) | 3.5 dpc 时的胚胎发育速率(桑椹胚-囊胚/活胚胎) | 5.5 dpc 时的孵化率(孵化的囊胚/培养的胚胎) | |
| 缓慢冻结 | 410 | 89.3 % (366/410)一个 | 91.8 % (336/366)一个 | 49.7 % (90/181)一个 |
| 抹刀 MVD | 341 | 92.7 % (316/341)乙 | 97.2 % (307/316)乙 | 41.0 % (68/166)一个 |
| 新鲜胚胎 | 458 | - | 98.7 % (452/458)乙 | 67.8 % (139/205)乙 |
表 1: 玻璃化或缓慢冷冻的 8 细胞小鼠胚胎的存活率和体外发育率。体内 8 细胞小鼠胚胎通过 Spatula MVD 或缓慢冷冻冷冻保存,并与新鲜胚胎进行比较。从 2.5 dpc 的雌性中收集新鲜胚胎,并在与其他组相同的条件下培养。升温/解冻后确定存活率(从设备中存活/回收的胚胎)。活的胚胎在体外培养。胚胎发育速率 (桑椹囊胚/活胚胎) 和孵化速率 (孵化/培养的胚胎) 分别在 3.5 dpc 和 5.5 dpc 下测定。不同上标表示差异显著 (P < 0.05)。
| 胚胎数量 | 恢复率(从设备/冷冻保存的胚胎中恢复) | 存活率(从设备中存活/回收的胚胎) | 怀孕率(怀孕/移植女性) | 移植雌性(出生/移植胚胎的幼仔)的出生率 | |
| 缓慢冻结 | 531 | 88.3 % (469/531)一个 | 85.1 % (399/469)一个 | - | - |
| 抹刀 MVD | 431 | 84.2 % (363/431)一个 | 94.7 % (344/363)b | 53.3 % (8/15)一个 | 17.8 % (47/264)一个 |
| 新鲜胚胎 | 446 | - | 97.7 % (436/446)乙 | 53.3 % (8/15)一个 | 20.6 % (53/257)一个 |
表 2:玻璃化或缓慢冷冻的 2 细胞小鼠胚胎的恢复率和存活率。玻璃化/加热胚胎与新鲜胚胎的生殖结果。体外产生的 2 细胞胚胎用 Spatula MVD 或 SLF 冷冻保存。升温或解冻后确定恢复率(从设备中回收/从设备中回收的胚胎)和存活率(从设备中回收的胚胎)。将活的温胚胎和新鲜胚胎移植给受体雌性 (每组 15 只雌性,每只雌性 ~17 个胚胎)。确定了怀孕率 (怀孕/移植雌性) 和出生率 (幼崽出生/移植胚胎)。不同上标表示差异显著 (P < 0.05)。
还对刮刀 MVD 进行了 体外 生产的绵羊植入前胚胎的玻璃化测试,并与商业设备进行了比较6。结果如 表 3 所示。按照国际胚胎技术协会 (IETS) 15 推荐的标准通过形态学评估胚胎的质量,并将那些优秀和良好的 1 级胚胎分配给每个实验组。
玻璃化冷冻法对存活率 (分别为 ~70% 和 ~16%,加热后 3 小时或 24 小时) 和第 8 天的胚胎孵化均不受玻璃化方法的影响。与对照组(新鲜胚胎)相比,两种玻璃化技术在第 8 天的囊胚百分比较低(分别为 ~ 8% 和 20.5%;P < 0.05)。这些结果表明, 体外 产生的绵羊胚胎也可以使用 Spatula MVD 进行玻璃化。此外,通过将经受慢速冷冻的绵羊胚胎、抹刀 MVD 或商业设备移植给受体雌性来补充先前的结果16。 结果如表 4 所示。在实验组之间评估胚胎存活率(第 30 天活胚胎/移植胚胎)、妊娠率(怀孕/移植母羊)、从妊娠到出生的胎儿丢失(出生时评估的羔羊/第 30 天评估的活胚胎)和羔羊存活率(出生后 1 周的活羔羊/羔羊出生)。
结果显示,SLF (26.5%) 和 Spatula MVD (22.2%) 胚胎移植后的胚胎存活率相似,但商业设备组 (52.0%,P < 0.05)。冷冻保存方法对生殖结局 (妊娠期、流产、出生体重和羔羊存活率) 没有显著影响。总体而言,抹刀 MVD 也是适合绵羊植入前胚胎玻璃化的方法。
| 胚胎数量 | 存活率 %(活/冻存胚胎) | 发育速率 %(第 6 天的桑葚囊胚/裂解的胚胎) | 孵化率 %(孵化的囊胚/裂解的胚胎) | ||
| 3 小时 | 24 小时 | ||||
| 抹刀 MVD | 165 | 69.6 ± 2.4安 | 14.6 ± 3.5安培 | 11.1 ± 2.1b | 6.4 ± 1.9b |
| 商用设备 | 165 | 71.3 ± 1.3安 | 17.7 ± 4.5安培 | 12.7 ± 3.2b | 10.2 ± 2.9b |
| 对照组(新鲜胚胎) | 408 | - | - | 41.3 ± 3.7安培 | 20.5 ± 4.5安培 |
表 3:使用 Spatula MVD 或商业设备玻璃化冷冻的绵羊胚胎的存活率和体外发育率。使用刮刀 MVD 或商业设备将体外产生的 2-8 个细胞期胚胎(受精后第 2 天)玻璃化,然后加热。在升温后 3 小时和 24 小时分析存活率 (活体/冻存)。发育和孵化速率分别定义为第 6 天获得的桑椹和囊胚的数量以及孵化的胚胎数量与切割(2-8 个细胞)胚胎的数量。同一列中的不同上标表示差异显著 (P < 0.05)。数据显示为 SEM ±平均值。
| 胚胎存活率(第 30 天的活胚胎/移植胚胎) | 怀孕率(怀孕/转移的母羊) | 胎儿丢失(出生时进入的羔羊/第 30 天有活力的胚胎) | 妊娠期 (d) | 出生体重 (g) | 羔羊存活率(出生后 1 周的活羔羊/出生的羔羊) | |
| 抹刀 MVD | 22.2 %a (28/126) | 32.9 %a (25/76) | 4.0 %a (1/25) | 150.7 ± 1.8安 | 4102 ± 112.4安 | 87.5 %a (21/24) |
| 商用 设备 | 52.0 %乙 (91/175) | 66.0 %乙 (62/94) | 11.0 %a (8/73) | 150.4 ± 1.9安培 | 3980 ± 221.2安培 | 83.1 %a (54/65) |
| 缓慢冻结 | 26.5 %a (36/136) | 38.3 %a (28/73) | 6.7 %a (2/30) | 150.4 ± 2.1安 | 4319 ± 107.3安 | 89.3 %a (25/28) |
表 4:冷冻保存方法对移植后胚胎存活、妊娠维持和羔羊生产的影响。 将桑椹对 体内 或 体外 产生的胚胎的扩增囊胚进行玻璃化/缓慢冷冻和加热/解冻,并转移到经产美利奴同步母羊身上。比较实验组之间的胚胎存活率(第 30 天有活力的胚胎/移植的胚胎)、怀孕率(怀孕/移植的母羊)、从妊娠到出生的胎儿损失(出生时进入的羔羊/第 30 天有活力的胚胎)、妊娠长度 (d)、出生体重 (g) 和羔羊存活率(出生后 1 周的活羔羊/羔羊出生)。
此外,使用 Spatula MVD 方法将我们设施中不再使用的转基因小鼠系备份为双细胞胚胎。每个小鼠品系至少 300 个主要通过 体外 受精(或自然交配)产生的双细胞胚胎玻璃化。通过加热每条细胞系的两到三个刮刀并将胚胎转移给假怀孕的雌性受体来对该过程进行质量控制。不同转基因小鼠品系的代表性结果如 表 5 所示。平均恢复率为 90.4%,存活率为 96.8%。怀孕率为 80%,平均出生率为 31.5%。值得注意的是,出生率显示出从 12% 到 45% 的广泛结果,这可能是由于不同的基因修饰会影响胚胎敏感性和胚胎移植结果。总的来说,这些结果与之前在工厂获得的结果一致。
| 鼠标线 | 玻璃化/加热 胚胎的数量 | 恢复率(从设备中回收/冷冻保存的胚胎) | 存活率(从设备中存活/回收的胚胎) | 怀孕率(怀孕/移植女性) | 出生率(出生/移植的幼仔胚胎) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| 平均 | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
表 5:在不同转基因小鼠品系的 2 细胞胚胎中进行的质量控制玻璃化过程的代表性结果。 使用 Spatula MVD 方法将 GM 小鼠品系备份为双细胞胚胎 (最少 300 个胚胎)。通过加热每条细胞系的两到三个刮刀并将胚胎转移给假怀孕的雌性受体来对该过程进行质量控制。加热后确定恢复率(从设备/冷冻保存的胚胎中恢复)和存活率(从设备中恢复的存活/恢复的胚胎)。将活的加热胚胎以 2 细胞阶段转移给受体雌性 (每系 1 至 3 只雌性,每只雌性 ~18 个胚胎)。确定了怀孕率 (怀孕/移植雌性) 和出生率 (幼崽出生/移植胚胎)。
最后,我们最近进行了一项比较工作,其中新鲜和玻璃化加热的小鼠受精卵用 CRISPR 试剂显微注射,然后在 体外 培养或转移给假怀孕的雌性17。目的是评估使用 Spatula MVD 的玻璃化受精卵是否可以成为 B6D2F1/J 和 C57BL/6J 受精卵显微注射的合适胚胎来源。恢复率和存活率与之前为 2-8 个细胞期胚胎获得的结果相似(表 6)。总体而言,玻璃化加热的受精卵在显微注射中存活下来,发育成孵化的囊胚或产生活的幼崽,并表现出由 CRISPR/Cas9 系统诱导的突变。然而,玻璃化受精卵的突变率显著低于新鲜受精卵。受精卵冷冻库似乎是按需进行显微注射的胚胎替代来源,避免了全年动物的繁殖和维持,并加强了 3R 在 CRISPR 技术中的实施。
| 菌株 zygote | 冷冻保存的受精卵数量 | 恢复率(从设备/冷冻保存的胚胎中恢复) | 存活率(从设备中存活/回收的胚胎) |
| 编号 B6D2F1/J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL/6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
表 6:玻璃化加热的 B6D2F1/J 和 C57BL/6J 受精卵的恢复率和存活率。 从 B6D2F1/J 和 C57BL/6J 供体雌性中收集体内产生的受精卵,用 Spatula MVD 玻璃化,并加热。加热后确定恢复率(从设备/冷冻保存的胚胎中恢复)和存活率(从设备中恢复的存活/恢复的胚胎)。
讨论
Spatula MVD 是一种易于组装、低成本、最小体积的玻璃化装置,具有高胚胎容纳能力和最佳的液氮杜瓦瓶占有率。这种方法已被证明简单、快速且稳健。平均而言,我们不仅实现了玻璃化胚胎的高胚胎恢复率和存活率 (~90%),而且在小鼠进行胚胎移植时也取得了良好的生殖结果(~80% 的妊娠率和 ~30% 的出生率),这与其他最小体积玻璃化方法相当 18,19,20。
抹刀 MVD 玻璃化方法的关键步骤包括:(i) 抹刀制备。这种技术需要相当多的专业知识。用镊子加热凝胶上样器尖端产生的平台应为 ~ 1mm2 ,并且必须在末端闭合。如果尖端保持打开状态,由于温差,在加热过程中将刮刀插入蔗糖滴中时可能会形成气泡。气泡会干扰胚胎的寻找和恢复。(ii) 玻璃化溶液中的胚胎孵育。由于密度高,胚胎在液滴中保持在不同的高度。需要快速抽吸所有胚胎。如果胚胎在室温下在这些溶液中停留时间较长,则预计会产生毒性。(iii) 刮刀玻璃化滴剂。平台中含有胚胎的玻璃化液滴的体积应为 ~0.5-1.0 μL;较大的冷冻保护剂体积会影响胚胎活力。我们建议使用内径比胚胎大小稍宽的拉拉毛细管,这样可以承载所需的体积。此外,在关闭系统时,平台中较大的液滴可能会增加卡在壁内 0.5 mL 吸管中的可能性。(iv) 刮刀密封。用 0.5 mL 吸管合上刮刀时必须特别小心;这两个元素都必须对齐。刮刀中的胚胎滴不能受到干扰。(v) 在加热过程中,按照移除杆标识符和 0.5 mL 吸管的顺序进行作。否则,标识符可能会被温差驱逐。
这项技术需要在不同阶段对作员进行培训。主要的故障排除可能是从刮刀中恢复胚胎。如果在加热刮刀时回收的玻璃化胚胎少于 70-80%,这可能是由于 (i) 胚胎未完全加载到刮刀平台上或 (ii) 当系统关闭时,胚胎保留在 0.5 mL 吸管内壁中。为了克服第一个问题,必须在立体显微镜下使用抽吸管组件和装有冷冻保护剂介质的拉动毛细管加载含有胚胎的液滴,并沿毛细管有 2-3 个小气泡,这允许液体正确流动。对于第二个问题,如果在加热过程中在平台上看不到胚胎,请剪断棉塞以打开 0.5 mL 吸管,然后用 500 μL 0.5 M 蔗糖的 M2 溶液洗涤两次(参见第 2 节,第 1 步),将溶液排出培养皿中用于胚胎回收。
该方法的局限性主要与已经提到的关键阶段有关。我们认为关键是刮刀的准备。演奏一把好的刮刀需要训练,但一旦学会,就可以掌握。由于培养基是自制的,因此该方法不能用于人类生殖诊所。
Spatula MVD 的主要优点是,与商用设备相比,它是一种低成本的设备9。此外,与冷冻管玻璃化相比,它节省了液氮杜瓦瓶中的空间8。 我们已经在不同阶段的小鼠和绵羊胚胎上测试了它的功能。它比慢速冷冻方法特别简单、快速、更经济、更有效。
该方法可用于在广泛的研究领域中对不同非人类哺乳动物物种的胚胎进行玻璃化。
披露声明
作者声明没有利益冲突。
致谢
我们感谢 Alejo Menchaca 对 Spatula MVD 开发做出的贡献。GS 获得了生物技术研究生计划 - Facultad de Ciencias - Universidad de la República (https://webmasterbiotecnol.wixsite.com/biotec1) 的资助(资助号:GS 2437 347)。GS、MNM 和 MC 获得了 FOCEM - Fondo para la Convergencia Estructural del Mercosur (https://focem.mercosur.int/es/) 的资助(资助号:COF 03/11)。GS 和 MC 是乌拉圭 Sistema Nacional de Investigadores、Agencia Nacional de Investigación e Innovación 的研究员。(https://www.anii.org.uy/)。资助者(生物技术研究生计划 - Facultad de Ciencias -Universidad de la República;FOCEM - Fondo para la Convergencia Estructural del Mercosur;Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay)在研究设计、数据收集和分析、发表决定或手稿准备方面没有作用。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
参考文献
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。