Method Article
Espátula Montevideo Dispositivo para la vitrificación de embriones de mamíferos
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos el protocolo Espátula Montevideo para vitrificar embriones de preimplantación de ratones y ovejas, que consiste en una espátula casera y utiliza soluciones caseras. Los embriones se equilibran rápidamente en dos soluciones crioprotectoras de concentración creciente, se cargan en la espátula, se sumergen en nitrógeno líquido y finalmente se sellan con una pajita de 0,5 ml.
Resumen
Este estudio describe un método de vitrificación eficiente y rentable para la criopreservación de embriones de ratón y oveja conocido como la Espátula Montevideo (MVD). Este protocolo utiliza una espátula casera como dispositivo portador, que se prepara con una punta de cargador de gel. Los embriones se equilibran rápidamente en dos soluciones crioprotectoras caseras de concentración creciente, se cargan en la espátula y luego se sumergen directamente en nitrógeno líquido. Aproximadamente 30-40 embriones de ratón en etapa de preimplantación se pueden cargar en la espátula, que posteriormente se sella con una pajita de 0,5 ml. El uso de espátulas en lugar de criotubos, que se utilizan con frecuencia para almacenar embriones vitrificados, optimiza el espacio en los dewars de nitrógeno líquido. Además, el proceso de calentamiento requiere solo una solución casera de sacarosa de concentración decreciente para rehidratar los embriones y restaurar su morfología. Nuestro laboratorio ha utilizado con éxito la Espátula Montevideo para embriones preimplantatorios de ratón y oveja durante más de 10 años. La Espátula Montevideo ha demostrado una tasa media de recuperación (embriones recuperados/vitrificados) del 84% y una tasa de supervivencia (embriones viables/recuperados) del 97% en embriones de ratón. La vitrificación de embriones murinos ha dado mejores resultados que la congelación lenta, aunque no se han observado diferencias en los resultados reproductivos (tasas de embarazo, parto y natalidad). En embriones de oveja, se han logrado tasas de supervivencia y desarrollo embrionario similares con Spatula Montevideo en comparación con un dispositivo comercial. Aunque la tasa de preñez fue mayor para el dispositivo comercial, la tasa de supervivencia de los corderos no fue significativamente diferente entre los dispositivos. El método de vitrificación Espátula Montevideo es una técnica de criopreservación sencilla que se puede utilizar para almacenar embriones sobrantes, respaldar líneas de ratones modificados genéticamente y modelos de ovejas, y facilitar su intercambio entre investigadores de todo el mundo.
Introducción
La eficiencia de la generación de animales genéticamente modificados (GM) ha aumentado significativamente debido al desarrollo de métodos basados en endonucleasas, en particular CRISPR/Cas9. Muchos laboratorios en todo el mundo producen varias líneas de ratones y ratas transgénicos que deben ser criopreservadas para evitar la deriva genética y mantener la integridad delfenotipo original. Además, el archivo elimina la necesidad de una cría constante, que a menudo resulta en un número excesivo de animales. Algunos laboratorios envían líneas de ratones transgénicos como embriones criopreservados o esperma a repositorios internacionales, lo que facilita el intercambio de estos modelos y evita el transporte de animales vivos. Esto garantiza la accesibilidad a las líneas sin la generación repetitiva de modelos animales modificados genéticamente idénticos2. Por estas razones, la criopreservación de embriones y espermatozoides es primordial en cualquier instalación de animales modificados genéticamente. Por lo general, se prefiere la criopreservación de embriones para almacenar líneas transgénicas porque los embriones contienen el genoma diploide completo con modificaciones y se pueden recuperar fácilmente mediante la transferencia de embriones.
La vitrificación es un proceso de no equilibrio caracterizado por un desequilibrio entre el agua que entra en la célula y el agua que forma cristales extracelulares a su alrededor. Este método evita la formación de cristales de hielo intracelular, distinguiéndolo del método de congelación lenta (SLF)3 (ver Figura 1). La alta concentración de crioprotectores y el contacto directo con el nitrógeno líquido (LN2) permiten un enfriamiento ultrarrápido (~40 °C/s), logrando un estado vítreo de las muestras en cuestión de segundos. Además, la vitrificación es más rápida, fácil y menos costosa que la congelación lenta4. Requiere un LN2 mínimo y, por lo general, emplea equipos simples que se pueden comprar comercialmente o hacer en casa5 (consulte la Figura 1).
Además, el proceso de calentamiento es generalmente rápido y replicable. Debe realizarse rápidamente para evitar la toxicidad del crioprotector y mantener el estado vítreo3. A la hora de congelar embriones, muchos laboratorios tienen en cuenta la conveniencia del dispositivo portador, su fiabilidad, robustez, capacidad de retención y costes.
Preferimos el método de vitrificación con espátula de volumen mínimo para la criopreservación rutinaria de embriones de ovejas y ratones, utilizando el dispositivo Spatula Montevideo (MVD)6. Inicialmente, empleamos el método de congelación lenta7 , pero rápidamente pasamos a la vitrificación. Para crear un dispositivo más simple y más eficiente en el espacio para el LN2 dewar, modificamos la espátula casera de Tsang y Chow (2009)8, que se conecta a un tubo criogénico, para desarrollar la espátula MVD que se sella con una pajita de 0,5 mL (ver Tabla de Materiales). La espátula cuenta con una punta de gel (ver Tabla de Materiales), donde se forma una plataforma de aproximadamente 1 mm² derritiendo suavemente la punta con pinzas finas, creando una placa en forma de pétalo para cargar los embriones. Esta plataforma puede alojar hasta 40 embriones de ratón en una pequeña gota de vitrificación. Se inserta una varilla de tapón de identificación (ver Tabla de Materiales) en el extremo abierto de la punta del cargador de gel.
El objetivo de este método es vitrificar embriones de una forma sencilla, rápida y económica que, además, ahorra espacio en el dewar de nitrógeno. Este sistema se ha utilizado con éxito durante muchos años, proporcionando excelentes tasas de supervivencia embrionaria (~ 97%) y resultados reproductivos, particularmente en embriones de ratón. Dado que la espátula MVD se prepara en el laboratorio, es un método de bajo costo en comparación con los dispositivos comerciales9. Además, ahorra espacio en la dewar de nitrógeno en comparación con el uso de criotubos 8,10.

Figura 1: Comparación de las dos principales técnicas utilizadas para la criopreservación de embriones. Esta figura ha sido modificada con permiso de Crispo et al.1. Creado en BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Los animales utilizados para la obtención de embriones de ratón fueron alojados y manipulados de acuerdo con la ley nacional 18.611 y las directrices internacionales de cuidado animal11. El protocolo experimental (permiso número #007-18) fue aprobado oportunamente por el Comité de Cuidado y Uso de Animales del Institut Pasteur de Montevideo (se dio consentimiento por escrito). Los protocolos experimentales para ovocitos/embriones de oveja fueron aprobados por el Comité Institucional de Cuidado Animal Fundación IRAUy (protocolo #001-2017), cumpliendo con las directrices ARRIVE12 y se llevaron a cabo de acuerdo con las guías internacionales de cuidado animal11.
1. Vitrificación (Figura 2)
- Preparación de la espátula MVD
- Acorte la punta del cargador de gel (ver Tabla de Materiales) cortando los primeros 10 mm y el cono de la punta.
NOTA: Esto crea una punta más corta y recta, lo que facilita el sellado final con la pajita de 0,5 mL (ver Tabla de Materiales). - Sujete el extremo de la punta del cargador de gel con pinzas de relojero #5 (ver Tabla de Materiales) aproximadamente a 1,0 cm de la punta. Coloque suavemente la punta en la llama de un mechero Bunsen (consulte la Tabla de materiales) y manténgala durante 8-10 s para formar una plataforma en forma de pétalo de aproximadamente 1 mm2.
- Retirar de la llama y sujetar firmemente con las pinzas durante 5 s.
- Con un microscopio estereoscópico (ver Tabla de Materiales), verifique que la plataforma en forma de pétalo (~ 1 mm2) esté formada y que el borde distal esté sellado.
NOTA: La plataforma debe estar cerrada en el extremo distal para evitar la infiltración de LN2 durante la vitrificación. Asegúrese de que la plataforma esté limpia y libre de hilos de plástico. Si es demasiado pequeño o tiene hilos, recorte la punta y repita el procedimiento. - Repita los pasos 1.1.1-1.1.4 para preparar el número necesario de espátulas (1 espátula = hasta 40 embriones de ratón).
- Esterilice las espátulas con rayos ultravioleta (UV) u óxido de etileno y guárdelas en un tubo o caja estéril.
- El día de la vitrificación, recupere las espátulas, manipulándolas desde el extremo opuesto de la plataforma. Inserte una varilla de identificación (ver Tabla de Materiales) en cada espátula y colóquelas en la base del microscopio estereoscópico. Etiquete la varilla con un marcador permanente o una etiqueta adhesiva resistente al nitrógeno líquido.
NOTA: Evite siempre tocar la plataforma al manipular las espátulas. La longitud total del dispositivo completo (espátula + pajita de 0,5 mL + varilla de identificación) no debe exceder más de 1 cm de la longitud de la copa.
- Acorte la punta del cargador de gel (ver Tabla de Materiales) cortando los primeros 10 mm y el cono de la punta.
- Preparación de soluciones de vitrificación
- Preparar la solución FS: Disuelva 1,5 g de medio de gradiente de densidad (ver Tabla de Materiales) y 0,85 g de sacarosa (ver Tabla de Materiales) en 5 mL de solución salina tamponada con fosfato (PBS; ver Tabla de Materiales). Calentar en un baño de agua hirviendo hasta que se disuelva por completo, luego esterilizar con un filtro de 0,22 μm (ver Tabla de Materiales).
NOTA: Esta solución puede almacenarse a 4 °C durante un máximo de 6 meses. - Preparar la solución de previtrificación (PV): El día de la vitrificación, mezcle un 10% de etilenglicol (ver Tabla de Materiales), un 10% de dimetilsulfóxido (ver Tabla de Materiales) y un 80% de medio M2 (ver Tabla de Materiales). Se necesita un volumen total de 100 μL para 5 espátulas.
- Prepare la solución de vitrificación (V): El día de la vitrificación, combine un 15 % de etilenglicol, un 15 % de dimetilsulfóxido, un 10 % de medio M2 y una solución de FS al 60 %. Se requiere un volumen total de 100 μL para 5 espátulas.
- Preparar la solución FS: Disuelva 1,5 g de medio de gradiente de densidad (ver Tabla de Materiales) y 0,85 g de sacarosa (ver Tabla de Materiales) en 5 mL de solución salina tamponada con fosfato (PBS; ver Tabla de Materiales). Calentar en un baño de agua hirviendo hasta que se disuelva por completo, luego esterilizar con un filtro de 0,22 μm (ver Tabla de Materiales).
- Proceso de deshidratación y vitrificación embrionaria
- Prepare LN2: Vierta LN2 en un recipiente adecuado (por ejemplo, un recipiente de poliestireno aislado de 10 cm x 30 cm x 20 cm) y coloque tantas pajitas de 0,5 ml como espátulas para usar.
NOTA: Para facilitar la visualización de la plataforma de la espátula durante la manipulación bajo LN2, se sugiere que se utilice un contenedor de poliestireno con aislamiento inferior de color para crear un efecto de contraste.
PRECAUCIÓN: Use gafas y guantes apropiados (consulte la Tabla de materiales) cuando manipule LN2. - Preparar soluciones: En una placa de Petri de plástico de 100 mm (ver Tabla de Materiales), coloque las siguientes gotas: 100 μL de M2, 20 μL de solución PV y 20 μL de solución V para cada espátula.
- Vitrificar embriones: Colocar los embriones a vitrificar en la gota M2. Manipule de 30 a 40 embriones a la vez, incubándolos en la gota de solución PV durante 30 s y luego en la gota de solución V durante otros 30 s a temperatura ambiente (RT).
- Utilice un capilar de vidrio estirado (consulte la Tabla de Materiales) con un conjunto de tubo aspirador (consulte la Tabla de Materiales). Precargue el capilar con al menos 1 μL de la solución respectiva antes de colocar los embriones.
NOTA: Los embriones estarán a diferentes alturas en las gotas, así que ajuste el micrómetro del microscopio estereoscópico para localizarlos. Recupere los embriones de cada gota cuando queden 10 s. Todas las manipulaciones embrionarias deben realizarse bajo el microscopio estereoscópico. - Cargar embriones: Aspire los embriones utilizando una solución V mínima (por ejemplo, ~ 0,1 μL) y colóquelos rápidamente en la plataforma de la espátula.
- Inmersión en LN2: Después de cargar los embriones, sumergir inmediatamente la plataforma de la espátula en LN2 durante 5 s (sujetando la espátula con la mano, por su varilla). Luego, mientras mantiene la espátula en vapores LN2 , séllela con una pajita de 0,5 ml con pinzas largas de acero inoxidable (consulte la tabla de materiales).
NOTA: Retire el LN2 de la pajita antes de sellar para evitar la expansión durante el calentamiento. Asegúrese de que la espátula y la pajita estén alineadas correctamente para evitar el contacto entre la gota del embrión y la pared de la pajita. Para mayor comodidad, las espátulas selladas pueden permanecer en el contenedor LN2 hasta que todas las espátulas estén cargadas con embriones, rellenando con LN2 según sea necesario. - Repita el procedimiento: Repita los pasos 1.3.3 a 1.3.7 para cada grupo de embriones, utilizando un par de gotas frescas de PV y V.
- Almacenamiento: Transfiera las espátulas a las copas (ver Tabla de Materiales) y luego a un depósito de LN2 (ver Tabla de Materiales).
- Prepare LN2: Vierta LN2 en un recipiente adecuado (por ejemplo, un recipiente de poliestireno aislado de 10 cm x 30 cm x 20 cm) y coloque tantas pajitas de 0,5 ml como espátulas para usar.

Figura 2: Esquema del proceso de vitrificación con Espátula MVD. Consulte el texto para obtener más detalles. Creado en BioRender. Meikle, M. (2025) https://BioRender.com/x96y902. Haga clic aquí para ver una versión más grande de esta figura.
2. Calentamiento (Figura 3)
- Preparación de la solución
- Preparar una solución de sacarosa 1 M disolviendo 0,85 g de sacarosa en 2,5 mL de medio M2. Esterilice la solución con un filtro de 0,22 μm.
NOTA: Esta solución puede prepararse y almacenarse a 4 °C durante un máximo de 1 semana. - Prepare soluciones de sacarosa de 0,5 M y 0,25 M diluyendo la solución de sacarosa de 1 M con el volumen adecuado de medio M2.
- Mantenga las soluciones de sacarosa a 37 °C en una placa caliente (ver Tablas de Materiales) hasta que comience el calentamiento.
- Preparar una solución de sacarosa 1 M disolviendo 0,85 g de sacarosa en 2,5 mL de medio M2. Esterilice la solución con un filtro de 0,22 μm.
- Preparación de la placa de calentamiento
- En una placa de Petri de plástico de 100 mm, coloque las siguientes gotas de solución: una gota de 500 μL de sacarosa de 0,5 M, una gota de 50 μL de sacarosa de 0,5 M y una gota de 50 μL de sacarosa de 0,25 M por cada espátula a calentar. Coloque tres gotas de medio M2 (100 μL cada una) para lavar.
- Proceso de calentamiento
NOTA: El proceso de calentamiento tiene lugar a RT, por ejemplo, 20-22 °C sobre la base de un microscopio estereoscópico.- Recupera las espátulas selladas del dewar. Colóquelos en un recipiente apropiado con LN2. Véase la figura 3.
- Coloque la placa calefactora en el microscopio estereoscópico. Una a la vez, sostenga la base de la espátula con pinzas de acero inoxidable y, con una mano enguantada, saque la varilla de identificación y luego la pajita. Sumerja rápidamente la plataforma que contiene los embriones en la gota de sacarosa de 0,5 M de 500 μL.
- Asegurarse de que todos los embriones hayan caído en la gota; Si es necesario, mueva suavemente la espátula para ayudar a su liberación. Cargue los embriones en un capilar de vidrio extraído, colóquelos en la gota de 50 μL de solución de sacarosa de 0,5 M e incube durante 2 minutos.
- Colocar los embriones en la gota de 50 μL de solución de sacarosa 0,25 M e incubar durante otros 2 min.
NOTA: Antes de colocar los embriones en cada solución, precargue el capilar con la solución a utilizar. - Por último, lavar los embriones tres veces en diferentes gotas de medio M2 para eliminar la sacarosa.
- Incubar los embriones en condiciones apropiadas para cada especie durante al menos 1 h antes de su uso.
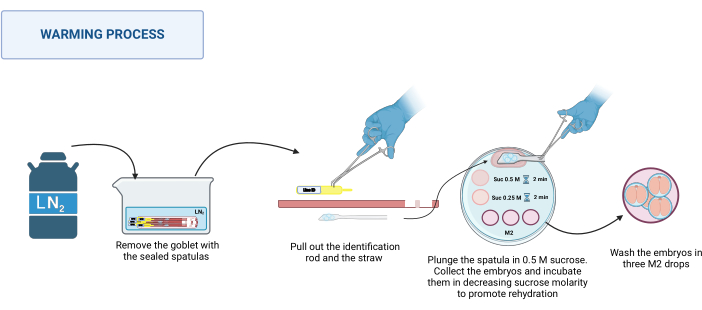
Figura 3: Esquema del proceso de calentamiento de la espátula MVD. Consulte el texto para obtener más detalles. Creado en BioRender. Meikle, M. (2025) https://BioRender.com/k91k191. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Inicialmente utilizamos el método tradicional de congelación lenta basado en soluciones de propilenglicol, pajitas y equipos de congelación a velocidad controlada7. Sin embargo, después de considerar que el método de vitrificación era una opción potencialmente más fácil y rentable, realizamos un estudio para comparar los resultados de la congelación lenta tradicional (SLF) frente a la MVD de espátula en embriones de ratón de 8 células in vivo y de 2 células producidos in vitro 13 (Tabla 1 y Tabla 2). Los resultados se presentan en términos de "tasa de recuperación", que define el número de embriones recuperados del dispositivo después del calentamiento sobre el número total de embriones criopreservados. La "tasa de supervivencia" se refiere al número de embriones viables sobre los embriones recuperados del dispositivo. Los embriones se consideraron viables si los blastómeros estaban intactos (dos blastómeros en embriones de 2 células y al menos cuatro blastómeros en embriones de 8 células)14. Estos términos se utilizan para evaluar si el dispositivo y todo el proceso son adecuados para la criopreservación.
Se logró una tasa de supervivencia (Tabla 1 y Tabla 2) y una tasa de desarrollo significativamente más altas a los 3,5 días después del coito (dpc; p. ej., embriones de mórulas y blastocisto, Tabla 1) para Spatula MVD que para el grupo de SLF en embriones de ratón. Aunque ambos métodos alcanzaron una tasa de eclosión aceptable, fue significativamente menor que el grupo control fresco, como se esperaba (embriones no vitrificados; Tabla 1). Los embriones frescos de 2 células vitrificados/calentados y de control se transfirieron a las hembras receptoras, sin revelar diferencias tanto en la tasa de embarazo (hembras embarazadas/totales transferidas) como en la tasa de natalidad (cachorros nacidos/transferidos embriones en el total de hembras receptoras; Tabla 2). Estos resultados nos llevan a pasar del método SLF a la vitrificación.
| Nº de embriones | Tasa de supervivencia a 2,5 dpc (embriones viables/recuperados del dispositivo) | Tasa de desarrollo embrionario a 3,5 dpc (mórulas-blastocistos/embriones viables) | Tasa de eclosión a 5,5 dpc (blastocistos eclosionados/embriones cultivados) | |
| Congelación lenta | 410 | 89,3 % (366/410)a | 91,8 % (336/366)a | 49,7 % (90/181)a |
| Espátula MVD | 341 | 92,7 % (316/341)b | 97,2 % (307/316)b | 41,0 % (68/166)a |
| Embriones frescos | 458 | - | 98,7 % (452/458)b | 67,8 % (139/205)b |
Tabla 1: Tasas de supervivencia y desarrollo in vitro de embriones murinos de 8 células sometidos a vitrificación o congelación lenta. Los embriones murinos de 8 células in vivo se criopreservaron mediante Spatula MVD o congelación lenta y se compararon con embriones frescos. Los embriones frescos se recolectaron de las hembras a 2,5 dpc y se cultivaron en las mismas condiciones que los otros grupos. La tasa de supervivencia (embriones viables/recuperados del dispositivo) se determinó después del calentamiento/descongelación. Los embriones viables se cultivaron in vitro. La tasa de desarrollo embrionario (mórulas-blastocistos/embriones viables) y la tasa de eclosión (embriones eclosionados/cultivados) se determinaron a 3,5 dpc y 5,5 dpc, respectivamente. Diferentes superíndices indican diferencias significativas (P < 0,05).
| Nº de embriones | Tasa de recuperación (recuperados del dispositivo/embriones criopreservados) | Tasa de supervivencia (embriones viables/recuperados del dispositivo) | Tasa de preñez (hembras preñadas/transferidas) | Tasa de natalidad en el total de hembras transferidas (cachorros nacidos/embriones transferidos) | |
| Congelación lenta | 531 | 88,3 % (469/531)a | 85,1 % (399/469)a | - | - |
| Espátula MVD | 431 | 84,2 % (363/431)a | 94,7 % (344/363)b | 53.3 % (8/15)a | 17,8 % (47/264)a |
| Embriones frescos | 446 | - | 97,7 % (436/446)b | 53.3 % (8/15)a | 20,6 % (53/257)a |
Tabla 2: Tasas de recuperación y supervivencia de embriones murinos de 2 células sometidos a vitrificación o congelación lenta. Resultados reproductivos de embriones vitrificados/calentados frente a embriones frescos.Los embriones de 2 células producidos in vitro fueron criopreservados por Spatula MVD o SLF. La recuperación (embriones recuperados del dispositivo/criopreservados) y la tasa de supervivencia (embriones viables/recuperados del dispositivo) se determinaron después del calentamiento o la descongelación. Los embriones viables calentados y frescos se transfirieron a las hembras receptoras (15 hembras por grupo, ~17 embriones por hembra). Se determinaron las tasas de embarazo (hembras preñadas/transferidas) y de nacimiento (cachorros nacidos/embriones transferidos). Diferentes superíndices indican diferencias significativas (P < 0,05).
La espátula MVD también se probó para la vitrificación de embriones preimplantacionales de ovejas producidos in vitro y se comparó con un dispositivo comercial6. Los resultados se muestran en la Tabla 3. La calidad de los embriones se evaluó por morfología siguiendo los criterios recomendados por la International Embryo Technology Society (IETS)15, y aquellos embriones excelentes y buenos de Grado 1 se asignaron a cada grupo experimental.
Ni la tasa de supervivencia (~70% y ~16%, 3 h o 24 h después del calentamiento, respectivamente) ni la eclosión del embrión en el día 8 se vieron influenciadas por el método de vitrificación. El porcentaje de blastocistos en el día 8 fue menor para ambas técnicas de vitrificación en comparación con el grupo control (embriones frescos) (~ 8% vs 20,5%, respectivamente; P < 0,05). Estos resultados sugieren que los embriones de oveja producidos in vitro también pueden ser vitrificados utilizando la espátula MVD. Además, los resultados previos se complementaron con la transferencia de embriones de oveja sometidos a congelación lenta, Espátula MVD o un dispositivo comercial a las hembras receptoras16. Los resultados se muestran en la Tabla 4. Se evaluó la tasa de supervivencia embrionaria (embriones viables en el día 30/embriones transferidos), la tasa de preñez (ovejas preñadas/transferidas), la pérdida fetal desde la gestación hasta el nacimiento (corderos nacidos evaluados al nacer/embriones viables en el día 30) y la tasa de supervivencia de corderos (corderos vivos 1 semana después del nacimiento/corderos nacidos) entre los grupos experimentales.
Los resultados mostraron que la tasa de supervivencia embrionaria después de la transferencia embrionaria fue similar para SLF (26,5%) y Spatula MVD (22,2%), pero fue mayor para el grupo de dispositivos comerciales (52,0%, P < 0,05). Los resultados reproductivos (duración de la gestación, pérdida fetal, peso al nacer y tasas de supervivencia de los corderos) no se vieron afectados significativamente por el método de criopreservación. En general, Spatula MVD también es un método adecuado para la vitrificación de embriones ovinos preimplantatorios.
| N° de embriones | Tasa de supervivencia % (embriones viables/criopreservados) | Tasa de desarrollo % (mórulas-blastocistos en el día 6/embriones escindidos) | Tasa de eclosión % (blastocistos eclosionados/embriones escindidos) | ||
| 3 h | 24 h | ||||
| Espátula MVD | 165 | 69,6 ± 2,4A | 14,6 ± 3,5A | 11.1 ± 2.1b | 6,4 ± 1,9b |
| Dispositivo comercial | 165 | 71,3 ± 1,3A | 17,7 ± 4,5A | 12,7 ± 3,2b | 10,2 ± 2,9b |
| Grupo control (embriones frescos) | 408 | - | - | 41,3 ± 3,7A | 20,5 ± 4,5A |
Tabla 3: Tasas de supervivencia y desarrollo in vitro de embriones ovinos sometidos a vitrificación con Espátula MVD o un dispositivo comercial.Los embriones producidos in vitro de 2 a 8 células (día 2 después de la fertilización) se vitrificaron con espátula MVD o un dispositivo comercial y luego se calentaron. Se analizó la tasa de supervivencia (viable/criopreservada) a las 3 h y a las 24 h post-calentamiento. Las tasas de desarrollo y eclosión se definieron como el número de mórulas y blastocistos obtenidos en el día 6 y el número de embriones eclosionados, respectivamente, sobre el número de embriones escindidos (2-8 células). Diferentes superíndices en la misma columna indican diferencias significativas (P < 0,05). Los datos se muestran como media ± SEM.
| Supervivencia embrionaria (embriones viables en el día 30/embriones transferidos) | Tasa de preñez (ovejas gestantes/transferidas) | Pérdida fetal (corderos nacidos a los que se accede al nacer/embriones viables en el día 30) | Duración de la gestación (d) | Peso al nacer (g) | Tasa de supervivencia de corderos (corderos vivos una semana después del nacimiento/corderos nacidos) | |
| Espátula MVD | 22,2 %a (28/126) | 32.9 %a (25/76) | 4.0 %a (1/25) | 150,7 ± 1,8A | 4102 ± 112,4A | 87.5 %a (21/24) |
| Dispositivo comercial | 52.0 %b (91/175) | 66.0 %b (62/94) | 11.0 %a (8/73) | 150,4 ± 1,9A | 3980 ± 221,2A | 83,1 %A (54/65) |
| Congelación lenta | 26,5 %A (36/136) | 38,3 %A (28/73) | 6.7 %a (2/30) | 150,4 ± 2,1A | 4319 ± 107,3A | 89.3 %a (25/28) |
Tabla 4: Efecto del método de criopreservación sobre la supervivencia embrionaria después de la transferencia, el mantenimiento de la preñez y la producción de corderos. Las mórulas a blastocistos expandidos de embriones producidos in vivo o in vitro se sometieron a vitrificación/congelación lenta y calentamiento/descongelación y se transfirieron a ovejas merinas multíparas sincronizadas. Se comparó la tasa de supervivencia embrionaria (embriones viables en el día 30/embriones transferidos), la tasa de preñez (ovejas preñadas/transferidas), la pérdida fetal desde la gestación hasta el nacimiento (corderos nacidos al nacer/embriones viables en el día 30), la duración de la gestación (d), el peso al nacer (g) y la tasa de supervivencia de los corderos (corderos vivos una semana después del nacimiento/corderos nacidos) entre los grupos experimentales.
Además, las líneas de ratones modificados genéticamente que ya no se utilizan en nuestras instalaciones se respaldaron como embriones de dos células utilizando el método Spatula MVD. Un mínimo de 300 embriones de dos células, producidos principalmente por fertilización in vitro (o apareamiento natural), fueron vitrificados para cada línea de ratones. El control de calidad del proceso se realizó calentando dos o tres espátulas de cada línea y transfiriendo los embriones a las receptoras pseudogestantes. En la Tabla 5 se muestran los resultados representativos de diferentes líneas de ratones modificados genéticamente. En promedio, la tasa de recuperación fue del 90,4 % y la tasa de supervivencia del 96,8 %. La tasa de embarazo fue del 80% y la tasa de natalidad del 31,5% en promedio. Cabe destacar que la tasa de natalidad mostró una amplia gama de resultados del 12% al 45%, lo que podría deberse a las diferentes modificaciones genéticas que pueden afectar la sensibilidad embrionaria y los resultados de la transferencia embrionaria. En general, estos resultados fueron consistentes con los obtenidos previamente en la instalación.
| Línea de ratón | Nº de embriones vitrificados/calentados | Tasa de recuperación (recuperados del dispositivo/embriones criopreservados) | Tasa de supervivencia (embriones viables/recuperados del dispositivo) | Tasa de preñez (hembras preñadas/transferidas) | Tasa de natalidad (cachorros nacidos/embriones transferidos) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| Promedio | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
Tabla 5: Resultados representativos del proceso de vitrificación de control de calidad realizado en embriones de 2 células de diferentes líneas de ratones modificados genéticamente. Las líneas de ratones transgénicos se respaldaron como embriones de dos células (mínimo 300 embriones) utilizando el método Spatula MVD. El control de calidad del proceso se realizó calentando dos o tres espátulas de cada línea y transfiriendo los embriones a las receptoras pseudogestantes. La recuperación (embriones recuperados del dispositivo/criopreservados) y la tasa de supervivencia (embriones viables/recuperados del dispositivo) se determinaron después del calentamiento. Los embriones viables calentados se transfirieron en etapa de 2 células a las hembras receptoras (1 a 3 hembras por línea, ~18 embriones por hembra). Se determinaron las tasas de embarazo (hembras preñadas/transferidas) y de nacimiento (cachorros nacidos/embriones transferidos).
Por último, recientemente hemos realizado un trabajo comparativo en el que cigotos de ratón frescos y calentados vitrificados fueron microinyectados con reactivos CRISPR y luego cultivados in vitro o transferidos a hembras pseudogestantes17. El objetivo fue evaluar si los cigotos vitrificados -mediante Spatula MVD- podrían ser una fuente adecuada de embriones para microinyección en cigotos B6D2F1/J y C57BL/6J. Las tasas de recuperación y supervivencia fueron similares a los resultados previos obtenidos para embriones en estadio de 2-8 células (Tabla 6). En general, los cigotos calentados vitrificados sobrevivieron a la microinyección, se convirtieron en blastocistos eclosionados o produjeron crías vivas, y demostraron mutaciones inducidas por el sistema CRISPR/Cas9. Sin embargo, la tasa de mutación fue significativamente menor en los cigotos vitrificados que en los frescos. El criobanco de cigotos parece ser una fuente alternativa de embriones para realizar sesiones de microinyección bajo demanda, evitando la cría y el mantenimiento de animales durante todo el año y potenciando la implementación de las 3R en la tecnología CRISPR.
| Cepa cigoto | Nº de cigotos criopreservados | Tasa de recuperación (recuperados del dispositivo/embriones criopreservados) | Tasa de supervivencia (embriones viables/recuperados del dispositivo) |
| B6D2F1/J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL/6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
Tabla 6: Tasas de recuperación y supervivencia de cigotos B6D2F1/J y C57BL/6J calentados vitrificados. Los cigotos producidos in vivo se recolectaron de hembras donantes B6D2F1/J y C57BL/6J, se vitrificaron con Spatula MVD y se calentaron. Las tasas de recuperación (embriones recuperados del dispositivo/embriones criopreservados) y supervivencia (embriones viables/recuperados del dispositivo) se determinaron después del calentamiento.
Discusión
La espátula MVD es un dispositivo de vitrificación fácil de montar, de bajo coste y volumen mínimo, con una alta capacidad de retención embrionaria y una óptima ocupación del nitrógeno líquido. Este método ha demostrado ser simple, rápido y robusto. En promedio, hemos logrado no solo altas tasas de recuperación y supervivencia embrionaria de embriones vitrificados (~90%), sino también buenos resultados reproductivos al realizar la transferencia de embriones en ratones (~80% de tasa de embarazo y ~30% de tasa de natalidad), que son comparables a otros métodos de vitrificación de volumen mínimo 18,19,20.
Los pasos críticos en el método de vitrificación de Spatula MVD incluyen: (i) Preparación de la espátula. Esta técnica requiere una experiencia considerable. La plataforma producida en la punta del cargador de gel por calentamiento con pinzas debe ser de ~ 1 mm2 y debe estar cerrada en el extremo. Si la punta permanece abierta, pueden formarse burbujas al sumergir la espátula en la gota de sacarosa durante el proceso de calentamiento debido a las diferencias de temperatura. Las burbujas interfieren con la búsqueda y recuperación de embriones. ii) Incubación embrionaria en soluciones de vitrificación. Debido a la alta densidad, los embriones permanecen a diferentes alturas en las gotas. Es necesaria una aspiración rápida de todos los embriones. Se espera toxicidad si los embriones permanecen en estas soluciones durante períodos más largos a temperatura ambiente. (iii) Gota de vitrificación de espátula. El volumen de la gota de vitrificación -que contiene los embriones- en la plataforma debe ser de ~0,5-1,0 μL; Los mayores volúmenes de crioprotector afectan la viabilidad del embrión. Recomendamos utilizar capilares extraídos con un diámetro interno un poco más ancho que el tamaño de un embrión, que llevarían el volumen necesario. Además, las caídas más grandes en la plataforma pueden aumentar la posibilidad de atascarse en la pajita de 0,5 ml dentro de la pared al cerrar el sistema. (iv) Sellado de espátula. Se debe tener especial cuidado al cerrar la espátula con la pajita de 0,5 mL; Ambos elementos tienen que estar alineados. Las gotas de embriones en la espátula no deben ser alteradas. (v) Durante el calentamiento, siga el orden de extracción del identificador de la varilla y la pajita de 0,5 mL. De lo contrario, el identificador puede ser expulsado por la diferencia de temperatura.
Esta técnica requiere la capacitación del operador en diferentes etapas. La principal solución de problemas podría ser la recuperación de los embriones de la espátula. Si menos del 70-80% de los embriones vitrificados se recuperan al calentar la espátula, esto puede deberse a (i) una carga incompleta de los embriones en la plataforma de la espátula o (ii) embriones que se retienen en la pared interna de paja de 0,5 mL cuando el sistema está cerrado. Para superar el primer problema, la carga de la gota que contiene los embriones debe realizarse bajo el microscopio estereoscópico utilizando un conjunto de tubo aspirador y un capilar tirado cargado con el medio crioprotector que contiene los embriones y 2-3 pequeñas burbujas de aire a lo largo del capilar, lo que permite un flujo correcto del líquido. Para el segundo problema, si no hay embriones visibles en la plataforma durante el calentamiento, corte el tapón de algodón para abrir la pajita de 0,5 mL y lávela dos veces con 500 μL de sacarosa 0,5 M en M2 (ver sección 2, paso 1), expulsando la solución en un plato para la recuperación del embrión.
Las limitaciones del método están relacionadas principalmente con las etapas críticas ya mencionadas. Creemos que el punto clave es la preparación de la espátula. Se necesita entrenamiento para realizar una buena espátula, pero una vez aprendido, se puede dominar. Dado que los medios son caseros, este método no se puede utilizar en clínicas de reproducción humana.
La principal ventaja de la Espátula MVD es que es un dispositivo de bajo costo en comparación con los comerciales9. Además, ahorra espacio en la dewar de nitrógeno líquido en comparación con la vitrificación criotubular8. Hemos probado su funcionalidad en embriones de ratón y oveja en diferentes etapas. Es particularmente más simple, más rápido, más económico y más efectivo que el método de congelación lenta.
Este método se puede utilizar para vitrificar embriones de diferentes especies de mamíferos no humanos en una amplia gama de áreas de investigación.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Agradecemos a Alejo Menchaca por su aporte al desarrollo de la Espátula MVD. GS recibió financiamiento del Programa de Posgrado en Biotecnología - Facultad de Ciencias - Universidad de la República (https://webmasterbiotecnol.wixsite.com/biotec1) (Número de Subvención: GS 2437 347). GS, MNM y MC recibieron financiamiento del FOCEM - Fondo para la Convergencia Estructural del Mercosur (https://focem.mercosur.int/es/) (Número de Subvención: COF 03/11). GS y MC son becarios del Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay. (https://www.anii.org.uy/). Los financiadores (Programa de Posgrado en Biotecnología - Facultad de Ciencias - Universidad de la República; FOCEM - Fondo para la Convergencia Estructural del Mercosur; Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay) no participó en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
Referencias
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados