Method Article
جهاز ملعقة مونتيفيديو لتزجيج أجنة الثدييات
In This Article
Summary
هنا ، نقدم بروتوكول ملعقة مونتيفيديو لتزجيج أجنة الفئران والأغنام قبل الزرع ، والتي تتكون من ملعقة محلية الصنع وتستخدم محاليل محلية الصنع. يتم موازنة الأجنة بسرعة في محلولين بالتبريد بتركيز متزايد ، ويتم تحميلهما على الملعقة ، وغمرهما في النيتروجين السائل ، وأخيرا مختومة بقش 0.5 مل.
Abstract
تصف هذه الدراسة طريقة تزجيج فعالة وفعالة من حيث التكلفة لحفظ أجنة الفئران والأغنام بالتبريد المعروفة باسم ملعقة مونتيفيديو (MVD). يستخدم هذا البروتوكول ملعقة محلية الصنع كجهاز ناقل ، يتم تحضيره بطرف محمل جلي. يتم موازنة الأجنة بسرعة في محللين محليين الصنع بتركيز متزايد ، ويتم تحميلهما في الملعقة ، ثم غمرها مباشرة في النيتروجين السائل. يمكن تحميل ما يقرب من 30-40 جنينا من الفأر في مرحلة ما قبل الزرع على الملعقة ، والتي يتم إغلاقها لاحقا بقش 0.5 مل. يؤدي استخدام الملاعق بدلا من الأنابيب المبردة ، والتي تستخدم بشكل متكرر لتخزين الأجنة المزججة ، إلى تحسين المساحة في ديوارس النيتروجين السائل. بالإضافة إلى ذلك ، لا تتطلب عملية الاحترار سوى محلول سكروز محلي الصنع بتركيز متناقص لإعادة ترطيب الأجنة واستعادة مورفولوجيتها. استخدم مختبرنا بنجاح ملعقة مونتيفيديو لأجنة الفئران والأغنام قبل الزرع لأكثر من 10 سنوات. أظهرت ملعقة مونتيفيديو متوسط معدل الشفاء (الأجنة المستردة / المزججة) بنسبة 84٪ ومعدل بقاء (أجنة قابلة للحياة / المستعادة) بنسبة 97٪ في أجنة الفئران. أسفر تزجيج أجنة الفئران عن نتائج أفضل من التجميد البطيء ، على الرغم من عدم ملاحظة أي اختلافات في النتائج الإنجابية (الحمل والولادة ومعدلات المواليد). في أجنة الأغنام ، تم تحقيق معدلات بقاء ونمو أجنة مماثلة باستخدام ملعقة مونتيفيديو مقارنة بجهاز تجاري. على الرغم من أن معدل الحمل كان أعلى بالنسبة للجهاز التجاري ، إلا أن معدل بقاء الحملان لم يكن مختلفا بشكل كبير بين الأجهزة. طريقة التزجيج ملعقة مونتيفيديو هي تقنية حفظ بالتبريد مباشرة يمكن استخدامها لتخزين الأجنة الفائضة ، ونسخ خطوط الفئران المعدلة وراثيا ونماذج الأغنام احتياطيا ، وتسهيل تبادلها بين الباحثين في جميع أنحاء العالم.
Introduction
زادت كفاءة توليد المعدلة وراثيا (GM) بشكل كبير بسبب تطوير الأساليب القائمة على نوكلياز داخلي ، وخاصة كريسبر / كاس9. تنتج العديد من المختبرات في جميع أنحاء العالم العديد من خطوط الفئران والجرذان المعدلة وراثيا التي يجب حفظها بالتبريد لمنع الانجراف الجيني والحفاظ على سلامة النمط الظاهريالأصلي 1. بالإضافة إلى ذلك ، فإن الأرشفة تلغي الحاجة إلى التكاثر المستمر ، مما يؤدي غالبا إلى أعداد زائدة. ترسل بعض المختبرات خطوط الفئران المعدلة وراثيا كأجنة أو منوية محفوظة بالتبريد إلى المستودعات الدولية ، مما يسهل تبادل هذه النماذج مع تجنب نقل الحية. وهذا يضمن إمكانية الوصول إلى الخطوط دون التوليد المتكرر لنماذج المعدلة وراثياالمتطابقة 2. لهذه الأسباب ، يعد حفظ الأجنة المنوية بالتبريد أمرا بالغ الأهمية في أي منشأة حيوانية معدلة وراثيا. بشكل عام ، يفضل حفظ الأجنة بالتبريد لتخزين الخطوط المعدلة وراثيا لأن الأجنة تحتوي على الجينوم ثنائي الصبغيات الكامل مع التعديلات ويمكن استردادها بسهولة عن طريق نقل الأجنة.
التزجيج هو عملية غير متوازنة تتميز بعدم التوازن بين دخول الماء إلى الخلية والماء الذي يشكل بلورات خارج الخلية حولها. تمنع هذه الطريقة تكوين بلورات الجليد داخل الخلايا ، وتميزها عن طريقة التجميد البطيء (SLF) 3 (انظر الشكل 1). يتيح التركيز العالي للمواد الواقية من التبريد والتلامس المباشر مع النيتروجين السائل (LN2) التبريد فائق السرعة (~ 40 درجة مئوية / ثانية) ، مما يحقق حالة زجاجية للعينات في غضون ثوان. علاوة على ذلك ، فإن التزجيج أسرع وأسهل وأقل تكلفة من التجميد البطيء4. يتطلب الحد الأدنى من LN2 وعادة ما يستخدم معدات بسيطة يمكن شراؤها تجاريا أو محليةالصنع 5 (انظر الشكل 1).
بالإضافة إلى ذلك ، فإن عملية الاحترار سريعة وقابلة للتكرار بشكل عام. يجب إجراؤه بسرعة لتجنب سمية الحمامات بالتبريد والحفاظ على الحالة الزجاجية3. عند تجميد الأجنة ، تأخذ العديد من المختبرات في الاعتبار راحة الجهاز الناقل وموثوقيته وقوته وقدرته على الاحتفاظ والتكاليف.
نحن نفضل طريقة تزجيج الملعقة ذات الحجم الأدنى للحفظ الروتيني بالتبريد لأجنة الأغنام والفئران ، باستخدام جهاز ملعقة مونتيفيديو (MVD)6. في البداية ، استخدمنا طريقة التجميد البطيء7 ولكننا سرعان ما انتقلنا إلى التزجيج. لإنشاء جهاز أبسط وأكثر كفاءة في المساحة ل LN2 dewar ، قمنا بتعديل الملعقة محلية الصنع من Tsang and Chow (2009) 8 ، والتي يتم توصيلها بأنبوب التبريد ، لتطوير ملعقة MVD المختومة بقش 0.5 مل (انظر جدول المواد). تتميز الملعقة بطرف محمل هلامي (انظر جدول المواد) ، حيث يتم تشكيل منصة تبلغ مساحتها حوالي 1 مم مربع عن طريق إذابة الطرف برفق باستخدام ملقط دقيق ، مما يخلق صفيحة تشبه البتلة لتحميل الأجنة. يمكن أن تستوعب هذه المنصة ما يصل إلى 40 جنينا من الفأر في قطرة زجاجية صغيرة. يتم إدخال قضيب سدادة تحديد الهوية (انظر جدول المواد) في الطرف المفتوح لطرف اللودر الهلامي.
الهدف من هذه الطريقة هو تزجيج الأجنة بطريقة بسيطة وسريعة وغير مكلفة ، بالإضافة إلى ذلك ، توفر مساحة في ديوار النيتروجين. تم استخدام هذا النظام بنجاح لسنوات عديدة ، مما يوفر معدلات ممتازة لبقاء الجنين (~ 97٪) ونتائج إنجابية ، خاصة في أجنة الفئران. نظرا لأن ملعقة MVD يتم تحضيرها في المختبر ، فهي طريقة منخفضة التكلفة مقارنة بالأجهزة التجارية9. علاوة على ذلك ، فإنه يوفر مساحة في ديوار النيتروجين مقارنة باستخدام أنابيب التبريد8،10.

الشكل 1: مقارنة بين التقنيتين الرئيسيتين المستخدمتين لحفظ الأجنة بالتبريد. تم تعديل هذا الرقم بإذن من Crispo et al.1. تم إنشاؤه في BioRender.com. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تم إيواء المستخدمة للحصول على أجنة الفئران والتعامل معها وفقا للقانون الوطني 18.611 والمبادئ التوجيهية الدولية لرعاية11. تمت الموافقة على البروتوكول التجريبي (رقم التصريح # 007-18) في الوقت المناسب من قبل لجنة رعاية واستخدام في معهد باستور دي مونتيفيديو (تم منح موافقة كتابية). تمت الموافقة على البروتوكولات التجريبية لبويضات / أجنة الأغنام من قبل مؤسسة اللجنة المؤسسية لرعاية (البروتوكول # 001-2017) ، امتثالا لإرشادات ARRIVE12 وتم تنفيذها وفقا للإرشادات الدولية لرعاية11.
1. التزجيج (الشكل 2)
- تحضير ملعقة MVD
- قم بتقصير طرف اللودر الهلامي (انظر جدول المواد) عن طريق قطع أول 10 مم ومخروط الطرف.
ملاحظة: يؤدي ذلك إلى إنشاء طرف أقصر ومستقيم ، مما يسهل الختم النهائي باستخدام المصاصة سعة 0.5 مل (انظر جدول المواد). - أمسك طرف اللودر الهلامي بملقط صانع الساعات #5 (انظر جدول المواد) على بعد حوالي 1.0 سم من الحافة. ضع الطرف برفق في لهب موقد بنسن (انظر جدول المواد) واستمر لمدة 8-10 ثوان لتشكيل منصة تشبه البتلة يبلغ طولها حوالي 1 مم2.
- أخرجه من اللهب وامسكه بإحكام بالملقط لمدة 5 ثوان.
- باستخدام المجهر المجسم (انظر جدول المواد) ، تحقق من تشكيل المنصة الشبيهة بالبتلة (~ 1 مم2) وإغلاق الحافة البعيدة.
ملاحظة: يجب إغلاق المنصة في الطرف البعيد لمنع تسلل LN2 أثناء التزجيج. تأكد من أن المنصة نظيفة وخالية من الخيوط البلاستيكية. إذا كانت صغيرة جدا أو بها خيوط ، فقم بقص الطرف وكرر الإجراء. - كرر الخطوات 1.1.1-1.1.4 لتحضير العدد اللازم من الملاعق (1 ملعقة = ما يصل إلى 40 جنينا من الفأر).
- عقم الملاعق باستخدام الأشعة فوق البنفسجية (UV) أو أكسيد الإيثيلين وتخزينها في أنبوب أو صندوق معقم.
- في يوم التزجيج ، استرجع الملاعق ، وتعامل معها من الطرف الآخر للمنصة. أدخل قضيب تحديد (انظر جدول المواد) في كل ملعقة وضعها على قاعدة المجهر المجسم. قم بتسمية القضيب بعلامة دائمة أو ملصق ملصق سائل مقاوم للنيتروجين.
ملاحظة: تجنب دائما لمس المنصة عند التعامل مع الملاعق. يجب ألا يتجاوز الطول الإجمالي للجهاز الكامل (ملعقة + 0.5 مل قش + قضيب تحديد الهوية) أكثر من 1 سم من طول الكأس.
- قم بتقصير طرف اللودر الهلامي (انظر جدول المواد) عن طريق قطع أول 10 مم ومخروط الطرف.
- تحضير محاليل التزجيج
- تحضير محلول FS: قم بإذابة 1.5 جم من وسط تدرج الكثافة (انظر جدول المواد) و 0.85 جم من السكروز (انظر جدول المواد) في 5 مل من المحلول الملحي المخزن بالفوسفات (PBS ؛ انظر جدول المواد). سخنيها في حمام مائي مغلي حتى تذوب تماما ، ثم عقميها باستخدام مرشح 0.22 ميكرومتر (انظر جدول المواد).
ملاحظة: يمكن تخزين هذا المحلول عند 4 درجات مئوية لمدة تصل إلى 6 أشهر. - تحضير محلول ما قبل التزجيج (PV): في يوم التزجيج ، اخلطي 10٪ إيثيلين جلايكول (انظر جدول المواد) ، و 10٪ ثنائي ميثيل سلفوكسيد (انظر جدول المواد) ، و 80٪ M2 متوسط (انظر جدول المواد). هناك حاجة إلى حجم إجمالي قدره 100 ميكرولتر ل 5 ملاعق.
- تحضير محلول التزجيج (V): في يوم التزجيج ، امزج 15٪ إيثيلين جلايكول ، و 15٪ ثنائي ميثيل سلفوكسيد ، و 10٪ M2 متوسط ، و 60٪ محلول FS. مطلوب حجم إجمالي يبلغ 100 ميكرولتر ل 5 ملاعق.
- تحضير محلول FS: قم بإذابة 1.5 جم من وسط تدرج الكثافة (انظر جدول المواد) و 0.85 جم من السكروز (انظر جدول المواد) في 5 مل من المحلول الملحي المخزن بالفوسفات (PBS ؛ انظر جدول المواد). سخنيها في حمام مائي مغلي حتى تذوب تماما ، ثم عقميها باستخدام مرشح 0.22 ميكرومتر (انظر جدول المواد).
- عملية تجفيف الأجنة وتزجيجها
- تحضير LN2: صب LN2 في وعاء مناسب (على سبيل المثال ، حاوية بوليسترين معزولة مقاس 10 سم × 30 سم × 20 سم) وضع أكبر عدد ممكن من القش سعة 0.5 مل كملاعق لاستخدامها.
ملاحظة: لتسهيل تصور منصة الملعقة أثناء التلاعب تحت LN2 ، يقترح استخدام حاوية بوليسترين ملونة معزولة من الأسفل لإنشاء تأثير تباين.
تنبيه: ارتد نظارات واقية وقفازات مناسبة (انظر جدول المواد) عند التعامل مع LN2. - تحضير المحاليل: على طبق بتري بلاستيكي مقاس 100 مم (انظر جدول المواد) ، ضع القطرات التالية: 100 ميكرولتر من M2 ، و 20 ميكرولتر من المحلول الكهروضوئي ، و 20 ميكرولتر من محلول V لكل ملعقة.
- تزجيج الأجنة: ضع الأجنة المراد تزجيجها في قطرة M2. تعامل مع 30-40 جنينا في المرة الواحدة ، واحتضنها في قطرة المحلول الكهروضوئي لمدة 30 ثانية ، ثم في المحلول V قطرة لمدة 30 ثانية أخرى في درجة حرارة الغرفة (RT).
- استخدم شعيرات دموية زجاجية مسحوبة (انظر جدول المواد) مع مجموعة أنبوب شفاط (انظر جدول المواد). قم بتحميل الشعيرات الدموية مسبقا بما لا يقل عن 1 ميكرولتر من المحلول المعني قبل وضع الأجنة.
ملاحظة: ستكون الأجنة على ارتفاعات مختلفة في القطرات ، لذا اضبط ميكرومتر المجهر المجسم لتحديد موقعها. استرجع الأجنة من كل قطرة عندما تبقى 10 ثوان. يجب إجراء جميع عمليات التلاعب بالجنين تحت المجهر المجسم. - تحميل الأجنة: قم بشفط الأجنة باستخدام الحد الأدنى من محلول V (على سبيل المثال ، ~ 0.1 ميكرولتر) ووضعها بسرعة على منصة الملعقة.
- الغمر في LN2: بعد تحميل الأجنة ، اغمر منصة الملعقة على الفور في LN2 لمدة 5 ثوان (أمسك الملعقة باليد ، من قضيبها). بعد ذلك ، مع الحفاظ على الملعقة في أبخرة LN2 ، قم بإغلاقها بقش 0.5 مل باستخدام ملاقط طويلة من الفولاذ المقاوم للصدأ (انظر جدول المواد).
ملاحظة: قم بإزالة LN2 من المصاصة قبل إغلاقها لمنع التمدد أثناء التسخين. تأكد من محاذاة الملعقة والقش بشكل صحيح لتجنب ملامسة قطرة الجنين وجدار القش. للراحة ، يمكن أن تبقى الملاعق المختومة في حاوية LN2 حتى يتم تحميل جميع الملاعق بالأجنة ، وإعادة تعبئتها ب LN2 حسب الضرورة. - تكرار الإجراء: كرر الخطوات من 1.3.3 إلى 1.3.7 لكل مجموعة من الأجنة ، باستخدام زوج جديد من القطرات الكهروضوئية والخامسية.
- التخزين: انقل الملاعق إلى كؤوس (انظر جدول المواد) ثم إلى ديوار تخزين LN2 (انظر جدول المواد).
- تحضير LN2: صب LN2 في وعاء مناسب (على سبيل المثال ، حاوية بوليسترين معزولة مقاس 10 سم × 30 سم × 20 سم) وضع أكبر عدد ممكن من القش سعة 0.5 مل كملاعق لاستخدامها.

الشكل 2: مخطط عملية التزجيج باستخدام ملعقة MVD. انظر النص لمزيد من التفاصيل. تم إنشاؤه في BioRender. ميكل ، م. (2025) https://BioRender.com/x96y902. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. الاحترار (الشكل 3)
- تحضير الحل
- تحضير محلول سكروز 1 م لإذابة 0.85 غرام من السكروز في 2.5 مل من وسط M2. عقم المحلول بفلتر 0.22 ميكرومتر.
ملاحظة: يمكن تحضير هذا المحلول وتخزينه في درجة حرارة 4 درجات مئوية لمدة تصل إلى أسبوع واحد. - تحضير محاليل السكروز 0.5 م و 0.25 م عن طريق تخفيف محلول السكروز 1 متر بالحجم المناسب من وسط M2.
- حافظ على محاليل السكروز عند 37 درجة مئوية على صفيحة ساخنة (انظر جداول المواد) حتى يبدأ الاحترار.
- تحضير محلول سكروز 1 م لإذابة 0.85 غرام من السكروز في 2.5 مل من وسط M2. عقم المحلول بفلتر 0.22 ميكرومتر.
- تحضير لوحة الاحترار
- على طبق بتري بلاستيكي مقاس 100 مم ، ضع قطرات المحلول التالية: قطرة 500 ميكرولتر من 0.5 متر من السكروز ، وقطرة 50 ميكرولتر من 0.5 متر من السكروز ، وقطرة 50 ميكرولتر من 0.25 متر من السكروز لكل ملعقة يتم تسخينها. ضع ثلاث قطرات من M2 متوسط (100 ميكرولتر لكل منهما) للغسيل.
- عملية الاحترار
ملاحظة: تتم عملية الاحترار عند RT ، على سبيل المثال ، 20-22 درجة مئوية على قاعدة المجهر المجسم.- استرجع الملاعق المختومة من الديوار. ضعها في وعاء مناسب مع LN2. انظر الشكل 3.
- ضع لوحة التسخين على المجهر المجسم. واحدة تلو الأخرى ، أمسك قاعدة الملعقة بملاقط من الفولاذ المقاوم للصدأ ، وبيد مرتدية قفاز ، اسحب قضيب التعريف ثم القشة. اغمس المنصة التي تحتوي على الأجنة بسرعة في قطرة السكروز 0.5 متر البالغة 500 ميكرولتر.
- تأكد من أن جميع الأجنة قد سقطت في القطرة ؛ إذا لزم الأمر ، حرك الملعقة برفق للمساعدة في إطلاقها. قم بتحميل الأجنة في شعيرات دموية زجاجية مسحوبة ، وضعها في قطرة 50 ميكرولتر من محلول السكروز 0.5 متر ، واحتضانها لمدة دقيقتين.
- ضع الأجنة في قطرة 50 ميكرولتر من محلول السكروز 0.25 M واحتضانها لمدة دقيقتين أخريين.
ملاحظة: قبل وضع الأجنة في كل محلول ، قم بتحميل الشعيرات الدموية مسبقا بالمحلول المراد استخدامه. - أخيرا ، اغسل الأجنة ثلاث مرات في قطرات مختلفة من وسط M2 لإزالة السكروز.
- احتضان الأجنة في ظل الظروف المناسبة لكل نوع لمدة ساعة واحدة على الأقل قبل الاستخدام.
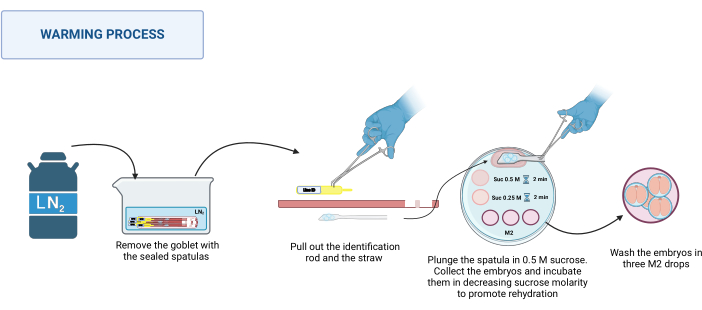
الشكل 3: مخطط عملية تسخين الملعقة MVD. انظر النص لمزيد من التفاصيل. تم إنشاؤه في BioRender. ميكل ، م. (2025) https://BioRender.com/k91k191. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
استخدمنا في البداية طريقة التجميد البطيء التقليدية القائمة على محاليل البروبيلين جلايكول والقش ومعدات التجميد ذات المعدل المتحكمفيه 7. ومع ذلك ، بعد اعتبار طريقة التزجيج خيارا أسهل وأكثر فعالية من حيث التكلفة ، أجرينا دراسة لمقارنة نتائج التجميد البطيء التقليدي (SLF) مقابل ملعقة MVD في 8 خلايا مشتقة في الجسم الحي وخليتين في المختبر أنتجت أجنةالفئران 13 (الجدول 1 والجدول 2). يتم تقديم النتائج من حيث "معدل الاسترداد" الذي يحدد عدد الأجنة المستردة من الجهاز بعد الاحترار على العدد الإجمالي للأجنة المحفوظة بالتبريد. يشير "معدل البقاء على قيد الحياة" إلى عدد الأجنة القابلة للحياة فوق الأجنة المستردة من الجهاز. اعتبرت الأجنة قابلة للحياة إذا كانت الأريمة سليمة (اثنان من الأريمة في أجنة من خليتين وأربعة بلاستوميرات على الأقل في أجنة مكونة من 8 خلايا)14. تستخدم هذه المصطلحات لتقييم ما إذا كان الجهاز والعملية برمتها مناسبين للحفظ بالتبريد.
تم تحقيق معدل بقاء أعلى بشكل ملحوظ (الجدول 1 والجدول 2) ومعدل النمو عند 3.5 أيام بعد الجماع (dpc ؛ على سبيل المثال ، أجنة المورولا والكيسة الأريمية ، الجدول 1) لملعقة MVD مقارنة بمجموعة SLF في أجنة الفئران. على الرغم من أن كلتا الطريقتين وصلت إلى معدل فقس مقبول ، إلا أنها كانت أقل بكثير من مجموعة التحكم الطازجة ، كما هو متوقع (الأجنة غير المزججة ؛ الجدول 1). تم نقل الأجنة المزججة / الدافئة والمراقبة الطازجة المكونة من خلية إلى الإناث المتلقية ، مما يكشف عن عدم وجود فروق في كل من معدل الحمل (الإناث الحوامل / إجمالي الإناث المنقولات) ومعدل المواليد (الأجنة المولودة / المنقولة في إجمالي الإناث المتلقين. الجدول 2). تقودنا هذه النتائج إلى التحول من طريقة SLF إلى التزجيج.
| عدد الأجنة | معدل البقاء على قيد الحياة عند 2.5 نقطة مئوية (أجنة قابلة للحياة / المستردة من الجهاز) | معدل نمو الجنين عند 3.5 نقطة مئوية (الكيسات الأريمية / الأجنة القابلة للحياة) | معدل الفقس عند 5.5 نقطة مئوية (الكيسات الأريمية المفرغة / الأجنة المستنبتة) | |
| التجميد البطيء | 410 | 89.3 ٪ (366/410)أ | 91.8 ٪ (336/366)أ | 49.7 ٪ (90/181) أ |
| ملعقة MVD | 341 | 92.7 ٪ (316/341) ب | 97.2 ٪ (307/316) ب | 41.0 ٪ (68/166)أ |
| الأجنة الطازجة | 458 | - | 98.7 ٪ (452/458) ب | 67.8 ٪ (139/205)ب |
الجدول 1: معدلات البقاء على قيد الحياة والنمو في المختبر لأجنة الفئران المكونة من 8 خلايا المعرضة للتزجيج أو التجميد البطيء. في الجسم الحي ، تم حفظ أجنة الفئران المكونة من 8 خلايا بالتبريد بواسطة ملعقة MVD أو التجميد البطيء ومقارنتها بالأجنة الطازجة. تم جمع الأجنة الطازجة من الإناث عند 2.5 نقطة مئوية وزرعت في نفس ظروف المجموعات الأخرى. تم تحديد معدل البقاء على قيد الحياة (الأجنة القابلة للحياة / المستردة من الجهاز) بعد الاحترار / الذوبان. تم زراعة الأجنة القابلة للحياة في المختبر . تم تحديد معدل نمو الجنين (الكيسات الأريمية / الأجنة القابلة للحياة) ومعدل الفقس (الأجنة المفرغة / المستنبتة) عند 3.5 نقطة مئوية و 5.5 نقطة مئوية ، على التوالي. تشير الحروف المرتفعة المختلفة إلى اختلافات كبيرة (P < 0.05).
| عدد الأجنة | معدل التعافي (تم استرداده من الجهاز / الأجنة المحفوظة بالتبريد) | معدل البقاء على قيد الحياة (الأجنة القابلة للحياة / المستردة من الجهاز) | معدل الحمل (الإناث الحوامل/المنقولات) | معدل المواليد في إجمالي الإناث المنقولات (الأجنة المولودة / المنقولة) | |
| التجميد البطيء | 531 | 88.3 ٪ (469/531)أ | 85.1 ٪ (399/469) أ | - | - |
| ملعقة MVD | 431 | 84.2 ٪ (363/431)أ | 94.7 ٪ (344/363)ب | 53.3 ٪ (8/15) أ | 17.8 ٪ (47/264)أ |
| الأجنة الطازجة | 446 | - | 97.7 ٪ (436/446) ب | 53.3 ٪ (8/15) أ | 20.6 ٪ (53/257)أ |
الجدول 2: معدلات الشفاء والبقاء على قيد الحياة لأجنة الفئران المكونة من خليتين المعرضة للتزجيج أو التجميد البطيء. الحصائل الإنجابية للأجنة المزججة/الدافئة مقابل الأجنة الطازجة.في المختبر ، تم حفظ الأجنة المكونة من خلية المنتجة بالتبريد بواسطة ملعقة MVD أو SLF. تم تحديد التعافي (المسترد من الجهاز / الأجنة المحفوظة بالتبريد) ومعدل البقاء على قيد الحياة (الأجنة القابلة للحياة / المستردة من الجهاز) بعد الاحترار أو الذوبان. تم نقل الأجنة الدافئة والطازجة القابلة للحياة إلى الإناث المتلقين (15 أنثى لكل مجموعة ، ~ 17 جنينا لكل أنثى). تم تحديد معدلات الحمل (الإناث الحوامل / المنقولات) والولادة (الأجنة المولودة / المنقولة). تشير الحروف المرتفعة المختلفة إلى اختلافات كبيرة (P < 0.05).
تم اختبار ملعقة MVD أيضا لتزجيج أجنة الأغنام المنتجة في المختبر قبل الزرع ومقارنتها بجهاز تجاري6. النتائج موضحة في الجدول 3. تم تقييم جودة الأجنة من خلال التشكل باتباع المعايير التي أوصت بها الجمعية الدولية لتكنولوجيا الأجنة (IETS) 15 ، وتم تخصيص تلك الأجنة الممتازة والجيدة من الدرجة الأولى لكل مجموعة تجريبية.
لم يتأثر معدل البقاء على قيد الحياة (~ 70٪ و ~ 16٪ ، بعد 3 ساعات أو 24 ساعة من الاحترار ، على التوالي) ولا فقس الجنين في اليوم 8 بطريقة التزجيج. كانت النسبة المئوية للكيسات الأريمية في اليوم 8 أقل لكل من تقنيات التزجيج مقارنة بالمجموعة الضابطة (الأجنة الطازجة) (~ 8٪ مقابل 20.5٪ ، على التوالي ؛ ص < 0.05). تشير هذه النتائج إلى أنه يمكن أيضا تزجيج أجنة الأغنام المنتجة في المختبر باستخدام ملعقة MVD. بالإضافة إلى ذلك ، تم استكمال النتائج السابقة عن طريق نقل أجنة الأغنام المعرضة للتجميد البطيء ، أو ملعقة MVD ، أو جهاز تجاري إلى الإناث المتلقية16. النتائج موضحة في الجدول 4. تم تقييم معدل بقاء الجنين (الأجنة القابلة للحياة في اليوم 30 / الأجنة المنقولة) ، ومعدل الحمل (النعاج الحامل / المنقولة) ، وفقدان الجنين من الحمل إلى الولادة (الحملان المولودة عند الولادة / الأجنة القابلة للحياة في اليوم 30) ، ومعدل بقاء الحملان (الحملان الحية بعد أسبوع واحد من الولادة / ولادة الحملان) بين المجموعات التجريبية.
أظهرت النتائج أن معدل بقاء الجنين بعد نقل الأجنة كان مشابها ل SLF (26.5٪) و ملعقة MVD (22.2٪) ولكنه كان أعلى بالنسبة لمجموعة الأجهزة التجارية (52.0٪ ، P < 0.05). لم تتأثر الحصائل الإنجابية (طول الحمل، وفقدان الجنين، ووزن الولادة، ومعدلات بقاء الحملان) بشكل يعتد به بطريقة الحفظ بالتبريد. بشكل عام ، تعد ملعقة MVD أيضا طريقة مناسبة لتزجيج أجنة الأغنام قبل الزرع.
| N° من الأجنة | معدل البقاء على قيد الحياة ٪ (الأجنة القابلة للحياة / المحفوظة بالتبريد) | معدل النمو٪ (الأكياس الأريمية المورولية في اليوم 6 / الأجنة المشقوقة) | معدل الفقس ٪ (الكيسات الأريمية المفرغة / الأجنة المشقوقة) | ||
| 3 ساعات | 24 ساعة | ||||
| ملعقة MVD | 165 | 69.6 ± 2.4أمبير | 14.6 ± 3.5أمبير | 11.1 ± 2.1ب | 6.4 ± 1.9ب |
| جهاز تجاري | 165 | 71.3 ±1.3 أمبير | 17.7 ± 4.5أمبير | 12.7 ± 3.2ب | 10.2 ± 2.9ب |
| المجموعة الضابطة (الأجنة الطازجة) | 408 | - | - | 41.3 ± 3.7أمبير | 20.5 ± 4.5أمبير |
الجدول 3: معدلات البقاء على قيد الحياة والنمو في المختبر لأجنة الأغنام المعرضة للتزجيج بواسطة ملعقة MVD أو جهاز تجاري.تم إنتاج أجنة من 2-8 خلايا في المختبر (اليوم 2 بعد الإخصاب) باستخدام ملعقة MVD أو جهاز تجاري ثم تسخينها. تم تحليل معدل البقاء على قيد الحياة (قابل للحياة / محفوظ بالتبريد) بعد 3 ساعات و 24 ساعة من الاحترار. تم تعريف معدلات التطور والفقس على أنها عدد المورولا والكيسات الأريمية التي تم الحصول عليها في اليوم 6 وعدد الأجنة المفرغة ، على التوالي ، على عدد الأجنة المشقوقة (2-8 خلايا). تشير الحروف المرتفعة المختلفة في نفس العمود إلى اختلافات كبيرة (P < 0.05). يتم عرض البيانات على أنها متوسط ± SEM.
| بقاء الجنين (الأجنة القابلة للحياة في اليوم 30 / الأجنة المنقولة) | معدل الحمل (النعاج الحامل / المنقولة) | فقدان الجنين (الحملان المولودة عند الولادة / الأجنة القابلة للحياة في اليوم 30) | طول الحمل (د) | الوزن عند الميلاد (جم) | معدل بقاء الحملان (الحملان الحية بعد أسبوع واحد من الولادة / ولادة الحملان) | |
| ملعقة MVD | 22.2٪ أ (28/126) | 32.9٪ أ (25/76) | 4.0٪ أ (1/25) | 150.7 ± 1.8أمبير | 4102 ± 112.4أمبير | 87.5٪ أ (21/24) |
| جهاز تجاري | 52.0٪ ب (91/175) | 66.0٪ ب (62/94) | 11.0٪ أ (8/73) | 150.4 ± 1.9أمبير | 3980 ± 221.2أمبير | 83.1 ٪أ (54/65) |
| التجميد البطيء | 26.5٪أ (36/136) | 38.3 ٪أ (28/73) | 6.7٪ أ (2/30) | 150.4 ± 2.1أمبير | 4319 ± 107.3أمبير | 89.3٪ أ (25/28) |
الجدول 4: تأثير طريقة الحفظ بالتبريد على بقاء الجنين بعد النقل والحفاظ على الحمل وإنتاج الحمل. تعرضت Morulae إلى الأكياس الأريمية الموسعة للأجنة المنتجة في الجسم الحي أو في المختبر للتزجيج / التجميد البطيء والاحترار / الذوبان وتم نقلها إلى نعاج ميرينو المتزامنة متعددة التقويم. تمت مقارنة معدل بقاء الجنين (الأجنة القابلة للحياة في اليوم 30 / الأجنة المنقولة) ، ومعدل الحمل (النعاج الحامل / المنقولة) ، وفقدان الجنين من الحمل إلى الولادة (الحملان المولودة عند الولادة / الأجنة القابلة للحياة في اليوم 30) ، وطول الحمل (د) ، والوزن عند الميلاد (جم) ومعدل بقاء الحملان (الحملان الحية بعد أسبوع واحد من الولادة / ولادة الحملان) بين المجموعات التجريبية.
علاوة على ذلك ، تم دعم خطوط الفئران المعدلة وراثيا التي لم تعد مستخدمة في منشأتنا كأجنة ثنائية الخلية باستخدام طريقة ملعقة MVD. تم تزجيج ما لا يقل عن 300 جنين ثنائي الخلية ، يتم إنتاجه بشكل أساسي عن طريق الإخصاب في المختبر (أو التزاوج الطبيعي) لكل خط فأر. تم إجراء مراقبة جودة العملية عن طريق تسخين ملعقتين أو ثلاث ملاعق من كل خط ونقل الأجنة إلى متلقين الحوامل الزائفات. تظهر النتائج التمثيلية لخطوط الفأر المعدلة وراثيا المختلفة في الجدول 5. في المتوسط ، كان معدل الشفاء 90.4٪ ، ومعدل البقاء على قيد الحياة 96.8٪. كان معدل الحمل 80٪ ، وكان معدل المواليد 31.5٪ في المتوسط. وتجدر الإشارة إلى أن معدل المواليد أظهر مجموعة واسعة من النتائج من 12٪ إلى 45٪ ، والتي يمكن أن تكون بسبب التعديلات الجينية المختلفة التي يمكن أن تؤثر على حساسية الجنين ونتائج نقل الأجنة. بشكل عام ، كانت هذه النتائج متسقة مع تلك التي تم الحصول عليها سابقا في المنشأة.
| خط الماوس | عدد الأجنة المزججة / الدافئة | معدل الشفاء (تم استرداده من الجهاز / الأجنة المحفوظة بالتبريد) | معدل البقاء على قيد الحياة (الأجنة القابلة للحياة / المستردة من الجهاز) | معدل الحمل (الإناث الحوامل/المنقولات) | معدل المواليد (الجراء المولودين / المنقولين الأجنة) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| متوسط | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
الجدول 5: النتائج التمثيلية لعملية التزجيج لمراقبة الجودة التي تم إجراؤها في أجنة 2 خلية من خطوط فأر معدلة وراثيا مختلفة. تم دعم خطوط الفأر المعدلة وراثيا كأجنة ثنائية الخلية (300 جنين على الأقل) باستخدام طريقة ملعقة MVD. تم إجراء مراقبة جودة العملية عن طريق تسخين ملعقتين أو ثلاث ملاعق من كل خط ونقل الأجنة إلى متلقين الحوامل الزائفات. تم تحديد التعافي (المسترد من الجهاز / الأجنة المحفوظة بالتبريد) ومعدل البقاء على قيد الحياة (الأجنة القابلة للحياة / المستردة من الجهاز) بعد الاحترار. تم نقل الأجنة الدافئة القابلة للحياة في مرحلة خليتين إلى الإناث المتلقين (1 إلى 3 إناث لكل سطر ، ~ 18 جنينا لكل أنثى). تم تحديد معدلات الحمل (الإناث الحوامل / المنقولات) والولادة (الأجنة المولودة / المنقولة).
أخيرا ، أجرينا مؤخرا عملا مقارنا تم فيه حقن زيجوت الفأر الطازج والمزجج بكواشف كريسبر ثم زراعتها أو نقلها في المختبر إلى الإناث الحواملالزائفة 17. كان الهدف هو تقييم ما إذا كانت البيضة البيضية المزججة - باستخدام ملعقة MVD - يمكن أن تكون مصدرا مناسبا للأجنة للحقن المجهري في البيضة البيضة الملقحة B6D2F1 / J و C57BL / 6J. كانت معدلات التعافي والبقاء على قيد الحياة مماثلة للنتائج السابقة التي تم الحصول عليها لأجنة مرحلة 2-8 خلايا (الجدول 6). بشكل عام ، نجت البيضة الملقحة الدافئة بالتزجيج من الحقن المجهري ، وتطورت إلى كيسات أريمية مفرغة أو أنتجت صغارا حية ، وأظهرت طفرات ناتجة عن نظام CRISPR / Cas9. ومع ذلك ، كان معدل الطفرات أقل بكثير في البيضة الملقحة المزججة منه في الزيجوت الطازج. يبدو أن Zygote cryobanking هي مصدر بديل للأجنة لإجراء جلسات الحقن المجهري عند الطلب ، وتجنب تربية وصيانتها طوال العام بأكمله وتعزيز تنفيذ 3Rs في تقنية كريسبر.
| سلالة البيضة الملقحة | Nº من البيضة البيضة الملقحة المحفوظة بالتبريد | معدل الشفاء (تم استرداده من الجهاز / الأجنة المحفوظة بالتبريد) | معدل البقاء على قيد الحياة (الأجنة القابلة للحياة / المستردة من الجهاز) |
| B6D2F1 / J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL / 6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
الجدول 6: معدلات الانتعاش والبقاء على قيد الحياة للزيجوت B6D2F1 / J و C57BL / 6J الدافئة بالمزجج. تم جمع البيضات البيقية المنتجة في الجسم الحي من الإناث المانحة B6D2F1 / J و C57BL / 6J ، وتم تزجيجها بواسطة ملعقة MVD ، وتسخينها. تم تحديد معدلات التعافي (المستردة من الجهاز / الأجنة المحفوظة بالتبريد) والبقاء على قيد الحياة (الأجنة القابلة للحياة / المستردة من الجهاز) بعد الاحترار.
Discussion
جهاز Spatula MVD هو جهاز تزجيج سهل التجميع ومنخفض التكلفة وأقل حجم مع قدرة عالية على الاحتفاظ بالجنين وإشغال مثالي للنيتروجين السائل. أثبتت هذه الطريقة أنها بسيطة وسريعة وقوية. في المتوسط ، لم نحقق فقط معدلات عالية لاستعادة الأجنة والبقاء على قيد الحياة للأجنة المزججة (~ 90٪) ولكن أيضا نتائج إنجابية جيدة عند إجراء نقل الأجنة في الفئران (~ 80٪ معدل الحمل و ~ 30٪ معدل المواليد) ، والتي يمكن مقارنتها بطرق التزجيج الأخرى للحد الأدنىمن الحجم 18،19،20.
تشمل الخطوات الحاسمة في طريقة تزجيج الملعقة MVD ما يلي: (ط) تحضير الملعقة. تتطلب هذه التقنية خبرة كبيرة. يجب أن تكون المنصة المنتجة في طرف اللودر الجل عن طريق التسخين بالملقط ~ 1 مم2 ويجب إغلاقها في النهاية. إذا ظل الطرف مفتوحا ، فقد تتشكل فقاعات عند غمر الملعقة في قطرة السكروز أثناء عملية الاحترار بسبب الاختلافات في درجات الحرارة. تتداخل الفقاعات مع البحث عن الأجنة وتعافيها. (ثانيا) حضانة الأجنة في محاليل التزجيج. بسبب الكثافة العالية ، تبقى الأجنة على ارتفاعات مختلفة في القطرات. هناك حاجة إلى شفط سريع لجميع الأجنة. من المتوقع حدوث سمية إذا بقيت الأجنة في هذه المحاليل لفترات أطول في درجة حرارة الغرفة. (ثالثا) انخفاض زجاج الملعقة. يجب أن يكون حجم قطرة التزجيج - التي تحتوي على الأجنة - في المنصة ~ 0.5-1.0 ميكرولتر ؛ تؤثر أحجام الحمالات المجمدة الأكبر على بقاء الجنين. نوصي باستخدام الشعيرات الدموية المسحوبة ذات القطر الداخلي الأوسع قليلا من حجم الجنين ، والتي تحمل الحجم المطلوب. بالإضافة إلى ذلك ، قد تؤدي القطرات الكبيرة في المنصة إلى زيادة احتمالية الوقوع في القشة التي تبلغ سعتها 0.5 مل داخل الحائط عند إغلاق النظام. (رابعا) ختم الملعقة. يجب توخي الحذر بشكل خاص عند إغلاق الملعقة بالقش 0.5 مل ؛ يجب محاذاة كلا العنصرين. يجب عدم إزعاج قطرات الجنين في الملعقة. (ت) أثناء الاحترار ، اتبع ترتيب إزالة معرف القضيب والقش 0.5 مل. خلاف ذلك ، قد يتم طرد المعرف بسبب اختلاف درجة الحرارة.
تتطلب هذه التقنية تدريب المشغل في مراحل مختلفة. يمكن أن يكون استكشاف الأخطاء وإصلاحها الرئيسي هو استعادة الأجنة من الملعقة. إذا تم استرداد أقل من 70-80٪ من الأجنة المزججة عند تسخين الملعقة ، فقد يكون هذا بسبب (1) التحميل غير الكامل للأجنة على منصة الملعقة أو (2) الاحتفاظ بالأجنة في الجدار الداخلي للقش 0.5 مل عند إغلاق النظام. للتغلب على المشكلة الأولى ، يجب إجراء تحميل القطرة التي تحتوي على الأجنة تحت المجهر المجهر المجهري باستخدام مجموعة أنبوب الشفاط والشعيرات الدموية المسحوبة المحملة بوسائط الجذع بالتبريد التي تحتوي على الأجنة و 2-3 فقاعات هواء صغيرة على طول الشعيرات الدموية ، مما يسمح بالتدفق الصحيح للسائل. بالنسبة للمشكلة الثانية ، إذا لم تكن هناك أجنة مرئية في المنصة أثناء الاحترار ، فقم بقص السدادة القطنية لفتح القش سعة 0.5 مل واغسلها مرتين باستخدام 500 ميكرولتر من 0.5 متر من السكروز في M2 (انظر القسم 2 ، الخطوة 1) ، وطرد المحلول في طبق لاستعادة الأجنة.
ترتبط قيود الطريقة بشكل أساسي بالمراحل الحرجة التي سبق ذكرها. نعتقد أن النقطة الأساسية هي تحضير الملعقة. يتطلب الأمر تدريبا لأداء ملعقة جيدة ، ولكن بمجرد تعلمها ، يمكن إتقانها. نظرا لأن الوسائط محلية الصنع ، فلا يمكن استخدام هذه الطريقة في عيادات الإنجاب البشري.
الميزة الرئيسية ل Spatula MVD هي أنه جهاز منخفض التكلفة مقارنة بالأجهزة التجارية9. علاوة على ذلك ، فإنه يوفر مساحة في ديوار النيتروجين السائل مقارنة بتزجيج الأنبوبالمبرد 8. لقد اختبرنا وظائفه على أجنة الفئران والأغنام في مراحل مختلفة. إنه أبسط وأسرع وأكثر اقتصادا وأكثر فعالية بشكل خاص من طريقة التجميد البطيء.
يمكن استخدام هذه الطريقة لتزجيج أجنة أنواع الثدييات غير البشرية المختلفة في مجموعة واسعة من مجالات البحث.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نشكر أليخو مينشاكا على مساهمته في تطوير Spatula MVD. تلقت GS تمويلا من برنامج الدراسات العليا في التكنولوجيا الحيوية - Facultad de Ciencias - Universidad de la República (https://webmasterbiotecnol.wixsite.com/biotec1) (رقم المنحة: GS 2437 347). تلقت GS و MNM و MC تمويلا من FOCEM - Fondo para la Convergencia Estructural del Mercosur (https://focem.mercosur.int/es/) (رقم المنحة: COF 03/11). GS و MC زميلان في Sistema Nacional de Investigadores ، الوكالة الوطنية للتحقيقات والابتكار ، أوروغواي. (https://www.anii.org.uy/). الممولون (برنامج الدراسات العليا في التكنولوجيا الحيوية - كلية العلوم - جامعة الجمهورية ؛ FOCEM - Fondo para la Convergencia Estructural del Mercosur; لم يكن للمعهد الوطني للتحقيقات أي دور في تصميم الدراسة أو جمع البيانات وتحليلها أو قرار النشر أو إعداد المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
References
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved