Method Article
Spatola Montevideo Dispositivo per la vitrificazione di embrioni di mammiferi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui presentiamo il protocollo Spatola Montevideo per la vitrificazione di embrioni preimpianto di topi e pecore, che consiste in una spatola fatta in casa e utilizza soluzioni fatte in casa. Gli embrioni vengono rapidamente equilibrati in due soluzioni crioprotettive a concentrazione crescente, caricati sulla spatola, immersi in azoto liquido e infine sigillati con una cannuccia da 0,5 mL.
Abstract
Questo studio descrive un metodo di vitrificazione efficiente ed economico per la crioconservazione di embrioni di topi e pecore noto come Spatola Montevideo (MVD). Questo protocollo utilizza una spatola fatta in casa come dispositivo di trasporto, che viene preparata con una punta di caricamento del gel. Gli embrioni vengono rapidamente equilibrati in due soluzioni crioprotettive fatte in casa a concentrazione crescente, caricate nella spatola e quindi immerse direttamente nell'azoto liquido. Circa 30-40 embrioni di topo in fase preimpianto possono essere caricati sulla spatola, che viene successivamente sigillata con una cannuccia da 0,5 ml. L'uso di spatole al posto dei criotubi, che vengono spesso utilizzati per conservare gli embrioni vitrificati, ottimizza lo spazio nei dewar di azoto liquido. Inoltre, il processo di riscaldamento richiede solo una soluzione di saccarosio fatta in casa a concentrazione decrescente per reidratare gli embrioni e ripristinare la loro morfologia. Il nostro laboratorio utilizza con successo la Spatola Montevideo per embrioni preimpianto di topi e pecore da oltre 10 anni. La Spatola Montevideo ha dimostrato un tasso medio di recupero (embrioni recuperati/vitrificati) dell'84% e un tasso di sopravvivenza (embrioni vitali/recuperati) del 97% negli embrioni di topo. La vitrificazione di embrioni murini ha prodotto risultati migliori rispetto al congelamento lento, sebbene non siano state osservate differenze negli esiti riproduttivi (gravidanza, parto e tassi di natalità). Negli embrioni di pecora, con la Spatola Montevideo sono stati raggiunti tassi di sopravvivenza e di sviluppo embrionale simili rispetto a un dispositivo commerciale. Sebbene il tasso di gravidanza fosse più alto per il dispositivo commerciale, il tasso di sopravvivenza dell'agnello non era significativamente diverso tra i dispositivi. Il metodo di vitrificazione Spatula Montevideo è una semplice tecnica di crioconservazione che può essere utilizzata per conservare gli embrioni in eccesso, eseguire il backup di linee di topi geneticamente modificati e modelli di pecore e facilitare il loro scambio tra i ricercatori di tutto il mondo.
Introduzione
L'efficienza della generazione animale geneticamente modificata (GM) è aumentata in modo significativo grazie allo sviluppo di metodi basati sull'endonucleasi, in particolare CRISPR/Cas9. Molti laboratori in tutto il mondo producono varie linee di topi e ratti geneticamente modificati che dovrebbero essere crioconservate per prevenire la deriva genetica e mantenere l'integrità del fenotipo originale1. Inoltre, l'archiviazione elimina la necessità di un allevamento costante, che spesso si traduce in un numero eccessivo di animali. Alcuni laboratori inviano linee di topi GM come embrioni o spermatozoi crioconservati a depositi internazionali, facilitando lo scambio di questi modelli ed evitando il trasporto di animali vivi. Ciò garantisce l'accessibilità alle linee senza la generazione ripetitiva di modelli di animali GM identici2. Per questi motivi, la crioconservazione di embrioni e spermatozoi è fondamentale in qualsiasi struttura per animali geneticamente modificati. In generale, la crioconservazione degli embrioni è preferita per la conservazione delle linee GM perché gli embrioni contengono il genoma diploide completo con modifiche e possono essere facilmente recuperati tramite trasferimento embrionale.
La vitrificazione è un processo di non equilibrio caratterizzato da uno squilibrio tra l'acqua che entra nella cellula e l'acqua che forma cristalli extracellulari attorno ad essa. Questo metodo previene la formazione di cristalli di ghiaccio intracellulari, distinguendolo dal metodo di congelamento lento (SLF)3 (vedi Figura 1). L'alta concentrazione di crioprotettori e il contatto diretto con l'azoto liquido (LN2) consentono un raffreddamento ultrarapido (~40 °C/s), raggiungendo uno stato vitreo dei campioni in pochi secondi. Inoltre, la vitrificazione è più veloce, più facile e meno costosa del congelamento lento4. Richiede un LN2 minimo e in genere impiega apparecchiature semplici che possono essere acquistate commercialmente o fatte in casa5 (vedi Figura 1).
Inoltre, il processo di riscaldamento è generalmente veloce e replicabile. Dovrebbe essere eseguito rapidamente per evitare la tossicità del crioprotettore e per mantenere lo stato vitreo3. Quando si congelano gli embrioni, molti laboratori considerano la comodità del dispositivo portante, la sua affidabilità, robustezza, capacità di tenuta e costi.
Preferiamo il metodo di vitrificazione a spatola a volume minimo per la crioconservazione di routine di embrioni di ovini e topi, utilizzando il dispositivo Spatola Montevideo (MVD)6. Inizialmente, abbiamo impiegato il metodo di congelamento lento7 , ma siamo passati rapidamente alla vitrificazione. Per creare un dispositivo più semplice ed efficiente in termini di spazio per il dewar LN2 , abbiamo modificato la spatola fatta in casa da Tsang e Chow (2009)8, che è collegata a un criotubo, per sviluppare la spatola MVD che è sigillata con una cannuccia da 0,5 ml (vedi Tabella dei materiali). La spatola è dotata di una punta di caricamento del gel (vedi Tabella dei materiali), dove una piattaforma di circa 1 mm² è formata fondendo delicatamente la punta con una pinza fine, creando una piastra simile a un petalo per caricare gli embrioni. Questa piattaforma può ospitare fino a 40 embrioni di topo in una piccola goccia di vitrificazione. Un'asta di identificazione (vedi Tabella dei materiali) è inserita nell'estremità aperta della punta del caricatore di gel.
Lo scopo di questo metodo è quello di vitrificare gli embrioni in un metodo semplice, veloce ed economico che, inoltre, consente di risparmiare spazio nel dewar con azoto. Questo sistema è stato utilizzato con successo per molti anni, fornendo eccellenti tassi di sopravvivenza embrionale (~97%) e risultati riproduttivi, in particolare negli embrioni di topo. Poiché la spatola MVD viene preparata in laboratorio, è un metodo a basso costo rispetto ai dispositivi commerciali9. Inoltre, consente di risparmiare spazio nel dewar con azoto rispetto all'uso di criotubi 8,10.

Figura 1: Confronto tra le due principali tecniche utilizzate per la crioconservazione degli embrioni. Questa figura è stata modificata con il permesso di Crispo et al.1. Creato nel BioRender.com. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
Gli animali utilizzati per ottenere embrioni di topo sono stati alloggiati e gestiti secondo la legge nazionale 18.611 e le linee guida internazionali per la cura degli animali11. Il protocollo sperimentale (numero di permesso #007-18) è stato opportunamente approvato dal Comitato per la Cura e l'Uso degli Animali dell'Institut Pasteur de Montevideo (è stato dato il consenso scritto). I protocolli sperimentali per ovociti/embrioni di pecora sono stati approvati dal Comitato Istituzionale per la Cura degli Animali Fundación IRAUy (protocollo #001-2017), conformi alle linee guida ARRIVE12 e sono stati eseguiti in conformità con le linee guida internazionali per la cura degli animali11.
1. Vitrificazione (Figura 2)
- Spatola MVD preparazione
- Accorciare la punta del gel-loader (vedi Tabella dei materiali) tagliando i primi 10 mm e il cono della punta.
NOTA: In questo modo si crea una punta più corta e diritta, facilitando la sigillatura finale con la cannuccia da 0,5 ml (vedere la Tabella dei materiali). - Tenere l'estremità della punta del caricatore di gel con la pinza #5 dell'orologiaio (vedi Tabella dei materiali) a circa 1,0 cm dalla punta. Posizionare delicatamente la punta nella fiamma di un bruciatore Bunsen (vedi Tabella dei materiali) e tenere premuto per 8-10 s fino a formare una piattaforma simile a un petalo di circa 1 mm2.
- Togliere dal fuoco e tenere forte con la pinza per 5 s.
- Utilizzando uno stereomicroscopio (vedi Tabella dei materiali), verificare che la piattaforma a forma di petalo (~ 1 mm2) sia formata e che il bordo distale sia sigillato.
NOTA: La piattaforma deve essere chiusa all'estremità distale per evitare l'infiltrazione di LN2 durante la vetrificazione. Assicurarsi che la piattaforma sia pulita e priva di fili di plastica. Se è troppo piccola o ha dei fili, tagliare la punta e ripetere la procedura. - Ripetere i passaggi 1.1.1-1.1.4 per preparare il numero necessario di spatole (1 spatola = fino a 40 embrioni di topo).
- Sterilizzare le spatole utilizzando raggi ultravioletti (UV) o ossido di etilene e conservarle in una provetta o scatola sterile.
- Il giorno della vetrificazione, recuperare le spatole, maneggiandole dall'estremità opposta della piattaforma. Inserire un'asta di identificazione (vedi Tabella dei materiali) in ciascuna spatola e posizionarla sulla base dello stereomicroscopio. Etichettare l'asta con un pennarello indelebile o un'etichetta adesiva resistente all'azoto liquido.
NOTA: Evitare sempre di toccare la piattaforma quando si maneggiano le spatole. La lunghezza totale dell'intero dispositivo (spatola + 0,5 ml di cannuccia + asta di identificazione) non deve superare 1 cm della lunghezza del calice.
- Accorciare la punta del gel-loader (vedi Tabella dei materiali) tagliando i primi 10 mm e il cono della punta.
- Preparazione di soluzioni di vitrificazione
- Preparare la soluzione FS: Sciogliere 1,5 g di terreno con gradiente di densità (vedere la Tabella dei Materiali) e 0,85 g di saccarosio (vedere la Tabella dei Materiali) in 5 mL di soluzione salina tamponata con fosfato (PBS; vedere la Tabella dei Materiali). Scaldare a bagnomaria bollente fino a completa dissoluzione, quindi sterilizzare con un filtro da 0,22 μm (vedi Tabella dei materiali).
NOTA: Questa soluzione può essere conservata a 4 °C per un massimo di 6 mesi. - Preparare la soluzione di pre-vitrificazione (PV): il giorno della vetrificazione, miscelare il 10% di glicole etilenico (vedere la Tabella dei Materiali), il 10% di dimetilsolfossido (vedere la Tabella dei Materiali) e l'80% di M2 di terreno (vedere la Tabella dei Materiali). Per 5 spatole è necessario un volume totale di 100 μl.
- Preparare la soluzione di vitrificazione (V): il giorno della vetrificazione, combinare il 15% di glicole etilenico, il 15% di dimetilsolfossido, il 10% di terreno M2 e la soluzione di FS al 60%. Per 5 spatole è necessario un volume totale di 100 μl.
- Preparare la soluzione FS: Sciogliere 1,5 g di terreno con gradiente di densità (vedere la Tabella dei Materiali) e 0,85 g di saccarosio (vedere la Tabella dei Materiali) in 5 mL di soluzione salina tamponata con fosfato (PBS; vedere la Tabella dei Materiali). Scaldare a bagnomaria bollente fino a completa dissoluzione, quindi sterilizzare con un filtro da 0,22 μm (vedi Tabella dei materiali).
- Processo di disidratazione e vitrificazione degli embrioni
- Preparare LN2: Versare LN2 in un contenitore adatto (ad esempio, un contenitore di polistirene isolato di 10 cm x 30 cm x 20 cm) e posizionare tante cannucce da 0,5 ml quante sono le spatole da utilizzare.
NOTA: Per facilitare la visualizzazione della piattaforma della spatola durante la manipolazione sotto LN2, si suggerisce di utilizzare un contenitore di polistirene isolato con fondo colorato per creare un effetto di contrasto.
ATTENZIONE: Indossare occhiali e guanti adeguati (vedere la tabella dei materiali) quando si maneggia LN2. - Preparare le soluzioni: Su una piastra di Petri di plastica da 100 mm (vedi Tabella dei materiali), posizionare le seguenti gocce: 100 μl di M2, 20 μl di soluzione PV e 20 μl di soluzione V per ogni spatola.
- Vitrificare gli embrioni: Posizionare gli embrioni da vitrificare nella goccia M2. Maneggiare 30-40 embrioni alla volta, incubandoli nella goccia di soluzione PV per 30 s, e poi nella goccia di soluzione V per altri 30 s a temperatura ambiente (RT).
- Utilizzare un capillare di vetro tirato (vedi Tabella dei materiali) con un tubo aspiratore (vedi Tabella dei materiali). Precaricare il capillare con almeno 1 μL della rispettiva soluzione prima di posizionare gli embrioni.
NOTA: Gli embrioni saranno a diverse altezze nelle gocce, quindi regola il micrometro dello stereomicroscopio per localizzarli. Recupera gli embrioni da ogni goccia quando rimangono 10 s. Tutte le manipolazioni degli embrioni devono essere condotte allo stereomicroscopio. - Caricare gli embrioni: aspirare gli embrioni utilizzando una soluzione di V minima (ad es. ~ 0,1 μL) e posizionarli rapidamente sulla piattaforma della spatola.
- Immersione in LN2: Dopo aver caricato gli embrioni, immergere immediatamente la piattaforma della spatola in LN2 per 5 s (tenendo la spatola a mano, per l'asta). Quindi, mantenendo la spatola nei vapori di LN2 , sigillarla con una cannuccia da 0,5 ml utilizzando una pinzetta lunga in acciaio inossidabile (vedi Tabella dei materiali).
NOTA: Rimuovere LN2 dalla cannuccia prima di sigillare per evitare l'espansione durante il riscaldamento. Assicurati che la spatola e la cannuccia siano allineate correttamente per evitare il contatto tra la goccia dell'embrione e la parete della paglia. Per comodità, le spatole sigillate possono rimanere nel contenitore LN2 fino a quando tutte le spatole non sono caricate con embrioni, riempiendole nuovamente con LN2 se necessario. - Ripetere la procedura: Ripetere i passaggi da 1.3.3 a 1.3.7 per ogni gruppo di embrioni, utilizzando un paio di gocce PV e V fresche.
- Stoccaggio: Trasferire le spatole nei calici (vedi Tabella dei materiali) e poi in un dewar di stoccaggio LN2 (vedi Tabella dei materiali).
- Preparare LN2: Versare LN2 in un contenitore adatto (ad esempio, un contenitore di polistirene isolato di 10 cm x 30 cm x 20 cm) e posizionare tante cannucce da 0,5 ml quante sono le spatole da utilizzare.

Figura 2: Schema del processo di vetrificazione utilizzando Spatola MVD. Si veda il testo per maggiori dettagli. Creato in BioRender. Meikle, M. (2025) https://BioRender.com/x96y902. Clicca qui per visualizzare una versione più grande di questa figura.
2. Riscaldamento (Figura 3)
- Preparazione della soluzione
- Preparare una soluzione di saccarosio 1 M sciogliendo 0,85 g di saccarosio in 2,5 mL di terreno M2. Sterilizzare la soluzione con un filtro da 0,22 μm.
NOTA: Questa soluzione può essere preparata e conservata a 4 °C per un massimo di 1 settimana. - Preparare le soluzioni di saccarosio 0,5 M e 0,25 M diluendo la soluzione di saccarosio 1 M con il volume appropriato di terreno M2.
- Mantenere le soluzioni di saccarosio a 37 °C su una piastra calda (vedi Tabelle dei materiali) fino all'inizio del riscaldamento.
- Preparare una soluzione di saccarosio 1 M sciogliendo 0,85 g di saccarosio in 2,5 mL di terreno M2. Sterilizzare la soluzione con un filtro da 0,22 μm.
- Preparazione della piastra riscaldante
- Su una piastra di Petri di plastica da 100 mm, posizionare le seguenti gocce di soluzione: una goccia da 500 μl di saccarosio 0,5 M, una goccia da 50 μl di saccarosio 0,5 M e una goccia da 50 μl di saccarosio 0,25 M per ogni spatola da riscaldare. Mettere tre gocce di terreno M2 (100 μl ciascuna) per il lavaggio.
- Processo di riscaldamento
NOTA: Il processo di riscaldamento avviene a RT, ad esempio 20-22 °C sulla base di uno stereomicroscopio.- Recupera le spatole sigillate dal dewar. Metterli in un contenitore appropriato con LN2. Vedere la Figura 3.
- Posizionare la piastra riscaldante sullo stereomicroscopio. Uno alla volta, afferra la base della spatola con una pinzetta in acciaio inossidabile e, con una mano guantata, estrai l'asta di identificazione e poi la cannuccia. Immergi rapidamente la piattaforma contenente gli embrioni nella goccia di saccarosio 0,5 M da 500 μl.
- Assicurarsi che tutti gli embrioni siano caduti nella goccia; Se necessario, muovere delicatamente la spatola per favorirne il rilascio. Caricare gli embrioni in un capillare di vetro tirato, metterli nella goccia da 50 μl di soluzione di saccarosio 0,5 M e incubare per 2 minuti.
- Immergere gli embrioni nella goccia da 50 μl di soluzione di saccarosio 0,25 M e incubare per altri 2 minuti.
NOTA: Prima di inserire gli embrioni in ogni soluzione, precaricare il capillare con la soluzione da utilizzare. - Infine, lavare gli embrioni tre volte in diverse gocce di terreno M2 per rimuovere il saccarosio.
- Incubare gli embrioni in condizioni appropriate per ciascuna specie per almeno 1 ora prima dell'uso.
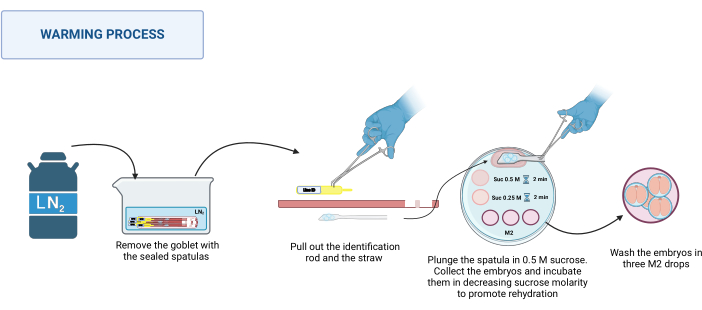
Figura 3: Schema del processo di riscaldamento MVD della spatola. Si veda il testo per maggiori dettagli. Creato in BioRender. Meikle, M. (2025) https://BioRender.com/k91k191. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Inizialmente abbiamo utilizzato il tradizionale metodo di congelamento lento basato su soluzioni di glicole propilenico, cannucce e apparecchiature di congelamento a velocità controllata7. Tuttavia, dopo aver considerato il metodo di vitrificazione un'opzione potenzialmente più semplice ed economica, abbiamo condotto uno studio per confrontare i risultati del congelamento lento tradizionale (SLF) rispetto alla MVD a spatola in embrioni di topo derivati in vivo a 8 cellule e in embrioni di topo prodotti in vitro a 2 cellule13 (Tabella 1 e Tabella 2). I risultati sono presentati in termini di "tasso di recupero", che definisce il numero di embrioni recuperati dal dispositivo dopo il riscaldamento rispetto al numero totale di embrioni crioconservati. Il "tasso di sopravvivenza" si riferisce al numero di embrioni vitali rispetto agli embrioni recuperati dal dispositivo. Gli embrioni erano considerati vitali se i blastomeri erano intatti (due blastomeri negli embrioni a 2 cellule e almeno quattro blastomeri negli embrioni a 8 cellule)14. Questi termini vengono utilizzati per valutare se il dispositivo e l'intero processo sono adatti alla crioconservazione.
Un tasso di sopravvivenza significativamente più elevato (Tabella 1 e Tabella 2) e un tasso di sviluppo a 3,5 giorni dopo il coito (dpc; ad esempio, embrioni di morule e blastocisti, Tabella 1) sono stati raggiunti per la MVD a spatola rispetto al gruppo SLF negli embrioni di topo. Sebbene entrambi i metodi abbiano raggiunto un tasso di schiusa accettabile, è stato significativamente inferiore rispetto al gruppo fresco di controllo, come previsto (embrioni non vitrificati; Tabella 1). Gli embrioni freschi a 2 cellule vitrificati/riscaldati e di controllo sono stati trasferiti alle femmine riceventi, non rivelando differenze sia nel tasso di gravidanza (femmine gravide/totali trasferite) che nel tasso di natalità (cuccioli nati/embrioni trasferiti sul totale delle femmine riceventi; Tabella 2). Questi risultati ci portano a passare dal metodo SLF alla vitrificazione.
| Nº di embrioni | Tasso di sopravvivenza a 2,5 dpc (embrioni vitali/recuperati dal dispositivo) | Tasso di sviluppo embrionale a 3,5 dpc (morule-blastocisti/embrioni vitali) | Tasso di schiusa a 5,5 dpc (blastocisti schiuse/embrioni in coltura) | |
| Congelamento lento | 410 | 89,3 % (366/410)a | 91,8 % (336/366)a | 49,7 % (90/181)a |
| Spatola MVD | 341 | 92,7 % (316/341)b | 97,2 % (307/316)b | 41,0 % (68/166)a |
| Embrioni freschi | 458 | - | 98,7 % (452/458)b | 67,8 % (139/205)b |
Tabella 1: Tassi di sopravvivenza e di sviluppo in vitro di embrioni murini a 8 cellule sottoposti a vitrificazione o congelamento lento. In vivo, gli embrioni murini a 8 cellule sono stati crioconservati mediante spatola MVD o congelamento lento e confrontati con gli embrioni freschi. Gli embrioni freschi sono stati raccolti da femmine a 2,5 dpc e coltivati nelle stesse condizioni degli altri gruppi. Il tasso di sopravvivenza (embrioni vitali/recuperati dal dispositivo) è stato determinato dopo il riscaldamento/scongelamento. Gli embrioni vitali sono stati coltivati in vitro. Il tasso di sviluppo embrionale (morule-blastocisti/embrioni vitali) e il tasso di schiusa (embrioni schiusi/coltivati) sono stati determinati rispettivamente a 3,5 dpc e 5,5 dpc. Apici diversi indicano differenze significative (P < 0,05).
| Nº di embrioni | Tasso di recupero (recuperato dal dispositivo/embrioni crioconservati) | Tasso di sopravvivenza (embrioni vitali/recuperati dal dispositivo) | Tasso di gravidanza (femmine in gravidanza/trasferite) | Tasso di natalità nel totale delle femmine trasferite (cuccioli nati/embrioni trasferiti) | |
| Congelamento lento | 531 | 88,3 % (469/531)a | 85,1 % (399/469)a | - | - |
| Spatola MVD | 431 | 84,2 % (363/431)a | 94,7 % (344/363)b | 53,3 % (8/15)a | 17,8 % (47/264)a |
| Embrioni freschi | 446 | - | 97,7 % (436/446)b | 53,3 % (8/15)a | 20,6 % (53/257)a |
Tabella 2: Tassi di recupero e sopravvivenza di embrioni murini a 2 cellule sottoposti a vitrificazione o congelamento lento. Risultati riproduttivi di embrioni vitrificati/riscaldati rispetto a embrioni freschi.In vitro gli embrioni a 2 cellule prodotti sono stati crioconservati mediante Spatola MVD o SLF. Il recupero (recuperato dal dispositivo/embrioni crioconservati) e il tasso di sopravvivenza (embrioni vitali/recuperati dal dispositivo) sono stati determinati dopo il riscaldamento o lo scongelamento. Gli embrioni vitali, riscaldati e freschi sono stati trasferiti alle femmine riceventi (15 femmine per gruppo, ~17 embrioni per femmina). Sono stati determinati i tassi di gravidanza (femmine gravide/trasferite) e di nascita (cuccioli nati/embrioni trasferiti). Apici diversi indicano differenze significative (P < 0,05).
La spatola MVD è stata anche testata per la vitrificazione di embrioni preimpianto di pecore prodotte in vitro e confrontata con un dispositivo commerciale6. I risultati sono mostrati nella Tabella 3. La qualità degli embrioni è stata valutata in base alla morfologia seguendo i criteri raccomandati dall'International Embryo Technology Society (IETS)15 e gli embrioni eccellenti e buoni di grado 1 sono stati assegnati a ciascun gruppo sperimentale.
Né il tasso di sopravvivenza (~70% e ~16%, 3 ore o 24 ore dopo il riscaldamento, rispettivamente) né la schiusa dell'embrione all'ottavo giorno sono stati influenzati dal metodo di vitrificazione. La percentuale di blastocisti al giorno 8 era inferiore per entrambe le tecniche di vitrificazione rispetto al gruppo di controllo (embrioni freschi) (~ 8% vs 20,5%, rispettivamente; P < 0,05). Questi risultati suggeriscono che gli embrioni di pecora prodotti in vitro possono anche essere vitrificati utilizzando la spatola MVD. Inoltre, i risultati precedenti sono stati integrati dal trasferimento di embrioni di pecora sottoposti a congelamento lento, Spatola MVD o un dispositivo commerciale alle femmine riceventi16. I risultati sono mostrati nella Tabella 4. Tra i gruppi sperimentali sono stati valutati il tasso di sopravvivenza degli embrioni (embrioni vitali al 30° giorno/embrioni trasferiti), il tasso di gravidanza (pecore gravide/trasferite), la perdita fetale dalla gestazione alla nascita (agnelli nati alla nascita/embrioni vitali al 30° giorno) e il tasso di sopravvivenza degli agnelli (agnelli vivi 1 settimana dopo la nascita/agnelli nati).
I risultati hanno mostrato che il tasso di sopravvivenza embrionale dopo il trasferimento embrionale era simile per SLF (26,5%) e Spatola MVD (22,2%), ma era più alto per il gruppo di dispositivi commerciali (52,0%, P < 0,05). Gli esiti riproduttivi (durata della gestazione, perdita fetale, peso alla nascita e tassi di sopravvivenza dell'agnello) non sono stati influenzati in modo significativo dal metodo di crioconservazione. Nel complesso, la Spatola MVD è anche un metodo adatto per la vitrificazione di embrioni ovini preimpianto.
| N° di embrioni | Tasso di sopravvivenza % (embrioni vitali/crioconservati) | Tasso di sviluppo % (morule-blastocisti al giorno 6/embrioni scissi) | Tasso di schiusa % (blastocisti schiuse/embrioni scissi) | ||
| 3 h | 24 h | ||||
| Spatola MVD | 165 | 69,6 ± 2,4A | 14,6 ± 3,5A | 11.1 ± 2.1b | 6,4 ± 1,9b |
| Dispositivo commerciale | 165 | 71,3 ± 1,3A | 17,7 ± 4,5A | 12,7 ± 3,2b | 10,2 ± 2,9b |
| Gruppo di controllo (embrioni freschi) | 408 | - | - | 41,3 ± 3,7A | 20,5 ± 4,5A |
Tabella 3: Tassi di sopravvivenza e di sviluppo in vitro di embrioni ovini sottoposti a vitrificazione mediante spatola MVD o dispositivo commerciale.Gli embrioni in stadio di 2-8 cellule prodotti in vitro (giorno 2 dopo la fecondazione) sono stati vitrificati utilizzando la spatola MVD o un dispositivo commerciale e quindi riscaldati. Il tasso di sopravvivenza (vitale/crioconservato) è stato analizzato a 3 ore e 24 ore dopo il riscaldamento. I tassi di sviluppo e di schiusa sono stati definiti come il numero di morule e blastocisti ottenute il giorno 6 e il numero di embrioni schiusi, rispettivamente, rispetto al numero di embrioni tagliati (2-8 cellule). Apici diversi nella stessa colonna indicano differenze significative (P < 0,05). I dati vengono visualizzati come media ± SEM.
| Sopravvivenza embrionale (embrioni vitali al 30° giorno/embrioni trasferiti) | Tasso di gravidanza (pecore gravide/trasferite) | Perdita fetale (agnelli nati accessibili alla nascita/embrioni vitali il 30° giorno) | Durata della gestazione (d) | Peso alla nascita (g) | Tasso di sopravvivenza degli agnelli (agnelli vivi una settimana dopo la nascita/agnelli nati) | |
| Spatola MVD | 22,2 %A (28/126) | 32,9 %A (25/76) | 4,0 %A (1/25) | 150,7 ± 1,8A | 4102 ± 112.4a | 87,5 %A (21/24) |
| Dispositivo commerciale | 52,0 %b (91/175) | 66,0 % b (62/94) | 11,0 %A (8/73) | 150,4 ± 1,9A | 3980 ± 221,2A | 83,1 %A (54/65) |
| Congelamento lento | 26,5 %A (36/136) | 38,3 %A (28/73) | 6,7 %A (2/30) | 150,4 ± 2,1A | 4319 ± 107.3A | 89,3 %A (25/28) |
Tabella 4: Effetto del metodo di crioconservazione sulla sopravvivenza degli embrioni dopo il trasferimento, sul mantenimento della gravidanza e sulla produzione di agnelli. Le morule alle blastocisti espanse di embrioni prodotti in vivo o in vitro sono state sottoposte a vitrificazione/congelamento lento e riscaldamento/scongelamento e sono state trasferite a pecore sincronizzate Merino pluripare. Tra i gruppi sperimentali sono stati confrontati il tasso di sopravvivenza degli embrioni (embrioni vitali al 30° giorno/embrioni trasferiti), il tasso di gravidanza (pecore gravide/trasferite), la perdita fetale dalla gestazione alla nascita (agnelli nati alla nascita/embrioni vitali al 30° giorno), la lunghezza della gestazione (d), il peso alla nascita (g) e il tasso di sopravvivenza degli agnelli (agnelli vivi una settimana dopo la nascita/agnelli nati).
Inoltre, le linee di topi geneticamente modificati non più in uso nella nostra struttura sono state sottoposte a backup come embrioni a due cellule utilizzando il metodo Spatola MVD. Per ogni linea di topi sono stati vitrificati almeno 300 embrioni bicellulari, prodotti principalmente mediante fecondazione in vitro (o accoppiamento naturale). Il controllo di qualità del processo è stato eseguito riscaldando due o tre spatole di ciascuna linea e trasferendo gli embrioni a riceventi di sesso femminile pseudogravido. I risultati rappresentativi di diverse linee di topi geneticamente modificati sono riportati nella Tabella 5. In media, il tasso di guarigione è stato del 90,4% e il tasso di sopravvivenza è stato del 96,8%. Il tasso di gravidanza era dell'80% e il tasso di natalità era in media del 31,5%. Da notare che il tasso di natalità ha mostrato un'ampia gamma di risultati, dal 12% al 45%, il che potrebbe essere dovuto alle diverse modifiche genetiche che possono influenzare la sensibilità degli embrioni e i risultati del trasferimento degli embrioni. In generale, questi risultati sono stati coerenti con quelli precedentemente ottenuti nello stabilimento.
| Linea del mouse | N. di embrioni vitrificati/riscaldati | Tasso di recupero (recuperato dal dispositivo/embrioni crioconservati) | Tasso di sopravvivenza (embrioni vitali/recuperati dal dispositivo) | Tasso di gravidanza (femmine in gravidanza/trasferite) | Tasso di natalità (cuccioli nati/embrioni trasferiti) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| Nella media | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
Tabella 5: Risultati rappresentativi del processo di vitrificazione del controllo di qualità eseguito in embrioni a 2 cellule di diverse linee di topi geneticamente modificati. Le linee di topi GM sono state sottoposte a backup come embrioni a due cellule (minimo 300 embrioni) utilizzando il metodo Spatola MVD. Il controllo di qualità del processo è stato eseguito riscaldando due o tre spatole di ciascuna linea e trasferendo gli embrioni a riceventi di sesso femminile pseudogravido. Il recupero (recuperato dal dispositivo/embrioni crioconservati) e il tasso di sopravvivenza (embrioni vitali/recuperati dal dispositivo) sono stati determinati dopo il riscaldamento. Gli embrioni vitali riscaldati sono stati trasferiti in fase di 2 cellule alle femmine riceventi (da 1 a 3 femmine per linea, ~ 18 embrioni per femmina). Sono stati determinati i tassi di gravidanza (femmine gravide/trasferite) e di nascita (cuccioli nati/embrioni trasferiti).
Infine, abbiamo recentemente condotto un lavoro comparativo in cui zigoti di topo freschi e vitrificati riscaldati sono stati microiniettati con reagenti CRISPR e poi coltivati in vitro o trasferiti a femmine pseudogravide17. L'obiettivo era valutare se gli zigoti vitrificati -utilizzando Spatola MVD- potessero essere una fonte adatta di embrioni per microiniezione negli zigoti B6D2F1/J e C57BL/6J. I tassi di recupero e sopravvivenza sono stati simili ai risultati ottenuti in precedenza per embrioni in stadio di 2-8 cellule (Tabella 6). Nel complesso, gli zigoti vitrificati-riscaldati sono sopravvissuti alla microiniezione, si sono sviluppati in blastocisti schiuse o hanno prodotto cuccioli vivi e hanno dimostrato mutazioni indotte dal sistema CRISPR/Cas9. Tuttavia, il tasso di mutazione era significativamente più basso negli zigoti vitrificati rispetto a quelli freschi. La criobanca dello zigote sembra essere una fonte alternativa di embrioni per eseguire sessioni di microiniezione su richiesta, evitando l'allevamento e il mantenimento degli animali durante tutto l'anno e migliorando l'implementazione delle 3R nella tecnologia CRISPR.
| Ceppo zigote | Nº di zigoti crioconservati | Tasso di recupero (recuperato dal dispositivo/embrioni crioconservati) | Tasso di sopravvivenza (embrioni vitali/recuperati dal dispositivo) |
| B6D2F1/J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL/6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
Tabella 6: Tassi di recupero e sopravvivenza degli zigoti B6D2F1/J e C57BL/6J vitrificati-riscaldati. Gli zigoti prodotti in vivo sono stati raccolti da femmine donatrici di B6D2F1/J e C57BL/6J, vitrificati con Spatola MVD e riscaldati. I tassi di recupero (recuperati dal dispositivo/embrioni crioconservati) e di sopravvivenza (embrioni vitali/recuperati dal dispositivo) sono stati determinati dopo il riscaldamento.
Discussione
La spatola MVD è un dispositivo di vetrificazione facile da montare, a basso costo e a volume minimo, con un'elevata capacità di ritenzione dell'embrione e un'occupazione ottimale del dewar con azoto liquido. Questo metodo ha dimostrato di essere semplice, veloce e robusto. In media, abbiamo ottenuto non solo alti tassi di recupero e sopravvivenza degli embrioni vitrificati (~90%), ma anche buoni risultati riproduttivi quando si esegue il trasferimento di embrioni nei topi (~80% di tasso di gravidanza e ~30% di tasso di nascita), che sono paragonabili ad altri metodi di vitrificazione del volume minimo 18,19,20.
Le fasi critiche del metodo di vetrificazione MVD a spatola includono: (i) Preparazione della spatola. Questa tecnica richiede una notevole esperienza. La piattaforma prodotta nella punta del caricatore di gel mediante riscaldamento con una pinza deve essere di ~ 1 mm2 e deve essere chiusa all'estremità. Se la punta rimane aperta, possono formarsi delle bolle quando si immerge la spatola nella goccia di saccarosio durante il processo di riscaldamento a causa delle differenze di temperatura. Le bolle interferiscono con la ricerca e il recupero degli embrioni. (ii) Incubazione embrionale in soluzioni di vitrificazione. A causa dell'alta densità, gli embrioni rimangono a diverse altezze nelle gocce. È necessaria una rapida aspirazione di tutti gli embrioni. La tossicità è prevista se gli embrioni rimangono in queste soluzioni per periodi più lunghi a temperatura ambiente. (iii) Gocce di vetrificazione a spatola. Il volume della goccia di vitrificazione -contenente gli embrioni- nella piattaforma dovrebbe essere ~0,5-1,0 μL; Volumi maggiori di crioprotettore influiscono sulla vitalità dell'embrione. Si consiglia di utilizzare capillari tirati con un diametro interno un po' più largo delle dimensioni di un embrione, che porterebbero il volume necessario. Inoltre, gocce più grandi nella piattaforma possono aumentare la possibilità di rimanere incastrati nella cannuccia da 0,5 ml all'interno del muro quando si chiude il sistema. (iv) Sigillatura a spatola. Prestare particolare attenzione quando si chiude la spatola con la cannuccia da 0,5 mL; Entrambi gli elementi devono essere allineati. Le gocce di embrione nella spatola non devono essere disturbate. (v) Durante il riscaldamento, seguire l'ordine di rimozione dell'identificatore dell'asta e della cannuccia da 0,5 ml. In caso contrario, l'identificatore può essere espulso dalla differenza di temperatura.
Questa tecnica richiede la formazione dell'operatore in diverse fasi. La principale risoluzione dei problemi potrebbe essere il recupero degli embrioni dalla spatola. Se meno del 70-80% degli embrioni vitrificati viene recuperato quando si riscalda la spatola, ciò può essere dovuto a (i) un caricamento incompleto degli embrioni sulla piattaforma della spatola o (ii) gli embrioni vengono trattenuti nella parete interna della cannuccia da 0,5 ml quando il sistema è chiuso. Per superare il primo problema, il caricamento della goccia contenente gli embrioni deve essere effettuato allo stereomicroscopio utilizzando un tubo aspiratore e un capillare tirato caricato con il terreno crioprotettore contenente gli embrioni e 2-3 piccole bolle d'aria lungo il capillare, che consentono un corretto flusso del liquido. Per il secondo problema, se non sono visibili embrioni nella piattaforma durante il riscaldamento, tagliare il tappo di cotone per aprire la cannuccia da 0,5 ml e lavarla due volte con 500 μl di saccarosio 0,5 M in M2 (vedere sezione 2, passaggio 1), espellendo la soluzione in un piatto per il recupero degli embrioni.
I limiti del metodo sono principalmente legati alle fasi critiche già citate. Crediamo che il punto chiave sia la preparazione della spatola. Ci vuole allenamento per eseguire una buona spatola, ma una volta imparata, può essere padroneggiata. Poiché i terreni sono fatti in casa, questo metodo non può essere utilizzato nelle cliniche di riproduzione umana.
Il vantaggio principale della Spatola MVD è che si tratta di un dispositivo a basso costo rispetto a quelli commerciali9. Inoltre, consente di risparmiare spazio nel dewar con azoto liquido rispetto alla vetrificazione con criotubo8. Abbiamo testato la sua funzionalità su embrioni di topo e pecora in diverse fasi. È particolarmente semplice, veloce, economico ed efficace rispetto al metodo di congelamento lento.
Questo metodo può essere utilizzato per vitrificare embrioni di diverse specie di mammiferi non umani in un'ampia gamma di aree di ricerca.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Ringraziamo Alejo Menchaca per il suo contributo allo sviluppo della Spatola MVD. GS ha ricevuto finanziamenti dal Programma Post-Laurea in Biotecnologie - Facultad de Ciencias - Universidad de la República (https://webmasterbiotecnol.wixsite.com/biotec1) (Numero di sovvenzione: GS 2437 347). GS, MNM e MC hanno ricevuto finanziamenti da FOCEM - Fondo para la Convergencia Estructural del Mercosur (https://focem.mercosur.int/es/) (Numero di sovvenzione: COF 03/11). GS e MC sono membri del Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay. (https://www.anii.org.uy/). I finanziatori (Biotechnology Postgraduate Program - Facultad de Ciencias -Universidad de la República; FOCEM - Fondo para la Convergencia Estructural del Mercosur; Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay) non ha avuto alcun ruolo nella progettazione dello studio, nella raccolta e nell'analisi dei dati, nella decisione di pubblicare o nella preparazione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
Riferimenti
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon