Method Article
Разработка мышиной модели стеноза анастомотической артерии бедренной артерии
В этой статье
Резюме
Здесь мы представляем мышиную модель анастомоза бедренной артерии, предлагая исследователям ценную животную модель для изучения и моделирования стеноза сосудистого анастомоза. Это развитие имеет решающее значение для улучшения нашего понимания патофизиологии, лежащей в основе этого состояния, и способствует более точным и эффективным исследованиям сосудистых заболеваний.
Аннотация
В сосудистой хирургии сосудистый анастомоз является распространенным реконструктивным методом, используемым для восстановления кровотока. Тем не менее, рестеноз анастомоза является частым послеоперационным осложнением, в первую очередь вызванным хирургическим вмешательством повреждением сосудов, гиперплазией интимы и воспалительными реакциями. Модель анастомоза бедренной артерии мыши широко используется для исследования механизмов рестеноза анастомоза и восстановления сосудов. Анастомоз бедренной артерии с микроскопическим контролем «конец в конец» позволяет точно моделировать сосудистые повреждения и процессы восстановления после операции, обеспечивая надежный экспериментальный инструмент для изучения патологических механизмов, связанных с рестенозом. Данное исследование направлено на совершенствование хирургической техники анастомоза бедренной артерии у мышей. Благодаря усовершенствованию хирургических методов и оптимизации технических деталей мы добились заметного повышения коэффициента успешности и воспроизводимости модели. Конкретные улучшения включают в себя усовершенствованные методы обработки сосудов во время операции, выбор шовных материалов и оптимизацию методов наложения швов для минимизации утечки анастомоза и послеоперационной окклюзии. В исследовании также подчеркивается наблюдение за гиперплазией интимы, сосудистым ремоделированием в месте анастомоза и долгосрочной проходимостью сосудов. Благодаря этим исследованиям мы предоставляем краткое и эффективное оперативное руководство по проведению анастомоза бедренной артерии у мышей, предлагая надежную техническую поддержку для экспериментальных исследований в сосудистой хирургии. Эта работа закладывает прочную основу для последующих исследований связанных механизмов и оценки терапевтического вмешательства.
Введение
Сосудистый анастомоз является фундаментальным методом в процедурах реваскуляризации, играя ключевую роль в восстановлении кровотока и способствуя восстановлению тканей. Тем не менее, возникновение гиперплазии интимы (ИГ) в месте анастомоза часто приводит к рестенозу, что значительно ухудшает долгосрочную проходимость сосудов и негативно влияет на клинические исходы и прогноз пациента 1,2. ИГ тесно связана с интраоперационным повреждением сосудов, характеризующимся аномальной пролиферацией и миграцией гладкомышечных клеток (СМК) и чрезмерным отложением внеклеточного матрикса1. Эти сложные и взаимосвязанные патологические процессы подчеркивают критическую необходимость выяснения точных механизмов ИГ для информирования о профилактических и интервенционных стратегиях против рестеноза.
Благодаря своей воспроизводимости и точному контролю, мышиные модели анастомоза бедренной артерии получили широкое применение в исследованиях восстановления сосудов и связанных с ним патологических механизмов 3,4,5. Сквозной анастомоз у мышей позволяет точно моделировать послеоперационное повреждение анастомоза, обеспечивая динамическое наблюдение за ИГ и ремоделирование сосудов. Эти модели обеспечивают идеальную платформу для изучения взаимодействий между эндотелиальными клетками и SMC после операции и для оценки роли воспалительных реакций в развитии ИГ6. Сочетая гистологический анализ и обнаружение молекулярных биомаркеров, исследователи могут всесторонне определить ключевые факторы ИГ, предлагая критически важное представление о его основных механизмах и потенциальных терапевтических мишенях.
Развитие ИГ обусловлено множеством факторов, при этом гемодинамические изменения являются решающим фактором 1,7,8. В анастомотическом участке области с низким напряжением сдвига и аномальным индексом колебательного сдвига (OSI) являются основными стимулами для пролиферации и миграции SMC 1,7. Кроме того, несоответствие комплаенсу и турбулентный кровоток вокруг анастомоза усугубляют повреждение эндотелия, ускоряя прогрессирование ИГ8. Эти результаты подчеркивают необходимость оптимизации хирургических техник и выбора соответствующих материалов для смягчения патологических изменений в месте анастомоза.
В последние годы баллоны с лекарственным покрытием (DCB) продемонстрировали эффективность в снижении ИГ. Антипролиферативные средства, такие как паклитаксел, эффективно ингибируют пролиферацию и миграцию SMC, значительно снижая частоту рестеноза9. Тем не менее, проблемы сохраняются в системах с высоким потоком, таких как артериовенозные трансплантаты, где быстрые колебания напряжения сдвига и высокая скорость кровотока могут снизить эффективность DCBs1. Будущие исследования должны быть сосредоточены на улучшении применимости ДКБ в различных гемодинамических средах, а также на использовании достижений биоматериаловедения для разработки более персонализированных и эффективных решений для послеоперационного рестеноза. В дополнение к локализованным вмешательствам,на развитие ИГ существенно влияют такие системные факторы, как сахарный диабет, атеросклероз и эндотелиальная дисфункция. Таким образом, клинические стратегии должны отдавать приоритет комплексному лечению этих системных состояний для улучшения общего здоровья сосудов. В то же время, идентификация и мониторинг новых биомаркеров прогрессирования ИГ могут предоставить возможности для раннего вмешательства. Интеграция искусственного интеллекта в хирургическое планирование предлагает еще одно многообещающее направление, позволяющее вычислительно проектировать оптимизированные конфигурации анастомотиков, тем самым повышая показатели успеха операции и продлевая проходимость сосудов.
При изучении послеоперационной ИГ и связанных с ней патологических механизмов модель анастомоза бедренной артерии выделяется своей точностью и воспроизводимостью11. Эта модель, использующая микрохирургические методы для создания сквозного анастомоза бедренной артерии у мышей, точно имитирует локализованную хирургическую травму в месте анастомоза. Преимущества этой модели становятся особенно очевидными по сравнению с такими моделями, как травмы, вызванные проволокой, или другими альтернативами. Основным техническим преимуществом модели анастомоза бедренной артерии является ее способность индуцировать высоколокализованное и контролируемое повреждение сосудов12. Хирургическая травма позволяет целенаправленно воздействовать на область анастомоза, точно имитируя характер травмы, встречающийся в клинической сосудистой хирургии. Напротив, модели травм, индуцированных проволокой, хотя и более просты в технике, часто приводят к обширной эндотелиальной денудации, что затрудняет воспроизведение локализованной травмы, наблюдаемой в реальных операциях с использованием анастомоза. Кроме того, вариабельность глубины и степени повреждения, вызванного проводами, в разных исследованиях потенциально снижает воспроизводимость результатов. Обширный и диффузный характер повреждений в моделях повреждений проволокой делает их менее актуальными для исследования локализованной ИГ, которая специфически связана с анастомотическими областями.
В этом исследовании, используя мышиную модель анастомоза бедренной артерии, мы систематически совершенствовали хирургические методы для повышения показателей успешности модели и обеспечения долгосрочной проходимости анастомотического участка. Опираясь на эту устоявшуюся основу, наше исследование углубилось в молекулярные и клеточные механизмы, лежащие в основе ИГ, включая регуляторные пути, которые регулируют миграцию и пролиферацию СМК, а также роль медиаторов воспаления в прогрессировании ИГ. С помощью этого исследования мы стремимся внести новый теоретический вклад в механизмы постанастомотического рестеноза и создать экспериментальную основу для разработки терапевтических стратегий, специально нацеленных на ИГ.
протокол
Это исследование было одобрено, и с животными обращались в соответствии с Руководством по обращению с лабораторными животными и их использованию в Китае. Исследование строго соответствовало этическим требованиям экспериментов на животных и было одобрено Комитетом по этике животных (номер одобрения: SWMU20221109-019). Здесь для настоящего исследования были использованы 8-недельные здоровые мыши C57BL/6 любого пола весом от 20 до 22 г. Животные были размещены в Центре лабораторных животных Юго-Западного медицинского университета (SWMU).
1. Предоперационные процедуры
- Обезболивайте мышей ингаляцией 3% изофлурана в соответствии с утвержденными в учреждении протоколами. После начала анестезии убедитесь в полной потере рефлексов, такой как отсутствие реакции на защемление пальца ноги, чтобы обеспечить глубокую анестезию, прежде чем приступать к операции. После индуцирования анестезии уменьшите концентрацию изофлурана до 1%-1,5% для поддержания обезболивающего состояния, гарантируя, что животные остаются в глубокой анестезии на протяжении всей хирургической процедуры.
- Расположите мышь лежа на спине на хирургической платформе, вытягивая задние конечности без чрезмерного растяжения.
- Нанесите крем для депиляции на область бедер примерно на 1 минуту, чтобы удалить волосы, затем тщательно очистите область, чтобы удалить остатки крема и выбившиеся волоски.
- Продезинфицируйте место операции раствором йода 3 раза, чтобы подготовиться к последующим хирургическим этапам.
2. Сосудистый анастомоз бедренной артерии
- Под стереомикроскопом с помощью микроскальпеля сделайте разрез длиной примерно 1,5 см по оси бедренной кости в области средней части бедра. После разреза кожи выполните тупое рассечение для отделения подкожной клетчатки до тех пор, пока бедренная артерия и бедренная вена не обнажаются. Бедренная артерия расположена латерально к бедренной вене, а нерв расположен выше и латерально от артерии.
- Тщательно рассеките ткань, чтобы полностью обнажить участок бедренной артерии длиной 1 см. С помощью гемостатических щипцов аккуратно разделите мышцы и глубокие фасции, чтобы обнажить нервы, артерию и вену. Во время этого процесса нерв располагается на самом внешнем слое, артерия – посередине, а вена – на внутреннем.
- Аккуратно отделите бедренную артерию и бедренную вену с помощью тупого рассечения. Будьте осторожны при использовании тонких щипцов для отделения соединительной ткани, чтобы полностью обнажить бедренную артерию. Поместите стерильную подушечку под бедренную артерию, чтобы предотвратить случайное повреждение иглой во время процедуры. Впоследствии аккуратно зажмите бедренную артерию щипцами, чтобы вызвать гематому.
- . С помощью небольших кровоостанавливающих щипцов зажмите проксимальный и дистальный концы бедренной артерии. С помощью тонких ножниц аккуратно и симметрично пересеките бедренную артерию.
- Наберите 1% гепаринизированный физиологический раствор (1% гепарин в обычном физрастворе) в шприц объемом 1 мл для инъекции в анастомоз бедренной артерии. Добавляйте физиологический раствор по 3-4 капли за один раз, сделав несколько повторных полосканий, чтобы удалить сгустки крови из артерии.
- Чтобы обеспечить поддержку сосуда во время последующего наложения швов и смоделировать потенциальное повреждение, вызванное вмешательством с помощью проводника, в бедренную артерию вставить хирургический шов длиной 1 см 6-0. Обеспечьте правильное выравнивание и гладкость бедренной артерии, чтобы облегчить процесс наложения швов.
- Используйте хирургический шов 12-0 для анастомоза и отрегулируйте угол наклона иглы под микроскопом так, чтобы игла выходила с внутренней стороны на внешнюю сторону сосуда.
- Создайте восемь мест прокола, четыре на проксимальном и четыре на дистальных концах бедренной артерии.
- Убедитесь, что места пункции расположены в передней, задней, левой и правой точках сосуда, с соответствующими участками на дистальном и проксимальном концах. При выборе этих точек убедитесь, что сосуд доступен, избегайте критических анатомических структур и поддерживайте хороший кровоток во время анастомоза.
- Диаметр прокола должен быть достаточно маленьким, чтобы свести к минимуму повреждение сосуда, но достаточно большим для проведения необходимых процедур. Для пункции обычно используется игла для наложения швов 12-0.
- Вырежьте четыре отрезка шва 12-0, каждый длиной 3-4 см, и проденьте каждый через соответствующее отверстие для прокола. Начните с завязывания свободного узла, чтобы избежать запутывания швов.
- Снимите шов 6-0, используемый для поддержки судна, и надежно завяжите узлы. Освободите гемостатические щипцы после завершения анастомоза.
- Аккуратно соскребите бедренную артерию изогнутыми щипцами от проксимального к дистальному концу, чтобы проверить проходимость, убедившись, что кровь свободно течет по сосуду. Кроме того, внимательно осмотрите место анастомоза на наличие любых признаков явной утечки.
3. Послеоперационный шов
- Сшивайте кожу нижней конечности с помощью хирургического шва 6-0, используя прерывистый шов для обеспечения точного выравнивания и безопасного сближения ткани. После наложения швов на рану нанесите на зашитый участок настойку йода, чтобы обеззаразить рану и еще больше снизить риск инфицирования.
- Поддерживайте стерильные условия после операции. Не оставляйте животное без присмотра до тех пор, пока оно не придет в сознание, достаточное для поддержания лежачего положения на грудине. Не возвращайте животных, перенесших операцию, в компанию других животных до полного выздоровления.
4. Послеоперационное наблюдение и забор проб
- Регулярно осматривайте место операции на наличие признаков воспаления, чрезмерного отека или выделений. Задокументируйте состояние животного и при необходимости обеспечьте надлежащий уход.
- Через 4 недели после операции гуманно усыпьте мышей в соответствии с утвержденными этическими принципами. Для эвтаназии введите передозировку пентобарбитала натрия (150 мг/кг, внутрибрюшинное введение), обеспечивая безболезненную и гуманную конечную точку. Как только потеря сознания и прекращение рефлексов подтверждены, начните забор тканей.
Примечание: В предварительных исследованиях мы обнаружили, что сбор образцов в течение3-й недели или ранее не способствует формированию гиперплазии интимы. И наоборот, сбор образцов на5-й неделе приводил к чрезмерной гиперплазии интимы. Этот чрезмерный рост не только препятствовал наблюдению за последующими экспериментами, но и представлял потенциальную опасность для здоровья мышей. Так что здесь была выбрана4-я неделя. - Соберите образцы бедренной артерии с центром в месте анастомоза, простираясь примерно на 1 см в обоих направлениях от анастомоза. С помощью тонких ножниц иссеките бедренную артерию вместе со всей окружающей мышечной тканью.
- После иссечения образец промыть в PBS для удаления остатков крови, затем зафиксировать его в 10% нейтральном формалине на 1-2 дня для дальнейшей консервации и анализа.
ПРИМЕЧАНИЕ: 10% нейтральный формалин является классическим выбором для фиксации тканей, эффективно сшивая белки и сохраняя целостность структуры ткани, что делает его особенно подходящим для длительного хранения тканей. Напротив, 4% параформальдегид (PFA) является более мягким фиксатором, который лучше подходит для более тонкого сохранения внутриклеточных структур (таких как нуклеиновые кислоты и белки) и обычно используется для иммуногистохимии или иммунофлуоресцентного анализа. Основной целью данного исследования является наблюдение за гистологическими изменениями в кровеносных сосудах (такими как гиперплазия интимы и ремоделирование сосудов), а не за точной локализацией внутриклеточных молекул или белков. Таким образом, фиксирующий эффект формалина достаточен для удовлетворения экспериментальных потребностей. Если исследование требует более высокой молекулярной точности (например, сохранения РНК или белков), PFA может быть лучшим выбором.
5. Обезвоживание и зарастание бедренной артерии
- После фиксации поместите образцы в закладные коробки. Промойте образцы бедренной артерии проточной водой в течение 6-8 часов перед обработкой на предмет обезвоживания тканей с помощью автоматизированного тканевого процессора.
- Залить расплавленный парафин в формы для закладки, осторожно подхватить бедренную артерию с помощью нагретых щипцов и вертикально вставить ее в форму, содержащую расплавленный парафин. Отделите крышку и дно закладочной коробки, расположив дно поверх закладной формы. Добавьте небольшое количество растопленного парафина, чтобы зафиксировать его на месте, послужив основой для парафинового блока. Пузырьков воздуха следует тщательно избегать.
- Когда восковой блок остынет до такой степени, что на поверхности образуется прозрачная восковая пленка, поместите его на стол для замораживания для быстрого охлаждения.
- Извлеките встроенный восковой блок из закладной формы и аккуратно обрежьте излишки парафина, окружающие тканевый блок, с помощью острого лезвия.
6. Подготовка парафиновых срезов бедренной артерии
- Установите лезвие на микротом, убедившись, что нож острый для резки.
- Закрепите парафиновый блок на держателе и отрегулируйте блок относительно лезвия в соответствующее положение для секционирования.
- Обрежьте блок, чтобы убедиться, что внедренная ткань может быть полностью разрезана. Установите толщину начальных сечений равной 15-20 мкм.
- Отрегулируйте толщину секции примерно до 4 мкм и приступайте к секционной обработке.
- Аккуратно поднимите пряди с помощью щетки и перенесите их специальным тонким пинцетом в слайд-бокс, наполненный теплой водой (примерно 45 °C) для облегчения плавания.
- Перенесите срезы разворота на предметные стекла микроскопа. Расположите направляющие под углом 45°, чтобы слить лишнюю воду. После этого поместите слайды в духовку для сушки, обычно при 37 °C в течение 2 часов, а затем выпекайте при 60 °C в течение 1 часа.
7. Окрашивание гематоксилин-эозином
- Гидратируйте срезы, используя ряд дифференцированных концентраций этанола, включая абсолютный этанол, 95%, 80% и 70% этанола, при этом каждый этап занимает примерно 5 минут. Затем промойте секции дистиллированной водой, чтобы удалить остатки этанола.
- Окрашивайте срезы гематоксилином примерно на 8-10 минут и тщательно промойте 3 раза проточной водой, чтобы удалить излишки пятна.
- Для дифференциации окрашенных участков применяют 1% раствор соляной кислоты на короткий период 5-7 с.
- Чтобы усилить синий цвет, обработайте срезы раствором нашатырного спирта 1:400 в течение 1 минуты.
- После замачивания в 75% этаноле окрашивать срезы эозином в течение 36 с. После окрашивания последовательно обезвоживайте срезы с возрастающим рядом концентраций этанола (80%, 90%, 95% и 100%), причем каждый этап длится 3-5 с.
- Наконец, запекайте срезы при температуре 37 °C в духовке в течение 10 минут, нанесите пару капель герметика на предметное стекло, накройте образец покровным стеклом, чтобы зафиксировать их на месте, и дайте ему высохнуть на воздухе естественным образом.
Результаты
При хирургии сосудистого анастомоза механическое повреждение стенки сосуда может активировать клетки интимы и спровоцировать пролиферацию. Изменения скорости и направления кровотока после анастомоза также могут стимулировать пролиферацию клеток интимы. Процесс ремоделирования сосудов и долговременная нестабильность кровотока также могут постоянно стимулировать клетки интимы, что в конечном итоге приводит к утолщению.
Для подтверждения успешности модели анастомоза бедренной артерии было выполнено окрашивание гематоксилином и эозином собранных участков бедренной артерии. Наблюдалось наличие значительной гиперплазии интимы, свидетельствующей об успешном ремоделировании сосудов и подтверждающей успешность процедуры анастомоза (рисунок 1А).
Для оценки гиперплазии интимы были отмеченыи идентифицированы границы ключевых сосудистых структур, включая просвет, внутреннюю эластическую пластинку (ИЭЛ) и наружную эластическую пластинку (ЭЭЛ). На основе этих границ были проведены измерения площади с помощью программного обеспечения для анализа изображений. Интимная зона рассчитывалась путем измерения общей площади, заключенной в IEL, и вычитания площади просвета для получения фактической площади интимной зоны. Медиальная область определялась путем измерения общей площади, охватываемой EEL, и вычитания площади IEL, что дало фактическую площадь медиальной области. Для оценки степени гиперплазии интимы было рассчитано отношение интимальной зоны к медиальной области (соотношение интимальной/медиальной зоны), что дало четкое и количественное представление степени утолщения интимы (рис. 1В).
Специфическое определение эндотелиального маркера сосудов CD31 и маркера гладкой мускулатуры α-СМА проводили методом иммуногистохимического окрашивания как в нормальной, так и в экспериментальной группе после операции по удалению анастомоза бедренной артерии (рис. 2).
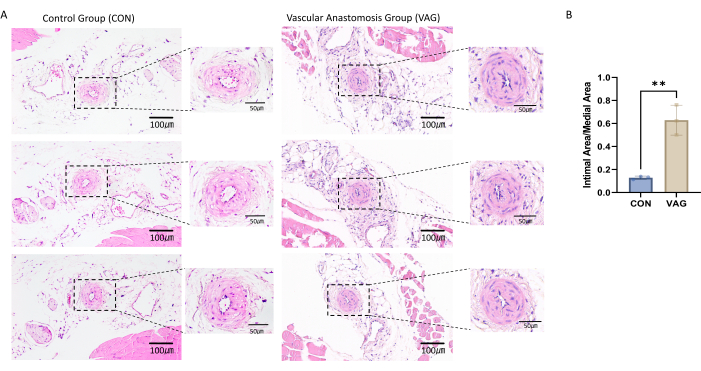
Рисунок 1: Окрашивание анастомотической ткани бедренной артерии гематоксилином и эозином. (A) После 4 недель операции образцы бедренной артерии были взяты из левой задней конечности мыши. Артериальную ткань погружали в парафин и разрезали до толщины 4 мкм. На срезах проводили окрашивание гематоксилином и эозином, выявив значительную гиперплазию интимы в бедренной артерии. (Б) Статистическая гистограмма показала, что отношение неоинтимы к медиа в сосудах анастомоза значительно увеличилось. Данные представлены в виде среднего ± стандартной погрешности среднего (SEM). Статистическую значимость оценивали с помощью независимого t-критерия. Ось y представляет собой отношение интимной области к медиальной области, выраженное в процентах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Иммуногистохимический анализ маркеров эндотелия сосудов и гладкой мускулатуры после операции по удалению анастомоза бедренной артерии. Иммуногистохимический анализ выявил изменения в морфологии и распределении CD31-меченых сосудистых эндотелиальных клеток, а также послеоперационную пролиферацию гладкомышечных клеток, меченных α-СМА, как в нормальной, так и в хирургической группах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Сосудистый анастомоз является важнейшим методом в сосудистой реконструктивной хирургии, а его животная модель играет ключевую роль в изучении механизмов послеоперационного рестеноза. Эта модель предлагает контролируемый подход к исследованию сосудистых патологических изменений, в частности, к пониманию происхождения чрезмерно пролиферирующих клеток в неоинтиме во время рестеноза. Источник пролиферирующих гладкомышечных клеток (СМК) становится решающей проблемой, когда после сосудистых анастомозов происходит серьезное повреждение артерий, что приводит к апоптозу СМК в среде. СМК, полученные из среды кровеносных сосудов, не являются единственными, участвующими в процессе; Стволовые клетки в адвентиции также могут дифференцироваться в новые SMC, потенциально способствуя неоинтимальной гиперплазии15. Были подняты вопросы о происхождении этих клеток, происходят ли они из существующих SMC или стволовых клеток, или же другие адвентициальные клетки, такие как стволовые клетки, играют роль в пролиферации, миграции и дифференцировке. Экспериментальная модель артериального анастомоза является ценным инструментом для изучения миграции адвентициальных клеток в неоинтиму и их трансформации в SMC после повреждения артерий. При хирургическом разрушении сосудов эластичный слой также разрушается, что позволяет адвентициальным клеткам мигрировать к внутреннему слою. Эта модель дает важное представление о клеточных механизмах, участвующих в ответе на повреждение артерий. Каждый точный маневр во время процедуры сосудистого анастомоза критически влияет на целостность сосудов и общий успех хирургической модели. При разгибании задней конечности мыши избегайте чрезмерного выпрямления, так как чрезмерное напряжение может повредить эластичность артерии, усложнив последующее наложение швов и потенциально привести к микроразрывам в стенке сосуда, что может нарушить кровоток и вероятность успешного проведения анастомоза. Во время рассечения и изоляции важно тщательно различать артерию, вену и нерв, особенно избегая повреждения вены. Повреждение вен может вызвать чрезмерное кровотечение, обструкцию операционного поля и усложнить процедуру. После изоляции бедренной артерии зажмите проксимальный и дистальный концы тонкими кровоостанавливающими щипцами, стараясь не допустить растяжения сосуда. Эта мера предосторожности сводит к минимуму повреждение стенки сосуда и, после снятия зажимов, позволяет кровотоку постепенно возобновляться, снижая стресс эндотелиальных клеток и потенциальное повреждение.
Выбор подходящего шовного материала имеет решающее значение для сохранения целостности сосудов и обеспечения гладкого анастомоза. Размер и тип шовной нити должны соответствовать конкретным требованиям обрабатываемого судна. Выбор подходящей длины шва 6-0 для поддержки артерии является критически важным шагом. Чрезмерная длина шва может натирать маленькие кровоостанавливающие зажимы и привести к повреждению эндотелия. Кроме того, во время наложения сосудистых швов убедитесь, что игла проходит от внутренней к внешней стенке сосуда одним движением, чтобы свести к минимуму травму эндотелия. Этот шаг имеет решающее значение, так как повреждение эндотелия увеличивает риск послеоперационного тромбоза и влияет на последующую функциональную оценку сосуда16. Каждая точка прокола должна быть точно выровнена, с симметричными отверстиями как на проксимальном, так и на дистальном концах. Отрегулируйте количество стежков в соответствии с диаметром сосуда; Например, для сосудов меньшего размера может потребоваться меньшее количество швов (например, три вместо четырех), чтобы уменьшить плотность швов, предотвратить обструкцию кровотока и обеспечить модельную проходимость для дальнейших анализов. Выбор шовного материала 12-0 имеет важное значение для уменьшения травматизации стенки сосуда, так как его тонкий профиль сводит к минимуму физическое воздействие на сосудистую структуру и сохраняет целостность эндотелиальных клеток, что имеет решающее значение для послеоперационного заживления и проходимости кровотока. Использование более тонкого шва помогает сохранить структурную целостность в модельном сосуде, что поддерживает устойчивый кровоток и обеспечивает надежную основу для последующего анализа. На протяжении всего процесса наложения швов поддерживайте постоянное натяжение шва, чтобы избежать ослабления или чрезмерной затяжки, которые могут ограничить местный кровоток.
После удаления кровоостанавливающих щипцов может произойти незначительное подтекание крови, что ожидаемо; Тем не менее, поддержание непрерывного кровотока имеет решающее значение для долгосрочной стабильности модели. Послеоперационное наблюдение имеет важное значение для обеспечения успеха модели. В течение 4 недель после операции следует внимательно следить за общим состоянием здоровья мыши, включая проверку на наличие кровотечения, инфекции или тромбоза в месте операции, чтобы обеспечить выживание и отсутствие серьезных осложнений. Последовательное наблюдение за кровотоком в области операции не только верифицирует проходимость анастомоза, но и обеспечивает качественную поддержку для дальнейшего анализа, создавая прочную основу для применения модели в долгосрочных исследованиях.
В этом исследовании мы стремимся оценить анастомотический стеноз, вызванный повреждением сосудов и гиперплазией интимы после реваскуляризации. В то время как мышиная модель дает ценную информацию о первоначальной биологической реакции на повреждение сосудов, существуют неотъемлемые ограничения ее применимости в имитации сосудистых состояний человека. Во-первых, прогрессирование гиперплазии интимы у мышей, обычно наблюдаемое в течение нескольких недель, может не полностью воспроизводить хроническое развитие, наблюдаемое у людей в течение месяцев или лет, что ограничивает оценкудолгосрочных сосудистых изменений. Кроме того, физиологические различия между сосудистой системой мыши и человека, включая различия в размере сосудов, скорости заживления и клеточных реакциях, создают проблемы для прямого трансляционного применения полученных результатов. Точный контроль тяжести травмы бедренной артерии мыши также является сложной задачей, поскольку незначительные отклонения в хирургической технике могут значительно повлиять на реакцию сосуда, внося вариабельность в исходы. Наконец, микрохирургические требования к работе с мелкими сосудами увеличивают техническую сложность и риск непоследовательных травм, что может повлиять на воспроизводимость результатов. Эти факторы в совокупности подчеркивают необходимость тщательной интерпретации результатов данной модели при рассмотрении их значимости для сосудистой патофизиологии человека.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Мы хотели бы выразить нашу искреннюю благодарность профессору Цинбо Сюй и Янхуа Ху из Чжэцзянского университета за их ценную техническую помощь. Эта работа была поддержана Национальными фондами естественных наук Китая (номера грантов 82070502 и 32171099), Сычуаньской научно-технической программой (номера грантов 2025HJRC0035, 2024NSFSC0709) и Совместным проектом Лучжоу-Юго-Западного медицинского университета (2024LZXNYDJ021, 2024LZXNYDJ014)
Материалы
| Name | Company | Catalog Number | Comments |
| 6-0 Nylon Suture with Needle | Ningbo Chenghe | 240102 | |
| 12-0 Nylon Suture with Needle | Ningbo Lingqiao | 22064 | |
| Electro-heating standing-temperature incubator | Shanghai Boxun | HPX-9272MBE | |
| Eosin Staining Solution | Servicebio | G1005-2 | |
| Formaldehyde Solution | KESHI | 50-00-0 | |
| Hematoxylin Staining Solution | Servicebio | G1005-1 | |
| Heparin Sodium | Solarbio | H8060 | |
| MAGSCANNER KF-PRO-002 | KFBIO | KFPBL00200107003 | |
| Mounting medium | Wuxi Jiangyuan | 220810 | |
| OLYMPUS SZ2-ILST | OLYMPUS CORPORATION | SN 9B40828 | |
| Paraffin embedding machine | YAGUANG | YB-7LF | |
| Phosphate-Buffered Saline | Solarbio | P1010 |
Ссылки
- Haruguchi, H., Teraoka, S. Intimal hyperplasia and hemodynamic factors in arterial bypass and arteriovenous grafts: A review. J Artificial Organs. 6 (4), 227-235 (2003).
- Huang, C., et al. Outcome and risk factors of restenosis post percutaneous transluminal angioplasty at juxta-anastomotic of wrist autogenous radial-cephalic arteriovenous fistulas: A retrospective cohort study. Ann Vas Surg. 93, 234-242 (2023).
- Pruthi, N., Tyagi, G., Gohil, D. End-to-side microvascular anastomosis on rat femoral vessels using only 2-throw knot interrupted sutures - evaluation of feasibility and patency rates on rat femoral vessels model. World Neurosurg. 148, e145-e150 (2021).
- Yücel, H. C., et al. Effectiveness of 1α-25-dihydroxyvitamin d3 active substance on anastomosis safety in the rat femoral artery end-to-end anastomosis experimental model: Macroscopic and histological analyses. J Plastic Reconstruct Aesthetic Surg. 97, 310-319 (2024).
- Godden, D. R. P., Little, R., Weston, A., Greenstein, A., Woodwards, R. T. M. Catecholamine sensitivity in the rat femoral artery after microvascular anastomosis. Microsurgery. 20 (5), 217-220 (2000).
- Lu, Y., et al. Endothelial ripk1 protects artery bypass graft against arteriosclerosis by regulating smc growth. Sci Adv. 9 (35), e8939(2023).
- Ghista, D. N., Kabinejadian, F. Coronary artery bypass grafting hemodynamics and anastomosis design: A biomedical engineering review. Biomed Eng Online. 12 (1), 129(2013).
- Surovtsova, I. Effects of compliance mismatch on blood flow in an artery with endovascular prosthesis. J Biomech. 38 (10), 2078-2086 (2005).
- Matsuura, S., et al. Effect of drug-coated balloons in treatment of stenosis of the femoral artery and vein bypass graft not responding to plain old balloon angioplasty: A case report. Surg Case Rep. 5 (1), 204(2019).
- Funk, S. D., Yurdagul, A., Orr, A. W. Hyperglycemia and endothelial dysfunction in atherosclerosis: Lessons from type 1 diabetes. Int J Vas Medicine. 2012, 1-19 (2012).
- Akelina, Y. Ballestín Aeds. Microsurgery 101. , Springer Nature. Switzerland. (2024).
- Curaj, A., Zhoujun, W., Staudt, M., Liehn, E. A. Induction of accelerated atherosclerosis in mice: The "wire-injury" model. J Vis Exp. (162), e54571(2020).
- Oh, J. G., Ishikawa, K. Experimental models of cardiovascular diseases: Overview. Methods Mol Biol. 1816, 3-14 (2018).
- Lipke, E. A., West, J. L. Localized delivery of nitric oxide from hydrogels inhibits neointima formation in a rat carotid balloon injury model. Acta Biomater. 1 (6), 597-606 (2005).
- Dong, Z. F., et al. Role of smooth muscle progenitor cells in vascular mechanical injury and repair. Medicine Novel Technol Devices. 16, 100178(2022).
- Yau, J. W., Teoh, H., Verma, S. Endothelial cell control of thrombosis. BMC Cardiovasc Disord. 15, 130(2015).
- Jia, G., Aroor, A. R., Jia, C., Sowers, J. R. Endothelial cell senescence in aging-related vascular dysfunction. Biochim Biophys Acta. 1865 (7), 1802-1809 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены