Method Article
Desarrollo de un modelo murino para la estenosis anastomótica de la arteria femoral
En este artículo
Resumen
Aquí presentamos un modelo murino para la anastomosis de la arteria femoral, ofreciendo a los investigadores un valioso modelo animal para estudiar y simular la estenosis anastomótica vascular. Este desarrollo es crucial para avanzar en nuestra comprensión de la fisiopatología subyacente a esta afección y facilitar una investigación más precisa y eficaz de las enfermedades vasculares.
Resumen
En cirugía vascular, la anastomosis vascular es una técnica reconstructiva común que se utiliza para restaurar el flujo sanguíneo. Sin embargo, la reestenosis anastomótica es una complicación postoperatoria frecuente, causada principalmente por lesión vascular inducida por cirugía, hiperplasia íntima y respuestas inflamatorias. El modelo de anastomosis de la arteria femoral del ratón se utiliza ampliamente para investigar los mecanismos de la reestenosis anastomótica y la reparación vascular. La anastomosis de la arteria femoral de extremo a extremo guiada microscópicamente permite una simulación precisa de la lesión vascular y los procesos de reparación después de la cirugía, proporcionando una herramienta experimental confiable para estudiar los mecanismos patológicos relacionados con la reestenosis. Este estudio se centra en perfeccionar la técnica quirúrgica para la anastomosis de la arteria femoral en ratones. A través de refinamientos en las técnicas quirúrgicas y la optimización de los detalles técnicos, hemos logrado un marcado aumento en la tasa de éxito y reproducibilidad del modelo. Las mejoras específicas incluyen técnicas refinadas de manejo vascular durante la cirugía, la selección de materiales de sutura y la optimización de los métodos de sutura para minimizar la fuga anastomótica y la oclusión postoperatoria. El estudio también enfatiza la observación de hiperplasia intimal, remodelación vascular en el sitio anastomótico y permeabilidad vascular a largo plazo. A través de esta investigación, proporcionamos una guía operativa concisa y eficiente para realizar la anastomosis de la arteria femoral del ratón, ofreciendo un soporte técnico confiable para estudios experimentales en cirugía vascular. Este trabajo sienta una base sólida para investigaciones posteriores sobre los mecanismos relacionados y las evaluaciones de la intervención terapéutica.
Introducción
La anastomosis vascular es una técnica fundamental en los procedimientos de revascularización, ya que desempeña un papel fundamental en la restauración del flujo sanguíneo y promueve la reparación de los tejidos. Sin embargo, la aparición de hiperplasia de íntima (IH) en el sitio anastomótico a menudo conduce a la reestenosis, lo que compromete significativamente la permeabilidad vascular a largo plazo e impacta negativamente en los resultados clínicos y en el pronóstico del paciente 1,2. La HI está estrechamente asociada con la lesión vascular intraoperatoria, caracterizada por una proliferación y migración anormales de células musculares lisas (CME) y un depósito excesivo de matriz extracelular1. Estos procesos patológicos complejos e interrelacionados subrayan la necesidad crítica de dilucidar los mecanismos precisos de la IH para informar las estrategias preventivas e intervencionistas contra la reestenosis.
Debido a su reproducibilidad y control preciso, los modelos murinos de anastomosis de la arteria femoral han sido ampliamente adoptados en la investigación sobre la reparación vascular y los mecanismos patológicos asociados 3,4,5. La anastomosis de extremo a extremo en ratones permite una simulación precisa de la lesión anastomótica posquirúrgica, lo que permite la observación dinámica de la IH y la remodelación vascular. Estos modelos proporcionan una plataforma ideal para estudiar las interacciones entre las células endoteliales y las SMC después de la cirugía y para evaluar el papel de las respuestas inflamatorias en el desarrollo de IH6. Al combinar el análisis histológico y la detección de biomarcadores moleculares, los investigadores pueden identificar de manera integral los impulsores clave de la IH, ofreciendo información crítica sobre sus mecanismos subyacentes y posibles objetivos terapéuticos.
El desarrollo de la HI está impulsado por múltiples factores, siendo los cambios hemodinámicos un contribuyente crítico 1,7,8. En el sitio anastomótico, las regiones de bajo esfuerzo cortante y el índice de corte oscilatorio anormal (OSI) son estímulos primarios para la proliferación y migración de SMCs 1,7. Además, los desajustes de cumplimiento y el flujo sanguíneo turbulento alrededor de la anastomosis exacerban la lesión endotelial, acelerando la progresión de la HI8. Estos hallazgos subrayan la necesidad de optimizar las técnicas quirúrgicas y seleccionar los materiales adecuados para mitigar los cambios patológicos en el sitio anastomótico.
En los últimos años, los balones recubiertos de fármaco (DCB) han demostrado su eficacia en la reducción del IH. Los agentes antiproliferativos, como el paclitaxel, inhiben eficazmente la proliferación y migración de las CME, reduciendo significativamente la incidencia de reestenosis9. Sin embargo, persisten desafíos en sistemas de alto flujo como los injertos arteriovenosos, donde las fluctuaciones rápidas en el esfuerzo cortante y las altas tasas de flujo sanguíneo pueden disminuir la eficacia de los DCB1. Los estudios futuros deben centrarse en mejorar la aplicabilidad de los DCB en diversos entornos hemodinámicos, al tiempo que se aprovechan los avances en la ciencia de los biomateriales para desarrollar soluciones más personalizadas y eficaces para la reestenosis posquirúrgica. Además de las intervenciones localizadas, factores sistémicos como la diabetes, la aterosclerosis y la disfunción endotelial influyen significativamente en el desarrollo de HI10. Por lo tanto, las estrategias clínicas deben priorizar el manejo integral de estas afecciones sistémicas para mejorar la salud vascular general. Al mismo tiempo, la identificación y el seguimiento de nuevos biomarcadores para la progresión del HI podrían proporcionar oportunidades para la intervención temprana. La integración de la inteligencia artificial en la planificación quirúrgica ofrece otra vía prometedora, ya que permite el diseño computacional de configuraciones anastomóticas optimizadas, mejorando así las tasas de éxito quirúrgico y prolongando la permeabilidad vascular.
En el estudio de la HI postquirúrgica y los mecanismos patológicos asociados, el modelo de anastomosis de la arteria femoral se destaca por su precisión y reproducibilidad11. Este modelo, que emplea técnicas microquirúrgicas para crear una anastomosis de extremo a extremo de la arteria femoral en ratones, imita con precisión el trauma quirúrgico localizado en el sitio anastomótico. Las ventajas de este modelo se hacen particularmente evidentes cuando se comparan con modelos como la lesión inducida por cable u otras alternativas. Una ventaja técnica importante del modelo de anastomosis de la arteria femoral es su capacidad para inducir una lesión vascular altamente localizada y controlada12. El trauma quirúrgico permite un impacto focalizado en la región anastomótica, imitando de cerca los patrones de lesión encontrados en la cirugía vascular clínica. Por el contrario, los modelos de lesiones inducidas por alambre, aunque más simples en su técnica, a menudo resultan en una denudación endotelial extensa, lo que dificulta la replicación del trauma localizado observado en las cirugías anastomóticas de la vida real13. Además, la variabilidad en la profundidad y el alcance del daño inducido por alambre entre los diferentes ensayos potencialmente disminuye la reproducibilidad de los resultados. La naturaleza extensa y difusa del daño en los modelos de lesión por alambre hace que sea menos relevante para investigar el HI localizado que se asocia específicamente con regiones anastomóticas.
En este estudio, utilizando un modelo murino de anastomosis de la arteria femoral, refinamos sistemáticamente las técnicas quirúrgicas para mejorar las tasas de éxito del modelo y garantizar la permeabilidad a largo plazo del sitio anastomótico. Aprovechando esta base establecida, nuestro estudio profundizó en los mecanismos moleculares y celulares subyacentes a la IH, incluidas las vías reguladoras que rigen la migración y proliferación de las SMC, así como el papel de los mediadores inflamatorios en la progresión de la IH. A través de esta investigación, nuestro objetivo es aportar nuevos conocimientos teóricos sobre los mecanismos de la reestenosis postanastomótica y establecer una base experimental para el desarrollo de estrategias terapéuticas dirigidas específicamente a la IH.
Protocolo
Este estudio fue aprobado y los animales fueron manejados de acuerdo con las Directrices para el Manejo y Uso de Animales de Laboratorio en China. La investigación se adhirió estrictamente a los requisitos éticos de los experimentos con animales, con la aprobación del Comité de Ética Animal (Número de aprobación: SWMU20221109-019). Aquí, se utilizaron ratones C57BL/6 sanos de 8 semanas de edad de ambos sexos, con un peso de entre 20 y 22 g, para el presente estudio. Los animales fueron alojados en el Centro de Animales de Laboratorio de la Universidad Médica del Suroeste (SWMU).
1. Procedimientos preoperatorios
- Anestesiar ratones con inhalación de isoflurano al 3% de acuerdo con los protocolos aprobados institucionalmente. Después del inicio de la anestesia, verifique la pérdida completa de los reflejos, como la falta de respuesta al pinzamiento de los dedos de los pies, para asegurar una anestesia profunda antes de proceder con la cirugía. Después de inducir la anestesia, reduzca la concentración de isoflurano a 1%-1.5% para mantener el estado anestésico, asegurando que los animales permanezcan en anestesia profunda durante todo el procedimiento quirúrgico.
- Coloque al ratón en decúbito supino sobre una plataforma quirúrgica, extendiendo las extremidades traseras sin estirarse demasiado.
- Aplique una crema depilatoria en el área del muslo durante aproximadamente 1 minuto para eliminar el vello, luego limpie el área a fondo para eliminar cualquier crema residual y el vello suelto.
- Desinfecte el sitio quirúrgico con solución de yodo 3 veces para prepararse para los pasos quirúrgicos posteriores.
2. Anastomosis vascular de la arteria femoral
- Bajo un microscopio estereoscópico, haga una incisión de aproximadamente 1,5 cm de largo a lo largo del eje del fémur en la región media del muslo con un microbisturí. Después de incidir la piel, realice una disección roma para separar el tejido subcutáneo hasta que la arteria femoral y la vena femoral queden expuestas. La arteria femoral se encuentra lateralmente a la vena femoral, y el nervio se coloca superior y lateralmente a la arteria.
- Diseccionar cuidadosamente el tejido para exponer completamente una sección de 1 cm de la arteria femoral. Con pinzas hemostáticas, separe suavemente los músculos y la fascia profunda para exponer los nervios, la arteria y la vena. Durante este proceso, el nervio se encuentra en la capa más externa, la arteria está en el medio y la vena está en el interior.
- Separe suavemente la arteria femoral y la vena femoral mediante una disección roma. Tenga cuidado de usar pinzas finas para separar el tejido conectivo y exponer completamente la arteria femoral. Coloque una almohadilla estéril debajo de la arteria femoral para evitar lesiones accidentales con la aguja durante el procedimiento. Posteriormente, pinza suavemente la arteria femoral con fórceps para inducir un hematoma.
- . Con pequeñas pinzas hemostáticas, pinza los extremos proximal y distal de la arteria femoral. Use tijeras finas para seccionar la arteria femoral de manera ordenada y simétrica.
- Extraer solución salina heparinizada al 1% (heparina al 1% en solución salina normal) en una jeringa de 1 ml para inyectar en la anastomosis de la arteria femoral. Agregue solución salina en 3-4 gotas a la vez, con varios enjuagues repetidos para eliminar los coágulos de sangre de la arteria.
- Para proporcionar soporte al vaso durante la sutura posterior y simular el daño potencial causado por una intervención con guía, inserte una sutura quirúrgica 6-0 de 1 cm de largo en la arteria femoral. Asegurar la correcta alineación y suavidad de la arteria femoral para facilitar el proceso de sutura.
- Utilice una sutura quirúrgica 12-0 para la anastomosis y ajuste el ángulo de la aguja bajo el microscopio para asegurarse de que la aguja salga del lado interno hacia el lado externo del vaso.
- Cree ocho sitios de punción, cuatro en los extremos proximal y cuatro en los extremos distales de la arteria femoral.
- Asegúrese de que los sitios de punción estén ubicados en los puntos anterior, posterior, izquierdo y derecho del vaso, con los sitios correspondientes en los extremos distal y proximal. Al seleccionar estos puntos, asegúrese de que el vaso sea accesible, evite las estructuras anatómicas críticas y mantenga un buen flujo sanguíneo durante la anastomosis.
- Haga que el diámetro de la punción sea lo suficientemente pequeño para minimizar el daño al recipiente, pero lo suficientemente grande para los procedimientos necesarios. Por lo general, se usa una aguja de sutura 12-0 para la punción.
- Corte cuatro trozos de sutura 12-0, cada uno de 3-4 cm de largo, y pase cada uno a través del orificio de punción correspondiente. Comience haciendo un nudo suelto para evitar enredar las suturas.
- Retire la sutura 6-0 utilizada para el soporte del recipiente y ate los nudos de forma segura. Suelte las pinzas hemostáticas una vez completada la anastomosis.
- Raspe suavemente la arteria femoral con pinzas curvas desde el extremo proximal hasta el distal para verificar la permeabilidad, asegurándose de que la sangre fluya libremente a través del vaso. Además, inspeccione cuidadosamente el sitio de la anastomosis en busca de signos de fugas evidentes.
3. Sutura postoperatoria
- Suturar la piel de la extremidad inferior mediante una sutura quirúrgica 6-0, empleando una sutura interrumpida para garantizar una alineación precisa y una aproximación segura del tejido. Después de suturar la herida, aplique tintura de yodo en el área suturada para desinfectar la herida y reducir aún más el riesgo de infección.
- Mantener las condiciones estériles después de la cirugía. No deje al animal desatendido hasta que haya recuperado la conciencia suficiente para mantener la decúbito esternal. No devuelva los animales que han sido sometidos a cirugía a la compañía de otros animales hasta que estén completamente recuperados.
4. Observación postoperatoria y toma de muestras
- Inspeccione regularmente el sitio quirúrgico en busca de signos de inflamación, hinchazón excesiva o secreción. Documente la condición del animal y brinde los cuidados adecuados según sea necesario.
- A las 4 semanas después de la cirugía, eutanasia humanitaria a los ratones de acuerdo con las pautas éticas aprobadas. En el caso de la eutanasia, administrar una sobredosis de pentobarbital sódico (150 mg/kg, inyección intraperitoneal), asegurando un objetivo indoloro y humano. Una vez confirmada la inconsciencia y el cese de los reflejos, se inicia la recolección de tejidos.
NOTA: En los estudios preliminares, encontramos que la recolección de las muestras durante la3ª semana o antes no fue propicia para la formación de hiperplasia intimal. Por el contrario, la recolección de muestras en la5ª semana condujo a una hiperplasia íntima excesiva. Este crecimiento excesivo no solo impidió la observación de experimentos posteriores, sino que también planteó riesgos potenciales para la salud de los ratones. Así que la4ª semana fue seleccionada aquí. - Recoja muestras de la arteria femoral, centradas en el sitio de la anastomosis, que se extiendan aproximadamente 1 cm en ambas direcciones desde la anastomosis. Con unas tijeras finas, extirpe la arteria femoral junto con todo el tejido muscular circundante.
- Después de la escisión, enjuague la muestra en PBS para eliminar la sangre residual, luego fíjela en formalina neutra al 10% durante 1-2 días para su posterior conservación y análisis.
NOTA: Una formalina neutra al 10% es una opción clásica para la fijación de tejidos, ya que reticula eficazmente las proteínas y preserva la integridad de la estructura del tejido, lo que la hace particularmente adecuada para el almacenamiento a largo plazo de tejidos. Por el contrario, el paraformaldehído al 4% (PFA) es un fijador más suave que es más adecuado para la preservación más fina de las estructuras intracelulares (como ácidos nucleicos y proteínas) y se usa comúnmente para el análisis de inmunohistoquímica o inmunofluorescencia. El objetivo principal de este estudio es observar los cambios histológicos en los vasos sanguíneos (como la hiperplasia íntima y el remodelado vascular) más que la localización precisa de moléculas o proteínas intracelulares. Por lo tanto, el efecto de fijación de la formalina es suficiente para satisfacer las necesidades experimentales. Si la investigación requiere una mayor fidelidad molecular (como la preservación del ARN o las proteínas), el PFA puede ser una mejor opción.
5. Deshidratación e incrustación de la arteria femoral
- Después de la fijación, coloque las muestras en cajas de inclusión. Enjuague las muestras de arteria femoral con agua corriente durante 6-8 h antes de procesarlas para la deshidratación de tejidos utilizando un procesador de tejidos automatizado.
- Vierta la parafina derretida en moldes de inclusión, recoja cuidadosamente la arteria femoral con pinzas calientes e insértela verticalmente en el molde que contiene la parafina fundida. Separe la tapa y la parte inferior de la caja de incrustación, con la parte inferior colocada encima del molde de incrustación. Agregue una pequeña cantidad de parafina derretida para fijarla en su lugar, sirviendo como base para el bloque de parafina. Las burbujas de aire deben evitarse meticulosamente.
- Cuando el bloque de cera se haya enfriado hasta el punto en que se forme una película de cera transparente en la superficie, colóquelo en una mesa de congelación para que se enfríe rápidamente.
- Retire el bloque de cera incrustado del molde de inclusión y recorte el exceso de parafina que rodea el bloque de tejido con cuidado con una cuchilla afilada.
6. Preparación de secciones de parafina de la arteria femoral
- Monte la hoja en el micrótomo, asegurándose de que el cuchillo esté afilado para seccionar.
- Fije el bloque de parafina en el soporte y ajuste el bloque en relación con la cuchilla a la posición adecuada para el seccionamiento.
- Recorta el bloque para asegurarte de que el tejido incrustado se pueda seccionar por completo. Ajuste el grosor de las secciones iniciales a 15-20 μm.
- Ajuste el grosor de la sección a aproximadamente 4 μm y proceda con el seccionado.
- Levante las secciones suavemente con un cepillo y transfiéralas con pinzas finas especializadas a una caja deslizante llena de agua tibia (aproximadamente 45 ° C) para facilitar la flotación.
- Transfiera las secciones de extensión a portaobjetos de microscopio. Coloque los portaobjetos en un ángulo de 45° para drenar el exceso de agua. A continuación, coloque los portaobjetos en un horno para que se sequen, normalmente a 37 °C durante 2 h, seguido de un horneado a 60 °C durante 1 h.
7. Tinción de hematoxilina-eosina
- Hidrate las secciones utilizando una serie de concentraciones de etanol graduadas, que incluyen etanol absoluto, etanol al 95%, 80% y 70%, y cada paso dura aproximadamente 5 minutos. Posteriormente, enjuague las secciones con agua destilada para eliminar cualquier residuo de etanol.
- Tiñir las secciones con hematoxilina durante aproximadamente 8-10 minutos y lavar a fondo 3 veces con agua corriente para eliminar el exceso de mancha.
- Para diferenciar las secciones manchadas, aplique una solución de alcohol de ácido clorhídrico al 1% durante un breve período de 5-7 s.
- Para intensificar el color azul, trate las secciones con una solución de amoníaco 1:400 durante 1 min.
- Después de remojar en etanol al 75%, tiña las secciones con eosina durante 36 s. Después de la tinción, deshidratar secuencialmente las secciones con una serie ascendente de concentraciones de etanol (80%, 90%, 95% y 100%), con una duración de 3-5 s en cada paso.
- Por último, hornee las secciones a 37 °C en un horno durante 10 min, aplique un par de gotas de agente sellador en un portaobjetos de vidrio, cubra la muestra con un cubreobjetos para asegurarlas en su lugar y deje que se seque al aire de forma natural.
Resultados
En la cirugía de anastomosis vascular, la lesión mecánica de la pared del vaso puede activar las células íntimas y desencadenar la proliferación. Los cambios en la velocidad y dirección del flujo sanguíneo después de la anastomosis también pueden estimular la proliferación de células íntimas. El proceso de remodelación vascular y la inestabilidad a largo plazo del flujo sanguíneo también pueden estimular persistentemente las células íntimas, lo que en última instancia conduce al engrosamiento.
Para confirmar el éxito del modelo de anastomosis de la arteria femoral, se realizó una tinción de hematoxilina y eosina en las secciones de la arteria femoral extraídas. Se observó la presencia de hiperplasia íntima significativa, lo que indica un remodelado vascular exitoso y confirma el éxito del procedimiento de anastomosis (Figura 1A).
Para evaluar la hiperplasia intimal, se marcaron e identificaron los límites de las estructuras vasculares clave, incluyendo la luz, la lámina elástica interna (LIE) y la lámina elástica externa (EEL)14. Sobre la base de estos límites, las mediciones de área se realizaron utilizando software de análisis de imágenes. El área íntima se calculó midiendo el área total encerrada por el IEL y restando el área lumínica para obtener el área real de la región íntima. El área medial se determinó midiendo el área total encerrada por el EEL y restando el área del IEL, obteniendo el área real de la región medial. Para evaluar la extensión de la hiperplasia intimal, se calculó la relación entre el área íntima y el área medial (relación íntima/medial), proporcionando una representación clara y cuantitativa del grado de engrosamiento de la íntima (Figura 1B).
La detección específica del marcador endotelial vascular CD31 y del marcador de músculo liso α-AME se realizó mediante el método de tinción inmunohistoquímica tanto en el grupo control normal como en el grupo experimental tras la cirugía de anastomosis de la arteria femoral (Figura 2).
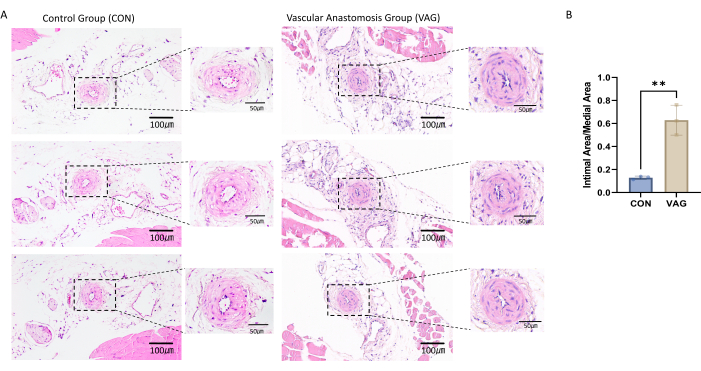
Figura 1: Tinción de hematoxilina y eosina de la sección de tejido anastomótico de la arteria femoral. (A) Después de 4 semanas de cirugía, se recolectaron muestras de la arteria femoral de la extremidad trasera izquierda del ratón. El tejido arterial se incrustó en parafina y se seccionó hasta obtener un grosor de 4 μm. Se realizó tinción de hematoxilina y eosina en las secciones, revelando una hiperplasia íntima significativa en la arteria femoral. (B) El histograma estadístico mostró que la relación entre la neoíntima y la media aumentó significativamente en los vasos anastomóticos. Los datos se presentan como media ± error estándar de la media (SEM). La significación estadística se evaluó mediante la prueba t independiente. El eje Y representa la relación entre el área íntima y el área medial, expresada como porcentaje. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Análisis inmunohistoquímico de marcadores vasculares endoteliales y de músculo liso tras cirugía de anastomosis de la arteria femoral. El análisis inmunohistoquímico reveló alteraciones en la morfología y distribución de las células endoteliales vasculares marcadas con CD31, así como la proliferación postoperatoria de células de músculo liso marcadas con α-SMA, tanto en el grupo normal como en el quirúrgico. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La anastomosis vascular es una técnica crucial en la cirugía de reconstrucción vascular, y su modelo animal desempeña un papel clave en el estudio de los mecanismos de la reestenosis postoperatoria. Este modelo ofrece un enfoque controlado para investigar los cambios patológicos vasculares, particularmente en la comprensión del origen de las células sobreproliferantes en la neoíntima durante la reestenosis. La fuente de proliferación de células musculares lisas (SMC) se convierte en un problema crucial cuando se produce una lesión arterial grave después de anastomosis vasculares, lo que resulta en la apoptosis de las SMC en el medio. Las SMC derivadas de los medios de los vasos sanguíneos no son las únicas involucradas; Las células madre de la adventicia también pueden diferenciarse en nuevas SMC, lo que podría contribuir a la hiperplasia neointimal15. Se han planteado preguntas sobre el origen de estas células, ya sea que provengan de SMC existentes o células madre, o si otras células adventiciales, como las células madre, desempeñan un papel a través de la proliferación, la migración y la diferenciación. El modelo experimental de anastomosis arterial es una herramienta valiosa para estudiar la migración de las células adventicias a la neoíntima y su transformación en SMC después de una lesión arterial. Al interrumpir quirúrgicamente los vasos, la capa elástica también se altera, lo que permite que las células adventiciales migren hacia la capa interna. Este modelo ofrece información importante sobre los mecanismos celulares implicados en la respuesta a la lesión arterial. Cada maniobra precisa durante el procedimiento de anastomosis vascular tiene un impacto crítico en la integridad vascular y en el éxito general del modelo quirúrgico. Al extender la extremidad posterior del ratón, evite enderezar en exceso, ya que una tensión excesiva puede dañar la elasticidad de la arteria, complicando la sutura posterior y potencialmente provocando microdesgarros en la pared del vaso, lo que podría comprometer el flujo sanguíneo y la tasa de éxito de la anastomosis. Durante la disección y el aislamiento, es esencial distinguir cuidadosamente la arteria, la vena y el nervio, evitando particularmente cualquier daño a la vena. La lesión venosa puede causar sangrado excesivo, obstruyendo el campo quirúrgico y aumentando la complejidad del procedimiento. Después de aislar la arteria femoral, pinzar los extremos proximal y distal con pinzas hemostáticas finas, teniendo cuidado de evitar estirar el vaso. Esta precaución minimiza el daño a la pared de los vasos y, al soltar las pinzas, permite que el flujo sanguíneo se reanude gradualmente, reduciendo el estrés de las células endoteliales y el daño potencial.
La elección de la sutura adecuada es fundamental para preservar la integridad del vaso y garantizar una anastomosis suave. El tamaño y el tipo de sutura deben coincidir con los requisitos específicos del vaso que se manipula. La selección de una longitud adecuada de sutura 6-0 para sostener la arteria es un paso crítico. La longitud excesiva de la sutura puede rozar los pequeños clips hemostáticos y causar lesiones endoteliales. Además, durante la sutura vascular, asegúrese de que la aguja pase de la pared interna a la externa del vaso en un solo movimiento para minimizar el trauma endotelial. Este paso es crítico, ya que el daño endotelial aumenta el riesgo de trombosis postoperatoria e impacta en las evaluaciones funcionales posteriores del vaso16. Cada punto de punción debe estar alineado con precisión, con orificios simétricos en ambos extremos proximal y distal. Ajuste el número de puntos de acuerdo con el diámetro del recipiente; Por ejemplo, los vasos más pequeños pueden requerir menos puntos (p. ej., tres en lugar de cuatro) para reducir la densidad de la sutura, prevenir la obstrucción del flujo sanguíneo y garantizar la permeabilidad del modelo para análisis posteriores. La elección de una sutura 12-0 es esencial para reducir el trauma en la pared del vaso, ya que su perfil delgado minimiza el impacto físico en la estructura vascular y preserva la integridad de las células endoteliales, que es fundamental para la cicatrización postoperatoria y la permeabilidad del flujo sanguíneo. El uso de una sutura más delgada ayuda a mantener la integridad estructural dentro del vaso modelo, lo que apoya el flujo sanguíneo sostenido y proporciona una base confiable para el análisis posterior. Durante todo el proceso de sutura, mantenga una tensión constante en la sutura para evitar que se afloje o se apriete demasiado, lo que podría restringir el flujo sanguíneo local.
Después de retirar las pinzas hemostáticas, puede producirse una pequeña fuga de sangre, lo cual es de esperar; Sin embargo, mantener un flujo sanguíneo continuo es crucial para la estabilidad a largo plazo del modelo. La observación postoperatoria es esencial para garantizar el éxito del modelo. Durante las 4 semanas posteriores a la cirugía, se debe vigilar de cerca la salud general del ratón, incluida la comprobación de sangrado, infección o trombosis en el sitio quirúrgico, para garantizar la supervivencia y la ausencia de complicaciones importantes. La observación constante del flujo sanguíneo en el sitio quirúrgico no solo verifica la permeabilidad de la anastomosis, sino que también proporciona un soporte de alta calidad para análisis posteriores, estableciendo una base sólida para la aplicación del modelo en estudios a largo plazo.
En este estudio, nuestro objetivo es evaluar la estenosis anastomótica causada por lesión vascular e hiperplasia íntima después de la revascularización. Si bien el modelo de ratón proporciona información valiosa sobre la respuesta biológica inicial a la lesión vascular, existen limitaciones inherentes a su aplicabilidad para imitar las afecciones vasculares humanas. En primer lugar, la progresión de la hiperplasia de la íntima en ratones, que suele observarse a lo largo de unas pocas semanas, puede no replicar completamente el desarrollo crónico observado en los seres humanos durante meses o años, lo que limita la evaluación de los cambios vasculares a largo plazo17. Además, las diferencias fisiológicas entre los sistemas vasculares del ratón y del humano, incluidas las variaciones en el tamaño de los vasos, las tasas de curación y las respuestas celulares, presentan desafíos para la aplicación traslacional directa de los hallazgos. El control preciso de la gravedad de la lesión en la arteria femoral del ratón también es un desafío, ya que pequeñas desviaciones en la técnica quirúrgica pueden afectar significativamente la respuesta del vaso, introduciendo variabilidad en los resultados. Por último, las exigencias microquirúrgicas de trabajar con vasos pequeños aumentan la complejidad técnica y el riesgo de lesiones inconsistentes, lo que puede afectar a la reproducibilidad de los resultados. Estos factores enfatizan colectivamente la necesidad de una interpretación cuidadosa de los hallazgos de este modelo al considerar su relevancia para la fisiopatología vascular humana.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Nos gustaría expresar nuestro más sincero agradecimiento al Prof. Qingbo Xu y Yanhua Hu de la Universidad de Zhejiang por su valiosa asistencia técnica. Este trabajo contó con el apoyo de las Fundaciones Nacionales de Ciencias Naturales de China (números de subvención 82070502 y 32171099), el Programa de Ciencia y Tecnología de Sichuan (números de subvención 2025HJRC0035, 2024NSFSC0709) y el Proyecto Conjunto de la Universidad Médica Luzhou-Southwest (2024LZXNYDJ021, 2024LZXNYDJ014)
Materiales
| Name | Company | Catalog Number | Comments |
| 6-0 Nylon Suture with Needle | Ningbo Chenghe | 240102 | |
| 12-0 Nylon Suture with Needle | Ningbo Lingqiao | 22064 | |
| Electro-heating standing-temperature incubator | Shanghai Boxun | HPX-9272MBE | |
| Eosin Staining Solution | Servicebio | G1005-2 | |
| Formaldehyde Solution | KESHI | 50-00-0 | |
| Hematoxylin Staining Solution | Servicebio | G1005-1 | |
| Heparin Sodium | Solarbio | H8060 | |
| MAGSCANNER KF-PRO-002 | KFBIO | KFPBL00200107003 | |
| Mounting medium | Wuxi Jiangyuan | 220810 | |
| OLYMPUS SZ2-ILST | OLYMPUS CORPORATION | SN 9B40828 | |
| Paraffin embedding machine | YAGUANG | YB-7LF | |
| Phosphate-Buffered Saline | Solarbio | P1010 |
Referencias
- Haruguchi, H., Teraoka, S. Intimal hyperplasia and hemodynamic factors in arterial bypass and arteriovenous grafts: A review. J Artificial Organs. 6 (4), 227-235 (2003).
- Huang, C., et al. Outcome and risk factors of restenosis post percutaneous transluminal angioplasty at juxta-anastomotic of wrist autogenous radial-cephalic arteriovenous fistulas: A retrospective cohort study. Ann Vas Surg. 93, 234-242 (2023).
- Pruthi, N., Tyagi, G., Gohil, D. End-to-side microvascular anastomosis on rat femoral vessels using only 2-throw knot interrupted sutures - evaluation of feasibility and patency rates on rat femoral vessels model. World Neurosurg. 148, e145-e150 (2021).
- Yücel, H. C., et al. Effectiveness of 1α-25-dihydroxyvitamin d3 active substance on anastomosis safety in the rat femoral artery end-to-end anastomosis experimental model: Macroscopic and histological analyses. J Plastic Reconstruct Aesthetic Surg. 97, 310-319 (2024).
- Godden, D. R. P., Little, R., Weston, A., Greenstein, A., Woodwards, R. T. M. Catecholamine sensitivity in the rat femoral artery after microvascular anastomosis. Microsurgery. 20 (5), 217-220 (2000).
- Lu, Y., et al. Endothelial ripk1 protects artery bypass graft against arteriosclerosis by regulating smc growth. Sci Adv. 9 (35), e8939 (2023).
- Ghista, D. N., Kabinejadian, F. Coronary artery bypass grafting hemodynamics and anastomosis design: A biomedical engineering review. Biomed Eng Online. 12 (1), 129 (2013).
- Surovtsova, I. Effects of compliance mismatch on blood flow in an artery with endovascular prosthesis. J Biomech. 38 (10), 2078-2086 (2005).
- Matsuura, S., et al. Effect of drug-coated balloons in treatment of stenosis of the femoral artery and vein bypass graft not responding to plain old balloon angioplasty: A case report. Surg Case Rep. 5 (1), 204 (2019).
- Funk, S. D., Yurdagul, A., Orr, A. W. Hyperglycemia and endothelial dysfunction in atherosclerosis: Lessons from type 1 diabetes. Int J Vas Medicine. 2012, 1-19 (2012).
- Akelina, Y. Ballestín Aeds. Microsurgery 101. , (2024).
- Curaj, A., Zhoujun, W., Staudt, M., Liehn, E. A. Induction of accelerated atherosclerosis in mice: The "wire-injury" model. J Vis Exp. (162), e54571 (2020).
- Oh, J. G., Ishikawa, K. Experimental models of cardiovascular diseases: Overview. Methods Mol Biol. 1816, 3-14 (2018).
- Lipke, E. A., West, J. L. Localized delivery of nitric oxide from hydrogels inhibits neointima formation in a rat carotid balloon injury model. Acta Biomater. 1 (6), 597-606 (2005).
- Dong, Z. F., et al. Role of smooth muscle progenitor cells in vascular mechanical injury and repair. Medicine Novel Technol Devices. 16, 100178 (2022).
- Yau, J. W., Teoh, H., Verma, S. Endothelial cell control of thrombosis. BMC Cardiovasc Disord. 15, 130 (2015).
- Jia, G., Aroor, A. R., Jia, C., Sowers, J. R. Endothelial cell senescence in aging-related vascular dysfunction. Biochim Biophys Acta. 1865 (7), 1802-1809 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados