Method Article
股动脉吻合口狭窄小鼠模型的开发
摘要
在这里,我们提出了一种用于股动脉吻合术的小鼠模型,为研究人员提供了一个有价值的动物模型来研究和模拟血管吻合口狭窄。这一发展对于促进我们对这种疾病背后的病理生理学的理解以及促进对血管疾病的更准确和有效的研究至关重要。
摘要
在血管外科手术中,血管吻合术是一种用于恢复血流的常见重建技术。然而,吻合口再狭窄是一种常见的术后并发症,主要由手术诱导的血管损伤、内膜增生和炎症反应引起。小鼠股动脉吻合模型广泛用于研究吻合口再狭窄和血管修复的机制。显微镜引导的端到端股动脉吻合术可以精确模拟手术后的血管损伤和修复过程,为研究与再狭窄相关的病理机制提供了可靠的实验工具。本研究的重点是改进小鼠股动脉吻合术的手术技术。通过手术技术的改进和技术细节的优化,我们实现了模型成功率和可重复性的显着提高。具体的改进包括手术过程中改进的血管处理技术、缝合材料的选择以及缝合方法的优化,以最大限度地减少吻合口瘘和术后闭塞。该研究还强调观察内膜增生、吻合口部位的血管重塑和长期血管通畅。通过这项研究,我们为小鼠股动脉吻合术提供了简洁高效的作指南,为血管外科的实验研究提供了可靠的技术支持。这项工作为后续研究治疗干预的相关机制和评估奠定了坚实的基础。
引言
血管吻合术是血运重建手术中的一项基本技术,在恢复血流和促进组织修复方面起着关键作用。然而,吻合口部位内膜增生 (IH) 的发生通常会导致再狭窄,这会严重损害长期血管通畅,并对临床结果和患者预后产生负面影响 1,2。IH 与术中血管损伤密切相关,其特征是平滑肌细胞 (SMC) 异常增殖和迁移以及细胞外基质过度沉积1。这些复杂且相互关联的病理过程强调了阐明 IH 的确切机制的迫切需要,以便为预防和干预再狭窄的策略提供信息。
由于其可重复性和精确控制性,股动脉吻合的小鼠模型已被广泛用于血管修复和相关病理机制的研究 3,4,5。小鼠的端到端吻合可以准确模拟术后吻合口损伤,从而能够动态观察 IH 和血管重塑。这些模型为研究术后内皮细胞和 SMC 之间的相互作用以及评估炎症反应在 IH 发展中的作用提供了一个理想的平台6。通过结合组织学分析和分子生物标志物检测,研究人员可以全面识别 IH 的关键驱动因素,从而为其潜在机制和潜在治疗靶点提供重要见解。
IH 的发展受多种因素驱动,其中血流动力学变化是关键因素 1,7,8。在吻合口部位,低剪切应力和异常振荡剪切指数 (OSI) 区域是 SMC 增殖和迁移的主要刺激因素 1,7。此外,顺应性错配和吻合口周围的湍流会加剧内皮损伤,加速 IH 进展8。这些发现强调了优化手术技术和选择合适的材料以减轻吻合口部位病理变化的必要性。
近年来,药物涂层球囊 (DCB) 已被证明可有效降低 IH。抗增殖剂,如紫杉醇,有效抑制 SMCs 增殖和迁移,显著降低再狭窄的发生率9。然而,在动静脉移植物等高流量系统中仍然存在挑战,其中剪切应力的快速波动和高血流速率可能会降低 DCB的疗效 1。未来的研究应侧重于提高 DCB 在不同血流动力学环境中的适用性,同时利用生物材料科学的进步为术后再狭窄开发更加个性化和有效的解决方案。除了局部干预外,糖尿病、动脉粥样硬化和内皮功能障碍等全身性因素也会显着影响 IH 的发展10。因此,临床策略应优先考虑对这些全身性疾病的全面管理,以增强整体血管健康。同时,识别和监测 IH 进展的新型生物标志物可以为早期干预提供机会。将人工智能整合到手术计划中提供了另一条有前途的途径,允许对优化的吻合口配置进行计算设计,从而提高手术成功率并延长血管通畅性。
在术后 IH 和相关病理机制的研究中,股动脉吻合模型以其精度和可重复性而著称11。该模型采用显微外科技术对小鼠股动脉进行端到端吻合,准确模拟吻合口部位的局部手术创伤。与线诱导损伤或其他替代方案等模型相比,该模型的优势尤为明显。股动脉吻合模型的一个主要技术优势是它能够诱导高度局部和受控的血管损伤12。手术创伤允许对吻合口区域产生集中影响,与临床血管手术中遇到的损伤模式非常相似。相比之下,钢导的损伤模型虽然技术简单,但通常会导致广泛的内皮剥脱,因此难以复制在现实生活中的吻合口手术中观察到的局部创伤13。此外,不同试验中线诱导损伤深度和程度的可变性可能会降低结果的可重复性。钢丝损伤模型中损伤的广泛性和弥漫性使其与研究与吻合口区域特别相关的局部 IH 相关性较低。
在这项研究中,利用股动脉吻合的小鼠模型,我们系统地改进了手术技术,以提高模型成功率并确保吻合口部位的长期通畅。利用这一已建立的基础,我们的研究深入研究了 IH 的分子和细胞机制,包括控制 SMCs 迁移和增殖的调节途径,以及炎症介质在 IH 进展中的作用。通过这项研究,我们旨在为吻合口后再狭窄的机制提供新的理论见解,并为开发专门针对 IH 的治疗策略奠定实验基础。
研究方案
这项研究获得批准,动物按照《中国实验动物管理和使用指南》进行处理。该研究严格遵守动物实验的道德要求,并获得了动物伦理委员会的批准(批准号:SWMU20221109-019)。在这里,本研究使用了 8 周龄的任一性别的健康 C57BL/6 小鼠,体重在 20-22 克之间。这些动物被安置在西南医科大学 (SWMU) 的实验动物中心。
1. 术前程序
- 根据机构批准的方案,用 3% 异氟醚吸入麻醉小鼠。麻醉开始后,验证反射是否完全丧失,例如对脚趾捏没有反应,以确保在进行手术前进行深度麻醉。诱导麻醉后,将异氟醚的浓度降低到 1%-1.5% 以维持麻醉状态,确保动物在整个手术过程中保持深度麻醉。
- 将鼠标仰卧在手术平台上,伸展后肢而不过度伸展。
- 将脱毛膏涂抹在大腿区域约 1 分钟以去除毛发,然后彻底清洁该区域以去除任何残留的乳霜和杂散的毛发。
- 用碘溶液对手术部位进行 3 次消毒,为后续的手术步骤做准备。
2. 股动脉血管吻合术
- 在立体显微镜下,使用微型手术刀在大腿中部区域沿股骨轴线切开约 1.5 厘米长的切口。切开皮肤后,进行钝性解剖以分离皮下组织,直到暴露股动脉和股静脉。股动脉位于股静脉的外侧,神经位于动脉的上方和外侧。
- 仔细解剖组织以完全暴露股动脉的 1 cm 切片。使用止血钳轻轻分离肌肉和深筋膜,以暴露神经、动脉和静脉。在此过程中,神经位于最外层,动脉位于中间,静脉位于内侧。
- 使用钝性解剖轻轻分离股动脉和股静脉。小心使用细镊子分离结缔组织以完全暴露股动脉。在股动脉下方放置无菌垫,以防止手术过程中意外刺伤针头。随后,用镊子轻轻夹住股动脉以诱导血肿。
- .使用小止血钳夹住股动脉的近端和远端。使用细剪刀整齐对称地横切股动脉。
- 在 1 mL 注射器中抽取 1% 肝素化盐水(生理盐水中含 1% 肝素)用于股动脉吻合处注射。一次加入 3-4 滴生理盐水,重复冲洗几次以去除动脉中的任何血凝块。
- 为了在随后的缝合过程中为血管提供支撑并模拟导丝介入造成的潜在损伤,请将 1 厘米长的 6-0 手术缝合线插入股动脉。确保股动脉正确对齐和光滑,以促进缝合过程。
- 使用 12-0 手术缝合线进行吻合,并在显微镜下调整针头角度,以确保针头从血管内侧流出到外侧。
- 创建八个穿刺部位,四个在股动脉的近端,四个在股动脉的远端。
- 确保穿刺部位位于血管的前、后、左、右点,相应的部位位于远端和近端。选择这些穴位时,确保血管可接近,避开关键的解剖结构,并在吻合术期间保持良好的血流。
- 使穿刺直径足够小,以尽量减少对血管的损害,但又要足够大以进行必要的程序。12-0 缝合针通常用于穿刺。
- 剪下四根 12-0 缝合线,每根缝合线长 3-4 厘米,每根缝合线穿过相应的穿刺孔。首先打一个松散的结,以避免缝合线缠结。
- 取下用于血管支撑的 6-0 缝合线,并牢固地打结。吻合完成后松开止血钳。
- 用弯曲的镊子从近端到远端轻轻刮擦股动脉,检查是否通畅,确保血液自由流过血管。此外,仔细检查吻合部位是否有任何明显渗漏的迹象。
3. 术后缝合
- 使用 6-0 手术缝合缝合下肢皮肤,采用间断缝合,以确保组织精确对齐和安全接近。缝合伤口后,在缝合区域涂抹碘酊,对伤口进行消毒,进一步降低感染风险。
- 术后保持无菌条件。在动物恢复足够的意识以维持胸骨卧位之前,不要让动物无人看管。在动物完全康复之前,不要将接受手术的动物送回其他动物的陪伴处。
4. 术后观察和取样
- 定期检查手术部位是否有任何炎症、过度肿胀或分泌物的迹象。记录动物的状况并根据需要提供适当的护理。
- 手术后 4 周,根据批准的伦理指南对小鼠进行人道安乐死。对于安乐死,给予过量的戊巴比妥钠(150 mg/kg,腹膜内注射),确保无痛和人道的终点。一旦确认无意识和反射停止,就开始收集组织。
注意:在初步研究中,我们发现在第 3 周或更早收获样本不利于内膜增生的形成。相反,在第 5 周采集样本导致过度内膜增生。这种过度生长不仅阻碍了后续实验的观察,而且对小鼠构成了潜在的健康风险。所以这里选择了第 4 周。 - 收集股动脉样本,以吻合部位为中心,从吻合口向两个方向延伸约 1 cm。使用细剪刀,切除股动脉以及所有周围的肌肉组织。
- 切除后,用 PBS 冲洗样品以去除残留的血液,然后将其在 10% 中性福尔马林中固定 1-2 天,以便进一步保存和分析。
注:10% 中性福尔马林是组织固定的经典选择,可有效交联蛋白质并保持组织结构的完整性,使其特别适合组织的长期储存。相比之下,4% 多聚甲醛 (PFA) 是一种较温和的固定剂,更适合更精细地保存细胞内结构(如核酸和蛋白质),通常用于免疫组织化学或免疫荧光分析。本研究的主要目的是观察血管的组织学变化(如内膜增生和血管重塑),而不是细胞内分子或蛋白质的精确定位。因此,福尔马林的固定作用足以满足实验需要。如果研究需要更高的分子保真度(例如保存 RNA 或蛋白质),PFA 可能是更好的选择。
5. 股动脉脱水和嵌入
- 固定后,将样品放入包埋盒中。用流水冲洗股动脉样品 6-8 小时,然后使用自动组织处理器进行组织脱水处理。
- 将熔化的石蜡倒入包埋模具中,用加热的镊子小心地拾取股动脉,然后将其垂直嵌入含有熔融石蜡的模具中。将包埋盒的盖子和底部分开,将底部放在包埋模具的顶部。加入少量熔化的石蜡将其固定到位,作为石蜡块的基础。应小心避免气泡。
- 当蜡块冷却到表面形成透明蜡膜的程度时,将其放在冷冻台上快速冷却。
- 从包埋模具中取出嵌入的蜡块,并使用锋利的刀片小心修剪包围组织块的多余石蜡。
6. 股动脉石蜡切片的制备
- 将刀片安装在切片机上,确保刀锋利,便于切片。
- 将石蜡块固定在支架上,并将石蜡块相对于刀片调整到适当的切片位置。
- 修剪块以确保包埋的组织可以完全切片。将初始切片的厚度设置为 15-20 μm。
- 将切片厚度调整为大约 4 μm 并继续切片。
- 用刷子轻轻提起切片,然后用专用的细镊子将它们转移到装满温水(约 45 °C)的载玻片盒中,以促进漂浮。
- 将扩散切片转移到显微镜载玻片上。将载玻片以 45° 角放置以排出多余的水。之后,将载玻片放入烘箱中干燥,通常在 37 °C 下干燥 2 小时,然后在 60 °C 下烘烤 1 小时。
7. 苏木精-曙红染色
- 使用一系列分级乙醇浓度(包括无水乙醇、95%、80% 和 70% 乙醇)对切片进行水合,每个步骤大约需要 5 分钟。随后,用蒸馏水冲洗切片以去除任何残留的乙醇。
- 用苏木精染色切片约 8-10 分钟,然后用流水彻底洗涤 3 次以去除多余的污渍。
- 为了区分染色切片,应用 1% 盐酸醇溶液 5-7 秒。
- 为了增强蓝色,用 1:400 氨溶液处理切片 1 分钟。
- 浸泡在 75% 乙醇中后,用伊红对切片染色 36 秒。染色后,用一系列递增的乙醇浓度(80%、90%、95% 和 100%)依次脱水切片,每个步骤持续 3-5 秒。
- 最后,将切片在37°C的烘箱中烘烤10分钟,在载玻片上滴几滴密封剂,用盖玻片盖住标本以将其固定到位,并使其自然风干。
结果
在血管吻合手术中,血管壁的机械损伤可以激活内膜细胞并触发增殖。吻合后血流速度和方向的变化也会刺激内膜细胞的增殖。血管重塑过程和血流的长期不稳定也会持续刺激内膜细胞,最终导致增厚。
为了确认股动脉吻合模型的成功,对收集的股动脉切片进行了苏木精和伊红染色。观察到显着内膜增生的存在,表明血管重塑成功并证实吻合手术成功(图 1A)。
为了评估内膜增生,标记并确定了关键血管结构的边界,包括管腔、内弹性层 (IEL) 和外弹性层 (EEL)14。基于这些边界,使用图像分析软件进行面积测量。通过测量 IEL 包围的总面积并减去管腔面积来计算内膜面积,得到实际的内膜区面积。通过测量 EEL 包围的总面积并减去 IEL 的面积来确定内侧面积,得到实际的内侧区域面积。为了评估内膜增生的程度,计算了内膜面积与内侧面积的比率(内膜/内侧比),提供了内膜增厚程度的清晰和定量表示(图 1B)。
正常对照组和实验组在股动脉吻合手术后,均采用免疫组化染色法对血管内皮标志物 CD31 和平滑肌标志物 α-SMA 进行特异性检测(图2)。
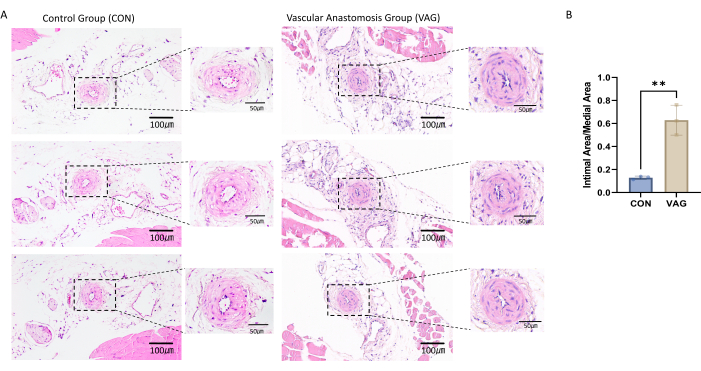
图 1:股动脉吻合组织切片的苏木精和伊红染色。 (A) 手术 4 周后,从小鼠左后肢采集股动脉样本。将动脉组织包埋在石蜡中并切片至 4 μm 的厚度。对切片进行苏木精和伊红染色,显示股动脉内膜显著增生。(B) 统计直方图显示,吻合口血管中新内膜与中层的比率显著增加。数据表示为平均值±平均值的标准误差 (SEM)。使用独立 t 检验评估统计学意义。y 轴表示内膜面积与内侧面积的比率,以百分比表示。 请单击此处查看此图的较大版本。

图 2:股动脉吻合手术后血管内皮和平滑肌标志物的免疫组织化学分析。 免疫组织化学分析显示正常组和手术组CD31标记的血管内皮细胞的形态和分布发生变化,以及α-SMA标记的平滑肌细胞术后增殖。 请单击此处查看此图的较大版本。
讨论
血管吻合术是血管重建手术中的一项关键技术,其动物模型在研究术后再狭窄的机制中起着关键作用。该模型提供了一种受控方法来研究血管病理变化,特别是在了解再狭窄期间新内膜中过度增殖细胞的起源。当血管吻合后发生严重动脉损伤时,增殖平滑肌细胞 (SMC) 的来源成为一个关键问题,导致 SMC 在介质中凋亡。源自血管介质的 SMC 并不是唯一涉及的;外膜中的干细胞也可能分化成新的 SMC,可能导致新内膜增生15。人们一直对这些细胞的起源提出疑问,它们是否来自现有的 SMC 或干细胞,或者其他外源细胞(如干细胞)是否通过增殖、迁移和分化发挥作用。实验性动脉吻合模型是研究外膜细胞迁移到新内膜以及动脉损伤后它们转化为 SMC 的宝贵工具。通过手术破坏血管,弹性层也被破坏,使外膜细胞向内层迁移。该模型为动脉损伤反应所涉及的细胞机制提供了重要的见解。血管吻合术过程中的每一次精确作都会严重影响血管完整性和手术模型的整体成功。伸展小鼠后肢时,避免过度伸直,因为过度紧张可能会损害动脉的弹性,使后续缝合复杂化,并可能导致血管壁出现微撕裂,从而可能影响血流和吻合成功率。在解剖和隔离过程中,必须仔细区分动脉、静脉和神经,特别是避免对静脉造成任何损伤。静脉损伤可能导致出血过多,阻塞手术区域并增加手术的复杂性。隔离股动脉后,用细止血钳夹住近端和远端,注意避免拉伸血管。这种预防措施可最大限度地减少血管壁损伤,并在松开夹子后,允许血流逐渐恢复,从而减少内皮细胞应激和潜在损伤。
选择合适的缝合线对于保持血管完整性和确保顺利吻合至关重要。缝合线的尺寸和类型应与所处理的血管的具体要求保持一致。选择合适的 6-0 缝合线来支撑动脉是一个关键步骤。缝合线过长可能会摩擦小止血夹并导致内皮损伤。此外,在血管缝合过程中,确保针头以单一动作从内血管壁穿过外侧,以尽量减少内皮损伤。这一步至关重要,因为内皮损伤会增加术后血栓形成的风险并影响血管的后续功能评估16。每个穿刺点应精确对齐,近端和远端都有对称的孔。根据容器直径调整针数;例如,较小的血管可能需要更少的缝合(例如,3 针而不是 4 针)以降低缝合密度,防止血流阻塞,并确保模型通畅以进行进一步分析。选择 12-0 缝合线对于减少血管壁的创伤至关重要,因为它的薄型最大限度地减少了对血管结构的物理影响并保持了内皮细胞的完整性,这对于术后愈合和血流通畅至关重要。使用较薄的缝合线有助于维持模型血管内的结构完整性,从而支持持续的血流并为后续分析提供可靠的基础。在整个缝合过程中,保持缝合线的张力一致,以避免松动或过度收紧,这可能会限制局部血液流动。
取下止血钳后,可能会出现轻微的血液泄漏,这是意料之中的;然而,保持连续的血流对于模型的长期稳定性至关重要。术后观察对于确保模型成功至关重要。在手术后的 4 周内,应密切监测小鼠的整体健康状况,包括检查手术部位是否有出血、感染或血栓形成,以确保存活和无重大并发症。持续观察手术部位的血流不仅可以验证吻合口通畅性,还可以为进一步分析提供高质量的支持,为该模型在长期研究中的应用奠定了坚实的基础。
在这项研究中,我们旨在评估血运重建后血管损伤和内膜增生引起的吻合口狭窄。虽然小鼠模型为对血管损伤的初始生物反应提供了有价值的见解,但其在模拟人类血管状况方面的适用性存在固有的局限性。首先,通常在几周内观察到的小鼠内膜增生的进展可能无法完全复制在人类中观察到的数月或数年的慢性发展,这限制了对长期血管变化的评估17。此外,小鼠和人类血管系统之间的生理差异,包括血管大小、愈合速率和细胞反应的变化,为研究结果的直接转化应用带来了挑战。精确控制小鼠股动脉损伤的严重程度也具有挑战性,因为手术技术的微小偏差会显着影响血管的反应,从而给结果带来可变性。最后,在小血管上工作的显微外科需求增加了技术复杂性和不一致损伤的风险,这可能会影响结果的可重复性。这些因素共同强调了在考虑该模型与人类血管病理生理学的相关性时需要仔细解释该模型的研究结果。
披露声明
作者没有需要披露的利益冲突。
致谢
我们衷心感谢浙江大学的徐庆波教授和胡艳华教授提供的宝贵技术帮助。这项工作得到了中国国家自然科学基金(批准号 82070502 和 32171099)、四川省科技计划(批准号 2025HJRC0035、2024NSFSC0709)和泸州-西南医科大学联合项目(2024LZXNYDJ021、2024LZXNYDJ014)的支持
材料
| Name | Company | Catalog Number | Comments |
| 6-0 Nylon Suture with Needle | Ningbo Chenghe | 240102 | |
| 12-0 Nylon Suture with Needle | Ningbo Lingqiao | 22064 | |
| Electro-heating standing-temperature incubator | Shanghai Boxun | HPX-9272MBE | |
| Eosin Staining Solution | Servicebio | G1005-2 | |
| Formaldehyde Solution | KESHI | 50-00-0 | |
| Hematoxylin Staining Solution | Servicebio | G1005-1 | |
| Heparin Sodium | Solarbio | H8060 | |
| MAGSCANNER KF-PRO-002 | KFBIO | KFPBL00200107003 | |
| Mounting medium | Wuxi Jiangyuan | 220810 | |
| OLYMPUS SZ2-ILST | OLYMPUS CORPORATION | SN 9B40828 | |
| Paraffin embedding machine | YAGUANG | YB-7LF | |
| Phosphate-Buffered Saline | Solarbio | P1010 |
参考文献
- Haruguchi, H., Teraoka, S. Intimal hyperplasia and hemodynamic factors in arterial bypass and arteriovenous grafts: A review. J Artificial Organs. 6 (4), 227-235 (2003).
- Huang, C., et al. Outcome and risk factors of restenosis post percutaneous transluminal angioplasty at juxta-anastomotic of wrist autogenous radial-cephalic arteriovenous fistulas: A retrospective cohort study. Ann Vas Surg. 93, 234-242 (2023).
- Pruthi, N., Tyagi, G., Gohil, D. End-to-side microvascular anastomosis on rat femoral vessels using only 2-throw knot interrupted sutures - evaluation of feasibility and patency rates on rat femoral vessels model. World Neurosurg. 148, e145-e150 (2021).
- Yücel, H. C., et al. Effectiveness of 1α-25-dihydroxyvitamin d3 active substance on anastomosis safety in the rat femoral artery end-to-end anastomosis experimental model: Macroscopic and histological analyses. J Plastic Reconstruct Aesthetic Surg. 97, 310-319 (2024).
- Godden, D. R. P., Little, R., Weston, A., Greenstein, A., Woodwards, R. T. M. Catecholamine sensitivity in the rat femoral artery after microvascular anastomosis. Microsurgery. 20 (5), 217-220 (2000).
- Lu, Y., et al. Endothelial ripk1 protects artery bypass graft against arteriosclerosis by regulating smc growth. Sci Adv. 9 (35), e8939 (2023).
- Ghista, D. N., Kabinejadian, F. Coronary artery bypass grafting hemodynamics and anastomosis design: A biomedical engineering review. Biomed Eng Online. 12 (1), 129 (2013).
- Surovtsova, I. Effects of compliance mismatch on blood flow in an artery with endovascular prosthesis. J Biomech. 38 (10), 2078-2086 (2005).
- Matsuura, S., et al. Effect of drug-coated balloons in treatment of stenosis of the femoral artery and vein bypass graft not responding to plain old balloon angioplasty: A case report. Surg Case Rep. 5 (1), 204 (2019).
- Funk, S. D., Yurdagul, A., Orr, A. W. Hyperglycemia and endothelial dysfunction in atherosclerosis: Lessons from type 1 diabetes. Int J Vas Medicine. 2012, 1-19 (2012).
- Akelina, Y. Ballestín Aeds. Microsurgery 101. , (2024).
- Curaj, A., Zhoujun, W., Staudt, M., Liehn, E. A. Induction of accelerated atherosclerosis in mice: The "wire-injury" model. J Vis Exp. (162), e54571 (2020).
- Oh, J. G., Ishikawa, K. Experimental models of cardiovascular diseases: Overview. Methods Mol Biol. 1816, 3-14 (2018).
- Lipke, E. A., West, J. L. Localized delivery of nitric oxide from hydrogels inhibits neointima formation in a rat carotid balloon injury model. Acta Biomater. 1 (6), 597-606 (2005).
- Dong, Z. F., et al. Role of smooth muscle progenitor cells in vascular mechanical injury and repair. Medicine Novel Technol Devices. 16, 100178 (2022).
- Yau, J. W., Teoh, H., Verma, S. Endothelial cell control of thrombosis. BMC Cardiovasc Disord. 15, 130 (2015).
- Jia, G., Aroor, A. R., Jia, C., Sowers, J. R. Endothelial cell senescence in aging-related vascular dysfunction. Biochim Biophys Acta. 1865 (7), 1802-1809 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。