Method Article
Entwicklung eines Mausmodells für die Anastomosenstenose der Arteria femoralis
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Mausmodell für die Anastomose der Oberschenkelarterie vor, das den Forschern ein wertvolles Tiermodell zur Untersuchung und Simulation einer vaskulären Anastomosenstenose bietet. Diese Entwicklung ist entscheidend, um unser Verständnis der Pathophysiologie, die dieser Erkrankung zugrunde liegt, zu verbessern und eine genauere und effektivere Erforschung von Gefäßerkrankungen zu ermöglichen.
Zusammenfassung
In der Gefäßchirurgie ist die vaskuläre Anastomose eine gängige rekonstruktive Technik, die zur Wiederherstellung des Blutflusses eingesetzt wird. Die anastomosische Restenose ist jedoch eine häufige postoperative Komplikation, die hauptsächlich durch chirurgische Gefäßverletzungen, Intimahyperplasie und Entzündungsreaktionen verursacht wird. Das Anastomosenmodell der Oberschenkelarterie der Maus wird häufig verwendet, um die Mechanismen der Anastomosenrestenose und der Gefäßreparatur zu untersuchen. Die mikroskopisch geführte End-to-End-Anastomose der Oberschenkelarterie ermöglicht die präzise Simulation von Gefäßverletzungs- und Reparaturprozessen nach Operationen und bietet ein zuverlässiges experimentelles Werkzeug zur Untersuchung der pathologischen Mechanismen im Zusammenhang mit der Restenose. Diese Studie konzentriert sich auf die Verfeinerung der Operationstechnik für die Anastomose der Oberschenkelarterie bei Mäusen. Durch Verfeinerungen der Operationstechniken und die Optimierung technischer Details haben wir eine deutliche Steigerung der Erfolgsquote und Reproduzierbarkeit des Modells erreicht. Zu den spezifischen Verbesserungen gehören verfeinerte Gefäßhandhabungstechniken während der Operation, die Auswahl von Nahtmaterialien und die Optimierung der Nahtmethoden, um Anastomosenleckagen und postoperative Verschlüsse zu minimieren. Die Studie betont auch die Beobachtung der Intimahyperplasie, des Gefäßumbaus an der Anastomosenstelle und der langfristigen Durchgängigkeit der Gefäße. Durch diese Forschung bieten wir einen prägnanten und effizienten Operationsleitfaden für die Durchführung einer Anastomose der Oberschenkelarterie an der Maus und bieten eine zuverlässige technische Unterstützung für experimentelle Studien in der Gefäßchirurgie. Diese Arbeit legt eine solide Grundlage für nachfolgende Untersuchungen zu verwandten Mechanismen und Evaluationen therapeutischer Interventionen.
Einleitung
Die vaskuläre Anastomose ist eine grundlegende Technik bei Revaskularisationsverfahren, die eine entscheidende Rolle bei der Wiederherstellung des Blutflusses und der Förderung der Gewebereparatur spielt. Das Auftreten einer Intimahyperplasie (IH) an der Anastomosenstelle führt jedoch häufig zu einer Restenose, die die langfristige Durchgängigkeit der Gefäße erheblich beeinträchtigt und sich negativ auf die klinischen Ergebnisse und die Prognose der Patienten auswirkt 1,2. IH ist eng mit intraoperativen Gefäßverletzungen assoziiert, die durch eine abnormale Proliferation und Migration von glatten Muskelzellen (SMCs) und eine übermäßige Ablagerung der extrazellulären Matrixgekennzeichnet sind 1. Diese komplexen und miteinander verknüpften pathologischen Prozesse unterstreichen die dringende Notwendigkeit, die genauen Mechanismen der IH aufzuklären, um präventive und interventionelle Strategien gegen Restenose zu entwickeln.
Aufgrund ihrer Reproduzierbarkeit und präzisen Kontrolle wurden murine Modelle der Anastomose der Oberschenkelarterie in der Forschung zur Gefäßreparatur und den damit verbundenen pathologischen Mechanismen weitgehend übernommen 3,4,5. Die End-to-End-Anastomose bei Mäusen ermöglicht eine genaue Simulation postoperativer Anastomosenverletzungen und ermöglicht eine dynamische Beobachtung von IH und Gefäßumbau. Diese Modelle bieten eine ideale Plattform, um die Wechselwirkungen zwischen Endothelzellen und SMCs nach der Operation zu untersuchen und die Rolle von Entzündungsreaktionen bei der IH-Entwicklung zu bewerten6. Durch die Kombination von histologischer Analyse und molekularer Biomarker-Detektion können Forscher die Schlüsselfaktoren von IH umfassend identifizieren und so wichtige Einblicke in die zugrunde liegenden Mechanismen und potenziellen therapeutischen Ziele bieten.
Die Entwicklung von IH wird von mehreren Faktoren bestimmt, wobei hämodynamische Veränderungen einen entscheidenden Beitrag leisten 1,7,8. An der Anastomosenstelle sind Regionen mit geringer Scherspannung und abnormalem oszillatorischem Scherindex (OSI) primäre Stimuli für die Proliferation und Migration von SMCs 1,7. Darüber hinaus verschlimmern Compliance-Mismatches und turbulenter Blutfluss um die Anastomose die Endothelverletzung und beschleunigen die IH-Progression8. Diese Ergebnisse unterstreichen die Notwendigkeit, die Operationstechniken zu optimieren und geeignete Materialien auszuwählen, um pathologische Veränderungen an der Anastomosenstelle zu mildern.
In den letzten Jahren haben medikamentenbeschichtete Ballons (DCBs) ihre Wirksamkeit bei der Reduzierung von IH gezeigt. Antiproliferative Wirkstoffe wie Paclitaxel hemmen wirksam die Proliferation und Migration von SMCs und reduzieren so die Inzidenz von Restenose9 erheblich. In Systemen mit hohem Durchfluss wie arteriovenösen Transplantaten, bei denen schnelle Schwankungen der Scherspannung und hohe Blutflussraten die Wirksamkeit von DCBs verringern können, bestehen jedoch weiterhin Herausforderungen1. Zukünftige Studien sollten sich darauf konzentrieren, die Anwendbarkeit von DCBs in verschiedenen hämodynamischen Umgebungen zu verbessern und gleichzeitig Fortschritte in der Biomaterialwissenschaft zu nutzen, um personalisiertere und effektivere Lösungen für postoperative Restenose zu entwickeln. Zusätzlich zu den lokalisierten Interventionen beeinflussen systemische Faktoren wie Diabetes, Atherosklerose und endotheliale Dysfunktion die IH-Entwicklung signifikant10. Daher sollten klinische Strategien einer umfassenden Behandlung dieser systemischen Erkrankungen Vorrang einräumen, um die allgemeine Gefäßgesundheit zu verbessern. Gleichzeitig könnte die Identifizierung und Überwachung neuartiger Biomarker für die IH-Progression Möglichkeiten für eine frühzeitige Intervention bieten. Die Integration von künstlicher Intelligenz in die Operationsplanung bietet einen weiteren vielversprechenden Weg, der das rechnerische Design optimierter Anastomosenkonfigurationen ermöglicht, wodurch die chirurgischen Erfolgsraten verbessert und die Gefäßdurchgängigkeit verlängert werden.
Bei der Untersuchung der postoperativen IH und der damit verbundenen pathologischen Mechanismen zeichnet sich das Anastomosenmodell der Oberschenkelarterie durch seine Präzision und Reproduzierbarkeitaus 11. Dieses Modell, bei dem mikrochirurgische Techniken verwendet werden, um eine End-to-End-Anastomose der Oberschenkelarterie bei Mäusen zu erzeugen, ahmt ein lokalisiertes chirurgisches Trauma an der Anastomosenstelle genau nach. Die Vorteile dieses Modells werden besonders deutlich im Vergleich zu Modellen wie der drahtinduzierten Verletzung oder anderen Alternativen. Ein großer technischer Vorteil des Anastomosenmodells der Oberschenkelarterie ist seine Fähigkeit, hochgradig lokalisierte und kontrollierte Gefäßverletzungen zu induzieren12. Das chirurgische Trauma ermöglicht eine fokussierte Beeinflussung der Anastomosenregion, die den Verletzungsmustern in der klinischen Gefäßchirurgie sehr nahe kommt. Im Gegensatz dazu führen Draht-induzierte Verletzungsmodelle, obwohl sie technisch einfacher sind, oft zu einer ausgedehnten endothelialen Denudation, was es schwierig macht, lokalisierte Traumata zu replizieren, die bei realen Anastomosenoperationen beobachtet wurden13. Darüber hinaus verringert die Variabilität in der Tiefe und dem Ausmaß der drahtinduzierten Schädigung über verschiedene Studien hinweg möglicherweise die Reproduzierbarkeit der Ergebnisse. Die extensive und diffuse Natur der Schädigung in Drahtverletzungsmodellen macht sie weniger relevant für die Untersuchung der lokalisierten IH, die spezifisch mit Anastomosenregionen assoziiert ist.
In dieser Studie haben wir unter Verwendung eines murinen Modells der Anastomose der Oberschenkelarterie die chirurgischen Techniken systematisch verfeinert, um die Erfolgsraten des Modells zu verbessern und eine langfristige Durchgängigkeit der Anastomosenstelle zu gewährleisten. Auf dieser etablierten Grundlage befasste sich unsere Studie mit den molekularen und zellulären Mechanismen, die IH zugrunde liegen, einschließlich der regulatorischen Signalwege, die die Migration und Proliferation von SMCs steuern, sowie der Rolle von Entzündungsmediatoren bei der Progression von IH. Durch diese Forschung wollen wir neue theoretische Einblicke in die Mechanismen der postanastomatischen Restenose liefern und eine experimentelle Grundlage für die Entwicklung therapeutischer Strategien schaffen, die speziell auf die IH abzielen.
Protokoll
Diese Studie wurde genehmigt und die Tiere wurden in Übereinstimmung mit den Richtlinien für das Management und die Verwendung von Labortieren in China behandelt. Die Forschung hielt sich strikt an die ethischen Anforderungen von Tierversuchen, mit Genehmigung der Tierethikkommission (Zulassungsnummer: SWMU20221109-019). Hier wurden 8 Wochen alte gesunde C57BL/6 Mäuse beiderlei Geschlechts mit einem Gewicht zwischen 20 und 22 g für die vorliegende Studie verwendet. Die Tiere wurden im Laboratory Animal Center der Southwest Medical University (SWMU) untergebracht.
1. Präoperative Eingriffe
- Betäubung von Mäusen mit 3% Isofluran-Inhalation gemäß institutionell anerkannten Protokollen. Überprüfen Sie nach Beginn der Anästhesie den vollständigen Verlust der Reflexe, wie z. B. das Fehlen einer Reaktion auf das Einklemmen der Zehen, um eine tiefe Anästhesie zu gewährleisten, bevor Sie mit der Operation fortfahren. Reduzieren Sie nach der Einleitung der Anästhesie die Isoflurankonzentration auf 1 % bis 1,5 %, um den Anästhesiezustand aufrechtzuerhalten und sicherzustellen, dass die Tiere während des gesamten chirurgischen Eingriffs in tiefer Narkose bleiben.
- Positionieren Sie die Maus in Rückenlage auf einer chirurgischen Plattform und strecken Sie die Hintergliedmaßen aus, ohne sich zu überstrecken.
- Tragen Sie ca. 1 Minute lang eine Enthaarungscreme auf den Oberschenkelbereich auf, um Haare zu entfernen, und reinigen Sie den Bereich dann gründlich, um Cremereste und streunende Haare zu entfernen.
- Desinfizieren Sie das Operationsfeld 3x mit Jodlösung, um sich auf die nachfolgenden Operationsschritte vorzubereiten.
2. Vaskuläre Anastomose der Arteria femoralis
- Machen Sie unter einem Stereomikroskop mit einem Mikroskalpell einen etwa 1,5 cm langen Schnitt entlang der Achse des Oberschenkelknochens in der Mitte des Oberschenkels. Führen Sie nach dem Einschneiden der Haut eine stumpfe Dissektion durch, um das Unterhautgewebe zu trennen, bis die Oberschenkelarterie und die Oberschenkelvene freigelegt sind. Die Oberschenkelarterie befindet sich lateral der Oberschenkelvene, der Nerv befindet sich oberhalb und seitlich der Arterie.
- Präparieren Sie das Gewebe vorsichtig, um einen 1 cm langen Abschnitt der Oberschenkelarterie vollständig freizulegen. Trennen Sie mit einer hämostatischen Pinzette vorsichtig die Muskeln und die tiefen Faszien, um die Nerven, die Arterie und die Vene freizulegen. Während dieses Prozesses befindet sich der Nerv auf der äußersten Schicht, die Arterie in der Mitte und die Vene auf der Innenseite.
- Trennen Sie die Oberschenkelarterie und die Oberschenkelvene vorsichtig durch stumpfe Dissektion. Seien Sie vorsichtig, wenn Sie eine feine Pinzette verwenden, um das Bindegewebe zu trennen und die Oberschenkelarterie vollständig freizulegen. Legen Sie ein steriles Pad unter die Oberschenkelarterie, um eine versehentliche Nadelverletzung während des Eingriffs zu vermeiden. Klemmen Sie anschließend die Oberschenkelarterie vorsichtig mit einer Zange ein, um ein Hämatom herbeizuführen.
- . Klemmen Sie mit einer kleinen hämostatischen Pinzette die proximalen und distalen Enden der Oberschenkelarterie ein. Verwenden Sie eine feine Schere, um die Oberschenkelarterie sauber und symmetrisch zu durchschneiden.
- Ziehen Sie 1% heparinisierte Kochsalzlösung (1% Heparin in normaler Kochsalzlösung) in eine 1-ml-Spritze zur Injektion an die Anastomose der Oberschenkelarterie. Fügen Sie Kochsalzlösung in Form von 3-4 Tropfen auf einmal hinzu, mit mehreren wiederholten Spülungen, um Blutgerinnsel aus der Arterie zu entfernen.
- Um das Gefäß bei der anschließenden Naht zu stützen und mögliche Schäden durch einen Führungsdrahteingriff zu simulieren, wird eine 1 cm lange chirurgische Naht 6-0 in die Oberschenkelarterie eingeführt. Stellen Sie sicher, dass die Oberschenkelarterie richtig ausgerichtet und glatt ist, um den Nahtvorgang zu erleichtern.
- Verwenden Sie für die Anastomose ein chirurgisches Nahtmaterial 12-0 und passen Sie den Nadelwinkel unter dem Mikroskop an, um sicherzustellen, dass die Nadel von der Innenseite zur Außenseite des Gefäßes austritt.
- Erstellen Sie acht Punktionsstellen, vier an den proximalen und vier an den distalen Enden der Oberschenkelarterie.
- Stellen Sie sicher, dass sich die Punktionsstellen am anterioren, hinteren, linken und rechten Punkt des Gefäßes befinden, mit entsprechenden Stellen an den distalen und proximalen Enden. Achten Sie bei der Auswahl dieser Punkte darauf, dass das Gefäß zugänglich ist, kritische anatomische Strukturen vermieden werden und eine gute Durchblutung während der Anastomose aufrechterhalten wird.
- Machen Sie den Einstichdurchmesser klein genug, um Schäden am Gefäß zu minimieren, aber groß genug für die notwendigen Eingriffe. Für die Punktion wird typischerweise eine 12-0 Nahtnadel verwendet.
- Schneiden Sie vier Längen 12-0 Nahtmaterial von je 3-4 cm Länge ab und fädeln Sie jedes durch das entsprechende Einstichloch. Beginnen Sie damit, einen losen Knoten zu binden, um ein Verheddern der Nähte zu vermeiden.
- Entfernen Sie die 6-0-Naht, die für die Gefäßstütze verwendet wurde, und binden Sie die Knoten sicher. Lassen Sie die hämostatische Pinzette los, nachdem die Anastomose abgeschlossen ist.
- Kratzen Sie die Oberschenkelarterie vorsichtig mit einer gebogenen Pinzette vom proximalen zum distalen Ende, um die Durchgängigkeit zu überprüfen und sicherzustellen, dass das Blut frei durch das Gefäß fließt. Untersuchen Sie außerdem die Anastomosenstelle sorgfältig auf Anzeichen von offensichtlichen Leckagen.
3. Postoperative Naht
- Vernähen Sie die Haut der unteren Extremität mit einer chirurgischen Naht 6-0, wobei Sie eine unterbrochene Naht verwenden, um eine präzise Ausrichtung und eine sichere Annäherung an das Gewebe zu gewährleisten. Tragen Sie nach dem Nähen der Wunde Jodtinktur auf die vernähte Stelle auf, um die Wunde zu desinfizieren und das Infektionsrisiko weiter zu verringern.
- Halten Sie nach der Operation sterile Bedingungen aufrecht. Lassen Sie das Tier nicht unbeaufsichtigt, bis es wieder genügend Bewusstsein erlangt hat, um das Brustbein aufrecht zu erhalten. Geben Sie die Tiere, die operiert wurden, nicht an andere Tiere zurück, bis sie sich vollständig erholt haben.
4. Postoperative Beobachtung und Probenahme
- Untersuchen Sie die Operationsstelle regelmäßig auf Anzeichen von Entzündungen, übermäßigen Schwellungen oder Ausfluss. Dokumentieren Sie den Zustand des Tieres und sorgen Sie bei Bedarf für eine angemessene Pflege.
- 4 Wochen nach der Operation euthanasieren Sie die Mäuse auf humane Weise in Übereinstimmung mit den anerkannten ethischen Richtlinien. Zur Euthanasie ist eine Überdosis Pentobarbital-Natrium (150 mg/kg, intraperitoneale Injektion) zu verabreichen, um einen schmerzfreien und humanen Endpunkt zu gewährleisten. Sobald die Bewusstlosigkeit und das Aufhören der Reflexe bestätigt sind, beginnen Sie mit der Gewebeentnahme.
HINWEIS: In den Vorstudien stellten wir fest, dass die Entnahme der Proben in der 3. Woche oder früher nicht förderlich für die Bildung einer Intimahyperplasie war. Umgekehrt führte die Probenentnahme in der 5. Woche zu einer exzessiven Intimahyperplasie. Dieses übermäßige Wachstum erschwerte nicht nur die Beobachtung nachfolgender Experimente, sondern stellte auch potenzielle Gesundheitsrisiken für die Mäuse dar. Also wurde hier die 4. Woche ausgewählt. - Entnehmen Sie Proben der Oberschenkelarterie, die sich auf die Anastomosenstelle konzentrieren und sich von der Anastomose aus in beide Richtungen erstrecken. Schneiden Sie mit einer feinen Schere die Oberschenkelarterie zusammen mit dem gesamten umgebenden Muskelgewebe heraus.
- Spülen Sie die Probe nach der Exzision in PBS, um Blutreste zu entfernen, und fixieren Sie sie dann 1-2 Tage lang in 10% neutralem Formalin zur weiteren Konservierung und Analyse.
HINWEIS: Ein 10% neutrales Formalin ist eine klassische Wahl für die Gewebefixierung, da es Proteine effektiv vernetzt und die Integrität der Gewebestruktur bewahrt, wodurch es sich besonders für die Langzeitlagerung von Geweben eignet. Im Gegensatz dazu ist 4% Paraformaldehyd (PFA) ein milderes Fixiermittel, das sich besser für die feinere Konservierung intrazellulärer Strukturen (wie Nukleinsäuren und Proteine) eignet und häufig für die Immunhistochemie oder Immunfluoreszenzanalyse verwendet wird. Das primäre Ziel dieser Studie ist es, die histologischen Veränderungen in den Blutgefäßen (wie Intimahyperplasie und Gefäßumbau) zu beobachten, und nicht die genaue Lokalisierung von intrazellulären Molekülen oder Proteinen. Daher ist die Fixierungswirkung von Formalin ausreichend, um den experimentellen Bedarf zu decken. Wenn die Forschung eine höhere molekulare Genauigkeit erfordert (z. B. die Konservierung von RNA oder Proteinen), kann PFA die bessere Wahl sein.
5. Dehydration und Einbettung der Oberschenkelarterie
- Legen Sie die Proben nach der Fixierung in Einbettboxen. Spülen Sie die Proben der Oberschenkelarterie 6-8 Stunden lang mit fließendem Wasser, bevor Sie sie mit einem automatisierten Gewebeprozessor zur Gewebedehydrierung verarbeiten.
- Gießen Sie geschmolzenes Paraffin in Einbettformen, heben Sie die Oberschenkelarterie vorsichtig mit einer erhitzten Pinzette auf und betten Sie sie vertikal in die Form ein, die das geschmolzene Paraffin enthält. Trennen Sie den Deckel und den Boden der Einbettbox, wobei der Boden auf die Einbettform gelegt wird. Füge eine kleine Menge geschmolzenes Paraffin hinzu, um es an Ort und Stelle zu fixieren und als Basis für den Paraffinblock zu dienen. Luftblasen sollten penibel vermieden werden.
- Wenn der Wachsblock so weit abgekühlt ist, dass sich ein transparenter Wachsfilm auf der Oberfläche bildet, legen Sie ihn zum schnellen Abkühlen auf einen Gefriertisch.
- Entfernen Sie den eingebetteten Wachsblock aus der Einbettform und schneiden Sie das überschüssige Paraffin, das den Gewebeblock umgibt, vorsichtig mit einer scharfen Klinge ab.
6. Vorbereitung von Paraffinabschnitten der Oberschenkelarterie
- Montieren Sie die Klinge auf dem Mikrotom und stellen Sie sicher, dass das Messer zum Schneiden scharf ist.
- Befestigen Sie den Paraffinblock an der Halterung und stellen Sie den Block relativ zur Klinge in die richtige Position zum Schneiden.
- Schneiden Sie den Block ab, um sicherzustellen, dass das eingebettete Gewebe vollständig geschnitten werden kann. Stellen Sie die Dicke der Anfangsprofile auf 15-20 μm ein.
- Stellen Sie die Schnittdicke auf ca. 4 μm ein und fahren Sie mit dem Trennen fort.
- Heben Sie die Abschnitte vorsichtig mit einer Bürste an und geben Sie sie mit einer speziellen feinen Pinzette in eine mit warmem Wasser (ca. 45 °C) gefüllte Objektträgerbox, um das Schwimmen zu erleichtern.
- Übertragen Sie die Spread-Schnitte auf Objektträger. Positionieren Sie die Rutschen in einem Winkel von 45°, um überschüssiges Wasser abzulassen. Anschließend die Objektträger zum Trocknen in den Ofen schieben, in der Regel 2 h bei 37 °C und anschließend 1 h bei 60 °C backen.
7. Hämatoxylin-Eosin-Färbung
- Hydratisieren Sie die Abschnitte mit einer Reihe von abgestuften Ethanolkonzentrationen, einschließlich absolutem Ethanol, 95 %, 80 % und 70 % Ethanol, wobei jeder Schritt etwa 5 Minuten dauert. Spülen Sie anschließend die Abschnitte mit destilliertem Wasser ab, um Ethanolreste zu entfernen.
- Färben Sie die Abschnitte ca. 8-10 Minuten lang mit Hämatoxylin und waschen Sie sie 3x gründlich mit fließendem Wasser, um überschüssigen Fleck zu entfernen.
- Zur Unterscheidung der gefärbten Abschnitte 1%ige Salzsäurealkohollösung für einen kurzen Zeitraum von 5-7 s auftragen.
- Um die blaue Farbe zu intensivieren, behandeln Sie die Schnitte 1 min lang mit einer 1:400 Ammoniaklösung.
- Nach dem Einweichen in 75%igem Ethanol die Abschnitte 36 s lang mit Eosin färben. Nach der Färbung werden die Schnitte nacheinander mit einer aufsteigenden Reihe von Ethanolkonzentrationen (80 %, 90 %, 95 % und 100 %) dehydriert, wobei jeder Schritt 3-5 s dauert.
- Zum Schluss die Abschnitte bei 37 °C im Ofen 10 Minuten backen, ein paar Tropfen Dichtmittel auf einen Objektträger auftragen, die Probe mit einem Deckglas abdecken, um sie an Ort und Stelle zu halten, und an der Luft trocknen lassen.
Ergebnisse
Bei der vaskulären Anastomosenchirurgie kann eine mechanische Verletzung der Gefäßwand die Intimzellen aktivieren und die Proliferation auslösen. Änderungen der Geschwindigkeit und Richtung des Blutflusses nach der Anastomose können ebenfalls die Proliferation von Intimazellen stimulieren. Der Prozess des Gefäßumbaus und die langfristige Instabilität des Blutflusses können auch die Intimzellen anhaltend stimulieren, was letztendlich zu einer Verdickung führt.
Um den Erfolg des Anastomosenmodells der Oberschenkelarterie zu bestätigen, wurde eine Hämatoxylin- und Eosinfärbung an den entnommenen Abschnitten der Oberschenkelarterie durchgeführt. Das Vorliegen einer signifikanten Intimahyperplasie wurde beobachtet, was auf einen erfolgreichen Gefäßumbau hinweist und den Erfolg des Anastomosenverfahrens bestätigt (Abbildung 1A).
Zur Beurteilung der Intimahyperplasie wurden die Grenzen der wichtigsten Gefäßstrukturen, einschließlich des Lumens, der inneren elastischen Lamina (IEL) und der äußeren elastischen Lamina (EEL), markiert und identifiziert14. Basierend auf diesen Grenzen wurden Flächenmessungen mit Hilfe einer Bildanalysesoftware durchgeführt. Die Intimafläche wurde berechnet, indem die Gesamtfläche, die von der IEL umschlossen wird, gemessen und die Lumenfläche subtrahiert wurde, um die tatsächliche Fläche der Intimalregion zu erhalten. Die mediale Fläche wurde bestimmt, indem die Gesamtfläche, die vom EEL umschlossen wurde, gemessen und die Fläche des IEL subtrahiert wurde, wodurch sich die tatsächliche Fläche der medialen Region ergab. Um das Ausmaß der Intimahyperplasie zu beurteilen, wurde das Verhältnis des Intimbereichs zum medialen Bereich (Intimal/Medial-Verhältnis) berechnet, das eine klare und quantitative Darstellung des Grades der Intimalverdickung liefert (Abbildung 1B).
Der spezifische Nachweis des vaskulären endothelialen Markers CD31 und des Markers der glatten Muskulatur α-SMA erfolgte mit der immunhistochemischen Färbemethode sowohl in der normalen Kontrollgruppe als auch in der Versuchsgruppe nach einer Anastomosenoperation der Oberschenkelarterie (Abbildung 2).
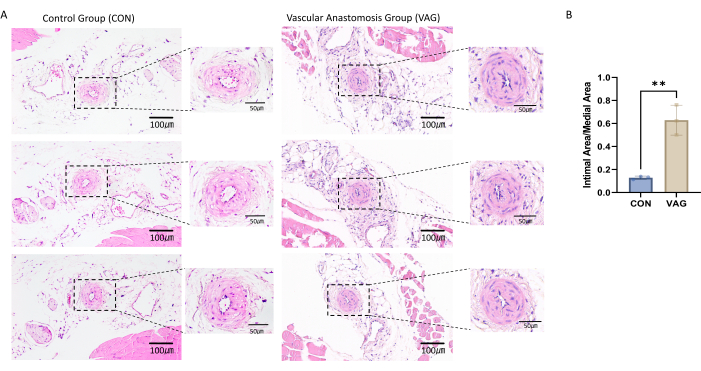
Abbildung 1: Hämatoxylin- und Eosin-Färbung eines Anastomosengewebeschnitts der Oberschenkelarterie. (A) Nach 4-wöchiger Operation wurden Proben der Oberschenkelarterie aus der linken Hintergliedmaße der Maus entnommen. Das arterielle Gewebe wurde in Paraffin eingebettet und auf eine Dicke von 4 μm geschnitten. Hämatoxylin- und Eosin-Färbungen wurden an den Schnitten durchgeführt, wobei eine signifikante Intimahyperplasie in der Oberschenkelarterie festgestellt wurde. (B) Das statistische Histogramm zeigte, dass das Verhältnis von Neointima zu Medium in den Anastomosengefäßen signifikant anstieg. Die Daten werden als Mittelwert ± Standardfehler des Mittelwerts (SEM) dargestellt. Die statistische Signifikanz wurde mit dem unabhängigen t-Test bewertet. Die y-Achse stellt das Verhältnis des Intimbereichs zum medialen Bereich dar, ausgedrückt in Prozent. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Immunhistochemische Analyse von vaskulären endothelialen und glatten Muskelmarkern nach einer Anastomosenoperation der Oberschenkelarterie. Die immunhistochemische Analyse ergab Veränderungen in der Morphologie und Verteilung von CD31-markierten vaskulären Endothelzellen sowie in der postoperativen Proliferation von α-SMA-markierten glatten Muskelzellen sowohl in der normalen als auch in der chirurgischen Gruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die vaskuläre Anastomose ist eine entscheidende Technik in der Gefäßrekonstruktionschirurgie, wobei ihr Tiermodell eine Schlüsselrolle bei der Untersuchung der Mechanismen der postoperativen Restenose spielt. Dieses Modell bietet einen kontrollierten Ansatz zur Untersuchung vaskulärer pathologischer Veränderungen, insbesondere zum Verständnis des Ursprungs übermäßig proliferierender Zellen in der Neointima während der Restenose. Die Quelle der proliferierenden glatten Muskelzellen (SMCs) wird zu einem entscheidenden Problem, wenn nach vaskulären Anastomosen eine schwere arterielle Schädigung auftritt, die zur Apoptose von SMCs in den Medien führt. SMCs, die aus den Medien der Blutgefäße gewonnen werden, sind nicht die einzigen, die daran beteiligt sind. Stammzellen in der Adventitia können sich auch zu neuen SMCs differenzieren, was möglicherweise zur neointimalen Hyperplasie beiträgt15. Es wurde die Frage aufgeworfen, woher diese Zellen stammen, ob sie aus bestehenden SMCs oder Stammzellen stammen oder ob andere Adventivzellen, wie z. B. Stammzellen, durch Proliferation, Migration und Differenzierung eine Rolle spielen. Das experimentelle arterielle Anastomosenmodell ist ein wertvolles Werkzeug, um die Migration von Adventitialzellen in die Neointima und ihre Umwandlung in SMCs nach arterieller Verletzung zu untersuchen. Durch das chirurgische Aufbrechen der Gefäße wird auch die elastische Schicht aufgerissen, so dass Adventitialzellen in Richtung der inneren Schicht wandern können. Dieses Modell bietet wichtige Einblicke in die zellulären Mechanismen, die an der Reaktion auf arterielle Verletzungen beteiligt sind. Jedes präzise Manöver während des vaskulären Anastomosenverfahrens wirkt sich entscheidend auf die vaskuläre Integrität und den Gesamterfolg des chirurgischen Modells aus. Vermeiden Sie bei der Streckung der hinteren Gliedmaße der Maus eine Überbegradigung, da eine übermäßige Spannung die Elastizität der Arterie beeinträchtigen kann, was das anschließende Nähen erschwert und möglicherweise zu Mikrorissen in der Gefäßwand führt, die den Blutfluss und die Erfolgsrate der Anastomose beeinträchtigen können. Bei der Dissektion und Isolierung ist es wichtig, Arterie, Vene und Nerv sorgfältig zu unterscheiden, um insbesondere eine Schädigung der Vene zu vermeiden. Eine Venenverletzung kann zu übermäßigen Blutungen führen, das Operationsfeld behindern und die Komplexität des Eingriffs erhöhen. Nach der Isolierung der Oberschenkelarterie klemmen Sie die proximalen und distalen Enden mit einer feinen hämostatischen Pinzette ab und achten Sie darauf, dass das Gefäß nicht gedehnt wird. Diese Vorsichtsmaßnahme minimiert die Schädigung der Gefäßwand und ermöglicht beim Lösen der Klemmen die allmähliche Wiederaufnahme des Blutflusses, wodurch der Stress der Endothelzellen und mögliche Schäden reduziert werden.
Die Wahl des geeigneten Nahtmaterials ist entscheidend für die Erhaltung der Gefäßintegrität und die Gewährleistung einer reibungslosen Anastomose. Die Größe und der Typ des Nahtmaterials sollten den spezifischen Anforderungen des zu behandelnden Gefäßes entsprechen. Die Auswahl einer geeigneten Länge von 6-0 Nahtmaterial zur Unterstützung der Arterie ist ein kritischer Schritt. Eine übermäßige Länge der Naht kann an den kleinen hämostatischen Clips reiben und eine Endothelverletzung verursachen. Stellen Sie außerdem sicher, dass die Nadel während der Gefäßnaht in einer einzigen Bewegung von der inneren zur äußeren Gefäßwand gelangt, um ein Endotheltrauma zu minimieren. Dieser Schritt ist von entscheidender Bedeutung, da eine Endothelschädigung das Risiko einer postoperativen Thrombose erhöht und sich auf die nachfolgende Funktionsbeurteilung des Gefäßes auswirkt16. Jeder Einstichpunkt sollte genau ausgerichtet sein, mit symmetrischen Löchern sowohl am proximalen als auch am distalen Ende. Passen Sie die Anzahl der Stiche an den Gefäßdurchmesser an; Zum Beispiel können kleinere Gefäße weniger Stiche erfordern (z. B. drei statt vier), um die Nahtdichte zu reduzieren, eine Obstruktion des Blutflusses zu verhindern und die Durchgängigkeit des Modells für weitere Analysen sicherzustellen. Die Wahl einer 12-0-Naht ist wichtig, um das Trauma der Gefäßwand zu reduzieren, da ihr dünnes Profil die physischen Auswirkungen auf die Gefäßstruktur minimiert und die Integrität der Endothelzellen bewahrt, was für die postoperative Heilung und die Durchgängigkeit des Blutflusses entscheidend ist. Die Verwendung einer dünneren Naht trägt dazu bei, die strukturelle Integrität des Modellgefäßes zu erhalten, was einen anhaltenden Blutfluss unterstützt und eine zuverlässige Grundlage für die anschließende Analyse bietet. Halten Sie während des gesamten Nahtvorgangs eine konstante Spannung in der Naht aufrecht, um ein Lockern oder übermäßiges Anziehen zu vermeiden, das den lokalen Blutfluss einschränken könnte.
Nach dem Entfernen der hämostatischen Pinzette kann es zu einem geringfügigen Blutaustritt kommen, der zu erwarten ist. Die Aufrechterhaltung eines kontinuierlichen Blutflusses ist jedoch entscheidend für die Langzeitstabilität des Modells. Die postoperative Beobachtung ist für den Erfolg des Modells unerlässlich. Während der 4 Wochen nach der Operation sollte der allgemeine Gesundheitszustand der Maus engmaschig überwacht werden, einschließlich der Überprüfung auf Blutungen, Infektionen oder Thrombosen an der Operationsstelle, um das Überleben und das Fehlen größerer Komplikationen zu gewährleisten. Die konsequente Beobachtung des Blutflusses an der Operationsstelle bestätigt nicht nur die Durchgängigkeit der Anastomose, sondern bietet auch eine qualitativ hochwertige Unterstützung für weitere Analysen, was eine solide Grundlage für die Anwendung des Modells in Langzeitstudien bildet.
In dieser Studie wollen wir die Anastomosenstenose untersuchen, die durch Gefäßverletzungen und Intimahyperplasie nach Revaskularisation verursacht wird. Während das Mausmodell wertvolle Einblicke in die anfängliche biologische Reaktion auf Gefäßverletzungen liefert, gibt es inhärente Einschränkungen bei der Anwendbarkeit bei der Nachahmung menschlicher Gefäßerkrankungen. Erstens kann das Fortschreiten der Intimahyperplasie bei Mäusen, das typischerweise über einige Wochen beobachtet wird, die chronische Entwicklung, die beim Menschen über Monate oder Jahre beobachtet wurde, möglicherweise nicht vollständig replizieren, was die Beurteilung langfristiger vaskulärer Veränderungen einschränkt17. Darüber hinaus stellen die physiologischen Unterschiede zwischen dem Gefäßsystem der Maus und dem Menschen, einschließlich Variationen in der Gefäßgröße, der Heilungsraten und der zellulären Reaktionen, eine Herausforderung für die direkte translationale Anwendung der Ergebnisse dar. Die genaue Kontrolle des Schweregrads der Verletzung in der Oberschenkelarterie der Maus ist ebenfalls eine Herausforderung, da geringfügige Abweichungen in der Operationstechnik die Reaktion des Gefäßes erheblich beeinflussen können, was zu einer Variabilität der Ergebnisse führt. Schließlich erhöhen die mikrochirurgischen Anforderungen bei der Arbeit an kleinen Gefäßen die technische Komplexität und das Risiko von inkonsistenten Verletzungen, die die Reproduzierbarkeit der Ergebnisse beeinträchtigen können. Diese Faktoren unterstreichen zusammen die Notwendigkeit einer sorgfältigen Interpretation der Ergebnisse dieses Modells, wenn ihre Relevanz für die menschliche vaskuläre Pathophysiologie berücksichtigt wird.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir bedanken uns herzlich bei Prof. Qingbo Xu und Yanhua Hu von der Zhejiang Universität für ihre wertvolle technische Unterstützung. Diese Arbeit wurde unterstützt von den National Natural Science Foundations of China (Fördernummern 82070502 und 32171099), dem Sichuan Science and Technology Program (Fördernummern 2025HJRC0035, 2024NSFSC0709) und dem Luzhou-Southwest Medical University Joint Project (2024LZXNYDJ021, 2024LZXNYDJ014)
Materialien
| Name | Company | Catalog Number | Comments |
| 6-0 Nylon Suture with Needle | Ningbo Chenghe | 240102 | |
| 12-0 Nylon Suture with Needle | Ningbo Lingqiao | 22064 | |
| Electro-heating standing-temperature incubator | Shanghai Boxun | HPX-9272MBE | |
| Eosin Staining Solution | Servicebio | G1005-2 | |
| Formaldehyde Solution | KESHI | 50-00-0 | |
| Hematoxylin Staining Solution | Servicebio | G1005-1 | |
| Heparin Sodium | Solarbio | H8060 | |
| MAGSCANNER KF-PRO-002 | KFBIO | KFPBL00200107003 | |
| Mounting medium | Wuxi Jiangyuan | 220810 | |
| OLYMPUS SZ2-ILST | OLYMPUS CORPORATION | SN 9B40828 | |
| Paraffin embedding machine | YAGUANG | YB-7LF | |
| Phosphate-Buffered Saline | Solarbio | P1010 |
Referenzen
- Haruguchi, H., Teraoka, S. Intimal hyperplasia and hemodynamic factors in arterial bypass and arteriovenous grafts: A review. J Artificial Organs. 6 (4), 227-235 (2003).
- Huang, C., et al. Outcome and risk factors of restenosis post percutaneous transluminal angioplasty at juxta-anastomotic of wrist autogenous radial-cephalic arteriovenous fistulas: A retrospective cohort study. Ann Vas Surg. 93, 234-242 (2023).
- Pruthi, N., Tyagi, G., Gohil, D. End-to-side microvascular anastomosis on rat femoral vessels using only 2-throw knot interrupted sutures - evaluation of feasibility and patency rates on rat femoral vessels model. World Neurosurg. 148, e145-e150 (2021).
- Yücel, H. C., et al. Effectiveness of 1α-25-dihydroxyvitamin d3 active substance on anastomosis safety in the rat femoral artery end-to-end anastomosis experimental model: Macroscopic and histological analyses. J Plastic Reconstruct Aesthetic Surg. 97, 310-319 (2024).
- Godden, D. R. P., Little, R., Weston, A., Greenstein, A., Woodwards, R. T. M. Catecholamine sensitivity in the rat femoral artery after microvascular anastomosis. Microsurgery. 20 (5), 217-220 (2000).
- Lu, Y., et al. Endothelial ripk1 protects artery bypass graft against arteriosclerosis by regulating smc growth. Sci Adv. 9 (35), e8939 (2023).
- Ghista, D. N., Kabinejadian, F. Coronary artery bypass grafting hemodynamics and anastomosis design: A biomedical engineering review. Biomed Eng Online. 12 (1), 129 (2013).
- Surovtsova, I. Effects of compliance mismatch on blood flow in an artery with endovascular prosthesis. J Biomech. 38 (10), 2078-2086 (2005).
- Matsuura, S., et al. Effect of drug-coated balloons in treatment of stenosis of the femoral artery and vein bypass graft not responding to plain old balloon angioplasty: A case report. Surg Case Rep. 5 (1), 204 (2019).
- Funk, S. D., Yurdagul, A., Orr, A. W. Hyperglycemia and endothelial dysfunction in atherosclerosis: Lessons from type 1 diabetes. Int J Vas Medicine. 2012, 1-19 (2012).
- Akelina, Y. Ballestín Aeds. Microsurgery 101. , (2024).
- Curaj, A., Zhoujun, W., Staudt, M., Liehn, E. A. Induction of accelerated atherosclerosis in mice: The "wire-injury" model. J Vis Exp. (162), e54571 (2020).
- Oh, J. G., Ishikawa, K. Experimental models of cardiovascular diseases: Overview. Methods Mol Biol. 1816, 3-14 (2018).
- Lipke, E. A., West, J. L. Localized delivery of nitric oxide from hydrogels inhibits neointima formation in a rat carotid balloon injury model. Acta Biomater. 1 (6), 597-606 (2005).
- Dong, Z. F., et al. Role of smooth muscle progenitor cells in vascular mechanical injury and repair. Medicine Novel Technol Devices. 16, 100178 (2022).
- Yau, J. W., Teoh, H., Verma, S. Endothelial cell control of thrombosis. BMC Cardiovasc Disord. 15, 130 (2015).
- Jia, G., Aroor, A. R., Jia, C., Sowers, J. R. Endothelial cell senescence in aging-related vascular dysfunction. Biochim Biophys Acta. 1865 (7), 1802-1809 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten