Method Article
Sviluppo di un modello murino per la stenosi anastomotica dell'arteria femorale
In questo articolo
Riepilogo
Qui presentiamo un modello murino per l'anastomosi dell'arteria femorale, offrendo ai ricercatori un prezioso modello animale per studiare e simulare la stenosi anastomotica vascolare. Questo sviluppo è fondamentale per far progredire la nostra comprensione della fisiopatologia alla base di questa condizione e facilitare una ricerca più accurata ed efficace sulle malattie vascolari.
Abstract
In chirurgia vascolare, l'anastomosi vascolare è una tecnica ricostruttiva comune utilizzata per ripristinare il flusso sanguigno. Tuttavia, la restenosi anastomotica è una complicanza postoperatoria frequente, causata principalmente da lesioni vascolari indotte da interventi chirurgici, iperplasia intimale e risposte infiammatorie. Il modello di anastomosi dell'arteria femorale di topo è ampiamente utilizzato per studiare i meccanismi della restenosi anastomotica e della riparazione vascolare. L'anastomosi dell'arteria femorale end-to-end guidata al microscopio consente una simulazione precisa delle lesioni vascolari e dei processi di riparazione dopo l'intervento chirurgico, fornendo uno strumento sperimentale affidabile per lo studio dei meccanismi patologici correlati alla restenosi. Questo studio si concentra sul perfezionamento della tecnica chirurgica per l'anastomosi dell'arteria femorale nei topi. Attraverso il perfezionamento delle tecniche chirurgiche e l'ottimizzazione dei dettagli tecnici, abbiamo ottenuto un notevole aumento del tasso di successo e della riproducibilità del modello. I miglioramenti specifici includono tecniche di manipolazione vascolare perfezionate durante l'intervento chirurgico, la selezione dei materiali di sutura e l'ottimizzazione dei metodi di sutura per ridurre al minimo le perdite anastomotiche e l'occlusione postoperatoria. Lo studio enfatizza anche l'osservazione dell'iperplasia intimale, del rimodellamento vascolare nel sito anastomotico e della pervietà dei vasi a lungo termine. Attraverso questa ricerca, forniamo una guida operativa concisa ed efficiente per l'esecuzione dell'anastomosi dell'arteria femorale di topo, offrendo un supporto tecnico affidabile per studi sperimentali in chirurgia vascolare. Questo lavoro getta solide basi per le successive indagini sui meccanismi correlati e sulle valutazioni dell'intervento terapeutico.
Introduzione
L'anastomosi vascolare è una tecnica fondamentale nelle procedure di rivascolarizzazione, che svolge un ruolo fondamentale nel ripristino del flusso sanguigno e nella promozione della riparazione dei tessuti. Tuttavia, l'insorgenza di iperplasia intimale (IH) nel sito anastomotico porta spesso a restenosi, che compromette significativamente la pervietà vascolare a lungo termine e influisce negativamente sugli esiti clinici e sulla prognosi del paziente 1,2. L'IH è strettamente associata al danno vascolare intraoperatorio, caratterizzato da proliferazione e migrazione anomale delle cellule muscolari lisce (SMC) e da un'eccessiva deposizione di matrice extracellulare1. Questi processi patologici complessi e interconnessi sottolineano la necessità critica di chiarire i meccanismi precisi dell'IH per informare le strategie preventive e interventistiche contro la restenosi.
Grazie alla loro riproducibilità e al controllo preciso, i modelli murini di anastomosi dell'arteria femorale sono stati ampiamente adottati nella ricerca sulla riparazione vascolare e sui meccanismi patologici associati 3,4,5. L'anastomosi end-to-end nei topi consente una simulazione accurata della lesione anastomotica post-chirurgica, consentendo l'osservazione dinamica dell'IH e del rimodellamento vascolare. Questi modelli forniscono una piattaforma ideale per studiare le interazioni tra cellule endoteliali e SMC post-operatorie e per valutare il ruolo delle risposte infiammatorie nello sviluppo dell'IH6. Combinando l'analisi istologica e il rilevamento di biomarcatori molecolari, i ricercatori possono identificare in modo completo i fattori chiave dell'IH, offrendo informazioni critiche sui suoi meccanismi sottostanti e sui potenziali bersagli terapeutici.
Lo sviluppo dell'IH è guidato da molteplici fattori, con i cambiamenti emodinamici che contribuiscono in modo critico 1,7,8. A livello anastomotico, le regioni di basso sforzo di taglio e l'indice di taglio oscillatorio anomalo (OSI) sono gli stimoli primari per la proliferazione e la migrazione delle SMC 1,7. Inoltre, le discrepanze di compliance e il flusso sanguigno turbolento intorno all'anastomosi aggravano il danno endoteliale, accelerando la progressione dell'IH8. Questi risultati sottolineano la necessità di ottimizzare le tecniche chirurgiche e di selezionare materiali appropriati per mitigare i cambiamenti patologici nel sito anastomotico.
Negli ultimi anni, i palloncini rivestiti di farmaco (DCB) hanno dimostrato efficacia nel ridurre l'IH. Gli agenti antiproliferativi, come il paclitaxel, inibiscono efficacemente la proliferazione e la migrazione delle SMC, riducendo significativamente l'incidenza della restenosi9. Tuttavia, le sfide persistono nei sistemi ad alto flusso come gli innesti arterovenosi, dove le rapide fluttuazioni dello sforzo di taglio e le elevate velocità di flusso sanguigno possono ridurre l'efficacia dei DCB1. Gli studi futuri dovrebbero concentrarsi sul miglioramento dell'applicabilità dei DCB in vari ambienti emodinamici, sfruttando al contempo i progressi nella scienza dei biomateriali per sviluppare soluzioni più personalizzate ed efficaci per la restenosi post-chirurgica. Oltre agli interventi localizzati, fattori sistemici come il diabete, l'aterosclerosi e la disfunzione endoteliale influenzano significativamente lo sviluppo dell'IH10. Pertanto, le strategie cliniche dovrebbero dare priorità alla gestione completa di queste condizioni sistemiche per migliorare la salute vascolare generale. Allo stesso tempo, l'identificazione e il monitoraggio di nuovi biomarcatori per la progressione dell'IH potrebbero fornire opportunità per un intervento precoce. L'integrazione dell'intelligenza artificiale nella pianificazione chirurgica offre un'altra strada promettente, consentendo la progettazione computazionale di configurazioni anastomotiche ottimizzate, migliorando così le percentuali di successo chirurgico e prolungando la pervietà vascolare.
Nello studio dell'IH post-chirurgico e dei meccanismi patologici associati, il modello di anastomosi dell'arteria femorale si distingue per la sua precisione e riproducibilità11. Questo modello, che impiega tecniche microchirurgiche per creare anastomosi end-to-end dell'arteria femorale nei topi, imita accuratamente il trauma chirurgico localizzato nel sito anastomotico. I vantaggi di questo modello diventano particolarmente evidenti se confrontati con modelli come le lesioni indotte dal filo o altre alternative. Uno dei principali vantaggi tecnici del modello di anastomosi dell'arteria femorale è la sua capacità di indurre lesioni vascolari altamente localizzate e controllate12. Il trauma chirurgico consente un impatto mirato sulla regione anastomotica, imitando da vicino i modelli di lesione riscontrati nella chirurgia vascolare clinica. Al contrario, i modelli di lesione indotta da filo, sebbene più semplici nella tecnica, spesso provocano un'estesa denudazione endoteliale, rendendo difficile replicare il trauma localizzato osservato negli interventi di chirurgia anastomotica nella vita reale13. Inoltre, la variabilità nella profondità e nell'entità del danno indotto dal filo in diversi studi riduce potenzialmente la riproducibilità dei risultati. La natura estesa e diffusa del danno nei modelli di lesione del filo lo rende meno rilevante per lo studio dell'IH localizzato che è specificamente associato alle regioni anastomotiche.
In questo studio, utilizzando un modello murino di anastomosi dell'arteria femorale, abbiamo sistematicamente perfezionato le tecniche chirurgiche per migliorare le percentuali di successo del modello e garantire la pervietà a lungo termine del sito anastomotico. Sfruttando questa base consolidata, il nostro studio ha approfondito i meccanismi molecolari e cellulari alla base dell'IH, comprese le vie regolatorie che governano la migrazione e la proliferazione delle SMC, nonché il ruolo dei mediatori infiammatori nella progressione dell'IH. Attraverso questa ricerca, miriamo a contribuire a nuove intuizioni teoriche sui meccanismi della restenosi post-anastomotica e a stabilire una base sperimentale per lo sviluppo di strategie terapeutiche specificamente mirate all'IH.
Protocollo
Questo studio è stato approvato e gli animali sono stati gestiti in conformità con le linee guida per la gestione e l'uso di animali da laboratorio in Cina. La ricerca ha aderito rigorosamente ai requisiti etici degli esperimenti sugli animali, con l'approvazione del Comitato Etico Animale (Numero di approvazione: SWMU20221109-019). Qui, per il presente studio sono stati utilizzati topi C57BL/6 sani di 8 settimane di entrambi i sessi, di peso compreso tra 20 e 22 g. Gli animali sono stati ospitati presso il Laboratory Animal Center della Southwest Medical University (SWMU).
1. Procedure preoperatorie
- Anestetizzare i topi con inalazione di isoflurano al 3% in conformità con i protocolli approvati istituzionalmente. Dopo l'inizio dell'anestesia, verificare la completa perdita dei riflessi, come la mancata risposta al pizzicamento delle dita, per garantire un'anestesia profonda prima di procedere con l'intervento. Dopo aver indotto l'anestesia, ridurre la concentrazione di isoflurano all'1%-1,5% per mantenere lo stato anestetico, assicurandosi che gli animali rimangano in anestesia profonda durante la procedura chirurgica.
- Posizionare il topo supino su una piattaforma chirurgica, estendendo gli arti posteriori senza allungarsi eccessivamente.
- Applicare una crema depilatoria sulla zona della coscia per circa 1 minuto per rimuovere i peli, quindi pulire accuratamente l'area per rimuovere eventuali residui di crema e peli randagi.
- Disinfettare il sito chirurgico con soluzione di iodio 3 volte per prepararsi alle fasi chirurgiche successive.
2. Anastomosi vascolare dell'arteria femorale
- Al microscopio, praticare un'incisione lunga circa 1,5 cm lungo l'asse del femore nella regione di metà coscia utilizzando un microbisturi. Dopo aver inciso la pelle, eseguire una dissezione smussata per separare il tessuto sottocutaneo fino a quando l'arteria femorale e la vena femorale non sono esposte. L'arteria femorale si trova lateralmente alla vena femorale e il nervo è posizionato superiormente e lateralmente all'arteria.
- Sezionare con cura il tessuto per esporre completamente una sezione di 1 cm dell'arteria femorale. Usando una pinza emostatica, separa delicatamente i muscoli e la fascia profonda per esporre i nervi, l'arteria e la vena. Durante questo processo, il nervo si trova sullo strato più esterno, l'arteria si trova nel mezzo e la vena si trova all'interno.
- Separare delicatamente l'arteria femorale e la vena femorale utilizzando la dissezione smussata. Prestare attenzione all'uso di pinze sottili per separare il tessuto connettivo in modo da esporre completamente l'arteria femorale. Posizionare un tampone sterile sotto l'arteria femorale per evitare lesioni accidentali da ago durante la procedura. Successivamente, bloccare delicatamente l'arteria femorale con una pinza per indurre un ematoma.
- . Usando una piccola pinza emostatica, bloccare le estremità prossimale e distale dell'arteria femorale. Usa le forbici sottili per sezionare in modo ordinato e simmetrico l'arteria femorale.
- Aspirare soluzione fisiologica eparinizzata all'1% (eparina all'1% in soluzione fisiologica normale) in una siringa da 1 ml per iniezione all'anastomosi dell'arteria femorale. Aggiungere soluzione salina come 3-4 gocce alla volta, con diversi risciacqui ripetuti per rimuovere eventuali coaguli di sangue dall'arteria.
- Per fornire supporto al vaso durante la successiva sutura e simulare il potenziale danno causato da un intervento su filo guida, inserire una sutura chirurgica 6-0 lunga 1 cm nell'arteria femorale. Garantire il corretto allineamento e la levigatezza dell'arteria femorale per facilitare il processo di sutura.
- Utilizzare una sutura chirurgica 12-0 per l'anastomosi e regolare l'angolo dell'ago al microscopio per assicurarsi che l'ago esca dal lato interno al lato esterno del vaso.
- Creare otto siti di puntura, quattro sulle estremità prossimali e quattro sulle estremità distali dell'arteria femorale.
- Assicurarsi che i siti di puntura si trovino nei punti anteriore, posteriore, sinistro e destro del vaso, con i siti corrispondenti alle estremità distale e prossimale. Quando si selezionano questi punti, assicurarsi che il vaso sia accessibile, evitare strutture anatomiche critiche e mantenere un buon flusso sanguigno durante l'anastomosi.
- Rendere il diametro della puntura abbastanza piccolo da ridurre al minimo i danni al recipiente, ma abbastanza grande per le procedure necessarie. Un ago da sutura 12-0 viene generalmente utilizzato per la puntura.
- Tagliare quattro lunghezze di sutura 12-0, ciascuna lunga 3-4 cm, e infilarle ciascuna attraverso il foro di puntura corrispondente. Inizia con il fare un nodo sciolto per evitare di aggrovigliare i punti di sutura.
- Rimuovere la sutura 6-0 utilizzata per il supporto del vaso e legare saldamente i nodi. Rilasciare la pinza emostatica al termine dell'anastomosi.
- Raschiare delicatamente l'arteria femorale con una pinza curva dall'estremità prossimale a quella distale per verificare la pervietà, assicurandosi che il sangue scorra liberamente attraverso il vaso. Inoltre, ispezionare attentamente il sito dell'anastomosi per eventuali segni di perdite evidenti.
3. Sutura postoperatoria
- Sutura la pelle dell'arto inferiore utilizzando una sutura chirurgica 6-0, impiegando una sutura interrotta per garantire un allineamento preciso e un'approssimazione sicura del tessuto. Dopo aver suturato la ferita, applicare la tintura di iodio sull'area suturata per disinfettare la ferita e ridurre ulteriormente il rischio di infezione.
- Mantenere le condizioni sterili dopo l'intervento chirurgico. Non lasciare l'animale incustodito fino a quando non ha riacquistato sufficiente coscienza per mantenere la decubito sternale. Non restituire gli animali che hanno subito un intervento chirurgico alla compagnia di altri animali fino a quando non si sono completamente ripresi.
4. Osservazione e campionamento postoperatorio
- Ispezionare regolarmente il sito chirurgico per eventuali segni di infiammazione, gonfiore eccessivo o secrezione. Documentare le condizioni dell'animale e fornire cure adeguate, se necessario.
- A 4 settimane dall'intervento, sopprimere umanamente i topi in conformità con le linee guida etiche approvate. Per l'eutanasia, somministrare un sovradosaggio di pentobarbital sodico (150 mg/kg, iniezione intraperitoneale), garantendo un endpoint indolore e umano. Una volta confermata l'incoscienza e la cessazione dei riflessi, iniziare la raccolta dei tessuti.
NOTA: Negli studi preliminari, abbiamo scoperto che la raccolta dei campioni durante la3a settimana o prima non favoriva la formazione di iperplasia intimale. Al contrario, la raccolta di campioni alla 5asettimana ha portato a un'eccessiva iperplasia intimale. Questa crescita eccessiva non solo ha impedito l'osservazione di esperimenti successivi, ma ha anche posto potenziali rischi per la salute dei topi. Quindi la 4asettimana è stata selezionata qui. - Raccogliere campioni di arteria femorale, centrati sul sito dell'anastomosi, che si estendono per circa 1 cm in entrambe le direzioni dall'anastomosi. Usando le forbici sottili, asportare l'arteria femorale insieme a tutto il tessuto muscolare circostante.
- Dopo l'escissione, sciacquare il campione in PBS per rimuovere il sangue residuo, quindi fissarlo in formalina neutra al 10% per 1-2 giorni per un'ulteriore conservazione e analisi.
NOTA: Una formalina neutra al 10% è una scelta classica per la fissazione dei tessuti, reticolando efficacemente le proteine e preservando l'integrità della struttura tissutale, rendendola particolarmente adatta per la conservazione a lungo termine dei tessuti. Al contrario, la paraformaldeide al 4% (PFA) è un fissativo più blando che è più adatto per la conservazione più fine delle strutture intracellulari (come acidi nucleici e proteine) ed è comunemente usato per l'immunoistochimica o l'analisi di immunofluorescenza. Lo scopo principale di questo studio è osservare i cambiamenti istologici nei vasi sanguigni (come l'iperplasia intimale e il rimodellamento vascolare) piuttosto che la localizzazione precisa di molecole o proteine intracellulari. Pertanto, l'effetto di fissazione della formalina è sufficiente a soddisfare le esigenze sperimentali. Se la ricerca richiede una maggiore fedeltà molecolare (come la conservazione di RNA o proteine), il PFA può essere una scelta migliore.
5. Disidratazione e incorporamento dell'arteria femorale
- Dopo il fissaggio, posizionare i campioni in scatole di inclusione. Sciacquare i campioni dell'arteria femorale con acqua corrente per 6-8 ore prima di essere processati per la disidratazione dei tessuti utilizzando un processore di tessuti automatizzato.
- Versare la paraffina fusa negli stampi da inclusione, sollevare con cura l'arteria femorale utilizzando una pinza riscaldata e incorporarla verticalmente nello stampo contenente la paraffina fusa. Separare il coperchio e il fondo della scatola di inclusione, con il fondo posizionato sopra lo stampo di inclusione. Aggiungere una piccola quantità di paraffina fusa per fissarla in posizione, fungendo da base per il blocco di paraffina. Le bolle d'aria devono essere evitate meticolosamente.
- Quando il blocco di cera si è raffreddato al punto da formare una pellicola di cera trasparente sulla superficie, posizionarlo su un tavolo di congelamento per farlo raffreddare rapidamente.
- Rimuovere il blocco di cera incorporato dallo stampo di inclusione e tagliare accuratamente la paraffina in eccesso che circonda il blocco di tessuto utilizzando una lama affilata.
6. Preparazione di sezioni di paraffina dell'arteria femorale
- Montare la lama sul microtomo, assicurandosi che il coltello sia affilato per il sezionamento.
- Fissare il blocco di paraffina sul supporto e regolare il blocco rispetto alla lama nella posizione appropriata per il sezionamento.
- Tagliare il blocco per assicurarsi che il tessuto incorporato possa essere completamente sezionato. Impostare lo spessore delle sezioni iniziali a 15-20 μm.
- Regolare lo spessore della sezione a circa 4 μm e procedere con il sezionamento.
- Sollevare delicatamente le sezioni con un pennello e trasferirle con una pinzetta fine specializzata in una scatola di scorrimento riempita con acqua tiepida (circa 45 °C) per facilitare il galleggiamento.
- Trasferire le sezioni di stesura sui vetrini del microscopio. Posizionare gli scivoli con un angolo di 45° per drenare l'acqua in eccesso. Successivamente, mettere le diapositive in forno ad asciugare, tipicamente a 37 °C per 2 ore, quindi cuocere a 60 °C per 1 ora.
7. Colorazione ematossilina-eosina
- Idratare le sezioni utilizzando una serie di concentrazioni graduali di etanolo, tra cui etanolo assoluto, etanolo al 95%, 80% e 70%, con ogni passaggio che dura circa 5 minuti. Successivamente, sciacquare le sezioni con acqua distillata per rimuovere eventuali residui di etanolo.
- Macchiare le sezioni con ematossilina per circa 8-10 minuti e lavare accuratamente 3 volte con acqua corrente per rimuovere la macchia in eccesso.
- Per differenziare le sezioni colorate, applicare una soluzione alcolica di acido cloridrico all'1% per un breve periodo di 5-7 s.
- Per intensificare il colore blu, trattare le sezioni con una soluzione di ammoniaca 1:400 per 1 minuto.
- Dopo l'immersione in etanolo al 75%, colorare le sezioni con eosina per 36 s. Dopo la colorazione, disidratare in sequenza le sezioni con una serie crescente di concentrazioni di etanolo (80%, 90%, 95% e 100%), con ogni passaggio della durata di 3-5 s.
- Infine, cuocere le sezioni a 37 °C in forno per 10 minuti, applicare un paio di gocce di sigillante su un vetrino, coprire il campione con un vetrino per fissarli in posizione e lasciarlo asciugare naturalmente all'aria.
Risultati
Nella chirurgia dell'anastomosi vascolare, la lesione meccanica della parete del vaso può attivare le cellule intimali e innescare la proliferazione. I cambiamenti nella velocità e nella direzione del flusso sanguigno dopo l'anastomosi possono anche stimolare la proliferazione delle cellule intimali. Il processo di rimodellamento vascolare e l'instabilità a lungo termine del flusso sanguigno possono anche stimolare in modo persistente le cellule intimali, portando infine all'ispessimento.
Per confermare il successo del modello di anastomosi dell'arteria femorale, è stata eseguita la colorazione con ematossilina ed eosina sulle sezioni dell'arteria femorale prelevate. È stata osservata la presenza di una significativa iperplasia intimale, che indica il successo del rimodellamento vascolare e conferma il successo della procedura di anastomosi (Figura 1A).
Per valutare l'iperplasia intimale, sono stati contrassegnatie identificati i confini delle strutture vascolari chiave, tra cui il lume, la lamina elastica interna (IEL) e la lamina elastica esterna (EEL). Sulla base di questi confini, le misurazioni dell'area sono state eseguite utilizzando un software di analisi delle immagini. L'area intimale è stata calcolata misurando l'area totale racchiusa dall'IEL e sottraendo l'area del lume per ottenere l'area effettiva della regione intimale. L'area mediale è stata determinata misurando l'area totale racchiusa dall'EEL e sottraendo l'area dell'IEL, ottenendo l'area effettiva della regione mediale. Per valutare l'entità dell'iperplasia intimale, è stato calcolato il rapporto tra l'area intimale e l'area mediale (rapporto intimale/mediale), fornendo una rappresentazione chiara e quantitativa del grado di ispessimento intimale (Figura 1B).
Il rilevamento specifico del marcatore endoteliale vascolare CD31 e del marcatore della muscolatura liscia α-SMA è stato eseguito utilizzando il metodo di colorazione immunoistochimica sia nel gruppo di controllo normale che nel gruppo sperimentale dopo l'intervento chirurgico di anastomosi dell'arteria femorale (Figura 2).
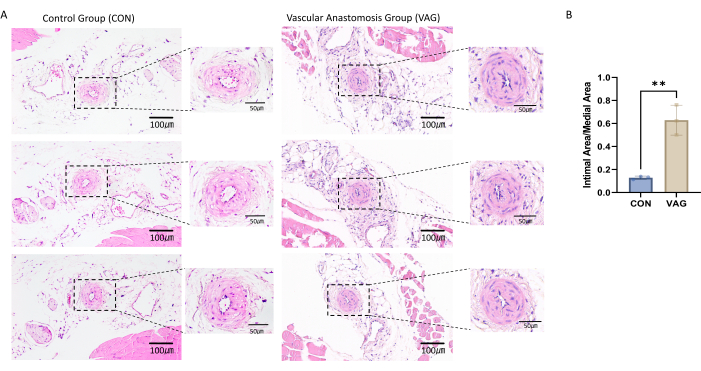
Figura 1: Colorazione con ematossilina ed eosina della sezione di tessuto anastomotico dell'arteria femorale. (A) Dopo 4 settimane di intervento chirurgico, sono stati prelevati campioni di arteria femorale dall'arto posteriore sinistro del topo. Il tessuto arterioso è stato immerso in paraffina e sezionato a uno spessore di 4 μm. Sulle sezioni sono state eseguite colorazioni con ematossilina ed eosina, rivelando una significativa iperplasia intimale nell'arteria femorale. (B) L'istogramma statistico ha mostrato che il rapporto tra neointima e media aumentava significativamente nei vasi anastomotici. I dati sono presentati come media ± errore standard della media (SEM). La significatività statistica è stata valutata utilizzando il t-test indipendente. L'asse y rappresenta il rapporto tra l'area intimale e l'area mediale, espresso in percentuale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Analisi immunoistochimica dei marcatori endoteliali vascolari e della muscolatura liscia dopo un intervento chirurgico di anastomosi dell'arteria femorale. L'analisi immunoistochimica ha rivelato alterazioni nella morfologia e nella distribuzione delle cellule endoteliali vascolari marcate con CD31, nonché la proliferazione postoperatoria di cellule muscolari lisce marcate con α-SMA, sia nel gruppo normale che in quello chirurgico. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'anastomosi vascolare è una tecnica cruciale nella chirurgia di ricostruzione vascolare, con il suo modello animale che svolge un ruolo chiave nello studio dei meccanismi della restenosi postoperatoria. Questo modello offre un approccio controllato allo studio dei cambiamenti patologici vascolari, in particolare nella comprensione dell'origine delle cellule iperproliferanti nella neointima durante la restenosi. La fonte della proliferazione delle cellule muscolari lisce (SMC) diventa una questione cruciale quando si verifica una grave lesione arteriosa dopo anastomosi vascolari, con conseguente apoptosi delle SMC nei media. Le SMC derivate dai mezzi dei vasi sanguigni non sono le uniche coinvolte; le cellule staminali nell'avventizia possono anche differenziarsi in nuove SMC, contribuendo potenzialmente all'iperplasia neointimale15. Sono state sollevate domande sull'origine di queste cellule, se provengono da SMC esistenti o cellule staminali, o se altre cellule avventiziali, come le cellule staminali, svolgono un ruolo attraverso la proliferazione, la migrazione e la differenziazione. Il modello sperimentale di anastomosi arteriosa è uno strumento prezioso per studiare la migrazione delle cellule avventiziali nella neointima e la loro trasformazione in SMC a seguito di lesione arteriosa. Distruggendo chirurgicamente i vasi, anche lo strato elastico viene distrutto, consentendo alle cellule avventiziali di migrare verso lo strato interno. Questo modello offre importanti informazioni sui meccanismi cellulari coinvolti nella risposta alla lesione arteriosa. Ogni manovra precisa durante la procedura di anastomosi vascolare ha un impatto critico sull'integrità vascolare e sul successo complessivo del modello chirurgico. Quando si estende l'arto posteriore del topo, evitare di raddrizzarsi eccessivamente, poiché una tensione eccessiva può danneggiare l'elasticità dell'arteria, complicando la sutura successiva e portando potenzialmente a microlacerazioni nella parete del vaso, che potrebbero compromettere il flusso sanguigno e il tasso di successo dell'anastomosi. Durante la dissezione e l'isolamento, è essenziale distinguere attentamente l'arteria, la vena e il nervo, evitando in particolare qualsiasi danno alla vena. La lesione venosa può causare sanguinamento eccessivo, ostruendo il campo chirurgico e aumentando la complessità della procedura. Dopo aver isolato l'arteria femorale, bloccare le estremità prossimale e distale con una pinza emostatica fine, facendo attenzione a non allungare il vaso. Questa precauzione riduce al minimo i danni alla parete del vaso e, dopo aver rilasciato i morsetti, consente al flusso sanguigno di riprendere gradualmente, riducendo lo stress delle cellule endoteliali e i potenziali danni.
La scelta della sutura appropriata è fondamentale per preservare l'integrità dei vasi e garantire un'anastomosi regolare. Le dimensioni e il tipo di sutura devono essere in linea con i requisiti specifici del vaso da maneggiare. La selezione di una lunghezza appropriata di sutura 6-0 per sostenere l'arteria è un passaggio fondamentale. Una lunghezza eccessiva della sutura può sfregare contro le piccole clip emostatiche e causare lesioni endoteliali. Inoltre, durante la sutura vascolare, assicurarsi che l'ago passi dalla parete interna a quella esterna del vaso con un unico movimento per ridurre al minimo il trauma endoteliale. Questo passaggio è fondamentale, poiché il danno endoteliale aumenta il rischio di trombosi postoperatoria e influisce sulle successive valutazioni funzionali del vaso16. Ogni punto di puntura deve essere allineato con precisione, con fori simmetrici sia sull'estremità prossimale che su quella distale. Regolare il numero di punti in base al diametro del recipiente; Ad esempio, i vasi più piccoli possono richiedere meno punti di sutura (ad esempio, tre invece di quattro) per ridurre la densità della sutura, prevenire l'ostruzione del flusso sanguigno e garantire la pervietà del modello per ulteriori analisi. La scelta di una sutura 12-0 è essenziale per ridurre il trauma alla parete del vaso, poiché il suo profilo sottile riduce al minimo l'impatto fisico sulla struttura vascolare e preserva l'integrità delle cellule endoteliali, che è fondamentale per la guarigione postoperatoria e la pervietà del flusso sanguigno. L'uso di una sutura più sottile aiuta a mantenere l'integrità strutturale all'interno del vaso modello, che supporta un flusso sanguigno sostenuto e fornisce una base affidabile per le analisi successive. Durante tutto il processo di sutura, mantenere una tensione costante nella sutura per evitare allentamenti o irrigidimenti eccessivi, che potrebbero limitare il flusso sanguigno locale.
Dopo aver rimosso la pinza emostatica, può verificarsi una lieve perdita di sangue, che è prevista; Tuttavia, il mantenimento di un flusso sanguigno continuo è fondamentale per la stabilità a lungo termine del modello. L'osservazione postoperatoria è essenziale per garantire il successo del modello. Durante le 4 settimane successive all'intervento chirurgico, la salute generale del topo deve essere attentamente monitorata, compreso il controllo di sanguinamento, infezione o trombosi nel sito chirurgico, per garantire la sopravvivenza e l'assenza di complicanze importanti. L'osservazione costante del flusso sanguigno nel sito chirurgico non solo verifica la pervietà dell'anastomosi, ma fornisce anche un supporto di alta qualità per ulteriori analisi, stabilendo una solida base per l'applicazione del modello in studi a lungo termine.
In questo studio, miriamo a valutare la stenosi anastomotica causata da danno vascolare e iperplasia intimale dopo rivascolarizzazione. Sebbene il modello murino fornisca preziose informazioni sulla risposta biologica iniziale al danno vascolare, ci sono limitazioni intrinseche alla sua applicabilità nell'imitare le condizioni vascolari umane. In primo luogo, la progressione dell'iperplasia intimale nei topi, tipicamente osservata nell'arco di poche settimane, potrebbe non replicare completamente lo sviluppo cronico osservato nell'uomo nel corso di mesi o anni, il che limita la valutazione dei cambiamenti vascolari a lungo termine17. Inoltre, le differenze fisiologiche tra i sistemi vascolari di topo e umani, comprese le variazioni nelle dimensioni dei vasi, nei tassi di guarigione e nelle risposte cellulari, presentano sfide per l'applicazione traslazionale diretta dei risultati. Anche il controllo preciso della gravità della lesione nell'arteria femorale del topo è impegnativo, poiché piccole deviazioni nella tecnica chirurgica possono avere un impatto significativo sulla risposta del vaso, introducendo variabilità nei risultati. Infine, le esigenze microchirurgiche di lavorare su piccoli vasi aumentano la complessità tecnica e il rischio di lesioni incoerenti, che possono influire sulla riproducibilità dei risultati. Questi fattori sottolineano collettivamente la necessità di un'attenta interpretazione dei risultati di questo modello quando si considera la loro rilevanza per la fisiopatologia vascolare umana.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Vorremmo estendere i nostri sinceri ringraziamenti al Prof. Qingbo Xu e a Yanhua Hu dell'Università di Zhejiang per la loro preziosa assistenza tecnica. Questo lavoro è stato sostenuto dalla National Natural Science Foundations of China (numeri di sovvenzione 82070502 e 32171099), dal Sichuan Science and Technology Program (numeri di sovvenzione 2025HJRC0035, 2024NSFSC0709) e dal progetto congiunto Luzhou-Southwest Medical University (2024LZXNYDJ021, 2024LZXNYDJ014)
Materiali
| Name | Company | Catalog Number | Comments |
| 6-0 Nylon Suture with Needle | Ningbo Chenghe | 240102 | |
| 12-0 Nylon Suture with Needle | Ningbo Lingqiao | 22064 | |
| Electro-heating standing-temperature incubator | Shanghai Boxun | HPX-9272MBE | |
| Eosin Staining Solution | Servicebio | G1005-2 | |
| Formaldehyde Solution | KESHI | 50-00-0 | |
| Hematoxylin Staining Solution | Servicebio | G1005-1 | |
| Heparin Sodium | Solarbio | H8060 | |
| MAGSCANNER KF-PRO-002 | KFBIO | KFPBL00200107003 | |
| Mounting medium | Wuxi Jiangyuan | 220810 | |
| OLYMPUS SZ2-ILST | OLYMPUS CORPORATION | SN 9B40828 | |
| Paraffin embedding machine | YAGUANG | YB-7LF | |
| Phosphate-Buffered Saline | Solarbio | P1010 |
Riferimenti
- Haruguchi, H., Teraoka, S. Intimal hyperplasia and hemodynamic factors in arterial bypass and arteriovenous grafts: A review. J Artificial Organs. 6 (4), 227-235 (2003).
- Huang, C., et al. Outcome and risk factors of restenosis post percutaneous transluminal angioplasty at juxta-anastomotic of wrist autogenous radial-cephalic arteriovenous fistulas: A retrospective cohort study. Ann Vas Surg. 93, 234-242 (2023).
- Pruthi, N., Tyagi, G., Gohil, D. End-to-side microvascular anastomosis on rat femoral vessels using only 2-throw knot interrupted sutures - evaluation of feasibility and patency rates on rat femoral vessels model. World Neurosurg. 148, e145-e150 (2021).
- Yücel, H. C., et al. Effectiveness of 1α-25-dihydroxyvitamin d3 active substance on anastomosis safety in the rat femoral artery end-to-end anastomosis experimental model: Macroscopic and histological analyses. J Plastic Reconstruct Aesthetic Surg. 97, 310-319 (2024).
- Godden, D. R. P., Little, R., Weston, A., Greenstein, A., Woodwards, R. T. M. Catecholamine sensitivity in the rat femoral artery after microvascular anastomosis. Microsurgery. 20 (5), 217-220 (2000).
- Lu, Y., et al. Endothelial ripk1 protects artery bypass graft against arteriosclerosis by regulating smc growth. Sci Adv. 9 (35), e8939 (2023).
- Ghista, D. N., Kabinejadian, F. Coronary artery bypass grafting hemodynamics and anastomosis design: A biomedical engineering review. Biomed Eng Online. 12 (1), 129 (2013).
- Surovtsova, I. Effects of compliance mismatch on blood flow in an artery with endovascular prosthesis. J Biomech. 38 (10), 2078-2086 (2005).
- Matsuura, S., et al. Effect of drug-coated balloons in treatment of stenosis of the femoral artery and vein bypass graft not responding to plain old balloon angioplasty: A case report. Surg Case Rep. 5 (1), 204 (2019).
- Funk, S. D., Yurdagul, A., Orr, A. W. Hyperglycemia and endothelial dysfunction in atherosclerosis: Lessons from type 1 diabetes. Int J Vas Medicine. 2012, 1-19 (2012).
- Akelina, Y. Ballestín Aeds. Microsurgery 101. , (2024).
- Curaj, A., Zhoujun, W., Staudt, M., Liehn, E. A. Induction of accelerated atherosclerosis in mice: The "wire-injury" model. J Vis Exp. (162), e54571 (2020).
- Oh, J. G., Ishikawa, K. Experimental models of cardiovascular diseases: Overview. Methods Mol Biol. 1816, 3-14 (2018).
- Lipke, E. A., West, J. L. Localized delivery of nitric oxide from hydrogels inhibits neointima formation in a rat carotid balloon injury model. Acta Biomater. 1 (6), 597-606 (2005).
- Dong, Z. F., et al. Role of smooth muscle progenitor cells in vascular mechanical injury and repair. Medicine Novel Technol Devices. 16, 100178 (2022).
- Yau, J. W., Teoh, H., Verma, S. Endothelial cell control of thrombosis. BMC Cardiovasc Disord. 15, 130 (2015).
- Jia, G., Aroor, A. R., Jia, C., Sowers, J. R. Endothelial cell senescence in aging-related vascular dysfunction. Biochim Biophys Acta. 1865 (7), 1802-1809 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon