Method Article
Использование сборки in vivo для высокоэффективного конструирования плазмид
В этой статье
Резюме
Сборка in vivo — это независимый от лигирования метод клонирования, который основан на собственных ферментах репарации ДНК у бактерий для сборки фрагментов ДНК путем гомологичной рекомбинации. Этот протокол является как быстрым, так и экономически эффективным, так как требуется небольшое количество реагентов, а эффективность клонирования может достигать 99 %.
Аннотация
Сборка in vivo (IVA) — это метод молекулярного клонирования, при котором используются собственные ферменты, присутствующие в бактериях, способствующие межмолекулярной рекомбинации фрагментов ДНК для сборки плазмид. Этот метод работает путем преобразования фрагментов ДНК с областями гомологии 15-50.н. в широко используемые лабораторные штаммы Escherichia coli , и бактерии используют независимый от RecA путь репарации для сборки фрагментов ДНК в плазмиду. Этот метод является более быстрым и экономически эффективным, чем многие методы молекулярного клонирования, которые основаны на сборке плазмид in vitro до трансформации в штаммы E. coli . Это связано с тем, что методы in vitro требуют закупки специализированных ферментов и проведения последовательных ферментативных реакций, требующих инкубации. Однако, в отличие от методов in vitro , экспериментально не было показано, что НДС собирает линейные плазмиды. В этой статье мы рассказываем о протоколе IVA, используемом нашей лабораторией для быстрой сборки плазмид и субклонирования фрагментов ДНК между плазмидами с различным происхождением репликации и маркерами устойчивости к антибиотикам.
Введение
Молекулярное клонирование включает в себя ряд лабораторных методов, необходимых для получения плазмид, содержащих специфическую рекомбинантную ДНК1. Эти вездесущие методы часто выступают в качестве узкого места в экспериментальном рабочемпроцессе2. Многие методы молекулярного клонирования основаны на сборке фрагментов ДНК in vitro с использованием серии ферментативных реакций перед превращением в штамм-хозяин (например, Escherichia coli DH5a) для амплификации 3,4,5,6,7. Поскольку методы сборки плазмид in vitro основаны на ферментах, покупка или очистка ферментов может быть как дорогостоящей, так и трудоемкой.
Сборка in vivo (IVA) представляет собой метод молекулярного клонирования, основанный на межмолекулярной рекомбинации фрагментов ДНК в подходящем хозяине 8,9,10,11,12. В основе этого метода лежало наблюдение о том, что широко используемые повторно клонирующие штаммы E. coli могут опосредуть межмолекулярную рекомбинацию одноцепочечного праймера с плазмидой, расщепленной ферментами рестрикции13. Использование ПЦР для получения гомологичных концов ДНК для сборки плазмид у E. coli было описано в 1990-х годах, и этот метод получил название рекомбинационная ПЦР 3,14. Сообщалось, что эффективность рекомбинационной ПЦР составила около 50%14. Тем не менее, этот метод не получил широкого распространения, вероятно, из-за высокой стоимости праймеров и риска введения нежелательных мутаций с использованием полимераз низкой точности для амплификации больших фрагментов ДНК. Эти недостатки были значительными в 1990-х годах, и их можно было избежать, используя методы клонирования in vitro, такие как клонирование, опосредованное рестрикцией ферментов.
В последние годы стоимость праймеров снизилась, а новые коммерческие полимеразы повысили точность амплификации ПЦР. В результате рекомбинационная ПЦР была пересмотрена в качестве быстрого и экономически эффективного метода молекулярного клонирования и переименована в IVA 2,9,15,16. В связи с повышением осуществимости НДС был дополнительно изучен и метод был оптимизирован для достижения эффективности клонирования до 99%16. В ходе оптимизаций были выявлены особенности гомологичной ДНК, такие как количество пар оснований и температура плавления, которые максимизируют эффективность рекомбинации in vivo 2,16. Дальнейший анализ показал, что до 6 фрагментов ДНК в диапазоне от 150 до 7.н. могут быть эффективно собраны с помощью IVA15. Кроме того, наша группа недавно использовала IVA для сборки серии плазмид с различными кассетами с устойчивостью к антибиотикам и истоками репликации17. В этом исследовании клонирование IVA было высокоэффективным (71-100%) с небольшим числом клонов, протестированных для каждой плазмиды (n = 2)17. Здесь мы опишем протокол IVA, используемый в нашей лаборатории.
протокол
1. Спроектируйте праймеры или фрагменты ДНК с гомологичными концами
- Используйте программное обеспечение для обработки текстов или специализированное программное обеспечение для анализа ДНК, чтобы искусственно собрать желаемую плазмиду.
ПРИМЕЧАНИЕ: Часто бывает полезно пометить цветом фрагменты ДНК из разных источников и выделить гомологичные области, которые будут использоваться на последующих этапах сборки. Кроме того, также полезно маркировать гомологичную ДНК цветом, чтобы обеспечить направленную сборку. - Дизайн-праймеры, которые связываются с каждым фрагментом ДНК и содержат 15-50.н. гомологичной последовательности ДНК (рис. 1)2,15.
- Для повышения эффективности ИВА убедитесь, что гомологичные фрагменты ДНК имеют температуру плавления 47-52 °С2.
ПРИМЕЧАНИЕ: Температура плавления может быть определена с помощью онлайнового программного обеспечения18 или по формуле: Температура плавления = 64,9 + 41 * (nG + nC - 16,4)/(nA + nT + nG + nC), где n = количество G, C, A или T в последовательности 6,19. - Избегайте праймеров с часто повторяющимися последовательностями, такими как CATCATCATCATCAT, которые кодируют для HIS-метки, так как они могут привести к нестабильности20. Если для таких применений, как вставка поли-ГИС метки, требуется окончательная повторяющаяся аминокислотная последовательность, используйте альтернативные кодоны, такие как CATCACCATCACCAC, чтобы уменьшить повторение последовательности нуклеиновых кислот.
ПРИМЕЧАНИЕ: Грунтовки можно заказать у любого предпочтительного поставщика. Если предполагается синтезировать фрагменты ДНК, то в синтезированный фрагмент ДНК должны быть включены гомологичные концы.
- Для повышения эффективности ИВА убедитесь, что гомологичные фрагменты ДНК имеют температуру плавления 47-52 °С2.
2. Амплификация продуктов ДНК, содержащих гомологичные концы
- Изолируйте плазмидную ДНК или матрицы геномной ДНК с помощью стандартных коммерчески доступных наборов для выделения ДНК или щелочного лизиса 6,17.
- Используйте матрицу ДНК (из шага 2.1) и праймеры, содержащие гомологичные участки (шаг 1.2), в реакции ПЦР с коммерчески доступной полимеразой высокой точности. Чтобы ограничить перенос матриц ДНК в последующих реакциях, используйте небольшое количество матричной ДНК (20 пг-1 нг) в каждой реакции. Обратитесь к рекомендациям производителя по компонентам ферментоспецифичной реакционной смеси ПЦР и рекомендуемым условиям циклирования ПЦР. Приступайте к ПЦР-реакции.
- Настройте реакции ПЦР (50 μL) для амплификации фрагментов ДНК, показанных на рисунке 2 , чтобы они содержали 100 μM dNTP, 0,2 μM каждого праймера ДНК, матричную ДНК (50 пг pSU19 и 1 нг pSU18mCherry), 1x реакционную буферную смесь для ПЦР, содержащую Mg2+ (конечная концентрация 2 мМ), и 1 U высокоточной ДНК-полимеразы.
- Используйте программу циклического тачдауна ПЦР для амплификации pSU19 и mCherry (Рисунок 2). Установите начальную стадию денатурации на уровне 95 °C в течение 5 минут, затем 10 циклов при 95 °C в течение 15 с, 55 °C-0,5 °C за цикл в течение 15 с и 72 °C в течение 1 мин, а затем 20 дополнительных циклов при 95 °C в течение 15 с, 50 °C в течение 15 с и 72 °C в течение 1 мин. Завершите цикл ПЦР заключительным этапом удлинения при температуре 72 °C в течение 10 минут.
ПРИМЕЧАНИЕ: Если плазмидный остов должен быть амплифицирован, отрегулируйте количество матрицы ДНК в зависимости от молекулярной массы: ~20 пг/1.н. плазмидной ДНК на 50 мкл ПЦР-реакции (50 пг ДНК для pSU19 (показано)). Кроме того, корректируйте циклы ПЦР таким образом, чтобы свести к минимуму количество мутаций, вносимых при амплификации: для амплификации плазмидных остов достаточно всего 20-25 циклов ПЦР.
- После завершения ПЦР-реакции удалите аликвоту (2 мкл) ПЦР-реакции, соедините с загрузочным красителем (до концентрации 1x) и разделите фрагменты ДНК с помощью электрофореза в агарозном геле21. Используйте ультрафиолетовый (УФ) или светодиодный трансиллюминатор для визуализации фрагментов ДНК, которые мигрировали в агарозном геле. Определите, являются ли продукты ПЦР уникальными, и сравните продукты с лестницей ДНК, чтобы проверить, имеют ли они ожидаемую молекулярную массу (Рисунок 2). Если продукты ПЦР правильной молекулярной массы не визуализируются, обратитесь к рекомендациям производителя по оптимизации ПЦР-реакции.
ПРИМЕЧАНИЕ: Когда продукты ПЦР не являются уникальными, но имеется большое количество фрагментов ДНК, соответствующих ожидаемой молекулярной массе, можно избежать дополнительной реакции ПЦР. - Если в агарозном геле присутствует несколько фрагментов ДНК, вырежьте из агарозного геля фрагмент ДНК, соответствующий ожидаемой молекулярной массе, и используйте набор для экстракции агарозного геля для восстановления фрагмента ДНК.
- Чтобы удалить метилированную матричную ДНК из реакций ПЦР, добавьте 1 мкл DpnI непосредственно в реакционную пробирку. Инкубируйте реакции при температуре 37°C в течение 15 минут или на ночь.
ПРИМЕЧАНИЕ: Этот необязательный шаг настоятельно рекомендуется для ограничения количества матричной ДНК, которая переносится вперед в последующих реакциях. Однако этот этап можно пропустить, если в реакции ПЦР используются очень низкие концентрации матричной ДНК. - Используйте набор для очистки нуклеиновых кислот для удаления остаточных ферментов, солей, димеров праймеров и других нежелательных низкомолекулярных продуктов ДНК, полученных в результате ферментативных анализов.
ПРИМЕЧАНИЕ: Шаги 2.1-2.6 можно пропустить, если синтезируются фрагменты ДНК. - Количественно оцените концентрацию ДНК в очищенных фрагментах ДНК с помощью спектрофотометрии или оценки геля.
3. НДС (Рисунок 3)
- Рассчитайте количество ДНК, необходимое для каждой реакции IVA (рекомендуется 25-50 нг плазмидной ДНК). Используйте большее количество плазмидной ДНК для плазмид с более высокой молекулярной массой (например, для плазмид 2,3.н. используйте 25 нг плазмиды, но если плазмиды 9.н., используйте 50 нг в каждой реакции). Рассчитать объем вставной ДНК, необходимый для проведения реакции; используйте молярное соотношение плазмиды ДНК 1:3 или 1:5.
ПРИМЕЧАНИЕ: Онлайн-калькуляторы биографии или формулы, представленные ниже, могут быть использованы для расчета молярного количества двухцепочечного фрагмента ДНК и определения молярного соотношения каждого фрагмента ДНК.
Для расчета молярного количества двухцепочечного фрагмента ДНК мы используем следующую формулу: pmol = (вес в нг) × 1000 / (пары оснований × 650 дальтон). Кроме того, молярные соотношения могут быть рассчитаны следующим образом: масса вставки (г) = желаемое отношение вставки/плазмиды моляров × масса плазмиды (г) × отношение вставки к длине плазмиды6. - Объедините рассчитанный объем плазмиды и вставьте ДНК в предварительно охлажденную микроцентрифужную пробирку объемом 1,5 мл и держите на льду.
- Перенесите плазмиду и вставьте смесь ДНК из стадии 3.2 в аликвоту (25-100 мкл) размороженной рекА-химически компетентной E. coli (например, E. coli DH5a;пункт 22).
ПРИМЕЧАНИЕ: Объем используемых компетентных клеток зависит от объема плазмиды и вставной смеси ДНК; Эта смесь не должна превышать 10% объема компетентных клеток. - Перейдите к преобразованию теплового шока23.
- Инкубируйте смесь химически компетентной кишечной палочки и ДНК на льду в течение 30 минут.
- Переложите на водяную баню при температуре 42 °C на 1 минуту, затем переложите трубку в лед на 2 минуты.
- Асептически перенесите LB в пробирку, чтобы довести объем до 1 мл.
- Перелейте объем объемом 1 мл в стеклянную пробирку для культивирования и поместите в инкубатор для встряхивания при температуре 37 °C, 220 об/мин или температуре, рекомендованной для восстановления бактериального штамма и/или плазмиды (типичный диапазон от 25 °C до 37 °C) и дайте возможность получить плазмидный маркер выбора антибиотика.
- После того как клетки восстановились в течение от 30 минут до 1 часа, нанесите аликвоту (100 мкл из 1000 мкл) реакции трансформации на твердую селекционную среду и используйте стерильный разбрасыватель клеток для диспергирования аликвоты по агаровой культуральной пластине. Соберите остальные трансформированные клетки центрифугированием (13 000 × г в течение 1 мин), выбросьте надосадочную жидкость, повторно суспендируйте клеточную гранулу в 100 мкл стерильной среды и положите на твердую отборную среду, как указано выше. Дайте жидкости впитаться в твердые среды в течение 30 минут, переверните тарелки для культивирования. и поместите их в инкубатор на ночь при температуре, рекомендованной для бактериального штамма и/или плазмиды.
4. Скрининг на правильность сборки плазмид
- После инкубации (шаг 3.5) извлеките из инкубатора культуральные планшеты и перечислите колонии путем прямого подсчета, если на каждой культуральной пластине имеется несколько изолированных колоний бактерий. Выберите несколько колоний (1-10) для скрининга, чтобы определить, содержат ли они желаемую собранную плазмиду.
- Перенесите стерильные питательные среды с добавлением соответствующих антибиотиков в стерильные пробирки для культивирования (стеклянные или пластиковые). Инокулируйте питательную среду, коснувшись 1 колонии стерильной переводной иглой или петлей, и перенесите клетки в питательную среду пробирки с помощью переводной иглы. Поместите пробирки с культуральными культурами в встряхивающий инкубатор и инкубируйте в течение 16-18 часов при температуре, рекомендованной для штамма бактерии и/или плазмиды (типичный диапазон от 25 °C до 37 °C).
- На следующий день выделите плазмидную ДНК из бактериальных культур методом щелочного лизиса6 или с помощью коммерчески доступного набора для выделения плазмид в соответствии с инструкциями производителя.
- Определите, правильно ли собраны плазмиды.
- Количественное определение концентрации ДНК выделенных плазмид с помощью спектрофотометрии или оценки геля.
- Используйте аликвоту (50-150 нг) плазмидной ДНК для диагностической реакции рестрикционного переваривания (конечный объем 10 мкл). Выбирайте ферменты рестрикции в зависимости от того, где они, как ожидается, будут расщеплять собранную плазмидную ДНК.
Примечание: Мы рекомендуем две отдельные реакции: (1) обработку плазмидной ДНК ферментом рестрикции, который, как ожидается, расщепляет плазмиду в одном месте, и (2) обработку плазмидной ДНК двумя ферментами рестрикции, которые, как ожидается, иссекут весь или часть вставленного фрагмента ДНК. Ферменты рестрикции имеются в продаже и должны использоваться в соответствии с инструкциями производителя. - Как только реакция фермента рестрикции завершена, соедините с загрузочным красителем (до концентрации 1x), загрузите всю смесь в агарозный гель и разделите фрагменты ДНК с помощью электрофореза21 агарозного геля. Используйте УФ- или светодиодный трансиллюминатор для визуализации фрагментов ДНК, которые мигрировали в агарозном геле. Сравните ограниченные фрагменты ДНК с лестницей молекулярной массы, чтобы определить, являются ли они ожидаемой молекулярной массой (рис. 4). Обратите внимание на плазмиды с ожидаемыми паттернами рестрикции ферментов (называемые положительными клонами); Выбросьте пробирки, содержащие плазмиды, которые не имеют ожидаемого характера рестрикции (называемые отрицательными клонами).
- Чтобы убедиться, что положительные клоны имеют ожидаемую последовательность нуклеотидов, отправьте аликвоту положительных плазмидных клонов на секвенирование.
ПРИМЕЧАНИЕ: Рекомендуется секвенирование всей плазмиды (например, секвенирование нанопор).
Результаты
В этой рукописи, в качестве примера использования IVA, мы следовали предусмотренному нами рабочему процессу IVA для повторного клонирования открытой рамки считывания mCherry в сайт множественного клонирования плазмиды pSU19 для создания плазмиды, идентичной pSU19mCherry (рис. 3)17. Праймеры, подходящие для ВВА, были разработаны на основе этапов протокола 1.1 и 1.2. Затем с помощью набора для выделения pSU19 и pSU18mCherry использовали набор для выделения плазмид, которые служили шаблонами для ПЦР-реакций по амплификации плазмидного скелета и вставке ДНК соответственно (шаг протокола 2.1). Плазмидный каркас pSU19 был амплифицирован методом ПЦР (пары праймеров: pSU19_F: TAGGGTACCGAGCTCGAATTC и pSU19_R CCCGGGGATCCTCTAGAGTC), а открытая рамка считывания mCherry была амплифицирована методом ПЦР из pSU18mCherry (пары праймеров mCherry_F: ctctagaggatccccgggATGGTATCAAAAGGAGAGGAAGGAAG и mCherry_R: gaattcgagctcggtaccctaTTATCATTACTTACAGTTC; строчные нуклеотидные последовательности в праймерах mCherry указывают на нуклеотиды, которые гомологичны праймерам, используемым для амплификации остова pSU19; шаг протокола 2.2). Специфическую амплификацию ПЦР верифицировали с помощью электрофореза в агарозном геле (шаг протокола 2.3; Рисунок 2) а ПЦР-препараты подвергались остальной части рабочего процесса дня 1 (этапы протокола 2.5-3.5; Рисунок 3).
На следующий день были пронумерованы колонии на трансформационной пластине (шаг протокола 4.1; Рисунок 3, день 2). В этом эксперименте было видно шесть колоний; количество колоний может быть увеличено путем нанесения большей аликвоты восстановленной культуры или увеличения количества ДНК, которая трансформируется в компетентные клетки. Если на трансформационных планшетах нет колоний, важно сначала убедиться, что компетентные клетки обладают высокой эффективностью трансформации. Мы добились успеха в использовании компетентных клеток с эффективностью трансформации от 10,7 до 10,9 колониеобразующих единиц/мкг трансформированной ДНК pUC19. Если эффективность трансформации не является проблемой, может потребоваться увеличение количества ДНК, трансформируемой в компетентные клетки, и/или увеличение объема компетентных клеток при проведении IVA с плазмидами с более высокой молекулярной массой или при сборке большого количества фрагментов ДНК.
Мы отобрали две колонии для скрининга на правильную сборку плазмид (этапы протокола 4.1-4.3.3). На следующий день мы следовали рабочему процессу для дня 3 (Рисунок 3). После выделения плазмид обработайте каждую плазмиду XbaI или XbaI и EcoRI, которые, как ожидается, расщепят правильно собранную плазмиду один или два раза (рис. 4). Как видно на рисунке 4, обе ферментативные реакции привели к образованию одного продукта ДНК, соответствующего 2,3.н. для плазмидного клона 1, что указывает на то, что это только pSU19. Ферментативная обработка плазмидного клона 2 привела к получению одного продукта ДНК ~3.н. после обработки XbaI и двух продуктов ДНК (2,3.н. и 770.н.) после обработки XbaI и EcoRI. Затем правильная сборка плазмидного клона 2 была проверена с помощью анализа секвенирования всей плазмиды (протокол шаг 4.4; Рисунок 3, день 3). В этом примере правильная эффективность сборки плазмид составила 50%. Мы редко проверяем более двух клонов на предмет правильной сборки плазмид и обычно имеем 50-100% эффективность сборки плазмид. По нашему опыту, отрицательные клоны обычно содержат либо (i) плазмидный каркас, перенесенный из матричной ДНК, которая повторно циркулировала, либо (ii) продукт гибридной ДНК, состоящий из матричной ДНК, которая рекомбинирована в гибридную плазмиду. ДпнI лечение (протокол шаг 2.5) ограничивает количество отрицательных клонов. Если это не повышает эффективность ВВС, рекомендуется проверить конструкцию праймера ПЦР и повторно амплифицировать плазмидные магистрали и продукты ПЦР.

Рисунок 1: Стратегия разработки праймера IVA. Первым шагом (Шаг 1) в проектировании праймера IVA является использование программного обеспечения для создания файла последовательности желаемой собранной плазмиды in silico. Второй шаг (Шаг 2) заключается в разработке праймеров, которые амплифицируют плазмидный остов вблизи соединения плазмиды и вставленной последовательности ДНК. Праймеры для вставной последовательности должны иметь достаточное количество нуклеотидов для специфического связывания и амплификации желаемого продукта ДНК и содержать 15-50.о. соседнего плазмидного остова для гомологичной рекомбинации. Области гомологии в плазмидном дизайне имеют цветовую кодировку. Сокращение: IVA = сборка in vivo . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
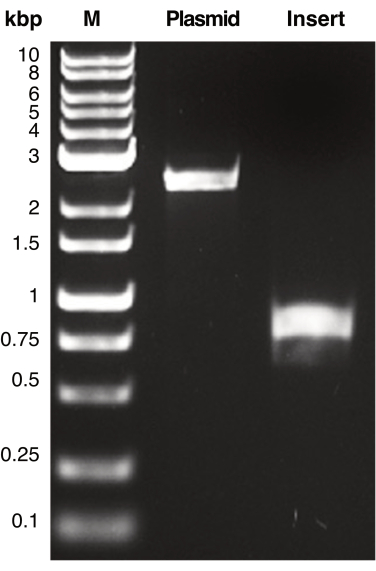
Рисунок 2: ПЦР-амплификация плазмиды и ДНК вставки. Показано репрезентативное изображение фрагментов ДНК, амплифицированных методом ПЦР, соответствующих плазмиде и вставной ДНК, содержащей участки гомологии. Фрагменты ДНК разделяли с помощью гель-электрофореза и визуализировали с помощью УФ-транслюминации. Продукты ДНК сравнивали с маркером молекулярной массы (М) для определения видимой молекулярной массы каждого продукта ПЦР. Ожидаемая молекулярная масса плазмиды (pSU19) и вставной ДНК (mCherry) составляет 2,3.н. и 770.н. соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Схема рабочего процесса сборки in vivo. ДНК амплифицируют методом ПЦР для создания 5' и 3' гомологичных областей. ДпнЛечение I используется для расщепления ДНК матрицы. Набор для очистки нуклеотидов используется для удаления солей и ферментов из ДНК, амплифицированной методом ПЦР. Для определения концентрации ДНК используется УФ-спектрофотометрия, а отношение вставки к молярам плазмиды 3:1 объединяется в предварительно охлажденную микрофуговую пробирку. Объединенная ДНК переносится в ледяную микропробирку, содержащую аликвоту размороженных компетентных клеток E. coli DH5α. ДНК преобразуется в E. coli DH5α с помощью теплового шока, наносится на твердую селекционную среду и инкубируется при 37 °C в течение 18 ч. После инкубации отдельные колонии, содержащие клоны плазмид, переносят в пробирки для культивирования, содержащие стерильную жидкую среду и антибиотик, затем инкубируют при 37 °С с перемешиванием в течение 18 ч. На следующий день плазмидная ДНК выделяется из клеток, и для скрининга положительных клонов используется лечение ферментами рестрикции. Затем положительные клоны отправляются на анализ секвенирования, чтобы подтвердить последовательность ДНК плазмид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Гель-электрофорез для скрининга положительных плазмидных клонов. Два различных плазмидных клона были выделены и обработаны ферментами рестрикции, которые, как ожидается, расщепят положительные клоны один раз для линеаризации плазмиды или два раза для высвобождения вставленной ДНК. После обработки ферментами рестрикции образцы разделяли с помощью гель-электрофореза и визуализировали с помощью УФ-транслюминации. Молекулярную массу оценивали путем сравнения с маркером молекулярной массы. Ожидаемая молекулярная масса линеаризованного положительного клона (плазмида + вставка) составила 3,07.н., а ожидаемая молекулярная масса фрагментов ДНК после двойного расщепления положительного клона составила 2,3.н. (плазмидный остов) и 770.о. (вставка). Клон плазмиды 1 является отрицательным (пустой плазмидой), а клон 2 является положительным клоном. Сокращения: SC = одинарная спайность; DC = двойное спайность; M = маркер молекулярной массы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Наиболее важным этапом для успешного клонирования IVA является разработка фрагмента ДНК и праймера. Эффективность IVA значительно повышается, когда гомологичные фрагменты имеют длину не менее 15.о. при температуре плавления примерно 47-52 °C. Опубликовано подробное исследование, посвященное оптимизации дизайна фрагментов IVA16. Еще одним важным шагом для достижения высокой эффективности клонирования является использование как можно меньшего количества матричной ДНК на этапах амплификации ПЦР. Чтобы еще больше уменьшить перенос матричной ДНК, мы обрабатываем наши послециклические ПЦР-реакции DpnI, чтобы расщепить метилированную матричную ДНК. Это может значительно уменьшить объем скрининга, необходимого для выделения положительного клона. По нашему опыту, при лечении DpnI нам нужно проводить скрининг только 1-2 колоний за одну трансформацию; без обработки DpnI нам нужно проводить скрининг 5-10 колоний за одну трансформацию.
Хотя мы и другие сообщали о клонировании IVA с получением большого количества колониеобразующих единиц16,17, возможно, что на трансформационных пластинах колоний нет. По нашему опыту, увеличение количества ДНК, преобразованной в компетентные клетки (особенно при работе с большим плазмидным каркасом) и/или увеличение объема используемых компетентных клеток может повысить эффективность трансформации. Если после корректировки количества ДНК или компетентных клеток колонии не видны, мы экспериментально подтверждаем эффективность трансформации компетентных клеток и секвенируем наши линейные фрагменты ДНК, чтобы подтвердить, что они содержат желаемые гомологичные участки. Следование этим шагам по устранению неполадок обычно повышает эффективность IVA.
Метод клонирования IVA имеет несколько ограничений. Они связаны с использованием ПЦР для амплификации конкретных фрагментов ДНК. Например, плазмидные опоры могут варьироваться по размеру, причем некоторые из них приближаются или превышают 10.н. в длину (например, pMMB67HE24, pFUSE25). Если желаемый плазмидный остов слишком велик или его трудно амплифицировать с помощью высокоточной корректурной полимеразы, все еще существует возможность линеаризации плазмиды с помощью ферментов рестрикции (например, SmaI или EcoRV) и использования линеаризованной плазмиды вместо продукта ПЦР для реакции ВВС16. По нашему опыту, эффективность IVA значительно снижается, если не достигается почти 100% линеаризация плазмид с помощью лечения рестрикционными ферментами.
Еще одним потенциальным ограничением IVA является стоимость, связанная с покупкой новых праймеров, содержащих гомологичные выступы ДНК для клонирования каждого уникального фрагмента ДНК. Эти затраты могут быть частично снижены, если лаборатория использует ограниченное количество плазмидных остов и может использовать универсальные праймеры для создания большой партии амплифицированной плазмидной основы для будущего клонирования IVA. Кроме того, если все плазмиды, используемые в лаборатории, имеют идентичные множественные сайты клонирования, то для всех плазмид можно использовать одни и те же универсальные праймеры. Еще одним ограничением метода IVA является то, что, насколько нам известно, он не был протестирован для сборки линейных плазмид, которые обычно используются для клонирования повторяющейся или нестабильной ДНК26.
IVA — это эффективный по времени и с минимальными затратами метод клонирования, который имеет ряд преимуществ по сравнению с другими методами молекулярного клонирования, основанными на сборке фрагментов ДНК in vitro. Как правило, это экономически выгодно, так как сборка плазмид не зависит от коммерчески приобретенных ферментов или буферов для сборки ДНК 4,5,27. Это экономит время и снижает затраты, поскольку исключаются типичные этапы ферментативной реакции, что может сэкономить до 72 часов лабораторных манипуляций 2,15. Кроме того, оборудование и реагенты, необходимые для IVA, как правило, уже присутствуют или доступны в лабораториях, которые регулярно проводят молекулярное клонирование.
Наша группа недавно использовала IVA для создания серии из 24 плазмид с идентичными множественными сайтами клонирования, тремя вариантами для числа копий плазмид и пятьювариантами для маркеров выбора антибиотиков. Мы продемонстрировали, как универсальные праймеры могут быть использованы для клонирования генов в каждую плазмиду17. В этом исследовании эффективность клонирования составила 71-100%, потому что очень небольшое количество колоний было проверено на выявление положительных клонов (семь из них были проверены на пять положительных клонов)17. В другом исследовании сообщалось, что эффективность клонирования IVA достигает максимума в 97% ± 1,9%, более высокий показатель можно объяснить тем, что авторы систематически тестируют большое количество клонов направильную сборку плазмид. IVA также может быть использован для таких приложений, как сайт-направленный мутагенез или интеграция праймеров, содержащих последовательности меток27. IVA — это универсальный и эффективный метод клонирования, который может быть адаптирован для многих рутинных применений молекулярного клонирования в лаборатории.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
HGB финансируется за счет стипендий для выпускников Канады - магистерской программы от Совета по естественным наукам и инженерным исследованиям Канады (NSERC) и докторской премии декана (Университет Саскачевана). Эта работа была поддержана грантом NSERC Discovery Grant (RGPIN-2021-03066), стартовыми фондами (для JLT) от Университета Саскачевана и Канадским фондом инноваций John R. Evans Leaders Fund (грант No 42269 для JLT). Авторы благодарят г-на Эрика Тумбса за предоставленную фотографию количественного определения ДНК методом УФ-спектроскопии.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 kb Plus DNA ladder | FroggaBio | DM015-R500 | DNA molecular weight marker |
| AccuReady M Single Channel 0.5-10 µL | Bulldog Bio | BPP020 | Pipettes for transferring liquid |
| AccuReady M Single Channel Pipettor Kit | Bulldog Bio | BPK100 | Pipettes for transferring liquid |
| Agar | BioShop Canada | AGR003.1 | Solidifying agent for growth medium |
| Agarose | Biobasic | D0012 | Make agarose gels for DNA electrophoresis |
| Biometra TOne | Analytikjena | 846-2-070-301 | Thermocycler |
| Caps for glass culture tubes | Fisher Scientific | 14-957-91 | Reusable caps for glass culture tubes |
| DNA primers | Integrated DNA Technologies | N/A | Bind and amplify template DNA in PCR reaction |
| DpnI | New England Biolabs | R0176S | Cleave methylated template DNA following PCR amplification |
| EcoRI | New England Biolabs | R3101L | Restriction enzyme, comes with appropriate buffer |
| Eppendorf microtubes 1.5 mL | Sarstedt | 72.690.300 | Microtube, 1.5 mL, conical base, PP, attached flat cap, molded graduations and frosted writing space |
| Ethidium bromide | Fisher Scientific | AAL0748203 | DNA visualization/intercalating agent, toxic |
| EZ-10 Spin Column Plasmid DNA Miniprep Kit | Biobasic | BS614 | Isolate plasmid DNA from overnight bacterial cultures |
| GelDoc Go-Gel system | Bio-Rad | 12009077 | Imaging DNA gels |
| Glass culture tubes | Fisher Scientific | 14-925E | Glass culture tubes |
| myGel Mini Electrophoresis System | Sigma-Aldrich | Z742288 | System used for gel electrophoresis |
| NanoDrop One | Thermo Fisher | ND-ONE-W | Determine DNA concentration |
| PCR Clean Up for DNA Sequencing | Biobasic | BT5100 | Purify PCR products |
| Petri dish | Sarstedt | 82.1473.011 | Petri dish 92 x 16 mm, PS, transparent, with ventilation cams |
| Pipette tip, 1000 µL | Sarstedt | 70.305 | Pipette tips for 100-1000 µL |
| Pipette tip, 2.5 µL | Sarstedt | 70.3010.265 | Pipette tips for up to 2.5 µL |
| Pipette tip, 20 µL | Sarstedt | 70.3020.200 | Pipette tips for up to 20 µL |
| Pipette tip, 200 µL | Sarstedt | 70.3030.020 | Pipette tips for 1-200 µL |
| Salt (NaCl) | Fisher Scientific | S271-10 | Component of bacterial growth medium (10 g/L) |
| Single 0.2 mL PCR tubes with flat cap | FroggaBio | TF-1000 | PCR tubes |
| Tryptone (Bacteriological) | BioShop Canada | TRP402.5 | Component of bacterial growth medium (10 g/L) |
| VeriFi DNA polymerase | PCR Biosystems | PB10.42-01 | High fidelity polymerase, the PCR buffer containing Mg2+ and dNTPs is provided with purchase |
| Xba I | New England Biolabs | R0145S | Restriction enzyme, comes with appropriate buffer |
| Yeast extract | BioShop Canada | YEX401.205 | Component of bacterial growth medium (5 g/L) |
Ссылки
- Bertero, A., Brown, S., Vallier, L. Methods of cloning. Basic Science Methods for Clinical Researchers. Chapter 2, 19-39 (2017).
- Garcia-Nafria, J., Watson, J. F., Greger, I. H. IVA cloning: A single-tube universal cloning system exploiting bacterial in vivo assembly. Sci Rep. 6, 27459 (2016).
- Bubeck, P., Winkler, M., Bautsch, W. Rapid cloning by homologous recombination in vivo. Nucleic Acids Res. 21 (15), 3601-3602 (1993).
- Avilan, L. Assembling multiple fragments: the Gibson assembly. Methods Mol Biol. 2633, 45-53 (2023).
- Stukenberg, D., et al. The Marburg Collection: A Golden Gate DNA assembly framework for synthetic biology applications in Vibrio natriegens. ACS Synth Biol. 10 (8), 1904-1919 (2021).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular cloning: a laboratory manual. , (1989).
- Engler, C., Marillonnet, S. Golden Gate cloning. Methods Mol Biol. 1116, 119-131 (2014).
- Ma, H., Kunes, S., Schatz, P. J., Botstein, D. Plasmid construction by homologous recombination in yeast. Gene. 58 (2-3), 201-216 (1987).
- Cao, P., Wang, L., Zhou, G., Wang, Y., Chen, Y. Rapid assembly of multiple DNA fragments through direct transformation of PCR products into E. coli and Lactobacillus. Plasmid. 76, 40-46 (2014).
- Conley, E. C., Saunders, V. A., Saunders, J. R. Deletion and rearrangement of plasmid DNA during transformation of Escherichia coli with linear plasmid molecules. Nucleic Acids Res. 14 (22), 8905-8917 (1986).
- Conley, E. C., Saunders, V. A., Jackson, V., Saunders, J. R. Mechanism of intramolecular recyclization and deletion formation following transformation of Escherichia coli with linearized plasmid DNA. Nucleic Acids Res. 14 (22), 8919-8932 (1986).
- Sung, W. L., Zahab, D. M. Site-specific recombination directed by single-stranded crossover linkers: specific deletion of the amino-terminal region of the beta-galactosidase gene in pUC plasmids. DNA. 6 (4), 373-379 (1987).
- Mandecki, W. Oligonucleotide-directed double-strand break repair in plasmids of Escherichia coli: a method for site-specific mutagenesis. Proc Natl Acad Sci USA. 83 (19), 7177-7181 (1986).
- Jones, D. H., Howard, B. H. A rapid method for recombination and site-specific mutagenesis by placing homologous ends on DNA using polymerase chain reaction. Biotechniques. 10 (1), 62-66 (1991).
- Kostylev, M., Otwell, A. E., Richardson, R. E., Suzuki, Y. Cloning should be simple: Escherichia coli DH5alpha-mediated assembly of multiple DNA fragments with short end homologies. PLoS One. 10 (9), e0137466 (2015).
- Chen, F., et al. Simplified plasmid cloning with a universal MCS design and bacterial in vivo assembly. BMC Biotechnol. 21 (1), 24 (2021).
- Braun, H. G., Kanwal, N., Rivera Lopez, L. F., Thomassin, J. L. Generation of a plasmid series for rapid sub-cloning and use in various Enterobacteriaceae. J Biosci Bioeng. 138 (6), 478-487 (2024).
- Kibbe, W. A. OligoCalc: an online oligonucleotide properties calculator. Nucleic Acids Res. 35 (Web Server issue), W43-W46 (2007).
- Wallace, R. B., et al. Hybridization of synthetic oligodeoxyribonucleotides to phi chi 174 DNA: the effect of single base pair mismatch. Nucleic Acids Res. 6 (11), 3543-3557 (1979).
- Bzymek, M., Lovett, S. T. Instability of repetitive DNA sequences: The role of replication in multiple mechanisms. Proc Natl Acad Sci USA. 98 (15), 8319-8325 (2001).
- Lee, P. Y., Costumbrado, J., Hsu, C. -. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923 (2012).
- Sambrook, J., Russell, D. W. The inoue method for preparation and transformation of competent E. coli: "ultra-competent" cells. CSH Protoc. 2006 (1), (2006).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253 (2007).
- Fürste, J. P., et al. Molecular cloning of the plasmid RP4 primase region in a multi-host-range tacP expression vector. Gene. 48 (1), 119-131 (1986).
- Bäumler, A. J., et al. Identification of a new iron regulated locus of Salmonella typhi. Gene. 183 (1-2), 207-213 (1996).
- Godiska, R., et al. Linear plasmid vector for cloning of repetitive or unstable sequences in Escherichia coli. Nucleic Acids Res. 38 (6), e88 (2010).
- Watson, J. F., Garcia-Nafria, J. In vivo DNA assembly using common laboratory bacteria: A re-emerging tool to simplify molecular cloning. J Biol Chem. 294 (42), 15271-15281 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены