Method Article
体内 组装用于 高效质粒构建
摘要
体内 组装是一种不依赖连接的克隆方法,它依赖于细菌中内在的 DNA 修复酶通过同源重组组装 DNA 片段。该方案既省时又省钱,因为需要的试剂很少,克隆效率可高达 99%。
摘要
体内组装 (IVA) 是一种分子克隆方法,它使用细菌中存在的内在酶促进 DNA 片段的分子间重组来组装质粒。该方法的工作原理是将具有 15-50 bp 同源区域的 DNA 片段转化为常用的实验室大肠杆菌菌株,细菌使用不依赖 RecA 的修复途径将 DNA 片段组装成质粒。与许多依赖于在转化为大肠杆菌菌株之前对质粒进行体外组装的分子克隆方法相比,这种方法更快速且更具成本效益。这是因为体外方法需要购买专用酶和需要孵育的连续酶促反应。然而,与体外方法不同,IVA 尚未被实验证明可以组装线性质粒。在这里,我们分享了我们实验室使用的 IVA 方案,用于在具有不同复制起点和抗生素耐药性标记的质粒之间快速组装质粒和亚克隆 DNA 片段。
引言
分子克隆包括生产含有特异性重组 DNA 的质粒所需的一系列实验室技术1。这些无处不在的技术通常会成为实验工作流程中的瓶颈2。许多分子克隆技术依赖于在转化为宿主菌株(例如大肠杆菌 DH5a)进行扩增之前,使用一系列酶促反应在体外组装 DNA 片段 3,4,5,6,7。由于体外质粒组装方法依赖于酶,因此购买或纯化酶可能既昂贵又耗时。
体内组装 (IVA) 是一种分子克隆方法,它依赖于 DNA 片段在合适的宿主中的分子间重组 8,9,10,11,12。该方法的基础是观察到常用的大肠杆菌 recA 克隆菌株可以介导单链引物与被限制性内切酶裂解的质粒的分子间重组13。1990 年代描述了使用 PCR 生成用于大肠杆菌中质粒组装的同源 DNA 末端,该方法被命名为重组 PCR 3,14。据报道,重组 PCR 的效率约为 50%14。然而,这种方法并未被广泛采用,可能是由于引物成本高,并且使用低保真聚合酶扩增大 DNA 片段存在引入不需要的突变的风险。这些缺点在 1990 年代很显着,可以通过使用体外克隆方法(例如限制性内切酶介导的克隆)来避免。
近年来,引物的成本有所降低,新的商业聚合酶提高了 PCR 扩增的保真度。因此,重组 PCR 作为一种快速且经济高效的分子克隆技术被重新审视,并更名为 IVA 2,9,15,16。随着可行性的提高,IVA 得到了进一步探索,该方法经过优化,克隆效率高达 99%16。优化确定了同源 DNA 的特征,例如碱基对数和熔解温度,这些特征可最大限度地提高体内重组效率 2,16。进一步分析表明,IVA15 可以有效地组装多达 6 个 150 bp 至 7 kbp 的 DNA 片段。此外,我们小组最近使用 IVA 组装了具有不同抗生素耐药盒和复制起点的质粒系列17。在这项研究中,IVA 克隆非常高效 (71-100%),每个质粒 (n = 2) 测试了少量克隆17。在这里,我们描述了我们实验室使用的 IVA 协议。
研究方案
1. 设计具有同源末端的引物或 DNA 片段
- 使用文字处理软件或专门的 DNA 分析软件人工组装所需的质粒。
注:对来自不同来源的 DNA 片段进行颜色编码并突出显示将用于下游组装步骤的同源区域通常很有帮助。此外,对同源 DNA 进行颜色编码以确保定向组装也很有帮助。 - 设计与每个 DNA 片段结合并含有 15-50 bp 同源 DNA 序列的引物(图 1)2,15。
- 为了提高 IVA 效率,请确保同源 DNA 片段的熔解温度为 47-52 °C2。
注:熔解温度可以使用在线软件18 或公式确定:熔解温度 = 64.9 + 41 * (nG + nC - 16.4)/(nA + nT + nG + nC),其中 n = 序列 6,19 中的 G、C、A 或 T 的数量。 - 避免使用具有高度重复序列的引物,例如编码 HIS 标签的 CATCATCATCATCATCAT,因为它们会引入不稳定性20。如果插入 poly-HIS 标签等应用需要最终的重复氨基酸序列,请使用 CATCACCATCATCACCAC 等替代密码子来减少核酸序列重复。
注:引物可从任何首选供应商处订购。如果要合成 DNA 片段,则应将同源末端掺入合成的 DNA 片段中。
- 为了提高 IVA 效率,请确保同源 DNA 片段的熔解温度为 47-52 °C2。
2. 扩增含有同源末端的 DNA 产物
- 使用市售的标准 DNA 分离试剂盒或碱性裂解分离质粒 DNA 或基因组 DNA 模板 6,17。
- 在含有市售高保真聚合酶的 PCR 反应中使用模板 DNA(来自步骤 2.1)和包含同源区域的引物(步骤 1.2)。为了限制下游反应中的 DNA 模板残留,请在每个反应中使用少量模板 DNA (20 pg-1 ng)。请参阅制造商的建议,了解酶特异性 PCR 反应混合物组分和推荐的 PCR 循环条件。继续进行 PCR 反应。
- 设置 PCR 反应 (50 μL) 以扩增 图 2 所示的 DNA 片段,其中含有 100 μM dNTP、0.2 μM 每种 DNA 引物、模板 DNA(50 pg pSU19 和 1 ng pSU18mCherry)、1x 含有 Mg2+ (终浓度 2 mM)的 PCR 反应缓冲液混合物和 1 U 高保真 DNA 聚合酶。
- 使用着陆 PCR 循环程序扩增 pSU19 和 mCherry(图 2)。将初始变性步骤设置为 95 °C 5 分钟,然后是 10 个 95 °C 循环 15 秒,每个循环 55 °C-0.5 °C 15 秒,72 °C 1 分钟,然后,20 个额外的循环,95 °C 15 秒,50 °C 15 秒,72 °C 1 分钟。在 72 °C 下完成 PCR 循环,最后延伸步骤 10 分钟。
注:如果要扩增质粒骨架,请根据分子量调整 DNA 模板的数量:每 50 μL PCR 反应使用 ~20 pg/1 kbp 质粒 DNA(pSU19 为 50 pg DNA(如图所示))。此外,调整 PCR 循环以尽量减少扩增过程中引入的突变数量:对于质粒骨架的扩增,只需 20-25 个 PCR 循环就足够了。
- PCR 反应完成后,取出等分试样 (2 μL) 的 PCR 反应物,与上样染料(浓度为 1 倍)混合,并通过琼脂糖凝胶电泳21 分离 DNA 片段。使用紫外 (UV) 或 LED 透射仪观察已在琼脂糖凝胶中迁移的 DNA 片段。确定 PCR 产物是否唯一,并将产物与 DNA 分子量标准进行比较,以检查它们是否为预期的分子量(图 2)。如果未观察到正确分子量的 PCR 产物,请参阅制造商的建议以优化 PCR 反应。
注:当 PCR 产物不是唯一的,但存在与预期分子量相对应的丰度 DNA 片段时,可以避免额外的 PCR 反应。 - 如果琼脂糖凝胶中存在多个 DNA 片段,则从琼脂糖凝胶中切除与预期分子量相对应的 DNA 片段,并使用琼脂糖凝胶提取试剂盒回收 DNA 片段。
- 要从 PCR 反应中去除甲基化模板 DNA,请将 1 μL DpnI 直接添加到反应管中。将反应物在 37°C 下孵育 15 分钟至过夜。
注:强烈建议使用此可选步骤,以限制下游反应中携带的模板 DNA 量。但是,如果在 PCR 反应中使用非常低浓度的模板 DNA,则可以跳过此步骤。 - 使用核酸纯化试剂盒去除残留的酶、盐、引物二聚体和酶促检测产生的其他不需要的低分子 DNA 产物。
注:如果合成 DNA 片段,则可以跳过步骤 2.1-2.6。 - 通过分光光度法或凝胶估计定量纯化的 DNA 片段的 DNA 浓度。
3. IVA(图 3)
- 计算每个 IVA 反应所需的 DNA 量(建议使用 25-50 ng 质粒 DNA)。对于分子量较高的质粒,使用更大量的质粒 DNA(例如,对于 2.3 kbp 的质粒,使用 25 ng 质粒,但当质粒为 9 kbp 时,每个反应使用 50 ng)。计算反应所需的插入 DNA 体积;使用 1:3 或 1:5 摩尔比例的质粒:插入 DNA。
注:在线生物计算器或下面提供的公式可用于计算双链 DNA 片段的摩尔量并确定每个 DNA 片段的摩尔比。
我们使用以下公式计算双链 DNA 片段的摩尔量:pmol =(以 ng 为单位的重量)× 1,000 /(碱基对× 650 道尔顿)。此外,摩尔比可通过以下方式计算:插入片段质量 (g) = 所需插入片段/质粒摩尔比 ×质粒质量 (g) ×插入片段与质粒长度的比值6。 - 合并计算体积的质粒,将 DNA 插入预冷的 1.5 mL 微量离心管中,并保持在冰上。
- 将质粒转移并将步骤 3.2 中的 DNA 混合物插入到等分试样 (25-100 μL) 中,将解冻的 recA 化学感受态大肠杆菌(例如大肠杆菌 DH5a;22)。
注:使用的感受态细胞的体积取决于质粒和插入片段 DNA 混合物的体积;该混合物不应超过感受态细胞体积的 10%。 - 继续进行热休克变换23。
- 将化学感受态 大肠杆菌 和 DNA 的混合物在冰上孵育 30 分钟。
- 转移至 42 °C 水浴中 1 分钟,然后将试管转移到冰中 2 分钟。
- 将 LB 无菌转移到试管中,使体积补足至 1 mL。
- 将 1 mL 体积转移到玻璃培养管中,置于 37 °C、220 rpm 或细菌菌株和/或质粒回收的推荐温度(典型范围为 25 °C-37 °C)的振荡培养箱中,并允许生产质粒编码的抗生素选择标记。
- 细胞恢复 30 分钟至 1 小时后,将转化反应物的等分试样(100 μL of 1,000 μL)沉积到固体选择培养基上,并使用无菌细胞涂布器将等分试样分散到琼脂培养板上。通过离心(13,000 × g 1 分钟)收集其余转化的细胞,弃去上清液,将细胞沉淀重悬于 100 μL 无菌培养基中,并如上所述沉积到固体选择培养基上。让液体吸收到固体培养基中 30 分钟,倒置培养板。并将它们置于细菌菌株和/或质粒的推荐温度下的培养箱中过夜。
4. 筛选正确的质粒组装
- 孵育后(步骤 3.5),从培养箱中取出培养板,如果每个培养板上有几个分离的细菌菌落,则直接计数菌落。选择几个菌落 (1-10) 进行筛选,以确定它们是否包含所需的组装质粒。
- 将补充有适当抗生素的无菌生长培养基转移到无菌培养管(玻璃或塑料)中。用无菌转移针或环接触 1 个菌落接种培养基,然后用转移针将细胞转移到培养基中。将培养管置于振荡培养箱中,并在细菌菌株和/或质粒的推荐温度(典型范围为 25 °C 至 37 °C)下孵育 16-18 小时。
- 第二天,根据制造商的说明,通过碱性裂解6 或使用市售质粒分离试剂盒从细菌培养物中分离质粒 DNA。
- 确定质粒是否正确组装。
- 通过分光光度法或凝胶估计定量分离质粒的 DNA 浓度。
- 使用等分试样 (50-150 ng) 的质粒 DNA 进行诊断性限制性消化反应(最终体积为 10 μL)。根据限制性内切酶预期切割组装质粒 DNA 的位置来选择限制性内切酶。
注:我们建议进行两个单独的反应:(1) 用一种预期会在单个位点切割质粒的限制性内切酶处理质粒 DNA,以及 (2) 用两种限制性内切酶处理质粒 DNA,预期会切除全部或部分插入的 DNA 片段。限制性内切酶是市售的,应按照制造商的说明使用。 - 限制性内切酶反应完成后,与上样染料(至 1 倍浓度)混合,将整个混合物上样到琼脂糖凝胶上,并通过琼脂糖凝胶电泳21 分离 DNA 片段。使用 UV 或 LED 透射仪观察琼脂糖凝胶中迁移的 DNA 片段。将限制性 DNA 片段与分子量标准进行比较,以确定它们是否为预期的分子量(图 4)。记下具有预期酶限制模式的质粒(称为 阳性克隆);丢弃含有不具有预期限制性模式的质粒(称为 阴性克隆)的试管。
- 为确保阳性克隆具有预期的核苷酸序列,请将阳性质粒克隆的等分试样送去进行测序。
注意:建议进行全质粒测序(例如,纳米孔测序)。
结果
在本手稿中,作为 IVA 使用的一个例子,我们遵循提供的 IVA 工作流程,将 mCherry 开放阅读框重新克隆到质粒 pSU19 的多克隆位点,以产生与 pSU19mCherry 相同的质粒(图 3)17。适用于IVA的引物是根据方案步骤1.1和1.2设计的。然后,使用质粒分离试剂盒分离 pSU19 和 pSU18mCherry,它们作为 PCR 反应的模板,分别扩增质粒骨架和插入 DNA(方案步骤 2.1)。pSU19 质粒骨架经过 PCR 扩增(引物对:pSU19_F:TAGGGTACCGAGCTCGAATTC 和 pSU19_R CCCGGGGATCCTCTAGAGTC)和 mCherry 开放阅读框从 pSU18mCherry 进行 PCR 扩增(引物对mCherry_F:ctctagaggatccccgggATGGTATCAAAAGGAGAGGAAG 和 mCherry_R:gaattcgagctcggtaccctaTTATCATTACTTGTACAGTTC;mCherry 引物中的小写核苷酸序列表示核苷酸与用于扩增 pSU19 骨架的引物同源;方案步骤 2.2)。通过琼脂糖凝胶电泳验证特异性 PCR 扩增(方案步骤 2.3; 图 2)PCR 产物进行第 1 天工作流程的剩余时间(方案步骤 2.5-3.5; 图 3)。
第二天,枚举转化板上的菌落(方案步骤 4.1; 图 3,第 2 天)。在这个实验中,有六个菌落是可见的;通过铺板更大的回收培养物等分试样或增加转化为感受态细胞的 DNA 量,可以增加集落的数量。如果转化板上没有克隆,则首先验证感受态细胞是否具有高转化效率非常重要。我们已经成功地使用了转化效率为 10、7 至 10、9 集落形成单位/μg 转化的 pUC19 DNA 的感受态细胞。如果不考虑转化效率,当使用较高分子量质粒进行 IVA 或组装许多 DNA 片段时,可能需要增加转化到感受态细胞中的 DNA 量和/或增加感受态细胞的体积。
我们选择了两个菌落来筛选正确的质粒组装(方案步骤 4.1-4.3.3)。第二天,我们遵循了第 3 天的工作流程(图 3)。质粒分离后,用 XbaI 或 XbaI 和 EcoRI 处理每个质粒,预计它们会切割正确组装的质粒一次或两次(图 4)。如图 4 所示,两种酶反应都产生了对应于质粒克隆 1 的 2.3 kbp 的单个 DNA 产物,表明这是单独的 pSU19。质粒克隆 2 的酶处理,用 XbaI 处理后得到单个 ~3 kbp DNA 产物,用 XbaI 和 EcoRI 处理后得到两个 DNA 产物(2.3 kbp 和 770 bp)。然后通过全质粒测序分析验证质粒克隆 2 的正确组装(方案步骤 4.4; 图 3,第 3 天)。在这个例子中,正确的质粒组装效率为 50%。我们很少筛选两个以上的克隆以进行正确的质粒组装,并且通常具有 50-100% 的质粒组装效率。根据我们的经验,阴性克隆通常包含 (i) 从重新循环化的模板 DNA 中携带的质粒骨架,或 (ii) 由重组成杂交质粒的模板 DNA 组成的杂交 DNA 产物。 dpnI 处理(方案步骤 2.5)限制阴性克隆的数量。如果这不能提高 IVA 效率,建议验证 PCR 引物设计并重新扩增质粒骨架和 PCR 产物。

图 1:IVA 引物设计策略。 IVA 引物设计的第一步(步骤 1)是使用软件在 计算机中构建所需组装质粒的序列文件。第二步(步骤 2)是设计引物,在质粒和插入的 DNA 序列的连接处附近扩增质粒骨架。插入序列的引物应具有足够的核苷酸,以特异性结合和扩增所需的 DNA 产物,并含有 15-50 bp 的相邻质粒骨架,用于同源重组。质粒设计中的同源区域是用颜色编码的。缩写:IVA = 体内 组装。 请单击此处查看此图的较大版本。
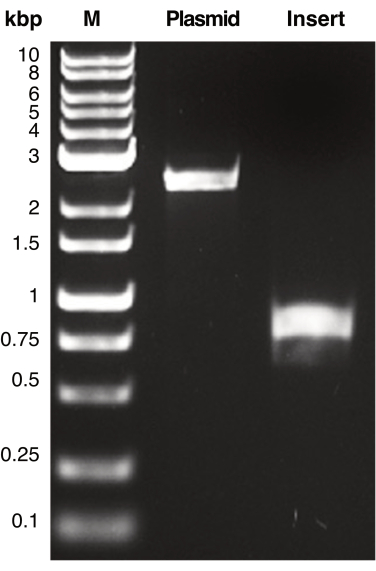
图 2:质粒和插入 DNA 的 PCR 扩增。 所示为对应于质粒和插入片段 DNA 的代表性图像,这些片段含有同源区域。通过凝胶电泳分离 DNA 片段,并通过 UV 透射观察。将 DNA 产物与分子量标记 (M) 进行比较,以确定每个 PCR 产物的表观分子量。质粒 (pSU19) 和插入 DNA (mCherry) 的预期分子量分别为 2.3 kbp 和 770 bp。 请单击此处查看此图的较大版本。

图 3:体内组装工作流程示意图。 DNA 经过 PCR 扩增,可产生 5' 和 3' 同源区。 dpnI 处理用于切割模板 DNA。核苷酸纯化试剂盒用于从 PCR 扩增的 DNA 中去除盐和酶。紫外分光光度法用于测定 DNA 浓度,并将 3:1 插入片段与质粒摩尔比合并到预冷的微量离心管中。将结合的 DNA 转移至冰冷的微量离心管中,该管中含有等分试样解冻的大 肠杆菌 DH5α 感受态细胞。通过热休克将 DNA 转化到 大肠杆菌 DH5α 中,铺板到固体选择培养基上,并在 37 °C 下孵育 18 小时。孵育后,将含有质粒克隆的单个菌落转移至含有无菌液体培养基和抗生素的培养管中,然后在37°C下搅拌孵育18小时。第二天,从细胞中分离质粒 DNA,并使用限制性内切酶处理来筛选阳性克隆。然后将阳性克隆送去进行测序分析,以确认质粒的 DNA 序列。 请单击此处查看此图的较大版本。

图 4:凝胶电泳筛选阳性质粒克隆。 分离两个不同的质粒克隆并用限制性内切酶处理,预期切割阳性克隆一次以线性化质粒或两次以释放插入的 DNA。限制性内切酶处理后,通过凝胶电泳分离样品,并通过 UV 透射观察。通过与分子量标记进行比较来估计分子量。线性化阳性克隆(质粒 + 插入片段)的预期分子量为 3.07 kbp,阳性克隆被切割两次后 DNA 片段的预期分子量为 2.3 kbp(质粒骨架)和 770 bp(插入片段)。质粒克隆 1 是阴性的(空质粒),克隆 2 是阳性的克隆。缩写:SC = 单卵裂;DC = 双卵裂;M = 分子量标记。 请单击此处查看此图的较大版本。
讨论
成功 IVA 克隆的最关键步骤是 DNA 片段和引物设计。当同源片段设计为至少 15 bp 长度且熔解温度约为 47-52 °C 时,IVA 效率会大大提高。 一项探索 IVA 片段设计优化的详细研究已经发表16.获得高克隆效率的另一个重要步骤是在 PCR 扩增步骤中使用尽可能少的模板 DNA。为了进一步减少模板 DNA 的残留,我们用 DpnI 处理循环后 PCR 反应以切割甲基化模板 DNA。这可以显著减少分离阳性克隆所需的筛选量。根据我们的经验,使用 DpnI 处理,我们每次转化只需要筛选 1-2 个菌落;如果没有 DpnI 处理,我们每次转化需要筛选 5-10 个克隆。
尽管我们和其他人已经报道了 IVA 克隆产生了许多集落形成单位16,17,但转化板上可能不存在集落。根据我们的经验,增加转化为感受态细胞的 DNA 量(尤其是在使用大质粒骨架时)和/或增加使用的感受态细胞体积可以提高转化效率。如果在调整 DNA 或感受态细胞的量后没有可见的菌落,我们通过实验确认感受态细胞原液的转化效率,并对我们的线性 DNA 片段进行测序,以确认它们包含所需的同源区域。遵循这些故障排除步骤通常会提高 IVA 效率。
IVA 克隆方法确实有几个限制。这些与使用 PCR 扩增特异性 DNA 片段有关。例如,质粒骨架的大小不一,有些长度接近或超过 10 kbp(例如,pMMB67HE24、pFUSE25)。如果所需的质粒骨架太大或难以用高保真校正聚合酶扩增,仍然可以选择使用限制性内切酶(例如 SmaI 或 EcoRV)对质粒进行线性化,并使用线性化质粒代替 PCR 产物进行 IVA 反应16。根据我们的经验,如果限制性内切酶处理不能实现接近 100% 的质粒线性化,则 IVA 的效率会显着降低。
IVA 的另一个潜在限制是购买包含同源 DNA 突出端的新引物以克隆每个独特的 DNA 片段所需的相关成本。如果实验室使用有限数量的质粒骨架,并且可以使用通用引物生成大批量扩增的质粒骨架用于未来的 IVA 克隆,则可以部分减轻这种成本。此外,如果实验室中使用的所有质粒都具有相同的多个克隆位点,则所有质粒都可以使用相同的通用引物。IVA 方法的另一个局限性是,据我们所知,它还没有经过通常用于克隆重复或不稳定的 DNA 的线性质粒组装的测试26。
IVA 是一种省时且经济高效的克隆方法,与其他依赖于体外 DNA 片段组装的分子克隆方法相比,它具有多项优势。它通常具有成本效益,因为质粒组装不依赖于市售的酶或缓冲液来组装 DNA 4,5,27。这节省了时间并降低了成本,因为避免了典型的酶促反应步骤,这可以节省长达 72 小时的实验室作时间 2,15。此外,IVA 所需的设备和试剂通常已经存在或在常规进行分子克隆的实验室中可用。
我们小组最近使用 IVA 生成了一系列 24 个质粒,这些质粒具有相同的多个克隆位点,3 个质粒拷贝数选项和 5 个抗生素选择标记选项17。我们展示了如何使用通用引物将基因克隆到每个质粒17 中。在这项研究中,克隆效率为 71-100%,因为筛选出的菌落很少来识别阳性克隆(筛选了 7 个克隆,筛选了 5 个阳性克隆)17。另一项研究报告了 IVA 克隆效率最高达到 97% ± 1.9%,较高的比率可以通过作者系统测试大量克隆的正确质粒组装来解释16。IVA 还可用于定点诱变或整合含有标签序列的引物等应用 27。IVA 是一种多功能且高效的克隆技术,可适用于实验室中的许多常规分子克隆应用。
披露声明
作者没有需要声明的利益冲突。
致谢
HGB 由加拿大自然科学与工程研究委员会 (NSERC) 的加拿大研究生奖学金 - 硕士课程和院长博士奖(萨斯喀彻温大学)资助。这项工作得到了 NSERC 发现补助金 (RGPIN-2021-03066)、萨斯喀彻温大学启动基金(JLT)和加拿大创新基金会 John R. Evans 领导者基金(JLT 的资助号 42269)的支持。作者感谢 Eric Toombs 先生提供通过紫外光谱法进行 DNA 定量的照片。
材料
| Name | Company | Catalog Number | Comments |
| 1 kb Plus DNA ladder | FroggaBio | DM015-R500 | DNA molecular weight marker |
| AccuReady M Single Channel 0.5-10 µL | Bulldog Bio | BPP020 | Pipettes for transferring liquid |
| AccuReady M Single Channel Pipettor Kit | Bulldog Bio | BPK100 | Pipettes for transferring liquid |
| Agar | BioShop Canada | AGR003.1 | Solidifying agent for growth medium |
| Agarose | Biobasic | D0012 | Make agarose gels for DNA electrophoresis |
| Biometra TOne | Analytikjena | 846-2-070-301 | Thermocycler |
| Caps for glass culture tubes | Fisher Scientific | 14-957-91 | Reusable caps for glass culture tubes |
| DNA primers | Integrated DNA Technologies | N/A | Bind and amplify template DNA in PCR reaction |
| DpnI | New England Biolabs | R0176S | Cleave methylated template DNA following PCR amplification |
| EcoRI | New England Biolabs | R3101L | Restriction enzyme, comes with appropriate buffer |
| Eppendorf microtubes 1.5 mL | Sarstedt | 72.690.300 | Microtube, 1.5 mL, conical base, PP, attached flat cap, molded graduations and frosted writing space |
| Ethidium bromide | Fisher Scientific | AAL0748203 | DNA visualization/intercalating agent, toxic |
| EZ-10 Spin Column Plasmid DNA Miniprep Kit | Biobasic | BS614 | Isolate plasmid DNA from overnight bacterial cultures |
| GelDoc Go-Gel system | Bio-Rad | 12009077 | Imaging DNA gels |
| Glass culture tubes | Fisher Scientific | 14-925E | Glass culture tubes |
| myGel Mini Electrophoresis System | Sigma-Aldrich | Z742288 | System used for gel electrophoresis |
| NanoDrop One | Thermo Fisher | ND-ONE-W | Determine DNA concentration |
| PCR Clean Up for DNA Sequencing | Biobasic | BT5100 | Purify PCR products |
| Petri dish | Sarstedt | 82.1473.011 | Petri dish 92 x 16 mm, PS, transparent, with ventilation cams |
| Pipette tip, 1000 µL | Sarstedt | 70.305 | Pipette tips for 100-1000 µL |
| Pipette tip, 2.5 µL | Sarstedt | 70.3010.265 | Pipette tips for up to 2.5 µL |
| Pipette tip, 20 µL | Sarstedt | 70.3020.200 | Pipette tips for up to 20 µL |
| Pipette tip, 200 µL | Sarstedt | 70.3030.020 | Pipette tips for 1-200 µL |
| Salt (NaCl) | Fisher Scientific | S271-10 | Component of bacterial growth medium (10 g/L) |
| Single 0.2 mL PCR tubes with flat cap | FroggaBio | TF-1000 | PCR tubes |
| Tryptone (Bacteriological) | BioShop Canada | TRP402.5 | Component of bacterial growth medium (10 g/L) |
| VeriFi DNA polymerase | PCR Biosystems | PB10.42-01 | High fidelity polymerase, the PCR buffer containing Mg2+ and dNTPs is provided with purchase |
| Xba I | New England Biolabs | R0145S | Restriction enzyme, comes with appropriate buffer |
| Yeast extract | BioShop Canada | YEX401.205 | Component of bacterial growth medium (5 g/L) |
参考文献
- Bertero, A., Brown, S., Vallier, L. Methods of cloning. Basic Science Methods for Clinical Researchers. Chapter 2, 19-39 (2017).
- Garcia-Nafria, J., Watson, J. F., Greger, I. H. IVA cloning: A single-tube universal cloning system exploiting bacterial in vivo assembly. Sci Rep. 6, 27459 (2016).
- Bubeck, P., Winkler, M., Bautsch, W. Rapid cloning by homologous recombination in vivo. Nucleic Acids Res. 21 (15), 3601-3602 (1993).
- Avilan, L. Assembling multiple fragments: the Gibson assembly. Methods Mol Biol. 2633, 45-53 (2023).
- Stukenberg, D., et al. The Marburg Collection: A Golden Gate DNA assembly framework for synthetic biology applications in Vibrio natriegens. ACS Synth Biol. 10 (8), 1904-1919 (2021).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular cloning: a laboratory manual. , (1989).
- Engler, C., Marillonnet, S. Golden Gate cloning. Methods Mol Biol. 1116, 119-131 (2014).
- Ma, H., Kunes, S., Schatz, P. J., Botstein, D. Plasmid construction by homologous recombination in yeast. Gene. 58 (2-3), 201-216 (1987).
- Cao, P., Wang, L., Zhou, G., Wang, Y., Chen, Y. Rapid assembly of multiple DNA fragments through direct transformation of PCR products into E. coli and Lactobacillus. Plasmid. 76, 40-46 (2014).
- Conley, E. C., Saunders, V. A., Saunders, J. R. Deletion and rearrangement of plasmid DNA during transformation of Escherichia coli with linear plasmid molecules. Nucleic Acids Res. 14 (22), 8905-8917 (1986).
- Conley, E. C., Saunders, V. A., Jackson, V., Saunders, J. R. Mechanism of intramolecular recyclization and deletion formation following transformation of Escherichia coli with linearized plasmid DNA. Nucleic Acids Res. 14 (22), 8919-8932 (1986).
- Sung, W. L., Zahab, D. M. Site-specific recombination directed by single-stranded crossover linkers: specific deletion of the amino-terminal region of the beta-galactosidase gene in pUC plasmids. DNA. 6 (4), 373-379 (1987).
- Mandecki, W. Oligonucleotide-directed double-strand break repair in plasmids of Escherichia coli: a method for site-specific mutagenesis. Proc Natl Acad Sci USA. 83 (19), 7177-7181 (1986).
- Jones, D. H., Howard, B. H. A rapid method for recombination and site-specific mutagenesis by placing homologous ends on DNA using polymerase chain reaction. Biotechniques. 10 (1), 62-66 (1991).
- Kostylev, M., Otwell, A. E., Richardson, R. E., Suzuki, Y. Cloning should be simple: Escherichia coli DH5alpha-mediated assembly of multiple DNA fragments with short end homologies. PLoS One. 10 (9), e0137466 (2015).
- Chen, F., et al. Simplified plasmid cloning with a universal MCS design and bacterial in vivo assembly. BMC Biotechnol. 21 (1), 24 (2021).
- Braun, H. G., Kanwal, N., Rivera Lopez, L. F., Thomassin, J. L. Generation of a plasmid series for rapid sub-cloning and use in various Enterobacteriaceae. J Biosci Bioeng. 138 (6), 478-487 (2024).
- Kibbe, W. A. OligoCalc: an online oligonucleotide properties calculator. Nucleic Acids Res. 35 (Web Server issue), W43-W46 (2007).
- Wallace, R. B., et al. Hybridization of synthetic oligodeoxyribonucleotides to phi chi 174 DNA: the effect of single base pair mismatch. Nucleic Acids Res. 6 (11), 3543-3557 (1979).
- Bzymek, M., Lovett, S. T. Instability of repetitive DNA sequences: The role of replication in multiple mechanisms. Proc Natl Acad Sci USA. 98 (15), 8319-8325 (2001).
- Lee, P. Y., Costumbrado, J., Hsu, C. -. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923 (2012).
- Sambrook, J., Russell, D. W. The inoue method for preparation and transformation of competent E. coli: "ultra-competent" cells. CSH Protoc. 2006 (1), (2006).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253 (2007).
- Fürste, J. P., et al. Molecular cloning of the plasmid RP4 primase region in a multi-host-range tacP expression vector. Gene. 48 (1), 119-131 (1986).
- Bäumler, A. J., et al. Identification of a new iron regulated locus of Salmonella typhi. Gene. 183 (1-2), 207-213 (1996).
- Godiska, R., et al. Linear plasmid vector for cloning of repetitive or unstable sequences in Escherichia coli. Nucleic Acids Res. 38 (6), e88 (2010).
- Watson, J. F., Garcia-Nafria, J. In vivo DNA assembly using common laboratory bacteria: A re-emerging tool to simplify molecular cloning. J Biol Chem. 294 (42), 15271-15281 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。