Method Article
Комплексный анализ реакции на лекарственные препараты с помощью анализа FLICK
В этой статье
Резюме
В этом протоколе описывается, как использовать анализ FLICK для оценки реакции на лекарственные препараты, включая подробные инструкции по использованию этого анализа для расчета темпов роста и смертности, вызванных лекарственными препаратами, а также для оценки механизма лекарственной гибели клеток.
Аннотация
Для понимания эффективности лекарств критически важно охарактеризовать степень лекарственно-индуцированной гибели клеток. Попытки количественно оценить уровень смертельной гибели, вызванной лекарственными препаратами, осложняются существованием более десятка молекулярно различных форм регулируемой смерти, каждая из которых имеет свое время активации и биохимические отличительные особенности. Кроме того, для некоторых подтипов некротической смерти отличительные черты наблюдаются лишь временно и быстро утрачиваются из-за разрыва клеток. Таким образом, даже при использовании комбинации анализов, специфичных для пути смерти, сложно точно количественно оценить общее количество клеточной гибели или относительный вклад каждого подтипа смерти. Еще одна проблема заключается в том, что многие анализы, специфичные для определения смерти, игнорируют то, как лекарства влияют на пролиферацию клеток, что затрудняет интерпретацию того, увеличивается или сокращается популяция, получающая лекарственные препараты. Анализ FLICK позволяет количественно оценить общий уровень гибели клеток после стимуляции способом, специфичным для смерти, но также в значительной степени независимым от типа (типов) активированной смерти. Кроме того, анализ FLICK сохраняет информацию об общем размере популяции и скорости пролиферации клеток. В этой рукописи мы описываем основное использование анализа FLICK, способы устранения неполадок в этом анализе при использовании различных типов биологического материала, а также способы использования анализа FLICK для количественной оценки вклада каждого типа клеточной гибели в наблюдаемый ответ на лекарственные препараты.
Введение
Что касается противораковых препаратов, доклиническая оценка чувствительности к препаратам обычно включает в себя проверку того, как лекарства влияют на жизнеспособность клеток в культуре1. Жизнеспособность клеток после воздействия лекарственного препарата является продуктом, по крайней мере, двух отдельных эффектов: индуцированного лекарственным препаратом ингибирования пролиферации клеток и активации клеточнойгибели2. К сожалению, несмотря на то, что клеточная смерть является критически важным фактором, необходимым для длительного ответа на лекарственные препараты, стандартные подходы не могут прояснить степень, в которой лекарство активируетклеточную смерть.
К распространенным анализам на лекарственный ответ относятся те, которые непосредственно подсчитывают клетки (например, счетчик Култера, некоторые виды использования проточной цитометрии или микроскопии), количественно оценивают способность клеток к пролиферации (например, анализ образования колоний) или количественно оценивают метаболическую активность (например, анализы CellTiter-Glo, МТТ на основе тетразолия или МТС). Общей особенностью этих анализов является то, что генерируемые данные пропорциональны количеству живых клеток. Поскольку лекарства значительно различаются по тому, как они координируют ингибирование роста и гибель клеток, количество живых клеток после воздействия препарата дает ненадежное представление об уровне индуцированной лекарственными препаратамигибели клеток. Кроме того, поскольку раковые клетки, как правило, быстро размножаются в клеточной культуре, количество живых клеток может быть значительно уменьшено по сравнению с необработанной популяцией, не вызывая приэтом гибели клеток. Таким образом, главный недостаток заключается в том, что степень гибели клеток не может быть количественно определена без измерения количества живых и мертвых клеток.
Точное количественное определение количества мертвых клеток после воздействия лекарственного препарата является сложной задачей по нескольким причинам2. Во-первых, существует более десятка регулируемых путей клеточной смерти 5,6,7,8. Несмотря на то, что биохимические маркеры обычно существуют для идентификации каждого типа регулируемой клеточной гибели, эти маркеры различаются по своей специфичности, и ни один анализ не может быть использован для одновременной количественной оценки всех подтипов смерти. Во-вторых, время активации для каждой формы клеточной смерти может сильно варьироваться в зависимости от контекста, поэтому полная картина не может быть получена, если смерть не будет количественно определенаво времени. Многие биохимические анализы для количественной оценки гибели клеток позволяют измерять конечную точку, поэтому получение кинетических данных может быть сложной задачей и ограничено стоимостью. Третье осложнение заключается в том, что мертвая клетка сама по себе является переходным промежуточным состоянием между состоянием живой клетки и диссоциированным клеточным мусором. Стабильность мертвых клеток варьируется в зависимости от подтипа смерти, при этом некоторые типы, такие как апоптоз, создают относительно стабильные трупы, в то время как другие типы смерти вызывают быстрый лизис. Таким образом, методы количественной оценки смерти, требующие сбора и подсчета мертвых клеток, также приведут к предвзятому пониманию клеточной смерти. Наконец, четвертое ограничение заключается в том, что биохимические анализы, которые количественно оценивают степень гибели клеток, обычно не дают никакого представления о том, как лекарство изменяет пролиферацию. Таким образом, общая численность популяции и, что важно, увеличивается или уменьшается популяция не может быть интерпретирована.
Некоторые анализы на основе микроскопии, такие как STACK и SPARKL, эффективны для измерения живых и мертвых клеток с течением времени, и эти анализы могут дать исчерпывающее представлениео гибели клеток, вызванной лекарственными препаратами. Однако для этих анализов требуются специализированные инструменты, такие как микроскоп Incucyte, что ограничивает пропускную способность и доступ к этим подходам. Кроме того, методы, основанные на микроскопии, требуют, чтобы мертвые клетки оставались в фокальной плоскости микроскопа на протяжении всего эксперимента, что ставит под угрозу возможность количественного определения мертвых клеток, когда они теряют адгезию к планшету или со временем распадаются мертвые клетки. Аналогичным образом, анализы, основанные на микроскопии, сталкиваются с проблемами при применении в контексте суспензионных культур, поскольку клетки дрейфуют в заданную фокальную плоскость и из нее.
Чтобы решить указанные выше проблемы, мы разработали анализ под названием FLICK (Fluorescence-based and Lysis-dependent Inference of Cell Death Kinetics)12,13. Целью анализа FLICK является определение уровня лекарственно-индуцированной гибели клеток, независимо от того, как клетки умирают. В методе FLICK используются клеточные красители, флуоресценция которых зависит от связывания ДНК. Ключевой особенностью FLICK является использование этих флуорофоров для обозначения накопления мертвых клеток с течением времени благодаря их доступной ДНК с последующим лизисом на основе механического детергента для проникновения любых живых клеток в конце анализа. Эти данные в сочетании с математическим моделированием позволяют количественно оценивать популяции живых и мертвых клеток с непрерывным временным разрешением и без необходимости сбора или обработки мертвых клеток. Кроме того, использование планшетного ридера для оценки флуоресценции мертвых клеток позволяет оценить мертвые клетки, не требуя, чтобы мертвые клетки оставались неповрежденными, тем самым уменьшая предвзятость против некротических форм смерти, которые приводят к разрыву клеток. Наконец, анализ FLICK требует минимального обращения с планшетами и может быстро генерировать кинетические измерения, что позволяет проводить высокопроизводительный скрининг лекарств. В этом протоколе мы фокусируемся на использовании анализа FLICK, в том числе на том, как использовать FLICK для определения скорости роста, вызванного лекарственным препаратом, уровня смертности и/или механизмов гибели клеток.
протокол
1. Оптимизация времени пермеабилизации для каждой интересующей клеточной линии
ПРИМЕЧАНИЕ: Описанные объемы и количества относятся к оптимизации одной клеточной линии. Эти значения следует увеличивать в зависимости от количества линий ячеек, которые должны быть протестированы.
- Пластина с нужным количеством ячеек в каждой лунке на 96 лунок, оптическое дно, пластина с черными стенками. Добавьте 100 μL готовой среды и дайте ячейкам прилипнуть к пластине на ночь.
ПРИМЕЧАНИЕ: Количество клеток с покрытием должно быть оптимизировано с учетом скорости роста клеток, оптимальной плотности и длины анализа. Типичное количество исходных клеток для адгезивных линий раковых клеток, измеренное в течение 72 часов, составляет 1500 - 5000 клеток на лунку. Например, клетки U2OS могут быть покрыты в дозе 2000 клеток на лунку в DMEM с 10% FBS, 2 мМ глутамина и 1% Pen-Strep и культивированы в течение ночи в стандартных условиях (5%CO2, 37 °C, с влажностью). - В конической центрифужной пробирке объемом 15 мл приготовьте 1,5 мл 1,5% раствора Triton-X в фосфатно-солевом буфере (PBS). Вихревой поток 1,5% раствора Triton-X в течение 5 с на максимальной скорости. Поместите на водяную баню при температуре 37 °C не менее чем на 30 минут.
- Визуально осмотрите раствор, чтобы убедиться, что Triton-X полностью растворился, завихрив его в течение нескольких секунд. Убедитесь, что раствор однороден.
- Добавьте по 10 мкл 1,5% раствора Triton-X в каждую лунку покрытых ячеек. Не перемешивайте.
ПРИМЕЧАНИЕ: На данном этапе не желательно перемешивать с помощью повторного пипетирования из-за образования пузырьков. - Верните клетки к 5%CO2, 37 °C с влажностью в инкубаторе для клеточных культур не менее чем на 1 ч.
ПРИМЕЧАНИЕ: После применения раствора Triton-X большинство клеточных линий полностью лизируются за 2-3 ч. Ожидание до 24 часов оказывает минимальное влияние на флуоресцентный сигнал при использовании красителей, таких как SYTOX Green. Увеличение процентного содержания Triton-X может сократить время инкубации трудно поддающихся лизиации клеточных линий. - Наблюдайте за морфологией клеток на световом микроскопе с помощью объектива с 10-кратным увеличением. Осматривайте клетки один раз в час до тех пор, пока тела клеток не перестанут быть видны. Запишите время, необходимое для пермеабилизации клеток.
ПРИМЕЧАНИЕ: При наличии флуоресцентного микроскопа лизис может быть визуализирован с помощью непроницаемого для клеток красителя ДНК, такого как SYTOX Green. Краситель может быть добавлен в 10-кратной конечной концентрации к раствору Triton-X, а пермеабилизация может быть подтверждена флуоресцентной микроскопией.
2. Подбор и калибровка окрашивания ДНК
Примечание: Обязательным требованием для анализа FLICK является использование флуорофора, который излучает сигнал ДНК-связывающим зависимым образом, не влияет на жизнеспособность клетки и производит сигнал, который линейно масштабируется в зависимости от номера клетки. В этом протоколе используется SYTOX Green. Другие красители с аналогичными свойствами также могут быть пригодны для анализа FLICK, но каждый из них должен быть оценен и откалиброван. Примеры приведены в таблице 1 .
- Для выбранного ДНК-красителя определите диапазон концентраций, подлежащих тестированию, на основе рекомендаций производителя.
- Для каждой концентрации, которую необходимо исследовать, поместите 40 000 клеток в 180 мкл среды для культивирования клеток в трех экземплярах вдоль крайней левой колонки 96-луночного оптического дна с черными стенками. Добавьте 90 μL среды в оставшиеся лунки.
ПРИМЕЧАНИЕ: Это будет использоваться для создания линейного титрования ячеек по рядам пластины. Конечная концентрация первых скважин составит 20 000 ячеек на скважину. Оптические нижние пластины не требуются для считывателей пластин, которые считывают флуоресценцию с верхней части лунки. Средой для культивирования клеток должна быть та же среда, которая использовалась для выращивания испытуемых клеток. Например, при использовании элементов U2OS 40 000 клеток должны быть ресуспендированы в 180 мкл DMEM. - С помощью многоканальной пипетки создайте последовательное разведение в соотношении 1:2, передав 90 мкл из крайней левой колонки в соседнюю колонку справа. Пипеткой 15х перемешать.
- Повторите шаг 2.3, двигаясь от второго столбца к третьему, затем от третьего столбца к четвертому столбцу и так далее. Завершите титрование в предпоследнем столбце пластины. Последний столбец оставьте без клеток, чтобы можно было получить фоновый сигнал клеточных культуральных сред.
- Для предпоследней колонки удалите 90 μл, чтобы во всех лунках было 90 μл среды, содержащей различное количество клеток. Дайте клеткам прилипнуть в течение 6 часов в инкубаторе для клеточных культур при температуре 37 °C.
- Приготовьте 10-кратный раствор ДНК-красителя для каждой концентрации тестируемого красителя, при этом ДНК-краситель разбавляют в полноценные питательные среды, используемые для культивирования интересующих клеток. Приготовьте 1,5 мл 1,5% раствора Triton-X в PBS, как описано в шаге 1.
- В каждую лунку 96-луночного планшета добавьте 10 мкл 10-кратного красителя для ДНК. Добавьте в каждую лунку по 10 мкл 1,5% раствора Triton-X для проникновения клеток. Инкубируйте клетки в этом растворе в течение оптимального времени, которое было определено на шаге 1.
Примечание: После добавления Triton-X конечная концентрация красителя ДНК составляет чуть меньше 1x, но это несущественно. После инкубации вся пластина должна быть лизирована. Ручное титрование клеток будет использоваться для определения оптимальной концентрации красителя ДНК и оптимальных настроек для получения флуоресценции. - Измерьте интенсивность флуоресценции на планшете для титрования клеток. Количественное определение флуоресценции в диапазоне настроек сбора данных, указанных производителем ДНК-красителя. В зависимости от используемого считывателя пластин изменяйте длины волн возбуждения и излучения и/или коэффициент цифрового усиления.
- Удалите фоновый сигнал из каждого измерения, вычитая средний сигнал столбца, не содержащего ячеек. Эти значения можно найти в крайней правой колонне лунок на серийной разбавляющей пластине.
- Определите линейность каждой концентрации красителя ДНК для каждой настройки сбора. Линейность может быть определена путем построения графика количества клеток в зависимости от сигнала флуоресценции и выполнения линейной регрессии. Коэффициент детерминации (r2) сообщает о степени, в которой сигнал флуоресценции линейно связан с номером клетки.
- Выберите настройки сбора данных и концентрацию красителя ДНК, которые имеют наилучшее сочетание линейности и динамического диапазона.
ПРИМЕЧАНИЕ: Рассмотрим весь диапазон номеров ячеек от 0 до 20 000 ячеек. Убедитесь, что коэффициент усиления и концентрация красителя ДНК линейны при малом числе клеток, от 0 до 1000 клеток. Несколько настроек прибора или концентраций ДНК-красителей могут обеспечить сильную корреляцию во всем диапазоне. Тем не менее, важно, чтобы чувствительность нижнего предела была надежной, чтобы можно было точно измерить небольшие изменения в мертвых клетках.
3. Покрытие клеток, внутрискважинное применение лекарств и измерение флуоресценции мертвых клеток с течением времени в планшетах, обработанных лекарствами
ПРИМЕЧАНИЕ: Планшеты для разведения лекарств могут быть гибко сконструированы в зависимости от экспериментальных потребностей. Как правило, планшеты для разведения лекарственного средства включают в себя логарифмическую или полулогарифмическую серию разведения одного или нескольких лекарственных средств.
- Рассмотрим оптимальную схему нанесения гальванических покрытий для эксперимента. Избегайте измерений из внешних лунок 96-луночной пластины, чтобы уменьшить шум, связанный с изменением роста, поскольку внешние лунки испытывают другие температуры, оксигенацию и испарение по сравнению с внутренними лунками пластины.
ПРИМЕЧАНИЕ: Включение элементов управления по всему ландшафту платформы повысит надежность данных о росте. Рассмотрите возможность включения контрольных лунок в центр и по краям пластины. - Определите количество пластин, необходимое для проведения эксперимента. Включите одну дополнительную пластину, которую необходимо лизировать в начале анализа, чтобы установить среднее количество клеток в лунке на момент введения препарата (т.е. контрольную пластину T0).
- Приготовьте клеточную суспензию в полной питательной среде.
- Исходя из необходимого для эксперимента количества планшетов (рассчитанного на шаге 3.2), определите необходимый объем клеточной суспензии. При посеве тарелок по 90 мкл на лунку, требуется около 10 мл на пластину. Умножьте количество необходимых пластин на 10 мл.
ПРИМЕЧАНИЕ: Желательно увеличить этот объем, чтобы учесть мертвый объем резервуара и потерю объема во время пипетирования. Например, рассчитанный объем можно умножить на 1,2. - Подсчитайте клетки и приготовьте разведение клеток исходя из желаемого количества клеток в лунке. Например, если вы хотите засеять 2000 клеток в 90 мкл среды на лунку 96-луночного планшета для 3 планшетов, рассчитайте общее количество клеток, необходимых для эксперимента, следующим образом:

Аналогично, если подсчитанная клеточная суспензия составляет 400 000 клеток/мл, объем клеточной суспензии, необходимый для эксперимента, будет составлять:

- Скорректировать объем питательных сред для клеточных культур, используемых для гальванического покрытия, путем вычитания объема подсчитанной клеточной суспензии, которую необходимо добавить.
36 мл среды - 2 мл клеточной суспензии = 34 мл скорректированного объема среды
- Исходя из необходимого для эксперимента количества планшетов (рассчитанного на шаге 3.2), определите необходимый объем клеточной суспензии. При посеве тарелок по 90 мкл на лунку, требуется около 10 мл на пластину. Умножьте количество необходимых пластин на 10 мл.
- Смешайте подсчитанную клеточную суспензию с правильным объемом среды с помощью серологической пипетки. Перенесите эту суспензию элемента в резервуар для реагентов с V-образным дном.
- С помощью многоканальной пипетки добавьте 90 мкл клеточной суспензии в каждую лунку 96-луночных планшетов. Регулярно перемешивайте клеточную суспензию в резервуаре с реагентом, используя многократное пипетирование с помощью серологической пипетки, чтобы обеспечить поддержание желаемой концентрации клеток на объем.
- Дайте клеткам прилипнуть на ночь в инкубаторе для клеточных культур при температуре 37 °C (обычно 12-24 часа).
- Приготовьте 1,5% раствор Triton-X в PBS, как описано в шаге 1. Объем этого раствора должен быть достаточным для лизирования всех пластин. Около 1,5 мл 1,5% Triton-X в PBS достаточно для лизизации одного 96-луночного планшета.
ПРИМЕЧАНИЕ: 1,5% раствор Triton-X в PBS стабилен в течение более недели и может быть изготовлен заранее для удобства. - Определите количество питательных сред для клеточных культур, необходимых для изготовления планшета для разведения препарата. Подготовьте планшеты для разведения лекарственного средства в U- или V-образных 96-луночных прозрачных планшетах.
- Чтобы убедиться, что объем разведенного препарата достаточен для проведения эксперимента, увеличьте минимально необходимый объем с учетом потери объема при пипетировании. Например, если лекарственные препараты необходимо добавить по 10 мкл в каждую лунку 96-луночного планшета, а эксперимент включает три планшета, то требуется 30 мкл разведенного лекарственного средства на лунку. Приготовьте 40-50 μл отравляемой среды на лунку, чтобы учесть потерю объема. Добавьте 1,5 мл к необходимому объему среды, чтобы учесть среду, необходимую для контрольной пластины T0.
- Приготовьте 10-кратную концентрацию выбранного ДНК-красителя в полной питательной среде. Эта концентрация основана на концентрации, выбранной на шаге 2.11. Общий объем данного раствора рассчитывается на шаге 3.8.
- Используя ДНК-краситель + питательная среда из этапа 3.9, приготовьте 10-кратную концентрацию каждого тестируемого препарата. Создайте только самую высокую дозу каждого препарата в планшете для разведения препарата и последовательно разбавляйте препараты многоканальной пипеткой, перемешивая 15 раз между каждой лункой.
ПРИМЕЧАНИЕ: При назначении максимальной дозы для данного препарата в планшете для разведения препарата, объем препарата должен быть учтен таким образом, чтобы обеспечить точность концентрации. - С помощью многоканальной пипетки добавьте 10 мкл раствора препарата + ДНК-красителя с шага 3.10 в планшеты, содержащие клетки.
ПРИМЕЧАНИЕ: Для планшетов для разведения лекарственного средства, в которых было создано серийное разведение, если лекарственные препараты добавляются в клетки, начиная с самой низкой концентрации лекарства и заканчивая самой высокой концентрацией, кончики многоканальной пипетки не нуждаются в замене. Тем не менее, наконечники на многоканальной пипетке следует менять между каждым планшетом и всякий раз, когда наконечники использовались в лунке, содержащей другой препарат или более высокую концентрацию препарата. - Считайте флуоресценцию для всех планшетов, в которые были добавлены препараты. Это флуоресцентное показание является показателем T0 (т.е. мертвые клетки в момент времени = 0 ч).
- Верните тарелки в инкубатор после снятия показаний флуоресценции Т0.
- Добавьте 10 мкл 10-кратного раствора ДНК-красителя, созданного на стадии 3.9, и 10 μл 1,5% раствора Triton-X на стадии 3.7 на контрольную пластину T0. Верните эту тарелку в инкубатор на количество времени, выбранное в пункте 1.8.
- Считайте показания контрольной пластины T0 после того, как клетки будут полностью лизированы, как описано в шаге 1.6.
4. Измерьте флуоресценцию мертвых клеток с течением времени для обработанных лекарственными препаратами планшетов
ПРИМЕЧАНИЕ: Сведите к минимуму время, в течение которого пластины находятся вне инкубатора. Длительные изменения температуры могут повлиять на жизнеспособность клеток, а воздействие света может поставить под угрозу работу флуорофоров ДНК, таких как SYTOX Green.
- Получайте показания флуоресценции для всех обработанных лекарственным препаратом планшетов каждые 3-4 ч после приема препарата. Пластины не нужно считывать в течение ночи, если только не требуется очень точная кинетика смерти.
ПРИМЕЧАНИЕ: Временные точки не обязательно должны измеряться через фиксированные/стандартные промежутки времени. В целом, временные точки могут быть взяты исключительно в обычное рабочее время, не вызывая ошибок при последующем анализе кинетики смерти. Кинетика может быть выведена при условии, что некоторые измерения проводятся в период до наступления смерти, во время восходящей фазы смерти и во время фазы насыщения/плато. - В желаемый конечный момент времени получите показания флуоресценции. Сразу после этого добавьте 10 μL 1,5% раствора Triton-X, приготовленного на шаге 3.7, для лизирования клеток.
- Верните планшеты в инкубатор и дайте клеткам проникнуть в течение времени, определенного в шаге 1.
- Получение показаний флуоресценции после пермеабилизации. Это значение флуоресценции пропорционально общему количеству клеток (т.е. живых + мертвых клеток) для каждой лунки.
5. Рассчитайте кинетику летальной дроби
ПРИМЕЧАНИЕ: Расчеты, описанные в этом протоколе, могут быть проанализированы в любом формате или программном обеспечении. Тем не менее, использование среды программирования, такой как MATLAB, R или Python, позволит проводить более быстрый и гибкий анализ.
- Рассчитайте средние значения флуоресценции с контрольной пластины T0, используя среднее значение 50% обрезки. Эта величина пропорциональна общему количеству клеток до введения лекарств.
- Используя аппроксимацию кривой и функцию экспоненциального роста, рассчитать кинетику роста популяции для всех скважин в эксперименте. Начальный размер популяции для каждой лунки представляет собой среднее значение флуоресценции T0, рассчитанное на шаге 5.1. Окончательный размер популяции для каждой скважины является величиной после пермеабилизации, рассчитанной на шаге 4.4. Продолжительность анализа составляет от 0 ч до конечной точки анализа, выбранной на шаге 4.4.
- Используя параметры роста, определенные на шаге 5.2, рассчитайте общее количество клеток в каждый измеренный момент времени в анализе для каждой лунки. Определите количество живых клеток в каждый измеренный момент времени, вычитая измеренное количество мертвых клеток из общего числа клеток, рассчитанного на шаге 5.2.
ПРИМЕЧАНИЕ: Из-за небольшого количества шума в анализе, иногда число живых клеток может быть небольшим отрицательным числом. Это значение можно вручную установить в 0, так как отрицательного числа живых клеток не может быть и, скорее всего, указывает на то, что все клетки в этом колодце были мертвы. - Рассчитайте летальную фракцию (LF) для каждой временной точки, разделив флуоресцентный сигнал мертвой клетки на общий клеточный сигнал для каждой временной точки.
- Подгонка уравнения запаздывающей экспоненциальной смерти (LED) к данным о временном потоке летальной дроби10. Чтобы избежать произвольных кинетических параметров для доз препарата, которые не индуцируют сколько-нибудь значительной летальности, подгоняют под линейную модель с наклоном, равным 0. Определите значимые уровни летальности на основе шума в анализе или НЧ, наблюдаемых при немедикаментозных условиях.
- Записывайте время наступления смерти (DO) из уравнения светодиода. Уравнение светодиода имеет четыре параметра: начальная НЧ (LFi), НЧ на плато (LFp), начальная смертность (DR) и DO. Выведите эти параметры из данных с помощью нелинейной регрессии (т.е. аппроксимации кривой).
- Рассчитайте фракционную жизнеспособность (ФВ) в конечной точке анализа для каждого препарата при каждой дозе. Вычтите значение LF конечной точки из 1 или разделите количество живых клеток на общее количество клеток.
ПРИМЕЧАНИЕ: ПВ может быть рассчитана в любой момент времени, а не только в конечной точке анализа. Эти данные используются для оценки фармакологии дозы (например, препарата IC50 или EC50).
6. Рассчитайте значение GR
- Определите среднее количество живых клеток для каждой лунки в начале анализа. Рассчитайте это значение, используя показания T0 после пермеабилизации, рассчитанные на шаге 3.15, и вычтите показания T0 для каждой скважины, которые были собраны на шаге 3.12. В приведенном ниже уравнении GR (шаг 6.3) это значение обозначается как x0.
ПРИМЕЧАНИЕ: Иногда самая высокая доза препарата может повлиять на флуоресцентное считывание красителя ДНК. Может оказаться желательным рассчитать среднее число живых клеток в момент времени 0 с использованием контрольных лунок. - Для контрольных лунок (xctrl) определите среднее количество живых клеток для каждой лунки в конечной точке анализа. Определите среднее количество живых клеток в конечной точке анализа для каждого состояния, подвергшегося лечению лекарственным препаратом (x(c)).
ПРИМЕЧАНИЕ: В зависимости от вариации роста клеток на планшете, для нормализации каждой лунки могут использоваться различные значения xctrl . Например, если значения xctrl систематически изменяются на пластине, может быть желательно использовать ближайшее значение xctrl , а не среднее значение xctrl на пластине. - Для каждой скважины, получавшей лекарственное лечение, рассчитайте нормализованное значение ингибирования темпов роста (ОР) с использованием следующего уравнения4:
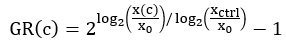
Выполните аппроксимацию кривой с помощью 4-параметрической логистической регрессии. GR находится по шкале от -1 до 1.
7. Расчет темпов роста и смертности, вызванных лекарственными препаратами, с использованием метода GRADE
ПРИМЕЧАНИЕ: ОТО представляет собой чистый темп роста популяции, а не истинный темп пролиферации клеток. Вызванный лекарственными препаратами рост населения и смертность могут быть рассчитаны с использованием комбинации ГР и летальной фракции (ЛФ).
- Определите время удвоения (τ) клеточной линии во время эксперимента, используя среднее количество живых клеток из контрольного показания T0 (x0), среднее количество живых клеток из контрольного условия в конечной точке анализа (xctrl) и продолжительность анализа в часах (t), чтобы решить следующее уравнение:

ПРИМЕЧАНИЕ: Точный расчет времени удвоения клеток (τ) требует, чтобы ячейки непрерывно удваивались на протяжении всего анализа. Для клеток, испытывающих ингибирование контакта, клетки должны быть засеменены с начальной плотностью, которая не будет сливаться в течение желаемого времени анализа. Например, среднее время удвоения U2OS составляет 24 часа. Посев 2000 клеток в лунку в 72-часовом анализе является оптимальным для интерпретации скорости их роста. - Определите взаимосвязь между темпами роста/смертности и численностью популяции. Для этого используйте модель рождения/смерти и симуляцию, инициализированную всеми вероятными парными комбинациями темпов роста и смертности. Для этого моделирования требуется среднее количество живых клеток с контрольной пластины T0 (x0), продолжительность анализа (t) и определяемый пользователем диапазон вероятных скоростей пролиферации (p) и смертности (d).


- Чтобы определить правдоподобные значения темпов роста, начните с необработанной скорости роста в удвоении клеточной популяции в час (1/T) как самой высокой скорости роста и 0 как самой низкой скорости роста. Разделите этот диапазон на 500 равномерно расположенных сегментов. Аналогичная операция может быть применена и для смертности, проверив диапазон от 0 до 1.
ПРИМЕЧАНИЕ: Все парные комбинации 500 скоростей могут быть выполнены с использованием любой среды программирования, но могут быть слишком интенсивными с точки зрения вычислений при использовании некоторого программного обеспечения. Сведение этого показателя ко всем парным комбинациям 50 коэффициентов роста и смертности может смягчить эту проблему, при этом точность вывода уменьшится. Шаблон электронной таблицы был предоставлен вместе с этим протоколом.
- Чтобы определить правдоподобные значения темпов роста, начните с необработанной скорости роста в удвоении клеточной популяции в час (1/T) как самой высокой скорости роста и 0 как самой низкой скорости роста. Разделите этот диапазон на 500 равномерно расположенных сегментов. Аналогичная операция может быть применена и для смертности, проверив диапазон от 0 до 1.
- Определите значения GR и LF (описанные выше) для каждой моделируемой пары скорости пролиферации (p) и смертности (d).
ПРИМЕЧАНИЕ: На шагах 7.2-7.3 будет создана таблица, содержащая каждую теоретическую пару коэффициентов пролиферации и смертности, с вычисленными значениями GR и LF для этой теоретической пары. Она будет функционировать как справочная таблица, связывающая экспериментально наблюдаемую пару значений GR и LF с парой показателей пролиферации и смертности, вызванных лекарственными препаратами. Тестирование более 500 дискретных значений на пролиферацию и смертность приведет к более точному числу значений, но этот уровень точности, вероятно, будет превосходить точность анализа. - Вычислите попарное расстояние между каждой экспериментально рассчитанной парой ОТ/НЧ и каждой теоретической парой ОТ/НЧ в таблице поиска. Сделайте вывод о том, что теоретическая пара с минимальным расстоянием до экспериментально наблюдаемой пары значений GR/LF является истинной частотой пролиферации и смертности, вызванной лекарственными препаратами.
8. Определение путей смерти с помощью селективных химических ингибиторов
Примечание: Химических ингибиторов одних только недостаточно для окончательного определения механизма смерти от данного препарата. Химические ингибиторы путей смерти должны использоваться для определения того, какие биохимические или фенотипические реакции следует исследовать в последующих экспериментах, которые, вероятно, будут включать морфологическую оценку, биохимические маркеры, специфичные для путей, и оценку генетических зависимостей.
- Оптимизируйте дозу каждого ингибитора клеточной смерти в интересующей клеточной линии путем тестирования диапазона концентраций ингибитора в контексте канонического активатора интересующего пути (путей) смерти (Таблица 2). В идеале выбранная доза ингибитора сама по себе не должна влиять на жизнеспособность клеток (см. метрику GR).
ПРИМЕЧАНИЕ: Не все клеточные линии могут активировать все пути смерти. Биохимическая или фенотипическая валидация может потребоваться при тестировании активаторов/ингибиторов различных путей смерти. - Рассмотрим оптимальную схему расположения гальванических покрытий для ингибиторного экрана. Чтобы свести к минимуму периодические эффекты, храните каждый препарат на той же пластине, что и оцениваемый ингибитор (ингибиторы), а повторяющиеся препараты — на отдельных планшетах.
- Засейте желаемое количество клеток в каждой лунке 96-луночной пластины с черными стенками с оптическим дном, аналогично шагу 3.3. Уменьшите объем покрытия до 80 мкл с учетом объемов ингибитора и препарата.
- Приготовьте 10-кратную концентрацию испытуемых ингибиторов в полной среде и добавьте по 10 мкл в каждую лунку. Предварительно обрабатывайте клетки ингибиторами пути смерти в течение 2-4 ч. После этого добавьте интересующие вас препараты и получите показания флуоресценции, как в шагах 3-5.
- Оцените изменение времени наступления смерти (ДО) и/или максимальной летальной фракции для оценки эффективности ингибитора (ингибиторов). DO — это выводимый параметр из модели Lag Exponential Death (LED). Смотрите шаги 5.6 - 5.7.
Результаты
Используя этот протокол, мы исследовали чувствительность клеток U2OS к ингибитору HDAC белиностату. Эти эксперименты были проведены с использованием 2 мкМ SYTOX Green для мечения мертвых клеток (рис. 1A). Кинетические показания были получены с помощью флуоресцентного считывателя пластин с коэффициентом усиления 130 (рис. 1B). Клетки лизировали в 1,5% растворе Triton-X в PBS в течение 2 ч в конце анализа (рис. 1C-D).
Протокол FLICK дает представление о темпах роста населения и смертности клеток, вызванных лекарственными препаратами. Эти выводы можно просматривать по отдельности или с помощью системы визуализации и анализа лекарственных препаратов GRADE, рассматриваемых вместе (рис. 1E). Оценка чувствительности Белиностата с использованием значения GR показывает, что 1 мкМ Белиностата дает значение GR примерно 0 (Рисунок 2A). По шкале GR положительные значения указывают на темпы роста населения, а отрицательные — на темпы сокращения населения. Таким образом, значение GR, равное 0, показывает, что популяция остается в состоянии стазиса (т.е. цитостатического лекарственного ответа). Учитывая традиционную интерпретацию цитостаза, можно сделать вывод, что 1 мкМ белиностат вызывает полное ингибирование роста без какого-либо уничтожения клеток. Тем не менее, оценка летальной фракции, вызванной препаратом, показывает, что 1 μМ белиностат вызывал примерно 50% летальности в ходе этого анализа (рис. 2B). В большинстве случаев эти два вывода были бы получены из различных экспериментов, которые нельзя сравнивать по принципу «яблоко к яблоку». Важно отметить, что с помощью анализа FLICK оба вывода получены из одних и тех же экспериментальных данных, но проанализированы по-разному, чтобы отразить влияние белиностата на рост популяции в зависимости от гибели клеток.
Эти два анализа также могут быть интегрированы с помощью аналитического метода GRADE (рис. 2C). Drug GRADE сопоставляет летальную фракцию, которая пропорциональна среднему коэффициенту смертности, со значением GR, чистым темпом прироста населения. Интеграция данных таким образом обеспечивает визуализацию того, как лекарство координирует ингибирование роста и активацию смерти. В рамках графика GRADE: препараты, которые ингибируют рост, не активируя смерть (т.е. цитостатические препараты, используя общепринятую интерпретацию), будут занимать верхнюю границу, препараты, которые только убивают, не изменяя скорость пролиферации клеток, будут занимать правую границу, а препараты, которые сначала вызывают ингибирование роста, за которой следует гибель клеток, остановленных в росте, будут занимать левую границу (т.е. двухфазные препараты; Рисунок 2В). Можно предположить, что препараты, которые приводят к ответам GR/LF, попадающим в эти границы, одновременно в некоторой степени ингибируют пролиферацию и одновременно активируют гибель клеток (т.е. сопутствующие препараты)3. Важно отметить, что положение каждого лекарственного ответа в пространстве GR/LF может быть использовано для вычисления истинного коэффициента пролиферации (p) и среднего коэффициента смертности (d) для каждой концентрации препарата (рисунок 2D-E). Обратите внимание, что значение ГР – это не истинная скорость пролиферации клеток, а скорее чистая скорость роста популяции (т.е. суммарный эффект, сочетающий истинную скорость пролиферации и смертность, вызванную лекарственными препаратами). Кроме того, коэффициент смертности, полученный в анализе GRADE (d, который является средним коэффициентом смертности), отличается от параметра смертности в кинетическом анализе светодиодов (DR, максимальная скорость или максимальная смертность).
Анализ FLICK может генерировать данные, специфичные для смерти, такие как летальная фракция, вызванная лекарством; Тем не менее, эти данные не зависят от механизма клеточной смерти. Чтобы получить представление о механизме клеточной смерти с помощью FLICK, самый простой метод заключается в том, чтобы определить, как кинетика летальной фракции изменяется при включении ингибиторов, специфичных для пути смерти. Ингибирование соответствующего механизма смерти должно приводить к снижению летальной фракции, вызванной препаратом, и/или к отсрочке наступления смерти. Здесь мы показываем, что 50 мкМ ингибитора панкаспазы z-VAD спасают около 50% летальности, вызванной 1 мкМ белиностатом (рис. 2F). Важно отметить, что, как и лекарства, ингибиторы имеют ограниченную специфичность и могут случайно ингибировать или усугублять другие механизмы смерти. Таким образом, прежде чем сделать окончательный вывод, эти данные должны быть дополнены другими выводами, такими как морфология клеток, измерение биохимических маркеров активации и/или оценка генетических зависимостей, специфичных для путей.
Чтобы формально проиллюстрировать, как интерпретация реакции на лекарство может быть изменена с помощью оценки на основе FLICK и анализа на основе GRADE, мы затем рассмотрели три препарата, которые имеют различные типы координации роста/смерти. Палбоциклиб является ингибитором Cdk4/6, который приводит к цитостатическому ответу (ингибирование роста без гибели клеток). Камптотекин является ингибитором топоизомеразы I, который вызывает двухфазный ответ (ингибирование роста с последующей гибелью клеток при высоких дозах). Белиностат является ингибитором HDAC, который вызывает совпадающую реакцию (частичное ингибирование роста и активация смерти при каждой дозе, но с различными пропорциями в зависимости от дозы). Используя традиционный анализ этих данных, можно отметить, что все три препарата существенно снижают относительную жизнеспособность клеток U2OS (рис. Хотя Палбоциклиб заметно менее активен, из этих данных неясно, не является ли Палбоциклиб неактивацией клеточной смерти. Используя анализ на основе ГР, который сообщает, как лекарства влияют на чистый темп роста популяции, можно более точно интерпретировать, что популяции, получавшие Палбоциклиб, продолжают увеличиваться при всех дозах, в то время как высокие дозы Камптотекина или Белиностата приводят к сокращению популяции, и, таким образом, гибель клеток должна быть активирована после высоких доз этих препаратов (Рисунок 2H). Тем не менее, анализ, основанный на ГР, не учитывает различную координацию между ростом и смертью, что может привести к ошибочным выводам об уровне гибели клеток, активируемой данным препаратом. Например, на основании данных ГР можно сделать вывод, что 1 мкМ Камптотекин активирует гибель клеток в большей степени, чем 1 мкМ Белиностат, учитывая, что Камптотекин приводит к значению ГР -0,25, а Белиностат дает значение ГР 0; значение -0,25 GR означает, что популяция сокращается на 25% так же быстро, как растет популяция без лечения. Используя визуализацию и анализ на основе GRADE, можно наблюдать, что камптотекин и белиностат различаются по координации роста/смерти. Таким образом, при дозе 1 мкМ оба Белиностата активируют смерть с большей скоростью, чем Камптотекин (0,8% смертей/ч для Белиностата, по сравнению с 0,7% смертей/ч для Камптотекина), но популяция, получавшая Камптотекин, сокращается быстрее из-за более выраженного ингибирования роста, индуцированного этим препаратом (Рисунок 2I).

Рисунок 1: Блок-схема протокола FLICK. (A) Создание клеточного разведения для оптимизации концентрации красителя ДНК и линейности измерений флуоресценции на считывателе микропланшетов. (B) Получить титрование по номеру клетки для 2 мкМ SYTOX Green в клетках U2OS. Коэффициент усиления 130 обеспечивает наиболее линейный сигнал по всем номерам сот. (C) Фазовые изображения клеток U2OS, лизированных 1,5% Triton-X с течением времени с использованием 10-кратного объектива. Прямоугольная область представляет собой увеличенное изображение флуоресценции SYTOX Green. Масштабные линейки репрезентативны для всех изображений. (D) SYTOX Зеленый сигнал после лизиса в указанное время. Данные представляют собой среднее значение +/- SD для 3 биологических репликатов. (E) Концептуальный обзор анализа, от его создания до анализа. Ключевыми этапами являются создание планшета для разведения препарата, лекарственное лечение клеток в многолуночном планшете, получение данных измерений флуоресценции с течением времени, а также расчет показателей роста и гибели. Для панелей B и D данные являются средним ± SD для n = 3 независимых биологических репликатов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Характеристика реакции на лекарственные препараты с помощью анализа FLICK и анализа на основе GRADE. (A) Метрика GR для ингибитора HDAC, белиностата, в дозе дозы. Показанные данные взяты из конечной точки анализа, которая составила 66 ч. При концентрации 1 мкМ Белиностат имеет значение GR примерно 0, что указывает на цитостатическую реакцию. (B) Кинетика летальной фракции для Белиностата. При концентрации 1 мкМ Белиностат индуцирует почти 50% летальности, которая не учитывается значением GR. (C) Фазовая диаграмма GRADE, основанная на моделировании всех возможных темпов роста и смертности. Моделирование было основано на времени удвоения U2OS в этом анализе (27,12 ч). (D) График GRADE для Белиностата по дозе в конечной точке анализа. (E) Столбчатая диаграмма предполагаемых по шкале GRADE темпов роста (p, удвоение населения в час) и смертности (d, доля населения, умирающего в час) для доз белиностата. Скорости были определены на основе смоделированных скоростей в (C) и данных из (D). (F) График летальной фракции для 1 мкМ белиностата, обработанного (фиолетовым) или без (черным) 50 мкМ ингибитора апоптотического апоптоза z-VAD. ΔLF = 0,18 рассчитывали путем вычитания среднего максимального LF из состояния, обработанного ингибиторами, из среднего максимального LF из контроля. (G) Относительная жизнеспособность (количество живых клеток в состоянии, обработанном препаратом, разделенное на количество живых клеток в необработанном состоянии) для трех препаратов после 72-часового воздействия. Все препараты снижают жизнеспособность клеток, но вклад клеточной смерти в ответ неизвестен. (H) Метрика GR для трех препаратов в (G). Эти данные демонстрируют, что два из трех препаратов приводят к сокращению популяции, на что указывает GR < 0. Вклад клеточной гибели до сих пор неясен, хотя клеточная смерть должна была быть активирована, когда значение GR отрицательное. (I) Предполагаемые нормы GRADE для трех препаратов. Палбоциклиб не приводит к летальному исходу, но приводит к остановке роста. Камптотекин является двухфазным; Более низкие дозы приводят к остановке роста, в то время как более высокие дозы приводят к остановке роста с последующей летальностью. Белиностат является случайным препаратом; диапазон доз пересекает середину графика GRADE, указывая на то, что все дозы приводят к нарушению роста и активации клеточной гибели. Данные на всех панелях представляют собой среднее значение ± SD для трех независимых экспериментов по биологической репликации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Краска | Кинетический | Конечная точка |
| СИТОКС Грин | Y | Y |
| СеллТокс Грин | Y | Y |
| NucSpot 500/515, 594/615, 750/780 | Y | Y |
| ЙО-3 | Y | Y |
| Йодид пропидиума | N | Y |
| 7-ААД | N | Y |
Таблица 1: ДНК-красители и их применение в FLICK. Многие типы красителей могут быть использованы для анализа FLICK только в конечной точке. Меньшее количество красителей соответствует условиям непрерывной инкубации на протяжении всего анализа. Другие красители, в том числе красители, которые не являются зелеными, не были глубоко охарактеризованы и должны быть тщательно оценены перед использованием.
| Путь смерти | Ингибитор | Типичная доза |
| Внутренний апоптоз | ЗВАД-ФМК | 50 мкМ |
| Внешний апоптоз | Z-IETD | 30 мкМ |
| Ферроптоз | Ферростатин-1 | 10 μМ |
| Некроптоз | Некростатин-1 | 50 мкМ |
| Пироптоз | ВХ-765 | 50 мкМ |
| Партанатос | Рукапариб | 1 мкМ |
| Аутофагическая зависимая гибель клеток | Гидроксихлорохин (HCQ) | 10 μМ |
| Гибель лизосомальных зависимых клеток | Е-64Д | 10 μМ |
| Купроптоз | Тетратиомолибдат (ТТМ) | 5 мкМ |
| Оксейптоз | N-ацетил-l-цистеин (NAC) | 2 мМ |
| Некроз, вызванный МПТ | Циклоспорин А (CsA) | 10 μМ |
Таблица 2: Пути гибели клеток и их ингибиторы. Ингибиторы клеточной смерти должны быть валидированы в отношении канонического активатора для каждого пути смерти. Выбранные дозы ингибиторов в идеале не должны влиять на жизнеспособность клеток.
Дополнительная таблица 1: Калькулятор GRADE. Таблица для расчета темпов роста и смертности, вызванных лекарственными препаратами, на основе данных GR и FV на основе FLICK. Пользователи должны ввести данные GR и FV, а также продолжительность анализа в часах, время удвоения ячеек в часах и начальные/конечные размеры популяции. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Анализ FLICK является надежным методом для получения всесторонней оценки влияния лекарственного препарата на рост и гибель клеточной популяции. Поскольку этот метод напрямую не подсчитывает клетки, важнейшими этапами протокола являются обеспечение линейности анализа и полного лизиса на этапах пермеабилизации тритонов. Правильное время пермеабилизации может быть определено визуально, как показано в этом протоколе, или количественно путем считывания флуоресценции пластины с течением времени и определения того, когда сигнал выходит на плато. Однако, по нашему опыту, когда мы сомневаемся, кажется, что нет никаких затрат на более длительное ожидание: для красителей ДНК, которые мы использовали в анализе FLICK, интенсивность сигнала остается стабильной в течение нескольких дней после лизиса. Мы регулярно используем краситель для нуклеиновых кислот SYTOX Green, и хотя мы не проверили каждый флуорофор, упомянутый в таблице 1, несколько других протоколов демонстрируют их эффективное использование 13,15,16. Оценка линейности данного непроницаемого для клетки красителя ДНК в диапазоне номеров клеток и настроек прибора обеспечит надежные и количественно надежные данные.
Некоторые клеточные линии сложнее лизировать, чем другие, и никогда не следует предполагать, что время лизиса для одной клеточной линии такое же, как и для другой13. Для некоторых клеточных линий при более высокой плотности лизис клеток приводит к тому, что клетки отрываются от колодца в виде листа, что может привести к ошибке считывателя пластин. Этого можно избежать, уменьшив начальную плотность засева или перемешивая лунки с помощью пипеток после лизиса и до считывания. Чтобы увеличить время лизиса или повысить эффективность лизиса, решение Triton-X можно настроить в сторону большего или более низкого процента, но мы еще не сталкивались со сценарием, в котором это было бы необходимо.
План эксперимента и схема разработки лекарственного препарата должны быть тщательно продуманы, когда требуются надежные данные о росте. Создание планшета для разведения препарата для анализа FLICK аналогично любому другому анализу на 96-луночной пластине. Тем не менее, включение множества элементов управления, охватывающих различные части ландшафта плиты, поможет получить надежное представление о кинетике роста и может помочь определить, существует ли систематическая изменчивость роста. Избегание внешних скважин пластины позволит получить более точные данные о росте, так как эти скважины более чувствительны к колебаниям температуры, кислорода или влажности, влияющим на их рост. Наконец, использование псевдорандомизированной схемы введения лекарств, такой как изменение местоположения препарата на реплицируемых пластинах, обеспечит более точную оценку поведения препарата.
Существуют некоторые ограничения для точного использования анализа FLICK. Эти ограничения в основном связаны с кинетическим выводом, поскольку данные конечной точки являются экспериментально наблюдаемыми значениями. Как кинетика пролиферации живых клеток, так и кинетика смерти зависят от некоторых предположений относительно траектории роста живых клеток с течением времени в условиях, обработанных лекарственными препаратами. В этом протоколе мы описываем эту траекторию роста как экспоненциальную и с равномерной скоростью во времени. В то время как эти особенности, вероятно, будут наблюдаться в отсутствие лекарства, они могут не соблюдаться в присутствии лекарства. Метод FLICK точен не потому, что предположения о траекториях роста всегда верны, а потому, что влияние любых неверных предположений сводится к минимуму, если популяция, получавшая лекарственные препараты, не размножается очень сильно (т.е. менее 2 или 3 удвоений популяции за период анализа). Мы не сталкивались с препаратами, которые нельзя было бы точно профилировать в FLICK; тем не менее, теория предполагает, что анализ FLICK перестанет быть точным для препарата, у которого смерть наступает очень медленно, в течение длительных периодов времени, которые в несколько раз превышают время удвоения клеток (примечание: мы не выявили ни одного препарата сэтими свойствами). Тем не менее, влияние любых неверных предположений о кинетике роста всей популяции не повлияет на время наступления смерти, полученное от установки светодиода, или на окончательные максимальные значения LF, поскольку они ограничены эмпирически измеренными значениями мертвых клеток и окончательными общими значениями клеток, которые были экспериментально определены в конце анализа.
Несмотря на эти ограничения, анализ FLICK позволяет получить информацию, которую сложно получить с помощью других методов ответа на лекарственные препараты. Большинство методов ответа на лекарственные препараты генерируют сигнал, пропорциональный количеству живых клеток, и эти методы могут быть использованы для количественной оценки того, как лекарственные препараты влияют на чистый темп роста популяции (т.е. значение ГР или эквивалент), но не могут точно различить цитотоксические и цитостатические эффекты препарата. В качестве альтернативы, анализы на основе микроскопии, которые измеряют как живые, так и мертвые клетки, безусловно, могут дать полную картину. Тем не менее, анализы, основанные на микроскопии, могут испытывать трудности с подсчетом мертвых клеток после того, как клетки разлагаются на обломки, что быстро происходит в контексте многих неапоптотических форм клеточной смерти. Ключевой особенностью FLICK является то, что измерения проводятся в планшетном считывателе, который агрегирует общую флуоресценцию мертвых клеток, а не подсчитывает мертвые клетки напрямую. Таким образом, сигнал мертвых клеток в FLICK не зависит от интактной клеточности мертвых клеток, которая в контексте неапоптотической гибели клеток является уникально существенной. Кроме того, уникальной особенностью анализа FLICK является возможность измерения популяций живых и мертвых клеток с использованием одного и того же реагента. Таким образом, анализ FLICK позволяет измерять живые и мертвые клетки с одинаковой чувствительностью. Эта функция позволяет проводить анализ с использованием метода GRADE и повышает точность одновременных расчетов темпов роста и смертности по методу GRADE. Прилагаемая дополнительная таблица 1 включает шаблон, используемый для визуализации GRADE лекарственного средства, в который пользователь может ввести длину анализа, рассчитанную скорость роста на шаге 7.1, начальное и конечное количество клеток или показания флуоресценции из контрольных условий, а также рассчитанные LF и GR из этапов 5.4 и 6.3. Файл содержит симуляцию всех парных комбинаций 50 темпов роста и смертности, которая будет автоматически обновляться на основе заданных пользователем параметров. Шаблон генерирует визуализацию на основе GRADE ответа на лекарственный препарат и предполагаемых по GRADE темпов роста (p) и смертности (d).
В будущей работе следует изучить применение анализа FLICK в сценариях 3D-культивирования клеток или при оценке реакции на лекарства органоидов опухолевого происхождения. Линейность и чувствительность данных FLICK не подвергались глубокому исследованию в этих контекстах, но теоретически анализ FLICK должен быть эффективным с некоторыми модификациями для интеграции флуоресценции в трехмерных образцах. Кроме того, добавление дополнительных клеточно-специфичных меток поможет различать два или более типов клеток в кокультуре. Эти достижения будут полезны для изучения взаимодействия иммунных клеток с раковыми клетками. Наконец, такие анализы, как SPARKL, вдохновляют на использование репортеров, специализирующихся на смерти, в формате анализа FLICK, что может повысить производительность при сохранении точностианализа клеточной смерти.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Мы благодарим всех бывших и нынешних сотрудников лаборатории Ли за их вклад в то, как наша лаборатория оценивает реакцию на лекарства. Эта работа была поддержана финансированием со стороны Национальных институтов здравоохранения для MJL (R21CA294000 и R35GM152194).
Материалы
| Name | Company | Catalog Number | Comments |
| Belinostat | ApexBio | A4612 | |
| Camptothecin | ApexBio | A2877 | |
| Conical centrifuge tube, 15mL | Fisher Scientific | 12-565-269 | |
| DMEM | Corning | 10017CV | For seeding and drugging cells |
| DMSO | Fisher Scientific | MT-25950CQC | For seeding and drugging cells |
| Fisherbrand 96-Well, Cell Culture-Treated, U-Shaped-Bottom Microplate | Fisher Scientific | FB012932 | For seeding and drugging cells (pin plate) |
| Greiner Bio-One CELLSTAR μClear 96-well, Cell Culture-Treated, Flat-Bottom Microplate | Greiner | 655090 | For seeding and drugging cells |
| IncuCyte S3 | Essen Biosciences | Any phase microscope will work | |
| MATLAB | MathWorks | https://www.mathworks.com/products/matlab.html | MATLAB version R2023b, a license is required |
| Microplate fluorescence reader | Tecan | Spark | For measuring dead cell fluorescence |
| Palbociclib | ApexBio | A8316 | |
| PBS | Corning | 21-040-CM | Any PBS works |
| Spark Multimode Microplate Reader | Tecan | https://www.tecan.com/spark-overview | SparkControl software version 2.2 |
| Sterile reservoir, 25 mL | Fisher Scientific | 13-681-508 | For seeding and drugging cells |
| Sytox Green nucleic acid stain | Thermo Fisher Scientific | S7020 | DNA stain for measuring dead cell fluorescence |
| Triton-X 100 | Thermo Fisher Scientific | J66624-AP | For permeabilizing cells |
| U2OS | ATCC | HTB-96 | An example cell line used in this protocol |
| Z-VAD-FMK | ApexBio | A1902 |
Ссылки
- Hafner, M., Niepel, M., Sorger, P. K. Alternative drug sensitivity metrics improve preclinical cancer pharmacogenomics. Nat Biotechnol. 35 (6), 500-502 (2017).
- Dixon, S. J., Lee, M. J. Quick tips for interpreting cell death experiments. Nat Cell Biol. 25 (12), 1720-1723 (2023).
- Schwartz, H. R., et al. Drug GRADE: An Integrated Analysis of Population Growth and Cell Death Reveals Drug-Specific and Cancer Subtype-Specific Response Profiles. Cell Rep. 31 (12), 107800(2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nat Methods. 13 (6), 1-11 (2016).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ. 25 (3), 486-541 (2018).
- Tsvetkov, P., et al. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science. 375 (6586), 1254-1261 (2022).
- Holze, C., et al. Oxeiptosis, a ROS-induced caspase-independent apoptosis-like cell-death pathway. Nat Immunol. 19 (2), 130-140 (2018).
- Maltese, W. A., Overmeyer, J. H. Methuosis Nonapoptotic Cell Death Associated with Vacuolization of Macropinosome and Endosome Compartments. Am J Pathol. 184 (6), 1630-1642 (2014).
- Inde, Z., Forcina, G. C., Denton, K., Dixon, S. J. Kinetic Heterogeneity of Cancer Cell Fractional Killing. Cell Rep. 32 (1), 107845(2020).
- Forcina, G. C., Conlon, M., Wells, A., Cao, J. Y., Dixon, S. J. Systematic Quantification of Population Cell Death Kinetics in Mammalian Cells. Cell Syst. 4 (6), 1-18 (2017).
- Gelles, J. D., et al. Single-Cell and Population-Level Analyses Using Real-Time Kinetic Labeling Couples Proliferation and Cell Death Mechanisms. Dev Cell. 51 (2), 277-291.e4 (2019).
- Richards, R., et al. Drug antagonism and single-agent dominance result from differences in death kinetics. Nat Chem Biol. 16 (7), 791-800 (2020).
- Richards, R., Honeywell, M. E., Lee, M. J. FLICK: an optimized plate reader-based assay to infer cell death kinetics. STAR Protoc. 2 (1), 100327(2021).
- Honeywell, M. E., et al. Functional genomic screens with death rate analyses reveal mechanisms of drug action. Nat Chem Biol. 20 (11), 1443-1452 (2024).
- Jannoo, R., Xia, Z., Row, P. E., Kanamarlapudi, V. Targeting of the Interleukin-13 Receptor (IL-13R)α2 Expressing Prostate Cancer by a Novel Hybrid Lytic Peptide. Biomolecules. 13 (2), 356(2023).
- Gelles, J. D., Chipuk, J. E. Why not add some SPARKL to your life (and death)! Mol Cell Oncol. 7 (1), 1685841(2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены