Method Article
تحليل شامل للاستجابة للأدوية باستخدام اختبار FLICK
In This Article
Summary
يصف هذا البروتوكول كيفية استخدام مقايسة FLICK لتقييم استجابات الأدوية ، بما في ذلك التعليمات التفصيلية لاستخدام هذا الاختبار لحساب معدلات النمو الناجم عن الأدوية ومعدلات الوفيات وتقييم آلية موت الخلايا الناجم عن الدواء.
Abstract
لفهم فعالية الدواء ، هناك حاجة ماسة لتوصيف مدى موت الخلايا الناجم عن الأدوية. تواجه الجهود المبذولة لتحديد مستوى موت الخلايا الناجم عن المخدرات تحديا من خلال وجود أكثر من اثني عشر شكلا متميزة جزيئيا من الموت المنظم ، ولكل منها توقيت التنشيط الخاص به والسمات المميزة للكيمياء الحيوية. علاوة على ذلك ، بالنسبة لبعض الأنواع الفرعية للموت النخر ، لا يتم ملاحظة السمات المميزة إلا بشكل عابر وتضيع بسرعة بسبب تمزق الخلية. وبالتالي ، حتى عند استخدام مجموعة من المقايسات الخاصة بمسار الموت ، من الصعب تحديد الكمية الإجمالية لموت الخلايا بدقة أو المساهمات النسبية لكل نوع فرعي من الوفاة. هناك مشكلة أخرى تتمثل في أن العديد من المقايسات الخاصة بالوفاة تتجاهل كيفية تأثير الأدوية على تكاثر الخلايا ، مما يجعل من الصعب تفسير ما إذا كان عدد السكان المعالجين بالمخدرات يتوسع أو يتقلص. يسمح اختبار FLICK بتحديد المستوى الكلي لموت الخلية بعد التحفيز بطريقة خاصة بالموت ولكنها أيضا محايدة إلى حد كبير لنوع (أنواع) الموت الذي تم تنشيطه. بالإضافة إلى ذلك ، يحتفظ اختبار FLICK بمعلومات حول الحجم الإجمالي للسكان ومعدل تكاثر الخلايا. في هذه المخطوطة ، نصف الاستخدام الأساسي لمقايسة FLICK ، وكيفية استكشاف أخطاء هذا الاختبار وإصلاحها عند استخدام أنواع مختلفة من المواد البيولوجية ، وكيفية استخدام مقايسة FLICK لتحديد مساهمات كل نوع من أنواع موت الخلايا في استجابة الدواء المرصودة.
Introduction
بالنسبة للأدوية المضادة للسرطان ، يتضمن التقييم قبل السريري لحساسية الدواء بشكل عام اختبار كيفية تأثير الأدوية على صلاحية الخلايا في الثقافة1. إن صلاحية الخلية بعد التعرض للأدوية هي نتاج تأثيرين منفصلين على الأقل: تثبيط تكاثر الخلايا الناجم عن الدواء وتنشيط موت الخلايا2. لسوء الحظ ، على الرغم من أن موت الخلايا هو ميزة مهمة مطلوبة لاستجابات الأدوية الدائمة ، إلا أن الأساليب القياسية تفشل في توضيح الدرجة التي ينشط بها الدواء موتالخلايا 3.
تشمل فحوصات الاستجابة للأدوية الشائعة تلك التي تحسب الخلايا مباشرة (على سبيل المثال ، Coulter Counter ، وبعض استخدامات قياس التدفق الخلوي أو الفحص المجهري) ، أو تحدد قدرة الخلايا على التكاثر (على سبيل المثال ، مقايسة تكوين المستعمرة) ، أو تحدد كمية نشاط التمثيل الغذائي (على سبيل المثال ، CellTiter-Glo ، فحوصات MTT أو MTS القائمة على التيترازوليوم). الميزة المشتركة لهذه المقايسات هي أن البيانات التي تم إنشاؤها تتناسب مع عدد الخلايا الحية. نظرا لأن الأدوية تختلف اختلافا كبيرا في كيفية تنسيقها لتثبيط النمو وموت الخلايا ، فإن عدد الخلايا الحية بعد التعرض للأدوية يوفر نظرة ثاقبة غير موثوقة لمستوى موت الخلايا الناجم عنالمخدرات 3. علاوة على ذلك ، نظرا لأن الخلايا السرطانية تتكاثر بشكل عام بسرعة في زراعة الخلايا ، يمكن تقليل عدد الخلايا الحية بشكل كبير بالنسبة للسكان غير المعالجين دون التسبب في أي موت للخلايا4. وبالتالي ، فإن العيب المركزي هو أنه لا يمكن قياس درجة موت الخلايا دون قياس عدد الخلايا الحية والميتة.
من الصعب تحديد عدد الخلايا الميتة بعد التعرض للمخدرات بدقة لعدة أسباب2. أولا ، يوجد أكثر من اثني عشر مسارا لموت الخلايا المنظمة5،6،7،8. على الرغم من وجود علامات كيميائية حيوية بشكل عام لتحديد كل نوع من أنواع موت الخلايا المنظم ، إلا أن هذه العلامات تختلف في خصوصيتها ، ولا يمكن استخدام اختبار واحد لتحديد جميع أنواع الموت الفرعية في وقت واحد. ثانيا ، يمكن أن يختلف توقيت التنشيط لكل شكل من أشكال موت الخلايا بشكل كبير اعتمادا على السياق ، لذلك لا يمكن أن تظهر صورة كاملة ما لم يتم تحديد الموت بمرور الوقت9،10. تنتج العديد من المقايسات الكيميائية الحيوية لقياس موت الخلايا قياسا لنقطة النهاية ، لذا فإن إنشاء البيانات الحركية يمكن أن يكون أمرا صعبا ومحدودا بالتكلفة. المضاعفات الثالثة هي أن الخلية الميتة نفسها هي حالة وسيطة عابرة بين حالة الخلية الحية وبقايا الخلية المنفصلة. يختلف استقرار الخلايا الميتة اعتمادا على النوع الفرعي للموت ، حيث تخلق بعض الأنواع ، مثل موت الخلايا المبرمج ، جثثا مستقرة نسبيا ، بينما تسبب أنواع الموت الأخرى التحلل السريع. وبالتالي ، فإن طرق تحديد الموت التي تتطلب جمع الخلايا الميتة وعدها ستنتج أيضا فهما متحيزا لموت الخلايا. أخيرا ، القيد الرابع هو أن المقايسات الكيميائية الحيوية التي تحدد درجة موت الخلايا تفشل عادة في تقديم أي نظرة ثاقبة حول كيفية تغيير الدواء للانتشار. وبالتالي ، لا يمكن تفسير الحجم الكلي للسكان - والأهم من ذلك ، ما إذا كان السكان يتوسع أو يتقلص.
بعض المقايسات القائمة على الفحص المجهري ، مثل STACK و SPARKL ، فعالة في قياس الخلايا الحية والميتة بمرور الوقت ، ويمكن أن تنتج هذه المقايسات رؤى شاملة حول موت الخلايا الناجم عنالمخدرات 10،11. ومع ذلك ، تتطلب هذه المقايسات أدوات متخصصة ، مثل مجهر Incucyte ، مما يخلق قيودا على الإنتاجية والوصول إلى هذه الأساليب. بالإضافة إلى ذلك ، تتطلب التقنيات القائمة على الفحص المجهري أن تظل الخلايا الميتة في المستوى البؤري للمجهر طوال مدة التجربة ، مما يضر بالقدرة على تحديد الخلايا الميتة عندما تفقد التصاقها باللوحة أو بمرور الوقت مع تحلل الخلايا الميتة. وبالمثل ، تواجه المقايسات القائمة على الفحص المجهري تحديات عند تطبيقها في سياق ثقافات التعليق ، حيث تنجرف الخلايا داخل وخارج مستوى بؤري معين.
لمعالجة المشكلات الموضحة أعلاه ، قمنا بإنشاء اختبار يسمى FLICK (الاستدلال القائم على التألق والمعتمد على التحلل لحركية موت الخلية) 12،13. الهدف من اختبار FLICK هو تحديد مستوى موت الخلايا الناجم عن المخدرات ، بغض النظر عن كيفية موت الخلايا. تستخدم طريقة FLICK أصباغ غير منفذة للخلية ، والتي يعتمد تألقها على ارتباط الحمض النووي. تتمثل السمة الرئيسية ل FLICK في استخدام هذه الفلوروفورات لتسمية تراكم الخلايا الميتة بمرور الوقت بفضل الحمض النووي الذي يمكن الوصول إليه ، متبوعا بتحلل ميكانيكي قائم على المنظفات لاختراق أي خلايا حية في نهاية الفحص. تتيح هذه البيانات ، جنبا إلى جنب مع النمذجة الرياضية ، القياس الكمي لكل من مجموعات الخلايا الحية والميتة بدقة زمنية مستمرة ودون الحاجة إلى جمع الخلايا الميتة أو التعامل معها. علاوة على ذلك ، فإن استخدام قارئ اللوحة لتقييم مضان الخلايا الميتة يسمح بتقييم الخلايا الميتة دون الحاجة إلى بقاء الخلايا الميتة سليمة ، وبالتالي التخفيف من التحيز ضد أشكال الموت النخرية التي تؤدي إلى تمزق الخلية. أخيرا ، يتطلب اختبار FLICK الحد الأدنى من التعامل مع اللوحة ويمكنه إنشاء قياسات حركية بسرعة ، مما يسمح بفحص الأدوية عالي الإنتاجية. في هذا البروتوكول ، نركز على استخدام اختبار FLICK ، بما في ذلك كيفية استخدام FLICK لاستنتاج معدل النمو الناجم عن الدواء ، ومعدل الوفيات ، و / أو آليات موت الخلايا.
Protocol
1. تحسين وقت النفاذية لكل خط خلية محل اهتمام
ملاحظة: الوحدات المجلدة والكميات الموضحة مخصصة لتحسين خط خلية واحد. يجب توسيع نطاق هذه القيم بناء على عدد خطوط الخلايا التي سيتم اختبارها.
- قم بلوحة العدد المطلوب من الخلايا في كل بئر من 96 بئر ، قاع بصري ، صفيحة سوداء الجدران. أضف 100 ميكرولتر من الوسط الكامل واترك الخلايا تلتصق باللوحة طوال الليل.
ملاحظة: يجب تحسين رقم الخلية المطلية مع مراعاة معدل نمو الخلايا والكثافة المثلى وطول المقايسة. أرقام خلايا البداية النموذجية لخطوط الخلايا السرطانية الملتصقة التي تم قياسها على مدار 72 ساعة هي 1500-5000 خلية لكل بئر. على سبيل المثال ، يمكن طلاء خلايا U2OS عند 2000 خلية لكل بئر في DMEM مع 10٪ FBS و 2 ملي مولار جلوتامين و 1٪ Pen-Strep ويتم زراعتها بين عشية وضحاها في الظروف القياسية (5٪ CO2 ، 37 درجة مئوية ، مع الرطوبة). - في أنبوب طرد مركزي مخروطي سعة 15 مل ، قم بإعداد 1.5 مل من محلول 1.5٪ من Triton-X في محلول ملحي مخزن بالفوسفات (PBS). Vortex حل Triton-X 1.5٪ لمدة 5 ثوان بأقصى سرعة. ضعها في حمام مائي 37 درجة مئوية لمدة 30 دقيقة على الأقل.
- افحص المحلول بصريا للتأكد من ذوبان Triton-X تماما عن طريق الدوامة لعدة ثوان. تأكد من أن المحلول متجانس.
- أضف 10 ميكرولتر من محلول Triton-X بنسبة 1.5٪ إلى كل بئر من الخلايا المطلية. لا تخلط.
ملاحظة: في هذه المرحلة ، ليس من المستحسن الخلط باستخدام سحب العينات المتكرر بسبب تكوين الفقاعات. - أعد الخلايا إلى 5٪ ثاني أكسيد الكربون2 ، 37 درجة مئوية مع حاضنة زراعة خلايا الرطوبة لمدة ساعة واحدة على الأقل.
ملاحظة: بعد تطبيق محلول Triton-X ، يتم تحلل معظم خطوط الخلايا بالكامل في 2-3 ساعات. الانتظار لمدة تصل إلى 24 ساعة له تأثير ضئيل على إشارة التألق عند استخدام أصباغ مثل SYTOX Green. قد تؤدي زيادة النسبة المئوية ل Triton-X إلى تقصير وقت الحضانة لخطوط الخلايا التي يصعب تحللها. - راقب مورفولوجيا الخلايا على مجهر ضوئي باستخدام هدف 10x. افحص الخلايا مرة كل ساعة حتى تختفي أجسام الخلايا مرئية. سجل الوقت اللازم لنفاذية الخلية.
ملاحظة: إذا كان المجهر الفلوري متاحا ، فيمكن تصور التحلل باستخدام صبغة DNA غير منفذة للخلية ، مثل SYTOX Green. يمكن إضافة الصبغة بتركيز نهائي 10x إلى محلول Triton-X ، ويمكن تأكيد النفاذية عن طريق المجهر الفلوري.
2. اختيار ومعايرة صبغة الحمض النووي
ملاحظة: أحد متطلبات اختبار FLICK هو استخدام فلوروفور غير منفذة للخلية تصدر إشارة بطريقة تعتمد على ربط الحمض النووي ، ولا تؤثر على صلاحية الخلية ، وتنتج إشارة تتسع خطيا مع رقم الخلية. يستخدم هذا البروتوكول SYTOX Green. قد تكون الأصباغ الأخرى ذات الخصائص المتشابهة مناسبة أيضا لمقايسة FLICK ، ولكن يجب تقييم ومعايرة كل منها. انظر الجدول 1 للاطلاع على أمثلة.
- بالنسبة لصبغة الحمض النووي المختارة ، حدد نطاق التركيزات المراد اختبارها بناء على توصية الشركة المصنعة.
- لكل تركيز يتم اختباره ، قم بلوحة 40.000 خلية في 180 ميكرولتر من وسط زراعة الخلايا في ثلاث نسخ على طول العمود الموجود في أقصى اليسار من 96 بئر ، قاع بصري ، صفيحة سوداء الجدران. أضف 90 ميكرولتر من الوسط إلى الآبار المتبقية.
ملاحظة: سيتم استخدام هذا لتوليد معايرة خلية خطية عبر صفوف اللوحة. سيكون التركيز النهائي للآبار الأولى 20,000 خلية / بئر. الألواح السفلية البصرية غير مطلوبة لقارئات الألواح التي تقرأ التألق من أعلى البئر. يجب أن يكون وسط زراعة الخلية هو نفس الوسيط المستخدم لزراعة الخلايا التي يتم اختبارها. على سبيل المثال ، في حالة استخدام خلايا U2OS ، يجب إعادة تعليق 40,000 خلية في 180 ميكرولتر من DMEM. - باستخدام ماصة متعددة القنوات، قم بإنشاء تخفيف تسلسلي بنسبة 1:2 عن طريق نقل 90 ميكرولتر من العمود الموجود في أقصى اليسار إلى العمود المجاور إلى اليمين. الماصة 15x للخلط.
- كرر الخطوة 2.3 ، وانتقل من العمود الثاني إلى العمود الثالث ، ثم من العمود الثالث إلى العمود الرابع ، وهكذا. قم بإنهاء المعايرة بالتحليل الحجمي في العمود الثاني إلى الأخير من اللوحة. اترك العمود الأخير بدون خلايا حتى يمكن الحصول على إشارة الخلفية لوسائط زراعة الخلايا.
- بالنسبة للعمود الثاني إلى الأخير ، قم بإزالة 90 ميكرولتر بحيث تحتوي جميع الآبار على 90 ميكرولتر من الوسط الذي يحتوي على عدد متنوع من الخلايا. دع الخلايا تلتصق لمدة 6 ساعات في حاضنة زراعة الخلايا 37 درجة مئوية.
- قم بإعداد محلول 10x من صبغة الحمض النووي لكل تركيز من الصبغة المراد اختبارها ، مع تخفيف صبغة الحمض النووي في وسائط نمو كاملة تستخدم لزراعة الخلايا ذات الأهمية. قم بإعداد 1.5 مل من محلول Triton-X بنسبة 1.5٪ في PBS ، كما هو موضح في الخطوة 1.
- إلى كل بئر من اللوحة المكونة من 96 بئرا ، أضف 10 ميكرولتر من صبغة الحمض النووي 10x. أضف 10 ميكرولتر من محلول Triton-X 1.5٪ إلى كل بئر لاختراق الخلايا. احتضان الخلايا في هذا المحلول للوقت الأمثل ، والذي تم تحديده في الخطوة 1.
ملاحظة: بعد إضافة Triton-X ، يكون التركيز النهائي لصبغة الحمض النووي أقل بقليل من 1x ، لكن هذا غير منطقي. بعد الحضانة ، يجب تحلل اللوحة بأكملها. سيتم استخدام المعايرة بالتحليل الحجمي اليدوي للخلايا لتحديد التركيز الأمثل لصبغة الحمض النووي والإعدادات المثلى للحصول على الفلورة. - قم بقياس شدة التألق عبر لوحة معايرة الحجم. حدد التألق على نطاق من إعدادات الاستحواذ على النحو الموضح من قبل الشركة المصنعة لصبغة الحمض النووي. اعتمادا على قارئ اللوحة المستخدم ، قم بتعديل الأطوال الموجية للإثارة والانبعاث و / أو الكسب الرقمي.
- قم بإزالة إشارة الخلفية من كل قياس عن طريق طرح متوسط إشارة العمود الذي لا يحتوي على خلايا. يمكن العثور على هذه القيم في عمود الآبار في أقصى اليمين في لوحة التخفيف التسلسلي.
- تحديد خطية كل تركيز من صبغة الحمض النووي لكل إعداد اكتساب. يمكن تحديد الخطية عن طريق رسم رقم الخلية مقابل إشارة التألق وإجراء الانحدار الخطي. يشير معامل التحديد (r2) إلى درجة ارتباط إشارة التألق خطيا برقم الخلية.
- اختر إعدادات الاستحواذ وتركيز صبغة الحمض النووي الذي يحتوي على أفضل مزيج من الخطية والنطاق الديناميكي.
ملاحظة: ضع في اعتبارك النطاق الكامل لأرقام الخلايا من 0 إلى 20,000 خلية. تأكد من أن الكسب وتركيز صبغة الحمض النووي خطيان عند أعداد الخلايا المنخفضة ، بين 0 و 1000 خلية. قد توفر العديد من إعدادات الجهاز أو تركيزات صبغة الحمض النووي ارتباطا قويا على النطاق بأكمله. ومع ذلك ، من الضروري أن تكون الحساسية المنخفضة قوية ، بحيث يمكن قياس التغييرات الصغيرة في الخلايا الميتة بدقة.
3. طلاء الخلايا ، وتطبيق الأدوية الجيدة ، وقياس مضان الخلايا الميتة بمرور الوقت في الألواح المعالجة بالأدوية
ملاحظة: يمكن تصميم ألواح تخفيف الأدوية بمرونة بناء على الاحتياجات التجريبية. بشكل عام ، ستتضمن لوحات تخفيف الأدوية سلسلة تخفيف سجلية أو شبه لوغاريتمية لدواء واحد أو أكثر.
- ضع في اعتبارك تخطيط الطلاء الأمثل للتجربة. تجنب القياسات من الآبار الخارجية لصفيحة مكونة من 96 بئرا لتقليل الضوضاء المرتبطة بتباين النمو ، حيث تتعرض الآبار الخارجية لدرجات حرارة مختلفة وأكسجين وتبخر مقارنة بالآبار الداخلية للوحة.
ملاحظة: سيؤدي تضمين عناصر التحكم في جميع أنحاء المناظر الطبيعية للوحة إلى زيادة متانة بيانات النمو. ضع في اعتبارك تضمين آبار التحكم في وسط وحواف اللوحة. - تحديد عدد اللوحات المطلوبة للتجربة. قم بتضمين لوحة إضافية واحدة ليتم تحللها في بداية الفحص لتحديد متوسط عدد الخلية لكل بئر في وقت التخدير (أي لوحة التحكم T0).
- تحضير تعليق الخلية في وسط النمو الكامل.
- بناء على عدد اللوحات اللازمة للتجربة (المحسوبة في الخطوة 3.2) ، حدد حجم تعليق الخلية المطلوب. إذا كانت ألواح البذر عند 90 ميكرولتر لكل بئر ، فستكون هناك حاجة إلى حوالي 10 مل لكل لوحة. اضرب عدد اللوحات المطلوبة في 10 مل.
ملاحظة: من المستحسن زيادة هذا الحجم لمراعاة الحجم الميت للخزان وفقدان الحجم أثناء سحب العينات. على سبيل المثال ، يمكن ضرب الحجم المحسوب في 1.2. - عد الخلايا وإعداد تخفيف الخلية بناء على العدد المطلوب من الخلايا لكل بئر. على سبيل المثال ، إذا كنت تهدف إلى زرع 2000 خلية في 90 ميكرولتر من الوسائط لكل بئر من صفيحة مكونة من 96 بئرا ، لإجمالي 3 لوحات ، احسب العدد الإجمالي للخلايا اللازمة للتجربة على النحو التالي:

وبالمثل ، إذا كان تعليق الخلية المحسوبة 400,000 خلية / مل ، فسيكون حجم تعليق الخلية اللازم للتجربة هو:

- قم بتصحيح حجم وسائط زراعة الخلايا المستخدمة في الطلاء عن طريق طرح حجم تعليق الخلية المحسود المراد إضافته.
وسائط 36 مل - تعليق خلية 2 مل = 34 مل حجم وسائط مصححة
- بناء على عدد اللوحات اللازمة للتجربة (المحسوبة في الخطوة 3.2) ، حدد حجم تعليق الخلية المطلوب. إذا كانت ألواح البذر عند 90 ميكرولتر لكل بئر ، فستكون هناك حاجة إلى حوالي 10 مل لكل لوحة. اضرب عدد اللوحات المطلوبة في 10 مل.
- امزج معلق الخلية المحسوبة مع حجم الوسائط الصحيح باستخدام ماصة مصلية. انقل تعليق الخلية هذا إلى خزان كاشف قاع V.
- باستخدام ماصة متعددة القنوات، أضف 90 ميكرولتر من تعليق الخلية إلى كل بئر من الألواح المكونة من 96 بئرا. امزج معلق الخلية في خزان الكاشف بانتظام باستخدام سحب العينات المتكرر باستخدام ماصة مصلية للتأكد من الحفاظ على التركيز المطلوب للخلايا لكل حجم.
- دع الخلايا تلتصق طوال الليل في حاضنة زراعة الخلايا 37 درجة مئوية (بشكل عام 12-24 ساعة).
- قم بإعداد محلول Triton-X بنسبة 1.5٪ في PBS، كما هو موضح في الخطوة 1. يجب أن يكون حجم هذا المحلول كافيا لتحلل جميع الألواح. حوالي 1.5 مل من 1.5٪ Triton-X في PBS يكفي لتحلل صفيحة واحدة مكونة من 96 بئرا.
ملاحظة: حل Triton-X بنسبة 1.5٪ في PBS مستقر لأكثر من أسبوع ويمكن تصنيعه مسبقا للراحة. - تحديد كمية وسائط زراعة الخلايا المطلوبة لصنع لوحة تخفيف الدواء. قم بإعداد ألواح تخفيف الدواء في ألواح شفافة على شكل حرف U أو V 96 جيدا.
- للتأكد من أن حجم الدواء المخفف كاف للتجربة، قم بزيادة الحد الأدنى للحجم المطلوب لحساب فقدان الحجم أثناء سحب العينات. على سبيل المثال ، إذا تمت إضافة الأدوية في 10 ميكرولتر إلى كل بئر من صفيحة 96 بئرا وتضمنت التجربة ثلاثة ألواح ، فستكون هناك حاجة إلى 30 ميكرولتر من الدواء المخفف لكل بئر. قم بإعداد 40-50 ميكرولتر من الوسائط المخدرة لكل بئر لحساب فقدان الحجم. أضف 1.5 مل إلى حجم الوسائط المطلوبة لحساب الوسائط اللازمة للوحة التحكم T0.
- قم بإعداد تركيز 10x من صبغة الحمض النووي المختارة في وسط النمو الكامل. يعتمد هذا التركيز على التركيز المحدد في الخطوة 2.11. يتم حساب الحجم الإجمالي لهذا الحل في الخطوة 3.8.
- باستخدام صبغة الحمض النووي + وسط النمو من الخطوة 3.9 ، قم بإعداد تركيز 10x من كل دواء ليتم اختباره. قم بإنشاء أعلى جرعة فقط من كل دواء في لوحة تخفيف الدواء وقم بتخفيف الأدوية بشكل متسلسل باستخدام ماصة متعددة القنوات ، مع خلط 15 ضعفا بين كل بئر.
ملاحظة: عند عمل أعلى جرعة لدواء معين في لوحة تخفيف الدواء ، يجب حساب حجم الدواء للتأكد من دقة التركيز. - باستخدام ماصة متعددة القنوات، أضف 10 ميكرولتر من محلول صبغة الدواء + الحمض النووي من الخطوة 3.10 إلى الألواح التي تحتوي على خلايا.
ملاحظة: بالنسبة لألواح تخفيف الأدوية التي تم فيها إنشاء تخفيف تسلسلي ، إذا تمت إضافة الأدوية إلى الخلايا بدءا من أقل تركيز للدواء وعملت حتى أعلى تركيز ، فلا داعي للتغيير أطراف الماصة متعددة القنوات. ومع ذلك، يجب تغيير الأطراف الموجودة على الماصة متعددة القنوات بين كل لوحة وكلما استخدمت الأطراف في بئر يحتوي على دواء مختلف أو تركيز أعلى من الدواء. - اقرأ التألق لجميع اللوحات التي أضيفت إليها الأدوية. قراءة التألق هذه هي قراءة T0 (أي الخلايا الميتة في الوقت = 0 ساعة).
- أعد الألواح إلى الحاضنة بعد أخذ قراءة مضان T0.
- أضف 10 ميكرولتر من محلول صبغة الحمض النووي 10x الذي تم إنشاؤه في الخطوة 3.9 و 10 ميكرولتر من محلول Triton-X 1.5٪ في الخطوة 3.7 إلى لوحة التحكم T0. أعد هذه اللوحة إلى الحاضنة لمقدار الوقت المحدد في الخطوة 1.8.
- اقرأ لوحة التحكم T0 بمجرد تحلل الخلايا بالكامل ، كما هو موضح في الخطوة 1.6.
4. قياس تألق الخلايا الميتة بمرور الوقت للألواح المعالجة بالأدوية
ملاحظة: قلل من وقت خروج اللوحات من الحاضنة. يمكن أن تؤثر التغيرات المطولة في درجة الحرارة على بقاء الخلية ، ويمكن أن يؤدي التعرض للضوء إلى الإضرار بفلوروفورات الحمض النووي ، مثل SYTOX Green.
- احصل على قراءات مضان لجميع الألواح المعالجة بالأدوية كل 3-4 ساعات بعد التخدير. لا تحتاج اللوحات إلى القراءة بين عشية وضحاها ما لم تكن حركية الموت دقيقة للغاية.
ملاحظة: لا يلزم أخذ النقاط الزمنية على فترات زمنية ثابتة/قياسية. بشكل عام ، يمكن أخذ النقاط الزمنية حصريا خلال ساعات العمل العادية دون التسبب في أخطاء في التحليل النهائي لحركية الموت. يمكن استنتاج الحركية طالما تم أخذ بعض القياسات في الفترة التي تسبق ظهور الوفاة ، وأثناء مرحلة ارتفاع الموت ، وأثناء مرحلة التشبع / الهضبة. - في النقطة الزمنية النهائية المطلوبة ، احصل على قراءة مضان بعد ذلك مباشرة ، أضف 10 ميكرولتر من محلول Triton-X 1.5٪ المحضر في الخطوة 3.7 لتحلل الخلايا.
- أعد الألواح إلى الحاضنة واترك الخلايا تتخلل الوقت المحدد في الخطوة 1.
- الحصول على قراءات مضان بعد النفاذية. تتناسب قيمة التألق هذه مع العدد الإجمالي للخلايا (أي الخلايا الحية + الميتة) لكل بئر.
5. حساب حركية الكسر المميت
ملاحظة: يمكن تحليل الحسابات الموضحة في هذا البروتوكول بأي تنسيق أو برنامج. ومع ذلك ، فإن استخدام بيئة برمجة مثل MATLAB أو R أو Python سيسمح بتحليل أسرع وأكثر مرونة.
- احسب متوسط قيم التألق من لوحة التحكم T0 باستخدام المتوسط المشذب بنسبة 50٪. تتناسب هذه القيمة مع العدد الإجمالي للخلايا قبل التخدير.
- باستخدام تركيب المنحنى ودالة النمو الأسي ، احسب حركية النمو السكاني لجميع الآبار في التجربة. الحجم الأولي لكل بئر هو متوسط قيمة مضان T0 المحسوبة في الخطوة 5.1. الحجم النهائي لكل بئر هو قيمة ما بعد النفاذية المحسوبة في الخطوة 4.4. مدة الفحص من 0 ساعة إلى نقطة نهاية الفحص المحددة في الخطوة 4.4.
- باستخدام معلمات النمو المحددة في الخطوة 5.2 ، احسب عدد الخلايا الإجمالية في كل نقطة زمنية مقاسة في الفحص لكل بئر. حدد عدد الخلايا الحية في كل نقطة زمنية مقاسة عن طريق طرح قياس الخلايا الميتة من إجمالي الخلايا المحسوبة في الخطوة 5.2.
ملاحظة: نظرا لصغر كمية الضوضاء في المقايسة ، قد يكون رقم الخلية الحية في بعض الأحيان رقما سالبا صغيرا. يمكن ضبط هذا يدويا على 0 نظرا لأنه لا يمكن أن يكون هناك عدد سالب من الخلايا الحية ويشير على الأرجح إلى أن جميع الخلايا في هذا البئر قد ماتت. - احسب الكسر المميت (LF) لكل نقطة زمنية بقسمة إشارة مضان الخلية الميتة على إجمالي إشارة الخلية لكل نقطة زمنية.
- تناسب معادلة الموت الأسي المتأخر (LED) مع بيانات الدورة الزمنية للكسر المميت10. لتجنب المعلمات الحركية التعسفية لجرعات الدواء التي لا تسبب أي فتاكة كبيرة ، تناسب نموذجا خطيا بمنحدر يساوي 0. تحديد مستويات كبيرة من الفتك بناء على الضوضاء في الفحص أو LF الذي لوحظ للظروف غير المخدرة.
- سجل وقت بداية الوفاة (DO) من معادلة LED. تحتوي معادلة LED على أربع معلمات: LF الأولي (LFi) ، و LF عند الهضبة (LFp) ، ومعدل الوفيات الأولي (DR) ، و DO. استنتج هذه المعلمات من البيانات باستخدام انحدار غير خطي (أي تركيب المنحنى).
- احسب الجدوى الجزئية (FV) عند نقطة نهاية الفحص لكل دواء في كل جرعة. اطرح قيمة LF لنقطة النهاية من 1 أو اقسم عدد الخلايا المباشرة على إجمالي الخلايا.
ملاحظة: يمكن حساب FV في أي نقطة زمنية، وليس فقط عند نقطة نهاية المقايسة. تستخدم هذه البيانات لتقييم علم الأدوية بالجرعة (على سبيل المثال ، الدواء IC50 أو EC50).
6. احسب قيمة الموارد الوراثية
- حدد متوسط عدد الخلايا الحية لكل بئر في بداية الفحص. احسب هذه القيمة باستخدام قراءة T0 بعد النفاذية المحسوبة في الخطوة 3.15 وطرح قراءة T0 لكل بئر ، والتي تم جمعها في الخطوة 3.12. وفي معادلة الموارد الوراثية أدناه (الخطوة 3.6)، يشار إلى هذه القيمة ب x0.
ملاحظة: في بعض الأحيان ، يمكن أن تتداخل الجرعة الأعلى من الدواء مع قراءة مضان صبغة الحمض النووي. قد يكون من المستحسن حساب متوسط عدد الخلايا الحية في الوقت 0 باستخدام آبار التحكم. - بالنسبة لآبار التحكم (xctrl) ، حدد متوسط عدد الخلايا الحية لكل بئر عند نقطة نهاية الفحص. تحديد متوسط عدد الخلايا الحية عند نقطة نهاية الفحص لكل حالة معالجة بالمخدرات (x (c)).
ملاحظة: اعتمادا على التباين في نمو الخلايا عبر اللوحة ، يمكن استخدام قيم xctrl مختلفة لتطبيع كل بئر. على سبيل المثال ، إذا اختلفت قيم xctrl بشكل منهجي عبر اللوحة ، فقد يكون من المستحسن استخدام أقرب قيمة xctrl بدلا من متوسط قيمة xctrl للوحة. - بالنسبة لكل بئر معالج بالدواء، احسب قيمة تثبيط معدل النمو الطبيعي (GR) باستخدام المعادلة4 التالية:
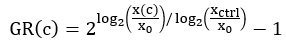
قم بإجراء تركيب المنحنى باستخدام انحدار لوجستي مكون من 4 معلمات. والموارد الوراثية على مقياس من -1 إلى 1.
7. حساب معدلات النمو والوفيات الناجمة عن الأدوية باستخدام طريقة GRADE
ملاحظة: تمثل الموارد الوراثية معدل النمو السكاني الصافي وليس معدل تكاثر الخلايا الحقيقي. يمكن حساب معدلات النمو السكاني الناجم عن المخدرات ومعدلات الوفيات باستخدام مزيج من الموارد الوراثية والجزء الفتاك (LF).
- حدد وقت المضاعفة (τ) لخط الخلية أثناء التجربة باستخدام متوسط عدد الخلايا الحية من قراءة التحكم T0 (x0) ، ومتوسط عدد الخلايا الحية من حالة التحكم عند نقطة نهاية الفحص (xctrl) ، وطول الاختبار بالساعات (t) لحل المعادلة التالية:

ملاحظة: يتطلب الحساب الدقيق لوقت مضاعفة الخلية (τ) أن تتضاعف الخلايا باستمرار طوال طول الفحص. بالنسبة للخلايا التي تعاني من تثبيط التلامس ، يجب زرع الخلايا عند كثافات البداية التي لن تصبح متقاربة خلال وقت الفحص المطلوب. على سبيل المثال ، يبلغ متوسط وقت مضاعفة U2OS 24 ساعة. يعد زرع 2000 خلية لكل بئر في اختبار مدته 72 ساعة هو الأمثل لتفسير معدل نموها. - تحديد العلاقة بين معدلات النمو / الوفيات وحجم السكان. للقيام بذلك ، استخدم نموذج الولادة / الوفاة ومحاكاة مهيأة مع جميع المجموعات الزوجية المعقولة لمعدلات النمو والوفيات. تتطلب هذه المحاكاة متوسط عدد الخلايا الحية من لوحة التحكم T0 (x0) ، وطول الفحص (t) ، ونطاق محدد من قبل المستخدم لمعدلات الانتشار المعقولة (p) ، ومعدلات الوفيات (d).


- لتحديد القيم المعقولة لمعدلات النمو ، ابدأ بمعدل النمو غير المعالج في مضاعفة عدد الخلايا لكل ساعة (1 / T) كأعلى معدل نمو و 0 كأقل معدل نمو. قسم هذا النطاق إلى 500 مقطع متباعدة بشكل متساو. يمكن تطبيق عملية مماثلة لمعدل الوفيات ، واختبار نطاق من 0 إلى 1.
ملاحظة: يمكن تنفيذ جميع المجموعات الزوجية المكونة من 500 معدلات باستخدام أي بيئة برمجة ولكنها قد تكون مكثفة للغاية من الناحية الحسابية في حالة استخدام بعض البرامج. يمكن أن يؤدي تقليل هذا إلى جميع المجموعات الزوجية من 50 معدل نمو ووفيات إلى التخفيف من هذه المشكلة ، مع تقليل دقة الاستدلال. تم توفير قالب جدول بيانات مع هذا البروتوكول.
- لتحديد القيم المعقولة لمعدلات النمو ، ابدأ بمعدل النمو غير المعالج في مضاعفة عدد الخلايا لكل ساعة (1 / T) كأعلى معدل نمو و 0 كأقل معدل نمو. قسم هذا النطاق إلى 500 مقطع متباعدة بشكل متساو. يمكن تطبيق عملية مماثلة لمعدل الوفيات ، واختبار نطاق من 0 إلى 1.
- تحديد قيم GR و LF (الموضحة أعلاه) لكل زوج من زوج معدل التكاثر المحاكي (p) والموت (d).
ملاحظة: ستولد الخطوات 7.2-7.3 جدولا يحتوي على كل زوج نظري من معدلات الانتشار والوفيات ، مع قيم GR و LF المحسوبة لهذا الزوج النظري. سيعمل هذا كجدول بحث لربط زوج من قيم GR و LF المرصودة تجريبيا بزوج من معدلات الانتشار والوفيات الناجمة عن المخدرات. سيؤدي اختبار أكثر من 500 قيمة منفصلة لمعدلات الانتشار والوفيات إلى قيمة أكثر دقة من الناحية العددية ، ولكن من المحتمل أن يكون هذا المستوى من الدقة يتجاوز دقة المقايس. - احسب المسافة الزوجية بين كل زوج GR / LF محسوب تجريبيا وكل زوج GR / LF نظري في جدول البحث. استنتج أن الزوج النظري مع الحد الأدنى من المسافة إلى الزوج المرصود تجريبيا من قيم GR / LF هو معدلات الانتشار والوفيات الحقيقية الناجمة عن المخدرات.
8. تحديد مسارات الموت باستخدام مثبطات كيميائية انتقائية للمسار
ملاحظة: المثبطات الكيميائية وحدها غير كافية لتحديد آلية الموت لدواء معين بشكل نهائي. يجب استخدام المثبطات الكيميائية لمسارات الموت لتحديد الاستجابات الكيميائية الحيوية أو المظهرية التي يجب استكشافها في التجارب اللاحقة ، والتي من المحتمل أن تشمل التقييم المورفولوجي ، والعلامات الكيميائية الحيوية الخاصة بالمسار ، وتقييم التبعيات الجينية.
- قم بتحسين جرعة كل مثبط لموت الخلايا في خط الخلية محل الاهتمام عن طريق اختبار نطاق جرعة من تركيزات المثبطات في سياق المنشط المتعارف عليه لمسار (مسارات) الموت ذات الأهمية (الجدول 2). من الناحية المثالية ، يجب ألا تؤثر الجرعة المختارة من المثبط على بقاء الخلية من تلقاء نفسها (تحقق من مقياس GR).
ملاحظة: لا يمكن لجميع خطوط الخلايا تنشيط جميع مسارات الموت. قد تكون هناك حاجة إلى التحقق من صحة الكيميائي الحيوي أو النمط الظاهري عند اختبار المنشطات / المثبطات لمسارات الموت المختلفة. - ضع في اعتبارك تخطيط الطلاء الأمثل لشاشة المثبطة. لتقليل تأثيرات الدفعات ، احتفظ بكل دواء على نفس اللوحة مثل المثبط (المثبطات) التي يتم تقييمها ، مع تكرارات على لوحات منفصلة.
- قم بزرع العدد المطلوب من الخلايا في كل بئر من صفيحة ذات قاع بصري وذات جدران سوداء ذات 96 بئرا ، على غرار الخطوة 3.3. قلل حجم الطلاء إلى 80 ميكرولتر لحساب أحجام المثبط والدواء.
- قم بإعداد 10x تنسيقية للمثبطات ليتم اختبارها في وسائط كاملة وإضافة 10 ميكرولتر إلى كل بئر. معالجة الخلايا مسبقا بمثبطات مسار الموت لمدة 2-4 ساعات. بعد ذلك ، أضف الأدوية ذات الأهمية واحصل على قراءة مضان ، كما في الخطوات 3-5.
- تقييم التغير في وقت بداية الوفاة (DO) و / أو الحد الأقصى للجزء المميت لتقييم فعالية المثبط (المثبطات). DO هي معلمة مستنبطة من نموذج الموت الأسي المتأخر (LED). انظر الخطوات 5.6 - 5.7.
النتائج
باستخدام هذا البروتوكول ، استكشفنا حساسية خلايا U2OS لمثبط HDAC Belinostat. تم إجراء هذه التجارب باستخدام 2 ميكرومتر SYTOX Green لتسمية الخلايا الميتة (الشكل 1 أ). تم إجراء القراءات الحركية باستخدام قارئ لوحة الفلورسنت عند إعداد كسب 130 (الشكل 1 ب). تم تحلل الخلايا في محلول Triton-X بنسبة 1.5٪ في PBS لمدة ساعتين في نهاية الفحص (الشكل 1C-D).
ينتج بروتوكول FLICK نظرة ثاقبة حول معدل النمو السكاني ومعدل موت الخلايا الناجم عن المخدرات. يمكن عرض هذه الرؤى بشكل منفصل أو باستخدام إطار تصور وتحليل GRADE للأدوية ، معا (الشكل 1E). يكشف تقييم حساسية Belinostat باستخدام قيمة GR أن 1 ميكرومتر Belinostat ينتج عنه قيمة GR تبلغ حوالي 0 (الشكل 2 أ). وعلى مقياس الموارد الوراثية، تشير القيم الإيجابية إلى معدل التوسع السكاني، وتشير القيم السالبة إلى معدل الانكماش السكاني. وبالتالي ، فإن قيمة GR البالغة 0 تكشف أن السكان لا يزالون في حالة ركود (أي استجابة دواء تثبيط الخلايا). بالنظر إلى التفسير التقليدي للركن الخلوي ، يمكن للمرء أن يستنتج أن 1 ميكرومتر من البيلينوستات يسبب تثبيط النمو الكامل دون أي قتل للخلايا. ومع ذلك ، فإن تقييم الجزء المميت الناجم عن المخدرات يكشف أن 1 ميكرومتر بيلينوستات تسبب في ما يقرب من 50٪ من الفتك على مدار هذا الفحص (الشكل 2 ب). في معظم الحالات ، يمكن اشتقاق هاتين الرؤيتين من تجارب مختلفة لا يمكن مقارنتها بطريقة التفاح إلى التفاح. الأهم من ذلك ، باستخدام مقايسة FLICK ، يتم اشتقاق كلتا الرؤيتين من نفس البيانات التجريبية ولكن تم تحليلهما بشكل مختلف لالتقاط تأثيرات Belinostat على النمو السكاني مقابل موت الخلايا.
يمكن أيضا دمج هاتين الرؤيتين باستخدام الطريقة التحليلية GRADE (الشكل 2C). يضع DRUG GRADE الجزء المميت ، الذي يتناسب مع متوسط معدل الوفيات ، مقابل قيمة الموارد الوراثية ، معدل النمو السكاني الصافي يوفر دمج البيانات بهذه الطريقة تصورا لكيفية تنسيق الدواء لتثبيط النمو وتنشيط الموت. ضمن مخطط GRADE: الأدوية التي تمنع النمو دون تنشيط الموت (أي الأدوية المثبطة للخلايا ، باستخدام التفسير الشائع) ستحتل الحدود العليا ، والأدوية التي تقتل فقط دون تغيير معدلات تكاثر الخلايا ستحتل الحدود الصحيحة ، والأدوية التي تسبب أولا تثبيط النمو ، تليها موت الخلايا المتوقفة عن النمو ستشغل الحدود اليسرى (أي ، الأدوية ثنائية الطور الشكل 2 ج). يمكن الاستدلال على الأدوية التي تؤدي إلى استجابات GR / LF التي تقع ضمن هذه الحدود لتثبيط التكاثر في نفس الوقت إلى حد ما مع تنشيط موت الخلايا (أي الأدوية المتزامنة)3. والأهم من ذلك، يمكن استخدام موضع كل استجابة دوائية داخل حيز الموارد الوراثية/الفلور الوراثي لحساب معدل الانتشار الحقيقي (ع) ومتوسط معدل الوفيات (د) لكل تركيز من تركيزات الدواء (الشكل 2D-E). ويلاحظ أن قيمة الموارد الوراثية ليست معدل تكاثر الخلايا الحقيقي بل معدل النمو السكاني الصافي (أي الأثر الصافي الذي يجمع بين معدل الانتشار الحقيقي ومعدل الوفيات الناجمة عن المخدرات). أيضا ، يختلف معدل الوفيات الناتج في تحليل GRADE (d ، وهو متوسط معدل الوفيات) عن معلمة معدل الوفيات في التحليل الحركي LED (DR ، السرعة القصوى أو الحد الأقصى لمعدل الوفيات).
يمكن لمقايسة FLICK أن تولد بيانات خاصة بالوفاة ، مثل الجزء المميت الناجم عن المخدرات. ومع ذلك ، فإن هذه البيانات لا تتجاوز آلية موت الخلايا. لاكتساب نظرة ثاقبة حول آلية موت الخلايا باستخدام FLICK ، فإن أبسط طريقة هي تحديد كيفية تغيير حركية الكسر المميت عن طريق إدراج مثبطات خاصة بمسار الموت. يجب أن يؤدي تثبيط آلية الموت ذات الصلة إلى تقليل الجزء المميت الناجم عن المخدرات و / أو تأخير وقت ظهور الوفاة. هنا ، نوضح أن 50 ميكرومتر من مثبط عموم الكاسباز z-VAD ينقذ حوالي 50٪ من الفتك الناجم عن 1 ميكرومتر بيلينوستات (الشكل 2F). الأهم من ذلك ، مثل الأدوية ، فإن المثبطات لها خصوصية محدودة وقد تمنع أو تؤدي إلى تفاقم آليات الموت الأخرى عن طريق الخطأ. وبالتالي ، قبل التوصل إلى استنتاج نهائي ، يجب استكمال هذه البيانات برؤى أخرى ، مثل مورفولوجيا الخلية ، وقياس العلامات الكيميائية الحيوية للتنشيط ، و / أو تقييم التبعيات الجينية الخاصةبالمسار 14.
لتوضيح كيفية تغيير تفسير الاستجابة الدوائية رسميا من خلال التقييم القائم على FLICK والتحليل القائم على GRADE ، استكشفنا بعد ذلك ثلاثة أدوية تتميز بأنواع مختلفة من تنسيق النمو / الموت. Palbociclib هو مثبط Cdk4 / 6 ينتج عنه استجابة تثبيط الخلايا (تثبيط النمو مع عدم موت الخلايا). Camptothecin هو مثبط توبويزوميراز I يسبب استجابة ثنائية الطور (تثبيط النمو ، يليه موت الخلايا بجرعات عالية). Belinostat هو مثبط HDAC يسبب استجابة متزامنة (تثبيط النمو الجزئي وتنشيط الوفاة في كل جرعة ، ولكن بنسب متفاوتة عبر الجرعات). باستخدام التحليل التقليدي لهذه البيانات ، يمكن ملاحظة أن جميع الأدوية الثلاثة تقلل بشكل كبير من الجدوى النسبية لخلايا U2OS (الشكل 2G). على الرغم من أن Palbociclib أقل قوة بشكل ملحوظ ، إلا أنه ليس من الواضح من هذه البيانات أن Palbociclib فشل في تنشيط موت الخلايا. باستخدام تحليل قائم على الموارد الوراثية ، والذي يشير إلى كيفية تأثير الأدوية على معدل النمو السكاني الصافي ، يمكن تفسير أكثر دقة أن المجموعات السكانية المعالجة بالبوسيكليب تستمر في التوسع في جميع الجرعات ، في حين أن الجرعات العالية من كامبتوثيسين أو بلينوستات تؤدي إلى انكماش السكان ، وبالتالي ، يجب أن يكون موت الخلايا قد تم تنشيطه بعد جرعات عالية من هذه الأدوية (الشكل 2H). ومع ذلك ، فإن التحليل القائم على الموارد الوراثية يفشل في مراعاة التنسيق المتنوع بين النمو والموت ، مما قد يؤدي إلى استنتاجات خاطئة حول مستوى موت الخلايا الذي يتم تنشيطه بواسطة دواء معين. على سبيل المثال ، بناء على بيانات الموارد الوراثية ، يمكن للمرء أن يستنتج أن 1 ميكرومتر كامبتوثيسين ينشط موت الخلايا بدرجة أكبر من 1 ميكرومتر بلينوستات ، بالنظر إلى أن كامبتوثيسين ينتج عنه قيمة GR تبلغ -0.25 وينتج عن Belinostat قيمة GR تبلغ 0. تعني قيمة -0.25 GR أن عدد السكان يتقلص بنسبة 25٪ بالسرعة التي يتوسع بها عدد السكان غير المعالجين. باستخدام التصور والتحليل المستند إلى GRADE ، يمكن ملاحظة أن Camptothecin و Belinostat يختلفان في تنسيق النمو / الموت. وبالتالي ، عند جرعة 1 ميكرومتر ، ينشط كل من Belinostat الموت بمعدل أعلى من Camptothecin (0.8٪ وفاة / ساعة ل Belinostat ، مقارنة ب 0.7٪ وفاة / ساعة ل Camptothecin) ، لكن السكان المعالجين بكامبتوثيسين يتقلصون بشكل أسرع بسبب تثبيط النمو الأكثر وضوحا الناجم عن هذا الدواء (الشكل 2I).

الشكل 1: مخطط انسيابي لبروتوكول FLICK. (أ) قم بإنشاء تخفيف للخلية لتحسين تركيز صبغة الحمض النووي وخطية قياسات التألق على قارئ صفيحة دقيقة. (ب) اكتساب معايرة بالتحليل الحجمي عبر رقم الخلية ل 2 ميكرومتر SYTOX Green في خلايا U2OS. يوفر الكسب 130 أكبر إشارة خطية عبر جميع أرقام الخلايا. (ج) صور الطور لخلايا U2OS التي تم تحللها بنسبة 1.5٪ Triton-X بمرور الوقت باستخدام هدف 10x. المنطقة المعبأة عبارة عن عرض مكبر لمضان SYTOX Green. تمثل أشرطة المقياس جميع الصور. (د) إشارة SYTOX الخضراء بعد التحلل في الأوقات المحددة. البيانات متوسطة +/- SD ل 3 مكررات بيولوجية. (ه) نظرة عامة مفاهيمية على الفحص ، من الإعداد إلى التحليل. تتمثل الخطوات الرئيسية في إنشاء لوحة تخفيف الدواء ، وتخدير الخلايا في صفيحة متعددة الآبار ، والحصول على قياسات التألق بمرور الوقت ، وحساب مقاييس النمو والوفاة. بالنسبة للوحيتين B و D ، تكون البيانات متوسطة ± SD ل n = 3 مكررات بيولوجية مستقلة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: توصيف الاستجابات الدوائية باستخدام مقايسة FLICK والتحليل القائم على GRADE. (أ) مقياس GR لمثبط HDAC ، Belinostat ، على جرعة من الجرعات. البيانات المعروضة مأخوذة من نقطة نهاية الفحص ، والتي كانت 66 ساعة. عند 1 ميكرومتر ، يكون لدى Belinostat قيمة GR حوالي 0 ، مما يشير إلى استجابة تثبيط الخلايا. (ب) حركية الكسر المميت لبيلينواستات. عند 1 ميكرومتر ، يحفز Belinostat ما يقرب من 50٪ من الفتك ، والتي لا يتم التقاطها بواسطة قيمة GR. (ج) مخطط مرحلة GRADE بناء على محاكاة لجميع معدلات النمو والوفيات المحتملة. استندت المحاكاة إلى زمن مضاعفة U2OS في هذا الاختبار (27.12 ساعة). (د) مخطط GRADE ل Belinostat عبر الجرعة عند نقطة نهاية الفحص. (ه) مخطط شريط للنمو المستنبط من GRADE (p ، مضاعفة عدد السكان في الساعة) والوفيات (د ، جزء من السكان الذين يموتون في الساعة) لجرعات Belinostat. تم تحديد المعدلات من معدلات محاكاة في (C) والبيانات من (D). (F) مخطط الكسر المميت ل 1 ميكرومتر بيلينوستات معالج ب (أرجواني) أو بدون (أسود) 50 ميكرومتر من مثبط موت الخلايا المبرمج z-VAD. تم حساب ΔLF = 0.18 عن طريق طرح متوسط الحد الأقصى LF من الحالة المعالجة بالمثبط من متوسط الحد الأقصى LF من السيطرة. (ز) الجدوى النسبية (عدد الخلايا الحية في الحالة المعالجة بالعقاقير ، مقسوما على عدد الخلايا الحية في الحالة غير المعالجة) لثلاثة أدوية بعد التعرض لمدة 72 ساعة. تقلل جميع الأدوية من صلاحية الخلايا ، لكن مساهمة موت الخلايا في الاستجابة غير معروفة. (ح) مقياس الموارد الوراثية لثلاثة أدوية في الفقرة (ز). وتبين هذه البيانات أن اثنين من الأدوية الثلاثة يؤديان إلى انكماش السكان، وهو ما يشير إليه الموارد الوراثية < 0. لا تزال مساهمة موت الخلايا غير واضحة ، على الرغم من أنه يجب تنشيط موت الخلايا عندما تكون قيمة GR سالبة. (ط) المعدلات المستنبطة من الدرجة لثلاثة أدوية. Palbociclib غير قاتل ولكنه يؤدي إلى توقف النمو. Camptothecin ثنائي الطور. تؤدي الجرعات المنخفضة إلى توقف النمو بينما تؤدي الجرعات الأعلى إلى توقف النمو يليه الفتاك. بلينوستات هو دواء مصادفة. يقطع نطاق الجرعة منتصف مخطط GRADE ، مما يشير إلى أن جميع الجرعات تؤدي إلى اضطراب في النمو وتنشيط موت الخلايا. البيانات في جميع اللوحات هي متوسط ± SD لثلاث تجارب بيولوجية مستقلة للتكرار. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| صبغ | الحركيه | نقطة النهاية |
| SYTOX الأخضر | Y | Y |
| سيلتوكس جرين | Y | Y |
| نوك سبوت 500/515 ، 594/615 ، 750/780 | Y | Y |
| يويو -3 | Y | Y |
| بروبيديوم يوديد | N | Y |
| 7-AAD | N | Y |
الجدول 1: أصباغ الحمض النووي وتطبيقها في FLICK. يمكن استخدام العديد من أنواع الأصباغ في فحوصات FLICK لنقطة النهاية فقط. عدد أقل من الأصباغ تفي بالشروط المراد احتضانها بشكل مستمر طوال الفحص. الأصباغ الأخرى ، بما في ذلك الأصباغ غير الخضراء ، لم يتم تمييزها بعمق ويجب تقييمها بعناية قبل الاستخدام.
| مسار الموت | المانع | الجرعة النموذجية |
| موت الخلايا المبرمج الجوهري | ZVAD-FMK | 50 ميكرومتر |
| موت الخلايا المبرمج الخارجي | Z-IETD | 30 ميكرومتر |
| السفيروبتوز | فيروستاتين -1 | 10 ميكرومتر |
| التشريح | نيكروستاتين -1 | 50 ميكرومتر |
| داء الحمى | VX-765 | 50 ميكرومتر |
| بارثاناتوس | روكاباريب | 1 ميكرومتر |
| موت الخلايا المعتمدة على البعاث الذاتي | هيدروكسي كلوروكين (HCQ) | 10 ميكرومتر |
| موت الخلايا المعتمدة على الليزوزومات | E-64D | 10 ميكرومتر |
| داء الغبط | رباعي الثيوموليدايت (TTM) | 5 ميكرومتر |
| داء التأكسج | ن-أسيتيل-ل-سيستين (NAC) | 2 مللي |
| نخر مدفوع ب MPT | السيكلوسبورين أ (CsA) | 10 ميكرومتر |
الجدول 2: مسارات موت الخلايا ومثبطاتها. يجب التحقق من صحة مثبطات موت الخلايا مقابل منشط قانوني لكل مسار موت. يجب ألا تؤثر جرعات المثبطات المختارة بشكل مثالي على بقاء الخلية.
الجدول التكميلي 1: حاسبة الدرجة. جدول بيانات لحساب معدلات النمو والوفيات الناجمة عن الأدوية من بيانات الموارد الوراثية والمقابل المستقيم المستندة إلى FLICK. وينبغي للمستعملين إدخال بيانات الموارد الوراثية والقيمة العادلة، إلى جانب طول الفحص بالساعات، ووقت مضاعفة الخلية بالساعات، وأحجام السكان البدء/النهاية. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يعد اختبار FLICK طريقة قوية لتوليد تقييم شامل لتأثير الدواء على نمو وموت مجموعة الخلايا. نظرا لأن هذه الطريقة لا تحسب الخلايا بشكل مباشر ، فإن الخطوات الحاسمة في البروتوكول هي ضمان خطية الفحص والتحلل الكامل أثناء خطوات نفاذية التريتون. يمكن تحديد وقت النفاذية الصحيح بصريا ، كما هو موضح في هذا البروتوكول ، أو كميا عن طريق قراءة مضان اللوحة بمرور الوقت وتحديد وقت هضبة الإشارة. ومع ذلك ، في تجربتنا ، عندما تكون في شك ، لا يبدو أن هناك أي تكلفة للانتظار لفترة أطول: بالنسبة لأصباغ الحمض النووي التي استخدمناها في اختبار FLICK ، تظل شدة الإشارة مستقرة لعدة أيام بعد التحلل. نحن نستخدم بانتظام صبغة الحمض النووي الأخضر SYTOX ، وعلى الرغم من أننا لم نتحقق من صحة كل فلوروفور مشار إليه في الجدول 1 ، إلا أن العديد من البروتوكولات الأخرى توضح استخدامها الفعال13،15،16. سيضمن تقييم خطية صبغة الحمض النووي غير المنفذة للخلية عبر مجموعة من أرقام الخلايا وإعدادات الأدوات بيانات قوية وموثوقة كميا.
يصعب تحلل بعض خطوط الخلايا أكثر من غيرها ، ولا ينبغي أبدا افتراض أن وقت التحلل لخط خلية واحد هو نفسه13 سلالة أخرى. بالنسبة لبعض خطوط الخلايا ، عند الكثافة العالية ، يتسبب تحلل الخلية في رفع الخلايا عن البئر كورقة ، مما قد يتسبب في حدوث خطأ في قارئ اللوحة. يمكن تجنب ذلك عن طريق تقليل كثافة البذر البدائية أو خلط الماصة في الآبار بعد التحلل وقبل القراءة. لتحسين وقت التحلل أو كفاءة التحلل ، يمكن تعديل محلول Triton-X إلى نسبة أعلى أو أقل ، لكننا لم نواجه بعد سيناريو كان فيه ذلك ضروريا.
يجب النظر بعناية في التصميم التجريبي وتخطيط طلاء الأدوية عند الرغبة في بيانات نمو قوية. إن إنشاء لوحة تخفيف الدواء لمقايسة FLICK هو نفسه مثل أي اختبار آخر للوحة 96 بئرا. ومع ذلك ، فإن تضمين العديد من عناصر التحكم التي تغطي أجزاء مختلفة من المناظر الطبيعية للوحة سيساعد في إنشاء رؤى قوية حول حركية النمو ويمكن أن يساعد في تحديد ما إذا كان هناك تباين منهجي في النمو. سيؤدي تجنب الآبار الخارجية للوحة إلى إنتاج بيانات نمو أكثر دقة ، حيث أن هذه الآبار أكثر حساسية لتقلبات درجة الحرارة أو الأكسجين أو الرطوبة ، مما يؤثر على نموها. أخيرا ، سيوفر استخدام نمط التخدير العشوائي الزائف ، مثل تبديل موقع الدواء على الألواح المكررة ، تقييما أكثر دقة لسلوك الدواء.
توجد بعض القيود على الاستخدام الدقيق لمقايسة FLICK. ترتبط هذه القيود في الغالب بالاستدلال الحركي ، حيث أن بيانات نقطة النهاية هي قيم لوحظت تجريبيا. تعتمد كل من حركية تكاثر الخلايا الحية وحركية الموت على بعض الافتراضات فيما يتعلق بمسار نمو الخلايا الحية بمرور الوقت في الحالة المعالجة بالدواءات. في هذا البروتوكول ، نصف مسار النمو هذا بأنه أسي وبمعدل موحد بمرور الوقت. في حين أنه من المحتمل ملاحظة هذه الميزات في حالة عدم وجود دواء ، فقد لا يتم الالتزام بها في وجود دواء. طريقة FLICK دقيقة ، ليس لأن الافتراضات حول مسارات النمو صحيحة دائما ، ولكن بدلا من ذلك ، لأن تأثير أي افتراضات غير صحيحة يتم تقليله إذا لم يتكاثر السكان المعالجون بالمخدرات كثيرا (أي أقل من 2 أو 3 مضاعفة للسكان في فترة الفحص). لم نواجه أدوية لا يمكن تحديدها بدقة في FLICK. ومع ذلك ، تشير النظرية إلى أن اختبار FLICK سيتوقف عن الدقة بالنسبة للدواء الذي يحدث فيه الموت ببطء شديد ، على مدى فترات طويلة من الزمن وهي عدة مضاعفات لوقت مضاعفة الخلية (ملاحظة: لم نحدد أي أدوية بهذه الميزات3). ومع ذلك ، فإن تأثير أي افتراضات غير صحيحة لحركية النمو لإجمالي السكان لن يؤثر على وقت بداية الوفاة الذي تم الحصول عليه من ملاءمة LED أو قيم LF القصوى النهائية ، حيث يتم تقييدها بقيم الخلايا الميتة المقاسة تجريبيا ، وقيم الخلايا الإجمالية النهائية التي تم تحديدها تجريبيا في نهاية المقايسة.
على الرغم من هذه القيود ، فإن اختبار FLICK يتيح رؤى يصعب توليدها باستخدام طرق الاستجابة للأدوية الأخرى. تولد معظم طرق الاستجابة للأدوية إشارة تتناسب مع عدد الخلايا الحية ، ويمكن استخدام هذه الطرق لتحديد كيفية تأثير الأدوية على معدل النمو السكاني الصافي (أي قيمة الموارد الوراثية أو ما يعادلها) ولكن لا يمكنها التمييز بدقة بين التأثيرات السامة للخلايا مقابل التأثيرات السامة للخلايا للدواء. بدلا من ذلك ، يمكن للمقايسات القائمة على الفحص المجهري التي تقيس الخلايا الحية والميتة أن تولد بالتأكيد صورة شاملة. ومع ذلك ، قد تكافح المقايسات القائمة على الفحص المجهري لحساب الخلايا الميتة بعد أن تتحلل الخلايا إلى حطام ، كما سيحدث بسرعة في سياق العديد من الأشكال غير المبرمجة لموت الخلايا. تتمثل إحدى السمات الرئيسية ل FLICK في أن القياسات تتم في قارئ اللوحة ، والذي يجمع إجمالي مضان الخلايا الميتة بدلا من عد الخلايا الميتة مباشرة. وبالتالي ، فإن إشارة الخلية الميتة في FLICK لا تعتمد على الخلوية السليمة للخلايا الميتة ، والتي ، في سياق موت الخلايا المبرمج ، ضرورية بشكل فريد. علاوة على ذلك ، فإن الميزة الفريدة لمقايسة FLICK هي القدرة على قياس كل من مجموعات الخلايا الحية والميتة باستخدام نفس الكاشف. وبالتالي ، ينتج اختبار FLICK قياسات للخلايا الحية والميتة بنفس الحساسية. تتيح هذه الميزة التحليل باستخدام طريقة GRADE وتحسن دقة حسابات النمو ومعدل الوفيات المتزامنة ل GRADE. يتضمن الجدول التكميلي 1 المتضمن نموذجا يستخدم لتصور GRADE للدواء ، حيث يمكن للمستخدم إدخال طول الفحص ، ومعدل النمو المحسوب من الخطوة 7.1 ، وأرقام الخلايا البادئة والنهاية أو قراءات الفلورسنت من ظروف التحكم ، و LF و GR المحسوبين من الخطوتين 5.4 و 6.3. يحتوي الملف على محاكاة لجميع المجموعات الزوجية المكونة من 50 معدل نمو ووفيات سيتم تحديثها تلقائيا بناء على المعلمات التي يحددها المستخدم. يولد القالب تصورا قائما على GRADE للاستجابة للأدوية ومعدلات النمو المستنبطة من GRADE (p) والوفيات (d).
يجب أن يستكشف العمل المستقبلي تطبيق اختبار FLICK في سيناريوهات زراعة الخلايا ثلاثية الأبعاد أو في تقييم الاستجابات الدوائية للعضيات المشتقة من الورم. لم يتم استجواب خطية وحساسية بيانات FLICK بعمق في هذه السياقات ، ولكن من الناحية النظرية ، يجب أن يكون اختبار FLICK فعالا مع بعض التعديلات لدمج التألق عبر عينات ثلاثية الأبعاد. بالإضافة إلى ذلك ، فإن إضافة تسميات إضافية خاصة بالخلايا سيساعد في التمييز بين نوعين أو أكثر من الخلايا في الزراعة المشتركة. ستكون هذه التطورات ذات قيمة لاستكشاف تفاعلات الخلايا المناعية مع الخلايا السرطانية. أخيرا ، تلهم المقايسات مثل SPARKL استخدام المراسلين الخاصين بالوفاة بتنسيق فحص FLICK ، مما قد يحسن الإنتاجية مع الحفاظ على دقة رؤى موت الخلايا11،16.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر جميع الأعضاء السابقين والحاليين في Lee Lab على مساهماتهم في منظور مختبرنا حول تقييم استجابات الأدوية. ودعم هذا العمل بتمويل من المعاهد الوطنية للصحة لمنظمة MJL (R21CA294000 و R35GM152194).
Materials
| Name | Company | Catalog Number | Comments |
| Belinostat | ApexBio | A4612 | |
| Camptothecin | ApexBio | A2877 | |
| Conical centrifuge tube, 15mL | Fisher Scientific | 12-565-269 | |
| DMEM | Corning | 10017CV | For seeding and drugging cells |
| DMSO | Fisher Scientific | MT-25950CQC | For seeding and drugging cells |
| Fisherbrand 96-Well, Cell Culture-Treated, U-Shaped-Bottom Microplate | Fisher Scientific | FB012932 | For seeding and drugging cells (pin plate) |
| Greiner Bio-One CELLSTAR μClear 96-well, Cell Culture-Treated, Flat-Bottom Microplate | Greiner | 655090 | For seeding and drugging cells |
| IncuCyte S3 | Essen Biosciences | Any phase microscope will work | |
| MATLAB | MathWorks | https://www.mathworks.com/products/matlab.html | MATLAB version R2023b, a license is required |
| Microplate fluorescence reader | Tecan | Spark | For measuring dead cell fluorescence |
| Palbociclib | ApexBio | A8316 | |
| PBS | Corning | 21-040-CM | Any PBS works |
| Spark Multimode Microplate Reader | Tecan | https://www.tecan.com/spark-overview | SparkControl software version 2.2 |
| Sterile reservoir, 25 mL | Fisher Scientific | 13-681-508 | For seeding and drugging cells |
| Sytox Green nucleic acid stain | Thermo Fisher Scientific | S7020 | DNA stain for measuring dead cell fluorescence |
| Triton-X 100 | Thermo Fisher Scientific | J66624-AP | For permeabilizing cells |
| U2OS | ATCC | HTB-96 | An example cell line used in this protocol |
| Z-VAD-FMK | ApexBio | A1902 |
References
- Hafner, M., Niepel, M., Sorger, P. K. Alternative drug sensitivity metrics improve preclinical cancer pharmacogenomics. Nat Biotechnol. 35 (6), 500-502 (2017).
- Dixon, S. J., Lee, M. J. Quick tips for interpreting cell death experiments. Nat Cell Biol. 25 (12), 1720-1723 (2023).
- Schwartz, H. R., et al. Drug GRADE: An Integrated Analysis of Population Growth and Cell Death Reveals Drug-Specific and Cancer Subtype-Specific Response Profiles. Cell Rep. 31 (12), 107800(2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nat Methods. 13 (6), 1-11 (2016).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ. 25 (3), 486-541 (2018).
- Tsvetkov, P., et al. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science. 375 (6586), 1254-1261 (2022).
- Holze, C., et al. Oxeiptosis, a ROS-induced caspase-independent apoptosis-like cell-death pathway. Nat Immunol. 19 (2), 130-140 (2018).
- Maltese, W. A., Overmeyer, J. H. Methuosis Nonapoptotic Cell Death Associated with Vacuolization of Macropinosome and Endosome Compartments. Am J Pathol. 184 (6), 1630-1642 (2014).
- Inde, Z., Forcina, G. C., Denton, K., Dixon, S. J. Kinetic Heterogeneity of Cancer Cell Fractional Killing. Cell Rep. 32 (1), 107845(2020).
- Forcina, G. C., Conlon, M., Wells, A., Cao, J. Y., Dixon, S. J. Systematic Quantification of Population Cell Death Kinetics in Mammalian Cells. Cell Syst. 4 (6), 1-18 (2017).
- Gelles, J. D., et al. Single-Cell and Population-Level Analyses Using Real-Time Kinetic Labeling Couples Proliferation and Cell Death Mechanisms. Dev Cell. 51 (2), 277-291.e4 (2019).
- Richards, R., et al. Drug antagonism and single-agent dominance result from differences in death kinetics. Nat Chem Biol. 16 (7), 791-800 (2020).
- Richards, R., Honeywell, M. E., Lee, M. J. FLICK: an optimized plate reader-based assay to infer cell death kinetics. STAR Protoc. 2 (1), 100327(2021).
- Honeywell, M. E., et al. Functional genomic screens with death rate analyses reveal mechanisms of drug action. Nat Chem Biol. 20 (11), 1443-1452 (2024).
- Jannoo, R., Xia, Z., Row, P. E., Kanamarlapudi, V. Targeting of the Interleukin-13 Receptor (IL-13R)α2 Expressing Prostate Cancer by a Novel Hybrid Lytic Peptide. Biomolecules. 13 (2), 356(2023).
- Gelles, J. D., Chipuk, J. E. Why not add some SPARKL to your life (and death)! Mol Cell Oncol. 7 (1), 1685841(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved