Method Article
Незрелая мышиная модель обратимой односторонней обструкции мочеточника
В этой статье
Резюме
В настоящем протоколе описана пошаговая, воспроизводимая модель односторонней обструкции мочеточника.
Аннотация
Односторонняя обструкция мочеточника (НВО) является распространенной причиной хронической болезни почек (ХБП), приводящей к прогрессированию интерстициального фиброза почек и в конечном итоге приводящей к необратимому повреждению почек. Решающее значение имеет облегчение ситуации с UUO. В литературе было создано несколько животных моделей обратимой односторонней обструкции мочеточника (RUUO), что позволяет наблюдать за структурными изменениями и функциональными повреждениями, а также моделировать физиологические и патофизиологические изменения после облегчения обструкции мочеточника. В этом исследовании была создана обратимая модель обструкции в одностороннем мочеточнике мыши с использованием силиконовой трубки. Значительное повреждение почек наблюдалось до снятия обструкции, а после отмечалось частичное восстановление. В отличие от НВО, эта модель предотвращает прогрессирующий гидронефроз, приводящий к отчетливым патологическим исходам. Эта простая хирургическая процедура демонстрирует высокий процент успеха и является перспективной моделью в качестве классической модели для изучения обратимой обструктивной нефропатии и потенциальных методов лечения интерстициального фиброза почек. Кроме того, она обеспечивает практическую платформу для изучения механизмов восстановления после обструктивной нефропатии, регенерации почечных клеток и ремоделирования тканей.
Введение
Обструкция уретры в значительной степени способствует почечному интерстициальному фиброзу и хронической болезни почек (ХБП), потенциально приводя к необратимым структурным повреждениям и функциональным нарушениям в почке1. В то время как односторонняя обструкция мочеточника (НН) широко используется для изучения повреждения почек и ХБП, она не точно воспроизводит механизмы спонтанного восстановления, которые происходят после устранения обструкции. Модель UUO включает в себя наложение швов на левый мочеточник, что приводит к постоянной обструкции, расширению мочеточника, гидронефрозу, сдавливанию почечной паренхимы и истончению коры головного мозга. Гистологическое исследование обычно выявляет канальцевую дилатацию, некроз эпителиальных клеток канальцев, а также прогрессирующее интерстициальное воспаление и фиброз2. Эта модель в первую очередь исследует интерстициальный фиброз почек и необратимую потерю функции почек из-за стойкой обструкции.
Тем не менее, многие заболевания почек, встречающиеся в клинической практике, такие как обструкция, вызванная камнями мочеточника или опухолями, являются обратимыми. Модель обратимой односторонней обструкции мочеточника (RUUO) позволяет частично восстановить структуру почек и функцию мочевыводящих путей, что в конечном итоге устраняет гидронефроз. Выздоровление может быть оценено с помощью методов визуализации, гистологического исследования и анализа биомаркеров для количественной оценки уменьшения повреждения почек и фиброза3. Эта модель близко имитирует фазу выздоровления при обструктивной нефропатии в клинических условиях и более подходит, чем UUO, для изучения ключевых процессов, таких как воспаление, иммунные реакции, регенерация клеток и ремоделирование тканей 4,5,6,7,8.
Модель RUUO позволяет исследователям анализировать восстановление и регенерацию почек после облегчения травмы, устраняя ограничения UUO в динамических исследованиях. Сравнивая различные временные моменты до и после обструкции, исследователи могут исследовать молекулярные пути, участвующие в травме и восстановлении, включая воспаление, апоптоз, фиброз и регенерацию. Этот подход улучшает понимание механизмов восстановления почек и определяет потенциальные терапевтические мишени 2,3,4,5,8,9,10. В то время как почечный фиброз часто считается необратимым, клинические наблюдения показывают, что раннее облегчение обструкции на начальных стадиях фиброза может остановить или даже обратить вспять прогрессирование заболевания. Модель RUUO представляет собой ценную экспериментальную платформу для исследования этого явления11.
Кроме того, модель RUUO облегчает изучение реверсивного фиброза после снятия обструкции, предлагая понимание механизмов восстановления и потенциальных антифибротических методов лечения 3,4. Следовательно, эта модель очень практична для трансляционных исследований. Основной целью этой экспериментальной модели является индуцирование обструктивной нефропатии через канюляцию мочеточника с последующей стандартизированной разгрузкой в заранее определенный момент времени для обеспечения согласованности. Он оптимизирован для обеспечения простоты, воспроизводимости и безопасности, что делает его эффективным инструментом для экспериментальных исследований.
протокол
Это исследование на животных проводилось в соответствии с руководящими принципами Хельсинкской декларации и было одобрено Комитетом по этике научных исследований Детской больницы Чунцинского медицинского университета. В общей сложности 27 самцов крыс Sprague Dawley (SD) были коммерчески получены и размещены в Центре лабораторных животных Детской больницы Чунцинского медицинского университета (SPF, номер лицензии: SYXK (Chongqing) 2007-0016). Крысы содержались в контролируемых температурных условиях с 12-часовым циклом свет/темнота и имели свободный доступ к пище и воде.
Протокол проведен на крысах-самцах SD в возрасте 6-8 недель и применим к крысам всех возрастов с двусторонними мочеточниками. В этом исследовании пятнадцать 6-недельных самцов крыс SD были случайным образом распределены в три группы: родная группа (n = 5), группа UUO (n = 5) и группа RUUO (n = 5). Кроме того, пять 8-недельных крыс SD (n = 5) были включены в качестве дополнительной контрольной группы. Для создания модели RUUO было использовано 12 крыс, а также 7 дополнительных крыс с учетом потенциальных рисков, таких как интраоперационная и послеоперационная смертность, неудачи хирургических операций, неполная обструкция и неудачное обращение. Это обеспечивало минимум 5 крыс в группе для последующих анализов.
Все хирургические процедуры проводились в строгом соответствии с институциональными и национальными рекомендациями по уходу за лабораторными животными и их использованию. Хирургический персонал придерживался протоколов использования средств индивидуальной защиты (СИЗ), включая хирургические маски, перчатки и халаты. Для каждой процедуры использовались стерильные хирургические инструменты, которые были автоклавированы до и после использования для поддержания стерильности. Отходы, в том числе острые предметы и биологические образцы, были утилизированы в соответствии с протоколами обращения с опасными отходами для снижения рисков загрязнения и обеспечения безопасности.
1. Подготовка животных и инструментов
- Проводить все процедуры с использованием стерильных (автоклавных) инструментов и расходных материалов. Разрежьте стерилизованную силиконовую трубку (внутренний диаметр: 1,5 мм, внешний диаметр: 2,5 мм) на сегменты примерно по 1 см. Сделайте продольный надрез вдоль одной стороны стенки трубки для последующего использования.
- Обезболивание крыс путем внутрибрюшинной инъекции пентобарбитала (40 мг/кг) (в соответствии с утвержденными в учреждении протоколами). Подтвердите адекватную анестезию, проверив отсутствие рефлекторных реакций, таких как рефлекс отмены педали, при защемлении пальца ноги. Нанесите ветеринарную офтальмологическую мазь на глаза, чтобы предотвратить пересыхание роговицы во время анестезии.
- Депилируют брюшную полость крысы от мечевидного отростка к лобковому симфизу и простирают двусторонне до средней линии.
- Расположите крысу в лежачем положении на подогреваемой хирургической подушке и закрепите ее конечности резиновыми веревками.
- Накидывайте стерильный фенестрированный лист для поддержания стерильности поля. Подготовьте кожу раствором повидон-йода. Сделайте разрез кожи по средней линии вдоль живота, простирающийся от субксифоидной области до чуть ниже пупка, чтобы обеспечить адекватное обнажение почек и верхних отделов мочеточника.
- Надрезать подкожные ткани и фасцию по средней линии с помощью хирургических ножниц. Тщательно рассеките кожу и подлежащие ткани слой за слоем и полностью обнажите забрюшинное пространство с помощью тканевых щипцов.
2. Обструктивная хирургия при обратимой односторонней обструкции мочеточника
- Втяните кишечник в правую сторону брюшной полости с помощью стерильного тампона, чтобы облегчить прямую визуализацию левого мочеточника. Накройте мочеточник марлей, пропитанной солевым раствором, чтобы предотвратить высыхание.
- Рассеките и мобилизуйте левый мочеточник с помощью микроскопических щипцов, освободив примерно 1,5 см от окружающих тканей.
- Поместите силиконовую трубку длиной 1 см (внутренний диаметр: 1,5 мм, внешний диаметр: 2,5 мм) под освобожденный мочеточник. Используйте щипцы, чтобы обеспечить полное прилегание к трубе.
- Перевязать силиконовую трубку и среднюю часть мочеточника шелковой нитью 3-0, чтобы вызвать обструкцию мочеточника. Избегайте чрезмерной силы лигирования. Постепенно протяните силиконовую трубку вдоль продольной оси мочеточника, чтобы обеспечить надежное, но нескользящее перевязку.
- Осторожно переместите кишечник в брюшную полость, обеспечивая правильное выравнивание без напряжения или препятствий.
- Непрерывно сшивайте мышцы живота и фасциальные слои с помощью нерассасывающегося шовного материала 2-0 с изогнутой режущей иглой для обеспечения достаточной прочности на разрыв. Закройте кожу нерассасывающимся швом 4-0, обеспечивая анатомическое выравнивание и равномерное натяжение, чтобы способствовать заживлению и свести к минимуму риск расхождения раны.
- Продезинфицируйте место разреза раствором повидон-йода. Дайте крысам восстановиться в контролируемых условиях при постоянной температуре в течение 7 дней.
3. Релейная хирургия обратимой односторонней обструкции мочеточника
- Подготовьте необходимых животных и инструменты, обеспечив стерильную установку для повторного открытия брюшной полости и полного обнажения брюшной полости.
- Аккуратно рассеките узел силиконовой трубки с помощью лезвия скальпеля. Извлеките трубку и орошите брюшную полость обычным физиологическим раствором, чтобы свести к минимуму спайки и риск инфекции.
- Вправьте кишечник и зашите разрез брюшной стенки слоями с помощью 4-0 нерассасывающихся швов. Место разреза простерилизовать раствором повидон-йода. Поместите крысу в среду с контролируемой температурой на 7-дневный послеоперационный период восстановления.
- На 14-й день после операции сделайте крыс под наркозом (следуя процедуре, описанной в шаге 1.2) и соберите образцы почек, поперечно разрезав почки на две половины.
- Храните одну половину в 4% параформальдегиде для гистопатологического исследования, а другую половину быстро замораживайте в жидком азоте для хранения при температуре −80 °C для последующего молекулярного анализа. Соберите образцы крови для биохимических анализов.
- Провести эвтаназию с помощью удушения CO2 с последующим вывихом шейки матки в соответствии с этическими рекомендациями.
4. Последующая оценка
- Отслеживайте массу тела после RUUO для оценки общего восстановления. Сравните изменения веса с контрольной группой и группой UUO.
- Измерьте массу и объем почек для оценки восстановления почек.
- Мониторинг уровня креатинина (Scr) в сыворотке крови как индикатора улучшения функции почек9.
- Введите метиленовый синий в почечную лоханку для подтверждения проходимости мочеточника. Наблюдайте за перистальтикой и окраской мочеточника для оценки восстановления после обструкции.
- Проводите окрашивание H&E для оценки целостности канальцев и структуры почек после RUUO 8,10.
- Проведение трихромного окрашивания по Массону для оценки регрессии почечного интерстициального фиброза 8,10.
- Сравните баллы повреждения почек 3,8 между группами UUO и RUUO для количественной оценки восстановления тканей.
Результаты
Оценивали влияние UUO и его последующего высвобождения (RUUO) на массу тела, массу почек, объем почек и уровни креатинина (Scr) в сыворотке крови, как показано в таблице 1. Данные представлены в виде среднего ± стандартного отклонения (SD), при этом n = 5 на группу.
Через 6 недель средняя масса тела у нативной группы составила 234 г ± 16 г, масса почек составила 0,9107 г ± 0,0475 г, а объем почек составил 0,8962 см³ ± 0,0502 см³. К 8 неделям в контрольной группе наблюдалось достоверное увеличение массы тела (291 г ± 20 г, P < 0,05), массы почек (1,1443 г ± 0,0687 г, P < 0,05) и объема почек (1,1340 см³ ± 0,0392 см³, P > 0,05), при уровне Scr 18,07 мкмоль/л ± 2,17 моль/л.
В 8-недельной группе ННК наблюдалось значительное увеличение почек, при этом масса почек (2,5535 г ± 0,2587 г, P < 0,01) и объем почек (2,8533 см³ ± 0,3870 см³, P < 0,01) значительно увеличились. Масса тела была несколько ниже, чем в контрольной группе (280 г ± 17 г, P < 0,05), а также повысился уровень Scr (20,02 мкмоль/л ± 1,36 моль/л, P < 0,05), что свидетельствует о нарушении функции почек.
В группе 8-недельного RUUO масса почек (1,5178 г ± 0,1305 г, P < 0,05) и объем почек (1,6183 см³ ± 0,0906 см³, P < 0,05) были ниже, чем в группе UUO, но оставались повышенными по сравнению с контрольной группой, при этом заметное значение наблюдалось только в объеме почек (P < 0,05). Уровни Scr (16,42 мкмоль/л ± 4,03 мкмоль/л, P < 0,05) были снижены по сравнению с группой UUO, но не полностью вернулись к исходному уровню. Масса тела (288 г ± 12 г, P > 0,05) была выше, чем в группе с НРП, но оставалась несколько ниже, чем в контрольной группе.
Морфология почек и почечной лоханки претерпела значительные изменения после обструкции мочеточника. Выше места обструкции мочеточники и почечная лоханка демонстрировали выраженное расширение, с увеличением почек и заметным истончением почечной коры и мозгового вещества. После реканализации обструкции мочеточника дилатация мочеточников и почечной лоханки была значительно снижена, хотя наблюдалась небольшая остаточная дилатация (Рисунок 1).
Для оценки проходимости мочеточника в почечную лоханку с помощью инсулиновой иглы вводили 0,1 мл метиленового синего (0,33 мм × 12,7 мм). Полная обструкция была подтверждена, когда краситель не смог проникнуть через закупорку мочеточника. Результаты инъекции метиленового синего в почечную лоханку и мочеточники крыс с помощью RUUO до устранения обструкции представлены на рисунке 2А. После удаления силиконовой трубки мочеточник в месте лигирования имел румяный цвет (рис. 2B) и демонстрировал нормальную перистальтику, что позволяет предположить, что этот метод привел к минимальному повреждению мочеточника.
Гистологический анализ нормальной почки выявил плотные, здоровые канальцы, окружающие клубочки (рис. 3, слева). Через четырнадцать дней после НВО эпителий проксимальных канальцев наблюдались вакуолизация и дегенерация, потеря границ кисти и отшелушивание. В пределах просветов наблюдались некротические клетки. Дистальные канальцы оказались расширенными, некоторые канальцы отсутствовали, а собирательные протоки были расширены, что привело к истончению почечной коры (рис. 3).
Трихромное окрашивание Массона использовалось для оценки интерстициального фиброза почек, при этом окрашенные в синий цвет коллагеновые волокна указывали нафиброзные изменения. Этот метод эффективно дифференцирует клетки, коллагеновые волокна и другие компоненты тканей. В модели UUO через 14 дней наблюдалось существенное увеличение коллагеновых волокон в почечном интерстиции, что указывает на выраженный интерстициальный фиброз (рис. 4). Напротив, модель RUUO продемонстрировала заметное уменьшение коллагеновых волокон, что позволяет предположить, что фиброз был либо смягчен, либо отсрочен.
Согласно шкале повреждения почек (рис. 5), в группе UUO наблюдалось тяжелое повреждение почек, в то время как в группе RUUO наблюдалось умеренное повреждение почек. Как показано на рисунке 5, оценка почечного повреждения была значительно выше в группе с НВОО по сравнению с нативной группой (P < 0,0001). Группа RUUO показала значительно более низкий балл по травме почек по сравнению с группой UUO (P < 0,05); тем не менее, оценка оставалась значительно выше по сравнению с местной группой (P < 0,001). В целом, повреждение почек в группе RUUO значительно уменьшилось по сравнению с группой UUO (P < 0,05).

Рисунок 1: Репрезентативная гистология нативной почки, почки с НВН (14-дневная) и почки РУУО. По сравнению с нативной почкой, 14-дневный прием UUO привел к заметному увеличению объема почки, характеризующемуся выраженным расширением почечной лоханки и проксимального отдела мочеточника, а также уменьшением толщины коры и мозгового мозга почек. Напротив, объем почек в группе RUUO (правая панель) был значительно уменьшен по сравнению с группой UUO (средняя панель), с отчетливым сужением почечной лоханки и мочеточника. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Визуализация мочеточника с помощью инъекции метиленового синего и после удаления силиконовой трубки. (A) На7-й день RUUO, после введения метиленового синего в почечную лоханку, наблюдалось окрашивание в мочеточнике над силиконовой трубкой, в то время как участок ниже места лигирования оставался неокрашенным. (B) Мочеточник становится красноватым после удаления силиконовой трубки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Репрезентативная гистология нативных почек, почек UUO и RUUO. В почке UUO наблюдается потеря щеточной границы в проксимальных канальцах, значительное расширение просвета канальцев, дегенерация, отслоение и распад эпителиальных клеток канальцев, а также обнажение базальной мембраны, что свидетельствует о выраженном остром повреждении канальцев. Количество расширенных почечных канальцев в почке RUUO заметно ниже, чем в почке UUO, что свидетельствует о частичном восстановлении канальцев. Верхние панели: Масштабная линейка = 100 μм; нижние панели (вставка): Масштабная линейка = 16 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
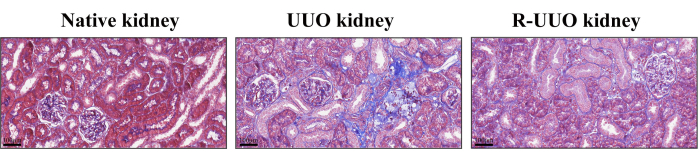
Рисунок 4: Трихромное окрашивание Массоном нативных почек, почек UUO и RUUO. Участки, окрашенные в синий цвет, указывают на коллагеновые волокна. Почка UUO продемонстрировала более высокую плотность коллагеновых волокон по сравнению с родной почкой. Напротив, почка RUUO показала значительное снижение плотности коллагеновых волокон по сравнению с почкой UUO, что указывает на облегчение интерстициального фиброза. Верхние панели: Масштабная линейка = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Оценка повреждения канальцев в нативных почках, почках UUO и RUUO. На основании окрашивания гематоксилином и эозином (ПЭ) гистологические изменения в почечной ткани оценивались по полуколичественной шкале для тубулярного некроза: 0 = нормальная почка, 1 = минимальный некроз (≤5% вовлечения), 2 = легкий некроз (5%-25% поражения), 3 = умеренный некроз (25%-50% поражения), 4 = тяжелый некроз (50%-75% поражения) и 5 = наиболее тяжелый некроз (>75% поражения). Ось y представляет оценки повреждения почек, в то время как ось x представляет экспериментальные группы. По сравнению с нативной группой, группа UUO показала значительно более высокий балл повреждения почек (P < 0,0001). Напротив, группа RUUO имела значительно более низкий балл почечного повреждения по сравнению с группой UUO (P < 0,05). Тем не менее, по сравнению с родной группой, группа RUUO по-прежнему показала значительно более высокий балл повреждения почек (P < 0,001). В целом, в группе UUO наблюдалось тяжелое повреждение почек, в то время как в группе RUUO наблюдалось умеренное повреждение почек. Почечное повреждение в группе RUUO значительно уменьшилось по сравнению с группой UUO (P < 0,05). Статистическая значимость указывается следующим образом: *P < 0,05, ***P < 0,001 и ****P < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Группа | Масса тела (г) | Масса почек (г) | Объем почек (см³) | Креатинин сыворотки крови (мкмоль/л) |
| Нативный (6 недель) | 234 ± 16а | 0,91 ± 0,05А | 0,90 ± 0,05А | Н/Д* |
| Контроль (8 недель) | 291 ± 20*b | 1,14 ± 0,07*b | 1,13 ± 0,04А | 18.07 ± 2.17*b |
| UUO (8 недель) | 280 ± 17*c | 2,55 ± 0,26**c | 2,85 ± 0,39**c | 20.02 ± 1.36*c |
| RUUO (8 недель) | 288 ± 12*b | 1,52 ± 0,13*b | 1,62 ± 0,09**b | 16.42 ± 4.03а |
Таблица 1: Масса тела, масса почек, объем почек и уровень креатинина в сыворотке крови в различных группах. Данные представлены в виде среднего ± стандартного отклонения (SD), при этом n = 5 на группу. Названия групп указывают на возраст крыс на момент измерения и соответствующую модель заболевания. Статистические сравнения проводились с использованием критерия Краскела-Уоллиса, за которым последовал тест множественных сравнений Данна. Разные надстрочные буквы (a, b, c) обозначают статистически значимые различия между группами (P < 0,05), где группы, использующие одну и ту же букву, существенно не отличаются, в то время как группы с разными буквами указывают на значимые различия. Для прямых сравнений с контрольной группой (за исключением креатинина в сыворотке крови) статистическая значимость обозначена как P < 0,05 через (*) и P < 0,01 через (**). *Н/Д: Уровень креатинина в сыворотке крови не измерялся в группе нативного ребенка (6-недельного возраста). По сравнению с местной группой, контрольная группа продемонстрировала значительное увеличение как массы тела, так и массы почек (P < 0,05), что указывает на заметный рост и развитие у 8-недельных крыс и их почек. Объем почек также увеличился в контрольной группе, хотя разница не была статистически значимой (P > 0,05). По сравнению с контрольной группой, в группе UUO наблюдалось статистически значимое снижение массы тела (P < 0,05), при этом масса и объем почек значительно увеличились (P < 0,01). Уровень креатинина в сыворотке крови также значительно повышался в группе ННЭ (P < 0,05). По сравнению с группой UUO, в группе RUUO наблюдалось статистически значимое увеличение массы тела (P < 0,05) и значительное снижение массы почек, объема почек и уровня креатинина в сыворотке крови (P < 0,05), при этом особенно заметно снижение креатинина в сыворотке крови. По сравнению с контрольной группой, в группе RUUO наблюдалось достоверное увеличение объема почек (P < 0,01) и значительное снижение уровня креатинина в сыворотке крови (P < 0,05), в то время как различия в массе тела и массе почек не были значимыми. В целом, в группе UUO наблюдалось увеличение массы почек, объема почек и уровня креатинина в сыворотке крови по сравнению с контрольной группой, в то время как в группе RUUO наблюдалось восстановление этих показателей, при этом все различия были статистически значимыми (P < 0,05).
Обсуждение
В этой модели используется силиконовая трубка для окружения мочеточника, обеспечивающая структурную поддержку, с последующим лигированием шелковой нитью для вызова полной обструкции мочеточника за счет компрессии. Через семь дней лигирование и силиконовая трубка удаляются, чтобы облегчить декомпрессию почек и восстановить целостность и функциональность мочевыводящих путей.
Силиконовые трубки, изготовленные из силиконовых эластомеров, обеспечивают превосходную гибкость, биосовместимость, химическую стойкость и термическую стабильность. Медицинский силиконовый каучук специально разработан для применений, требующих превосходных механических свойств, включая долгосрочную имплантацию, в то время как обычные силиконовые трубки включают в себя ряд коммерчески доступных вариантов, которые могут отличаться по эластичности, твердостии профилям биосовместимости. Учитывая короткую продолжительность эксперимента (7-14 дней) и отсутствие длительных механических нагрузок в данном исследовании, силиконовые трубки были выбраны для создания моделей обструкции мочеточника у крыс из-за их адекватной биосовместимости, соответствующей эластичности и экономической эффективности. Таким образом, оба материала демонстрируют функциональную эквивалентность и могут быть взаимозаменяемы в данном исследовании.
Продолжительность обструкции является критическим фактором для восстановления почек RUUO, при этом исследования показывают, что повреждение почек может быть частично смягчено, если обструкция будет устранена на седьмой день, в то время как после14-7 дня существенного восстановления не наблюдается. Оптимальная продолжительность обструкции мочеточника в модели RUUO была определена равной семи дням, чтобы предотвратить чрезмерное повреждение и гарантировать, что длительная обструкция не окажет чрезмерного влияния на результаты. Сравнивая почки, подвергшиеся обструкции в течение 14 дней, с почками, состояние которых было облегчено через семь дней, визуально изучалось прогрессирование обструктивной нефропатии в моделях RUUO и UUO. Метиленовый синий был введен в почечную лоханку для подтверждения полной обструкции мочеточника перед удалением катетера. Для тестирования был выбран7-й день обструкции вместо первого дня из-за выраженного расширения почечной лоханки к этому времени, что облегчило введение иглы и снизило риск повреждения мочеточника от использования иглы инсулина в 1-й день.
Метод облегчения обструкции прост, эффективен и разработан для минимизации потенциального повреждения мочеточника. Эта модель обеспечивает полную обструкцию при одновременном повышении успешности реканализации и снижении вероятности повреждения мочеточника. Модель RUUO характеризуется своей простотой, воспроизводимостью и легкостью в реализации, что делает ее ценным инструментом для изучения почечного фиброза, регенерации почек и связанных с ним механизмов 14,15,16.
Основываясь на модели UUO, модель RUUO устраняет необратимые ограничения своей предшественницы. Интегрируя патологическое прогрессирование индуцированного UUO интерстициального фиброза почек с последующим восстановлением после снятия обструкции, модель RUUO воспроизводит фазу восстановления при остром повреждении почек (ОПП) и фиброзе почек. Эта модель облегчает моделирование процессов лечения почек с клинически обструкцией почек и обеспечивает более полное исследование регенерации клеток и ремоделирования внеклеточного матрикса (ВКМ) по сравнению с традиционной моделью UUO.
Изучение UUO у людей дает ценную информацию о механизмах повреждения почек, фиброза и потенциальных терапевтических вмешательствах. UUO широко используется для имитации обструктивной нефропатии, вызванной такими состояниями, как обструкция мочеточникового перехода (UPJO), камни в почках или опухоли2. Фиброз почек, характеризующийся чрезмерным отложением ВКМ, является отличительной чертой хронической болезни почек, и модели UUO играют важную роль в изучении роли ВКМ в прогрессировании фиброза. Эта модель надежно воспроизводит процесс повреждения почек, в частности, развитие фиброза, обеспечивая основу для исследования механизмов, лежащих в основе почечного фиброза.
Исследования показывают, что снятие обструкции может частично восстановить и сохранить почечную гемодинамику и функцию, в некоторой степени смягчая прогрессирование фиброза17. Это имеет значительные последствия для восстановления после повреждения почек. Тем не менее, отсроченное облегчение обструкции часто приводит к плохому выздоровлению и дальнейшему ухудшению состояния почек, что потенциально может привести к почечнойнедостаточности. Кроме того, НВО был связан с гипертензией, при этом отсроченное вмешательство коррелировало с более высокой частотой и тяжестью этого состояния. Эти результаты подчеркивают критическую важность раннего вмешательства для минимизации повреждения почек и управления артериальным давлением. Отсроченное облегчение не только усугубляет фиброз и снижение функции почек, но и увеличивает риск гипертонии.
В этом контексте модель RUUO служит ценным инструментом для исследования динамического характера повреждения почек и восстановления. Исследования с использованием модели RUUO показывают, что, хотя деструкция мочеточника может смягчить некоторые повреждения, стойкий фиброз и долгосрочные повреждения остаются, что наблюдается как на животных, так и в клинических моделях19. Таким образом, модель RUUO имеет важное значение для понимания того, как раннее вмешательство может помочь ограничить необратимое повреждение почек и замедлить прогрессирование хронической болезни почек и связанных с ней осложнений, таких как гипертония.
Несколько исследователей предложили различные модели RUUO 10,14,20,21,22,23. Тем не менее, многие существующие модели реканализации имеют ограничения, включая сложные хирургические процедуры, высокие требования к техническим навыкам и нестабильные результаты. Например, в Ульме22 описан метод встраивания поясничной мышцы мочеточника, который способствует успешной реканализации и относительно прост в выполнении. Тем не менее, на его эффективность могут влиять такие факторы, как поза животного, движение и колебания напряжения поясничной мышцы. Park et al.23 использовали неинвазивный микрососудистый клипс для индуцирования обструкции в течение 10 дней с последующим удалением клипсы с использованием того же хирургического подхода. Хотя этот метод имеет такие преимущества, как биосовместимость, простота в эксплуатации, минимальная продолжительность процедуры и воспроизводимость, он может привести к кишечным спайкам и снижению успешности реканализации мочеточника.
Использование силиконовой трубки является эффективной альтернативой, так как ее мягкость и биосовместимость позволяют проводить обструкцию мочеточника, не повреждая окружающие ткани. Этот подход сводит к минимуму повреждение тканей и воспалительные реакции, обеспечивая при этом облегчение обструкции без необратимого повреждения мочеточника. Следовательно, модель RUUO остается обратимой, стабильной и пригодной для долгосрочных исследований.
Метод пузырно-мочеточниковой реимплантации, использованный Hesketh et al.10 , хорошо подходит для изучения патофизиологических изменений после везикомочечниковой реимплантации. Однако эта методика предполагает сложную хирургическую процедуру с длительным временем операции и рисками разрыва и отслойки мочеточника из-за чрезмерного напряжения. Кроме того, укороченный мочеточник может не успешно анастомозироваться с тригоном мочевого пузыря, что приводит к аномальному воссоединению и потенциальной неудаче хирургического вмешательства. Эти проблемы ограничивают его применимость, особенно в моделях мелких животных.
Yao et al.16 представили методику пережатия мочеточника с использованием свернутой полиэтиленовой трубки, которая уменьшает повреждение мочеточника и обеспечивает стабильную окклюзию. Однако гладкая поверхность полиэтиленовой трубки может привести к соскальзыванию лигатуры из-за перистальтики и движения животного, что может привести к обструкции. Chevalier et al.9 вставили силиконовую трубку в левый мочеточник неонатальных мышей, которая была удалена после пяти дней пережатия сосудов. В то время как эта модель эффективно индуцирует обструкцию, использование лигирования шелковой нитью в качестве альтернативы сосудистым зажимам дало сопоставимые результаты, включая значительное уменьшение объема почек и почечной лоханки. Кроме того, этот метод вызывал минимальные воспалительные и фиброзные реакции вокруг мочеточника. Несмотря на то, что через семь дней после снятия обструкции наблюдалась легкая дилатация мочеточника, она была значительно менее серьезной, чем приреимплантации пузырно-мочеточникового аппарата. Этот подход также предотвращает пузырно-мочеточниковый рефлюкс, что делает его жизнеспособной альтернативой для изучения RUUO.
Ключевым моментом в этом подходе является минимизация повреждения мочеточника во время операции, так как повреждение мочеточника может вызвать воспаление, потенциально приводящее к адгезии, закрытию и неудаче реканализации. Пузырно-мочеточниковая реимплантация сопряжена с такими рисками, как прямое повреждение мочеточника, воспаление анастомоза и потенциальное закрытие из-за хирургических ошибок. Кроме того, недостаточный дренаж осадка мочи перед реимплантацией может способствовать неудаче реканализации. Использование силиконовой трубки для внешнего покрытия мочеточника обеспечивает защиту, в то время как перевязка сосудистым зажимом или шелковой нитью через силиконовую трубку вызывает обструкцию мочеточника. Тем не менее, сосудистые зажимы могут увеличить риск кишечных спаек и снизить показатели успешности реканализации. Несмотря на то, что изменение положения зажима каждые два дня во время обструкции мочеточника, как сообщается, улучшает показатели успешности реканализации на 70%17, этот метод значительно продлевает время процедуры и создает технические проблемы. Напротив, лигирование шелковой нитью через силиконовую трубку предлагает более простой подход с уменьшением воспаления. Основной проблемой остается вопрос о том, обеспечивает ли лигирование шелковой нитью полную обструкцию и однородность у испытуемых.
В этом исследовании метиленовый синий был введен в мочеточник для подтверждения полной обструкции. В группе UUO все крысы достигли успешной обструкции (100% успеха), при этом смертность в стандартных условиях не наблюдалась. В группе RUUO (n = 12) шесть крыс были исключены из анализа из-за осложнений: одна умерла во время операции от угнетения дыхания, вызванного анестезией, две скончались от послеоперационных осложнений (подозрение на кровотечение или инфекцию) на 6 и 13 день, у двух была неполная обструкция, а у одной произошла неудачная реканализация из-за хирургических осложнений. Следовательно, выживаемость в группе RUUO составила 75% (95% ДИ: 46,77%-91,11%), успешность полной обструкции составила 80% (95% ДИ: 49,0%-94,3%), а успешность реканализации составила 90% (95% ДИ: 59,6%-98,2%). Все пропорции были рассчитаны с использованием соответствующих знаменателей после исключения, а 95% доверительные интервалы были определены с использованием метода оценки Вильсона.
Под восстановлением понимается восстановление физиологической функции после патологических изменений или функциональных нарушений. Она включает в себя не только обращение вспять патологических изменений, но и возвращение функции органов к уровню, близкому к нормальному. В отличие от этого, консервация относится к вмешательствам, начатым до или на ранних стадиях процесса заболевания, чтобы предотвратить дальнейшее ухудшение, а не полностью обратить вспять существующие повреждения24. Для проведения дифференциации между восстановлением и сохранением почек требуется всесторонняя базовая оценка функции почек, а также динамический мониторинг прогрессирования заболевания и устранения обструкции. Это исследование было ограничено краткосрочными наблюдениями и не включало систематический мониторинг патологических маркеров во время выздоровления. В частности, in vivo лонгитюдные биомаркеры не использовались для отслеживания истинной инверсии патологических механизмов. Несмотря на то, что наблюдались улучшения в почечной ткани и функции почек, остается неясным, представляют ли эти изменения полный патологический регресс. Будущие исследования должны включать биомаркеры фиброза и медиаторы воспаления для динамической оценки разрешения заболевания.
Кроме того, из-за ограничений в экспериментальном оборудовании и методах, в этом исследовании не измеряли протеинурию и альбуминурию, параметры, хорошо известные как индикаторы патофизиологии почек24. Их отсутствие может ограничивать прямые сравнения с классическими моделями заболеваний почек. Будущие исследования должны включать стандартизированный анализ белка мочи наряду с измерениями креатинина сыворотки крови и азота мочевины крови, чтобы обеспечить более всестороннюю оценку функции почек и повреждений.
Хирургическое облегчение обструктивной болезни почек является основной клинической стратегией лечения обструктивных заболеваний почек25. Хотя это исследование не полностью устанавливает полную инверсию почечных патологических механизмов, оно представляет собой ценную исследовательскую модель для изучения патологических и физиологических изменений после высвобождения обструкции мочеточника. Это также позволяет оценить, полностью ли восстановлена функция почек или только частично.
Таким образом, эта модель применима к крысам разного возраста, хотя для неонатальных крыс, проходящих RUUO, требуется особая осторожность, включая соответствующий выбор силиконовой трубки и профилактику повреждения мочеточника. Следует избегать чрезмерного лигирования, чтобы предотвратить неудачу реканализации. Модель демонстрирует сопоставимую эффективность реканализации, будучи при этом простой, стабильной и осуществимой, что делает ее хорошо подходящей для изучения воспалительных и иммунных процессов, регенерации почек и связанных с ними механизмов, со значительным потенциалом для дальнейших исследований.
Раскрытие информации
Никакой.
Благодарности
Эта работа была поддержана Программой молодежных инноваций в медицине будущего, Чунцинский медицинский университет (W0056), Совместный проект по инновациям и применению технологий ТКМ в Чунцине (2020ZY023877).
Материалы
| Name | Company | Catalog Number | Comments |
| Forceps | Shanghai Medical Devices Co.,Ltd | 20220032 | |
| Gauze | Sichuan Kelun Co., Ltd | 20172140152 | |
| Hematoxylin and Eosin Stain Kit | Solarbio | G1120 | |
| Insulin needles | KDL Medical Devices | 20193140938 | |
| Masson’s Trichrome Stain Kit | Solarbio | G1340 | |
| Medical Cotton balls | Sichuan Kelun Co., Ltd | 20170037 | |
| Medical Cotton sticks | Sichuan Kelun Co., Ltd | 20172140026 | |
| Methylene blue | Tianjin Dengfeng Chemical Reagent Factory | 14038-43-8 | |
| Microscopic forceps | Suqian Shifeng Medical Devices Co., Ltd | S50985 | |
| Needle holders | Suqian Shifeng Medical Devices Co., Ltd | S7005 | |
| Povidone-iodine Solution | Sichuan Kelun Co., Ltd | 514001 | |
| Saline | Sichuan Kelun Co., Ltd | 20220004 | |
| SD Rats | SPF(Beijing)Biotechnology Co.,Ltd | D025 | |
| Silicone tubing | Taizhou Chunshi New Materials Co., Ltd | CS356 | |
| Silk suture | Qiangsheng Medical Devices Co.,Ltd | SA84G | |
| Surgical blade | Huanan Yunyue Medical Devices Co.,Ltd | CE0434 | |
| Surgical scissors | Shanghai Medical Devices Co.,Ltd | J21130 | |
| Syringe | Tongmai medical devices | 20183140304 | |
| Tissue Forceps | Jiangxi Yuyuan Medical Equipment Co., Ltd | J36030 |
Ссылки
- Chaves, L. D., et al. Contrasting effects of systemic monocyte/macrophage and CD4+ t cell depletion in a reversible ureteral obstruction mouse model of chronic kidney disease. Clin Dev Immunol. 2013, 836989(2013).
- Chevalier, R. L., Forbes, M. S., Thornhill, B. A. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney Int. 75 (11), 1145-1152 (2009).
- Aranda-Rivera, A. K., et al. Sulforaphane protects from kidney damage during the release of unilateral ureteral obstruction (RUUO) by activating nuclear factor erythroid 2-related factor 2 (nrf2): Role of antioxidant, anti-inflammatory, and antiapoptotic mechanisms. Free Radic Biol Med. 212, 49-64 (2024).
- Narváez Barros, A., et al. Reversal unilateral ureteral obstruction: A mice experimental model. Nephron. 142 (2), 125-134 (2019).
- Cochrane, A. L., et al. Renal structural and functional repair in a mouse model of reversal of ureteral obstruction. J Am Soc Nephrol. 16 (12), 3623-3630 (2005).
- Kaeidi, A., et al. The therapeutic approaches of renal recovery after relief of the unilateral ureteral obstruction: A comprehensive review. Iran J Basic Med Sci. 23 (11), 1367-1373 (2020).
- Liu, Y., et al. A porcine model of relief of unilateral ureteral obstruction: Study on self-repairing capability over multiple time points. Mol Cell Biochem. 419 (1-2), 115-123 (2016).
- Puri, T. S., et al. Chronic kidney disease induced in mice by reversible unilateral ureteral obstruction is dependent on genetic background. Am J Physiol Renal Physiol. 298 (4), F1024-F1032 (2010).
- Chevalier, R. L., Kim, A., Thornhill, B. A., Wolstenholme, J. T. Recovery following relief of unilateral ureteral obstruction in the neonatal rat. Kidney Int. 55 (3), 793-807 (1999).
- Hesketh, E. E., et al. A murine model of irreversible and reversible unilateral ureteric obstruction. J Vis Exp. (94), e52559(2014).
- Klahr, S., Morrissey, J. Obstructive nephropathy and renal fibrosis. Am J Physiol Renal Physiol. 283 (5), F861-F875 (2002).
- Jin, B., et al. Loss of men1 leads to renal fibrosis and decreases HGF-ADAMTS5 pathway activity via an epigenetic mechanism. Clin Transl Med. 12 (8), e982(2022).
- Fischer, N. G., He, J., Aparicio, C. Surface immobilization chemistry of a laminin-derived peptide affects keratinocyte activity. Coatings (Basel). 10 (6), 560(2020).
- Song, J., et al. Losartan accelerates the repair process of renal fibrosis in UUO mouse after the surgical recanalization by upregulating the expression of tregs. Int Urol Nephrol. 51 (11), 2073-2081 (2019).
- Song, J., et al. Regulatory t cells accelerate the repair process of renal fibrosis by regulating mononuclear macrophages. Am J Med Sci. 361 (6), 776-785 (2021).
- Yao, Y., et al. Interferon-γ improves renal interstitial fibrosis and decreases intrarenal vascular resistance of hydronephrosis in an animal model. Urology. 77 (3), e768-e761.e713 (2011).
- Chevalier, R. L., Thornhill, B. A., Chang, A. Y., Cachat, F., Lackey, A. Recovery from release of ureteral obstruction in the rat: Relationship to nephrogenesis. Kidney Int. 61 (6), 2033-2043 (2002).
- Lucarelli, G., et al. Delayed relief of ureteral obstruction is implicated in the long-term development of renal damage and arterial hypertension in patients with unilateral ureteral injury. J Urol. 189 (3), 960-965 (2013).
- Ito, K., et al. Renal damage progresses despite improvement of renal function after relief of unilateral ureteral obstruction in adult rats. Am J Physiol Renal Physiol. 287 (6), F1283-F1293 (2004).
- Song, J., et al. A modified relief of unilateral ureteral obstruction model. Ren Fail. 41 (1), 497-506 (2019).
- Morrissey, J., et al. morphogenetic protein-7 improves renal fibrosis and accelerates the return of renal function. J Am Soc Nephrol. 13 (suppl_1), S14-S21 (2002).
- Ulm, A. H., Miller, F. An operation to produce experimental reversible hydronephrosis in dogs. J Urol. 88, 337-341 (1962).
- Park, H. C., et al. Postobstructive regeneration of kidney is derailed when surge in renal stem cells during course of unilateral ureteral obstruction is halted. Am J Physiol Renal Physiol. 298 (2), F357-F364 (2010).
- Forni, L. G., et al. Renal recovery after acute kidney injury. Intensive Care Med. 43 (6), 855-866 (2017).
- Varela, S., Omling, E., Borjesson, A., Salo, M. Resolution of hydronephrosis after pyeloplasty in children. J Pediatr Urol. 17 (1), e101-e102.e7 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены