Method Article
Um modelo murino imaturo de obstrução ureteral unilateral reversível
Neste Artigo
Resumo
O presente protocolo descreve um modelo passo a passo reprodutível de obstrução ureteral unilateral.
Resumo
A obstrução ureteral unilateral (UUO) é uma causa comum de doença renal crônica (DRC), levando à progressão da fibrose intersticial renal e, por fim, resultando em danos renais irreversíveis. O alívio do UUO é crucial. Vários modelos animais de obstrução ureteral unilateral reversível (RUUO) foram estabelecidos na literatura, permitindo a observação de alterações estruturais e danos funcionais, além de simular alterações fisiológicas e fisiopatológicas após o alívio da obstrução ureteral. Neste estudo, foi estabelecido um modelo de obstrução reversível no ureter murino unilateral com tubo de silicone. Danos renais significativos foram observados antes do alívio da obstrução, com recuperação parcial observada posteriormente. Ao contrário do UUO, este modelo previne a hidronefrose progressiva, levando a resultados patológicos distintos. Este procedimento cirúrgico simples demonstra uma alta taxa de sucesso e é promissor como um modelo clássico para investigar nefropatia obstrutiva reversível e possíveis tratamentos para fibrose intersticial renal. Além disso, fornece uma plataforma prática para estudar os mecanismos de recuperação da nefropatia obstrutiva, regeneração de células renais e remodelação tecidual.
Introdução
A obstrução uretral contribui significativamente para a fibrose intersticial renal e a doença renal crônica (DRC), podendo levar a danos estruturais irreversíveis e prejuízos funcionais no rim1. Embora a obstrução ureteral unilateral (UUO) seja amplamente utilizada para estudar lesão renal e DRC, ela não replica com precisão os mecanismos de recuperação espontânea que ocorrem após a remoção de uma obstrução. O modelo UUO envolve a ligadura do ureter esquerdo com suturas, resultando em obstrução permanente, dilatação ureteral, hidronefrose, compressão do parênquima renal e afinamento cortical. O exame histológico geralmente revela dilatação tubular, necrose de células epiteliais tubulares e inflamação intersticial progressiva e fibrose2. Este modelo investiga principalmente a fibrose intersticial renal e a perda irreversível da função renal devido à obstrução persistente.
No entanto, muitas doenças renais encontradas na prática clínica, como obstrução causada por cálculos ou tumores ureterais, são reversíveis. O modelo de obstrução ureteral unilateral reversível (RUUO) permite a restauração parcial da estrutura renal e da função do trato urinário, resolvendo a hidronefrose. A recuperação pode ser avaliada por meio de técnicas de imagem, exame histológico e análise de biomarcadores para quantificar a redução da lesão renal e fibrose3. Este modelo imita de perto a fase de recuperação da nefropatia obstrutiva em ambientes clínicos e é mais adequado do que o UUO para estudar processos-chave como inflamação, respostas imunes, regeneração celular e remodelação tecidual 4,5,6,7,8.
O modelo RUUO permite que os pesquisadores analisem o reparo e a regeneração renal após o alívio da lesão, abordando as limitações do UUO em estudos dinâmicos. Ao comparar diferentes pontos de tempo antes e depois da obstrução, os pesquisadores podem investigar as vias moleculares envolvidas na lesão e no reparo, incluindo inflamação, apoptose, fibrose e regeneração. Essa abordagem melhora a compreensão dos mecanismos de recuperação renal e identifica potenciais alvos terapêuticos 2,3,4,5,8,9,10. Embora a fibrose renal seja frequentemente considerada irreversível, as observações clínicas sugerem que o alívio precoce da obstrução durante os estágios iniciais da fibrose pode interromper ou mesmo reverter a progressão da doença. O modelo RUUO fornece uma plataforma experimental valiosa para investigar esse fenômeno11.
Além disso, o modelo RUUO facilita o estudo da reversão da fibrose após o alívio da obstrução, oferecendo insights sobre os mecanismos de recuperação e possíveis terapias antifibróticas 3,4. Consequentemente, este modelo é altamente prático para a pesquisa translacional. O objetivo principal deste modelo experimental é induzir nefropatia obstrutiva por meio de canulação ureteral, seguida de alívio padronizado em um ponto de tempo predefinido para garantir a consistência. Ele é otimizado para simplicidade, reprodutibilidade e segurança, tornando-o uma ferramenta eficaz para pesquisas experimentais.
Protocolo
Este estudo em animais aderiu às diretrizes da Declaração de Helsinque e foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Infantil da Universidade Médica de Chongqing. Um total de 27 ratos Sprague Dawley (SD) machos foram obtidos comercialmente e alojados no Centro de Animais de Laboratório do Hospital Infantil da Universidade Médica de Chongqing (SPF, número de licença: SYXK (Chongqing) 2007-0016). Os ratos foram mantidos em condições controladas de temperatura com ciclo claro/escuro de 12 horas e tiveram acesso ad libitum a comida e água.
O protocolo foi realizado em ratos machos SD com idade entre 6 e 8 semanas e é aplicável a ratos de todas as idades com ureteres bilaterais. Neste estudo, quinze ratos SD machos de 6 semanas de idade foram aleatoriamente divididos em três grupos: o grupo nativo (n = 5), o grupo UUO (n = 5) e o grupo RUUO (n = 5). Além disso, cinco ratos SD de 8 semanas de idade (n = 5) foram incluídos como um grupo controle adicional. Para estabelecer o modelo RUUO, foram utilizados 12 ratos, com 7 ratos adicionais adquiridos para contabilizar riscos potenciais, como mortalidade intra e pós-operatória, falhas cirúrgicas, obstrução incompleta e reversão malsucedida. Isso garantiu um mínimo de 5 ratos por grupo para análises subsequentes.
Todos os procedimentos cirúrgicos foram realizados em estrita conformidade com as diretrizes institucionais e nacionais para cuidados e uso de animais de laboratório. A equipe cirúrgica aderiu aos protocolos de equipamentos de proteção individual (EPI), incluindo máscaras cirúrgicas, luvas e aventais. Instrumentos cirúrgicos estéreis foram usados para cada procedimento e foram autoclavados antes e após o uso para manter a esterilidade. Os resíduos, incluindo perfurocortantes e espécimes biológicos, foram descartados em conformidade com os protocolos de gerenciamento de resíduos perigosos para mitigar os riscos de contaminação e garantir a segurança.
1. Preparação de animais e instrumentos
- Realize todos os procedimentos usando instrumentos estéreis (autoclavados) e consumíveis. Corte o tubo de silicone esterilizado (diâmetro interno: 1.5 mm, diâmetro externo: 2.5 mm) em segmentos de aproximadamente 1 cm. Faça uma incisão longitudinal ao longo de um lado da parede do tubo para uso posterior.
- Anestesiar os ratos por meio de injeção intraperitoneal de pentobarbital (40 mg / kg) (seguindo protocolos aprovados institucionalmente). Confirme a anestesia adequada verificando a ausência de respostas reflexas, como o reflexo de retirada do pedal, ao beliscar o dedo do pé. Aplique pomada oftálmica veterinária nos olhos para evitar o ressecamento da córnea durante a anestesia.
- Depile o abdômen do rato do processo xifóide até a sínfise púbica e estenda bilateralmente até a linha média.
- Posicione o rato em decúbito dorsal em uma almofada cirúrgica aquecida e prenda seus membros com cordas de borracha.
- Cubra uma folha fenestrada estéril para manter um campo estéril. Prepare a pele com solução de iodopovidona. Faça uma incisão na pele na linha média ao longo do abdômen, estendendo-se da região subxifóide até logo abaixo do umbigo, para proporcionar exposição adequada dos rins e ureteres superiores.
- Incisar os tecidos subcutâneos e a fáscia ao longo da linha média usando uma tesoura cirúrgica. Disseque a pele e os tecidos subjacentes meticulosamente, camada por camada, e exponha totalmente o espaço retroperitoneal usando uma pinça de tecido.
2. Cirurgia obstrutiva para obstrução ureteral unilateral reversível
- Retraia o intestino para o lado direito da cavidade abdominal usando um cotonete estéril para facilitar a visualização direta do ureter esquerdo. Cubra o ureter com gaze embebida em solução salina para evitar a dessecação.
- Disseque e mobilize o ureter esquerdo usando uma pinça microscópica, liberando aproximadamente 1,5 cm dos tecidos circundantes.
- Coloque um tubo de silicone de 1 cm de comprimento (diâmetro interno: 1.5 mm, diâmetro externo: 2.5 mm) abaixo do ureter liberado. Use uma pinça para garantir o invólucro completo dentro do tubo.
- Ligue o tubo de silicone e a porção média do ureter usando fio de seda 3-0 para induzir a obstrução ureteral. Evite força de ligadura excessiva. Puxe gradualmente o tubo de silicone ao longo do eixo longitudinal do ureter para garantir uma ligadura segura, mas sem deslizamento.
- Reposicione o intestino dentro da cavidade peritoneal com cuidado, garantindo o alinhamento adequado sem tensão ou obstrução.
- Suturar o músculo abdominal e as camadas fasciais usando uma sutura não absorvível 2-0 com uma agulha cortante curva de forma contínua para fornecer resistência à tração adequada. Feche a pele com uma sutura inabsorvível 4-0, garantindo alinhamento anatômico e tensão uniforme para promover a cicatrização e minimizar o risco de deiscência da ferida.
- Desinfete o local da incisão com solução de iodopovidona. Permitir que os ratos recuperem em condições controladas a uma temperatura constante durante 7 dias.
3. Cirurgia de alívio da obstrução ureteral unilateral reversível
- Preparar os animais e instrumentos necessários, garantindo uma configuração estéril para a reabertura abdominal e exposição total da cavidade abdominal.
- Disseque o nó do tubo de silicone cuidadosamente usando uma lâmina de bisturi. Remova o tubo e irrigue a cavidade abdominal com solução salina normal para minimizar a adesão e o risco de infecção.
- Reposicione o intestino e suture a incisão da parede abdominal em camadas usando suturas não absorvíveis 4-0. Esterilize o local da incisão com solução de iodopovidona. Coloque o rato em um ambiente de temperatura controlada por um período de recuperação pós-operatória de 7 dias.
- No 14º dia de pós-operatório, anestesiar os ratos (seguindo o procedimento mencionado no passo 1.2) e coletar amostras renais seccionando-se transversalmente os rins em duas metades9.
- Armazene metade em paraformaldeído a 4% para exame histopatológico e congele rapidamente a outra metade em nitrogênio líquido para armazenamento a -80 ° C para análise molecular subsequente. Colete amostras de sangue para análises bioquímicas.
- Realizar a eutanásia via asfixia por CO2 seguida de luxação cervical seguindo as diretrizes éticas.
4. Avaliações de acompanhamento
- Acompanhe o peso corporal pós-RUUO para avaliar a recuperação geral. Compare as mudanças de peso com os grupos controle e UUO.
- Meça o peso e o volume do rim para avaliar a recuperação renal.
- Monitore os níveis de creatinina sérica (Scr) como um indicador de melhora da função renal9.
- Injete azul de metileno na pelve renal para confirmar a permeabilidade ureteral. Observe o peristaltismo ureteral e a coloração para avaliar a recuperação pós-obstrução.
- Realizar coloração H&E para avaliar a integridade tubular e a estrutura renal após RUUO 8,10.
- Realizar a coloração tricrômica de Masson para avaliar a regressão da fibrose intersticial renal 8,10.
- Compare os escores de dano renal 3,8 entre os grupos UUO e RUUO para quantificar a recuperação tecidual.
Resultados
Foram avaliados os efeitos da UUO e sua subsequente liberação (RUUO) sobre o peso corporal, peso renal, volume renal e níveis séricos de creatinina (Scr), conforme resumido na Tabela 1. Os dados são apresentados como média ± desvio padrão (DP), com n = 5 por grupo.
Às 6 semanas, o grupo nativo exibiu um peso corporal médio de 234 g ± 16 g, peso renal de 0,9107 g ± 0,0475 g e volume renal de 0,8962 cm³ ± 0,0502 cm³. Às 8 semanas, o grupo controle mostrou aumentos significativos no peso corporal (291 g ± 20 g, P < 0,05), peso renal (1,1443 g ± 0,0687 g, P < 0,05) e volume renal (1,1340 cm³ ± 0,0392 cm³, P > 0,05), com um nível de Scr de 18,07 μmol/L ± 2,17 μmol/L.
O grupo UUO de 8 semanas exibiu aumento renal substancial, com peso renal (2,5535 g ± 0,2587 g, P < 0,01) e volume renal (2,8533 cm³ ± 0,3870 cm³, P < 0,01) significativamente aumentados. O peso corporal foi ligeiramente menor do que no grupo controle (280 g ± 17 g, P < 0,05), e os níveis de Scr também aumentaram (20,02 μmol/L ± 1,36 μmol/L, P < 0,05), indicando comprometimento da função renal.
No grupo RUUO de 8 semanas, o peso renal (1,5178 g ± 0,1305 g, P < 0,05) e o volume renal (1,6183 cm³ ± 0,0906 cm³, P < 0,05) foram menores do que no grupo UUO, mas permaneceram elevados em comparação com o grupo controle, com uma significância notável observada apenas no volume renal (P < 0,05). Os níveis de Scr (16,42 μmol/L ± 4,03 μmol/L, P < 0,05) foram reduzidos em comparação com o grupo UUO, mas não retornaram totalmente à linha de base. O peso corporal (288 g ± 12 g, P > 0,05) foi maior do que no grupo UUO, mas permaneceu ligeiramente menor do que no grupo controle.
A morfologia dos rins e da pelve renal sofreu alterações significativas após a obstrução ureteral. Acima do local da obstrução, os ureteres e a pelve renal exibiam dilatação acentuada, com aumento renal e notável afinamento do córtex renal e medula. Após a recanalização da obstrução ureteral, a dilatação dos ureteres e da pelve renal foi substancialmente reduzida, embora tenha sido observada leve dilatação residual (Figura 1).
Para avaliar a permeabilidade ureteral, 0,1 mL de azul de metileno foi injetado na pelve renal usando uma agulha de insulina (0,33 mm × 12,7 mm). A obstrução completa foi confirmada quando o corante não conseguiu atravessar o bloqueio ureteral. Os resultados da injeção de azul de metileno na pelve renal e ureteres de ratos com RUUO antes da remoção da obstrução são mostrados na Figura 2A. Após a retirada do tubo de silicone, o ureter no local da ligadura exibiu uma cor avermelhada (Figura 2B) e demonstrou peristaltismo normal, sugerindo que essa técnica resultou em danos ureterais mínimos.
A análise histológica do rim normal revelou túbulos densos e saudáveis ao redor dos glomérulos (Figura 3, à esquerda). Quatorze dias após a UUO, o epitélio do túbulo proximal exibiu vacuolização e degeneração, perda das bordas em escova e esfoliação. Células necróticas foram observadas dentro dos lúmens. Os túbulos distais pareciam dilatados, alguns túbulos estavam ausentes e os ductos coletores estavam distendidos, levando ao afinamento do córtex renal (Figura 3).
A coloração tricrômica de Masson foi utilizada para avaliar a fibrose intersticial renal, com fibras colágenas coradas de azul indicando alterações fibróticas12. Este método diferencia efetivamente células, fibras de colágeno e outros componentes do tecido. No modelo UUO, após 14 dias, observou-se um aumento substancial das fibras colágenas no interstício renal, indicando fibrose intersticial pronunciada (Figura 4). Em contraste, o modelo RUUO demonstrou uma redução notável nas fibras de colágeno, sugerindo que a fibrose foi atenuada ou retardada.
De acordo com o escore de dano renal (Figura 5), o grupo UUO apresentou lesão renal grave, enquanto o grupo RUUO demonstrou lesão renal moderada. Conforme ilustrado na Figura 5, o escore de dano renal foi significativamente maior no grupo UUO em comparação com o grupo nativo (P < 0,0001). O grupo RUUO apresentou um escore de lesão renal significativamente menor em comparação com o grupo UUO (P < 0,05); no entanto, o escore permaneceu significativamente elevado em comparação com o grupo nativo (P < 0,001). No geral, a lesão renal no grupo RUUO foi significativamente aliviada em comparação com o grupo UUO (P < 0,05).

Figura 1: Histologia representativa dos rins nativos, UUO (14 dias) e RUUO. Em comparação com o rim nativo, 14 dias de UUO resultaram em um aumento notável no volume renal, caracterizado por dilatação acentuada da pelve renal e ureter proximal, juntamente com uma diminuição no córtex renal e na espessura da medula. Em contraste, o volume renal no grupo RUUO (painel direito) foi significativamente reduzido em comparação com o grupo UUO (painel médio), com constrição distinta da pelve renal e do ureter. Clique aqui para ver uma versão maior desta figura.

Figura 2: Visualização do ureter com injeção de azul de metileno e após a retirada do tubo de silicone. (A) No7º dia de RUUO, após a injeção de azul de metileno na pelve renal, observou-se coloração no ureter acima do tubo de silicone, enquanto a porção abaixo do local da ligadura permaneceu sem coloração. (B) O ureter parece avermelhado após a remoção do tubo de silicone. Clique aqui para ver uma versão maior desta figura.

Figura 3: Histologia representativa dos rins nativos, UUO e RUUO. O rim UUO exibe perda da borda em escova nos túbulos proximais, dilatação significativa do lúmen tubular, degeneração, esfoliação e desintegração das células epiteliais tubulares, bem como exposição da membrana basal, indicativa de lesão tubular aguda pronunciada. O número de túbulos renais dilatados no rim RUUO é notavelmente menor do que no rim UUO, fornecendo evidências de recuperação tubular parcial. Painéis superiores: Barra de escala = 100 μm; painéis inferiores (inserção): Barra de escala = 16 μm. Clique aqui para ver uma versão maior desta figura.
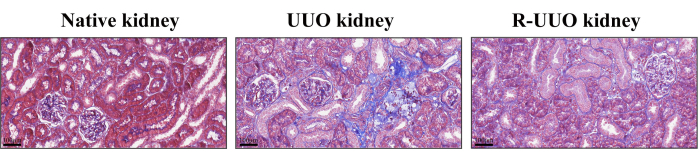
Figura 4: Coloração tricrômica de Masson dos rins nativos, UUO e RUUO. Áreas manchadas de azul indicam fibras de colágeno. O rim UUO exibiu uma maior densidade de fibras colágenas em comparação com o rim nativo. Em contraste, o rim RUUO mostrou uma redução significativa na densidade das fibras colágenas em comparação com o rim UUO, indicando um alívio da fibrose intersticial. Painéis superiores: Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Escores de danos tubulares em rins nativos, UUO e RUUO. Com base na coloração de hematoxilina e eosina (HE), as alterações histológicas no tecido renal foram pontuadas usando uma escala semiquantitativa para necrose tubular: 0 = rim normal, 1 = necrose mínima (≤5% de envolvimento), 2 = necrose leve (5%-25% de envolvimento), 3 = necrose moderada (25%-50% de envolvimento), 4 = necrose grave (50%-75% de envolvimento) e 5 = necrose mais grave (>75% de envolvimento). O eixo y representa os escores de lesão renal, enquanto o eixo x representa os grupos experimentais. Em comparação com o grupo nativo, o grupo UUO exibiu um escore de lesão renal significativamente maior (P < 0,0001). Em contraste, o grupo RUUO teve um escore de lesão renal significativamente menor em comparação com o grupo UUO (P < 0,05). No entanto, quando comparado ao grupo nativo, o grupo RUUO ainda apresentou um escore de lesão renal significativamente elevado (P < 0,001). No geral, o grupo UUO demonstrou lesão renal grave, enquanto o grupo RUUO exibiu lesão renal moderada. A lesão renal no grupo RUUO foi significativamente aliviada em comparação com o grupo UUO (P < 0,05). A significância estatística é indicada da seguinte forma: *P < 0,05, ***P < 0,001 e ****P < 0,0001. Clique aqui para ver uma versão maior desta figura.
| Grupo | Peso corporal (g) | Peso do rim (g) | Volume do rim (cm³) | Creatinina sérica (μmol/L) |
| Nativo (6 semanas) | 234 ± 16A | 0,91 ± 0,05A | 0,90 ± 0,05A | N/A* |
| Controle (8 semanas) | 291 ± 20*b | 1,14 ± 0,07*b | 1,13 ± 0,04A | 18.07 ± 2.17*b |
| UUO (8 semanas) | 280 ± 17*c | 2,55 ± 0,26**c | 2,85 ± 0,39**c | 20,02 ± 1,36*c |
| RUUO (8 semanas) | 288 ± 12*b | 1,52 ± 0,13*b | 1,62 ± 0,09**b | 16.42 ± 4.03A |
Tabela 1: Peso corporal, peso renal, volume renal e creatinina sérica nos diferentes grupos. Os dados são apresentados como média ± desvio padrão (DP), com n = 5 por grupo. Os nomes dos grupos indicam a idade dos ratos no momento da medição e o modelo de doença correspondente. As comparações estatísticas foram realizadas por meio do teste de Kruskal-Wallis, seguido do teste de comparações múltiplas de Dunn. Diferentes letras sobrescritas (a, b, c) denotam diferenças estatisticamente significativas entre os grupos (P < 0,05), onde os grupos que compartilham a mesma letra não são significativamente diferentes, enquanto os grupos com letras diferentes indicam diferenças significativas. Para comparações diretas com o grupo controle (exceto para creatinina sérica), a significância estatística é indicada como P < 0,05 por (*) e P < 0,01 por (**). *N/A: A creatinina sérica não foi medida no grupo nativo (6 semanas de idade). Em comparação com o grupo nativo, o grupo controle exibiu aumentos significativos no peso corporal e no peso renal (P < 0,05), indicando crescimento e desenvolvimento notáveis em ratos de 8 semanas de idade e seus rins. O volume renal também aumentou no grupo controle, embora a diferença não tenha sido estatisticamente significativa (P > 0,05). Em comparação com o grupo controle, o grupo UUO apresentou redução estatisticamente significativa no peso corporal (P < 0,05), enquanto o peso e o volume renal aumentaram significativamente (P < 0,01). O nível de creatinina sérica também aumentou significativamente no grupo UUO (P < 0,05). Em comparação com o grupo UUO, o grupo RUUO demonstrou um aumento estatisticamente significativo no peso corporal (P < 0,05) e reduções significativas no peso renal, volume renal e nível de creatinina sérica (P < 0,05), com uma diminuição na creatinina sérica sendo particularmente notável. Em comparação com o grupo controle, o grupo RUUO apresentou aumento significativo no volume renal (P < 0,01) e redução significativa no nível de creatinina sérica (P < 0,05), enquanto as diferenças no peso corporal e no peso renal não foram significativas. No geral, o grupo UUO apresentou aumento do peso renal, volume renal e nível de creatinina sérica em comparação com o grupo controle, enquanto o grupo RUUO apresentou recuperação nesses parâmetros, com todas as diferenças sendo estatisticamente significativas (P < 0,05).
Discussão
Este modelo emprega um tubo de silicone para circundar o ureter, fornecendo suporte estrutural, seguido de ligadura com um fio de seda para induzir a obstrução ureteral completa por compressão. Após sete dias, a ligadura e o tubo de silicone são removidos para facilitar a descompressão renal e a restauração da integridade e funcionalidade do trato urinário.
Os tubos de silicone, fabricados a partir de elastômeros de silicone, oferecem excelente flexibilidade, biocompatibilidade, resistência química e estabilidade térmica. A borracha de silicone de grau médico é projetada especificamente para aplicações que exigem propriedades mecânicas superiores, incluindo implantação de longo prazo, enquanto a tubulação de silicone geral abrange uma variedade de variantes disponíveis comercialmente que podem diferir em perfis de elasticidade, dureza e biocompatibilidade13. Dada a curta duração experimental (7-14 dias) e a ausência de estresse mecânico sustentado neste estudo, o tubo de silicone foi selecionado para estabelecer os modelos de obstrução ureteral de ratos devido à sua biocompatibilidade adequada, elasticidade adequada e custo-efetividade. Portanto, ambos os materiais exibem equivalência funcional e podem ser usados de forma intercambiável neste estudo.
A duração da obstrução é um fator crítico na recuperação renal do RUUO, com estudos indicando que o dano renal pode ser parcialmente atenuado se a obstrução for aliviada no sétimo dia, enquanto nenhuma recuperação significativa é observada além do dia 147. A duração ideal da obstrução ureteral no modelo RUUO foi determinada em sete dias para evitar danos excessivos e garantir que os resultados não fossem indevidamente influenciados pela obstrução prolongada. Comparando os rins submetidos a 14 dias de obstrução com aqueles aliviados após sete dias, a progressão da nefropatia obstrutiva nos modelos RUUO e UUO foi examinada visualmente. Azul de metileno foi injetado na pelve renal para confirmar a obstrução ureteral completa antes da remoção do cateter. O7º dia de obstrução foi selecionado para o teste em vez do primeiro dia devido à dilatação acentuada da pelve renal nesse momento, o que facilitou a inserção da agulha e reduziu o risco de danos ureterais pelo uso da agulha de insulina no dia 1.
O método para aliviar a obstrução é direto, eficaz e projetado para minimizar possíveis lesões ureterais. Este modelo garante a obstrução completa, melhorando a taxa de sucesso da recanalização e reduzindo a probabilidade de dano ureteral. O modelo RUUO é caracterizado por sua simplicidade, reprodutibilidade e facilidade de implementação, tornando-se uma ferramenta valiosa para o estudo da fibrose renal, regeneração renal e mecanismos associados 14,15,16.
Com base no modelo UUO, o modelo RUUO aborda as limitações irreversíveis de seu antecessor. Ao integrar a progressão patológica da fibrose intersticial renal induzida por UUO com a recuperação subsequente após o alívio da obstrução, o modelo RUUO replica a fase de recuperação da lesão renal aguda (LRA) e da fibrose renal. Este modelo facilita a simulação de processos de tratamento renal clinicamente obstruídos e fornece uma exploração mais abrangente da regeneração celular e remodelação da matriz extracelular (MEC) em comparação com o modelo UUO tradicional.
Estudar UUO em humanos oferece informações valiosas sobre os mecanismos de lesão renal, fibrose e possíveis intervenções terapêuticas. A UUO é amplamente utilizada para mimetizar a nefropatia obstrutiva causada por condições como obstrução da junção ureteropélvica (UPJO), cálculos renais ou tumores2. A fibrose renal, caracterizada pela deposição excessiva de MEC, é uma marca registrada da doença renal crônica, e os modelos UUO são fundamentais para estudar o papel da MEC na progressão da fibrose. Este modelo replica de forma confiável o processo de lesão renal, particularmente o desenvolvimento de fibrose, fornecendo uma base para investigar os mecanismos subjacentes à fibrose renal.
Pesquisas indicam que o alívio da obstrução pode restaurar e preservar parcialmente a hemodinâmica e a função renal, ao mesmo tempo em que mitiga a progressão da fibrose até certo ponto17. Isso tem implicações significativas para o reparo da lesão renal. No entanto, o alívio tardio da obstrução geralmente resulta em má recuperação e maior deterioração renal, potencialmente levando à insuficiência renal18. Além disso, a UUO tem sido associada à hipertensão, com intervenção tardia correlacionada a uma maior incidência e gravidade dessa condição. Esses achados ressaltam a importância crítica da intervenção precoce na minimização do dano renal e no controle da pressão arterial. O alívio tardio não apenas exacerba a fibrose e o declínio da função renal, mas também aumenta o risco de hipertensão.
Nesse contexto, o modelo RUUO serve como uma ferramenta valiosa para investigar a natureza dinâmica do dano renal e da recuperação. Estudos utilizando o modelo RUUO demonstram que, embora a desobstrução ureteral possa mitigar alguma lesão, a fibrose persistente e os danos a longo prazo permanecem, como observado em modelos animais e clínicos19. O modelo RUUO é, portanto, essencial para entender como a intervenção precoce pode ajudar a limitar o dano renal irreversível e retardar a progressão para doença renal crônica e complicações associadas, como hipertensão.
Vários pesquisadores propuseram diferentes modelos de RUUO 10,14,20,21,22,23. No entanto, muitos modelos de recanalização existentes têm limitações, incluindo procedimentos cirúrgicos complexos, altos requisitos de habilidade técnica e resultados inconsistentes. Por exemplo, Ulm22 descreveu o método de incorporação do psoas ureteral, que facilita a recanalização bem-sucedida e é relativamente simples de executar. No entanto, sua eficácia pode ser influenciada por fatores como postura do animal, movimento e variações na tensão muscular do psoas. Park et al.23 empregaram um clipe microvascular não invasivo para induzir obstrução por 10 dias, seguido de remoção do clipe usando a mesma abordagem cirúrgica. Embora esse método ofereça vantagens como biocompatibilidade, facilidade de operação, duração mínima do procedimento e reprodutibilidade, ele pode levar a aderências intestinais e menor taxa de sucesso na recanalização ureteral.
O uso de um tubo de silicone oferece uma alternativa eficaz, pois sua maciez e biocompatibilidade permitem a obstrução ureteral sem danificar os tecidos circundantes. Essa abordagem minimiza a lesão tecidual e as respostas inflamatórias, permitindo o alívio da obstrução sem danos ureterais permanentes. Consequentemente, o modelo RUUO permanece reversível, estável e adequado para estudos de longo prazo.
O método de reimplante vesicoureteral empregado por Hesketh et al.10 é adequado para estudar alterações fisiopatológicas após o reimplante vesicoureteral. No entanto, esta técnica envolve um procedimento cirúrgico complexo com um tempo de operação prolongado e riscos de ruptura e descolamento ureteral devido à tensão excessiva. Além disso, o ureter encurtado pode não se anastomosar com sucesso com o trígono da bexiga, levando a uma reconexão anormal e possível falha cirúrgica. Esses desafios limitam sua aplicabilidade, principalmente em modelos de pequenos animais.
Yao et al.16 introduziram uma técnica de pinçamento ureteral com tubo de polietileno dobrado, que reduz o dano ureteral e proporciona oclusão estável. No entanto, a superfície lisa do tubo de polietileno pode resultar em deslizamento da ligadura devido ao peristaltismo e movimento do animal, podendo causar obstrução. Chevalier et al.9 inseriram um tubo de silicone no ureter esquerdo de camundongos neonatais, que foi removido após cinco dias de pinçamento vascular. Embora esse modelo induza efetivamente a obstrução, o uso da ligadura com fio de seda como alternativa aos clipes vasculares produziu resultados comparáveis, incluindo reduções significativas no volume renal e da pelve renal. Além disso, esse método causou respostas inflamatórias e fibróticas mínimas ao redor do ureter. Embora tenha sido observada dilatação ureteral leve sete dias após o alívio da obstrução, ela foi consideravelmente menos grave do que a observada com o reimplante vesicoureteral10. Essa abordagem também previne o refluxo vesicoureteral, tornando-se uma alternativa viável para o estudo do RUUO.
Uma consideração importante nessa abordagem é minimizar o dano ureteral durante a cirurgia, pois a lesão ureteral pode induzir inflamação, potencialmente levando à adesão, fechamento e falha na recanalização. O reimplante vesicoureteral apresenta riscos como dano ureteral direto, inflamação da anastomose e possível fechamento devido a erros cirúrgicos. Além disso, a drenagem inadequada do sedimento urinário antes do reimplante pode contribuir para a falha da recanalização. O uso de um tubo de silicone para envolver o ureter externamente fornece proteção, enquanto a ligadura com um clipe vascular ou fio de seda através do tubo de silicone induz a obstrução ureteral. No entanto, os grampos vasculares podem aumentar o risco de aderências intestinais e diminuir as taxas de sucesso da recanalização. Embora o reposicionamento da pinça a cada dois dias durante a obstrução ureteral tenha sido relatado para melhorar as taxas de sucesso da recanalização em 70%17, esse método prolonga significativamente o tempo do procedimento e apresenta desafios técnicos. Por outro lado, a ligadura com fio de seda através de um tubo de silicone oferece uma abordagem mais simples com inflamação reduzida. A principal preocupação continua sendo se a ligadura com fio de seda garante obstrução completa e uniformidade entre os sujeitos experimentais.
Neste estudo, o azul de metileno foi injetado no ureter para confirmar a obstrução completa. No grupo UUO, todos os ratos obtiveram obstrução bem-sucedida (taxa de sucesso de 100%), sem mortalidade observada em condições padrão. No grupo RUUO (n = 12), seis ratos foram excluídos da análise devido a complicações: um morreu no intraoperatório de depressão respiratória induzida por anestesia, dois sucumbiram a complicações pós-operatórias (suspeita de sangramento ou infecção) nos dias 6 e 13, dois tiveram obstrução incompleta e um apresentou falha na recanalização devido a complicações cirúrgicas. Consequentemente, a taxa de sobrevida para o grupo RUUO foi de 75% (IC 95%: 46,77%-91,11%), a taxa de sucesso da obstrução completa foi de 80% (IC 95%: 49,0%-94,3%) e a taxa de sucesso da recanalização foi de 90% (IC 95%: 59,6%-98,2%). Todas as proporções foram calculadas usando os respectivos denominadores após as exclusões, e os intervalos de confiança de 95% foram determinados usando o método do escore de Wilson.
A recuperação refere-se à restauração da função fisiológica após alterações patológicas ou comprometimento funcional. Inclui não apenas a reversão de alterações patológicas, mas também o retorno da função do órgão a níveis quase normais. Em contraste, a preservação refere-se a intervenções iniciadas antes ou no início do processo da doença para evitar mais deterioração, em vez de reverter totalmente os danos existentes24. A diferenciação entre recuperação e preservação requer avaliações abrangentes da função renal basal, juntamente com o monitoramento dinâmico da progressão da doença e da resolução da obstrução. Este estudo foi limitado a observações de curto prazo e não incorporou o monitoramento sistemático de marcadores patológicos durante a recuperação. Especificamente, in vivo, biomarcadores longitudinais não foram usados para rastrear a verdadeira reversão de mecanismos patológicos. Embora tenham sido observadas melhorias no tecido renal e na função renal, ainda não está claro se essas alterações representam reversão patológica completa. Estudos futuros devem incluir biomarcadores de fibrose e mediadores inflamatórios para avaliar a resolução da doença de forma dinâmica.
Além disso, devido a limitações nos equipamentos e técnicas experimentais, este estudo não mediu proteinúria e albuminúria, parâmetros bem estabelecidos como indicadores de fisiopatologia renal24. Sua ausência pode limitar comparações diretas com modelos clássicos de doença renal. Pesquisas futuras devem incorporar análises padronizadas de proteínas urinárias juntamente com medições de creatinina sérica e nitrogênio ureico no sangue para fornecer uma avaliação mais abrangente da função renal e danos.
O alívio cirúrgico da obstrução é uma estratégia clínica primária para o tratamento das doenças renais obstrutivas25. Embora este estudo não estabeleça totalmente a reversão completa dos mecanismos patológicos renais, ele fornece um modelo de pesquisa valioso para investigar alterações patológicas e fisiológicas após a liberação da obstrução ureteral. Também permite avaliar se a função renal está totalmente restaurada ou apenas parcialmente preservada.
Em resumo, este modelo é aplicável a ratos de diferentes idades, embora sejam necessários cuidados especiais para ratos neonatais submetidos a RUUO, incluindo a seleção adequada de tubos de silicone e prevenção de danos ureterais. A ligadura excessiva deve ser evitada para evitar falha na recanalização. O modelo demonstra eficácia de recanalização comparável, embora seja simples, estável e viável, tornando-o adequado para estudar processos inflamatórios e imunológicos, regeneração renal e mecanismos relacionados, com potencial significativo para pesquisas futuras.
Divulgações
Nenhum.
Agradecimentos
Este trabalho foi apoiado pelo Programa de Inovação Juvenil em Medicina do Futuro, Universidade Médica de Chongqing (W0056), Projeto Conjunto de Inovação Tecnológica e Desenvolvimento de Aplicativos da MTC de Ciência e Saúde de Chongqing (2020ZY023877).
Materiais
| Name | Company | Catalog Number | Comments |
| Forceps | Shanghai Medical Devices Co.,Ltd | 20220032 | |
| Gauze | Sichuan Kelun Co., Ltd | 20172140152 | |
| Hematoxylin and Eosin Stain Kit | Solarbio | G1120 | |
| Insulin needles | KDL Medical Devices | 20193140938 | |
| Masson’s Trichrome Stain Kit | Solarbio | G1340 | |
| Medical Cotton balls | Sichuan Kelun Co., Ltd | 20170037 | |
| Medical Cotton sticks | Sichuan Kelun Co., Ltd | 20172140026 | |
| Methylene blue | Tianjin Dengfeng Chemical Reagent Factory | 14038-43-8 | |
| Microscopic forceps | Suqian Shifeng Medical Devices Co., Ltd | S50985 | |
| Needle holders | Suqian Shifeng Medical Devices Co., Ltd | S7005 | |
| Povidone-iodine Solution | Sichuan Kelun Co., Ltd | 514001 | |
| Saline | Sichuan Kelun Co., Ltd | 20220004 | |
| SD Rats | SPF(Beijing)Biotechnology Co.,Ltd | D025 | |
| Silicone tubing | Taizhou Chunshi New Materials Co., Ltd | CS356 | |
| Silk suture | Qiangsheng Medical Devices Co.,Ltd | SA84G | |
| Surgical blade | Huanan Yunyue Medical Devices Co.,Ltd | CE0434 | |
| Surgical scissors | Shanghai Medical Devices Co.,Ltd | J21130 | |
| Syringe | Tongmai medical devices | 20183140304 | |
| Tissue Forceps | Jiangxi Yuyuan Medical Equipment Co., Ltd | J36030 |
Referências
- Chaves, L. D., et al. Contrasting effects of systemic monocyte/macrophage and CD4+ t cell depletion in a reversible ureteral obstruction mouse model of chronic kidney disease. Clin Dev Immunol. 2013, 836989(2013).
- Chevalier, R. L., Forbes, M. S., Thornhill, B. A. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney Int. 75 (11), 1145-1152 (2009).
- Aranda-Rivera, A. K., et al. Sulforaphane protects from kidney damage during the release of unilateral ureteral obstruction (RUUO) by activating nuclear factor erythroid 2-related factor 2 (nrf2): Role of antioxidant, anti-inflammatory, and antiapoptotic mechanisms. Free Radic Biol Med. 212, 49-64 (2024).
- Narváez Barros, A., et al. Reversal unilateral ureteral obstruction: A mice experimental model. Nephron. 142 (2), 125-134 (2019).
- Cochrane, A. L., et al. Renal structural and functional repair in a mouse model of reversal of ureteral obstruction. J Am Soc Nephrol. 16 (12), 3623-3630 (2005).
- Kaeidi, A., et al. The therapeutic approaches of renal recovery after relief of the unilateral ureteral obstruction: A comprehensive review. Iran J Basic Med Sci. 23 (11), 1367-1373 (2020).
- Liu, Y., et al. A porcine model of relief of unilateral ureteral obstruction: Study on self-repairing capability over multiple time points. Mol Cell Biochem. 419 (1-2), 115-123 (2016).
- Puri, T. S., et al. Chronic kidney disease induced in mice by reversible unilateral ureteral obstruction is dependent on genetic background. Am J Physiol Renal Physiol. 298 (4), F1024-F1032 (2010).
- Chevalier, R. L., Kim, A., Thornhill, B. A., Wolstenholme, J. T. Recovery following relief of unilateral ureteral obstruction in the neonatal rat. Kidney Int. 55 (3), 793-807 (1999).
- Hesketh, E. E., et al. A murine model of irreversible and reversible unilateral ureteric obstruction. J Vis Exp. (94), e52559(2014).
- Klahr, S., Morrissey, J. Obstructive nephropathy and renal fibrosis. Am J Physiol Renal Physiol. 283 (5), F861-F875 (2002).
- Jin, B., et al. Loss of men1 leads to renal fibrosis and decreases HGF-ADAMTS5 pathway activity via an epigenetic mechanism. Clin Transl Med. 12 (8), e982(2022).
- Fischer, N. G., He, J., Aparicio, C. Surface immobilization chemistry of a laminin-derived peptide affects keratinocyte activity. Coatings (Basel). 10 (6), 560(2020).
- Song, J., et al. Losartan accelerates the repair process of renal fibrosis in UUO mouse after the surgical recanalization by upregulating the expression of tregs. Int Urol Nephrol. 51 (11), 2073-2081 (2019).
- Song, J., et al. Regulatory t cells accelerate the repair process of renal fibrosis by regulating mononuclear macrophages. Am J Med Sci. 361 (6), 776-785 (2021).
- Yao, Y., et al. Interferon-γ improves renal interstitial fibrosis and decreases intrarenal vascular resistance of hydronephrosis in an animal model. Urology. 77 (3), e768-e761.e713 (2011).
- Chevalier, R. L., Thornhill, B. A., Chang, A. Y., Cachat, F., Lackey, A. Recovery from release of ureteral obstruction in the rat: Relationship to nephrogenesis. Kidney Int. 61 (6), 2033-2043 (2002).
- Lucarelli, G., et al. Delayed relief of ureteral obstruction is implicated in the long-term development of renal damage and arterial hypertension in patients with unilateral ureteral injury. J Urol. 189 (3), 960-965 (2013).
- Ito, K., et al. Renal damage progresses despite improvement of renal function after relief of unilateral ureteral obstruction in adult rats. Am J Physiol Renal Physiol. 287 (6), F1283-F1293 (2004).
- Song, J., et al. A modified relief of unilateral ureteral obstruction model. Ren Fail. 41 (1), 497-506 (2019).
- Morrissey, J., et al. morphogenetic protein-7 improves renal fibrosis and accelerates the return of renal function. J Am Soc Nephrol. 13 (suppl_1), S14-S21 (2002).
- Ulm, A. H., Miller, F. An operation to produce experimental reversible hydronephrosis in dogs. J Urol. 88, 337-341 (1962).
- Park, H. C., et al. Postobstructive regeneration of kidney is derailed when surge in renal stem cells during course of unilateral ureteral obstruction is halted. Am J Physiol Renal Physiol. 298 (2), F357-F364 (2010).
- Forni, L. G., et al. Renal recovery after acute kidney injury. Intensive Care Med. 43 (6), 855-866 (2017).
- Varela, S., Omling, E., Borjesson, A., Salo, M. Resolution of hydronephrosis after pyeloplasty in children. J Pediatr Urol. 17 (1), e101-e102.e7 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados