Method Article
可逆的片側尿管閉塞の未熟マウスモデル
要約
本プロトコルは、単行尿管閉塞の段階的な再現可能なモデルを記述しています。
要約
片側性尿管閉塞(UUO)は、慢性腎臓病(CKD)の一般的な原因であり、腎間質性線維症の進行につながり、最終的には不可逆的な腎障害を引き起こします。UUOの軽減は非常に重要です。可逆的片側尿管閉塞(RUUO)のいくつかの動物モデルが文献で確立されており、構造変化と機能損傷の観察を可能にし、尿管閉塞の緩和後の生理学的および病態生理学的変化をシミュレートします。本研究では、シリコンチューブを用いて片側マウス尿管に可逆的閉塞モデルを確立した。閉塞の軽減前に重大な腎障害が観察され、その後に部分的な回復が認められました。UUOとは異なり、このモデルは進行性の水腎症を予防し、明確な病理学的結果をもたらします。この簡単な外科的処置は高い成功率を示しており、可逆性閉塞性腎症および腎間質性線維症の潜在的な治療法を調査するための古典的なモデルとして有望です。さらに、閉塞性腎症からの回復、腎細胞再生、および組織リモデリングのメカニズムを研究するための実用的なプラットフォームを提供します。
概要
尿道閉塞は、腎間質性線維症や慢性腎臓病(CKD)の大きな原因となり、腎臓に不可逆的な構造的損傷や機能障害をもたらす可能性があります1。片側尿管閉塞(UUO)は、腎障害やCKDの研究に広く使用されていますが、閉塞の除去後に発生する自然回復メカニズムを正確に再現するものではありません。UUOモデルでは、左尿管を縫合糸で結紮し、永久閉塞、尿管拡張、水腎症、腎実質の圧迫、皮質の菲薄化を引き起こします。組織学的検査では、通常、尿細管拡張、尿細管上皮細胞壊死、進行性間質性炎症および線維症が明らかになります2。このモデルは、主に腎間質性線維症と持続的な閉塞による不可逆的な腎機能喪失を調査します。
しかし、尿管結石や腫瘍による閉塞など、臨床診療で遭遇する多くの腎疾患は可逆的です。可逆的片側尿管閉塞(RUUO)モデルは、腎臓の構造と尿路機能の部分的な回復を可能にし、最終的に水腎症を解消します。回復は、画像技術、組織学的検査、およびバイオマーカー分析を通じて評価でき、腎障害と線維症の減少を定量化できます3。このモデルは、臨床現場での閉塞性腎症の回復段階を厳密に模倣しており、炎症、免疫応答、細胞再生、組織リモデリングなどの主要なプロセスを研究するためにUUOよりも適しています4,5,6,7,8。
RUUOモデルにより、研究者は損傷緩和後の腎臓の修復と再生を解析し、動的研究におけるUUOの限界に対処することができます。閉塞の前後の異なる時点を比較することで、研究者は炎症、アポトーシス、線維症、再生など、損傷と修復に関与する分子経路を調査できます。このアプローチにより、腎回復メカニズムの理解が深まり、潜在的な治療標的が特定されます 2,3,4,5,8,9,10。腎線維症はしばしば不可逆的であると考えられていますが、臨床観察は、初期の線維化段階での閉塞の早期緩和が疾患の進行を止めるか、さらには逆転させる可能性があることを示唆しています。RUUOモデルは、この現象を調査するための貴重な実験プラットフォームを提供します11。
さらに、RUUOモデルは、閉塞緩和後の線維症の逆転の研究を容易にし、回復メカニズムと潜在的な抗線維化療法に関する洞察を提供します3,4。したがって、このモデルはトランスレーショナルリサーチに非常に実用的です。この実験モデルの主な目的は、尿管カニューレ挿入を通じて閉塞性腎症を誘発し、その後、一貫性を確保するために事前定義された時点で標準化された緩和を行うことです。シンプルさ、再現性、安全性が最適化されているため、実験研究に有効なツールとなっています。
プロトコル
この動物実験は、ヘルシンキ宣言のガイドラインに準拠し、重慶医科大学小児病院の研究倫理委員会によって承認されました。合計27匹の雄のSprague Dawley(SD)ラットが商業的に入手され、重慶医科大学小児病院実験動物センター(SPF、ライセンス番号:SYXK(重慶)2007-0016)に収容されました。ラットは、12時間の明暗サイクルで制御された温度条件下で維持され、食物と水に 自由 にアクセスできました。
このプロトコルは、6〜8週齢の雄SDラットで実施され、両側尿管を持つすべての年齢のラットに適用できます。本研究では、6週齢の雄SDラット15匹を、ネイティブグループ(n = 5)、UUOグループ(n = 5)、RUUOグループ(n = 5)の3つのグループにランダムに割り当てた。さらに、5匹の8週齢のSDラット(n = 5)を追加の対照群として含めました。RUUO モデルを確立するために、12 匹のラットを使用し、術中および術後の死亡率、外科的失敗、不完全な閉塞、失敗した逆転などの潜在的なリスクを考慮して、さらに 7 匹のラットを調達しました。これにより、その後の分析のために、グループごとに最低5匹のラットが確保されました。
すべての外科的処置は、実験動物の世話と使用に関する施設および国のガイドラインに厳密に従って行われました。外科スタッフは、サージカルマスク、手袋、ガウンなどの個人用保護具(PPE)プロトコルを順守しました。各処置には滅菌手術器具を使用し、使用前と使用後にオートクレーブ滅菌して無菌性を維持しました。鋭利物や生体試料などの廃棄物は、汚染リスクを軽減し、安全性を確保するために、有害廃棄物管理プロトコルに準拠して処分されました。
1. 動物と器具の準備
- すべての手順は、滅菌済み(オートクレーブ済み)の器具と消耗品を使用して行ってください。滅菌したシリコンチューブ(内径1.5mm、外径2.5mm)を約1cmのセグメントにカットします。その後の使用のために、チューブ壁の片側に沿って縦方向に切開します。
- ペントバルビタール (40 mg/kg) の腹腔内注射 により ラットに麻酔をかけます (施設で承認されたプロトコルに従います)。つま先をつまんだときに、ペダルの引きこもり反射などの反射反応がないことを確認して、適切な麻酔を確認します。麻酔中の角膜の乾燥を防ぐために、獣医用眼科用軟膏を目に塗布します。.
- ラットの腹部を剣状突起から恥骨結合まで脱毛し、正中線まで両側に伸ばします。
- ラットを加熱された手術用パッドの仰臥位に置き、ゴム製のロープで手足を固定します。
- 滅菌フィールドを維持するために、滅菌穴あきシートをドレープします。ポビドンヨード溶液で皮膚を準備します。腹部に沿って正中線の皮膚切開を行い、剣状突起下領域から臍のすぐ下まで伸びて、腎臓と上部尿管が適切に露出するようにします。
- 手術用ハサミを使用して、正中線に沿って皮下組織と筋膜を切開します。皮膚とその下にある組織を層ごとに細心の注意を払って解剖し、組織鉗子を使用して後腹膜腔を完全に露出させます。
2. 可逆性片側尿管閉塞に対する閉塞手術
- 滅菌綿棒を使用して腸を腹腔の右側に引っ込め、左尿管の直接視覚化を容易にします。尿管を生理食塩水に浸したガーゼで覆い、乾燥を防ぎます。
- 顕微鏡的鉗子を使用して左尿管を解剖し、周囲の組織から約1.5cm解放します。
- 長さ1cmのシリコンチューブ(内径1.5mm、外径2.5mm)を遊離尿管の下に置きます。鉗子を使用して、チューブ内に完全に包まれていることを確認します。
- シリコンチューブと尿管の中央部を3-0シルク糸で結紮し、尿管閉塞を誘発します。過度の結紮力を避けてください。シリコンチューブを尿管の縦軸に沿って徐々に引っ張り、しっかりと滑りにくい結紮を確保します。
- 腸を腹腔内に慎重に再配置し、張力や障害物のない適切な位置合わせを確保します。
- 2-0の非吸収性縫合糸と湾曲した切断針を連続的に使用して、腹筋層と筋膜層を縫合し、適切な引張強度を提供します。4-0の非吸収性縫合糸で皮膚を閉じ、解剖学的なアライメントと均一な張力を確保して治癒を促進し、創傷裂開のリスクを最小限に抑えます。
- 切開部位をポビドンヨード溶液で消毒します。ラットを一定の温度で7日間制御された条件下で回復させます。
3. 可逆的片側尿管閉塞の緩和手術
- 必要な動物や器具を準備し、腹部の再開と腹腔の完全な露出のための無菌状態を確保します。
- メスの刃を使用して、シリコンチューブの結び目を慎重に解剖します。チューブを取り外し、通常の生理食塩水で腹腔を洗浄して、癒着と感染のリスクを最小限に抑えます。
- 腸の位置を変え、腹壁切開部を4-0非吸収性縫合糸を使用して層状に縫合します。切開部位をポビドンヨード溶液で滅菌します。ラットを制御された温度環境に置き、術後7日間の回復期間を過ごします。
- 術後14日目に、ラットに麻酔をかけ(ステップ1.2で述べた手順に従って)、腎臓を横切開して腎臓サンプルを2つの半分9に切断して採取する。
- 半分を4%パラホルムアルデヒドで保存して病理組織学的検査を行い、残りの半分を液体窒素で急速凍結して-80°Cで保存し、その後の分子分析に役立てます。生化学分析のために血液サンプルを採取します。
- CO2 窒息による安楽死と、それに続く倫理ガイドラインに従って子宮頸部脱臼を行います。
4. フォローアップ評価
- RUUO後の体重を追跡して、全体的な回復を評価します。体重の変化を対照グループとUUOグループで比較します。
- 腎臓の体重と腎臓の体積を測定して、腎臓の回復を評価します。
- 腎機能改善の指標として血清クレアチニン(Scr)レベルをモニターします9。
- 腎盂にメチレンブルーを注入して、尿管の開存性を確認します。尿管の蠕動運動と着色を観察して、閉塞後の回復を評価します。
- H&E染色を実施して、RUUO 8,10後の尿細管の完全性と腎構造を評価します。
- Massonのトリクローム染色を実施して、腎間質性線維症の退縮を評価します8,10。
- UUOグループとRUUOグループの間で腎障害スコア3,8を比較して、組織の回復を定量化します。
結果
表1に要約されているように、UUOおよびその後の放出(RUUO)が体重、腎臓重量、腎臓容積、および血清クレアチニン(Scr)レベルに及ぼす影響を評価した。データは平均±標準偏差(SD)として表され、グループごとにn = 5です。
6週間後、ネイティブグループの平均体重は234 g±16 g、腎臓重量は0.9107 g±0.0475 g、腎臓容積は0.8962 cm³±0.0502 cm³でした。8週間までに、対照群は体重(291 g ± 20 g、 P < 0.05)、腎臓重量(1.1443 g ± 0.0687 g、 P < 0.05)、腎臓容積(1.1340 cm³ ± 0.0392 cm³、 P > 0.05)の有意な増加を示し、Scrレベルは18.07 μmol/L ± 2.17 μmol/Lでした。
8週間のUUO群では、腎臓の重量(2.5535 g±0.2587 g、 P < 0.01)と腎臓容積(2.8533 cm³ ± 0.3870 cm³、 P < 0.01)が有意に増加し、大幅な腎肥大が見られました。体重は対照群よりわずかに少なく(280g±17g、 P <0.05)、Scr値も上昇(20.02μmol/L±1.36μmol/L、 P <0.05)し、腎機能障害を示していました。
8週間のRUUO群では、腎臓重量(1.5178 g ± 0.1305 g、 P < 0.05)および腎臓容積(1.6183 cm³ ± 0.0906 cm³、 P < 0.05)はUUO群よりも低かったが、対照群と比較して高いままであり、腎臓容積(P < 0.05)でのみ顕著な有意性が観察された。SCRレベル(16.42 μmol/L ± 4.03 μmol/L、 P < 0.05)はUUO群と比較して低下しましたが、完全にベースラインに戻ることはありませんでした。体重(288 g ± 12 g、 P > 0.05)はUUO群よりも高かったが、対照群よりもわずかに低いままであった。
腎臓と腎盂の形態は、尿管閉塞後に大きな変化を遂げました。閉塞部位より上では、尿管と腎盂が顕著な拡張を示し、腎臓の肥大と腎皮質と髄質の顕著な菲薄化を伴いました。尿管閉塞の再疎通後、尿管と腎盂の拡張は大幅に減少しましたが、わずかな残留拡張が観察されました(図1)。
尿管開存性を評価するために、インスリン針(0.33 mm×12.7 mm)を使用して、0.1 mLのメチレンブルーを腎盂に注射しました。染料が尿管閉塞を横断できなかったときに、完全な閉塞が確認されました。閉塞除去前のRUUOを使用したラットの腎盂および尿管へのメチレンブルー注射の結果を図 2Aに示します。.シリコンチューブを取り外した後、結紮部位の尿管は赤みを帯びた色を示し(図2B)、正常な蠕動運動を示し、この技術が尿管の損傷を最小限に抑えたことを示唆しています。
正常な腎臓の組織学的分析により、糸球体を取り巻く密集した健康な尿細管が明らかになりました(図3、左)。UUOの14日後、近位尿細管上皮は空胞化と変性、ブラシ境界の喪失、および剥離を示しました。壊死細胞は内腔内で観察された。遠位尿細管は拡張しているように見え、一部の尿細管は欠如しており、集合管は膨張しており、腎皮質の菲薄化につながっていました(図3)。
Massonのトリクローム染色は、腎間質性線維症の評価に使用され、青色に染色されたコラーゲン線維は線維性変化を示しました12。この方法は、細胞、コラーゲン繊維、およびその他の組織成分を効果的に区別します。UUOモデルでは、14日後、腎間質でコラーゲン線維の大幅な増加が観察され、顕著な間質性線維症が示されました(図4)。対照的に、RUUOモデルではコラーゲン繊維の顕著な減少が示され、線維化が緩和または遅延したことが示唆されました。
腎障害スコア(図5)によると、UUOグループは重度の腎障害を示し、RUUOグループは中等度の腎障害を示しました。 図5に示すように、腎障害スコアは、ネイティブグループと比較してUUOグループで有意に高かった(P < 0.0001)。RUUOグループは、UUOグループと比較して腎障害スコアが有意に低かった(P < 0.05)。ただし、スコアはネイティブグループと比較して有意に高いままでした(P < 0.001)。全体として、RUUO群の腎障害はUUO群と比較して有意に軽減されました(P < 0.05)。

図1:ネイティブ、UUO(14日)、およびRUUO腎臓の代表的な組織型。 天然の腎臓と比較して、UUOの14日間は、腎盂と近位尿管の顕著な拡張を特徴とする腎臓の容積の顕著な増加をもたらし、腎皮質と髄質の厚さの減少を特徴としました。対照的に、RUUO群(右パネル)の腎臓容積は、UUOグループ(中央パネル)と比較して有意に減少し、腎盂と尿管の明確な狭窄が見られました。 この図の拡大版を表示するには、ここをクリックしてください。

図2:メチレンブルー注射による尿管の可視化とシリコーンチューブ抜去後 (A)RUUOの7日目 、腎盂へのメチレンブルー注射後、シリコンチューブの上の尿管に染色が観察されましたが、結紮部位の下の部分は染色されていませんでした。(B)シリコンチューブを取り外した後、尿管が赤みを帯びて見えます。 この図の拡大版を表示するには、ここをクリックしてください。

図3:天然腎臓、UUO、およびRUUO腎臓の代表的な組織像。 UUO腎臓は、近位尿細管のブラシ境界の喪失、著しい尿細管内腔の拡張、尿細管上皮細胞の変性、剥離、崩壊、および基底膜の曝露を示し、顕著な急性尿細管損傷を示しています。RUUO腎臓の拡張した尿細管の数は、UUO腎臓よりも著しく少なく、部分的な尿細管回復の証拠を提供しています。上部パネル:スケールバー= 100μm;下部パネル(挿入図):スケールバー= 16 μm。 この 図の拡大版を表示するには、ここをクリックしてください。
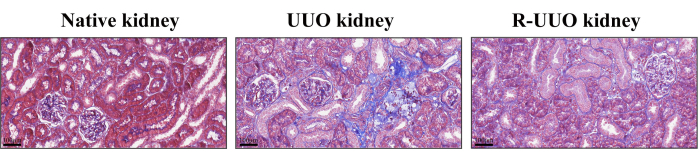
図4:Massonの天然腎臓、UUO、およびRUUO腎臓のトリクローム染色。 青色に染色された部分はコラーゲン繊維を示しています。UUO腎臓は、天然の腎臓と比較して、コラーゲン繊維の密度が高いことを示しました。一方、RUUO腎臓はUUO腎臓と比較してコラーゲン線維密度の有意な減少を示し、間質性線維症の緩和を示しました。上部パネル: スケールバー = 100 μm. この図の拡大版を表示するには、ここをクリックしてください。

図5:天然腎臓、UUO、およびRUUO腎臓の管状損傷スコア。 ヘマトキシリンおよびエオシン(HE)染色に基づき、尿細管壊死の半定量的尺度を用いて腎臓組織の組織学的変化を採点した:0 =正常な腎臓、1 =最小限の壊死(≤5%の関与)、2 =軽度の壊死(5%-25%の関与)、3 =中等度の壊死(25%-50%の関与)、4 =重度の壊死(50%-75%の関与)、および5 =最も重度の壊死(>75%の関与)。y軸は腎障害スコアを表し、x軸は実験グループを表します。ネイティブグループと比較して、UUOグループは有意に高い腎障害スコアを示しました(P < 0.0001)。対照的に、RUUOグループはUUOグループと比較して腎障害スコアが有意に低かった(P < 0.05)。ただし、ネイティブグループと比較すると、RUUOグループは依然として腎障害スコアが大幅に上昇しました(P < 0.001)。全体として、UUOグループは重度の腎障害を示し、RUUOグループは中等度の腎障害を示しました。RUUO群の腎障害は、UUO群と比較して有意に軽減されました(P < 0.05)。統計的有意性は、*P < 0.05、***P < 0.001、および****P < 0.0001として示されます。 この図の拡大版を表示するには、ここをクリックしてください。
| 群 | 体重(g) | 腎臓の重量(g) | 腎臓容積(cm³) | 血清クレアチニン (μmol/L) |
| ネイティブ (6週間) | 234 ± 16A | 0.91 ± 0.05A | 0.90 ± 0.05A | 該当なし* |
| コントロール(8週間) | 291 ± 20*b | 1.14 ± 0.07*b | 1.13 ± 0.04a | 18.07 ± 2.17*b |
| UUO (8週間) | 280 ± 17 * C | 2.55 ± 0.26°C | 2.85 ± 0.39°C | 20.02±1.36*C |
| RUUO (8週間) | 288 ± 12*b | 1.52 ± 0.13*b | 1.62 ± 0.09**b | 16.42 ± 4.03a |
表1:さまざまなグループの体重、腎臓の重量、腎臓の容積、および血清クレアチニンレベル。 データは平均±標準偏差(SD)として表され、グループごとにn = 5です。グループ名は、測定時のラットの年齢と対応する疾患モデルを示しています。統計的比較は、Kruskal-Wallis検定を使用して実行され、続いてDunnの多重比較検定が行われました。異なる上付き文字(a、b、c)は、グループ間で統計的に有意な差(P < 0.05)を示し、同じ文字を共有するグループは有意差がなく、異なる文字を持つグループは有意差を示します。対照群(血清クレアチニンを除く)との直接比較では、統計的有意性は P < 0.05 by (*)、 P < 0.01 by (**)として示されます。.*N/A:血清クレアチニンは、天然(生後6週齢)のグループでは測定されませんでした。ネイティブグループと比較して、対照グループは体重と腎臓重量の両方で有意な増加を示し(P < 0.05)、8週齢のラットとその腎臓で顕著な成長と発達を示しました。腎臓の容積も対照群で増加しましたが、その差は統計的に有意ではありませんでした(P > 0.05)。対照群と比較して、UUO群は体重の統計的に有意な減少(P < 0.05)を示し、腎臓の重量と腎臓の容積は有意に増加しました(P < 0.01)。血清クレアチニンレベルもUUO群で有意に増加しました(P < 0.05)。UUO群と比較して、RUUO群は体重の統計的に有意な増加(P < 0.05)と腎臓重量、腎臓容積、血清クレアチニン値の有意な減少(P < 0.05)を示し、特に血清クレアチニンの減少が顕著でした。対照群と比較して、RUUO群は腎臓容積の有意な増加(P < 0.01)と血清クレアチニン値の有意な減少(P < 0.05)を示したが、体重と腎臓重量の差は有意ではなかった。全体として、UUO群は対照群と比較して腎臓重量、腎容積、および血清クレアチニンレベルの増加を示し、RUUO群はこれらのパラメータで回復を示し、すべての差が統計的に有意でした(P < 0.05)。
ディスカッション
このモデルは、尿管を囲むためにシリコーンチューブを使用して構造的なサポートを提供し、その後、絹糸で結紮して圧縮によって完全な尿管閉塞を誘発します。7日後、結紮とシリコンチューブを取り外して、腎臓の減圧と尿路の完全性と機能の回復を促進します。
シリコーンエラストマーから製造されたシリコーンチューブは、優れた柔軟性、生体適合性、耐薬品性、および熱安定性を提供します。医療グレードのシリコーンゴムは、長期の埋め込みを含む優れた機械的特性を必要とする用途向けに特別に設計されていますが、一般的なシリコーンチューブには、弾力性、硬度、および生体適合性プロファイルが異なる可能性のあるさまざまな市販のバリエーションが含まれています13。この研究では、実験期間が短く(7〜14日)、持続的な機械的ストレスがないことを考慮して、ラット尿管閉塞モデルを確立するためにシリコーンチューブが選択されました。したがって、両方の材料は機能的同等性を示し、この研究では交換可能に使用できます。
閉塞の持続時間は RUUO 腎臓の回復の重要な要素であり、研究によると、閉塞が 7 日目に緩和されると腎障害を部分的に軽減できることが示されていますが、14 日目以降は有意な回復は観察されません7.RUUOモデルにおける尿管閉塞の最適な持続時間は、過度の損傷を防ぎ、結果が長期の閉塞によって過度に影響を受けないようにするために7日間であると決定されました。14日間の閉塞を受けた腎臓と7日後に解放された腎臓を比較することにより、RUUOモデルとUUOモデルにおける閉塞性腎症の進行を視覚的に調べました。メチレンブルーを腎盂に注入して、カテーテルを抜く前に完全な尿管閉塞を確認しました。閉塞の7日目 は、この時間までに腎盂が著しく拡張したため、1日目に針の挿入が容易になり、インスリン針の使用による尿管損傷のリスクが減少したため、初日ではなく検査に選択されました。
閉塞を軽減する方法は簡単で効果的であり、尿管損傷の可能性を最小限に抑えるように設計されています。このモデルは、再疎通の成功率を向上させ、尿管損傷の可能性を減らしながら、完全な閉塞を保証します。RUUOモデルは、その単純さ、再現性、および実装の容易さを特徴としており、腎線維症、腎再生、および関連するメカニズムを研究するための貴重なツールとなっています14,15,16。
UUOモデルに基づいて構築されたRUUOモデルは、その前身の不可逆的な制限に対処します。UUO誘発性腎間質性線維症の病理学的進行とその後の閉塞緩和後の回復を統合することにより、RUUOモデルは急性腎障害(AKI)と腎線維症の回復期を再現します。このモデルは、臨床的に閉塞した腎臓治療プロセスのシミュレーションを容易にし、従来のUUOモデルと比較して、細胞再生と細胞外マトリックス(ECM)リモデリングのより包括的な調査を提供します。
UUOをヒトで研究することで、腎障害、線維症、および潜在的な治療介入のメカニズムについて貴重な洞察を得ることができます。UUOは、尿路肩関節閉塞症(UPJO)、腎臓結石、腫瘍などの状態によって引き起こされる閉塞性腎症を模倣するために広く使用されています2。過剰なECM沈着を特徴とする腎線維症は、慢性腎臓病の特徴であり、UUOモデルは、線維症の進行におけるECMの役割を研究するのに役立ちます。このモデルは、腎障害のプロセス、特に線維症の発症を確実に再現し、腎線維症の根底にあるメカニズムを調査するための基盤を提供します。
研究によると、閉塞を緩和すると、腎の血行動態と機能を部分的に回復および維持し、線維症の進行をある程度軽減できることが示されています17。これは、腎障害の修復に重要な影響を及ぼします。しかし、閉塞の緩和が遅れると、回復が不十分になり、腎臓がさらに悪化することが多く、腎不全につながる可能性があります18。さらに、UUO は高血圧と関連しており、介入の遅延はこの状態の発生率と重症度が高いことと相関しています。これらの知見は、腎障害を最小限に抑え、血圧を管理するために早期介入が極めて重要であることを強調している。緩和の遅れは、線維化や腎機能の低下を悪化させるだけでなく、高血圧のリスクも高めます。
この文脈では、RUUOモデルは、腎臓の損傷と回復の動的な性質を調査するための貴重なツールとして機能します。RUUOモデルを使用した研究では、尿管閉塞の解消がある程度の損傷を軽減できる一方で、動物モデルと臨床モデルの両方で観察されるように、持続的な線維症と長期的な損傷が残ることが示されています19。したがって、RUUOモデルは、早期介入が不可逆的な腎障害を制限し、慢性腎臓病や高血圧などの関連合併症への進行を遅らせるのにどのように役立つかを理解するために不可欠です。
何人かの研究者がRUUO 10,14,20,21,22,23の異なるモデルを提案しています。しかし、既存の多くの再開通モデルには、複雑な外科的処置、高い技術的スキル要件、一貫性のない結果など、限界があります。例えば、Ulm22は、再疎通を成功させ、比較的簡単に実行できる尿管腰筋埋め込み法について説明しました。ただし、その有効性は、動物の姿勢、動き、腰筋の緊張の変化などの要因によって影響を受ける可能性があります。Parkら23は、非侵襲的な微小血管クリップを使用して10日間閉塞を誘発し、その後、同じ外科的アプローチを使用してクリップを取り外しました。この方法には、生体適合性、操作の容易さ、最小限の処置時間、再現性などの利点がありますが、腸の癒着や尿管再開通の成功率の低下につながる可能性があります。
シリコーンチューブの使用は、その柔らかさと生体適合性により、周囲の組織に損傷を与えることなく尿管閉塞を可能にするため、効果的な代替手段を提供します。このアプローチは、組織の損傷と炎症反応を最小限に抑えながら、永久的な尿管損傷なしに閉塞の緩和を可能にします。その結果、RUUOモデルは可逆的で安定しており、長期的な研究に適しています。
Hesketh et al.10 が採用している膀胱尿管再移植法は、膀胱尿管再移植後の病態生理学的変化の研究に適しています。しかし、この技術には複雑な外科的処置が含まれ、手術時間が長くなり、過度の緊張による尿管の破裂や剥離のリスクがあります。さらに、短縮された尿管は膀胱三角でうまく吻合できず、異常な再接続や外科的失敗につながる可能性があります。これらの課題は、特に小動物モデルにおいて、その適用性を制限します。
Yaoら16 は、折り畳まれたポリエチレンチューブを使用して尿管クランプを含む技術を導入し、これにより尿管の損傷を軽減し、安定した閉塞を実現します。ただし、ポリエチレンチューブの表面が滑らかなため、蠕動運動や動物の動きにより結紮糸が滑り、閉塞を引き起こす可能性があります。Chevalierら9 は、新生児マウスの左尿管にシリコンチューブを挿入し、5日間の血管クランプ後に除去しました。このモデルは効果的に閉塞を誘発しますが、血管クリップの代替として絹糸結紮を使用すると、腎臓と腎盂の体積が大幅に減少するなど、同等の結果が得られました。さらに、この方法は尿管周辺の最小限の炎症反応と線維化反応を引き起こしました。閉塞緩和の7日後に軽度の尿管拡張が観察されたが、膀胱尿管再移植術で見られたものよりもかなり重症度が低かった10。このアプローチは、膀胱尿管逆流も防ぎ、RUUOを研究するための実行可能な代替手段になります。
このアプローチで考慮すべき点は、尿管損傷が炎症を引き起こし、癒着、閉鎖、再疎通の失敗につながる可能性があるため、手術中の尿管損傷を最小限に抑えることです。膀胱尿管再移植は、直接的な尿管損傷、吻合部の炎症、手術ミスによる閉鎖の可能性などのリスクをもたらします。さらに、再移植前の尿沈渣の不適切な排水は、再開通の失敗に寄与する可能性があります。シリコンチューブを使用して尿管を外部から包み込むと保護されますが、シリコンチューブを介した血管クリップまたはシルク糸による結紮は尿管閉塞を誘発します。ただし、血管クランプは腸の癒着のリスクを高め、再開通の成功率を低下させる可能性があります。尿管閉塞時にクランプを 2 日ごとに再配置すると、再開通の成功率が 70% 向上すると報告されていますが17、この方法では手続き時間が大幅に長くなり、技術的な課題が生じます。対照的に、シリコーンチューブを介した絹糸の結紮は、炎症を軽減したより簡単なアプローチを提供します。主な関心事は、絹糸の結紮が実験対象間で完全な閉塞と均一性を確保するかどうかです。
この研究では、メチレンブルーを尿管に注入して、完全な閉塞を確認しました。UUOグループでは、すべてのラットが閉塞に成功し(成功率100%)、標準条件下では死亡率は観察されませんでした。RUUO群(n = 12)では、6匹のラットが合併症により解析から除外されました:1匹は麻酔誘発性呼吸抑制により術中に死亡し、2匹は6日目と13日目に術後合併症(出血または感染の疑い)で死亡し、2匹は不完全な閉塞を示し、1匹は外科的合併症による再開通に失敗しました。その結果、RUUO群の生存率は75%(95%CI: 46.77%-91.11%)、完全閉塞の成功率は80%(95%CI: 49.0%-94.3%)、再開通成功率は90%(95%CI: 59.6%-98.2%)であった。すべての比率は、除外後のそれぞれの分母を使用して計算し、95%信頼区間はウィルソンスコア法を使用して決定しました。
回復とは、病理学的変化または機能障害後の生理学的機能の回復を指します。これには、病理学的変化の逆転だけでなく、臓器機能の正常レベルに近い状態への復帰も含まれます。対照的に、保存とは、既存の損傷を完全に回復させるのではなく、さらなる悪化を防ぐために、疾患プロセスの前または早期に開始される介入を指す24。回復と保存を区別するには、包括的なベースラインの腎機能評価に加えて、疾患の進行と閉塞の解消の動的モニタリングが必要です。この研究は短期的な観察に限定されており、回復中の病理学的マーカーの体系的なモニタリングは組み込まれていませんでした。具体的には、 in vivoでは、縦断的バイオマーカーは、病理学的メカニズムの真の逆転を追跡するために使用されませんでした。腎臓組織と腎機能の改善が観察されましたが、これらの変化が完全な病理学的逆転を表しているかどうかは不明のままです。今後の研究では、疾患の解消を動的に評価するために、線維症バイオマーカーと炎症メディエーターを含める必要があります。
さらに、実験装置と技術の制限により、この研究では、腎病態生理学の指標として十分に確立されたパラメーターであるタンパク尿とアルブミン尿を測定しませんでした24。それらがないと、古典的な腎臓病モデルとの直接比較が制限される可能性があります。今後の研究では、標準化された尿タンパク質分析を血清クレアチニンおよび血中尿素窒素測定とともに組み込んで、腎機能と損傷をより包括的に評価する必要があります。
閉塞の外科的緩和は、閉塞性腎臓病を治療するための主要な臨床戦略である25。この研究は、腎病理学的メカニズムの完全な逆転を完全に確立するものではありませんが、尿管閉塞放出後の病理学的および生理学的変化を調査するための貴重な研究モデルを提供します。また、腎機能が完全に回復したのか、それとも部分的にしか保存されていないのかを評価することもできます。
要約すると、このモデルはさまざまな年齢のラットに適用できますが、RUUOを受ける新生児ラットには、適切なシリコンチューブの選択や尿管損傷の予防など、特別な注意が必要です。過度のライゲーションは、再開通の失敗を防ぐために避けるべきです。このモデルは、シンプルで安定しており、実現可能であると同時に、同等の再開通効果を示しているため、炎症および免疫プロセス、腎臓再生、および関連メカニズムの研究に適しており、さらなる研究に大きな可能性を秘めています。
開示事項
何一つ。
謝辞
この研究は、重慶医科大学未来医学における若者イノベーションプログラム(W0056)、重慶科学と健康共同TCM技術革新およびアプリケーション開発プロジェクト(2020ZY023877)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Forceps | Shanghai Medical Devices Co.,Ltd | 20220032 | |
| Gauze | Sichuan Kelun Co., Ltd | 20172140152 | |
| Hematoxylin and Eosin Stain Kit | Solarbio | G1120 | |
| Insulin needles | KDL Medical Devices | 20193140938 | |
| Masson’s Trichrome Stain Kit | Solarbio | G1340 | |
| Medical Cotton balls | Sichuan Kelun Co., Ltd | 20170037 | |
| Medical Cotton sticks | Sichuan Kelun Co., Ltd | 20172140026 | |
| Methylene blue | Tianjin Dengfeng Chemical Reagent Factory | 14038-43-8 | |
| Microscopic forceps | Suqian Shifeng Medical Devices Co., Ltd | S50985 | |
| Needle holders | Suqian Shifeng Medical Devices Co., Ltd | S7005 | |
| Povidone-iodine Solution | Sichuan Kelun Co., Ltd | 514001 | |
| Saline | Sichuan Kelun Co., Ltd | 20220004 | |
| SD Rats | SPF(Beijing)Biotechnology Co.,Ltd | D025 | |
| Silicone tubing | Taizhou Chunshi New Materials Co., Ltd | CS356 | |
| Silk suture | Qiangsheng Medical Devices Co.,Ltd | SA84G | |
| Surgical blade | Huanan Yunyue Medical Devices Co.,Ltd | CE0434 | |
| Surgical scissors | Shanghai Medical Devices Co.,Ltd | J21130 | |
| Syringe | Tongmai medical devices | 20183140304 | |
| Tissue Forceps | Jiangxi Yuyuan Medical Equipment Co., Ltd | J36030 |
参考文献
- Chaves, L. D., et al. Contrasting effects of systemic monocyte/macrophage and CD4+ t cell depletion in a reversible ureteral obstruction mouse model of chronic kidney disease. Clin Dev Immunol. 2013, 836989 (2013).
- Chevalier, R. L., Forbes, M. S., Thornhill, B. A. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney Int. 75 (11), 1145-1152 (2009).
- Aranda-Rivera, A. K., et al. Sulforaphane protects from kidney damage during the release of unilateral ureteral obstruction (RUUO) by activating nuclear factor erythroid 2-related factor 2 (nrf2): Role of antioxidant, anti-inflammatory, and antiapoptotic mechanisms. Free Radic Biol Med. 212, 49-64 (2024).
- Narváez Barros, A., et al. Reversal unilateral ureteral obstruction: A mice experimental model. Nephron. 142 (2), 125-134 (2019).
- Cochrane, A. L., et al. Renal structural and functional repair in a mouse model of reversal of ureteral obstruction. J Am Soc Nephrol. 16 (12), 3623-3630 (2005).
- Kaeidi, A., et al. The therapeutic approaches of renal recovery after relief of the unilateral ureteral obstruction: A comprehensive review. Iran J Basic Med Sci. 23 (11), 1367-1373 (2020).
- Liu, Y., et al. A porcine model of relief of unilateral ureteral obstruction: Study on self-repairing capability over multiple time points. Mol Cell Biochem. 419 (1-2), 115-123 (2016).
- Puri, T. S., et al. Chronic kidney disease induced in mice by reversible unilateral ureteral obstruction is dependent on genetic background. Am J Physiol Renal Physiol. 298 (4), F1024-F1032 (2010).
- Chevalier, R. L., Kim, A., Thornhill, B. A., Wolstenholme, J. T. Recovery following relief of unilateral ureteral obstruction in the neonatal rat. Kidney Int. 55 (3), 793-807 (1999).
- Hesketh, E. E., et al. A murine model of irreversible and reversible unilateral ureteric obstruction. J Vis Exp. (94), e52559 (2014).
- Klahr, S., Morrissey, J. Obstructive nephropathy and renal fibrosis. Am J Physiol Renal Physiol. 283 (5), F861-F875 (2002).
- Jin, B., et al. Loss of men1 leads to renal fibrosis and decreases HGF-ADAMTS5 pathway activity via an epigenetic mechanism. Clin Transl Med. 12 (8), e982 (2022).
- Fischer, N. G., He, J., Aparicio, C. Surface immobilization chemistry of a laminin-derived peptide affects keratinocyte activity. Coatings (Basel). 10 (6), 560 (2020).
- Song, J., et al. Losartan accelerates the repair process of renal fibrosis in UUO mouse after the surgical recanalization by upregulating the expression of tregs. Int Urol Nephrol. 51 (11), 2073-2081 (2019).
- Song, J., et al. Regulatory t cells accelerate the repair process of renal fibrosis by regulating mononuclear macrophages. Am J Med Sci. 361 (6), 776-785 (2021).
- Yao, Y., et al. Interferon-γ improves renal interstitial fibrosis and decreases intrarenal vascular resistance of hydronephrosis in an animal model. Urology. 77 (3), e768-e761.e713 (2011).
- Chevalier, R. L., Thornhill, B. A., Chang, A. Y., Cachat, F., Lackey, A. Recovery from release of ureteral obstruction in the rat: Relationship to nephrogenesis. Kidney Int. 61 (6), 2033-2043 (2002).
- Lucarelli, G., et al. Delayed relief of ureteral obstruction is implicated in the long-term development of renal damage and arterial hypertension in patients with unilateral ureteral injury. J Urol. 189 (3), 960-965 (2013).
- Ito, K., et al. Renal damage progresses despite improvement of renal function after relief of unilateral ureteral obstruction in adult rats. Am J Physiol Renal Physiol. 287 (6), F1283-F1293 (2004).
- Song, J., et al. A modified relief of unilateral ureteral obstruction model. Ren Fail. 41 (1), 497-506 (2019).
- Morrissey, J., et al. morphogenetic protein-7 improves renal fibrosis and accelerates the return of renal function. J Am Soc Nephrol. 13 (suppl_1), S14-S21 (2002).
- Ulm, A. H., Miller, F. An operation to produce experimental reversible hydronephrosis in dogs. J Urol. 88, 337-341 (1962).
- Park, H. C., et al. Postobstructive regeneration of kidney is derailed when surge in renal stem cells during course of unilateral ureteral obstruction is halted. Am J Physiol Renal Physiol. 298 (2), F357-F364 (2010).
- Forni, L. G., et al. Renal recovery after acute kidney injury. Intensive Care Med. 43 (6), 855-866 (2017).
- Varela, S., Omling, E., Borjesson, A., Salo, M. Resolution of hydronephrosis after pyeloplasty in children. J Pediatr Urol. 17 (1), e101-e102.e7 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved