Method Article
Un modèle murin immature d’obstruction urétérale unilatérale réversible
Dans cet article
Résumé
Le présent protocole décrit un modèle reproductible étape par étape de l’obstruction urétérale unilatérale.
Résumé
L’obstruction urétérale unilatérale (UUO) est une cause fréquente d’insuffisance rénale chronique (IRC), entraînant la progression de la fibrose interstitielle rénale et entraînant finalement des lésions rénales irréversibles. L’atténuation de l’UUO est cruciale. Plusieurs modèles animaux d’obstruction urétérale unilatérale réversible (RUUO) ont été établis dans la littérature, permettant d’observer les changements structurels et les dommages fonctionnels tout en simulant les changements physiologiques et physiopathologiques suite au soulagement de l’obstruction urétérale. Dans cette étude, un modèle d’obstruction réversible a été établi dans l’uretère murin unilatéral à l’aide d’un tube en silicone. Des lésions rénales importantes ont été observées avant le soulagement de l’obstruction, avec une récupération partielle notée par la suite. Contrairement à l’UUO, ce modèle empêche l’hydronéphrose progressive, conduisant à des résultats pathologiques distincts. Cette procédure chirurgicale simple démontre un taux de réussite élevé et est prometteuse en tant que modèle classique pour l’étude de la néphropathie obstructive réversible et des traitements potentiels de la fibrose interstitielle rénale. De plus, il fournit une plate-forme pratique pour étudier les mécanismes de récupération de la néphropathie obstructive, de la régénération des cellules rénales et du remodelage tissulaire.
Introduction
L’obstruction urétrale contribue de manière significative à la fibrose interstitielle rénale et à l’insuffisance rénale chronique (IRC), entraînant potentiellement des dommages structurels irréversibles et des déficiences fonctionnelles dans le rein1. Bien que l’obstruction urétérale unilatérale (UUO) soit largement utilisée pour étudier les lésions rénales et l’IRC, elle ne reproduit pas avec précision les mécanismes de récupération spontanée qui se produisent après l’élimination d’une obstruction. Le modèle UUO consiste à ligaturer l’uretère gauche avec des sutures, ce qui entraîne une obstruction permanente, une dilatation urétérale, une hydronéphrose, une compression du parenchyme rénal et un amincissement cortical. L’examen histologique révèle généralement une dilatation tubulaire, une nécrose des cellules épithéliales tubulaires, une inflammation interstitielle progressive et une fibrose2. Ce modèle étudie principalement la fibrose interstitielle rénale et la perte irréversible de la fonction rénale due à une obstruction persistante.
Cependant, de nombreuses maladies rénales rencontrées en pratique clinique, telles que l’obstruction causée par des calculs urétéraux ou des tumeurs, sont réversibles. Le modèle d’obstruction urétérale unilatérale réversible (RUUO) permet la restauration partielle de la structure rénale et de la fonction des voies urinaires, résolvant ainsi l’hydronéphrose. La récupération peut être évaluée à l’aide de techniques d’imagerie, d’un examen histologique et d’une analyse de biomarqueurs pour quantifier la réduction des lésions rénales et de la fibrose3. Ce modèle imite étroitement la phase de récupération de la néphropathie obstructive en milieu clinique et est plus adapté que l’UUO pour étudier des processus clés tels que l’inflammation, les réponses immunitaires, la régénération cellulaire et le remodelage tissulaire 4,5,6,7,8.
Le modèle RUUO permet aux chercheurs d’analyser la réparation et la régénération rénales après le soulagement des blessures, en abordant les limites de l’UUO dans les études dynamiques. En comparant différents points de temps avant et après l’obstruction, les chercheurs peuvent étudier les voies moléculaires impliquées dans les blessures et la réparation, notamment l’inflammation, l’apoptose, la fibrose et la régénération. Cette approche permet d’améliorer la compréhension des mécanismes de récupération rénale et d’identifier des cibles thérapeutiques potentielles 2,3,4,5,8,9,10. Bien que la fibrose rénale soit souvent considérée comme irréversible, les observations cliniques suggèrent qu’un soulagement précoce de l’obstruction au cours des premiers stades de la fibrose peut arrêter ou même inverser la progression de la maladie. Le modèle RUUO fournit une plate-forme expérimentale précieuse pour étudier ce phénomène11.
De plus, le modèle RUUO facilite l’étude de l’inversion de la fibrose après le soulagement de l’obstruction, offrant des informations sur les mécanismes de récupération et les thérapies antifibrotiques potentielles 3,4. Par conséquent, ce modèle est très pratique pour la recherche translationnelle. L’objectif principal de ce modèle expérimental est d’induire une néphropathie obstructive par canulation urétérale, suivie d’un soulagement standardisé à un moment prédéfini pour assurer la cohérence. Il est optimisé pour sa simplicité, sa reproductibilité et sa sécurité, ce qui en fait un outil efficace pour la recherche expérimentale.
Protocole
Cette étude sur les animaux a respecté les lignes directrices de la Déclaration d’Helsinki et a été approuvée par le Comité d’éthique de la recherche de l’Hôpital pour enfants de l’Université de médecine de Chongqing. Au total, 27 rats Sprague Dawley (SD) mâles ont été obtenus commercialement et hébergés au Centre des animaux de laboratoire de l’Hôpital pour enfants de l’Université de médecine de Chongqing (SPF, numéro de licence : SYXK (Chongqing) 2007-0016). Les rats ont été maintenus dans des conditions de température contrôlée avec un cycle lumière/obscurité de 12 heures et ont eu un accès ad libitum à la nourriture et à l’eau.
Le protocole a été réalisé sur des rats SD mâles âgés de 6 à 8 semaines et s’applique aux rats de tous âges avec des uretères bilatéraux. Dans cette étude, quinze rats SD mâles âgés de 6 semaines ont été répartis au hasard en trois groupes : le groupe natif (n = 5), le groupe UUO (n = 5) et le groupe RUUO (n = 5). De plus, cinq rats SD âgés de 8 semaines (n = 5) ont été inclus comme groupe témoin supplémentaire. Pour établir le modèle RUUO, 12 rats ont été utilisés, et 7 rats supplémentaires ont été achetés pour tenir compte des risques potentiels tels que la mortalité peropératoire et postopératoire, les échecs chirurgicaux, l’obstruction incomplète et l’inversion infructueuse. Cela a permis d’obtenir un minimum de 5 rats par groupe pour les analyses ultérieures.
Toutes les interventions chirurgicales ont été effectuées en stricte conformité avec les directives institutionnelles et nationales pour le soin et l’utilisation des animaux de laboratoire. Le personnel chirurgical a respecté les protocoles d’équipement de protection individuelle (EPI), y compris les masques chirurgicaux, les gants et les blouses. Des instruments chirurgicaux stériles ont été utilisés pour chaque procédure et ont été autoclavés avant et après utilisation pour maintenir la stérilité. Les déchets, y compris les objets tranchants et les échantillons biologiques, ont été éliminés conformément aux protocoles de gestion des déchets dangereux afin d’atténuer les risques de contamination et d’assurer la sécurité.
1. Préparation des animaux et des instruments
- Effectuer toutes les procédures à l’aide d’instruments et de consommables stériles (autoclavés). Coupez le tube en silicone stérilisé (diamètre intérieur : 1,5 mm, diamètre extérieur : 2,5 mm) en segments d’environ 1 cm. Faites une incision longitudinale le long d’un côté de la paroi du tube pour une utilisation ultérieure.
- Anesthésier les rats par injection intrapéritonéale de pentobarbital (40 mg/kg) (selon les protocoles approuvés par l’établissement). Confirmez une anesthésie adéquate en vérifiant l’absence de réponses réflexes, telles que le réflexe de retrait de la pédale, lors du pincement des orteils. Appliquez une pommade ophtalmique vétérinaire sur les yeux pour éviter le dessèchement de la cornée pendant l’anesthésie.
- Épiler l’abdomen du rat de l’apophyse xiphoïde à la symphyse pubienne et étendre bilatéralement jusqu’à la ligne médiane.
- Placez le rat en position couchée sur un coussin chirurgical chauffé et fixez ses membres avec des cordes en caoutchouc.
- Drapez une feuille fenêtrée stérile pour maintenir un champ stérile. Préparez la peau avec une solution de povidone iodée. Faites une incision cutanée médiane le long de l’abdomen, s’étendant de la région sous-xiphoïde jusqu’à juste en dessous de l’ombilic, afin d’exposer adéquatement les reins et les uretères supérieurs.
- Inciser les tissus sous-cutanés et le fascia le long de la ligne médiane à l’aide de ciseaux chirurgicaux. Disséquez méticuleusement la peau et les tissus sous-jacents couche par couche, et exposez complètement l’espace rétropéritonéal à l’aide d’une pince à tissus.
2. Chirurgie obstructive pour l’obstruction urétérale unilatérale réversible
- Rétractez l’intestin vers le côté droit de la cavité abdominale à l’aide d’un écouvillon stérile pour faciliter la visualisation directe de l’uretère gauche. Couvrez l’uretère avec de la gaze imbibée de solution saline pour éviter la dessiccation.
- Disséquez et mobilisez l’uretère gauche à l’aide d’une pince microscopique, en libérant environ 1,5 cm des tissus environnants.
- Placez un tube en silicone de 1 cm de long (diamètre intérieur : 1,5 mm, diamètre extérieur : 2,5 mm) sous l’uretère libéré. Utilisez une pince pour assurer une enveloppe complète dans le tube.
- Lister le tube en silicone et la partie centrale de l’uretère à l’aide de fil de soie 3-0 pour induire une obstruction urétérale. Évitez une force de ligature excessive. Tirez progressivement le tube de silicone le long de l’axe longitudinal de l’uretère pour assurer une ligature sûre mais antidérapante.
- Repositionnez soigneusement l’intestin dans la cavité péritonéale, en assurant un bon alignement sans tension ni obstruction.
- Suturez le muscle abdominal et les couches fasciales à l’aide d’une suture non résorbable 2-0 avec une aiguille de coupe incurvée de manière continue pour fournir une résistance à la traction adéquate. Fermez la peau avec une suture non résorbable 4-0, assurant un alignement anatomique et une tension uniforme pour favoriser la cicatrisation et minimiser le risque de déhiscence de la plaie.
- Désinfectez le site d’incision avec une solution de povidone iodée. Laissez les rats se rétablir dans des conditions contrôlées à une température constante pendant 7 jours.
3. Chirurgie de soulagement de l’obstruction urétérale unilatérale réversible
- Préparez les animaux et les instruments nécessaires, en assurant une configuration stérile pour la réouverture abdominale et l’exposition complète de la cavité abdominale.
- Disséquez soigneusement le nœud du tube en silicone à l’aide d’une lame de scalpel. Retirez le tube et irriguez la cavité abdominale avec une solution saline normale pour minimiser l’adhérence et le risque d’infection.
- Repositionnez l’intestin et suturez l’incision de la paroi abdominale en couches à l’aide de sutures non résorbables 4-0. Stérilisez le site d’incision avec une solution de povidone iodée. Placez le rat dans un environnement à température contrôlée pour une période de récupération postopératoire de 7 jours.
- Le 14e jour postopératoire, anesthésie les rats (en suivant la procédure mentionnée à l’étape 1.2) et prélève des échantillons de reins en sectionnant transversalement les reins en deux moitiés9.
- Stocker la moitié dans du paraformaldéhyde à 4 % pour un examen histopathologique, et congeler rapidement l’autre moitié dans de l’azote liquide pour un stockage à −80 °C pour une analyse moléculaire ultérieure. Prélever des échantillons de sang pour des analyses biochimiques.
- Effectuer l’euthanasie par asphyxie au CO2 suivie d’une luxation cervicale selon les directives éthiques.
4. Évaluations de suivi
- Suivre le poids corporel après l’RUUO pour évaluer la récupération globale. Comparez les changements de poids avec les groupes de contrôle et UUO.
- Mesurer le poids et le volume des reins pour évaluer la récupération rénale.
- Surveiller les taux de créatinine sérique (Scr) comme indicateur d’amélioration de la fonction rénale9.
- Injecter du bleu de méthylène dans le bassinet du rein pour confirmer la perméabilité urétérale. Observer le péristaltisme et la coloration urétérales pour évaluer la récupération post-obstruction.
- Effectuer une coloration H&E pour évaluer l’intégrité tubulaire et la structure rénale après RUUO 8,10.
- Effectuer la coloration trichrome de Masson pour évaluer la régression de la fibrose interstitielle rénale 8,10.
- Comparez les scoresd’atteinte rénale 3,8 entre les groupes UUO et RUUO pour quantifier la récupération tissulaire.
Résultats
Les effets de l’UUO et de sa libération ultérieure (RUUO) sur le poids corporel, le poids des reins, le volume des reins et les taux de créatinine sérique (Scr) ont été évalués, comme résumé dans le tableau 1. Les données sont présentées sous forme de moyenne ± d’écart-type (ET), avec n = 5 par groupe.
À 6 semaines, le groupe autochtone présentait un poids corporel moyen de 234 g ± 16 g, un poids rénal de 0,9107 g ± 0,0475 g et un volume rénal de 0,8962 cm³ ± 0,0502 cm³. À 8 semaines, le groupe témoin a montré des augmentations significatives du poids corporel (291 g ± 20 g, P < 0,05), du poids des reins (1,1443 g ± 0,0687 g, P < 0,05) et du volume rénal (1,1340 cm³ ± 0,0392 cm³, P > 0,05), avec un niveau Scr de 18,07 μmol/L ± 2,17 μmol/L.
Le groupe UUO de 8 semaines a montré une hypertrophie rénale substantielle, avec une augmentation significative du poids des reins (2,5535 g ± 0,2587 g, P < 0,01) et du volume rénal (2,8533 cm³ ± 0,3870 cm³, P < 0,01). Le poids corporel était légèrement inférieur à celui du groupe témoin (280 g ± 17 g, P < 0,05), et les taux de Scr ont également augmenté (20,02 μmol/L ± 1,36 μmol/L, P < 0,05), indiquant une altération de la fonction rénale.
Dans le groupe RUUO de 8 semaines, le poids des reins (1,5178 g ± 0,1305 g, P < 0,05) et le volume rénal (1,6183 cm³ ± 0,0906 cm³, P < 0,05) étaient inférieurs à ceux du groupe UUO mais restaient élevés par rapport au groupe témoin, avec une signification notable observée uniquement dans le volume rénal (P < 0,05). Les taux de Scr (16,42 μmol/L ± 4,03 μmol/L, P < 0,05) ont été réduits par rapport au groupe UUO, mais ne sont pas complètement revenus à la valeur initiale. Le poids corporel (288 g ± 12 g, P > 0,05) était plus élevé que dans le groupe UUO mais restait légèrement inférieur à celui du groupe témoin.
La morphologie des reins et du bassinet du rein a subi des modifications significatives suite à une obstruction urétérale. Au-dessus du site d’obstruction, les uretères et le bassinet du rein présentaient une dilatation marquée, avec une hypertrophie rénale et un amincissement notable du cortex rénal et de la moelle. Après recanalisation de l’obstruction urétérale, la dilatation des uretères et du bassinet du rein a été considérablement réduite, bien qu’une légère dilatation résiduelle ait été observée (Figure 1).
Pour évaluer la perméabilité urétérale, 0,1 mL de bleu de méthylène a été injecté dans le bassinet du rein à l’aide d’une aiguille à insuline (0,33 mm × 12,7 mm). L’obstruction complète a été confirmée lorsque le colorant n’a pas réussi à traverser le blocage urétéral. Les résultats de l’injection de bleu de méthylène dans le bassinet du rein et les uretères de rats atteints de RUUO avant l’élimination de l’obstruction sont illustrés à la figure 2A. Après le retrait du tube en silicone, l’uretère au site de ligature présentait une couleur rouge (Figure 2B) et présentait un péristaltisme normal, ce qui suggère que cette technique a entraîné des lésions urétérales minimes.
L’analyse histologique du rein normal a révélé des tubules denses et sains entourant les glomérules (Figure 3, à gauche). Quatorze jours après l’UUO, l’épithélium du tubule proximal présentait une vacuolisation et une dégénérescence, une perte des bordures du pinceau et une exfoliation. Des cellules nécrotiques ont été observées dans les lumières. Les tubules distaux semblaient dilatés, certains tubules étaient absents et les canaux collecteurs étaient distendus, ce qui a entraîné un amincissement du cortex rénal (Figure 3).
La coloration trichrome de Masson a été utilisée pour évaluer la fibrose interstitielle rénale, les fibres de collagène colorées en bleu indiquant des changements fibrotiques12. Cette méthode différencie efficacement les cellules, les fibres de collagène et d’autres composants tissulaires. Dans le modèle UUO, après 14 jours, une augmentation substantielle des fibres de collagène a été observée dans l’interstitium rénal, indiquant une fibrose interstitielle prononcée (Figure 4). En revanche, le modèle RUUO a démontré une réduction notable des fibres de collagène, ce qui suggère que la fibrose était atténuée ou retardée.
D’après le score d’atteinte rénale (figure 5), le groupe UUO présentait une lésion rénale sévère, tandis que le groupe RUUO présentait une lésion rénale modérée. Comme le montre la figure 5, le score d’atteinte rénale était significativement plus élevé dans le groupe UUO que dans le groupe natif (P < 0,0001). Le groupe RUUO a montré un score d’insuffisance rénale significativement plus faible que le groupe UUO (P < 0,05) ; cependant, le score est demeuré significativement élevé par rapport au groupe autochtone (P < 0,001). Dans l’ensemble, les lésions rénales dans le groupe RUUO ont été significativement atténuées par rapport au groupe UUO (P < 0,05).

Figure 1 : Histologie représentative des reins natifs, UUO (14 jours) et RUUO. Par rapport au rein natif, 14 jours d’UUO ont entraîné une augmentation notable du volume rénal, caractérisée par une dilatation marquée du bassinet du rein et de l’uretère proximal, ainsi qu’une diminution du cortex rénal et de l’épaisseur de la moelle. En revanche, le volume rénal dans le groupe RUUO (panneau de droite) était significativement réduit par rapport au groupe UUO (panneau du milieu), avec une constriction distincte du bassinet du rein et de l’uretère. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Visualisation de l’uretère avec injection de bleu de méthylène et après retrait du tube de silicone. (A) Le 7e jour de l’RUUO, après l’injection de bleu de méthylène dans le bassinet du rein, une coloration a été observée dans l’uretère au-dessus du tube de silicone, tandis que la partie située sous le site de ligature n’était pas colorée. (B) L’uretère apparaît rougeâtre après le retrait du tube de silicone. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Histologie représentative des reins natifs, UUO et RUUO. Le rein UUO présente une perte de bordure en brosse dans les tubules proximaux, une dilatation significative de la lumière tubulaire, une dégénérescence, une exfoliation et une désintégration des cellules épithéliales tubulaires, ainsi qu’une exposition de la membrane basale, indiquant une lésion tubulaire aiguë prononcée. Le nombre de tubules rénaux dilatés dans le rein RUUO est nettement inférieur à celui du rein UUO, ce qui témoigne d’une récupération tubulaire partielle. Panneaux supérieurs : Barre d’échelle = 100 μm ; panneaux inférieurs (en médaillon) : Barre d’échelle = 16 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
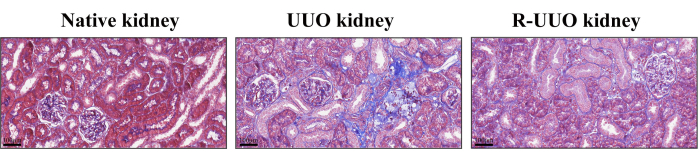
Figure 4 : Coloration trichrome de Masson des reins natifs, UUO et RUUO. Les zones bleuies indiquent la présence de fibres de collagène. Le rein UUO présentait une densité plus élevée de fibres de collagène par rapport au rein natif. En revanche, le rein RUUO a montré une réduction significative de la densité des fibres de collagène par rapport au rein UUO, indiquant une atténuation de la fibrose interstitielle. Panneaux supérieurs : Barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 5 : Scores de lésions tubulaires dans les reins natifs, UUO et RUUO. D’après la coloration à l’hématoxyline et à l’éosine (HE), les changements histologiques dans le tissu rénal ont été notés à l’aide d’une échelle semi-quantitative pour la nécrose tubulaire : 0 = rein normal, 1 = nécrose minime (atteinte de ≤5 %), 2 = nécrose légère (atteinte de 5 % à 25 %), 3 = nécrose modérée (atteinte de 25 % à 50 %), 4 = nécrose sévère (atteinte de 50 % à 75 %) et 5 = nécrose la plus grave (atteinte de >75 %). L’axe des y représente les scores d’atteinte rénale, tandis que l’axe des x représente les groupes expérimentaux. Par rapport au groupe autochtone, le groupe UUO a présenté un score d’insuffisance rénale significativement plus élevé (P < 0,0001). En revanche, le groupe RUUO avait un score d’insuffisance rénale significativement plus faible que le groupe UUO (P < 0,05). Cependant, par rapport au groupe autochtone, le groupe RUUO présentait toujours un score de lésion rénale significativement élevé (P < 0,001). Dans l’ensemble, le groupe UUO a présenté des lésions rénales graves, tandis que le groupe RUUO a présenté des lésions rénales modérées. Les lésions rénales dans le groupe RUUO ont été significativement atténuées par rapport au groupe UUO (P < 0,05). La signification statistique est indiquée comme suit : *P < 0,05, ***P < 0,001 et ****P < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Groupe | Poids corporel (g) | Poids des reins (g) | Volume rénal (cm³) | Créatinine sérique (μmol/L) |
| Native (6 semaines) | 234 ± 16A | 0,91 ± 0,05A | 0,90 ± 0,05A | N/A* |
| Contrôle (8 semaines) | 291 ± 20*b | 1,14 ± 0,07*b | 1,13 ± 0,04A | 18.07 ± 2.17*b |
| UUO (8 semaines) | 280 ± 17*c | 2,55 ± 0,26**c | 2,85 ± 0,39**c | 20,02 ± 1,36*c |
| RUUO (8 semaines) | 288 ± 12*b | 1,52 ± 0,13*b | 1,62 ± 0,09**b | 16.42 ± 4.03A |
Tableau 1 : Poids corporel, poids des reins, volume des reins et taux de créatinine sérique dans différents groupes. Les données sont présentées sous forme de moyenne ± d’écart-type (ET), avec n = 5 par groupe. Les noms de groupe indiquent l’âge des rats au moment de la mesure et le modèle de maladie correspondant. Des comparaisons statistiques ont été effectuées à l’aide du test de Kruskal-Wallis, suivi du test de comparaisons multiples de Dunn. Des lettres en exposant différentes (a, b, c) indiquent des différences statistiquement significatives entre les groupes (P < 0,05), où les groupes partageant la même lettre ne sont pas significativement différents, tandis que les groupes avec des lettres différentes indiquent des différences significatives. Pour les comparaisons directes avec le groupe témoin (à l’exception de la créatinine sérique), la signification statistique est indiquée comme P < 0,05 par (*) et P < 0,01 par (**). *N/A : La créatinine sérique n’a pas été mesurée dans le groupe natif (âgé de 6 semaines). Comparativement au groupe autochtone, le groupe témoin a montré des augmentations significatives du poids corporel et du poids des reins (P < 0,05), indiquant une croissance et un développement notables chez les rats de 8 semaines et leurs reins. Le volume rénal a également augmenté dans le groupe témoin, bien que la différence n’ait pas été statistiquement significative (P > 0,05). Par rapport au groupe témoin, le groupe UUO a montré une réduction statistiquement significative du poids corporel (P < 0,05), tandis que le poids et le volume des reins ont augmenté de manière significative (P < 0,01). Le taux de créatinine sérique a également augmenté de manière significative dans le groupe UUO (P < 0,05). Par rapport au groupe UUO, le groupe RUUO a démontré une augmentation statistiquement significative du poids corporel (P < 0,05) et des réductions significatives du poids des reins, du volume des reins et du taux de créatinine sérique (P < 0,05), une diminution de la créatinine sérique étant particulièrement notable. Par rapport au groupe témoin, le groupe RUUO a présenté une augmentation significative du volume rénal (P < 0,01) et une réduction significative du taux de créatinine sérique (P < 0,05), tandis que les différences de poids corporel et de poids des reins n’étaient pas significatives. Dans l’ensemble, le groupe UUO a montré une augmentation du poids des reins, du volume des reins et du taux de créatinine sérique par rapport au groupe témoin, tandis que le groupe RUUO a montré une récupération de ces paramètres, toutes les différences étant statistiquement significatives (P < 0,05).
Discussion
Ce modèle utilise un tube en silicone pour encercler l’uretère, fournissant un soutien structurel, suivi d’une ligature avec un fil de soie pour induire une obstruction complète de l’urétéral par compression. Après sept jours, la ligature et le tube en silicone sont retirés pour faciliter la décompression rénale et la restauration de l’intégrité et de la fonctionnalité des voies urinaires.
Les tubes en silicone, fabriqués à partir d’élastomères de silicone, offrent une excellente flexibilité, biocompatibilité, résistance chimique et stabilité thermique. Le caoutchouc de silicone de qualité médicale est spécialement conçu pour les applications nécessitant des propriétés mécaniques supérieures, y compris l’implantation à long terme, tandis que les tubes en silicone généraux englobent une gamme de variantes disponibles dans le commerce qui peuvent différer en termes d’élasticité, de dureté et de profils de biocompatibilité13. Compte tenu de la courte durée de l’expérience (7 à 14 jours) et de l’absence de stress mécanique soutenu dans cette étude, les tubes en silicone ont été choisis pour établir les modèles d’obstruction urétérale chez le rat en raison de leur biocompatibilité adéquate, de leur élasticité appropriée et de leur rapport coût-efficacité. Par conséquent, les deux matériaux présentent une équivalence fonctionnelle et peuvent être utilisés de manière interchangeable dans cette étude.
La durée de l’obstruction est un facteur critique dans la récupération rénale de l’RUUO, des études indiquant que les lésions rénales peuvent être partiellement atténuées si l’obstruction est soulagée le septième jour, alors qu’aucune récupération significative n’est observée au-delà du 14e jour7. La durée optimale de l’obstruction urétérale dans le modèle RUUO a été déterminée à sept jours afin d’éviter des dommages excessifs et de s’assurer que les résultats ne sont pas indûment influencés par une obstruction prolongée. En comparant les reins soumis à 14 jours d’obstruction avec ceux soulagés après sept jours, la progression de la néphropathie obstructive dans les modèles RUUO et UUO a été examinée visuellement. Du bleu de méthylène a été injecté dans le bassinet du rein pour confirmer l’obstruction complète de l’uretère avant le retrait du cathéter. Le 7ejour d’obstruction a été choisi pour les tests au lieu du premier jour en raison de la dilatation marquée du bassinet du rein à ce moment-là, ce qui a facilité l’insertion de l’aiguille et réduit le risque de lésions urétérales dues à l’utilisation d’une aiguille à insuline le jour 1.
La méthode pour soulager l’obstruction est simple, efficace et conçue pour minimiser les lésions urétérales potentielles. Ce modèle assure une obstruction complète tout en améliorant le taux de réussite de la recanalisation et en réduisant la probabilité de lésions urétérales. Le modèle RUUO se caractérise par sa simplicité, sa reproductibilité et sa facilité de mise en œuvre, ce qui en fait un outil précieux pour l’étude de la fibrose rénale, de la régénération rénale et des mécanismes associés 14,15,16.
S’appuyant sur le modèle UUO, le modèle RUUO répond aux limites irréversibles de son prédécesseur. En intégrant la progression pathologique de la fibrose interstitielle rénale induite par l’UUO avec la récupération ultérieure après le soulagement de l’obstruction, le modèle RUUO reproduit la phase de récupération de l’insuffisance rénale aiguë (IRA) et de la fibrose rénale. Ce modèle facilite la simulation des processus de traitement des reins cliniquement obstrués et offre une exploration plus complète de la régénération cellulaire et du remodelage de la matrice extracellulaire (MEC) par rapport au modèle UUO traditionnel.
L’étude de l’UUO chez l’homme offre des informations précieuses sur les mécanismes des lésions rénales, de la fibrose et des interventions thérapeutiques potentielles. L’UUO est largement utilisée pour imiter la néphropathie obstructive causée par des affections telles que l’obstruction de la jonction urétéro-pelvienne (UPJO), les calculs rénaux ou les tumeurs2. La fibrose rénale, caractérisée par un dépôt excessif de MEC, est une caractéristique de l’insuffisance rénale chronique, et les modèles UUO jouent un rôle déterminant dans l’étude du rôle de la MEC dans la progression de la fibrose. Ce modèle reproduit de manière fiable le processus de lésion rénale, en particulier le développement de la fibrose, fournissant une base pour l’étude des mécanismes sous-jacents à la fibrose rénale.
La recherche indique que le soulagement de l’obstruction peut partiellement restaurer et préserver l’hémodynamique et la fonction rénales tout en atténuant la progression de la fibrose dans une certaine mesure17. Cela a des implications importantes pour la réparation des lésions rénales. Cependant, le soulagement retardé de l’obstruction entraîne souvent une mauvaise récupération et une détérioration supplémentaire des reins, ce qui peut conduire à une insuffisance rénale18. De plus, l’UUO a été associée à l’hypertension, une intervention tardive étant corrélée à une incidence et une gravité plus élevées de cette maladie. Ces résultats soulignent l’importance cruciale d’une intervention précoce pour minimiser les lésions rénales et gérer la pression artérielle. Un soulagement retardé exacerbe non seulement la fibrose et le déclin de la fonction rénale, mais augmente également le risque d’hypertension.
Dans ce contexte, le modèle RUUO constitue un outil précieux pour étudier la nature dynamique des lésions rénales et de la récupération. Des études utilisant le modèle RUUO démontrent que si la désobstruction urétérale peut atténuer certaines blessures, une fibrose persistante et des dommages à long terme persistent, comme observé dans les modèles animaux et cliniques19. Le modèle RUUO est donc essentiel pour comprendre comment une intervention précoce peut aider à limiter les lésions rénales irréversibles et à ralentir la progression vers l’insuffisance rénale chronique et les complications associées telles que l’hypertension.
Plusieurs chercheurs ont proposé différents modèles de RUUO 10,14,20,21,22,23. Cependant, de nombreux modèles de recanalisation existants ont des limites, notamment des procédures chirurgicales complexes, des exigences élevées en matière de compétences techniques et des résultats incohérents. Par exemple, Ulm22 a décrit la méthode d’enrobage du psoas urétéral, qui facilite la recanalisation réussie et est relativement simple à réaliser. Cependant, son efficacité peut être influencée par des facteurs tels que la posture de l’animal, ses mouvements et les variations de la tension musculaire du psoas. Park et coll.23 ont utilisé un clip microvasculaire non invasif pour induire une obstruction pendant 10 jours, suivi d’un retrait du clip en utilisant la même approche chirurgicale. Bien que cette méthode offre des avantages tels que la biocompatibilité, la facilité d’utilisation, la durée minimale de la procédure et la reproductibilité, elle peut entraîner des adhérences intestinales et un taux de réussite plus faible dans la recanalisation urétérale.
L’utilisation d’un tube en silicone constitue une alternative efficace, car sa douceur et sa biocompatibilité permettent une obstruction urétérale sans endommager les tissus environnants. Cette approche minimise les lésions tissulaires et les réponses inflammatoires tout en permettant de soulager l’obstruction sans dommages urétérals permanents. Par conséquent, le modèle RUUO reste réversible, stable et adapté aux études à long terme.
La méthode de réimplantation vésico-urétérale employée par Hesketh et al.10 est bien adaptée à l’étude des changements physiopathologiques après la réimplantation vésico-urétérale. Cependant, cette technique implique une intervention chirurgicale complexe avec une durée d’opération prolongée et des risques de rupture et de décollement de l’urétéral en raison d’une tension excessive. De plus, l’uretère raccourci peut ne pas réussir à s’anastomoser avec le trigone de la vessie, ce qui entraîne une reconnexion anormale et un échec chirurgical potentiel. Ces défis limitent son applicabilité, en particulier dans les modèles de petits animaux.
Yao et coll.16 ont introduit une technique de clampage urétéral à l’aide d’un tube en polyéthylène plié, qui réduit les lésions urétérales et assure une occlusion stable. Cependant, la surface lisse du tube en polyéthylène peut entraîner un glissement de la ligature dû au péristaltisme et au mouvement de l’animal, ce qui peut provoquer une obstruction. Chevalier et al.9 ont inséré un tube de silicone dans l’uretère gauche de souris nouveau-nées, qui a été retiré après cinq jours de clampage vasculaire. Bien que ce modèle induise efficacement une obstruction, l’utilisation de la ligature au fil de soie comme alternative aux clips vasculaires a produit des résultats comparables, y compris des réductions significatives du volume des reins et du bassinet rénal. De plus, cette méthode a provoqué des réponses inflammatoires et fibrotiques minimales autour de l’uretère. Bien qu’une légère dilatation urétérale ait été observée sept jours après le soulagement de l’obstruction, elle était considérablement moins sévère que celle observée avec la réimplantation vésico-urétérale10. Cette approche prévient également le reflux vésico-urétéral, ce qui en fait une alternative viable pour étudier l’RUUO.
Une considération clé dans cette approche est de minimiser les lésions urétérales pendant la chirurgie, car les lésions urétérales peuvent induire une inflammation, pouvant entraîner une adhésion, une fermeture et un échec de recanalisation. La réimplantation vésico-urétérale présente des risques tels que des lésions urétérales directes, une inflammation anastomotique et une fermeture potentielle due à des erreurs chirurgicales. De plus, un drainage inadéquat des sédiments urinaires avant la réimplantation peut contribuer à l’échec de la recanalisation. L’utilisation d’un tube en silicone pour envelopper l’uretère à l’extérieur offre une protection, tandis que la ligature avec un clip vasculaire ou un fil de soie à travers le tube en silicone induit une obstruction urétérale. Cependant, les clamps vasculaires peuvent augmenter le risque d’adhérences intestinales et réduire les taux de réussite de la recanalisation. Bien qu’il ait été rapporté que le repositionnement de la pince tous les deux jours lors d’une obstruction urétérale améliore les taux de réussite de la recanalisation de 70 %17, cette méthode prolonge considérablement la durée de la procédure et présente des défis techniques. En revanche, la ligature au fil de soie à travers un tube en silicone offre une approche plus simple avec une inflammation réduite. La principale préoccupation reste de savoir si la ligature du fil de soie assure une obstruction et une uniformité complètes entre les sujets expérimentaux.
Dans cette étude, du bleu de méthylène a été injecté dans l’uretère pour confirmer l’obstruction complète. Dans le groupe UUO, tous les rats ont réussi à obstruer (taux de réussite de 100 %), sans qu’aucune mortalité n’ait été observée dans des conditions standard. Dans le groupe RUUO (n = 12), six rats ont été exclus de l’analyse en raison de complications : un est mort en peropératoire d’une dépression respiratoire induite par l’anesthésie, deux ont succombé à des complications postopératoires (suspicion d’hémorragie ou d’infection) aux jours 6 et 13, deux ont eu une obstruction incomplète et un a connu un échec de recanalisation en raison de complications chirurgicales. Par conséquent, le taux de survie pour le groupe RUUO était de 75 % (IC à 95 % : 46,77 %-91,11 %), le taux de réussite de l’obstruction complète était de 80 % (IC à 95 % : 49,0 %-94,3 %) et le taux de réussite de la recanalisation était de 90 % (IC à 95 % : 59,6 %-98,2 %). Toutes les proportions ont été calculées à l’aide des dénominateurs respectifs après les exclusions, et les intervalles de confiance à 95 % ont été déterminés à l’aide de la méthode du score de Wilson.
La récupération fait référence à la restauration de la fonction physiologique à la suite de modifications pathologiques ou d’une déficience fonctionnelle. Il comprend non seulement l’inversion des altérations pathologiques, mais aussi le retour de la fonction des organes à des niveaux proches de la normale. En revanche, la préservation fait référence aux interventions initiées avant ou au début du processus de la maladie afin d’empêcher une détérioration supplémentaire plutôt que d’inverser complètement les dommages existants24. Pour faire la différence entre la récupération et la préservation, il faut procéder à des évaluations complètes de la fonction rénale de base, ainsi qu’à une surveillance dynamique de la progression de la maladie et de la résolution de l’obstruction. Cette étude s’est limitée à des observations à court terme et n’a pas intégré de suivi systématique des marqueurs pathologiques pendant le rétablissement. Plus précisément, in vivo, les biomarqueurs longitudinaux n’ont pas été utilisés pour suivre l’inversion réelle des mécanismes pathologiques. Bien que des améliorations du tissu rénal et de la fonction rénale aient été observées, il n’est pas clair si ces changements représentent une inversion pathologique complète. Les études futures devraient inclure des biomarqueurs de fibrose et des médiateurs inflammatoires pour évaluer la résolution dynamique de la maladie.
De plus, en raison des limites de l’équipement et des techniques expérimentales, cette étude n’a pas mesuré la protéinurie et l’albuminurie, paramètres bien établis comme indicateurs de la physiopathologie rénale24. Leur absence peut limiter les comparaisons directes avec les modèles classiques de maladies rénales. Les recherches futures devraient intégrer une analyse standardisée des protéines urinaires ainsi que des mesures de la créatinine sérique et de l’azote uréique du sang afin de fournir une évaluation plus complète de la fonction rénale et des dommages.
Le soulagement chirurgical de l’obstruction est une stratégie clinique primaire pour traiter les maladies rénales obstructives25. Bien que cette étude n’établisse pas complètement l’inversion complète des mécanismes pathologiques rénaux, elle fournit un modèle de recherche précieux pour étudier les changements pathologiques et physiologiques après la libération d’une obstruction urétérale. Il permet également d’évaluer si la fonction rénale est entièrement restaurée ou seulement partiellement préservée.
En résumé, ce modèle s’applique à des rats d’âges différents, bien qu’une attention particulière soit requise pour les rats nouveau-nés subissant une RUUO, y compris le choix approprié d’un tube en silicone et la prévention des dommages urétéraux. Une ligature excessive doit être évitée pour éviter l’échec de la recanalisation. Le modèle démontre une efficacité de recanalisation comparable tout en étant simple, stable et réalisable, ce qui le rend bien adapté à l’étude des processus inflammatoires et immunitaires, de la régénération rénale et des mécanismes connexes, avec un potentiel important pour des recherches ultérieures.
Déclarations de divulgation
Aucun.
Remerciements
Ce travail a été soutenu par le Programme pour l’innovation des jeunes en médecine du futur de l’Université médicale de Chongqing (W0056), le Projet conjoint d’innovation et de développement d’applications de la technologie de la MTC pour les sciences et la santé de Chongqing (2020ZY023877).
matériels
| Name | Company | Catalog Number | Comments |
| Forceps | Shanghai Medical Devices Co.,Ltd | 20220032 | |
| Gauze | Sichuan Kelun Co., Ltd | 20172140152 | |
| Hematoxylin and Eosin Stain Kit | Solarbio | G1120 | |
| Insulin needles | KDL Medical Devices | 20193140938 | |
| Masson’s Trichrome Stain Kit | Solarbio | G1340 | |
| Medical Cotton balls | Sichuan Kelun Co., Ltd | 20170037 | |
| Medical Cotton sticks | Sichuan Kelun Co., Ltd | 20172140026 | |
| Methylene blue | Tianjin Dengfeng Chemical Reagent Factory | 14038-43-8 | |
| Microscopic forceps | Suqian Shifeng Medical Devices Co., Ltd | S50985 | |
| Needle holders | Suqian Shifeng Medical Devices Co., Ltd | S7005 | |
| Povidone-iodine Solution | Sichuan Kelun Co., Ltd | 514001 | |
| Saline | Sichuan Kelun Co., Ltd | 20220004 | |
| SD Rats | SPF(Beijing)Biotechnology Co.,Ltd | D025 | |
| Silicone tubing | Taizhou Chunshi New Materials Co., Ltd | CS356 | |
| Silk suture | Qiangsheng Medical Devices Co.,Ltd | SA84G | |
| Surgical blade | Huanan Yunyue Medical Devices Co.,Ltd | CE0434 | |
| Surgical scissors | Shanghai Medical Devices Co.,Ltd | J21130 | |
| Syringe | Tongmai medical devices | 20183140304 | |
| Tissue Forceps | Jiangxi Yuyuan Medical Equipment Co., Ltd | J36030 |
Références
- Chaves, L. D., et al. Contrasting effects of systemic monocyte/macrophage and CD4+ t cell depletion in a reversible ureteral obstruction mouse model of chronic kidney disease. Clin Dev Immunol. 2013, 836989(2013).
- Chevalier, R. L., Forbes, M. S., Thornhill, B. A. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney Int. 75 (11), 1145-1152 (2009).
- Aranda-Rivera, A. K., et al. Sulforaphane protects from kidney damage during the release of unilateral ureteral obstruction (RUUO) by activating nuclear factor erythroid 2-related factor 2 (nrf2): Role of antioxidant, anti-inflammatory, and antiapoptotic mechanisms. Free Radic Biol Med. 212, 49-64 (2024).
- Narváez Barros, A., et al. Reversal unilateral ureteral obstruction: A mice experimental model. Nephron. 142 (2), 125-134 (2019).
- Cochrane, A. L., et al. Renal structural and functional repair in a mouse model of reversal of ureteral obstruction. J Am Soc Nephrol. 16 (12), 3623-3630 (2005).
- Kaeidi, A., et al. The therapeutic approaches of renal recovery after relief of the unilateral ureteral obstruction: A comprehensive review. Iran J Basic Med Sci. 23 (11), 1367-1373 (2020).
- Liu, Y., et al. A porcine model of relief of unilateral ureteral obstruction: Study on self-repairing capability over multiple time points. Mol Cell Biochem. 419 (1-2), 115-123 (2016).
- Puri, T. S., et al. Chronic kidney disease induced in mice by reversible unilateral ureteral obstruction is dependent on genetic background. Am J Physiol Renal Physiol. 298 (4), F1024-F1032 (2010).
- Chevalier, R. L., Kim, A., Thornhill, B. A., Wolstenholme, J. T. Recovery following relief of unilateral ureteral obstruction in the neonatal rat. Kidney Int. 55 (3), 793-807 (1999).
- Hesketh, E. E., et al. A murine model of irreversible and reversible unilateral ureteric obstruction. J Vis Exp. (94), e52559(2014).
- Klahr, S., Morrissey, J. Obstructive nephropathy and renal fibrosis. Am J Physiol Renal Physiol. 283 (5), F861-F875 (2002).
- Jin, B., et al. Loss of men1 leads to renal fibrosis and decreases HGF-ADAMTS5 pathway activity via an epigenetic mechanism. Clin Transl Med. 12 (8), e982(2022).
- Fischer, N. G., He, J., Aparicio, C. Surface immobilization chemistry of a laminin-derived peptide affects keratinocyte activity. Coatings (Basel). 10 (6), 560(2020).
- Song, J., et al. Losartan accelerates the repair process of renal fibrosis in UUO mouse after the surgical recanalization by upregulating the expression of tregs. Int Urol Nephrol. 51 (11), 2073-2081 (2019).
- Song, J., et al. Regulatory t cells accelerate the repair process of renal fibrosis by regulating mononuclear macrophages. Am J Med Sci. 361 (6), 776-785 (2021).
- Yao, Y., et al. Interferon-γ improves renal interstitial fibrosis and decreases intrarenal vascular resistance of hydronephrosis in an animal model. Urology. 77 (3), e768-e761.e713 (2011).
- Chevalier, R. L., Thornhill, B. A., Chang, A. Y., Cachat, F., Lackey, A. Recovery from release of ureteral obstruction in the rat: Relationship to nephrogenesis. Kidney Int. 61 (6), 2033-2043 (2002).
- Lucarelli, G., et al. Delayed relief of ureteral obstruction is implicated in the long-term development of renal damage and arterial hypertension in patients with unilateral ureteral injury. J Urol. 189 (3), 960-965 (2013).
- Ito, K., et al. Renal damage progresses despite improvement of renal function after relief of unilateral ureteral obstruction in adult rats. Am J Physiol Renal Physiol. 287 (6), F1283-F1293 (2004).
- Song, J., et al. A modified relief of unilateral ureteral obstruction model. Ren Fail. 41 (1), 497-506 (2019).
- Morrissey, J., et al. morphogenetic protein-7 improves renal fibrosis and accelerates the return of renal function. J Am Soc Nephrol. 13 (suppl_1), S14-S21 (2002).
- Ulm, A. H., Miller, F. An operation to produce experimental reversible hydronephrosis in dogs. J Urol. 88, 337-341 (1962).
- Park, H. C., et al. Postobstructive regeneration of kidney is derailed when surge in renal stem cells during course of unilateral ureteral obstruction is halted. Am J Physiol Renal Physiol. 298 (2), F357-F364 (2010).
- Forni, L. G., et al. Renal recovery after acute kidney injury. Intensive Care Med. 43 (6), 855-866 (2017).
- Varela, S., Omling, E., Borjesson, A., Salo, M. Resolution of hydronephrosis after pyeloplasty in children. J Pediatr Urol. 17 (1), e101-e102.e7 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon