Method Article
가역적 일방적 요관 폐색의 미성숙한 쥐 모델(An Immature Murine Model of Reversible Unilateral Ureteral Obstruction)
요약
본 프로토콜은 편측 요관 폐색의 단계적이고 재현 가능한 모델을 설명합니다.
초록
편측성 요관 폐쇄(UUO)는 만성 신장 질환(CKD)의 흔한 원인으로, 신장 간질성 섬유증의 진행을 초래하고 궁극적으로 돌이킬 수 없는 신장 손상을 초래합니다. UUO의 완화는 매우 중요합니다. 가역적 편측 요관 폐색(RUUO)에 대한 여러 동물 모델이 문헌에 확립되어 구조적 변화 및 기능적 손상을 관찰하는 동시에 요관 폐색의 완화에 따른 생리학적 및 병태생리학적 변화를 시뮬레이션할 수 있습니다. 본 연구에서는 실리콘 튜브를 이용하여 편측 쥐 요관에 가역적 폐색 모델을 확립하였다. 폐색이 완화되기 전에 상당한 신장 손상이 관찰되었으며, 그 후 부분적인 회복이 관찰되었다. UUO와 달리 이 모델은 진행성 신증을 예방하여 뚜렷한 병리학적 결과를 초래합니다. 이 간단한 수술은 높은 성공률을 보여주며 가역적 폐쇄성 신병증 및 신장 간질성 섬유증에 대한 잠재적 치료법을 조사하기 위한 고전적인 모델로서 유망합니다. 또한 폐쇄성 신병증, 신세포 재생 및 조직 리모델링의 회복 메커니즘을 연구하기 위한 실용적인 플랫폼을 제공합니다.
서문
요도 폐색은 신장 간질성 섬유증(interstitial fibrosis)과 만성 신장 질환(chronic kidney disease, CKD)을 유발하며, 잠재적으로 신장의 돌이킬 수 없는 구조적 손상과 기능 장애를 초래할 수 있다1. 편측성 요관 폐쇄(UUO)는 신장 손상 및 CKD를 연구하는 데 널리 사용되지만, 폐색체 제거 후 발생하는 자발적 회복 메커니즘을 정확하게 복제하지는 않습니다. UUO 모델은 좌측 요관을 봉합사로 결찰하여 영구적인 폐색, 요관 확장, 신증, 신장 실질 압박 및 피질 얇아짐을 초래합니다. 조직학적 검사에서는 일반적으로 세뇨관 확장, 세뇨관 상피 세포 괴사, 진행성 간질 염증 및 섬유증이 밝혀진다2. 이 모델은 주로 신장 간질성 섬유증과 지속적인 폐색으로 인한 비가역적 신장 기능 상실을 조사합니다.
그러나 요관 결석이나 종양으로 인한 폐색과 같이 임상 실습에서 접하는 많은 신장 질환은 되돌릴 수 있습니다. 가역적 편측 요관 폐쇄(RUUO) 모델은 신장 구조와 요로 기능의 부분적 복원을 허용하여 궁극적으로 신증을 해결합니다. 영상 기법, 조직학적 검사 및 바이오마커 분석을 통해 회복을 평가하여 신장 손상 및 섬유증의 감소를 정량화할 수 있습니다3. 이 모델은 임상 환경에서 폐쇄성 신병증의 회복 단계를 밀접하게 모방하며 염증, 면역 반응, 세포 재생 및 조직 리모델링과 같은 주요 과정을 연구하는 데 UUO보다 더 적합합니다 4,5,6,7,8.
RUUO 모델을 통해 연구자들은 부상 완화 후 신장 복구 및 재생을 분석하여 동적 연구에서 UUO의 한계를 해결할 수 있습니다. 폐색 전후의 다양한 시점을 비교함으로써 연구자들은 염증, 세포사멸, 섬유증 및 재생을 포함하여 손상 및 복구와 관련된 분자 경로를 조사할 수 있습니다. 이 접근법은 신장 회복 메커니즘에 대한 이해를 높이고 잠재적인 치료 표적을 식별합니다 2,3,4,5,8,9,10. 신장 섬유증은 종종 돌이킬 수 없는 것으로 간주되지만, 임상 관찰에 따르면 초기 섬유증 단계에서 폐색이 조기에 완화되면 질병 진행을 멈추거나 역전시킬 수 있습니다. RUUO 모델은 이러한 현상을 조사하기 위한 귀중한 실험 플랫폼을 제공합니다11.
또한, RUUO 모델은 폐색 완화 후 섬유증 역전의 연구를 촉진하여 회복 메커니즘과 잠재적인 항섬유화 요법에 대한 통찰력을 제공합니다 3,4. 결과적으로 이 모델은 중개 연구에 매우 실용적입니다. 이 실험 모델의 주요 목적은 요관 삽관술을 통해 폐쇄성 신병증을 유도한 다음 일관성을 보장하기 위해 미리 정의된 시점에서 표준화된 완화를 수행하는 것입니다. 단순성, 재현성 및 안전성에 최적화되어 있어 실험 연구에 효과적인 도구입니다.
프로토콜
이 동물 연구는 헬싱키 선언의 지침을 준수했으며 충칭 의과 대학 아동 병원 연구 윤리 위원회의 승인을 받았습니다. 총 27마리의 수컷 Sprague Dawley(SD) 쥐를 상업적으로 획득하여 충칭 의과대학 아동병원 실험동물센터(SPF, 라이선스 번호: SYXK (Chongqing) 2007-0016)에 보관했습니다. 쥐는 12시간의 라이트/다크 사이클로 제어된 온도 조건에서 유지되었으며 음식과 물에 임시로 접근할 수 있었습니다.
이 프로토콜은 6-8주 령의 수컷 SD 쥐를 대상으로 수행되었으며 양측 요관이 있는 모든 연령의 쥐에 적용할 수 있습니다. 이 연구에서는 6주 된 수컷 SD 쥐 15마리를 토착 그룹(n = 5), UUO 그룹(n = 5), RUUO 그룹(n = 5)의 세 그룹에 무작위로 할당했습니다. 또한, 8주 된 SD 쥐 5마리(n=5)를 추가 대조군으로 포함시켰다. RUUO 모델을 확립하기 위해 12마리의 쥐를 사용했으며, 수술 중 및 수술 후 사망률, 수술 실패, 불완전한 폐색 및 실패한 역전과 같은 잠재적 위험을 설명하기 위해 7마리의 쥐를 추가로 조달했습니다. 이를 통해 후속 분석을 위해 그룹당 최소 5마리의 쥐를 확보할 수 있었습니다.
모든 수술 절차는 실험실 동물 관리 및 사용에 대한 기관 및 국가 지침에 따라 엄격하게 수행되었습니다. 수술진은 수술용 마스크, 장갑, 가운을 포함한 개인 보호 장비(PPE) 프로토콜을 준수했습니다. 각 절차에는 멸균 수술 기구가 사용되었으며 무균 상태를 유지하기 위해 사용 전후에 고압멸균 처리되었습니다. 날카로운 물건 및 생물학적 표본을 포함한 폐기물은 오염 위험을 완화하고 안전을 보장하기 위해 유해 폐기물 관리 프로토콜에 따라 처리되었습니다.
1. 동물 및 기구 준비
- 멸균(오토클레이브) 기구 및 소모품을 사용하여 모든 절차를 수행합니다. 멸균된 실리콘 튜브(내경: 1.5mm, 외경: 2.5mm)를 약 1cm 크기로 자릅니다. 나중에 사용할 수 있도록 튜브 벽의 한쪽을 따라 세로로 절개합니다.
- 펜토바르비탈(40mg/kg)의 복강내 주사를 통해 쥐를 마취합니다(기관에서 승인된 프로토콜에 따름). 발가락이 꼬집힐 때 페달 철수 반사와 같은 반사 반응이 없는지 확인하여 적절한 마취를 확인하십시오. 마취 중 각막이 건조해지는 것을 방지하기 위해 수의학 안과 연고를 눈에 바르십시오.
- 쥐의 복부를 xiphoid process에서 치골 symphysis까지 제모하고 양측으로 정중선까지 확장하십시오.
- 가열된 수술 패드 위에 쥐를 누운 자세로 놓고 고무 로프로 팔다리를 고정합니다.
- 멸균 필드를 유지하기 위해 멸균 천공 시트를 드레이핑합니다. 포비돈 요오드 용액으로 피부를 준비합니다. 복부를 따라 정중선 피부를 절개하여 배꼽 바로 아래까지 확장하여 신장과 상부 요관이 적절하게 노출되도록 합니다.
- 수술용 가위를 사용하여 정중선을 따라 피하 조직과 근막을 절개합니다. 피부와 기저 조직을 층층이 꼼꼼하게 절개하고 조직 겸자를 사용하여 후복막 공간을 완전히 노출시킵니다.
2. 가역적 편측 요관 폐색에 대한 폐쇄 수술
- 좌측 요관을 직접 볼 수 있도록 멸균 면봉을 사용하여 장을 복강 오른쪽으로 후퇴시킵니다. 건조를 방지하기 위해 식염수에 적신 거즈로 요관을 덮습니다.
- 현미경 겸자를 사용하여 좌측 요관을 절개하고 동원하여 주변 조직으로부터 약 1.5cm를 분리합니다.
- 1cm 길이의 실리콘 튜브(내경: 1.5mm, 외경: 2.5mm)를 비우는 요관 아래에 놓습니다. 집게를 사용하여 튜브 내부를 완전히 감싸십시오.
- 실리콘 튜브와 요관의 중간 부분을 3-0 명사를 사용하여 접합하여 요관 폐색을 유도합니다. 과도한 접합력을 피하십시오. 요관의 세로축을 따라 실리콘 튜브를 서서히 당겨 안전하지만 미끄러지지 않는 결찰을 보장합니다.
- 복막강 내에서 장을 조심스럽게 재배치하여 긴장이나 방해 없이 적절한 정렬을 보장합니다.
- 2-0 비흡수성 봉합사와 구부러진 절단 바늘을 사용하여 복부 근육과 근막층을 연속적으로 봉합하여 적절한 인장 강도를 제공합니다. 4-0 비흡수성 봉합사로 피부를 닫고 해부학적 정렬과 균일한 긴장을 보장하여 치유를 촉진하고 상처 탈락의 위험을 최소화합니다.
- 절개 부위를 포비돈 요오드 용액으로 소독합니다. 쥐가 7일 동안 일정한 온도에서 통제된 조건에서 회복할 수 있도록 합니다.
3. 가역적 편측 요관 폐색의 완화 수술
- 필요한 동물과 기구를 준비하여 복부 재개방 및 복강의 완전한 노출을 위한 멸균 설정을 보장합니다.
- 메스 칼날을 사용하여 실리콘 튜브의 매듭을 조심스럽게 절개합니다. 튜브를 제거하고 복강에 생리식염수를 세척하여 유착 및 감염 위험을 최소화합니다.
- 장의 위치를 조정하고 4-0 비흡수성 봉합사를 사용하여 복벽 절개 부위를 여러 겹으로 봉합합니다. 절개 부위를 포비돈 요오드 용액으로 소독합니다. 수술 후 7일의 회복 기간 동안 쥐를 온도가 조절된 환경에 두십시오.
- 수술 후 14일째에 쥐를 마취하고(1.2단계에서 언급한 절차에 따라) 신장을 두 반으로 가로로 절편하여 신장 샘플을 채취한다9.
- 조직 병리학 검사를 위해 4 % 파라 포름 알데히드에 절반을 보관하고 후속 분자 분석을 위해 -80 °C에서 보관하기 위해 다른 절반을 액체 질소에 빠르게 동결시킵니다. 생화학 분석을 위한 혈액 샘플을 수집합니다.
- CO2 질식을 통한 안락사를 수행한 후 윤리 지침에 따라 자궁경부 탈구를 수행합니다.
4. 후속 평가
- RUUO 후 체중을 추적하여 전반적인 회복을 평가합니다. 체중 변화를 대조군 및 UUO 그룹과 비교합니다.
- 신장 무게와 신장 용적을 측정하여 신장 회복을 평가합니다.
- 신장 기능 개선의 지표로 혈청 크레아티닌(Scr) 수치 모니터링9.
- 메틸렌 블루를 신장 골반에 주입하여 요관 개통을 확인합니다. 요관 연동 운동과 착색을 관찰하여 폐색 후 회복을 평가합니다.
- RUUO 8,10 이후 세뇨관 무결성 및 신장 구조를 평가하기 위해 H&E 염색을 수행합니다.
- 신장 간질성 섬유증 퇴행을 평가하기 위해 Masson의 삼색 염색을 실시합니다 8,10.
- 조직 회복을 정량화하기 위해 UUO와 RUUO 그룹 간의 신장 손상 점수 3,8을 비교합니다.
결과
표 1에 요약된 바와 같이 체중, 신장 중량, 신장 용적 및 혈청 크레아티닌(Scr) 수치에 대한 UUO 및 후속 방출(RUUO)의 효과를 평가했습니다. 데이터는 평균 ± 표준 편차(SD)로 표시되며 그룹당 n = 5입니다.
6주가 되었을 때 토착 그룹은 평균 체중 234g ± 16g, 신장 체중 0.9107g ± 0.0475g, 신장 부피 0.8962cm³ ± 0.0502cm³를 보였습니다. 8주가 지났을 때, 대조군은 체중(291 g ± 20 g, P < 0.05), 신장 중량(1.1443 g ± 0.0687 g, P < 0.05), 신장 용적(1.1340 cm³ ± 0.0392 cm³, P > 0.05)에서 Scr 수치가 18.07 μmol/L ± 2.17 μmol/L로 유의하게 증가하였다.
8주 UUO 그룹은 신장 중량(2.5535g ± 0.2587g, P < 0.01)과 신장 용적(2.8533cm³ ± 0.3870cm³, P < 0.01)이 유의하게 증가하여 상당한 신장 비대를 보였다. 체중은 대조군보다 약간 낮았고(280g ± 17g, P < 0.05), Scr 수치도 증가(20.02μmol/L ± 1.36μmol/L, P < 0.05)로 신장 기능 장애가 있음을 나타냈다.
8주 RUUO 투여군에서 신장 중량(1.5178g ± 0.1305g, P < 0.05)과 신장 용적(1.6183cm³ ± 0.0906cm³, P < 0.05)은 UUO 투여군보다 낮았으나 대조군에 비해 높은 수준을 유지했으며, 신장 용적(P < 0.05)에서만 주목할 만한 유의성이 관찰되었다. Scr 수준(16.42μmol/L ± 4.03μmol/L, P < 0.05)은 UUO 그룹에 비해 감소했지만 기준선으로 완전히 복귀하지는 않았습니다. 체중(288g ± 12g, P > 0.05)은 UUO 그룹보다 높았지만 대조군보다는 약간 낮게 유지되었습니다.
신장과 신장 골반의 형태는 요관 폐색 이후 상당한 변화를 겪었습니다. 폐색 부위 위에서는 요관과 신장 골반이 현저하게 확장되었으며, 신장이 커지고 신장 피질과 수질이 눈에 띄게 얇아졌습니다. 요관 폐색의 재개통 후 요관과 신장 골반의 확장이 상당히 감소했지만 약간의 잔류 확장이 관찰되었습니다(그림 1).
요관 개통을 평가하기 위해 인슐린 바늘(0.33mm × 12.7mm)을 사용하여 0.1mL의 메틸렌 블루를 신장 골반에 주입했습니다. 염료가 요관 막힘을 통과하지 못했을 때 완전한 폐색이 확인되었습니다. 폐색 제거 전에 RUUO가 있는 쥐의 신장 골반 및 요관에 메틸렌 블루를 주입한 결과는 그림 2A에 나와 있습니다. 실리콘 튜브를 제거한 후 결찰 부위의 요관은 붉은색을 나타내고(그림 2B) 정상적인 연동 운동을 보였는데, 이는 이 기술이 요관 손상을 최소화했음을 시사합니다.
정상 신장에 대한 조직학적 분석은 사구체를 둘러싼 조밀하고 건강한 세뇨관을 밝혀냈습니다(그림 3, 왼쪽). UUO 후 14일 후, 근위세뇨관 상피는 액포 및 퇴행, 덤불 테두리 상실 및 각질 제거를 보였습니다. 내강 내에서 괴사 세포가 관찰되었습니다. 원위세뇨관이 확장된 것처럼 보였고, 일부 세뇨관이 없었으며, 채혈관이 팽창하여 신장 피질이 얇아졌습니다(그림 3).
Masson의 트리크롬 염색은 신장 간질성 섬유증을 평가하는 데 사용되었으며, 파란색 염색 콜라겐 섬유는 섬유화 변화를 나타냅니다12. 이 방법은 세포, 콜라겐 섬유 및 기타 조직 구성 요소를 효과적으로 분화합니다. UUO 모델에서는 14일 후 신장 간질에서 콜라겐 섬유의 상당한 증가가 관찰되었으며, 이는 뚜렷한 간질성 섬유증을 나타냅니다(그림 4). 대조적으로, RUUO 모델은 콜라겐 섬유의 눈에 띄는 감소를 보여주었으며, 이는 섬유화가 완화되거나 지연되었음을 시사합니다.
신장 손상 점수(그림 5)에 따르면, UUO 그룹은 심각한 신장 손상을 보인 반면, RUUO 그룹은 중등도의 신장 손상을 보였다. 그림 5에서 볼 수 있듯이, 신장 손상 점수는 원래 그룹에 비해 UUO 그룹에서 유의하게 높았습니다(P < 0.0001). RUUO 그룹은 UUO 그룹에 비해 신장 손상 점수가 현저히 낮았다(P < 0.05). 그러나 점수는 네이티브 그룹에 비해 유의하게 높게 유지되었습니다(P < 0.001). 전반적으로 RUUO 그룹의 신장 손상은 UUO 그룹에 비해 유의하게 완화되었다(P < 0.05).

그림 1: 네이티브, UUO(14일) 및 RUUO 신장의 대표적인 조직학. 천연 신장과 비교했을 때, 14일 동안 UUO를 투여한 결과 신장 용적이 눈에 띄게 증가했는데, 이는 신장 피질과 수질 두께의 감소와 함께 신장 골반과 근위 요관의 현저한 확장을 특징으로 합니다. 대조적으로, RUUO 그룹(오른쪽 패널)의 신장 용적은 UUO 그룹(중간 패널)에 비해 현저히 감소했으며, 신장 골반과 요관의 뚜렷한 수축이 있었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 메틸렌 블루 주입 및 실리콘 튜브 제거 후 요관 시각화. (A) RUUO 7일 째 되는 날, 메틸렌 블루를 신장 골반에 주입한 후 실리콘 튜브 위의 요관에서 염색이 관찰된 반면 결찰 부위 아래 부분은 염색되지 않은 상태로 유지되었습니다. (B) 요관은 실리콘 튜브를 제거한 후 붉은색을 띱니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 네이티브, UUO 및 RUUO 신장의 대표적인 조직학. UUO 신장은 근위세뇨관의 브러시 경계 손실, 상당한 세뇨관 내강 확장, 퇴행, 박리 및 세뇨관 상피 세포의 분해, 기저막 노출을 나타내며 이는 뚜렷한 급성 세뇨관 손상을 나타냅니다. RUUO 신장의 확장된 신장 세뇨관의 수는 UUO 신장보다 현저히 적으며, 이는 부분적인 세뇨관 회복의 증거를 제공합니다. 상부 패널 : 스케일 바 = 100 μm; 하단 패널(삽입 사진): 스케일 바 = 16μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
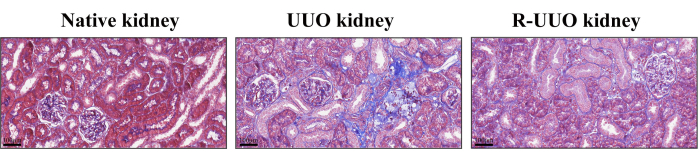
그림 4: Masson의 네이티브, UUO 및 RUUO 신장의 삼색 염색. 파란색으로 얼룩진 부분은 콜라겐 섬유를 나타냅니다. UUO 신장은 천연 신장에 비해 콜라겐 섬유의 밀도가 더 높았습니다. 대조적으로, RUUO 신장은 UUO 신장에 비해 콜라겐 섬유 밀도가 현저히 감소하여 간질성 섬유증이 완화되었음을 나타냅니다. 상단 패널: 스케일 바 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 네이티브, UUO 및 RUUO 신장의 세뇨관 손상 점수. 헤마톡실린 및 에오신(HE) 염색에 기초하여, 세뇨관 괴사에 대한 반정량적 척도를 사용하여 신장 조직의 조직학적 변화를 점수화했습니다: 0 = 정상 신장, 1 = 최소 괴사(≤5% 침범), 2 = 경증 괴사(5%-25% 침범), 3 = 중등도 괴사(25%-50% 침범), 4 = 심한 괴사(50%-75% 침범), 5 = 가장 심한 괴사(>75% 침범). y축은 신장 손상 점수를 나타내고 x축은 실험 그룹을 나타냅니다. 모국어 그룹에 비해 UUO 그룹은 현저하게 높은 신장 손상 점수를 보였다(P < 0.0001). 대조적으로, RUUO 그룹은 UUO 그룹에 비해 신장 손상 점수가 현저히 낮았다(P < 0.05). 그러나 모국어 그룹과 비교했을 때, RUUO 그룹은 여전히 현저하게 높은 신장 손상 점수를 보였다(P < 0.001). 전반적으로 UUO 그룹은 심각한 신장 손상을 보인 반면, RUUO 그룹은 중등도의 신장 손상을 보였다. RUUO 그룹의 신장 손상은 UUO 그룹에 비해 유의하게 완화되었다(P < 0.05). 통계적 유의성은 *P < 0.05, ***P < 0.001, ****P < 0.0001로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 그룹 | 체중 (g) | 신장 무게 (g) | 신장 용적(cm³) | 혈청 크레아티닌 (μmol/L) |
| 네이티브 (6주) | 234 ± 16ᅡ | 0.91 ± 0.05암페어 | 0.90 ± 0.05암페어 | 해당 사항 없음* |
| 대조군(8주) | 291 ± 20*B | 1.14 ± 0.07*b | 1.13 ± 0.04암페어 | 18.07 ± 2.17*b |
| UUO (8주) | 280 ± 17*C | 2.55 ± 0.26**c | 2.85 ± 0.39**c | 20.02 ± 1.36*씨 |
| RUUO (8주) | 288 ± 12*B | 1.52 ± 0.13*b | 1.62 ± 0.09**b | 16.42 ± 4.03암페어 |
표 1: 체중, 신장 무게, 신장 용적, 혈청 크레아티닌 수치(그룹별 기준). 데이터는 평균 ± 표준 편차(SD)로 표시되며 그룹당 n = 5입니다. 그룹 이름은 측정 시점의 쥐의 나이와 해당 질병 모델을 나타냅니다. 통계적 비교는 Kruskal-Wallis 검정을 사용하여 수행된 후 Dunn의 다중 비교 검정을 수행했습니다. 서로 다른 위 첨자(a, b, c)는 그룹(P < 0.05) 간에 통계적으로 유의미한 차이를 나타내며, 동일한 문자를 공유하는 그룹은 유의하게 다르지 않은 반면 다른 문자를 가진 그룹은 유의한 차이를 나타냅니다. 대조군(혈청 크레아티닌 제외)과의 직접 비교를 위해 통계적 유의성은 P < 0.05 x (*), P < 0.01 (**)로 표시됩니다. *N/A: 혈청 크레아티닌은 토종(생후 6주) 그룹에서 측정되지 않았습니다. 토착 그룹과 비교했을 때, 대조군은 체중과 신장 무게가 모두 유의하게 증가했으며(P < 0.05), 이는 8주 된 쥐와 그들의 신장에서 주목할 만한 성장과 발달을 나타냈다. 대조군의 신장 용적도 증가했지만, 그 차이는 통계적으로 유의하지 않았다(P > 0.05). 대조군과 비교했을 때, UUO 그룹은 체중이 통계적으로 유의하게 감소한 반면(P < 0.05), 신장 중량과 신장 용적은 유의하게 증가했다(P < 0.01). 혈청 크레아티닌 수치도 UUO 그룹에서 유의하게 증가했다(P < 0.05). UUO 그룹과 비교했을 때, RUUO 그룹은 체중이 통계적으로 유의하게 증가하고(P < 0.05), 신장 무게, 신장 용적, 혈청 크레아티닌 수치가 유의하게 감소(P < 0.05)했으며, 특히 혈청 크레아티닌의 감소가 두드러졌다. 대조군에 비해 RUUO 그룹은 신장 용적의 유의한 증가(P < 0.01)와 혈청 크레아티닌 수치의 현저한 감소(P < 0.05)를 보인 반면, 체중과 신장 무게의 차이는 유의하지 않았다. 전반적으로 UUO 그룹은 대조군에 비해 신장 무게, 신장 용적 및 혈청 크레아티닌 수치가 증가한 반면, RUUO 그룹은 이러한 매개변수에서 회복을 보였으며 모든 차이는 통계적으로 유의했습니다(P < 0.05).
토론
이 모델은 실리콘 튜브를 사용하여 요관을 둘러싸고 구조적 지지를 제공한 다음 견주실로 결찰하여 압박을 통해 요관을 완전히 폐쇄합니다. 7일 후, 신장 감압술과 요로 무결성 및 기능 회복을 촉진하기 위해 결찰과 실리콘 튜브를 제거합니다.
실리콘 엘라스토머로 제조된 실리콘 튜브는 뛰어난 유연성, 생체 적합성, 내화학성 및 열 안정성을 제공합니다. 의료용 실리콘 고무는 장기 이식을 포함하여 우수한 기계적 특성이 필요한 응용 분야를 위해 특별히 설계된 반면, 일반 실리콘 튜브는 탄성, 경도 및 생체 적합성 프로파일이 다를 수 있는 다양한 상용 변형을 포함합니다13. 이 연구에서 짧은 실험 기간(7-14일)과 지속적인 기계적 응력이 없다는 점을 감안할 때 적절한 생체 적합성, 적절한 탄성 및 비용 효율성으로 인해 쥐 요관 폐쇄 모델을 설정하기 위해 실리콘 튜브가 선택되었습니다. 따라서 두 재료 모두 기능적 동등성을 나타내며 본 연구에서 상호 교환적으로 사용할 수 있습니다.
폐색의 지속 기간은 RUUO 신장 회복에 중요한 요소이며, 연구에 따르면 7일째에 폐색이 완화되면 신장 손상이 부분적으로 완화될 수 있는 반면, 14일째 이후에는 유의미한 회복이 관찰되지않습니다. 7. RUUO 모델에서 요관 폐색의 최적 기간은 과도한 손상을 방지하고 결과가 장기간의 폐색에 의해 과도하게 영향을 받지 않도록 하기 위해 7일로 결정되었습니다. 폐색된 신장이 14일 동안 지속된 경우와 7일 후 해제된 신장을 비교하여, RUUO 및 UUO 모델에서 폐쇄성 신병증의 진행을 육안으로 조사하였다. 메틸렌 블루를 신장 골반에 주입하여 카테터 제거 전에 완전한 요관 폐색을 확인했습니다. 이 무렵 신장 골반의 현저한 확장으로 인해 폐색이 첫날이 아닌 7일 째를 검사 대상으로 선정되었으며, 이는 바늘 삽입을 용이하게 하고 1일차 인슐린 바늘 사용으로 인한 요관 손상 위험을 줄였습니다.
폐색을 완화하는 방법은 간단하고 효과적이며 잠재적인 요관 손상을 최소화하도록 설계되었습니다. 이 모델은 재개통 성공률을 높이고 요관 손상 가능성을 줄이면서 완전한 폐색을 보장합니다. RUUO 모델은 단순성, 재현성 및 구현 용이성을 특징으로 하여 신장 섬유증, 신장 재생 및 관련 메커니즘을 연구하는 데 유용한 도구입니다 14,15,16.
UUO 모델을 기반으로 하는 RUUO 모델은 이전 모델의 되돌릴 수 없는 한계를 해결합니다. UUO 모델은 UUO에 의한 신장 간질성 섬유증의 병리학적 진행을 폐색 완화 후 후속 회복과 통합함으로써 급성 신장 손상(AKI) 및 신장 섬유증의 회복 단계를 복제합니다. 이 모델은 임상적으로 폐쇄된 신장 치료 과정의 시뮬레이션을 용이하게 하고 기존 UUO 모델에 비해 세포 재생 및 세포외 기질(ECM) 리모델링에 대한 보다 포괄적인 탐색을 제공합니다.
인간을 대상으로 한 UUO를 연구하면 신장 손상, 섬유증 및 잠재적인 치료 개입의 메커니즘에 대한 귀중한 통찰력을 얻을 수 있습니다. UUO는 요도 접합부 폐쇄(UPJO), 신장 결석 또는 종양과 같은 질환으로 인한 폐쇄성 신병증을 모방하는 데 널리 사용됩니다2. 과도한 ECM 침착을 특징으로 하는 신장 섬유증은 만성 신장 질환의 특징이며, UUO 모델은 섬유증 진행에서 ECM의 역할을 연구하는 데 중요한 역할을 합니다. 이 모델은 신장 손상 과정, 특히 섬유증의 진행을 안정적으로 복제하여 신장 섬유증의 기전을 조사하기 위한 기초를 제공합니다.
연구에 따르면 폐색장애를 완화하면 섬유증의 진행을 어느 정도 완화하는 동시에 신장 혈역학 및 기능을 부분적으로 회복하고 보존할 수 있다17. 이는 신장 손상 복구에 중요한 영향을 미칩니다. 그러나 폐색의 완화가 지연되면 회복이 잘 되지 않고 신장이 더욱 악화되어 신부전으로 이어질 수 있다18. 또한 UUO는 고혈압과 관련이 있으며, 지연된 중재는 이 상태의 더 높은 발병률 및 중증도와 관련이 있습니다. 이러한 결과는 신장 손상을 최소화하고 혈압을 관리하는 데 조기 개입의 중요성을 강조합니다. 완화가 지연되면 섬유증과 신장 기능 저하가 악화될 뿐만 아니라 고혈압의 위험도 높아집니다.
이러한 맥락에서 RUUO 모델은 신장 손상 및 회복의 역동적인 특성을 조사하기 위한 유용한 도구 역할을 합니다. RUUO 모델을 사용한 연구는 요관 폐색이 일부 부상을 완화할 수 있지만 동물 및 임상 모델 모두에서 관찰된 바와 같이 지속적인 섬유증과 장기적인 손상이 남아 있음을 보여줍니다19. 따라서 RUUO 모델은 조기 개입이 돌이킬 수 없는 신장 손상을 제한하고 만성 신장 질환 및 고혈압과 같은 관련 합병증으로의 진행을 늦추는 데 어떻게 도움이 될 수 있는지 이해하는 데 필수적입니다.
여러 연구자들이 RUUO 10,14,20,21,22,23의 다양한 모델을 제안했습니다. 그러나 기존의 많은 재개통 모델에는 복잡한 수술 절차, 높은 기술 요구 사항, 일관되지 않은 결과 등 한계가 있습니다. 예를 들어, Ulm22는 성공적인 재개통을 촉진하고 비교적 간단하게 수행할 수 있는 요관 요근 매립 방법을 설명했습니다. 그러나 그 효과는 동물의 자세, 움직임 및 요근 긴장의 변화와 같은 요인에 의해 영향을 받을 수 있습니다. Park 등[23]은 비침습적 미세혈관 클립을 사용하여 10일 동안 폐색을 유도한 후 동일한 수술 방법을 사용하여 클립을 제거했습니다. 이 방법은 생체 적합성, 작동 용이성, 최소 시술 기간 및 재현성과 같은 이점을 제공하지만 장 유착과 요관 재개통 성공률을 낮출 수 있습니다.
실리콘 튜브를 사용하면 부드러움과 생체 적합성으로 주변 조직을 손상시키지 않고 요관 폐색을 허용하기 때문에 효과적인 대안을 제공합니다. 이 접근법은 조직 손상 및 염증 반응을 최소화하는 동시에 영구적인 요관 손상 없이 폐색 완화를 가능하게 합니다. 결과적으로 RUUO 모델은 가역적이고 안정적이며 장기 연구에 적합합니다.
Hesketh 등[10 ]이 채택한 방광요관 재이식 방법은 방광요관 재이식 후 병태생리학적 변화를 연구하는 데 매우 적합합니다. 그러나 이 기술은 수술 시간이 길고 과도한 장력으로 인해 요관 파열 및 박리의 위험이 있는 복잡한 수술 절차를 포함합니다. 또한, 짧아진 요관은 방광 삼각체와 성공적으로 문합되지 않아 비정상적인 재연결 및 잠재적인 수술 실패로 이어질 수 있습니다. 이러한 문제는 특히 소동물 모델에서 적용 가능성을 제한합니다.
Yao 등[16 ]은 접힌 폴리에틸렌 튜브를 사용하여 요관 클램핑과 관련된 기술을 도입했는데, 이는 요관 손상을 줄이고 안정적인 폐색을 제공합니다. 그러나 폴리에틸렌 튜브의 매끄러운 표면은 연동 운동 및 동물의 움직임으로 인해 합자 미끄러짐을 일으켜 잠재적으로 폐색을 유발할 수 있습니다. Chevalier 등9은 신생아 마우스의 왼쪽 요관에 실리콘 튜브를 삽입하여 5일간의 혈관 클램핑 후 제거했습니다. 이 모델은 효과적으로 폐색을 유도하지만, 혈관 클립의 대안으로 실실 결찰을 사용하면 신장 및 신장 골반 용적의 현저한 감소를 포함하여 유사한 결과를 얻었습니다. 또한 이 방법은 요관 주변에 최소한의 염증 및 섬유화 반응을 일으켰습니다. 폐색이 완화된 지 7일 후에 경미한 요관 확장이 관찰되었지만, 방광요관 재이식10에서 나타난 것보다는 상당히 덜 심각했다. 이 접근법은 또한 방광요관 역류를 예방하여 RUUO 연구를 위한 실행 가능한 대안이 됩니다.
이 접근법에서 주요 고려 사항은 요관 손상이 염증을 유발하여 잠재적으로 유착, 폐쇄 및 재개통 실패로 이어질 수 있으므로 수술 중 요관 손상을 최소화하는 것입니다. 방광 요관 재이식은 직접적인 요관 손상, 문합 염증 및 수술 오류로 인한 폐쇄 가능성과 같은 위험을 내포하고 있습니다. 또한 재이식 전에 소변 침전물을 적절하게 배출하지 않으면 재개통 실패의 원인이 될 수 있습니다. 실리콘 튜브를 사용하여 요관을 외부로 감싸면 보호가 제공되며, 실리콘 튜브를 통해 혈관 클립이나 실크 실로 결찰하면 요관 폐색이 유도됩니다. 그러나 혈관 클램프는 장 유착의 위험을 증가시키고 재개통 성공률을 낮출 수 있습니다. 요관 폐색 시 이틀에 한 번씩 클램프의 위치를 변경하면 재개통 성공률이 70%17 향상되는 것으로 보고되었지만, 이 방법은 시술 시간을 크게 연장하고 기술적인 문제를 야기합니다. 대조적으로, 실리콘 튜브를 통한 실실 결찰은 염증을 줄이면서 더 간단한 접근 방식을 제공합니다. 주요 관심사는 실실 결찰이 실험 대상자 전반에 걸쳐 완전한 폐색과 균일성을 보장하는지 여부입니다.
이 연구에서는 완전한 폐색을 확인하기 위해 메틸렌 블루를 요관에 주입했습니다. UUO 그룹에서는 모든 쥐가 성공적인 폐색(100% 성공률)을 달성했으며, 표준 조건에서는 폐사율이 관찰되지 않았습니다. RUUO 그룹(n=12)에서 6마리의 쥐는 합병증으로 인해 분석에서 제외되었다: 1마리는 마취로 인한 호흡 억제로 수술 중 사망했고, 2마리는 6일과 13일에 수술 후 합병증(출혈 또는 감염 의심)으로 사망했으며, 2마리는 불완전 폐색증, 1마리는 수술 합병증으로 인해 재개통 실패를 경험했다. 그 결과, RUUO 투여군의 생존율은 75%(95% CI: 46.77%-91.11%), 완전폐색 성공률은 80%(95% CI: 49.0%-94.3%), 재개통 성공률은 90%(95% CI: 59.6%-98.2%)였다. 모든 비율은 제외 후 각 분모를 사용하여 계산되었으며 95% 신뢰 구간은 Wilson 점수 방법을 사용하여 결정되었습니다.
회복은 병리학적 변화 또는 기능 장애에 따른 생리적 기능의 회복을 말합니다. 여기에는 병리학적 변화의 역전뿐만 아니라 장기 기능이 거의 정상 수준으로 복귀하는 것도 포함됩니다. 이와 대조적으로, 보존은 기존의 손상을 완전히 되돌리기보다는 추가적인 악화를 막기 위해 질병 진행 전 또는 초기에 시작되는 개입을 말한다24. 회복과 보존을 구별하기 위해서는 질병 진행 및 폐색 해결에 대한 동적 모니터링과 함께 포괄적인 기준선 신장 기능 평가가 필요합니다. 이 연구는 단기 관찰에 국한되었으며 회복 중 병리학적 마커에 대한 체계적인 모니터링을 통합하지 않았습니다. 특히, in vivo, 종방향 바이오마커는 병리학적 메커니즘의 진정한 역전을 추적하는 데 사용되지 않았습니다. 신장 조직과 신장 기능의 개선이 관찰되었지만, 이러한 변화가 완전한 병리학적 역전을 의미하는지는 불분명하다. 향후 연구에는 질병 해결을 동적으로 평가하기 위해 섬유증 바이오마커와 염증 매개체가 포함되어야 합니다.
또한, 실험 장비 및 기술의 한계로 인해, 본 연구는 신장 병태생리학의 지표로 잘 확립된 매개변수인 단백뇨와 알부민뇨를 측정하지 않았다24. 이들의 부재는 고전적인 신장 질환 모델과의 직접적인 비교를 제한할 수 있습니다. 향후 연구는 혈청 크레아티닌 및 혈액 요소 질소 측정과 함께 표준화된 소변 단백질 분석을 통합하여 신장 기능 및 손상에 대한 보다 포괄적인 평가를 제공해야 합니다.
폐색의 외과적 완화는 폐쇄성 신장 질환을 치료하기 위한 일차적인 임상 전략이다25. 이 연구는 신장 병리학적 기전의 완전한 역전을 완전히 규명하지는 못했지만, 요관 폐색해제 후 병리학적, 생리학적 변화를 조사하기 위한 귀중한 연구 모델을 제공합니다. 또한 신장 기능이 완전히 회복되었는지 아니면 부분적으로만 보존되었는지 평가할 수 있습니다.
요약하면, 이 모델은 다양한 연령의 쥐에 적용할 수 있지만, RUUO를 받는 신생아 쥐에게는 적절한 실리콘 튜브 선택 및 요관 손상 방지를 포함하여 특별한 주의가 필요합니다. 재개통 실패를 방지하기 위해 과도한 결찰은 피해야 합니다. 이 모델은 간단하고 안정적이며 실현 가능하면서도 유사한 재개통 효능을 보여주기 때문에 염증 및 면역 과정, 신장 재생 및 관련 메커니즘을 연구하는 데 매우 적합하며 추가 연구에 상당한 잠재력이 있습니다.
공개
없음.
감사의 말
이 작업은 충칭 의과대학(Chongqing Medical University, W0056), 충칭 과학 및 보건 공동 TCM 기술 혁신 및 응용 개발 프로젝트(2020ZY023877)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Forceps | Shanghai Medical Devices Co.,Ltd | 20220032 | |
| Gauze | Sichuan Kelun Co., Ltd | 20172140152 | |
| Hematoxylin and Eosin Stain Kit | Solarbio | G1120 | |
| Insulin needles | KDL Medical Devices | 20193140938 | |
| Masson’s Trichrome Stain Kit | Solarbio | G1340 | |
| Medical Cotton balls | Sichuan Kelun Co., Ltd | 20170037 | |
| Medical Cotton sticks | Sichuan Kelun Co., Ltd | 20172140026 | |
| Methylene blue | Tianjin Dengfeng Chemical Reagent Factory | 14038-43-8 | |
| Microscopic forceps | Suqian Shifeng Medical Devices Co., Ltd | S50985 | |
| Needle holders | Suqian Shifeng Medical Devices Co., Ltd | S7005 | |
| Povidone-iodine Solution | Sichuan Kelun Co., Ltd | 514001 | |
| Saline | Sichuan Kelun Co., Ltd | 20220004 | |
| SD Rats | SPF(Beijing)Biotechnology Co.,Ltd | D025 | |
| Silicone tubing | Taizhou Chunshi New Materials Co., Ltd | CS356 | |
| Silk suture | Qiangsheng Medical Devices Co.,Ltd | SA84G | |
| Surgical blade | Huanan Yunyue Medical Devices Co.,Ltd | CE0434 | |
| Surgical scissors | Shanghai Medical Devices Co.,Ltd | J21130 | |
| Syringe | Tongmai medical devices | 20183140304 | |
| Tissue Forceps | Jiangxi Yuyuan Medical Equipment Co., Ltd | J36030 |
참고문헌
- Chaves, L. D., et al. Contrasting effects of systemic monocyte/macrophage and CD4+ t cell depletion in a reversible ureteral obstruction mouse model of chronic kidney disease. Clin Dev Immunol. 2013, 836989(2013).
- Chevalier, R. L., Forbes, M. S., Thornhill, B. A. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney Int. 75 (11), 1145-1152 (2009).
- Aranda-Rivera, A. K., et al. Sulforaphane protects from kidney damage during the release of unilateral ureteral obstruction (RUUO) by activating nuclear factor erythroid 2-related factor 2 (nrf2): Role of antioxidant, anti-inflammatory, and antiapoptotic mechanisms. Free Radic Biol Med. 212, 49-64 (2024).
- Narváez Barros, A., et al. Reversal unilateral ureteral obstruction: A mice experimental model. Nephron. 142 (2), 125-134 (2019).
- Cochrane, A. L., et al. Renal structural and functional repair in a mouse model of reversal of ureteral obstruction. J Am Soc Nephrol. 16 (12), 3623-3630 (2005).
- Kaeidi, A., et al. The therapeutic approaches of renal recovery after relief of the unilateral ureteral obstruction: A comprehensive review. Iran J Basic Med Sci. 23 (11), 1367-1373 (2020).
- Liu, Y., et al. A porcine model of relief of unilateral ureteral obstruction: Study on self-repairing capability over multiple time points. Mol Cell Biochem. 419 (1-2), 115-123 (2016).
- Puri, T. S., et al. Chronic kidney disease induced in mice by reversible unilateral ureteral obstruction is dependent on genetic background. Am J Physiol Renal Physiol. 298 (4), F1024-F1032 (2010).
- Chevalier, R. L., Kim, A., Thornhill, B. A., Wolstenholme, J. T. Recovery following relief of unilateral ureteral obstruction in the neonatal rat. Kidney Int. 55 (3), 793-807 (1999).
- Hesketh, E. E., et al. A murine model of irreversible and reversible unilateral ureteric obstruction. J Vis Exp. (94), e52559(2014).
- Klahr, S., Morrissey, J. Obstructive nephropathy and renal fibrosis. Am J Physiol Renal Physiol. 283 (5), F861-F875 (2002).
- Jin, B., et al. Loss of men1 leads to renal fibrosis and decreases HGF-ADAMTS5 pathway activity via an epigenetic mechanism. Clin Transl Med. 12 (8), e982(2022).
- Fischer, N. G., He, J., Aparicio, C. Surface immobilization chemistry of a laminin-derived peptide affects keratinocyte activity. Coatings (Basel). 10 (6), 560(2020).
- Song, J., et al. Losartan accelerates the repair process of renal fibrosis in UUO mouse after the surgical recanalization by upregulating the expression of tregs. Int Urol Nephrol. 51 (11), 2073-2081 (2019).
- Song, J., et al. Regulatory t cells accelerate the repair process of renal fibrosis by regulating mononuclear macrophages. Am J Med Sci. 361 (6), 776-785 (2021).
- Yao, Y., et al. Interferon-γ improves renal interstitial fibrosis and decreases intrarenal vascular resistance of hydronephrosis in an animal model. Urology. 77 (3), e768-e761.e713 (2011).
- Chevalier, R. L., Thornhill, B. A., Chang, A. Y., Cachat, F., Lackey, A. Recovery from release of ureteral obstruction in the rat: Relationship to nephrogenesis. Kidney Int. 61 (6), 2033-2043 (2002).
- Lucarelli, G., et al. Delayed relief of ureteral obstruction is implicated in the long-term development of renal damage and arterial hypertension in patients with unilateral ureteral injury. J Urol. 189 (3), 960-965 (2013).
- Ito, K., et al. Renal damage progresses despite improvement of renal function after relief of unilateral ureteral obstruction in adult rats. Am J Physiol Renal Physiol. 287 (6), F1283-F1293 (2004).
- Song, J., et al. A modified relief of unilateral ureteral obstruction model. Ren Fail. 41 (1), 497-506 (2019).
- Morrissey, J., et al. morphogenetic protein-7 improves renal fibrosis and accelerates the return of renal function. J Am Soc Nephrol. 13 (suppl_1), S14-S21 (2002).
- Ulm, A. H., Miller, F. An operation to produce experimental reversible hydronephrosis in dogs. J Urol. 88, 337-341 (1962).
- Park, H. C., et al. Postobstructive regeneration of kidney is derailed when surge in renal stem cells during course of unilateral ureteral obstruction is halted. Am J Physiol Renal Physiol. 298 (2), F357-F364 (2010).
- Forni, L. G., et al. Renal recovery after acute kidney injury. Intensive Care Med. 43 (6), 855-866 (2017).
- Varela, S., Omling, E., Borjesson, A., Salo, M. Resolution of hydronephrosis after pyeloplasty in children. J Pediatr Urol. 17 (1), e101-e102.e7 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유