Method Article
Ein unreifes Mausmodell einer reversiblen einseitigen Harnleiterobstruktion
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt ein schrittweises, reproduzierbares Modell der einseitigen Harnleiterobstruktion.
Zusammenfassung
Die einseitige Harnleiterobstruktion (UUO) ist eine häufige Ursache für chronische Nierenerkrankungen (CKD), die zum Fortschreiten der interstitiellen Nierenfibrose und schließlich zu irreversiblen Nierenschäden führt. Die Linderung von UUO ist von entscheidender Bedeutung. In der Literatur wurden mehrere Tiermodelle der reversiblen einseitigen Harnleiterobstruktion (RUUO) etabliert, die die Beobachtung von strukturellen Veränderungen und funktionellen Schäden ermöglichen und gleichzeitig physiologische und pathophysiologische Veränderungen nach der Linderung der Harnleiterobstruktion simulieren. In dieser Studie wurde ein reversibles Obstruktionsmodell im unilateralen murinen Harnleiter mit Hilfe eines Silikonschlauchs etabliert. Vor der Linderung der Obstruktion wurde eine signifikante Nierenschädigung beobachtet, danach wurde eine teilweise Genesung festgestellt. Im Gegensatz zu UUO verhindert dieses Modell eine fortschreitende Hydronephrose, was zu unterschiedlichen pathologischen Ergebnissen führt. Dieses einfache chirurgische Verfahren weist eine hohe Erfolgsquote auf und ist vielversprechend als klassisches Modell für die Untersuchung der reversiblen obstruktiven Nephropathie und mögliche Behandlungen der interstitiellen Nierenfibrose. Darüber hinaus bietet es eine praktische Plattform für die Untersuchung der Mechanismen der Genesung von obstruktiver Nephropathie, der Regeneration von Nierenzellen und des Gewebeumbaus.
Einleitung
Eine Harnröhrenobstruktion trägt erheblich zur interstitiellen Nierenfibrose und chronischen Nierenerkrankung (CKD) bei, was möglicherweise zu irreversiblen strukturellen Schäden und Funktionsbeeinträchtigungen in der Niere führt1. Während die einseitige Harnleiterobstruktion (UUO) häufig zur Untersuchung von Nierenschäden und CKD eingesetzt wird, repliziert sie nicht genau die spontanen Erholungsmechanismen, die nach der Entfernung einer Obstruktion auftreten. Beim UUO-Modell wird der linke Harnleiter mit Nähten ligiert, was zu einer dauerhaften Obstruktion, Harnleitererweiterung, Hydronephrose, Kompression des Nierenparenchyms und kortikaler Ausdünnung führt. Die histologische Untersuchung zeigt typischerweise eine tubuläre Dilatation, eine tubuläre Epithelzellnekrose sowie eine progressive interstitielle Entzündung und Fibrose2. Dieses Modell untersucht hauptsächlich die interstitielle Fibrose der Nieren und den irreversiblen Verlust der Nierenfunktion aufgrund einer persistierenden Obstruktion.
Viele Nierenerkrankungen, die in der klinischen Praxis auftreten, wie z. B. Obstruktionen durch Harnleitersteine oder Tumore, sind jedoch reversibel. Das Modell der reversiblen unilateralen Harnleiterobstruktion (RUUO) ermöglicht die teilweise Wiederherstellung der Nierenstruktur und der Harnwegsfunktion, wodurch letztendlich die Hydronephrose behoben wird. Die Genesung kann durch bildgebende Verfahren, histologische Untersuchungen und Biomarkeranalysen beurteilt werden, um die Verringerung von Nierenschäden und Fibrose zu quantifizieren3. Dieses Modell ahmt die Erholungsphase der obstruktiven Nephropathie im klinischen Umfeld genau nach und eignet sich besser als UUO für die Untersuchung von Schlüsselprozessen wie Entzündungen, Immunreaktionen, Zellregeneration und Gewebeumbau 4,5,6,7,8.
Das RUUO-Modell ermöglicht es Forschern, die Nierenreparatur und -regeneration nach der Linderung von Verletzungen zu analysieren und dabei die Einschränkungen von UUO in dynamischen Studien zu berücksichtigen. Durch den Vergleich verschiedener Zeitpunkte vor und nach der Obstruktion können Forscher molekulare Signalwege untersuchen, die an Verletzungen und Reparaturen beteiligt sind, einschließlich Entzündungen, Apoptose, Fibrose und Regeneration. Dieser Ansatz verbessert das Verständnis der Mechanismen der renalen Erholung und identifiziert potenzielle therapeutische Ziele 2,3,4,5,8,9,10. Während Nierenfibrose oft als irreversibel angesehen wird, deuten klinische Beobachtungen darauf hin, dass eine frühzeitige Linderung der Obstruktion in den Anfangsstadien der Fibrose das Fortschreiten der Krankheit stoppen oder sogar umkehren kann. Das RUUO-Modell bietet eine wertvolle experimentelle Plattform, um dieses Phänomen zu untersuchen11.
Darüber hinaus erleichtert das RUUO-Modell die Untersuchung der Fibroseumkehr nach Obstruktionslinderung und bietet Einblicke in die Erholungsmechanismen und mögliche antifibrotische Therapien 3,4. Daher ist dieses Modell für die translationale Forschung sehr praktisch. Das primäre Ziel dieses experimentellen Modells ist die Induktion einer obstruktiven Nephropathie durch Harnleiterkanülierung, gefolgt von einer standardisierten Entlastung zu einem vordefinierten Zeitpunkt, um die Konsistenz zu gewährleisten. Es ist auf Einfachheit, Reproduzierbarkeit und Sicherheit optimiert, was es zu einem effektiven Werkzeug für die experimentelle Forschung macht.
Protokoll
Diese Tierstudie entsprach den Richtlinien der Deklaration von Helsinki und wurde von der Forschungsethikkommission des Kinderkrankenhauses der Medizinischen Universität Chongqing genehmigt. Insgesamt wurden 27 männliche Sprague Dawley (SD) Ratten kommerziell beschafft und im Laboratory Animal Center des Kinderkrankenhauses der Chongqing Medical University (SPF, Lizenznummer: SYXK (Chongqing) 2007-0016) untergebracht. Die Ratten wurden unter kontrollierten Temperaturbedingungen mit einem 12-stündigen Hell-Dunkel-Zyklus gehalten und hatten ad libitum Zugang zu Futter und Wasser.
Das Protokoll wurde an männlichen SD-Ratten im Alter von 6-8 Wochen durchgeführt und ist auf Ratten jeden Alters mit bilateralen Harnleitern anwendbar. In dieser Studie wurden fünfzehn 6 Wochen alte männliche SD-Ratten nach dem Zufallsprinzip in drei Gruppen eingeteilt: die native Gruppe (n = 5), die UUO-Gruppe (n = 5) und die RUUO-Gruppe (n = 5). Zusätzlich wurden fünf 8 Wochen alte SD-Ratten (n = 5) als zusätzliche Kontrollgruppe eingeschlossen. Zur Etablierung des RUUO-Modells wurden 12 Ratten verwendet, wobei 7 zusätzliche Ratten beschafft wurden, um potenzielle Risiken wie intraoperative und postoperative Mortalität, chirurgische Misserfolge, unvollständige Obstruktion und erfolglose Umkehrung zu berücksichtigen. Dies stellte sicher, dass mindestens 5 Ratten pro Gruppe für nachfolgende Analysen verwendet wurden.
Alle chirurgischen Eingriffe wurden in strikter Übereinstimmung mit den institutionellen und nationalen Richtlinien für die Pflege und Verwendung von Labortieren durchgeführt. Das chirurgische Personal hielt sich an die Protokolle für persönliche Schutzausrüstung (PSA), einschließlich chirurgischer Masken, Handschuhe und Kittel. Für jeden Eingriff wurden sterile chirurgische Instrumente verwendet, die vor und nach dem Gebrauch autoklaviert wurden, um die Sterilität zu erhalten. Abfallmaterialien, einschließlich scharfer Gegenstände und biologischer Proben, wurden in Übereinstimmung mit den Protokollen zur Entsorgung gefährlicher Abfälle entsorgt, um Kontaminationsrisiken zu minimieren und die Sicherheit zu gewährleisten.
1. Vorbereitung von Tieren und Instrumenten
- Führen Sie alle Eingriffe mit sterilen (autoklavierten) Instrumenten und Verbrauchsmaterialien durch. Schneiden Sie den sterilisierten Silikonschlauch (Innendurchmesser: 1,5 mm, Außendurchmesser: 2,5 mm) in ca. 1 cm lange Segmente. Machen Sie einen Längsschnitt entlang einer Seite der Rohrwand für die spätere Verwendung.
- Narkose der Ratten durch intraperitoneale Injektion von Pentobarbital (40 mg/kg) (nach institutionell anerkannten Protokollen). Bestätigen Sie eine angemessene Anästhesie, indem Sie überprüfen, ob beim Einklemmen der Zehen keine Reflexreaktionen, wie z. B. der Pedalrückzugsreflex, auftreten. Tragen Sie veterinärmedizinische Augensalbe auf die Augen auf, um ein Austrocknen der Hornhaut während der Anästhesie zu verhindern.
- Enthaaren Sie den Hinterleib der Ratte vom Processus xiphoideus bis zur Symphyse pubica und erstrecken Sie sich bilateral bis zur Mittellinie.
- Positionieren Sie die Ratte in Rückenlage auf einer beheizten Operationsunterlage und sichern Sie ihre Gliedmaßen mit Gummiseilen.
- Drapieren Sie ein steriles Fensterblatt, um ein steriles Feld zu erhalten. Bereiten Sie die Haut mit Povidon-Jod-Lösung vor. Machen Sie einen Hautschnitt in der Mittellinie entlang des Bauches, der sich von der subxiphoiden Region bis knapp unter den Nabel erstreckt, um eine ausreichende Freilegung der Nieren und oberen Harnleiter zu gewährleisten.
- Schneiden Sie das Unterhautgewebe und die Faszien entlang der Mittellinie mit einer chirurgischen Schere ein. Präparieren Sie die Haut und das darunterliegende Gewebe sorgfältig Schicht für Schicht und legen Sie den retroperitonealen Raum mit einer Gewebezange vollständig frei.
2. Obstruktive Operation bei reversibler einseitiger Harnleiterobstruktion
- Ziehen Sie den Darm mit einem sterilen Tupfer auf die rechte Seite der Bauchhöhle zurück, um die direkte Visualisierung des linken Harnleiters zu erleichtern. Decken Sie den Harnleiter mit mit Kochsalzlösung getränkter Gaze ab, um ein Austrocknen zu verhindern.
- Präparieren und mobilisieren Sie den linken Harnleiter mit einer mikroskopisch kleinen Pinzette, wobei Sie ca. 1,5 cm vom umgebenden Gewebe befreien.
- Legen Sie einen 1 cm langen Silikonschlauch (Innendurchmesser: 1,5 mm, Außendurchmesser: 2,5 mm) unter den befreiten Harnleiter. Verwenden Sie eine Pinzette, um eine vollständige Umhüllung des Rohrs zu gewährleisten.
- Lilizieren Sie den Silikonschlauch und den mittleren Teil des Harnleiters mit 3-0 Seidenfaden, um eine Harnleiterobstruktion zu induzieren. Vermeiden Sie übermäßige Ligaturkraft. Ziehen Sie den Silikonschlauch allmählich entlang der Längsachse des Harnleiters, um eine sichere, aber rutschfeste Ligatur zu gewährleisten.
- Positionieren Sie den Darm vorsichtig in der Bauchhöhle neu und sorgen Sie für eine korrekte Ausrichtung ohne Spannungen oder Verstopfungen.
- Vernähen Sie die Bauchmuskeln und Faszienschichten mit einer nicht resorbierbaren 2-0-Naht mit einer gebogenen Schneidenadel in kontinuierlicher Weise, um eine ausreichende Zugfestigkeit zu gewährleisten. Verschließen Sie die Haut mit einer nicht resorbierbaren 4-0-Naht, die eine anatomische Ausrichtung und eine gleichmäßige Spannung gewährleistet, um die Heilung zu fördern und das Risiko einer Wunddehiszenz zu minimieren.
- Desinfizieren Sie die Inzisionsstelle mit Povidon-Jod-Lösung. Lassen Sie die Ratten sich 7 Tage lang unter kontrollierten Bedingungen bei konstanter Temperatur erholen.
3. Entlastungsoperation bei reversibler einseitiger Harnleiterobstruktion
- Bereiten Sie die notwendigen Tiere und Instrumente vor und stellen Sie sicher, dass die Wiedereröffnung des Bauches und die vollständige Freilegung der Bauchhöhle steril sind.
- Präparieren Sie den Knoten des Silikonschlauchs vorsichtig mit einer Skalpellklinge. Entfernen Sie den Schlauch und spülen Sie die Bauchhöhle mit normaler Kochsalzlösung, um Adhäsion und Infektionsrisiko zu minimieren.
- Positionieren Sie den Darm neu und vernähen Sie den Bauchwandschnitt in Schichten mit 4-0 nicht resorbierbaren Nähten. Sterilisieren Sie die Inzisionsstelle mit Povidon-Jod-Lösung. Bringen Sie die Ratte für eine 7-tägige postoperative Erholungsphase in eine Umgebung mit kontrollierter Temperatur.
- Am postoperativen Tag 14 die Ratten anästhesieren (gemäß dem in Schritt 1.2 beschriebenen Verfahren) und Nierenproben entnehmen, indem die Nieren quer in zwei Hälften geschnittenwerden 9.
- Lagern Sie eine Hälfte in 4%igem Paraformaldehyd für die histopathologische Untersuchung und frieren Sie die andere Hälfte schnell in flüssigem Stickstoff ein, um sie für die anschließende molekulare Analyse bei -80 °C zu lagern. Sammeln Sie Blutproben für biochemische Analysen.
- Führen Sie Euthanasie durch CO2 -Erstickung mit anschließender Gebärmutterhalsluxation gemäß ethischen Richtlinien durch.
4. Nachfolgende Bewertungen
- Verfolgen Sie das Körpergewicht nach der RUUO, um die Gesamterholung zu beurteilen. Vergleichen Sie Gewichtsänderungen mit den Kontroll- und UUO-Gruppen.
- Messen Sie das Nierengewicht und das Nierenvolumen, um die Nierenerholung zu bewerten.
- Überwachen Sie den Serumkreatininspiegel (Scr) als Indikator für eine Verbesserung der Nierenfunktion9.
- Injizieren Sie Methylenblau in das Nierenbecken, um die Durchgängigkeit des Harnleiters zu bestätigen. Beobachten Sie die Peristaltik und Färbung des Harnleiters, um die Genesung nach der Obstruktion zu beurteilen.
- Durchführung einer H&E-Färbung zur Beurteilung der tubulären Integrität und der Nierenstruktur nach RUUO 8,10.
- Führen Sie die Masson-Trichrom-Färbung durch, um die Regression der interstitiellen Nierenfibrosezu beurteilen 8,10.
- Vergleichen Sie die Nierenschadenswerte 3,8 zwischen der UUO- und der RUUO-Gruppe, um die Gewebewiederherstellung zu quantifizieren.
Ergebnisse
Die Auswirkungen von UUO und seiner anschließenden Freisetzung (RUUO) auf das Körpergewicht, das Nierengewicht, das Nierenvolumen und die Serumkreatininspiegel (Scr) wurden bewertet, wie in Tabelle 1 zusammengefasst. Die Daten werden als Mittelwert ± Standardabweichung (SD) dargestellt, wobei n = 5 pro Gruppe ist.
Nach 6 Wochen wies die native Gruppe ein mittleres Körpergewicht von 234 g ± 16 g, ein Nierengewicht von 0,9107 g ± 0,0475 g und ein Nierenvolumen von 0,8962 cm³ ± 0,0502 cm³ auf. Nach 8 Wochen zeigte die Kontrollgruppe signifikante Zunahmen des Körpergewichts (291 g ± 20 g, P < 0,05), des Nierengewichts (1,1443 g ± 0,0687 g, P < 0,05) und des Nierenvolumens (1,1340 cm³ ± 0,0392 cm³, P > 0,05) mit einem Scr-Wert von 18,07 μmol/L ± 2,17 μmol/L.
Die 8-wöchige UUO-Gruppe zeigte eine signifikante Nierenvergrößerung, wobei das Nierengewicht (2,5535 g ± 0,2587 g, P < 0,01) und das Nierenvolumen (2,8533 cm³ ± 0,3870 cm³, P < 0,01) signifikant zunahmen. Das Körpergewicht war etwas niedriger als in der Kontrollgruppe (280 g ± 17 g, P < 0,05), und die Scr-Spiegel stiegen ebenfalls an (20,02 μmol/L ± 1,36 μmol/L, P < 0,05), was auf eine eingeschränkte Nierenfunktion hinweist.
In der 8-wöchigen RUUO-Gruppe waren das Nierengewicht (1,5178 g ± 0,1305 g, P < 0,05) und das Nierenvolumen (1,6183 cm³ ± 0,0906 cm³, P < 0,05) niedriger als in der UUO-Gruppe, blieben aber im Vergleich zur Kontrollgruppe erhöht, wobei eine bemerkenswerte Signifikanz nur im Nierenvolumen (P < 0,05) beobachtet wurde. Die Scr-Spiegel (16,42 μmol/L ± 4,03 μmol/L, P < 0,05) waren im Vergleich zur UUO-Gruppe reduziert, kehrten aber nicht vollständig zum Ausgangswert zurück. Das Körpergewicht (288 g ± 12 g, P > 0,05) war höher als in der UUO-Gruppe, blieb aber etwas niedriger als in der Kontrollgruppe.
Die Morphologie der Nieren und des Nierenbeckens erfuhr nach einer Harnleiterobstruktion signifikante Veränderungen. Oberhalb der Obstruktionsstelle zeigten die Harnleiter und das Nierenbecken eine deutliche Dilatation mit Nierenvergrößerung und deutlicher Ausdünnung der Nierenrinde und des Marks Nach der Rekanalisation der Harnleiterobstruktion war die Dilatation der Harnleiter und des Nierenbeckens erheblich reduziert, obwohl eine leichte Restdilatation beobachtet wurde (Abbildung 1).
Zur Beurteilung der Durchgängigkeit des Harnleiters wurden 0,1 ml Methylenblau mit einer Insulinnadel in das Nierenbecken injiziert (0,33 mm × 12,7 mm). Eine vollständige Obstruktion wurde bestätigt, als der Farbstoff die Harnleiterblockade nicht passieren konnte. Die Ergebnisse der Methylenblau-Injektion in das Nierenbecken und die Harnleiter von Ratten mit RUUO vor der Entfernung der Obstruktion sind in Abbildung 2A dargestellt. Nach Entfernung des Silikonschlauchs wies der Harnleiter an der Ligaturstelle eine rötliche Farbe auf (Abbildung 2B) und eine normale Peristaltik, was darauf hindeutet, dass diese Technik zu einer minimalen Harnleiterschädigung führte.
Die histologische Analyse der normalen Niere ergab dichte, gesunde Tubuli, die die Glomeruli umgeben (Abbildung 3, links). Vierzehn Tage nach der UUO zeigte das Epithel des proximalen Tubulus Vakuolation und Degeneration, Verlust der Bürstenränder und Exfoliation. Nekrotische Zellen wurden in den Lumen beobachtet. Die distalen Tubuli schienen erweitert, einige Tubuli fehlten und die Sammelkanäle waren aufgebläht, was zu einer Ausdünnung der Nierenrinde führte (Abbildung 3).
Die Trichrom-Färbung nach Masson wurde zur Beurteilung der interstitiellen Nierenfibrose verwendet, wobei bläulich gefärbte Kollagenfasern auf fibrotische Veränderungen hindeuteten12. Bei dieser Methode werden Zellen, Kollagenfasern und andere Gewebebestandteile effektiv differenziert. Im UUO-Modell wurde nach 14 Tagen ein erheblicher Anstieg der Kollagenfasern im renalen Interstitium beobachtet, was auf eine ausgeprägte interstitielle Fibrose hinweist (Abbildung 4). Im Gegensatz dazu zeigte das RUUO-Modell eine deutliche Verringerung der Kollagenfasern, was darauf hindeutet, dass die Fibrose entweder gemildert oder verzögert wurde.
Gemäß dem Nierenschadenswert (Abbildung 5) wies die UUO-Gruppe eine schwere Nierenschädigung auf, während die RUUO-Gruppe eine mittelschwere Nierenschädigung aufwies. Wie in Abbildung 5 dargestellt, war der Nierenschadenswert in der UUO-Gruppe signifikant höher als in der nativen Gruppe (P < 0,0001). Die RUUO-Gruppe zeigte im Vergleich zur UUO-Gruppe einen signifikant niedrigeren Nierenverletzungswert (P < 0,05); Der Score blieb jedoch im Vergleich zur nativen Gruppe signifikant hoch (P < 0,001). Insgesamt war die Nierenschädigung in der RUUO-Gruppe im Vergleich zur UUO-Gruppe signifikant gelindert (P < 0,05).

Abbildung 1: Repräsentative Histologie der nativen, UUO- (14-Tage) und RUUO-Nieren. Im Vergleich zur nativen Niere führten 14 Tage UUO zu einer bemerkenswerten Zunahme des Nierenvolumens, die durch eine deutliche Erweiterung des Nierenbeckens und des proximalen Harnleiters sowie eine Abnahme der Nierenrinde und der Medulladicke gekennzeichnet war. Im Gegensatz dazu war das Nierenvolumen in der RUUO-Gruppe (rechtes Panel) im Vergleich zur UUO-Gruppe (mittleres Panel) signifikant reduziert, mit deutlicher Verengung des Nierenbeckens und des Harnleiters. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Harnleitervisualisierung mit Methylenblau-Injektion und nach Entfernung des Silikonschlauchs. (A) Am 7. Tag der RUUO wurde nach der Injektion von Methylenblau in das Nierenbecken eine Färbung im Harnleiter über dem Silikonschlauch beobachtet, während der Teil unterhalb der Ligaturstelle ungefärbt blieb. (B) Der Harnleiter erscheint nach dem Entfernen des Silikonschlauchs rötlich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Repräsentative Histologie der nativen, UUO- und RUUO-Nieren. Die UUO-Niere weist einen Verlust der Bürstengrenze in den proximalen Tubuli, eine signifikante Erweiterung des tubulären Lumens, Degeneration, Exfoliation und Desintegration von tubulären Epithelzellen sowie eine Exposition der Basalmembran auf, was auf eine ausgeprägte akute tubuläre Schädigung hinweist. Die Anzahl der erweiterten Nierentubuli in der RUUO-Niere ist deutlich geringer als in der UUO-Niere, was auf eine partielle tubuläre Erholung hinweist. Obere Paneele: Maßstabsleiste = 100 μm; untere Felder (Einschub): Maßstabsleiste = 16 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
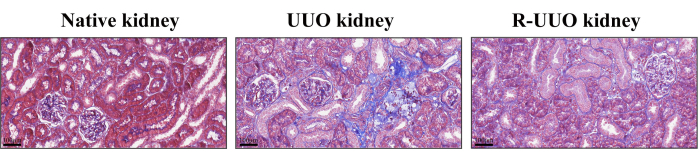
Abbildung 4: Massons Trichrom-Färbung von nativen, UUO- und RUUO-Nieren. Blau gefärbte Bereiche deuten auf Kollagenfasern hin. Die UUO-Niere wies im Vergleich zur nativen Niere eine höhere Dichte an Kollagenfasern auf. Im Gegensatz dazu zeigte die RUUO-Niere im Vergleich zur UUO-Niere eine signifikante Verringerung der Kollagenfaserdichte, was auf eine Linderung der interstitiellen Fibrose hindeutet. Obere Felder: Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Tubuläre Schädigungswerte in nativen, UUO- und RUUO-Nieren. Basierend auf Hämatoxylin- und Eosin (HE)-Färbungen wurden histologische Veränderungen im Nierengewebe anhand einer semiquantitativen Skala für tubuläre Nekrose bewertet: 0 = normale Niere, 1 = minimale Nekrose (≤5% Beteiligung), 2 = leichte Nekrose (5%-25% Beteiligung), 3 = mäßige Nekrose (25%-50% Beteiligung), 4 = schwere Nekrose (50%-75% Beteiligung) und 5 = schwerste Nekrose (>75% Beteiligung). Die y-Achse stellt die Werte für Nierenverletzungen dar, während die x-Achse experimentelle Gruppen darstellt. Im Vergleich zur nativen Gruppe wies die UUO-Gruppe einen signifikant höheren Nierenverletzungswert auf (P < 0,0001). Im Gegensatz dazu hatte die RUUO-Gruppe im Vergleich zur UUO-Gruppe einen signifikant niedrigeren Nierenverletzungswert (P < 0,05). Im Vergleich zur nativen Gruppe zeigte die RUUO-Gruppe jedoch immer noch einen signifikant erhöhten Nierenverletzungswert (P < 0,001). Insgesamt zeigte die UUO-Gruppe eine schwere Nierenschädigung, während die RUUO-Gruppe eine mittelschwere Nierenschädigung aufwies. Die Nierenschädigung in der RUUO-Gruppe war im Vergleich zur UUO-Gruppe signifikant gelindert (P < 0,05). Die statistische Signifikanz wird wie folgt angegeben: *P < 0,05, ***P < 0,001 und ****P < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Gruppe | Körpergewicht (g) | Gewicht der Niere (g) | Volumen der Niere (cm³) | Serum-Kreatinin (μmol/L) |
| Nativ (6 Wochen) | 234 ± 16A | 0,91 ± 0,05A | 0,90 ± 0,05A | N/A* |
| Kontrolle (8 Wochen) | 291 ± 20*b | 1,14 ± 0,07*b | 1,13 ± 0,04A | 18.07 ± 2.17*b |
| UUO (8 Wochen) | 280 ± 17*c | 2,55 ± 0,26**c | 2,85 ± 0,39**c | 20.02 ± 1.36*c |
| RUUO (8 Wochen) | 288 ± 12*b | 1,52 ± 0,13*b | 1,62 ± 0,09**b | 16,42 ± 4,03A |
Tabelle 1: Körpergewicht, Nierengewicht, Nierenvolumen und Serumkreatininspiegel in verschiedenen Gruppen. Die Daten werden als Mittelwert ± Standardabweichung (SD) dargestellt, wobei n = 5 pro Gruppe ist. Gruppennamen geben das Alter der Ratten zum Zeitpunkt der Messung und das entsprechende Krankheitsmodell an. Statistische Vergleiche wurden mit dem Kruskal-Wallis-Test durchgeführt, gefolgt von dem Mehrfachvergleichstest nach Dunn. Unterschiedliche hochgestellte Buchstaben (a, b, c) bezeichnen statistisch signifikante Unterschiede zwischen Gruppen (P < 0,05), wobei Gruppen mit demselben Buchstaben nicht signifikant unterschiedlich sind, während Gruppen mit unterschiedlichen Buchstaben signifikante Unterschiede anzeigen. Für direkte Vergleiche mit der Kontrollgruppe (mit Ausnahme von Serumkreatinin) wird die statistische Signifikanz mit P < 0,05 x (*) und P < 0,01 durch (**) angegeben. *N/A: Das Serumkreatinin wurde in der nativen (6 Wochen alten) Gruppe nicht gemessen. Im Vergleich zur nativen Gruppe zeigte die Kontrollgruppe signifikante Zunahmen sowohl des Körpergewichts als auch des Nierengewichts (P < 0,05), was auf ein bemerkenswertes Wachstum und eine bemerkenswerte Entwicklung bei 8 Wochen alten Ratten und ihren Nieren hinweist. Das Nierenvolumen nahm in der Kontrollgruppe ebenfalls zu, obwohl der Unterschied statistisch nicht signifikant war (P > 0,05). Im Vergleich zur Kontrollgruppe zeigte die UUO-Gruppe eine statistisch signifikante Reduktion des Körpergewichts (P < 0,05), während das Nierengewicht und das Nierenvolumen signifikant zunahmen (P < 0,01). Auch der Serumkreatininspiegel stieg in der UUO-Gruppe signifikant an (P < 0,05). Im Vergleich zur UUO-Gruppe zeigte die RUUO-Gruppe eine statistisch signifikante Zunahme des Körpergewichts (P < 0,05) und eine signifikante Verringerung des Nierengewichts, des Nierenvolumens und des Serumkreatininspiegels (P < 0,05), wobei eine Abnahme des Serumkreatinins besonders bemerkenswert war. Im Vergleich zur Kontrollgruppe zeigte die RUUO-Gruppe eine signifikante Zunahme des Nierenvolumens (P < 0,01) und eine signifikante Verringerung des Serumkreatininspiegels (P < 0,05), während die Unterschiede im Körpergewicht und Nierengewicht nicht signifikant waren. Insgesamt zeigte die UUO-Gruppe im Vergleich zur Kontrollgruppe ein erhöhtes Nierengewicht, Nierenvolumen und Serumkreatininspiegel, während die RUUO-Gruppe eine Erholung dieser Parameter zeigte, wobei alle Unterschiede statistisch signifikant waren (P < 0,05).
Diskussion
Bei diesem Modell wird ein Silikonschlauch verwendet, um den Harnleiter zu umschließen und strukturelle Unterstützung zu bieten, gefolgt von einer Ligatur mit einem Seidenfaden, um eine vollständige Harnleiterobstruktion durch Kompression zu induzieren. Nach sieben Tagen werden die Ligatur und der Silikonschlauch entfernt, um die Dekompression der Niere und die Wiederherstellung der Integrität und Funktionalität der Harnwege zu erleichtern.
Silikonschläuche, die aus Silikonelastomeren hergestellt werden, bieten eine hervorragende Flexibilität, Biokompatibilität, chemische Beständigkeit und thermische Stabilität. Medizinischer Silikonkautschuk wurde speziell für Anwendungen entwickelt, die überlegene mechanische Eigenschaften erfordern, einschließlich langfristiger Implantation, während allgemeine Silikonschläuche eine Reihe von kommerziell erhältlichen Varianten umfassen, die sich in Elastizitäts-, Härte- und Biokompatibilitätsprofilen unterscheiden können13. Aufgrund der kurzen Versuchsdauer (7-14 Tage) und des Fehlens anhaltender mechanischer Belastung in dieser Studie wurden Silikonschläuche aufgrund ihrer ausreichenden Biokompatibilität, angemessenen Elastizität und Kosteneffizienz für die Etablierung der Harnleiterobstruktionsmodelle der Ratte ausgewählt. Daher weisen beide Materialien eine funktionelle Gleichwertigkeit auf und können in dieser Studie austauschbar verwendet werden.
Die Dauer der Obstruktion ist ein kritischer Faktor für die Genesung der RUUO-Nieren, wobei Studien darauf hindeuten, dass Nierenschäden teilweise gemildert werden können, wenn die Obstruktion am siebten Tag gelindert wird, während nach Tag 147 keine signifikante Erholung beobachtet wird. Die optimale Dauer der Harnleiterobstruktion im RUUO-Modell wurde auf sieben Tage festgelegt, um eine übermäßige Schädigung zu vermeiden und sicherzustellen, dass die Ergebnisse nicht durch eine anhaltende Obstruktion übermäßig beeinflusst wurden. Durch den Vergleich von Nieren, die 14 Tage lang obstruktiv behandelt wurden, mit denen, die nach sieben Tagen gelindert wurden, wurde das Fortschreiten der obstruktiven Nephropathie in den RUUO- und UUO-Modellen visuell untersucht. Methylenblau wurde in das Nierenbecken injiziert, um eine vollständige Harnleiterobstruktion vor der Katheterentfernung zu bestätigen. Der 7. Tag der Obstruktion wurde anstelle des ersten Tages für den Test ausgewählt, da das Nierenbecken zu diesem Zeitpunkt bereits deutlich erweitert war, was das Einführen der Nadel erleichterte und das Risiko einer Harnleiterschädigung durch die Verwendung von Insulinnadeln an Tag 1 verringerte.
Die Methode zur Linderung der Obstruktion ist einfach, effektiv und darauf ausgelegt, mögliche Harnleiterverletzungen zu minimieren. Dieses Modell gewährleistet eine vollständige Obstruktion und verbessert gleichzeitig die Erfolgsrate der Rekanalisation und verringert die Wahrscheinlichkeit einer Harnleiterschädigung. Das RUUO-Modell zeichnet sich durch seine Einfachheit, Reproduzierbarkeit und einfache Implementierung aus, was es zu einem wertvollen Werkzeug für die Untersuchung der Nierenfibrose, der Nierenregeneration und der damit verbundenen Mechanismen macht 14,15,16.
Aufbauend auf dem UUO-Modell adressiert das RUUO-Modell die irreversiblen Einschränkungen seines Vorgängers. Durch die Integration der pathologischen Progression der UUO-induzierten interstitiellen Nierenfibrose mit der anschließenden Genesung nach Obstruktionslinderung repliziert das RUUO-Modell die Erholungsphase der akuten Nierenschädigung (AKI) und der Nierenfibrose. Dieses Modell erleichtert die Simulation klinisch obstruktiver Nierenbehandlungsprozesse und bietet eine umfassendere Untersuchung der Zellregeneration und des Umbaus der extrazellulären Matrix (ECM) im Vergleich zum traditionellen UUO-Modell.
Die Untersuchung von UUO beim Menschen bietet wertvolle Einblicke in die Mechanismen von Nierenschäden, Fibrose und möglichen therapeutischen Interventionen. UUO wird häufig verwendet, um obstruktive Nephropathie nachzuahmen, die durch Erkrankungen wie Obstruktion des ureterolischen Übergangs (UPJO), Nierensteine oder Tumore verursachtwird 2. Die renale Fibrose, die durch übermäßige EZM-Ablagerung gekennzeichnet ist, ist ein Kennzeichen chronischer Nierenerkrankungen, und UUO-Modelle sind maßgeblich an der Untersuchung der Rolle der EZM beim Fortschreiten der Fibrose beteiligt. Dieses Modell repliziert zuverlässig den Prozess der Nierenschädigung, insbesondere die Entwicklung der Fibrose, und bildet die Grundlage für die Untersuchung der Mechanismen, die der Nierenfibrose zugrunde liegen.
Untersuchungen deuten darauf hin, dass die Linderung der Obstruktion die Hämodynamik und Funktion der Nieren teilweise wiederherstellen und erhalten und gleichzeitig das Fortschreiten der Fibrose bis zu einem gewissen Grad abschwächenkann 17. Dies hat erhebliche Auswirkungen auf die Reparatur von Nierenverletzungen. Eine verzögerte Obstruktionslinderung führt jedoch häufig zu einer schlechten Genesung und einer weiteren Verschlechterung der Nieren, was möglicherweise zu Nierenversagen führenkann 18. Darüber hinaus wurde UUO mit Bluthochdruck in Verbindung gebracht, wobei eine verzögerte Intervention mit einer höheren Inzidenz und Schwere dieser Erkrankung korrelierte. Diese Ergebnisse unterstreichen die entscheidende Bedeutung einer frühzeitigen Intervention bei der Minimierung von Nierenschäden und der Kontrolle des Blutdrucks. Eine verzögerte Linderung verschlimmert nicht nur die Fibrose und den Rückgang der Nierenfunktion, sondern erhöht auch das Risiko für Bluthochdruck.
In diesem Zusammenhang dient das RUUO-Modell als wertvolles Instrument, um die dynamische Natur von Nierenschäden und -genesung zu untersuchen. Studien mit dem RUUO-Modell zeigen, dass eine Harnleiter-Deobstruktion zwar einige Verletzungen mildern kann, aber persistierende Fibrose und Langzeitschäden bestehen bleiben, wie sowohl in Tier- als auch in klinischen Modellen beobachtetwurde 19. Das RUUO-Modell ist daher unerlässlich, um zu verstehen, wie eine frühzeitige Intervention dazu beitragen kann, irreversible Nierenschäden zu begrenzen und das Fortschreiten zu chronischen Nierenerkrankungen und damit verbundenen Komplikationen wie Bluthochdruck zu verlangsamen.
Mehrere Forscher haben verschiedene Modelle von RUUOvorgeschlagen 10,14,20,21,22,23. Viele bestehende Rekanalisationsmodelle weisen jedoch Einschränkungen auf, darunter komplexe chirurgische Eingriffe, hohe technische Anforderungen und inkonsistente Ergebnisse. So beschrieb Ulm22 die Methode der Harnleiter-Psoas-Einbettung, die eine erfolgreiche Rekanalisation ermöglicht und relativ einfach durchzuführen ist. Seine Wirksamkeit kann jedoch durch Faktoren wie die Haltung des Tieres, die Bewegung und Schwankungen der Psoas-Muskelspannung beeinflusst werden. Park et al.23 verwendeten einen nicht-invasiven mikrovaskulären Clip, um eine Obstruktion für 10 Tage zu induzieren, gefolgt von einer Clipentfernung mit demselben chirurgischen Ansatz. Während diese Methode Vorteile wie Biokompatibilität, einfache Bedienung, minimale Verfahrensdauer und Reproduzierbarkeit bietet, kann sie zu intestinalen Adhäsionen und einer geringeren Erfolgsrate bei der Harnleiter-Rekanalisation führen.
Die Verwendung eines Silikonschlauchs bietet eine wirksame Alternative, da seine Weichheit und Biokompatibilität eine Harnleiterobstruktion ermöglichen, ohne das umgebende Gewebe zu schädigen. Dieser Ansatz minimiert Gewebeverletzungen und Entzündungsreaktionen und ermöglicht gleichzeitig die Linderung von Obstruktionen ohne dauerhafte Harnleiterschäden. Folglich bleibt das RUUO-Modell reversibel, stabil und eignet sich für Langzeitstudien.
Die von Hesketh et al.10 angewandte vesikoureterale Reimplantationsmethode eignet sich gut zur Untersuchung pathophysiologischer Veränderungen nach vesikoureteraler Reimplantation. Diese Technik beinhaltet jedoch einen komplexen chirurgischen Eingriff mit einer verlängerten Operationszeit und dem Risiko eines Harnleiterrisses und einer Harnleiterablösung aufgrund übermäßiger Spannung. Darüber hinaus kann es vorkommen, dass der verkürzte Harnleiter nicht erfolgreich mit dem Blasentrigon anastomosiert, was zu einer abnormalen Reverbindung und einem möglichen chirurgischen Versagen führt. Diese Herausforderungen schränken die Anwendbarkeit ein, insbesondere in Kleintiermodellen.
Yao et al.16 führten eine Technik ein, bei der die Harnleiterklemmung mit einem gefalteten Polyethylenschlauch verwendet wird, die Harnleiterschäden reduziert und einen stabilen Verschluss ermöglicht. Die glatte Oberfläche des Polyethylenrohrs kann jedoch aufgrund von Peristaltik und Tierbewegungen zu einem Verrutschen der Ligatur führen, was möglicherweise zu einer Verstopfung führen kann. Chevalier et al.9 führten einen Silikonschlauch in den linken Harnleiter von neugeborenen Mäusen ein, der nach fünftägiger Gefäßklemmung entfernt wurde. Während dieses Modell effektiv eine Obstruktion induziert, führte die Verwendung der Seidenfadenligatur als Alternative zu Gefäßclips zu vergleichbaren Ergebnissen, einschließlich einer signifikanten Verringerung des Nieren- und Nierenbeckenvolumens. Darüber hinaus verursachte diese Methode minimale entzündliche und fibrotische Reaktionen um den Harnleiter. Obwohl sieben Tage nach der Obstruktionslinderung eine leichte Harnleiterdilatation beobachtet wurde, war sie deutlich weniger schwerwiegend als bei der vesikoureteralen Reimplantation10. Dieser Ansatz verhindert auch vesikoureteralen Reflux, was ihn zu einer praktikablen Alternative für die Untersuchung von RUUO macht.
Ein wichtiger Aspekt bei diesem Ansatz ist die Minimierung von Harnleiterschäden während der Operation, da Harnleiterverletzungen Entzündungen auslösen können, die möglicherweise zu Adhäsion, Verschluss und Rekanalisationsversagen führen können. Die vesikoureterale Reimplantation birgt Risiken wie direkte Harnleiterschäden, Anastomosenentzündungen und einen möglichen Verschluss aufgrund von Operationsfehlern. Darüber hinaus kann eine unzureichende Drainage des Urinsediments vor der Reimplantation zum Versagen der Rekanalisation beitragen. Die Verwendung eines Silikonschlauchs, um den Harnleiter von außen zu umhüllen, bietet Schutz, während die Ligatur mit einem Gefäßclip oder Seidenfaden durch den Silikonschlauch eine Harnleiterobstruktion induziert. Gefäßklemmen können jedoch das Risiko von Darmadhäsionen erhöhen und die Erfolgsraten der Rekanalisation senken. Obwohl berichtet wurde, dass eine Neupositionierung der Klemme alle zwei Tage während einer Harnleiterobstruktion die Erfolgsraten der Rekanalisation um 70 % verbessert17, verlängert diese Methode die Verfahrenszeit erheblich und führt zu technischen Herausforderungen. Im Gegensatz dazu bietet die Seidenfadenligatur durch einen Silikonschlauch einen einfacheren Ansatz mit reduzierter Entzündung. Die Hauptsorge bleibt, ob die Seidenfadenligatur eine vollständige Obstruktion und Gleichmäßigkeit bei allen Versuchspersonen gewährleistet.
In dieser Studie wurde Methylenblau in den Harnleiter injiziert, um eine vollständige Obstruktion zu bestätigen. In der UUO-Gruppe erreichten alle Ratten eine erfolgreiche Obstruktion (100% Erfolgsquote), wobei unter Standardbedingungen keine Mortalität beobachtet wurde. In der RUUO-Gruppe (n = 12) wurden sechs Ratten aufgrund von Komplikationen von der Analyse ausgeschlossen: Eine starb intraoperativ an einer anästhesieinduzierten Atemdepression, zwei erlagen an den Tagen 6 und 13 postoperativen Komplikationen (Verdacht auf Blutungen oder Infektionen), zwei hatten eine inkomplette Obstruktion und bei einer kam es aufgrund chirurgischer Komplikationen zu einer fehlgeschlagenen Rekanalisation. Folglich betrug die Überlebensrate für die RUUO-Gruppe 75 % (95 % CI: 46,77 %-91,11 %), die Erfolgsrate einer vollständigen Obstruktion 80 % (95 % CI: 49,0 %-94,3 %) und die Rekanalisationserfolgsrate 90 % (95 % CI: 59,6 %-98,2 %). Alle Anteile wurden unter Verwendung der jeweiligen Nenner nach Ausschlüssen berechnet, und 95%-Konfidenzintervalle wurden mit der Wilson-Score-Methode bestimmt.
Unter Genesung versteht man die Wiederherstellung der physiologischen Funktion nach krankhaften Veränderungen oder Funktionsbeeinträchtigungen. Es umfasst nicht nur die Umkehrung pathologischer Veränderungen, sondern auch die Wiederherstellung der Organfunktion auf ein nahezu normales Niveau. Im Gegensatz dazu bezieht sich die Konservierung auf Interventionen, die vor oder zu Beginn des Krankheitsprozesses eingeleitet werden, um eine weitere Verschlechterung zu verhindern, anstatt bestehende Schäden vollständig rückgängig zu machen24. Die Unterscheidung zwischen Genesung und Erhalt erfordert umfassende Bewertungen der Nierenfunktion zu Studienbeginn sowie eine dynamische Überwachung des Fortschreitens der Erkrankung und der Auflösung der Obstruktion. Diese Studie beschränkte sich auf kurzfristige Beobachtungen und beinhaltete keine systematische Überwachung pathologischer Marker während der Genesung. Insbesondere wurden in vivo keine longitudinalen Biomarker verwendet, um die tatsächliche Umkehrung pathologischer Mechanismen zu verfolgen. Obwohl Verbesserungen des Nierengewebes und der Nierenfunktion beobachtet wurden, bleibt unklar, ob diese Veränderungen eine vollständige pathologische Umkehrung darstellen. Zukünftige Studien sollten Fibrose-Biomarker und Entzündungsmediatoren einbeziehen, um die Krankheitsauflösung dynamisch zu bewerten.
Darüber hinaus wurden in dieser Studie aufgrund von Einschränkungen bei den experimentellen Geräten und Techniken keine Proteinurie und Albuminurie gemessen, Parameter, die als Indikatoren der renalen Pathophysiologie gut etabliert sind24. Ihr Fehlen könnte direkte Vergleiche mit klassischen Modellen für Nierenerkrankungen einschränken. Zukünftige Forschung sollte neben Serumkreatinin- und Blutharnstoffstickstoffmessungen auch eine standardisierte Urinproteinanalyse umfassen, um eine umfassendere Bewertung der Nierenfunktion und -schädigung zu ermöglichen.
Die chirurgische Linderung von Obstruktionen ist eine primäre klinische Strategie zur Behandlung obstruktiver Nierenerkrankungen25. Obwohl diese Studie die vollständige Umkehrung der pathologischen Mechanismen der Nieren nicht vollständig belegt, stellt sie ein wertvolles Forschungsmodell für die Untersuchung pathologischer und physiologischer Veränderungen nach der Freisetzung von Harnleiterobstruktionen dar. Es ermöglicht auch zu beurteilen, ob die Nierenfunktion vollständig oder nur teilweise erhalten ist.
Zusammenfassend lässt sich sagen, dass dieses Modell auf Ratten unterschiedlichen Alters anwendbar ist, obwohl für neugeborene Ratten, die sich einer RUUO unterziehen, besondere Sorgfalt erforderlich ist, einschließlich der Auswahl geeigneter Silikonschläuche und der Prävention von Harnleiterschäden. Eine übermäßige Ligatur sollte vermieden werden, um ein Rekanalisationsversagen zu verhindern. Das Modell zeigt eine vergleichbare Rekanalisationswirksamkeit, ist aber einfach, stabil und machbar, wodurch es sich gut für die Untersuchung von Entzündungs- und Immunprozessen, der Nierenregeneration und verwandten Mechanismen eignet, mit erheblichem Potenzial für weitere Forschung.
Offenlegungen
Nichts.
Danksagungen
Diese Arbeit wurde unterstützt durch das Program for Youth Innovation in Future Medicine, Chongqing Medical University (W0056), Chongqing Science and Health Joint TCM Technology Innovation and Application Development Project (2020ZY023877).
Materialien
| Name | Company | Catalog Number | Comments |
| Forceps | Shanghai Medical Devices Co.,Ltd | 20220032 | |
| Gauze | Sichuan Kelun Co., Ltd | 20172140152 | |
| Hematoxylin and Eosin Stain Kit | Solarbio | G1120 | |
| Insulin needles | KDL Medical Devices | 20193140938 | |
| Masson’s Trichrome Stain Kit | Solarbio | G1340 | |
| Medical Cotton balls | Sichuan Kelun Co., Ltd | 20170037 | |
| Medical Cotton sticks | Sichuan Kelun Co., Ltd | 20172140026 | |
| Methylene blue | Tianjin Dengfeng Chemical Reagent Factory | 14038-43-8 | |
| Microscopic forceps | Suqian Shifeng Medical Devices Co., Ltd | S50985 | |
| Needle holders | Suqian Shifeng Medical Devices Co., Ltd | S7005 | |
| Povidone-iodine Solution | Sichuan Kelun Co., Ltd | 514001 | |
| Saline | Sichuan Kelun Co., Ltd | 20220004 | |
| SD Rats | SPF(Beijing)Biotechnology Co.,Ltd | D025 | |
| Silicone tubing | Taizhou Chunshi New Materials Co., Ltd | CS356 | |
| Silk suture | Qiangsheng Medical Devices Co.,Ltd | SA84G | |
| Surgical blade | Huanan Yunyue Medical Devices Co.,Ltd | CE0434 | |
| Surgical scissors | Shanghai Medical Devices Co.,Ltd | J21130 | |
| Syringe | Tongmai medical devices | 20183140304 | |
| Tissue Forceps | Jiangxi Yuyuan Medical Equipment Co., Ltd | J36030 |
Referenzen
- Chaves, L. D., et al. Contrasting effects of systemic monocyte/macrophage and CD4+ t cell depletion in a reversible ureteral obstruction mouse model of chronic kidney disease. Clin Dev Immunol. 2013, 836989(2013).
- Chevalier, R. L., Forbes, M. S., Thornhill, B. A. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney Int. 75 (11), 1145-1152 (2009).
- Aranda-Rivera, A. K., et al. Sulforaphane protects from kidney damage during the release of unilateral ureteral obstruction (RUUO) by activating nuclear factor erythroid 2-related factor 2 (nrf2): Role of antioxidant, anti-inflammatory, and antiapoptotic mechanisms. Free Radic Biol Med. 212, 49-64 (2024).
- Narváez Barros, A., et al. Reversal unilateral ureteral obstruction: A mice experimental model. Nephron. 142 (2), 125-134 (2019).
- Cochrane, A. L., et al. Renal structural and functional repair in a mouse model of reversal of ureteral obstruction. J Am Soc Nephrol. 16 (12), 3623-3630 (2005).
- Kaeidi, A., et al. The therapeutic approaches of renal recovery after relief of the unilateral ureteral obstruction: A comprehensive review. Iran J Basic Med Sci. 23 (11), 1367-1373 (2020).
- Liu, Y., et al. A porcine model of relief of unilateral ureteral obstruction: Study on self-repairing capability over multiple time points. Mol Cell Biochem. 419 (1-2), 115-123 (2016).
- Puri, T. S., et al. Chronic kidney disease induced in mice by reversible unilateral ureteral obstruction is dependent on genetic background. Am J Physiol Renal Physiol. 298 (4), F1024-F1032 (2010).
- Chevalier, R. L., Kim, A., Thornhill, B. A., Wolstenholme, J. T. Recovery following relief of unilateral ureteral obstruction in the neonatal rat. Kidney Int. 55 (3), 793-807 (1999).
- Hesketh, E. E., et al. A murine model of irreversible and reversible unilateral ureteric obstruction. J Vis Exp. (94), e52559(2014).
- Klahr, S., Morrissey, J. Obstructive nephropathy and renal fibrosis. Am J Physiol Renal Physiol. 283 (5), F861-F875 (2002).
- Jin, B., et al. Loss of men1 leads to renal fibrosis and decreases HGF-ADAMTS5 pathway activity via an epigenetic mechanism. Clin Transl Med. 12 (8), e982(2022).
- Fischer, N. G., He, J., Aparicio, C. Surface immobilization chemistry of a laminin-derived peptide affects keratinocyte activity. Coatings (Basel). 10 (6), 560(2020).
- Song, J., et al. Losartan accelerates the repair process of renal fibrosis in UUO mouse after the surgical recanalization by upregulating the expression of tregs. Int Urol Nephrol. 51 (11), 2073-2081 (2019).
- Song, J., et al. Regulatory t cells accelerate the repair process of renal fibrosis by regulating mononuclear macrophages. Am J Med Sci. 361 (6), 776-785 (2021).
- Yao, Y., et al. Interferon-γ improves renal interstitial fibrosis and decreases intrarenal vascular resistance of hydronephrosis in an animal model. Urology. 77 (3), e768-e761.e713 (2011).
- Chevalier, R. L., Thornhill, B. A., Chang, A. Y., Cachat, F., Lackey, A. Recovery from release of ureteral obstruction in the rat: Relationship to nephrogenesis. Kidney Int. 61 (6), 2033-2043 (2002).
- Lucarelli, G., et al. Delayed relief of ureteral obstruction is implicated in the long-term development of renal damage and arterial hypertension in patients with unilateral ureteral injury. J Urol. 189 (3), 960-965 (2013).
- Ito, K., et al. Renal damage progresses despite improvement of renal function after relief of unilateral ureteral obstruction in adult rats. Am J Physiol Renal Physiol. 287 (6), F1283-F1293 (2004).
- Song, J., et al. A modified relief of unilateral ureteral obstruction model. Ren Fail. 41 (1), 497-506 (2019).
- Morrissey, J., et al. morphogenetic protein-7 improves renal fibrosis and accelerates the return of renal function. J Am Soc Nephrol. 13 (suppl_1), S14-S21 (2002).
- Ulm, A. H., Miller, F. An operation to produce experimental reversible hydronephrosis in dogs. J Urol. 88, 337-341 (1962).
- Park, H. C., et al. Postobstructive regeneration of kidney is derailed when surge in renal stem cells during course of unilateral ureteral obstruction is halted. Am J Physiol Renal Physiol. 298 (2), F357-F364 (2010).
- Forni, L. G., et al. Renal recovery after acute kidney injury. Intensive Care Med. 43 (6), 855-866 (2017).
- Varela, S., Omling, E., Borjesson, A., Salo, M. Resolution of hydronephrosis after pyeloplasty in children. J Pediatr Urol. 17 (1), e101-e102.e7 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten