Method Article
Филамент ручной работы с силиконовым покрытием для мышей модели окклюзии средней мозговой артерии
В этой статье
Резюме
Этот протокол описывает простой метод создания покрытых нитей для модели окклюзии средней мозговой артерии (MCAO) у мышей с использованием силикона, нейлоновых швов и игл шприца. Этот метод позволяет производить филаменты с постоянным диаметром и различной длиной силиконовой оболочки в соответствии с экспериментальными потребностями.
Аннотация
По мере старения населения планеты ишемический инсульт становится второй по значимости причиной инвалидности и смертности во всем мире, ложась огромным бременем как на общество, так и на семьи. Несмотря на то, что такие методы лечения, как внутривенный тромболизис и эндоваскулярные вмешательства, могут значительно улучшить исходы лечения пациентов с острым ишемическим инсультом, только небольшой процент людей получает пользу от этих методов лечения. Чтобы улучшить наше понимание болезни и найти более эффективные методы лечения, исследователи постоянно разрабатывают и совершенствуют животные модели. Среди них модель окклюзии средней мозговой артерии (MCAO) выделяется как наиболее часто используемая модель в исследованиях цереброваскулярных заболеваний. Нить, используемая в этой модели, имеет решающее значение для ее разработки. В этом протоколе описывается метод создания нитей с постоянным диаметром и различной длиной силиконового покрытия. Модель MCAO, полученная с использованием этого метода на мышах C57, продемонстрировала высокий успех и согласованность, предлагая ценный инструмент для специализированных исследований ишемических цереброваскулярных заболеваний.
Введение
Инсульт является одной из наиболее распространенных причин смертности и инвалидности во всем мире. Ишемический и геморрагический инсульты являются основными типами цереброваскулярных событий, при этом ишемические инсульты составляют примерно 87% случаев 1,2,3. В настоящее время существует два метода лечения пациентов с ишемическим инсультом: фармакологическая терапия рекомбинантным тканевым активатором плазминогена (РТПА) и механическая тромбэктомия. Тем не менее, узкое терапевтическое окно и обширные критерии исключения ограничивают применение этих методов лечения, принося пользу лишь меньшинству пациентов. Это подчеркивает необходимость продолжения усилий по совершенствованию методов лечения ишемического инсульта 4,5. Модели in vitro неадекватны для воспроизведения сложных патофизиологических реакций после инсульта, что делает животные модели незаменимым компонентом доклинических исследований инсульта. Фокальная ишемия головного мозга человека чаще всего вызвана тромботической или эмболической окклюзией средней мозговой артерии (МКА), что делает модели грызунов, предназначенные для имитации окклюзии МКА (МКАО), весьма актуальными6.
Нитевидная модель MCAO, наиболее широко используемая в исследованиях инсульта, способствует окклюзии в начале средней мозговой артерии (MCA) и последующей реперфузии, что приводит к обширным инфарктам в подкорковых и корковых областях мозга. Преимущество данной модели заключается в ее способности восстанавливать кровоток после индукции очаговой ишемии, тем самым параллельно патофизиологическим процессам, наблюдаемым при инсультечеловека7. Кроме того, модель моделирует реперфузионное повреждение, которое является критическим фактором в степени повреждения8. Тем не менее, модель MCAO имеет ограничения, в том числе вариабельность объема инфаркта, при этом стандартное отклонение потенциально достигает до 64% от среднего значения в некоторых исследованиях9. Несмотря на более чем три десятилетия использования, усилия по повышению надежности модели продолжаются, но значительные вариации объема ишемического поражения сохраняются в исследованиях и лабораториях 10,11,12.
В этой статье представлен филамент собственного производства для индуцирования моделей, оценивающих показатели неврологического дефицита и области инфаркта головного мозга. В нем исследуется корреляция между длиной нити, покрытой силиконом, и успехом и стабильностью модели MCAO. Такая технология производства позволяет получать филаменты с похвальной стабильностью, что способствует разработке относительно стабильной модели MCAO.
протокол
Все процедуры на животных соответствовали экспериментальным процедурам и стандартам, утвержденным Комитетом по институциональному уходу за животными и их использованию Народной больницы провинции Шаньси (номер утверждения: 2024 Провинциальный комитет по медицинской этике No 64). В этом эксперименте использовались мыши-самцы C57BL/6 в возрасте 8-10 недель, весом 24-26 г. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Подготовка филамента
- Маркировка оригинальной нити: равномерно намотайте нейлоновый шов 6-0 на пластиковую пластину линейки. Сделайте отметки на расстоянии 5 мм и 10 мм от головки филамента (включая точку отметки покрытия и точку отметки глубины вставки).
- Отрежьте вертикально вниз лезвием, чтобы оба конца были идеально круглыми, в результате чего получится начальная нить длиной 2 см (Рисунок 1).
- Изготовление устройства для нанесения покрытия: С помощью гемостатических щипцов отломите головку иглы шприца 26 G, затем отполируйте отверстие иглы в идеальный круг с помощью наждачной бумаги. Наберите 2 мл силиконового герметика K-704 с помощью шприца 10 мК и, наконец, прикрепите головку иглы к шприцу.
- Нанесение покрытия на нить: Вставьте исходную нить в подготовленное отверстие для иглы с точностью до отмеченного положения 5 мм или 10 мм. Медленно и неуклонно нажимайте на шприц до полного покрытия нити под стереомикроскопом (Рисунок 2).
- Установка нити с покрытием: Зафиксируйте нить с покрытием вертикально с помощью клейкой ленты и подождите около 20 минут, пока силикон полностью схватится.
- Стерилизация и упаковка: Подготовленные нити замочите в 75% спирте, вытрите насухо ватным тампоном, а затем расфасовайте в центрифужные пробирки объемом 5 мл.
2. Модель MCAO
ПРИМЕЧАНИЕ: Хирургические инструменты стерилизовали автоклавированием (121 °C при 15 фунтах на квадратный дюйм в течение 60 минут). Операционный стол и другое оборудование были продезинфицированы с использованием этанола на 75%. Мышей голодали в течение 8 ч перед операцией, но им разрешали свободный доступ к воде.
- Введите 5 мг/кг мелоксикама подкожно для обезболивания за 60 минут до операции. Подключите тепловое одеяло, чтобы поддерживать температуру тела мыши на уровне 37 °C во время анестезии.
- Вводите анестезию 4% изофлураном до тех пор, пока не прекратятся спонтанные движения и подергивания усов, затем поддерживайте анестезию на уровне 1,5% (в соответствии с утвержденными в учреждении протоколами). Нанесите глазную мазь на оба глаза.
- Поместите мышь в лежачее положение, закрепите ее голову и конечности, сбрейте волосы на шее и верхней части груди и продезинфицируйте кожу 75% этанолом изнутри.
- Сделайте разрез кожи длиной 2,5 см по средней линии шеи, от нижней челюсти до грудины.
- Тупо рассеките правые мышцы шеи, чтобы обнажить влагалище сонной артерии. С помощью офтальмологических щипцов откройте влагалище и отделите общую сонную артерию (CCA), наружную сонную артерию (ECA) и внутреннюю сонную артерию (ICA), стараясь не повредить блуждающий нерв.
- Перед бифуркацией временно перевязать ОСА скользящим узлом и пережать ВСА микрохирургическим зажимом для артерии.
- Прижгите верхнюю щитовидную артерию от ЭКА с помощью биполярного коагуляционного шприц-ручки.
- Оставьте две нити на ECA для лигирования: одну на дистальном конце для постоянной лигирования, а другую на проксимальном конце со слабым узлом для дальнейшего использования. Сделайте разрез примерно 0,5 мм между двумя лигатурами на ECA с помощью офтальмологических ножниц, чтобы ввести нить.
- Вставьте нить с силиконовым покрытием толщиной 5 мм или 10 мм в CCA через разрез, а затем закрепите ее, затянув ослабленный узел.
- Отрезав дистальный конец ЭХА и сняв зажим с ВСА, втяните филамент в зону бифуркации ОСА. Затем переверните и продвигайте нить в глубокий ВСА, пока не почувствуете сопротивление. Слегка оттяните нить и закрепите ее, затянув узел.
- Зашить кожу животного швом 3-0 и продезинфицировать рану йодом. Поместите мышь в камеру восстановления на 1 час.
- Снова обезболите мышь, аккуратно удалите нить, перевяжите нить для лигирования ECA, фиксирующую нить, и отпустите узел CCA для восстановления кровотока и реперфузии средней мозговой артерии.
- Обрежьте лишние нити, зашите кожу шеи и еще раз продезинфицируйте область.
3. Фиктивная операция
- При фиктивных операциях введите филамент с силиконовым покрытием толщиной 7 мм, чтобы окклюзировать правую среднюю мозговую артерию, а затем немедленно удалите ее, чтобы обеспечить мгновенную реперфузию.
ПРИМЕЧАНИЕ: Последующая процедура идентична той, которая проводится на животных с ишемией головного мозга.
4. Нейрооценка
- Экспериментальных животных из каждой группы поместить в открытый грунт и провести поведенческую послеоперационную оценку через 4 ч после реперфузии ишемии головного мозга.
- Для успешного моделирования учитывайте баллы от 1 до 3. Критерии оценки основаны на скоринговом методеЛонга 10, как подробно описано в таблице 1.
- Оценивайте неврологические дефициты в соответствии с модифицированной шкалой тяжести неврологического расстройства (mNSS)13, проводя оценку через 24 ч и 72 ч после реперфузии (см. Таблицу 2).
5. Транскардиальная перфузия
- Обезболите мышь 1,5% пентобарбиталом натрия (в соответствии с утвержденными в учреждении протоколами). Поместите мышь обратно в клетку и подождите 10 минут. Затем ущипните пальцы ног мыши, чтобы проверить отсутствие рефлексов и обеспечить глубокую анестезию.
- Расположите мышь в лежачем положении на подставке из пенопласта и закрепите ее конечности.
- Отрежьте кончик иглы 25 G, чтобы затупить его, не допуская прокола стенки аорты. Подсоедините иглу к шприцу, наполненному 20 мл физраствора.
- Поднимите шерсть грудной клетки и с помощью ножниц срежьте кожу, чтобы обнажить мечевидный отросток. Возьмитесь за мечевидный отросток и разрежьте горизонтально под ним, чтобы обнажить диафрагму, открыв мышечный слой. Аккуратно разрежьте диафрагму ножницами, не допуская повреждения сердца.
- Разрежьте вдоль внешней стороны грудины, чтобы открыть грудную клетку с обеих сторон, переверните переднюю стенку грудной клетки и закрепите ее гемостатитом.
- С помощью ватного тампона удалите жир у основания сердца, обнажив корень аорты.
- Закрепите сердце щипцами, введите иглу в верхушку сердца и продвигайтесь наискось вверх, пока игла не станет видна через стенку аорты. Зажмите иглу на месте.
- Сделайте небольшой надрез в правом предсердии, чтобы наблюдать за кровотоком. Неуклонно прокалывайте физиологический раствор с помощью шприца, следя за тем, чтобы кровь выходила из правого предсердия. Как только сточные воды станут прозрачными, прекратите перфузию14.
- После перфузии обезглавьте мышь, чтобы собрать мозг15 и поместите его в морозильную камеру при температуре -20 °C для дальнейшей обработки.
6. Оценка объема инфаркта с помощью окрашивания ТТС
- Быстро заморозьте полученные ткани мозга в морозильной камере при температуре -20 °C на 20 минут, затем поместите их на предварительно охлажденную форму для нарезки мозга и нарежьте на ломтики толщиной 1 мм.
- Полученные участки мозга погрузить в 2% раствор ТТС и инкубировать при 37 °С в течение 20 мин.
- Погрузите срезы мозга в 4% параформальдегид на ночь и сделайте фотографии на следующий день.
- Измерьте площадь инфаркта для каждого среза и общую площадь мозга с помощью ImageJ. Рассчитайте коэффициент объема инфаркта по формуле: Объем инфаркта % = (Сумма инфарктных площадей / Сумма общих площадей мозга) × 100%.
Результаты
При создании модели MCAO основные инструменты, используемые для изготовления нитей и готовых нитей, показаны на рисунке 3. После производства филамента модель MCAO устанавливается путем введения филамента через наружную сонную артерию, при этом продолжительность операции записывается. Успешное моделирование определяется оценкой по шкале Лонга в 1-3 часа после удаления филамента. Масса тела контролируется ежедневно после операции. Неврологические дефициты оцениваются с помощью модифицированных шкал неврологической тяжести (mNSS) через 24 ч и 72 ч после операции. Ишемическое повреждение оценивается с помощью окрашивания TTC.
В группе 10-миллиметровых нитей у пяти из десяти мышей наблюдалось субарахноидальное кровоизлияние (САК), причем два из этих случаев закончились смертельным исходом. Следовательно, все пять пораженных мышей были исключены из исследования. Напротив, ни у одной из мышей в группе 5-миллиметровых нитей не наблюдалось САК. Коэффициент успешности моделирования составил 100% в группе 5-миллиметровых волокон, что значительно выше по сравнению с 50-процентным успехом, наблюдаемым в группе 10-миллиметровых волокон.
Время хирургического вмешательства, определяемое как продолжительность от разреза кожи до введения нити, было значительно короче в группе 5 мм филамента по сравнению с группой 10 мм (614 с ± 49,15 с против 758 с ± 65,63 с, P < 0,01) (рис. 4A). Обе группы филаментов продемонстрировали значительное снижение послеоперационной массы тела по сравнению с группой фиктивной операции; однако существенной разницы между двумя размерами нитей накала не наблюдалось (рисунок 4B).
Окрашивание TTC подтвердило инфаркт головного мозга в самодельной модели MCAO, индуцированной филаментом (рис. 5). Через три дня после операции объем инфаркта составил 21,48% ± 6,79% в группе 5 мм и 19,85% ± 7,01% в группе 10 мм, без существенной статистической разницы между двумя группами в отношении размера инфаркта. В каждой группе мышей наблюдалась вариабельность в области инфаркта головного мозга: у трех из пяти мышей площадь инфаркта была больше (рис. 5B,C), а у двух — меньшая площадь инфаркта (рис. 5E, F). Количественная оценка объема инфаркта показана на рисунке 5G.
Дефицит неврологических функций оценивали по шкале mNSS на 1-й и 3-й день после MCAO, как показано на рисунке 6. В оба дня в группах 5 мм и 10 мм наблюдалось значительно более высокие баллы mNSS по сравнению с группой фиктивной операции, при этом не наблюдалось существенной разницы между баллами mNSS в группах 5 мм и 10 мм.

Рисунок 1: Конструкция нити и маркировка. (A) Равномерная намотка нейлонового шовного материала 6-0 на пластиковую линейку. (B) Маркировка и вертикальное разрезание раны для создания нити толщиной 2 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
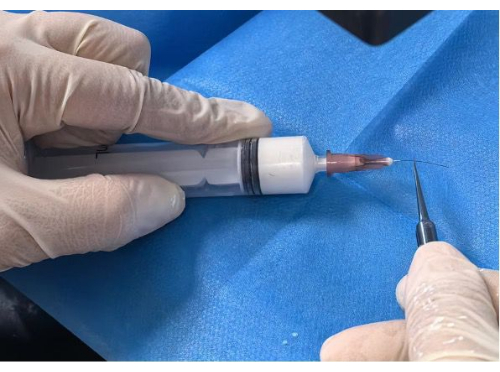
Рисунок 2: Нанесение покрытия на нить. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
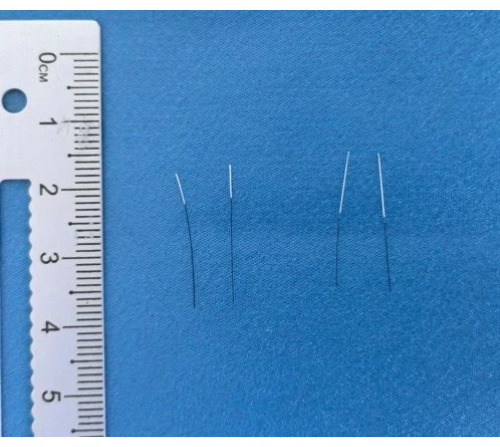
Рисунок 3: Готовые нити. Изображения готовых нитей после нанесения покрытия и маркировки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Продолжительность операции и масса тела мыши. (A) Продолжительность операции. (B) Масса тела мыши, измеренная до операции и через три дня после операции. Статистические различия были проанализированы с помощью ANOVA и теста Тьюки. Данные представлены в виде среднего значения ± SEM, n = 5, **P < 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Окрашенные TTC участки мозга. Репрезентативные срезы мозга, окрашенные TTC, показывают участки здоровых тканей (красные) и ишемическое повреждение (белые) в группах Sham (A,D), 5 мм MCAO (B,E) и 10 мм MCAO (C,F). У трех из пяти мышей площадь инфаркта увеличивается (B,C), а у двух — меньшая площадь инфаркта (E,F). (G) Количественная оценка объема инфаркта. Статистические различия были проанализированы с помощью ANOVA и теста Тьюки. Данные представлены в виде среднего ± SEM, n = 5, **P < 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Неврологические показатели после MCAO. Неврологические баллы были зарегистрированы на1-й и3-й день после MCAO. Статистические различия были проанализированы с помощью ANOVA и теста Тьюки. Данные представлены в виде среднего ± SEM, n = 5, ****P < 0,001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Отбеливание зрачков после введения филамента. Отбеливание зрачка наблюдается после введения 10 мм силиконовой нити. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| 0 баллов | Отсутствие симптомов неврологических повреждений | |
| 1 балл | Невозможность полного разгибания контралатеральной передней конечности | |
| 2 балла | Круговое движение в контрлатеральную сторону при ходьбе | |
| 3 балла | Наклон в контрлатеральную сторону во время ходьбы | |
| 4 балла | Неспособность самостоятельно ходить, потеря сознания | |
Таблица 1: Оценка по шкале Лонга для успеха модели. Система оценки Longa используется для определения успешности модели.
| Тесты | Точки | ||
| Поднятие мыши за хвост | 3 | ||
| Сгибание передней конечности | 1 | ||
| Сгибание задней конечности | 1 | ||
| Головка перемещена на >10° к вертикальной оси в течение 30 секунд | 1 | ||
| Ходячая мышь на полу | 3 | ||
| Обычная прогулка | 0 | ||
| Невозможность ходить прямо, | 1 | ||
| Кружение в сторону паретичной стороны | 2 | ||
| Падение на парезный бок | 3 | ||
| Испытание на балансировку луча | 6 | ||
| Балансирует при устойчивой осанке | 0 | ||
| Захватывает сторону балки | 1 | ||
| Обнимает бревно и 1 конечность падает вниз с балки | 2 | ||
| Обнимает бревно и 2 конечности падают вниз с бревна, или вращается на бревне [>30 с] | 3 | ||
| Пытается балансировать на луче, но падает [>20 с] | 4 | ||
| Пытается сбалансироваться на луче, но падает [>10 с] | 5 | ||
| Падает, нет попыток балансировать или висеть на бревне [<10 с] | 6 | ||
| Отсутствие рефлексов | 2 | ||
| Рефлектор ушной раковины (голова трясется при прикосновении к слуховому проходу) | 1 | ||
| роговичный рефлекс (моргание глаз при легком прикосновении к роговице ватой) | 1 | ||
Таблица 2: Модифицированные шкалы неврологической тяжести (mNSS). Модифицированные шкалы неврологической тяжести (mNSS), используемые для оценки неврологической тяжести.
Обсуждение
Данное исследование демонстрирует простой и экономически эффективный метод изготовления нити, подтверждая его целесообразность при создании модели MCAO. Длина силиконового покрытия нити может быть отрегулирована в соответствии с экспериментальными потребностями, что обеспечивает дополнительную гибкость. При приготовлении нитевидной эмболии диаметром 5 мм достигнут 100% успех без каких-либо случаев субарахноидального кровоизлияния (САК) у мышей. В группе, использующей эмболы с 10 мм нитями, были случаи САК, в то время как у остальных мышей наблюдался явный инфаркт в области МСА. Важным шагом в снижении SAH было небольшое втягивание нити при столкновении с сопротивлением во время процедуры. В предварительном эксперименте почти половина мышей без этой регулировки испытывала САК при использовании силиконовой нити с покрытием 5 мм. Нить столкнулась с сопротивлением, достигнув передней мозговой артерии12 мыши. Поэтому любое незначительное изменение положения мыши перед извлечением нити может привести к разрыву кровеносного сосуда. Небольшое втягивание нити накала может эффективно блокировать начало MCA, предотвращая попадание кончика нити в ACA и вызывая SAH.
При использовании 10-мм нитей наблюдалась более высокая частота САК, что может быть связано с уменьшенной гибкостью нити из-за увеличенной длины силиконового покрытия. Эта жесткость может привести к тому, что филамент проколет сосудов при столкновении с сопротивлением во время введения. Кроме того, продолжительность операции была больше для группы 10 мм, что согласуется с повышенной сложностью манипуляций с более длинными нитями с силиконовым покрытием, что приводит к увеличению времени операции. Это указывает на то, что более короткие длины филаментов с силиконовым покрытием могут не только обеспечить высокий уровень успеха моделирования, но и снизить хирургическую сложность и возникновение послеоперационных осложнений.
Тот факт, что использование волокон с силиконовым покрытием толщиной 5 мм и 10 мм у мышей модели MCAO не показывает существенных различий в площадях инфаркта головного мозга и поведенческих оценках, позволяет предположить, что при определенных условиях длина силиконового покрытия на нити может оказывать минимальное влияние на результаты эксперимента. Однако внутри каждой группы наблюдались заметные различия в зонах инфаркта головного мозга. В группе 5 мм у трех из пяти мышей наблюдались большие площади инфаркта, включая такие области, как таламус, гипоталамус и гиппокамп, в то время как у других были меньшие площади инфаркта. Распределение размеров инфаркта в группе 10 мм было аналогично распределению в группе 5 мм, что может быть связано с анатомической изменчивостью сосудистой сети головного мозга мышей15,16. Известным фактором, способствующим этому, является изменение проходимости задней коммуникативной артерии (PcomA)16. PcomA являются основными коллатеральными артериями после MCAO, индуцированными филаментом, снабжающими такие области, как гиппокамп и таламус17. Тем не менее, примерно у 90% мышей C57BL/6 наблюдается недоразвитие или отсутствие PcomAs17, и доля мышей с большими площадями инфаркта в каждой группе близка к этому проценту. Мыши с недоразвитыми или отсутствующими PcomA, в дополнение к MCA, также имеют затрудненное кровоснабжение задней мозговой артерии (PCA) в модели MCAO, что приводит к увеличению площади инфаркта12. В исследовании использовались более короткие нити с силиконовым покрытием (2 мм), чтобы избежать препятствования кровоснабжению PCA, но это значительно снизиловероятность успеха модели. Вариации анатомического расстояния между MCA и PCA в месте соединения, образующего Willis Circle, наблюдались у разных линий мышей и весовых категорий19. Следовательно, для обеспечения успешности моделирования и стабильности размеров инфаркта в когортах крайне важно получить покрытые силиконом нити индивидуальной длины, адаптированные к конкретным анатомическим вариациям сосудистой сети головного мозга мышей различных штаммов и массы тела. Описанный в данной статье метод получения филамента способствует проведению таких исследований.
Около 65% случаев ишемического инсульта сопровождаются временной или постоянной потерей зрения, обычно связанной с поражением оптического излучения или зрительной коры20,21. Тем не менее, пациенты с инсультом также имеют более высокий риск острой ишемии сетчатки22,23. В настоящее время нет четких экспериментальных моделей ишемического инсульта на животных, включающих ишемию сетчатки. У мышей, использующих нити диаметром 10 мм, у трех мышей наблюдалось ипсилатеральное отбеливание зрачков после введения нити, которое исчезло примерно через 5 минут после извлечения нити (рис. 7). Это явление указывает на окклюзию глазной артерии после введения филамента, но у мышей с филаментами 5 мм это не наблюдалось. В настоящее время нет единого мнения о происхождении глазной артерии у подопытных животных. Некоторые исследования показывают, что, как и у людей, глазная артерия (ОА) у мышей C57BL/6J берет начало от внутренней сонной артерии 24,25,26. Другие исследования утверждают, что, как и у крыс, мышиный OA происходит из крыловидной артерии (PPA)27. Следовательно, учитывая изменчивость в происхождении мышиного ОА, отбеливание зрачков, наблюдаемое у некоторых мышей из группы 10 мм, может быть связано с этой изменчивостью. У этих мышей глазные артерии, исходящие из ППА, испытывают недостаточное кровоснабжение из-за окклюзии в начале артерии 10-миллиметровой нитью, покрытой силиконом при введении, что приводит к отбеливанию зрачков. Такого явления не наблюдалось в группе 5 мм, вероятно, потому, что более короткая длина силикона была недостаточной для блокировки PPA.
Несмотря на то, что данное исследование представляет собой эффективный метод производства филаментов и экспериментально подтверждает его эффективность, предлагая стратегию индивидуализированной подготовки филаментов, оно также имеет некоторые ограничения. Силиконовое покрытие на нитях ручной работы наносится неравномерно, в результате чего получается неправильная цилиндрическая форма. В процессе изготовления шприц должен работать с постоянной скоростью, чтобы избежать несоответствий силиконового покрытия спереди и сзади нити. Доступные инструменты и простой в использовании процесс позволяют новичкам практиковаться в модели MCAO с нитями ручной работы. В будущих исследованиях можно было бы изучить усовершенствования в конструкции филамента, такие как оптимизация материалов или регулировка размеров, чтобы уменьшить частоту осложнений и повысить воспроизводимость модели. Более того, учет анатомических различий для достижения более стабильной модели будет иметь решающее значение для лучшего понимания механизмов и стратегий лечения ишемических цереброваскулярных заболеваний.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Эта работа была поддержана Медицинским фондом Ву Цзепина (320.6750.161290).
Материалы
| Name | Company | Catalog Number | Comments |
| 10 mL Syringe | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 2,3,5-Triphenyltetrazolium Chloride (TTC) | Sigma-Aldrich | G3005 | Dye for TTC staining |
| 24-well culture plate | Corning | CLS3527 | Vessel for TTC staining |
| 26 G syringe needle | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 4% paraformaldehyde | Servicebio | G1101 | Tissue fixation |
| 6-0 nylon suture | Haidike Medical Products Co., Ltd. | Materials for making filaments | |
| Anesthesia system for isoflurane | Rwd Life Science Co., Ltd. | R610 | Anesthetized animal |
| Bipolar electrocoagulation generator | Yirun Medical Instrument Co., Ltd. | ZG300 | Equipment for surgery |
| Constant temperature water bath | Spring Instrument Co., Ltd. | HH-M6 | TTC staining |
| Eye ointment | Guangzhou Pharmaceutical | H44023098 | Material for surgery |
| Heat blanket | ZH Biomedical Instrument Co., Ltd. | Maintain body temperatur | |
| Isoflurane | Rwd Life Science Co., Ltd. | R510-22-10 | Anesthetized animal |
| Meloxicam | Boehringer-Ingelheim | J20160020 | Analgesia for animal |
| Microsurgical artery clamp | Shanghai Jinzhong Surgical Instruments Co., Ltd. | W40130 | Instrument for surgery |
| Microsurgical hemostatic clamp forceps | Shanghai Jinzhong Surgical Instruments Co., Ltd. | M-W-0022 | Instrument for surgery |
| Microsurgical instruments set | Rwd Life Science Co., Ltd. | SP0009-R | Equipment for surgery |
| Mouse thermometer | Hubei Dasjiaer Biotechnology | FT3400 | Intraoperative temperature monitoring |
| Pentobarbital sodium | Sigma-Aldrich | P3761 | Euthanized animal |
| Shaver | Joyu Electrical Appliances | PHC-920 | Equipment for surgery |
| Silicone Sealant | Kafuter | K-704 | Materials for making filaments |
| Stereomicroscope | Rwd Life Science Co., Ltd. | 77001S | Equipment for surgery |
| Suture thread with needle (3-0) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | F404SUS302 | Equipment for surgery |
Ссылки
- Collaborators GBDS. Global, regional, and national burden of stroke and its risk factors, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet Neurol. 20 (10), 795-820 (2021).
- Kleindorfer, D. O., et al. Guideline for the prevention of stroke in patients with stroke and transient ischemic attack: A guideline from the American Heart Association/American Stroke Association. Stroke. 52 (7), e364-e467 (2021).
- Saini, V., Guada, L., Yavagal, D. R. Global epidemiology of stroke and access to acute ischemic stroke interventions. Neurology. 97 (20 Suppl 2), S6-S16 (2021).
- Hill, M. D., Coutts, S. B. Alteplase in acute ischaemic stroke: The need for speed. Lancet. 384 (9958), 1904-1906 (2014).
- Asif, K. S., et al. Mechanical thrombectomy global access for stroke (mt-glass): A mission thrombectomy (mt-2020 plus) study. Circulation. 147 (16), 1208-1220 (2023).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Des Devel Ther. 9, 3445-3454 (2015).
- Ringelstein, E. B., et al. Type and extent of hemispheric brain infarctions and clinical outcome in early and delayed middle cerebral artery recanalization. Neurology. 42 (2), 289-298 (1992).
- Shaik, N. F., Regan, R. F., Naik, U. P. Platelets as drivers of ischemia/reperfusion injury after stroke. Blood Adv. 5 (5), 1576-1584 (2021).
- Zhang, S. R., et al. Large-scale multivariate analysis to interrogate an animal model of stroke: Novel insights into poststroke pathology. Stroke. 52 (11), 3661-3669 (2021).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, Y., Ito, A., Takai, K., Saito, N. Blocking pterygopalatine arterial blood flow decreases infarct volume variability in a mouse model of intraluminal suture middle cerebral artery occlusion. J Neurosci Methods. 174 (1), 18-24 (2008).
- Yuan, F., et al. Optimizing suture middle cerebral artery occlusion model in c57bl/6 mice circumvents posterior communicating artery dysplasia. J Neurotrauma. 29 (7), 1499-1505 (2012).
- Bieber, M., et al. Validity and reliability of neurological scores in mice exposed to middle cerebral artery occlusion. Stroke. 50 (10), 2875-2882 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), e3564 (2012).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Mccoll, B. W., Carswell, H. V., Mcculloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond mca territory after intraluminal filament occlusion in c57bl/6j mice. Brain Res. 997 (1), 15-23 (2004).
- Liu, Z., et al. Optimisation of a mouse model of cerebral ischemia-reperfusion to address issues of survival and model reproducibility and consistency. Comput Intell Neurosci. 2022, 7594969 (2022).
- Ward, R., Collins, R. L., Tanguay, G., Miceli, D. A quantitative study of cerebrovascular variation in inbred mice. J Anat. 173, 87-95 (1990).
- Hanna, K. L., Hepworth, L. R., Rowe, F. Screening methods for post-stroke visual impairment: A systematic review. Disabil Rehabil. 39 (25), 2531-2543 (2017).
- Rowe, F. J. Stroke survivors' views and experiences on impact of visual impairment. Brain Behav. 7 (9), e00778 (2017).
- Scoles, D., Mcgeehan, B., Vanderbeek, B. L. The association of stroke with central and branch retinal arterial occlusion. Eye (Lond). 36 (4), 835-843 (2022).
- Kim, Y. D., et al. Cerebral magnetic resonance imaging of coincidental infarction and small vessel disease in retinal artery occlusion. Sci Rep. 11 (1), 864 (2021).
- Emiroglu, M. Y., et al. Effects of obstructive carotid artery disease on ocular circulation and the safety of carotid artery stenting. Heart Lung Circ. 26 (10), 1069-1078 (2017).
- Cotofana, S., Lachman, N. Arteries of the face and their relevance for minimally invasive facial procedures: An anatomical review. Plast Reconstr Surg. 143 (2), 416-426 (2019).
- Xu, X., et al. Dibazol-induced relaxation of ophthalmic artery in C57bl/6J mice is correlated with the potency to inhibit voltage-gated ca(2+) channels. Exp Eye Res. 231, 109468 (2023).
- Justic, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены