Method Article
נימה מצופה סיליקון בעבודת יד לעכברים דגמי חסימת עורק המוח האמצעי
In This Article
Summary
פרוטוקול זה מתאר שיטה פשוטה ליצירת חוטים מצופים למודל חסימת עורק המוח האמצעי (MCAO) בעכברים באמצעות סיליקון, תפרי ניילון ומחטי מזרק. שיטה זו מאפשרת ייצור חוטים בקוטר עקבי ואורכי עטיפת סיליקון שונים המותאמים לצרכי הניסוי.
Abstract
ככל שהאוכלוסייה העולמית מזדקנת, שבץ איסכמי עלה והפך לגורם השני המוביל לנכות ותמותה ברחבי העולם, מה שמטיל נטל עצום הן על החברה והן על המשפחות. למרות שטיפולים כגון פקקת תוך ורידית והתערבויות אנדווסקולריות יכולים לשפר באופן משמעותי את התוצאות עבור חולים עם שבץ איסכמי חריף, רק אחוז קטן מהאנשים מפיקים תועלת מטיפולים אלה. כדי לקדם את הבנתנו את המחלה ולגלות טיפולים יעילים יותר, חוקרים מפתחים ומשכללים ללא הרף מודלים של בעלי חיים. בין אלה, מודל חסימת עורק המוח האמצעי (MCAO) בולט כמודל הנפוץ ביותר בחקר מחלות כלי דם במוח. החוט המשמש במודל זה חיוני להתפתחותו. פרוטוקול זה מתאר שיטה ליצירת חוטים בקטרים עקביים ואורכים משתנים של ציפוי סיליקון. מודל MCAO המיוצר בשיטה זו בעכברי C57 הוכיח הצלחה ועקביות גבוהות, ומציע כלי רב ערך לחקירות מותאמות אישית של מחלות כלי דם במוח איסכמיות.
Introduction
שבץ מוחי הוא אחד הגורמים השכיחים ביותר לתמותה ונכות ברחבי העולם. שבץ איסכמי ודימום הם הסוגים העיקריים של אירועים במוח, כאשר שבץ איסכמי מהווה כ-87% מהמקרים 1,2,3. נכון לעכשיו, ישנן שתי שיטות טיפול לחולים עם שבץ איסכמי: טיפול תרופתי עם מפעיל פלסמינוגן רקמות רקומביננטי (rtPA) וכריתת פקקת מכנית. עם זאת, חלון הטיפולים הצר וקריטריוני ההדרה הנרחבים מגבילים את יישום הטיפולים הללו, ומועילים רק למיעוט מהמטופלים. זה מדגיש את הצורך במאמצים מתמשכים לשיפור הטיפולים בשבץ איסכמי 4,5. מודלים במבחנה אינם מספיקים לשכפול התגובות הפתופיזיולוגיות המורכבות לאחר שבץ מוחי, מה שהופך מודלים של בעלי חיים למרכיב הכרחי במחקר שבץ פרה-קליני. איסכמיה מוחית מוקדית אנושית נגרמת לרוב על ידי חסימה טרומבוטית או תסחיפית של עורק המוח האמצעי (MCA), מה שהופך מודלים של מכרסמים שנועדו לדמות חסימת MCA (MCAO) לרלוונטיים ביותר6.
מודל MCAO המושרה על ידי נימה, המאומץ ביותר בחקר שבץ מוחי, מקל על חסימה בתחילת עורק המוח האמצעי (MCA) ורפרפוזיה לאחר מכן, מה שמוביל לאוטמים נרחבים באזורים תת-קורטיקליים וקליפת המוח של המוח. היתרון של מודל זה טמון ביכולתו להחזיר את זרימת הדם לאחר גרימת איסכמיה מוקדית, ובכך מקביל לתהליכים הפתופיזיולוגיים שנצפו בשבץ מוחי אנושי7. בנוסף, המודל מדמה פגיעה ברפרפוזיה, גורם קריטי בהיקף הנזק8. עם זאת, למודל MCAO יש מגבלות, כולל שונות בנפח האוטם, כאשר סטיית התקן עשויה להגיע עד 64% מהערך הממוצע בחלק מהמחקרים9. למרות למעלה משלושה עשורים של שימוש, המאמצים לשפר את אמינות המודל נמשכים, אך שינויים משמעותיים בנפח הנגע האיסכמי נמשכים במחקרים ובמעבדות 10,11,12.
מאמר זה מציג נימה בייצור עצמי ליצירת מודלים המעריכים ציוני גירעון נוירולוגי ואזורי אוטם מוחי. הוא בוחן את המתאם בין אורכי נימה מצופים סיליקון לבין ההצלחה והיציבות של מודל MCAO. טכניקת ייצור זו מניבה חוטים בעלי עקביות ראויה לשבח, ותורמת לפיתוח מודל MCAO יציב יחסית.
Protocol
כל ההליכים בבעלי חיים עמדו בהליכי הניסוי ובתקנים שאושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של בית החולים העממי של מחוז שאנשי (מספר אישור: ועדת האתיקה הרפואית המחוזית מס' 64 לשנת 2024). העכברים ששימשו בניסוי זה היו עכברים זכרים C57BL/6, בני 8-10 שבועות, במשקל 24-26 גרם. פרטים על הריאגנטים והציוד המשמשים מפורטים בטבלת החומרים.
1. הכנת נימה
- סימון החוט המקורי: סובב את תפר הניילון 6-0 באופן שווה סביב לוחית סרגל פלסטיק. סמן סימנים במרחק של 5 מ"מ ו-10 מ"מ מראש החוט (כולל נקודת סימון הציפוי ונקודת סימון עומק ההכנסה).
- חותכים אנכית כלפי מטה עם להב כדי להבטיח ששני הקצוות עגולים לחלוטין, וכתוצאה מכך חוט ראשוני באורך 2 ס"מ (איור 1).
- ייצור מכשיר הציפוי: השתמש במלקחיים המוסטטיים כדי לנתק את ראש המחט של מזרק 26 גרם, ולאחר מכן לטש את חור המחט לעיגול מושלם עם נייר זכוכית. צייר 2 מ"ל של איטום סיליקון K-704 עם מזרק 10 mK, ולבסוף, חבר את ראש המחט למזרק.
- ציפוי הנימה: הכנס את החוט הראשוני לחור המחט המוכן עד למצב המסומן של 5 מ"מ או 10 מ"מ. דחפו לאט ובהתמדה את המזרק עד שהחוט מצופה במלואו תחת סטריאומיקרוסקופ (איור 2).
- הגדרת החוט המצופה: קבע את החוט המצופה זקוף בעזרת סרט דבק והמתן כ-20 דקות עד שהסיליקון יתייצב במלואו.
- עיקור ואריזה: משרים את החוטים המוכנים באלכוהול 75%, מנגבים אותם יבשים בעזרת צמר גפן ואז אורזים אותם בצינורות צנטריפוגה של 5 מ"ל.
2. דגם MCAO
הערה: כלים כירורגיים עוקרו על ידי חיטוי (121 מעלות צלזיוס ב-15 psi למשך 60 דקות). שולחן הניתוחים וציוד אחר עברו חיטוי באמצעות 75% אתנול. העכברים הוצמו במשך 8 שעות לפני הניתוח, אך אפשרו להם גישה חופשית למים.
- יש לתת 5 מ"ג/ק"ג של מלוקסיקם תת עורי לשיכוך כאבים 60 דקות לפני הניתוח. חבר שמיכת חום כדי לשמור על טמפרטורת גוף העכבר על 37 מעלות צלזיוס במהלך ההרדמה.
- יש לעורר הרדמה עם איזופלורן 4% עד להפסקת התנועות הספונטניות ועוויתות השפם, ולאחר מכן לשמור על הרדמה ברמה של 1.5% (בהתאם לפרוטוקולים שאושרו על ידי המוסד). יש למרוח משחת עיניים על שתי העיניים.
- הניחו את העכבר במצב שכיבה, אבטחו את ראשו וגפיו, גלחו את השיער על צווארו וחזהו העליון וחטאו את העור ב-75% אתנול מבפנים החוצה.
- בצע חתך עור באורך 2.5 ס"מ לאורך קו האמצע של הצוואר, מהלסת התחתונה ועד עצם החזה.
- נתח בצורה בוטה את שרירי הצוואר הימני כדי לחשוף את מעטפת הצוואר. השתמש במלקחיים עיניים כדי לפתוח את הנדן ולהפריד בין עורק הצוואר המשותף (CCA), עורק הצוואר החיצוני (ECA) ועורק הצוואר הפנימי (ICA), תוך הקפדה על הפרעה לעצב התועה.
- קשר זמנית את ה-CCA עם קשר החלקה לפני ההסתעפות והדק את ה-ICA עם מהדק עורק מיקרו-כירורגי.
- צרבו את עורק בלוטת התריס העליון מה-ECA באמצעות עט קרישה דו קוטבי.
- השאירו שני חוטים על ה-ECA לקשירה: אחד בקצה הדיסטלי לקשירה קבועה והשני בקצה הפרוקסימלי עם קשר רופף לשימוש עתידי. בצע חתך של כ-0.5 מ"מ בין שתי הקשרים ב-ECA באמצעות מספריים עיניים כדי להחדיר את החוטים.
- הכנס את החוט המצופה סיליקון בגודל 5 מ"מ או 10 מ"מ לתוך ה-CCA דרך החתך ולאחר מכן אבטח אותו על ידי הידוק הקשר הרופף.
- לאחר כריתת הקצה הדיסטלי של ה-ECA והוצאת המהדק מה-ICA, משוך את החוט לפיצול ה-CCA. לאחר מכן, הפוך וקדם את החוט לתוך ה-ICA העמוק עד שמרגישים התנגדות. משוך מעט את החוט ואבטח אותו על ידי הידוק הקשר.
- לתפור את עור החיה בתפר 3-0 ולחטא את הפצע ביוד. הנח את העכבר בתא התאוששות למשך שעה.
- הרדמו שוב את העכבר, הסירו בעדינות את החוטים, קשרו את חוט קשירת ה-ECA המאבטח את החוט ושחררו את קשר ה-CCA כדי להחזיר את זרימת הדם ולהחזיר את עורק המוח האמצעי.
- חתוך את החוטים העודפים, תפר את עור הצוואר וחטא את האזור פעם נוספת.
3. מבצע מזויף
- לפעולות דמה, הכנס חוט מצופה סיליקון בגודל 7 מ"מ כדי לחסום את עורק המוח האמצעי הימני ולאחר מכן משוך אותו מיד כדי לאפשר עירוי מיידי.
הערה: ההליך הבא זהה לזה המבוצע בבעלי חיים הסובלים מאיסכמיה מוחית.
4. נוירוסקור
- מקם חיות ניסוי מכל קבוצה בשדה פתוח ובצע ניקוד התנהגותי לאחר הניתוח 4 שעות לאחר רפרפוזיה של איסכמיה מוחית.
- לדוגמנות מוצלחת, שקול ציונים בין 1 ל-3. קריטריוני ההערכה מבוססים על שיטת הניקוד של לונגה10, כמפורט בטבלה 1.
- להעריך ליקויים נוירולוגיים על פי ציוני החומרה הנוירולוגית המותאמים (mNSS)13, עם הערכות שבוצעו 24 שעות ו-72 שעות לאחר הרפרפוזיה (ראה טבלה 2).
5. זלוף טרנס-קרדיולוגי
- להרדים את העכבר עם 1.5% נתרן פנטוברביטל (בהתאם לפרוטוקולים שאושרו על ידי המוסד). החזר את העכבר לכלוב שלו והמתן 10 דקות. לאחר מכן, צבט את אצבעות העכבר כדי לבדוק אם אין רפלקסים ולהבטיח הרדמה עמוקה.
- מקם את העכבר במצב שכיבה על מעמד קצף ואבטח את גפיו.
- חותכים את קצה המחט של 25 גרם כדי להקהות אותה, ולמנוע ניקוב של דופן אבי העורקים. חבר את המחט למזרק מלא ב-20 מ"ל מי מלח.
- הרם את פרוות בית החזה והשתמש במספריים כדי לחתוך את העור כדי לחשוף את תהליך ה-xiphoid. אחוז בתהליך ה-xiphoid וחתוך אופקית מתחתיו כדי לחשוף את הסרעפת על ידי פתיחת שכבת השריר. חותכים בזהירות את הסרעפת במספריים, והימנעו מפגיעה בלב.
- חותכים לאורך הצד החיצוני של עצם החזה כדי לפתוח את כלוב הצלעות משני הצדדים, להפוך את הדופן הקדמית של בית החזה ולאבטח אותו עם המוסטטים.
- השתמש בצמר גפן כדי להסיר את השומן בבסיס הלב, ולחשוף את שורש אבי העורקים.
- אבטח את הלב בעזרת מלקחיים, הכנס את המחט בקודקוד הלב והתקדם באלכסון כלפי מעלה עד שהמחט נראית דרך דופן אבי העורקים. מהדק את המחט למקומה.
- בצע חתך קטן באטריום הימני כדי לצפות בזרימת הדם. הזרמת מי מלח בהתמדה עם המזרק, תוך צפייה בדם שיוצא מהפרוזדור הימני. לאחר שהקולחים צלולים, עצור את הזלוף14.
- לאחר הזלוף, ערפו את ראשו של העכבר כדי לקצור את המוח15 והניחו אותו במקפיא של -20 מעלות צלזיוס להמשך עיבוד.
6. הערכת נפח אוטם על ידי צביעת TTC
- הקפיאו את רקמות המוח שנרכשו במהירות במקפיא של -20 מעלות צלזיוס למשך 20 דקות, ואז הניחו אותן על תבנית חיתוך מוח מקוררת מראש וחתכו אותן לפרוסות בעובי 1 מ"מ.
- טבלו את חלקי המוח שהתקבלו בתמיסת TTC 2% ודגרו בטמפרטורה של 37 מעלות צלזיוס למשך 20 דקות.
- טבלו את פרוסות המוח ב-4% פרפורמלדהיד למשך הלילה וצלמו למחרת.
- מדדו את האזור המוקטם עבור כל פרוסה ואת האזור הכולל במוח באמצעות ImageJ. חשב את יחס נפח האוטם באמצעות הנוסחה: נפח האוטם % = (סכום אזורי האוטם / סכום סך אזורי המוח) × 100%.
תוצאות
ביצירת מודל MCAO, הכלים העיקריים המשמשים לייצור החוטים והחוטים המוגמרים מוצגים באיור 3. לאחר ייצור נימה, מודל ה-MCAO נוצר על ידי החדרת החוט דרך עורק הצוואר החיצוני, כאשר משך הניתוח נרשם. דוגמנות מוצלחת מוגדרת על ידי ציון לונגה של 1-3 4 שעות לאחר נסיגת נימה. משקל הגוף מנוטר מדי יום לאחר הניתוח. ליקויים נוירולוגיים מוערכים באמצעות ציוני חומרה נוירולוגיים מותאמים (mNSS) לאחר 24 שעות ו-72 שעות לאחר הניתוח. נזק איסכמי מוערך באמצעות צביעת TTC.
בקבוצת נימה של 10 מ"מ, חמישה מתוך עשרה עכברים חוו דימום תת-עכבישי (SAH), כאשר שניים מהמקרים הללו היו קטלניים. כתוצאה מכך, כל חמשת העכברים שנפגעו לא נכללו במחקר. לעומת זאת, אף אחד מהעכברים בקבוצת החוטים בקוטר 5 מ"מ לא חווה SAH. שיעור ההצלחה של המידול היה 100% בקבוצת נימה של 5 מ"מ, גבוה משמעותית בהשוואה לשיעור ההצלחה של 50% שנצפה בקבוצת נימה של 10 מ"מ.
זמן הניתוח, המוגדר כמשך הזמן מחתך העור ועד להחדרת חוטים, היה קצר משמעותית בקבוצת החוטים של 5 מ"מ בהשוואה לקבוצת החוטים של 10 מ"מ (614 שניות ± 49.15 שניות לעומת 758 שניות ± 65.63 שניות, P < 0.01) (איור 4A). שתי קבוצות החוטים הראו ירידה משמעותית במשקל הגוף לאחר הניתוח בהשוואה לקבוצת פעולת הדמה; עם זאת, לא נצפה הבדל משמעותי בין שני גדלי החוטים (איור 4B).
צביעת TTC אישרה אוטם מוחי במודל MCAO המושרה על ידי נימה מתוצרת עצמית (איור 5). שלושה ימים לאחר הניתוח, נפח האוטם היה 21.48% ±-6.79% בקבוצת ה-5 מ"מ ו-19.85% ±-7.01% בקבוצת ה-10 מ"מ, ללא הבדל סטטיסטי משמעותי בין שתי הקבוצות לגבי גודל האוטם. בכל קבוצת עכברים הייתה שונות באזור האוטם המוחי, כאשר שלושה מתוך חמישה עכברים הראו שטח אוטם גדול יותר (איור 5B,C) ושניים הראו שטח אוטם קטן יותר (איור 5E,F). כימות נפח האוטם מוצג באיור 5G.
ליקויים בתפקוד נוירולוגי הוערכו על ידי ציוני mNSS בימים 1 ו-3 לאחר MCAO, כפי שמוצג באיור 6. בשני הימים, הקבוצות של 5 מ"מ ו-10 מ"מ הראו ציוני mNSS גבוהים משמעותית בהשוואה לקבוצת פעולת הדמה, כאשר לא נצפה הבדל משמעותי בין ציוני ה-mNSS של קבוצות ה-5 מ"מ וה-10 מ"מ.

איור 1: בנייה וסימון נימה. (A) ליפוף תפר הניילון 6-0 באופן שווה סביב לוחית סרגל פלסטיק. (B) תיוג וחיתוך אנכי של הפצע ליצירת חוט באורך 2 סנטימטרים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
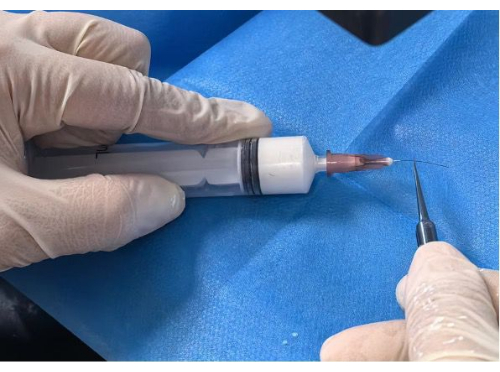
איור 2: ציפוי החוטים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
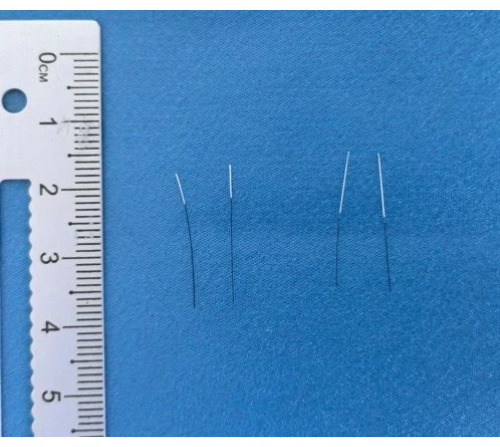
איור 3: חוטים מוגמרים. תמונות של החוטים שהושלמו לאחר ציפוי וסימון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: משך הניתוח ומשקל גוף העכבר. (A) משך הניתוח. (B) משקל גוף של עכבר שנמדד לפני הניתוח ושלושה ימים לאחר הניתוח. ההבדלים הסטטיסטיים נותחו באמצעות ANOVA ומבחן פוסט הוק Tukey. הנתונים מוצגים כממוצע ± SEM, n = 5, **P < 0.01. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: מקטעי מוח מוכתמים ב-TTC. קטעי מוח מייצגים מוכתמים ב-TTC המציגים אזורים של רקמה בריאה (אדום) ופגיעה איסכמית (לבן) עבור קבוצות Sham (A,D), 5 מ"מ MCAO (B,E) ו-10 מ"מ MCAO (C,F). שלושה מתוך חמישה עכברים מראים שטח אוטם גדול יותר (B,C), ושניים מציגים שטח אוטם קטן יותר (E,F). (ז) כימות נפח האוטם. ההבדלים הסטטיסטיים נותחו באמצעות ANOVA ומבחן פוסט הוק Tukey. הנתונים מוצגים כממוצע ± SEM, n = 5, **P < 0.01. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: ציונים נוירולוגיים לאחר MCAO. ציונים נוירולוגיים שנרשמו ביום הראשוןוהשלישי לאחר MCAO. ההבדלים הסטטיסטיים נותחו באמצעות ANOVA ומבחן פוסט הוק Tukey. הנתונים מוצגים כממוצע ± SEM, n = 5, ****P < 0.001. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: הלבנת אישונים לאחר החדרת נימה. הלבנת האישון נצפתה לאחר החדרת חוט הסיליקון 10 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| 0 נקודות | אין תסמינים של נזק נוירולוגי | |
| נקודה 1 | חוסר יכולת להאריך באופן מלא את הגפה הקדמית הנגדית | |
| 2 נקודות | סיבוב לצד הנגדי תוך כדי הליכה | |
| 3 נקודות | נשען לצד הנגדי בזמן הליכה | |
| 4 נקודות | חוסר יכולת ללכת באופן ספונטני, אובדן הכרה | |
טבלה 1: ניקוד לונגה להצלחת המודל. מערכת ניקוד לונגה משמשת לקביעת הצלחת המודל.
| בדיקות | נקודות | ||
| הרמת עכבר בזנב | 3 | ||
| כיפוף הגפה הקדמית | 1 | ||
| כיפוף הגפה האחורית | 1 | ||
| הראש נע >10° לציר האנכי תוך 30 שניות | 1 | ||
| עכבר מהלך על הרצפה | 3 | ||
| הליכה רגילה | 0 | ||
| חוסר יכולת ללכת ישר | 1 | ||
| מעגל לכיוון הצד הפרטי | 2 | ||
| נופל לצד הפרטי | 3 | ||
| מבחן איזון קרן | 6 | ||
| שיווי משקל עם יציבה יציבה | 0 | ||
| אוחז בצד הקורה | 1 | ||
| מחבק את הקורה ואיבר אחד נופל מהקורה | 2 | ||
| מחבק את הקורה ו-2 גפיים נופלות מהקורה, או מסתובב על הקורה [>30 שניות] | 3 | ||
| מנסה לאזן על הקורה אך נופל [>20 שניות] | 4 | ||
| מנסה לאזן על הקורה אך נופל [>10 שניות] | 5 | ||
| נופל, אין ניסיון לאזן או להיתלות על הקורה [<10 שניות] | 6 | ||
| היעדר רפלקסים | 2 | ||
| רפלקס אפרכסת (ראש רועד כשנוגעים בבשר השמיעה) | 1 | ||
| רפלקס קרנית (מצמוץ עיניים כאשר נוגעים קלות בקרנית עם כותנה) | 1 | ||
טבלה 2: ציוני חומרה נוירולוגיים מותאמים (mNSS). ציוני חומרה נוירולוגיים מותאמים (mNSS) המשמשים להערכת חומרה נוירולוגית.
Discussion
מחקר זה מדגים שיטה פשוטה וחסכונית לייצור נימה, המאשרת את היתכנותה ביצירת מודל MCAO. ניתן לכוונן את אורך מעיל הסיליקון של החוט בהתאם לצרכי הניסוי, מה שמציע גמישות נוספת. הכנת תסחיף נימה 5 מ"מ השיגה שיעור הצלחה של 100% ללא כל התרחשויות של דימום תת-עכבישי (SAH) בעכברים. בקבוצה שהשתמשה בתסחיף נימה של 10 מ"מ, היו מקרים של SAH, בעוד ששאר העכברים הראו אוטם ברור באזור MCA. צעד קריטי בהפחתת SAH היה למשוך מעט את החוט כאשר נתקל בהתנגדות במהלך ההליך. בניסוי הראשוני, כמעט מחצית מהעכברים ללא התאמה זו חוו SAH כאשר נעשה שימוש בחוט סיליקון מצופה 5 מ"מ. החוט נתקל בהתנגדות כשהגיע לעורק המוח הקדמי של העכבר12. לכן, כל שינוי קל במיקום העכבר לפני משיכת החוט עלול לקרוע את כלי הדם. נסיגה קלה של החוט יכולה לחסום ביעילות את מקור ה-MCA תוך מניעת כניסת קצה החוט ל-ACA וגרימת SAH.
בעת שימוש בחוטים של 10 מ"מ, נצפתה שכיחות גבוהה יותר של SAH, שניתן לייחס לגמישות המופחתת של החוט עקב אורך ציפוי הסיליקון המוגבר. קשיחות זו עלולה לגרום לנימה לנקב כלי דם כאשר נתקלים בהתנגדות במהלך ההחדרה. בנוסף, משך הניתוח היה ארוך יותר עבור קבוצת ה-10 מ"מ, עקבי עם הקושי המוגבר במניפולציה של חוטים ארוכים יותר מצופים סיליקון, וכתוצאה מכך זמני ניתוח ארוכים יותר. זה מצביע על כך שאורכי נימה מצופים סיליקון קצרים יותר יכולים לא רק להבטיח שיעור גבוה של הצלחה בדוגמנות אלא גם להפחית את המורכבות הכירורגית ואת התרחשותם של סיבוכים לאחר הניתוח.
הממצא כי השימוש בחוטים מצופים סיליקון בגודל 5 מ"מ ו-10 מ"מ בעכברי מודל MCAO אינו מראה הבדלים משמעותיים באזורי אוטם מוחי וציוני התנהגות מצביע על כך שבתנאים מסוימים, אורך ציפוי הסיליקון על החוט עשוי להיות בעל השפעה מינימלית על תוצאות הניסוי. עם זאת, בתוך כל קבוצה היו הבדלים ניכרים באזורי האוטם המוחי. בקבוצת ה-5 מ"מ, שלושה מתוך חמישה עכברים הראו אזורי אוטם גדולים יותר, כולל אזורים כמו התלמוס, ההיפותלמוס וההיפוקמפוס, בעוד שלאחרים היו אזורי אוטם קטנים יותר. התפלגות גדלי האוטם בקבוצת 10 מ"מ הייתה דומה לזו של קבוצת 5 מ"מ, מה שעשוי להיות קשור לשונות האנטומית של כלי הדם המוחיים של העכברים15,16. גורם תורם ידוע הוא השונות בסבלנות של העורק המתקשר האחורי (PcomA)16. ה-PcomAs הם העורקים הצדדיים העיקריים העוקבים אחר MCAO המושרה על ידי הנימה, ומספקים אזורים כמו ההיפוקמפוס ותלמוס17. עם זאת, כ-90% מעכברי C57BL/6 מציגים PcomAs17 לא מפותח או נעדר, ושיעור העכברים עם אזורי אוטם גדולים יותר בכל קבוצה קרוב לאחוז זה. לעכברים עם PcomAs לא מפותח או נעדר, בנוסף ל-MCA, יש גם חסימה באספקת הדם של עורק המוח האחורי (PCA) במודל MCAO, מה שמוביל לאזורי אוטם גדולים יותר12. מחקר השתמש בחוטים מצופים סיליקון קצרים יותר (2 מ"מ) כדי למנוע חסימת אספקת הדם של PCA, אך זה הפחית משמעותית את שיעור ההצלחה של המודל18. שינויים במרחק האנטומי בין ה-MCA ל-PCA בצומת היוצר את מעגל וויליס נצפו על פני זני עכברים שונים וקטגוריות משקל19. כתוצאה מכך, כדי להבטיח הצלחת מידול ויציבות של גודל האוטם בתוך קבוצות, קריטי להכין חוטים מצופים סיליקון באורכים מותאמים המותאמים לווריאציות האנטומיות הספציפיות בכלי הדם המוחיים של עכברים על פני זנים ומשקלי גוף שונים. שיטת ייצור החוטים המתוארת במאמר זה מקלה על מחקר כזה.
כ-65% ממקרי השבץ האיסכמי מלווים באובדן ראייה זמני או קבוע, המיוחס בדרך כלל לפגיעה בקרינה האופטית או בקליפת המוח הראייתית20,21. עם זאת, חולי שבץ מוחי נושאים גם סיכון גבוה יותר לאיסכמיה חריפה ברשתית22,23. נכון לעכשיו, אין מודלים ניסיוניים ברורים של שבץ איסכמי הכוללים איסכמיה ברשתית. בעכברים שהשתמשו בחוטים בקוטר 10 מ"מ, שלושה עכברים חוו הלבנת אישון במקביל לאחר החדרת חוטים, שנפתרה כ-5 דקות לאחר הוצאת החוט (איור 7). תופעה זו מצביעה על חסימה של עורק העיניים לאחר החדרת חוטים, אך זה לא נצפה בעכברים עם חוטים של 5 מ"מ. נכון לעכשיו, אין הסכמה לגבי מקור עורק העיניים בחיות ניסוי. מחקרים מסוימים מצביעים על כך שכמו בבני אדם, עורק העיניים (OA) בעכברי C57BL/6J מקורו בעורק הצוואר הפנימי 24,25,26. מחקר אחר מניח שכמו בחולדות, מקורו של OA בעכבר בעורק הפטריגופלטין (PPA)27. לפיכך, בהתחשב בשונות במקור הדלקת המפרקים של העכבר, הלבנת האישונים שנצפתה בחלק מהעכברים מקבוצת ה-10 מ"מ יכולה לנבוע משונות זו. בעכברים אלה, עורקי העיניים שמקורם ב-PPA חווים אספקת דם לא מספקת עקב חסימה בתחילת העורק על ידי חוט מצופה סיליקון בגודל 10 מ"מ בעת ההחדרה, וכתוצאה מכך הלבנת האישונים. תופעה כזו לא התרחשה בקבוצת ה-5 מ"מ, ככל הנראה מכיוון שהאורך הקצר יותר של הסיליקון לא הספיק כדי לחסום את ה-PPA.
למרות שמחקר זה מספק שיטה יעילה לייצור חוטים ומאמת את יעילותו באופן ניסיוני, ומציע אסטרטגיה להכנה פרטנית של חוטים, יש לו גם כמה מגבלות. ציפוי הסיליקון על החוטים בעבודת יד אינו מיושם באופן אחיד, וכתוצאה מכך צורה גלילית לא סדירה. במהלך תהליך הייצור, יש להפעיל את המזרק במהירות קבועה כדי למנוע חוסר עקביות בציפוי הסיליקון בחלק הקדמי והאחורי של הנימה. כלים משתלמים ותהליך קל לביצוע מאפשרים למתחילים לתרגל את מודל ה-MCAO עם חוטים בעבודת יד. מחקר עתידי יכול לחקור שיפורים בעיצוב חוטים, כגון אופטימיזציה של חומרים או התאמת מידות, כדי להפחית את שכיחות הסיבוכים ולשפר את יכולת השחזור של המודל. יתר על כן, התחשבות בהבדלים אנטומיים להשגת מודל יציב יותר תהיה חיונית להבנה טובה יותר של המנגנונים ואסטרטגיות הטיפול במחלות כלי דם במוח איסכמיות.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הרפואית וו ג'י-פינג (320.6750.161290).
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL Syringe | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 2,3,5-Triphenyltetrazolium Chloride (TTC) | Sigma-Aldrich | G3005 | Dye for TTC staining |
| 24-well culture plate | Corning | CLS3527 | Vessel for TTC staining |
| 26 G syringe needle | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 4% paraformaldehyde | Servicebio | G1101 | Tissue fixation |
| 6-0 nylon suture | Haidike Medical Products Co., Ltd. | Materials for making filaments | |
| Anesthesia system for isoflurane | Rwd Life Science Co., Ltd. | R610 | Anesthetized animal |
| Bipolar electrocoagulation generator | Yirun Medical Instrument Co., Ltd. | ZG300 | Equipment for surgery |
| Constant temperature water bath | Spring Instrument Co., Ltd. | HH-M6 | TTC staining |
| Eye ointment | Guangzhou Pharmaceutical | H44023098 | Material for surgery |
| Heat blanket | ZH Biomedical Instrument Co., Ltd. | Maintain body temperatur | |
| Isoflurane | Rwd Life Science Co., Ltd. | R510-22-10 | Anesthetized animal |
| Meloxicam | Boehringer-Ingelheim | J20160020 | Analgesia for animal |
| Microsurgical artery clamp | Shanghai Jinzhong Surgical Instruments Co., Ltd. | W40130 | Instrument for surgery |
| Microsurgical hemostatic clamp forceps | Shanghai Jinzhong Surgical Instruments Co., Ltd. | M-W-0022 | Instrument for surgery |
| Microsurgical instruments set | Rwd Life Science Co., Ltd. | SP0009-R | Equipment for surgery |
| Mouse thermometer | Hubei Dasjiaer Biotechnology | FT3400 | Intraoperative temperature monitoring |
| Pentobarbital sodium | Sigma-Aldrich | P3761 | Euthanized animal |
| Shaver | Joyu Electrical Appliances | PHC-920 | Equipment for surgery |
| Silicone Sealant | Kafuter | K-704 | Materials for making filaments |
| Stereomicroscope | Rwd Life Science Co., Ltd. | 77001S | Equipment for surgery |
| Suture thread with needle (3-0) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | F404SUS302 | Equipment for surgery |
References
- Collaborators GBDS. Global, regional, and national burden of stroke and its risk factors, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet Neurol. 20 (10), 795-820 (2021).
- Kleindorfer, D. O., et al. Guideline for the prevention of stroke in patients with stroke and transient ischemic attack: A guideline from the American Heart Association/American Stroke Association. Stroke. 52 (7), e364-e467 (2021).
- Saini, V., Guada, L., Yavagal, D. R. Global epidemiology of stroke and access to acute ischemic stroke interventions. Neurology. 97 (20 Suppl 2), S6-S16 (2021).
- Hill, M. D., Coutts, S. B. Alteplase in acute ischaemic stroke: The need for speed. Lancet. 384 (9958), 1904-1906 (2014).
- Asif, K. S., et al. Mechanical thrombectomy global access for stroke (mt-glass): A mission thrombectomy (mt-2020 plus) study. Circulation. 147 (16), 1208-1220 (2023).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Des Devel Ther. 9, 3445-3454 (2015).
- Ringelstein, E. B., et al. Type and extent of hemispheric brain infarctions and clinical outcome in early and delayed middle cerebral artery recanalization. Neurology. 42 (2), 289-298 (1992).
- Shaik, N. F., Regan, R. F., Naik, U. P. Platelets as drivers of ischemia/reperfusion injury after stroke. Blood Adv. 5 (5), 1576-1584 (2021).
- Zhang, S. R., et al. Large-scale multivariate analysis to interrogate an animal model of stroke: Novel insights into poststroke pathology. Stroke. 52 (11), 3661-3669 (2021).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, Y., Ito, A., Takai, K., Saito, N. Blocking pterygopalatine arterial blood flow decreases infarct volume variability in a mouse model of intraluminal suture middle cerebral artery occlusion. J Neurosci Methods. 174 (1), 18-24 (2008).
- Yuan, F., et al. Optimizing suture middle cerebral artery occlusion model in c57bl/6 mice circumvents posterior communicating artery dysplasia. J Neurotrauma. 29 (7), 1499-1505 (2012).
- Bieber, M., et al. Validity and reliability of neurological scores in mice exposed to middle cerebral artery occlusion. Stroke. 50 (10), 2875-2882 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), e3564(2012).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Mccoll, B. W., Carswell, H. V., Mcculloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond mca territory after intraluminal filament occlusion in c57bl/6j mice. Brain Res. 997 (1), 15-23 (2004).
- Liu, Z., et al. Optimisation of a mouse model of cerebral ischemia-reperfusion to address issues of survival and model reproducibility and consistency. Comput Intell Neurosci. 2022, 7594969(2022).
- Ward, R., Collins, R. L., Tanguay, G., Miceli, D. A quantitative study of cerebrovascular variation in inbred mice. J Anat. 173, 87-95 (1990).
- Hanna, K. L., Hepworth, L. R., Rowe, F. Screening methods for post-stroke visual impairment: A systematic review. Disabil Rehabil. 39 (25), 2531-2543 (2017).
- Rowe, F. J. Stroke survivors' views and experiences on impact of visual impairment. Brain Behav. 7 (9), e00778(2017).
- Scoles, D., Mcgeehan, B., Vanderbeek, B. L. The association of stroke with central and branch retinal arterial occlusion. Eye (Lond). 36 (4), 835-843 (2022).
- Kim, Y. D., et al. Cerebral magnetic resonance imaging of coincidental infarction and small vessel disease in retinal artery occlusion. Sci Rep. 11 (1), 864(2021).
- Emiroglu, M. Y., et al. Effects of obstructive carotid artery disease on ocular circulation and the safety of carotid artery stenting. Heart Lung Circ. 26 (10), 1069-1078 (2017).
- Cotofana, S., Lachman, N. Arteries of the face and their relevance for minimally invasive facial procedures: An anatomical review. Plast Reconstr Surg. 143 (2), 416-426 (2019).
- Xu, X., et al. Dibazol-induced relaxation of ophthalmic artery in C57bl/6J mice is correlated with the potency to inhibit voltage-gated ca(2+) channels. Exp Eye Res. 231, 109468(2023).
- Justic, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved