Method Article
Handgefertigtes silikonbeschichtetes Filament für Modelle zum Verschluss der mittleren Hirnarterie von Mäusen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine einfache Methode zur Herstellung von beschichteten Filamenten für das Modell des Verschlusses der mittleren Hirnarterie (MCAO) bei Mäusen unter Verwendung von Silikon, Nylonnähten und Spritzennadeln. Dieses Verfahren ermöglicht die Herstellung von Filamenten mit einem gleichbleibenden Durchmesser und verschiedenen Silikonummantelungslängen, die auf die experimentellen Bedürfnisse zugeschnitten sind.
Zusammenfassung
Mit der Alterung der Weltbevölkerung ist der ischämische Schlaganfall zur zweithäufigsten Ursache für Behinderungen und Mortalität weltweit geworden und stellt sowohl für die Gesellschaft als auch für die Familien eine immense Belastung dar. Obwohl Behandlungen wie intravenöse Thrombolyse und endovaskuläre Eingriffe die Ergebnisse für Patienten mit akutem ischämischem Schlaganfall erheblich verbessern können, profitiert nur ein kleiner Prozentsatz der Personen von diesen Therapien. Um das Verständnis der Krankheit zu verbessern und wirksamere Behandlungen zu entdecken, entwickeln und verfeinern Forscher kontinuierlich Tiermodelle. Unter diesen sticht das Modell des Verschlusses der mittleren Hirnarterie (MCAO) als das am häufigsten verwendete Modell in der Erforschung zerebrovaskulärer Erkrankungen hervor. Das Filament, das in diesem Modell verwendet wird, ist entscheidend für seine Entwicklung. Dieses Protokoll beschreibt ein Verfahren zur Herstellung von Filamenten mit gleichbleibenden Durchmessern und unterschiedlichen Längen der Silikonbeschichtung. Das mit dieser Methode an C57-Mäusen hergestellte MCAO-Modell hat einen hohen Erfolg und eine hohe Konsistenz gezeigt und bietet ein wertvolles Werkzeug für maßgeschneiderte Untersuchungen ischämischer zerebrovaskulärer Erkrankungen.
Einleitung
Schlaganfall ist eine der häufigsten Ursachen für Tod und Behinderung weltweit. Ischämische und hämorrhagische Schlaganfälle sind die primären Arten von zerebrovaskulären Ereignissen, wobei ischämische Schlaganfälle etwa 87 % der Fälle ausmachen 1,2,3. Derzeit gibt es zwei Behandlungsmodalitäten für Patienten mit ischämischem Schlaganfall: die pharmakologische Therapie mit rekombinantem Gewebeplasminogenaktivator (rtPA) und die mechanische Thrombektomie. Das enge therapeutische Fenster und die umfangreichen Ausschlusskriterien schränken jedoch die Anwendung dieser Behandlungen ein, von denen nur eine Minderheit der Patienten profitiert. Dies unterstreicht die Notwendigkeit kontinuierlicher Anstrengungen zur Verbesserung der Therapien ischämischer Schlaganfälle 4,5. In-vitro-Modelle sind ungeeignet, um die komplexen pathophysiologischen Reaktionen nach einem Schlaganfall zu replizieren, so dass Tiermodelle ein unverzichtbarer Bestandteil der präklinischen Schlaganfallforschung sind. Die fokale zerebrale Ischämie beim Menschen wird am häufigsten durch einen thrombotischen oder embolischen Verschluss der mittleren Hirnarterie (MCA) verursacht, was Nagetiermodelle, die zur Simulation eines MCA-Verschlusses (MCAO) entwickelt wurden, sehr relevant macht6.
Das filamentinduzierte MCAO-Modell, das in der Schlaganfallforschung am weitesten verbreitet ist, erleichtert den Verschluss zu Beginn der mittleren Hirnarterie (MCA) und die anschließende Reperfusion, was zu ausgedehnten Infarkten in subkortikalen und kortikalen Bereichen des Gehirns führt. Der Vorteil dieses Modells liegt in seiner Fähigkeit, den Blutfluss nach Induktion einer fokalen Ischämie wiederherzustellen und damit den pathophysiologischen Prozessen zu entsprechen, die beim menschlichen Schlaganfall beobachtet wurden7. Darüber hinaus simuliert das Modell eine Reperfusionsverletzung, ein kritischer Faktor für das Ausmaß der Schädigung8. Das MCAO-Modell weist jedoch Einschränkungen auf, einschließlich der Variabilität des Infarktvolumens, wobei die Standardabweichung in einigen Studien möglicherweise bis zu 64 % des Mittelwerts erreichenkann 9. Trotz über drei Jahrzehnten der Anwendung sind die Bemühungen um eine Verbesserung der Zuverlässigkeit des Modells noch nicht abgeschlossen, dennoch gibt es in den Studien und Labors nach wie vor signifikante Unterschiede im Volumen der ischämischen Läsionen 10,11,12.
In diesem Artikel wird ein selbst hergestelltes Filament zur Induktion von Modellen zur Bewertung von neurologischen Defizitwerten und Hirninfarktbereichen vorgestellt. Es wird der Zusammenhang zwischen mit Silikon beschichteten Filamentlängen und dem Erfolg und der Stabilität des MCAO-Modells untersucht. Diese Produktionstechnik liefert Filamente mit lobenswerter Konsistenz und trägt zur Entwicklung eines relativ stabilen MCAO-Modells bei.
Protokoll
Alle tierischen Verfahren entsprachen den experimentellen Verfahren und Standards, die vom Komitee für institutionelle Tierpflege und -verwendung des Shanxi Provincial People's Hospital genehmigt wurden (Genehmigungsnummer: 2024 Provincial Medical Ethics Committee No. 64). Bei den in diesem Experiment verwendeten Mäusen handelte es sich um männliche C57BL/6-Mäuse, 8-10 Wochen alt und mit einem Gewicht von 24-26 g. Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Filamente
- Markieren des Originalfilaments: Wickeln Sie die Naht 6-0 Nylon gleichmäßig um eine Zollstockplatte aus Kunststoff. Markieren Sie in einem Abstand von 5 mm und 10 mm zum Filamentkopf (einschließlich des Markierungspunkts der Beschichtung und des Markierungspunkts für die Einführtiefe).
- Schneiden Sie mit einer Klinge vertikal nach unten, um sicherzustellen, dass beide Enden perfekt kreisförmig sind, was zu einem anfänglich 2 cm langen Filament führt (Abbildung 1).
- Herstellung des Beschichtungsgeräts: Brechen Sie mit einer hämostatischen Pinzette den Nadelkopf einer 26 G Spritze ab und polieren Sie das Nadelloch mit Schleifpapier zu einem perfekten Kreis. Ziehen Sie 2 mL des Silikondichtstoffs K-704 mit einer 10 mK-Spritze auf und befestigen Sie schließlich den Nadelkopf an der Spritze.
- Beschichten des Filaments: Führen Sie das Ausgangsfilament bis zur markierten Position von 5 mm oder 10 mm in das vorbereitete Nadelloch ein. Drücken Sie die Spritze langsam und gleichmäßig, bis das Filament unter einem Stereomikroskop vollständig beschichtet ist (Abbildung 2).
- Abbinden des beschichteten Filaments: Fixieren Sie das beschichtete Filament aufrecht mit Klebeband und warten Sie ca. 20 min, bis das Silikon vollständig ausgehärtet ist.
- Sterilisation und Verpackung: Weichen Sie die vorbereiteten Filamente in 75%igem Alkohol ein, wischen Sie sie mit einem Wattestäbchen trocken und verpacken Sie sie dann in 5 mL Zentrifugenröhrchen.
2. MCAO-Modell
HINWEIS: Die chirurgischen Instrumente wurden durch Autoklavieren (121 °C bei 15 psi für 60 Minuten) sterilisiert. Der Operationstisch und andere Geräte wurden mit 75 % Ethanol desinfiziert. Die Mäuse wurden präoperativ 8 Stunden lang nüchtern, hatten aber freien Zugang zu Wasser.
- 5 mg/kg Meloxicam subkutan zur Analgesie 60 Minuten vor der Operation verabreichen. Schließen Sie eine Wärmedecke an, um die Körpertemperatur der Maus während der Narkose auf 37 °C zu halten.
- Induzieren Sie die Anästhesie mit 4 % Isofluran, bis spontane Bewegungen und Schnurrhaarzuckungen aufhören, und halten Sie dann die Anästhesie bei 1,5 % (gemäß den institutionell anerkannten Protokollen). Tragen Sie die Augensalbe auf beide Augen auf.
- Bringen Sie die Maus in Rückenlage, sichern Sie den Kopf und die Gliedmaßen, rasieren Sie die Haare am Hals und an der oberen Brust und desinfizieren Sie die Haut mit 75% Ethanol von innen nach außen.
- Machen Sie einen 2,5 cm langen Hautschnitt entlang der Mittellinie des Halses, vom Unterkiefer bis zum Brustbein.
- Präparieren Sie stumpf die rechten Nackenmuskeln, um die Halsschlagaderscheide freizulegen. Verwenden Sie eine Augenzange, um die Scheide zu öffnen und die Arteria carotis communis (CCA), die Arteria carotis externa (ECA) und die Arteria carotis interna (ICA) zu trennen, wobei Sie darauf achten sollten, den Vagusnerv nicht zu stören.
- Ligatur des CCA vorübergehend mit einem Slipknot vor der Bifurkation und Klemmen des ICA mit einem mikrochirurgischen Arterienklemmer.
- Verätzen Sie die obere Schilddrüsenarterie aus der ECA mit einem bipolaren Gerinnungsstift.
- Lassen Sie zwei Fäden für die Ligatur auf der ECA: einen am distalen Ende für die permanente Ligatur und einen weiteren am proximalen Ende mit einem losen Knoten für die zukünftige Verwendung. Machen Sie mit einer Augenschere einen etwa 0,5 mm großen Schnitt zwischen den beiden Ligaturen auf der ECA, um das Filament einzuführen.
- Führen Sie das 5 mm oder 10 mm silikonbeschichtete Filament durch den Schnitt in das CCA ein und sichern Sie es dann, indem Sie den losen Knoten festziehen.
- Nachdem Sie das distale Ende des ECA abgeschnitten und die Klemme vom ICA entfernt haben, ziehen Sie das Filament in die CCA-Bifurkation zurück. Drehen Sie dann das Filament um und schieben Sie es in den tiefen ICA, bis Sie einen Widerstand spüren. Ziehen Sie das Filament leicht zurück und sichern Sie es, indem Sie den Knoten festziehen.
- Nähen Sie die Haut des Tieres mit 3-0 Naht und desinfizieren Sie die Wunde mit Jod. Legen Sie die Maus für 1 h in eine Auffangkammer.
- Betäuben Sie die Maus erneut, entfernen Sie vorsichtig das Filament, binden Sie den ECA-Ligaturfaden ab, mit dem das Filament befestigt ist, und lösen Sie den CCA-Slipknot, um den Blutfluss wiederherzustellen und die mittlere Hirnarterie wiederherzustellen.
- Schneiden Sie die überschüssigen Fäden ab, nähen Sie die Halshaut und desinfizieren Sie den Bereich erneut.
3. Scheinbetrieb
- Bei Scheinoperationen wird ein 7 mm silikonbeschichtetes Filament eingeführt, um die rechte mittlere Hirnarterie zu verschließen, und dann sofort zurückgezogen, um eine sofortige Reperfusion zu ermöglichen.
HINWEIS: Das anschließende Verfahren ist identisch mit demjenigen, das bei Tieren durchgeführt wird, die sich einer zerebralen Ischämie unterziehen.
4. Neuroscore
- Platzieren Sie Versuchstiere aus jeder Gruppe auf einem offenen Feld und führen Sie 4 Stunden nach der Reperfusion der zerebralen Ischämie eine postoperative Verhaltensbewertung durch.
- Für eine erfolgreiche Modellierung sollten Sie Bewertungen zwischen 1 und 3 in Betracht ziehen. Die Bewertungskriterien basieren auf der Longa-Scoring-Methode10, wie in Tabelle 1 dargestellt.
- Beurteilung neurologischer Defizite gemäß den Modified Neurologic Severity Scores (mNSS)13, wobei die Auswertungen 24 h und 72 h nach der Reperfusion durchgeführt werden (siehe Tabelle 2).
5. Transkardiale Perfusion
- Betäuben Sie die Maus mit 1,5% Pentobarbital-Natrium (nach institutionell anerkannten Protokollen). Setzen Sie die Maus wieder in ihren Käfig ein und warten Sie 10 Minuten. Kneifen Sie dann die Zehen der Maus zusammen, um zu testen, ob keine Reflexe vorhanden sind, und sorgen Sie für eine tiefe Anästhesie.
- Positionieren Sie die Maus in Rückenlage auf einem Schaumstoffständer und sichern Sie ihre Gliedmaßen.
- Schneiden Sie die Spitze einer 25-G-Nadel ab, um sie abzustumpfen und ein Durchstechen der Aortenwand zu verhindern. Verbinden Sie die Nadel mit einer Spritze, die mit 20 ml Kochsalzlösung gefüllt ist.
- Heben Sie das Fell des Brustkorbs an und schneiden Sie die Haut mit einer Schere ab, um den Xiphoid-Prozess freizulegen. Fassen Sie den Xiphoid-Prozess und schneiden Sie horizontal darunter, um das Zwerchfell freizulegen, indem Sie die Muskelschicht öffnen. Schneiden Sie das Zwerchfell vorsichtig mit einer Schere ab, um Schäden am Herzen zu vermeiden.
- Schneiden Sie entlang der Außenseite des Brustbeins, um den Brustkorb auf beiden Seiten zu öffnen, drehen Sie die Vorderwand des Brustkorbs um und sichern Sie ihn mit Hämostaten.
- Verwenden Sie ein Wattestäbchen, um das Fett an der Basis des Herzens zu entfernen und die Wurzel der Aorta freizulegen.
- Sichern Sie das Herz mit einer Pinzette, führen Sie die Nadel an der Spitze des Herzens ein und bewegen Sie sich schräg nach oben, bis die Nadel durch die Aortenwand sichtbar ist. Klemmen Sie die Nadel fest.
- Machen Sie einen kleinen Schnitt im rechten Vorhof, um den Blutfluss zu beobachten. Perfundieren Sie die Kochsalzlösung gleichmäßig mit der Spritze und achten Sie darauf, dass das Blut aus dem rechten Vorhof austritt. Sobald das Abwasser klar ist, stoppen Sie die Perfusion14.
- Nach der Perfusion wird die Maus geköpft, um das Gehirn15 zu entnehmen, und zur weiteren Verarbeitung in einen -20 °C-Gefrierschrank gelegt.
6. Bestimmung des Infarktvolumens durch TTC-Färbung
- Frieren Sie das beschaffte Hirngewebe in einem -20 °C Gefrierschrank für 20 min schnell ein, legen Sie es dann auf eine vorgekühlte Gehirnschneideform und schneiden Sie es in 1 mm dicke Scheiben.
- Tauchen Sie die erhaltenen Hirnschnitte in 2%ige TTC-Lösung und inkubieren Sie sie 20 Minuten lang bei 37 °C.
- Tauchen Sie die Gehirnschnitte über Nacht in 4% Paraformaldehyd und fotografieren Sie am nächsten Tag.
- Messen Sie den Infarktbereich für jeden Schnitt und den gesamten Hirnbereich mit ImageJ. Berechnen Sie das Verhältnis des Infarktvolumens mit der Formel: Infarktvolumen % = (Summe der Infarktgebiete / Summe der gesamten Hirnareale) × 100%.
Ergebnisse
Bei der Erstellung des MCAO-Modells sind die primären Werkzeuge, die für die Herstellung der Filamente verwendet werden, und die fertigen Filamente in Abbildung 3 dargestellt. Nach der Filamentproduktion wird das MCAO-Modell erstellt, indem das Filament durch die Arteria carotis externa eingeführt wird, wobei die Dauer der Operation aufgezeichnet wird. Eine erfolgreiche Modellierung wird durch einen Longa-Score von 1-3 4 h nach der Filamententnahme definiert. Nach der Operation wird täglich das Körpergewicht kontrolliert. Neurologische Defizite werden mit Hilfe von modifizierten neurologischen Schweregrad-Scores (mNSS) 24 h und 72 h nach der Operation bewertet. Die ischämische Schädigung wird durch TTC-Färbung beurteilt.
In der Gruppe der 10-mm-Filamente erlitten fünf von zehn Mäusen eine Subarachnoidalblutung (SAB), wobei zwei dieser Fälle tödlich verliefen. Folglich wurden alle fünf betroffenen Mäuse von der Studie ausgeschlossen. Im Gegensatz dazu trat bei keiner der Mäuse in der 5-mm-Filamentgruppe eine SAB auf. Die Erfolgsrate bei der Modellierung lag bei 100 % in der 5-mm-Filamentgruppe und damit deutlich höher als die 50 % Erfolgsrate in der 10-mm-Filamentgruppe.
Die Operationszeit, definiert als die Dauer von der Hautinzision bis zum Einsetzen des Filaments, war in der 5-mm-Filamentgruppe signifikant kürzer als in der 10-mm-Filamentgruppe (614 s ± 49,15 s vs. 758 s ± 65,63 s, P < 0,01) (Abbildung 4A). Beide Filamentgruppen zeigten eine signifikante Reduktion des postoperativen Körpergewichts im Vergleich zur Scheinoperationsgruppe; Es wurde jedoch kein signifikanter Unterschied zwischen den beiden Filamentgrößen beobachtet (Abbildung 4B).
Die TTC-Färbung bestätigte den Hirninfarkt im selbstgemachten filamentinduzierten MCAO-Modell (Abbildung 5). Drei Tage nach der Operation betrug das Infarktvolumen 21,48 % ± 6,79 % für die 5-mm-Gruppe und 19,85 % ± 7,01 % für die 10-mm-Gruppe, wobei es keinen signifikanten statistischen Unterschied zwischen den beiden Gruppen in Bezug auf die Infarktgröße gab. In jeder Gruppe von Mäusen gab es eine Variabilität im Bereich des Hirninfarkts, wobei drei von fünf Mäusen einen größeren Infarktbereich aufwiesen (Abbildung 5B,C) und zwei einen kleineren Infarktbereich (Abbildung 5E,F). Die Quantifizierung des Infarktvolumens ist in Abbildung 5G dargestellt.
Neurologische Funktionsdefizite wurden anhand von mNSS-Scores an den Tagen 1 und 3 nach MCAO bewertet, wie in Abbildung 6 gezeigt. An beiden Tagen zeigten die 5-mm- und 10-mm-Gruppen signifikant erhöhte mNSS-Werte im Vergleich zur Schein-Operationsgruppe, wobei kein signifikanter Unterschied zwischen den mNSS-Werten der 5-mm- und 10-mm-Gruppe beobachtet wurde.

Abbildung 1: Konstruktion und Markierung des Filaments. (A) Gleichmäßiges Aufwickeln der Naht aus 6-0 Nylon um eine Zollstockplatte aus Kunststoff. (B) Markieren und vertikales Schneiden der Wunde, um ein 2 cm langes Filament zu erzeugen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
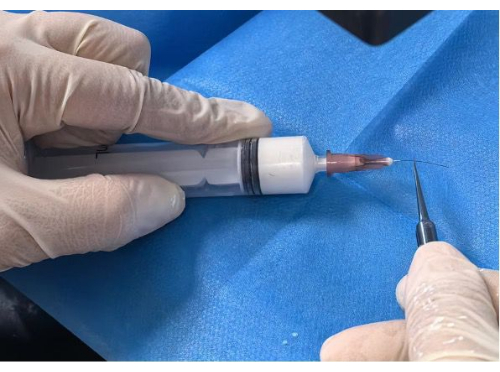
Abbildung 2: Beschichtung des Filaments. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
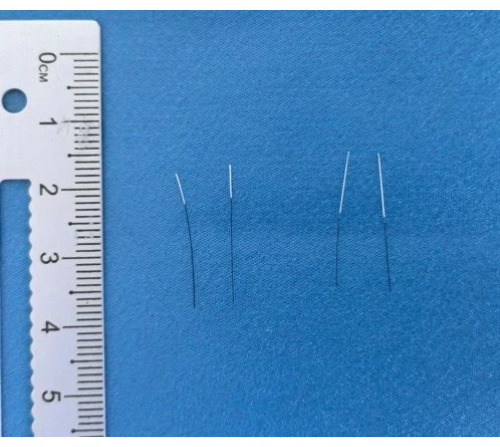
Abbildung 3: Fertige Filamente. Bilder der fertigen Filamente nach dem Beschichten und Markieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Operationsdauer und Körpergewicht der Maus. (A) Operationsdauer. (B) Körpergewicht der Maus, gemessen vor der Operation und drei Tage nach der Operation. Die statistischen Unterschiede wurden mittels ANOVA und Tukey-Post-hoc-Test analysiert. Die Daten werden als Mittelwert ± SEM, n = 5, **P < 0,01 dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: TTC-gefärbte Hirnschnitte. Repräsentative TTC-gefärbte Hirnschnitte mit Bereichen mit gesundem Gewebe (rot) und ischämischer Verletzung (weiß) für die Gruppen Sham (A,D), 5 mm MCAO (B,E) und 10 mm MCAO (C,F). Drei von fünf Mäusen zeigen ein größeres Infarktgebiet (B,C) und zwei ein kleineres Infarktgebiet (E,F). (G) Quantifizierung des Infarktvolumens. Die statistischen Unterschiede wurden mittels ANOVA und Tukey-Post-hoc-Test analysiert. Die Daten werden als Mittelwert ± SEM, n = 5, **P < 0,01 dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Neurologische Scores nach MCAO. Neurologische Werte, die am 1. und 3. Tag nach der MCAO aufgezeichnet wurden. Die statistischen Unterschiede wurden mittels ANOVA und Tukey-Post-hoc-Test analysiert. Die Daten werden als Mittelwert ± SEM, n = 5, ****P < 0,001 dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Pupillenaufhellung nach dem Einsetzen des Filaments. Aufhellung der Pupille, die nach dem Einsetzen des 10 mm Silikonfilaments beobachtet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| 0 Punkte | Keine Symptome einer neurologischen Schädigung | |
| 1 Punkt | Unfähigkeit, die kontralaterale Vordergliedmaße vollständig zu strecken | |
| 2 Punkte | Beim Gehen zur kontralateralen Seite kreisen | |
| 3 Punkte | Anlehnen an die kontralaterale Seite beim Gehen | |
| 4 Punkte | Unfähigkeit, spontan zu gehen, Bewusstlosigkeit | |
Tabelle 1: Longa-Bewertung für den Modellerfolg. Longa-Punktesystem, das verwendet wird, um den Erfolg des Modells zu bestimmen.
| Tests | Punkte | ||
| Maus am Schwanz aufziehen | 3 | ||
| Beugung der Vordergliedmaße | 1 | ||
| Beugung der Hintergliedmaße | 1 | ||
| Kopf innerhalb von 30 Sekunden um >10° zur vertikalen Achse verschoben | 1 | ||
| Laufende Maus auf dem Boden | 3 | ||
| Normaler Spaziergang | 0 | ||
| Unfähigkeit, geradeaus zu gehen | 1 | ||
| Kreisförmig zur paretischen Seite | 2 | ||
| Auf die paretische Seite fallen | 3 | ||
| Prüfung der Strahlbalance | 6 | ||
| Gleichgewichte mit ruhiger Haltung | 0 | ||
| Greift die Seite des Balkens | 1 | ||
| Umarmt den Balken und 1 Glied fällt vom Balken herunter | 2 | ||
| Umarmt den Balken und 2 Gliedmaßen fallen vom Balken herunter oder dreht sich auf dem Balken [>30 s] | 3 | ||
| Versucht, auf dem Balken zu balancieren, fällt aber herunter [>20 s] | 4 | ||
| Versucht, auf dem Balken zu balancieren, fällt aber herunter [>10 s] | 5 | ||
| Fällt herunter, kein Versuch, das Gleichgewicht zu halten oder am Balken zu hängen [<10 s] | 6 | ||
| Fehlen von Reflexen | 2 | ||
| Ohrmuschelreflex (ein Kopf schüttelt sich, wenn er den Gehörgang berührt) | 1 | ||
| Hornhautreflex (ein Wimpernschlag bei leichter Berührung der Hornhaut mit Watte) | 1 | ||
Tabelle 2: Modifizierte neurologische Schweregrad-Scores (mNSS). Modifizierte neurologische Schweregrad-Scores (mNSS) zur Beurteilung des neurologischen Schweregrades.
Diskussion
Diese Studie demonstriert eine einfache und kostengünstige Methode zur Herstellung von Filamenten und bestätigt ihre Machbarkeit bei der Erstellung eines MCAO-Modells. Die Länge der Silikonschicht des Filaments kann je nach experimentellem Bedarf angepasst werden, was zusätzliche Flexibilität bietet. Die Präparation eines 5 mm Filamentembolus erzielte eine Erfolgsquote von 100% ohne Auftreten von Subarachnoidalblutungen (SAB) bei Mäusen. In der Gruppe, die 10-mm-Filamentembolien verwendete, gab es Fälle von SAB, während der Rest der Mäuse einen deutlichen Infarkt in der MCA-Region zeigte. Ein kritischer Schritt bei der Reduzierung der SAB bestand darin, das Filament leicht zurückzuziehen, wenn es während des Eingriffs auf Widerstand stieß. Im Vorexperiment trat bei fast der Hälfte der Mäuse ohne diese Anpassung SAH auf, wenn ein 5 mm beschichtetes Silikonfilament verwendet wurde. Das Filament stieß auf Widerstand, als es die vordere Hirnarterieder Maus erreichte 12. Daher kann jede geringfügige Veränderung der Position der Maus vor dem Herausziehen des Filaments das Blutgefäß reißen. Ein leichtes Zurückziehen des Filaments kann den Ursprung des MCA effektiv blockieren und gleichzeitig verhindern, dass die Filamentspitze in das ACA eindringt und SAB verursacht.
Bei der Verwendung von 10 mm Filamenten wurde ein höheres Vorkommen von SAB beobachtet, was auf die geringere Flexibilität des Filaments aufgrund der erhöhten Silikonbeschichtungslänge zurückzuführen ist. Diese Steifigkeit kann dazu führen, dass das Filament Gefäße durchsticht, wenn es beim Einführen auf einen Widerstand stößt. Darüber hinaus war die Operationsdauer für die 10-mm-Gruppe länger, was mit der erhöhten Schwierigkeit der Handhabung längerer silikonbeschichteter Filamente übereinstimmt, was zu längeren Operationszeiten führte. Dies deutet darauf hin, dass kürzere silikonbeschichtete Filamentlängen nicht nur eine hohe Modellierungserfolgsrate gewährleisten, sondern auch die chirurgische Komplexität und das Auftreten postoperativer Komplikationen reduzieren können.
Die Erkenntnis, dass die Verwendung von 5 mm und 10 mm silikonbeschichteten Filamenten in den MCAO-Modellmäusen keine signifikanten Unterschiede in den Hirninfarktbereichen und Verhaltenswerten zeigt, deutet darauf hin, dass die Länge der Silikonbeschichtung auf dem Filament unter bestimmten Bedingungen einen minimalen Einfluss auf die experimentellen Ergebnisse haben kann. Innerhalb jeder Gruppe zeigten sich jedoch deutliche Unterschiede in den Hirninfarktbereichen. In der 5-mm-Gruppe wiesen drei von fünf Mäusen größere Infarktbereiche auf, darunter Regionen wie Thalamus, Hypothalamus und Hippocampus, während andere kleinere Infarktbereiche aufwiesen. Die Verteilung der Infarktgrößen in der 10-mm-Gruppe war ähnlich wie in der 5-mm-Gruppe, was mit der anatomischen Variabilität des zerebralen Gefäßsystems der Mäuse zusammenhängenkönnte 15,16. Ein bekannter beitragender Faktor ist die Variation der Durchgängigkeit der hinteren kommunizierenden Arterie (PcomA)16. Die PcomAs sind die Hauptkollateralarterien nach der durch das Filament induzierten MCAO und versorgen Bereiche wie den Hippocampus und den Thalamus17. Etwa 90 % der C57BL/6-Mäuse weisen jedoch unterentwickelte oder fehlende PcomAs17 auf, und der Anteil der Mäuse mit größeren Infarktgebieten in jeder Gruppe liegt nahe an diesem Prozentsatz. Mäuse mit unterentwickelten oder fehlenden PcomAs haben neben MCA im MCAO-Modell auch eine verstopfte Blutversorgung der hinteren Hirnarterie (PCA), was zu größeren Infarktgebieten führt12. In einer Studie wurden kürzere, silikonbeschichtete Filamente (2 mm) verwendet, um die PCA-Blutversorgung nicht zu behindern, was jedoch die Erfolgsquote des Modells signifikant reduzierte18. Variationen in der anatomischen Distanz zwischen dem MCA und dem PCA an der Verbindungsstelle, die den Willis-Kreis bildet, wurden bei verschiedenen Mausstämmen und Gewichtsklassen beobachtet19. Um den Modellierungserfolg und die Stabilität der Infarktgröße innerhalb von Kohorten zu gewährleisten, ist es daher entscheidend, silikonbeschichtete Filamente mit maßgeschneiderten Längen herzustellen, die an die spezifischen anatomischen Variationen im zerebralen Gefäßsystem von Mäusen über verschiedene Stämme und Körpergewichte hinweg angepasst sind. Die in diesem Artikel beschriebene Methode der Filamentherstellung erleichtert diese Forschung.
Etwa 65 % der ischämischen Schlaganfälle gehen mit einem vorübergehenden oder dauerhaften Sehverlust einher, der in der Regel auf eine Beeinträchtigung der optischen Strahlung oder des visuellen Kortex zurückzuführen ist20,21. Schlaganfallpatienten tragen jedoch auch ein höheres Risiko für eine akute retinale Ischämie22,23. Derzeit gibt es keine eindeutigen experimentellen Tiermodelle für ischämische Schlaganfälle, die eine retinale Ischämie beinhalten. Bei Mäusen, die 10-mm-Filamente verwendeten, kam es bei drei Mäusen nach dem Einsetzen des Filaments zu einer ipsilateralen Pupillenaufhellung, die etwa 5 Minuten nach dem Herausziehen des Filaments abklang (Abbildung 7). Dieses Phänomen deutet auf einen Verschluss der Arteria ophthalmica nach dem Einsetzen des Filaments hin, was bei Mäusen mit 5 mm Filamenten nicht beobachtet wurde. Derzeit gibt es keinen Konsens über die Herkunft der Arteria ophthalmica bei Versuchstieren. Einige Studien deuten darauf hin, dass die Arteria ophthalmica (OA) bei C57BL/6J-Mäusen, wie beim Menschen, aus der Arteria carotis interna stammt 24,25,26. Andere Forschungen gehen davon aus, dass die Maus-OA, wie bei Ratten, aus der Arteria pterygopalatinin (PPA) stammt27. Unter Berücksichtigung der Variabilität in der Herkunft der Maus-OA könnte die bei einigen Mäusen aus der 10-mm-Gruppe beobachtete Pupillenaufhellung auf diese Variabilität zurückzuführen sein. Bei diesen Mäusen sind die aus dem PPA stammenden Augenarterien unzureichend durchblutet, da das 10 mm silikonbeschichtete Filament beim Einführen am Anfang der Arterie einen Verschluss aufweist, was zu einer Pupillenaufhellung führt. In der 5-mm-Gruppe trat ein solches Phänomen nicht auf, wahrscheinlich weil die kürzere Länge des Silikons nicht ausreichte, um das PPA zu blockieren.
Obwohl diese Studie eine effektive Methode für die Filamentproduktion darstellt und ihre Wirksamkeit experimentell validiert und eine Strategie für die individualisierte Aufbereitung von Filamenten bietet, weist sie auch einige Einschränkungen auf. Die Silikonbeschichtung auf den handgefertigten Filamenten wird nicht gleichmäßig aufgetragen, was zu einer unregelmäßigen zylindrischen Form führt. Während des Herstellungsprozesses muss die Spritze mit einer konstanten Geschwindigkeit betrieben werden, um Inkonsistenzen in der Silikonbeschichtung an der Vorder- und Rückseite des Filaments zu vermeiden. Erschwingliche Werkzeuge und ein leicht verständlicher Prozess machen es Anfängern möglich, das MCAO-Modell mit handgefertigten Filamenten zu üben. Zukünftige Forschung könnte Verbesserungen im Filamentdesign untersuchen, wie z. B. die Optimierung von Materialien oder die Anpassung von Abmessungen, um das Auftreten von Komplikationen zu reduzieren und die Reproduzierbarkeit des Modells zu verbessern. Darüber hinaus wird die Berücksichtigung anatomischer Unterschiede zur Erreichung eines stabileren Modells entscheidend sein, um die Mechanismen und Behandlungsstrategien ischämischer zerebrovaskulärer Erkrankungen besser zu verstehen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Diese Arbeit wurde von der Wu Jieping Medical Foundation (320.6750.161290) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 mL Syringe | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 2,3,5-Triphenyltetrazolium Chloride (TTC) | Sigma-Aldrich | G3005 | Dye for TTC staining |
| 24-well culture plate | Corning | CLS3527 | Vessel for TTC staining |
| 26 G syringe needle | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 4% paraformaldehyde | Servicebio | G1101 | Tissue fixation |
| 6-0 nylon suture | Haidike Medical Products Co., Ltd. | Materials for making filaments | |
| Anesthesia system for isoflurane | Rwd Life Science Co., Ltd. | R610 | Anesthetized animal |
| Bipolar electrocoagulation generator | Yirun Medical Instrument Co., Ltd. | ZG300 | Equipment for surgery |
| Constant temperature water bath | Spring Instrument Co., Ltd. | HH-M6 | TTC staining |
| Eye ointment | Guangzhou Pharmaceutical | H44023098 | Material for surgery |
| Heat blanket | ZH Biomedical Instrument Co., Ltd. | Maintain body temperatur | |
| Isoflurane | Rwd Life Science Co., Ltd. | R510-22-10 | Anesthetized animal |
| Meloxicam | Boehringer-Ingelheim | J20160020 | Analgesia for animal |
| Microsurgical artery clamp | Shanghai Jinzhong Surgical Instruments Co., Ltd. | W40130 | Instrument for surgery |
| Microsurgical hemostatic clamp forceps | Shanghai Jinzhong Surgical Instruments Co., Ltd. | M-W-0022 | Instrument for surgery |
| Microsurgical instruments set | Rwd Life Science Co., Ltd. | SP0009-R | Equipment for surgery |
| Mouse thermometer | Hubei Dasjiaer Biotechnology | FT3400 | Intraoperative temperature monitoring |
| Pentobarbital sodium | Sigma-Aldrich | P3761 | Euthanized animal |
| Shaver | Joyu Electrical Appliances | PHC-920 | Equipment for surgery |
| Silicone Sealant | Kafuter | K-704 | Materials for making filaments |
| Stereomicroscope | Rwd Life Science Co., Ltd. | 77001S | Equipment for surgery |
| Suture thread with needle (3-0) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | F404SUS302 | Equipment for surgery |
Referenzen
- Collaborators GBDS. Global, regional, and national burden of stroke and its risk factors, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet Neurol. 20 (10), 795-820 (2021).
- Kleindorfer, D. O., et al. Guideline for the prevention of stroke in patients with stroke and transient ischemic attack: A guideline from the American Heart Association/American Stroke Association. Stroke. 52 (7), e364-e467 (2021).
- Saini, V., Guada, L., Yavagal, D. R. Global epidemiology of stroke and access to acute ischemic stroke interventions. Neurology. 97 (20 Suppl 2), S6-S16 (2021).
- Hill, M. D., Coutts, S. B. Alteplase in acute ischaemic stroke: The need for speed. Lancet. 384 (9958), 1904-1906 (2014).
- Asif, K. S., et al. Mechanical thrombectomy global access for stroke (mt-glass): A mission thrombectomy (mt-2020 plus) study. Circulation. 147 (16), 1208-1220 (2023).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Des Devel Ther. 9, 3445-3454 (2015).
- Ringelstein, E. B., et al. Type and extent of hemispheric brain infarctions and clinical outcome in early and delayed middle cerebral artery recanalization. Neurology. 42 (2), 289-298 (1992).
- Shaik, N. F., Regan, R. F., Naik, U. P. Platelets as drivers of ischemia/reperfusion injury after stroke. Blood Adv. 5 (5), 1576-1584 (2021).
- Zhang, S. R., et al. Large-scale multivariate analysis to interrogate an animal model of stroke: Novel insights into poststroke pathology. Stroke. 52 (11), 3661-3669 (2021).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, Y., Ito, A., Takai, K., Saito, N. Blocking pterygopalatine arterial blood flow decreases infarct volume variability in a mouse model of intraluminal suture middle cerebral artery occlusion. J Neurosci Methods. 174 (1), 18-24 (2008).
- Yuan, F., et al. Optimizing suture middle cerebral artery occlusion model in c57bl/6 mice circumvents posterior communicating artery dysplasia. J Neurotrauma. 29 (7), 1499-1505 (2012).
- Bieber, M., et al. Validity and reliability of neurological scores in mice exposed to middle cerebral artery occlusion. Stroke. 50 (10), 2875-2882 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), e3564(2012).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Mccoll, B. W., Carswell, H. V., Mcculloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond mca territory after intraluminal filament occlusion in c57bl/6j mice. Brain Res. 997 (1), 15-23 (2004).
- Liu, Z., et al. Optimisation of a mouse model of cerebral ischemia-reperfusion to address issues of survival and model reproducibility and consistency. Comput Intell Neurosci. 2022, 7594969(2022).
- Ward, R., Collins, R. L., Tanguay, G., Miceli, D. A quantitative study of cerebrovascular variation in inbred mice. J Anat. 173, 87-95 (1990).
- Hanna, K. L., Hepworth, L. R., Rowe, F. Screening methods for post-stroke visual impairment: A systematic review. Disabil Rehabil. 39 (25), 2531-2543 (2017).
- Rowe, F. J. Stroke survivors' views and experiences on impact of visual impairment. Brain Behav. 7 (9), e00778(2017).
- Scoles, D., Mcgeehan, B., Vanderbeek, B. L. The association of stroke with central and branch retinal arterial occlusion. Eye (Lond). 36 (4), 835-843 (2022).
- Kim, Y. D., et al. Cerebral magnetic resonance imaging of coincidental infarction and small vessel disease in retinal artery occlusion. Sci Rep. 11 (1), 864(2021).
- Emiroglu, M. Y., et al. Effects of obstructive carotid artery disease on ocular circulation and the safety of carotid artery stenting. Heart Lung Circ. 26 (10), 1069-1078 (2017).
- Cotofana, S., Lachman, N. Arteries of the face and their relevance for minimally invasive facial procedures: An anatomical review. Plast Reconstr Surg. 143 (2), 416-426 (2019).
- Xu, X., et al. Dibazol-induced relaxation of ophthalmic artery in C57bl/6J mice is correlated with the potency to inhibit voltage-gated ca(2+) channels. Exp Eye Res. 231, 109468(2023).
- Justic, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten