Method Article
Filamento recubierto de silicona hecho a mano para modelos de oclusión de la arteria cerebral media de ratones
En este artículo
Resumen
Este protocolo describe un método sencillo para crear filamentos recubiertos para el modelo de oclusión de la arteria cerebral media (MCAO) en ratones utilizando silicona, suturas de nailon y agujas de jeringa. Este método permite la producción de filamentos con un diámetro constante y varias longitudes de envoltura de silicona adaptadas a las necesidades experimentales.
Resumen
A medida que la población mundial envejece, el accidente cerebrovascular isquémico se ha convertido en la segunda causa principal de discapacidad y mortalidad en todo el mundo, lo que supone una inmensa carga tanto para la sociedad como para las familias. Aunque los tratamientos como la trombólisis intravenosa y las intervenciones endovasculares pueden mejorar sustancialmente los resultados de los pacientes con accidente cerebrovascular isquémico agudo, solo un pequeño porcentaje de personas se benefician de estas terapias. Para avanzar en nuestra comprensión de la enfermedad y descubrir tratamientos más efectivos, los investigadores están continuamente desarrollando y refinando modelos animales. Entre estos, destaca el modelo de oclusión de la arteria cerebral media (MCAO, por sus siglas en inglés) como el modelo más utilizado en la investigación de las enfermedades cerebrovasculares. El filamento utilizado en este modelo es crucial para su desarrollo. Este protocolo describe un método para crear filamentos con diámetros consistentes y longitudes variables de recubrimiento de silicona. El modelo MCAO producido con este método en ratones C57 ha demostrado un alto éxito y consistencia, ofreciendo una valiosa herramienta para investigaciones personalizadas sobre enfermedades cerebrovasculares isquémicas.
Introducción
El accidente cerebrovascular es una de las causas más prevalentes de mortalidad y discapacidad en todo el mundo. Los accidentes cerebrovasculares isquémicos y hemorrágicos son los principales tipos de eventos cerebrovasculares, y los accidentes cerebrovasculares isquémicos representan aproximadamente el 87% de los casos 1,2,3. En la actualidad, existen dos modalidades de tratamiento para los pacientes con accidente cerebrovascular isquémico: la terapia farmacológica con activador tisular recombinante del plasminógeno (rtPA) y la trombectomía mecánica. Sin embargo, la estrecha ventana terapéutica y los extensos criterios de exclusión limitan la aplicación de estos tratamientos, beneficiando solo a una minoría de pacientes. Esto subraya la necesidad de esfuerzos continuos para mejorar las terapias del ictus isquémico 4,5. Los modelos in vitro son inadecuados para replicar las complejas respuestas fisiopatológicas después de un accidente cerebrovascular, lo que hace que los modelos animales sean un componente indispensable de la investigación preclínica del accidente cerebrovascular. La isquemia cerebral focal humana es causada con mayor frecuencia por la oclusión trombótica o embólica de la arteria cerebral media (ACM), lo que hace que los modelos de roedores diseñados para simular la oclusión de la ACM (ACM) sean altamente relevantes6.
El modelo MCAO inducido por filamentos, el más ampliamente adoptado en la investigación del accidente cerebrovascular, facilita la oclusión al inicio de la arteria cerebral media (ACM) y la posterior reperfusión, lo que conduce a infartos extensos en áreas subcorticales y corticales del cerebro. La ventaja de este modelo radica en su capacidad para restaurar el flujo sanguíneo después de inducir isquemia focal, lo que es paralelo a los procesos fisiopatológicos observados en el accidente cerebrovascular humano7. Además, el modelo simula la lesión por reperfusión, un factor crítico en la extensión del daño8. Sin embargo, el modelo MCAO tiene limitaciones, incluyendo la variabilidad en el volumen del infarto, con una desviación estándar que puede alcanzar hasta el 64% del valor medio en algunos estudios9. A pesar de más de tres décadas de uso, los esfuerzos para mejorar la confiabilidad del modelo son continuos, sin embargo, persisten variaciones significativas en el volumen de la lesión isquémica entre estudios y laboratorios 10,11,12.
En este artículo se presenta un filamento de fabricación propia para inducir modelos que evalúan las puntuaciones de déficit neurológico y las áreas de infarto cerebral. Examina la correlación entre las longitudes de los filamentos recubiertos con silicona y el éxito y la estabilidad del modelo MCAO. Esta técnica de producción produce filamentos con una consistencia encomiable, lo que contribuye al desarrollo de un modelo MCAO relativamente estable.
Protocolo
Todos los procedimientos con animales se adhirieron a los procedimientos y estándares experimentales aprobados por el Comité Institucional de Cuidado y Uso de Animales del Hospital Popular Provincial de Shanxi (número de aprobación: Comité Provincial de Ética Médica No. 64 de 2024). Los ratones utilizados en este experimento fueron ratones machos C57BL/6, de 8-10 semanas de edad, con un peso de 24-26 g. Los detalles de los reactivos y el equipo utilizado se enumeran en la Tabla de Materiales.
1. Preparación del filamento
- Marcar el filamento original: Enrolle la sutura de nailon 6-0 de manera uniforme alrededor de una placa de regla de plástico. Haga marcas a 5 mm y 10 mm de la cabeza del filamento (incluyendo el punto de marca del recubrimiento y el punto de marca de la profundidad de inserción).
- Cortar verticalmente hacia abajo con una cuchilla para asegurarse de que ambos extremos sean perfectamente circulares, dando como resultado un filamento inicial de 2 cm de largo (Figura 1).
- Fabricación del dispositivo de recubrimiento: Utilice pinzas hemostáticas para romper la cabeza de la aguja de una jeringa de 26 G, luego pula el orificio de la aguja en un círculo perfecto con papel de lija. Extraiga 2 ml de sellador de silicona K-704 con una jeringa de 10 mK y, por último, fije la cabeza de la aguja a la jeringa.
- Recubrimiento del filamento: Inserte el filamento inicial en el orificio de la aguja preparado hasta la posición marcada de 5 mm o 10 mm. Empuje lenta y constantemente la jeringa hasta que el filamento esté completamente cubierto bajo un microscopio estereoscópico (Figura 2).
- Ajuste del filamento recubierto: Fije el filamento recubierto en posición vertical con cinta adhesiva y espere unos 20 minutos para que la silicona se asiente por completo.
- Esterilización y embalaje: Remoje los filamentos preparados en alcohol al 75%, séquelos con un hisopo de algodón y luego empaquételos en tubos de centrífuga de 5 ml.
2. Modelo MCAO
NOTA: Los instrumentos quirúrgicos se esterilizaron en autoclave (121 °C a 15 psi durante 60 min). La mesa de cirugía y otros equipos se desinfectaron con etanol al 75%. Los ratones fueron ayunados durante 8 h antes de la operación, pero se les permitió el libre acceso al agua.
- Administrar 5 mg/kg de meloxicam por vía subcutánea para la analgesia 60 min antes de la cirugía. Conecte una manta térmica para mantener la temperatura corporal del ratón a 37 °C durante la anestesia.
- Inducir la anestesia con isoflurano al 4% hasta que cesen los movimientos espontáneos y los espasmos de los bigotes, luego mantener la anestesia al 1,5% (siguiendo los protocolos aprobados institucionalmente). Aplique ungüento para los ojos en ambos ojos.
- Coloque al ratón en posición supina, asegure su cabeza y extremidades, afeite el vello del cuello y la parte superior del pecho, y desinfecte la piel con etanol al 75% de adentro hacia afuera.
- Realice una incisión cutánea de 2,5 cm de largo a lo largo de la línea media del cuello, desde la mandíbula inferior hasta el esternón.
- Diseccione sin rodeos los músculos del cuello derecho para exponer la vaina carotídea. Use pinzas oftálmicas para abrir la vaina y separar la arteria carótida común (CCA), la arteria carótida externa (ECA) y la arteria carótida interna (ACI), teniendo cuidado de evitar alterar el nervio vago.
- Ligar temporalmente el CCA con un nudo corredizo antes de la bifurcación y pinzar el ACI con una pinza arteria microquirúrgica.
- Cauterizar la arteria tiroidea superior a partir de la ECA utilizando una pluma de coagulación bipolar.
- Deje dos hilos en el ECA para la ligadura: uno en el extremo distal para la ligadura permanente y otro en el extremo proximal con un nudo suelto para uso futuro. Realice una incisión de aproximadamente 0,5 mm entre las dos ligaduras en el ECA utilizando unas tijeras oftálmicas para insertar el filamento.
- Inserte el filamento recubierto de silicona de 5 mm o 10 mm en el CCA a través de la incisión y luego asegúrelo apretando el nudo suelto.
- Después de cortar el extremo distal del ECA y quitar la abrazadera del ICA, retraiga el filamento a la bifurcación del CCA. A continuación, voltea y avanza el filamento hacia el ICA profundo hasta que sientas resistencia. Retira ligeramente el filamento y asegúralo apretando el nudo.
- Suturar la piel del animal con sutura 3-0 y desinfectar la herida con yodo. Coloque el mouse en una cámara de recuperación durante 1 h.
- Anestesiar al ratón de nuevo, retirar suavemente el filamento, atar el hilo de ligadura de ECA que sujeta el filamento y soltar el nudo corredizo CCA para restaurar el flujo sanguíneo y reperfundir la arteria cerebral media.
- Recorta el exceso de hilos, sutura la piel del cuello y desinfecta la zona una vez más.
3. Operación simulada
- Para operaciones simuladas, inserte un filamento recubierto de silicona de 7 mm para ocluir la arteria cerebral media derecha y luego retírelo inmediatamente para permitir una reperfusión instantánea.
NOTA: El procedimiento subsiguiente es idéntico al que se realiza en los animales sometidos a isquemia cerebral.
4. Puntuación neurológica
- Colocar los animales de experimentación de cada grupo en un campo abierto y realizar una puntuación conductual postoperatoria 4 h después de la reperfusión por isquemia cerebral.
- Para un modelado exitoso, considere puntuaciones entre 1 y 3. Los criterios de evaluación se basan en el método de puntuación Longa10, como se detalla en la Tabla 1.
- Evaluar los déficits neurológicos según las Escalas de Severidad Neurológica Modificada (mNSS)13, realizando evaluaciones a las 24 h y 72 h post-reperfusión (ver Tabla 2).
5. Perfusión transcardíaca
- Anestesiar al ratón con pentobarbital sódico al 1,5% (siguiendo protocolos aprobados institucionalmente). Vuelva a colocar al ratón en su jaula y espere 10 minutos. Luego, pellizque los dedos de los pies del ratón para probar la ausencia de reflejos y asegurar una anestesia profunda.
- Coloque el ratón en posición supina sobre un soporte de espuma y asegure sus extremidades.
- Cortar la punta de una aguja de 25 g para desafilarla y evitar la punción de la pared aórtica. Conecte la aguja a una jeringa llena de 20 ml de solución salina.
- Levante el pelaje del tórax y use unas tijeras para cortar la piel y exponer el proceso xifoides. Agarre la apófisis xifoides y corte horizontalmente por debajo de ella para exponer el diafragma abriendo la capa muscular. Corta cuidadosamente el diafragma con unas tijeras, evitando dañar el corazón.
- Corta a lo largo del lado exterior del esternón para abrir la caja torácica en ambos lados, voltea la pared anterior del tórax y asegúrala con hemostáticos.
- Use un hisopo de algodón para eliminar la grasa en la base del corazón, exponiendo la raíz de la aorta.
- Asegure el corazón con fórceps, inserte la aguja en el ápice del corazón y avance oblicuamente hacia arriba hasta que la aguja sea visible a través de la pared aórtica. Sujete la aguja en su lugar.
- Haz una pequeña incisión en la aurícula derecha para observar el flujo sanguíneo. Perfunda solución salina con la jeringa, vigilando que la sangre salga de la aurícula derecha. Una vez que el efluente esté limpio, detenga la perfusión14.
- Después de la perfusión, decapitar al ratón para extraer el cerebro15 y colocarlo en un congelador a -20 °C para su posterior procesamiento.
6. Evaluación del volumen del infarto mediante tinción TTC
- Congele rápidamente los tejidos cerebrales obtenidos en un congelador a -20 °C durante 20 minutos, luego colóquelos en un molde para cortar cerebros previamente enfriado y córtelos en rodajas de 1 mm de grosor.
- Sumerja las secciones de cerebro obtenidas en una solución de TTC al 2% e incube a 37 °C durante 20 min.
- Sumerja las rodajas de cerebro en paraformaldehído al 4% durante la noche y tome fotografías al día siguiente.
- Mida el área infartada de cada corte y el área total del cerebro con ImageJ. Calcule la relación de volumen de infarto usando la fórmula: % de volumen de infarto = (Suma de las áreas infartadas / Suma de las áreas cerebrales totales) × 100%.
Resultados
En la creación del modelo MCAO, las herramientas principales utilizadas para fabricar los filamentos y los filamentos terminados se muestran en la Figura 3. Después de la producción de filamento, el modelo MCAO se establece insertando el filamento a través de la arteria carótida externa, con la duración de la operación registrada. El modelado exitoso se define por una puntuación de Longa de 1-3 4 h después de la extracción del filamento. El peso corporal se controla diariamente después de la operación. Los déficits neurológicos se evalúan mediante puntuaciones de gravedad neurológica modificadas (mNSS) a las 24 h y 72 h después de la operación. El daño isquémico se evalúa mediante tinción TTC.
En el grupo de filamentos de 10 mm, cinco de cada diez ratones experimentaron hemorragia subaracnoidea (HSA), y dos de estos casos fueron mortales. En consecuencia, los cinco ratones afectados fueron excluidos del estudio. Por el contrario, ninguno de los ratones del grupo de filamentos de 5 mm experimentó HSA. La tasa de éxito del modelado fue del 100% en el grupo de filamento de 5 mm, significativamente mayor en comparación con la tasa de éxito del 50% observada en el grupo de filamento de 10 mm.
El tiempo quirúrgico, definido como la duración desde la incisión cutánea hasta la inserción del filamento, fue significativamente menor en el grupo de filamentos de 5 mm en comparación con el grupo de filamentos de 10 mm (614 s ± 49,15 s vs. 758 s ± 65,63 s, P < 0,01) (Figura 4A). Ambos grupos de filamentos mostraron una reducción significativa en el peso corporal postoperatorio en comparación con el grupo de operación simulada; sin embargo, no se observaron diferencias significativas entre los dos tamaños de filamento (Figura 4B).
La tinción con TTC confirmó el infarto cerebral en el modelo MCAO inducido por filamentos de fabricación propia (Figura 5). A los tres días de la cirugía, el volumen del infarto fue del 21,48% ± 6,79% para el grupo de 5 mm y del 19,85% ± 7,01% para el grupo de 10 mm, sin diferencias estadísticas significativas entre ambos grupos en cuanto al tamaño del infarto. En cada grupo de ratones, hubo variabilidad en el área de infarto cerebral, con tres de cinco ratones mostrando un área de infarto más grande (Figura 5B, C) y dos mostrando un área de infarto más pequeña (Figura 5E, F). La cuantificación del volumen del infarto se muestra en la Figura 5G.
Los déficits de la función neurológica se evaluaron mediante puntuaciones de mNSS en los días 1 y 3 post-MCAO, como se muestra en la Figura 6. En ambos días, los grupos de 5 mm y 10 mm mostraron puntuaciones mNSS significativamente mayores en comparación con el grupo de operación simulada, sin que se observaran diferencias significativas entre las puntuaciones mNSS de los grupos de 5 mm y 10 mm.

Figura 1: Construcción y marcado del filamento. (A) Enrollar la sutura de nailon 6-0 de manera uniforme alrededor de una placa de regla de plástico. (B) Etiquetar y cortar verticalmente la herida para crear un filamento de 2 cm. Haga clic aquí para ver una versión más grande de esta figura.
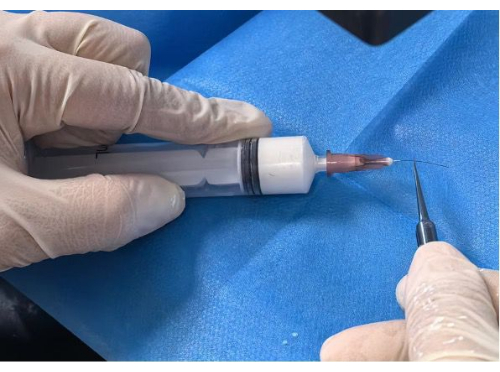
Figura 2: Recubrimiento del filamento. Haga clic aquí para ver una versión más grande de esta figura.
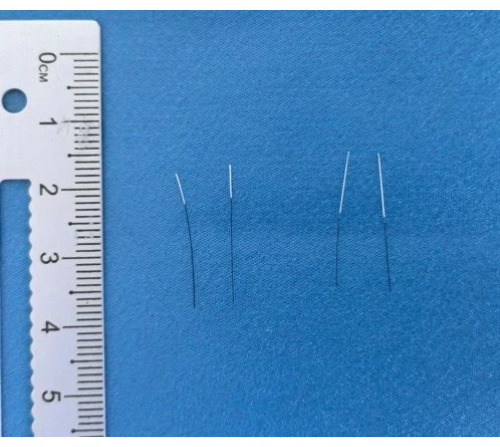
Figura 3: Filamentos terminados. Imágenes de los filamentos terminados después del recubrimiento y marcado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Duración quirúrgica y peso corporal del ratón. (A) Duración quirúrgica. (B) Peso corporal del ratón medido antes de la cirugía y tres días después de la operación. Las diferencias estadísticas se analizaron mediante ANOVA y prueba post hoc de Tukey. Los datos se presentan como media ± SEM, n = 5, **P < 0,01. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Secciones cerebrales teñidas con TTC. Secciones representativas del cerebro teñidas con TTC que muestran áreas de tejido sano (rojo) y lesión isquémica (blanco) para los grupos Sham (A,D), MCAO de 5 mm (B,E) y MCAO de 10 mm (C,F). Tres de cada cinco ratones muestran un área de infarto más grande (B,C) y dos muestran un área de infarto más pequeña (E,F). (G) Cuantificación del volumen del infarto. Las diferencias estadísticas se analizaron mediante ANOVA y prueba post hoc de Tukey. Los datos se presentan como media ± SEM, n = 5, **P < 0,01. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Puntuaciones neurológicas post-MCAO. Puntuaciones neurológicas registradas en el1º y3º día post-MCAO. Las diferencias estadísticas se analizaron mediante ANOVA y prueba post hoc de Tukey. Los datos se presentan como media ± SEM, n = 5, ****P < 0,001. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Blanqueamiento de la pupila después de la inserción del filamento. Se observa blanqueamiento de la pupila después de la inserción del filamento de silicona de 10 mm. Haga clic aquí para ver una versión más grande de esta figura.
| 0 puntos | Ausencia de síntomas de daño neurológico | |
| 1 punto | Incapacidad para extender completamente la extremidad anterior contralateral | |
| 2 puntos | Dar vueltas hacia el lado contralateral mientras se camina | |
| 3 puntos | Inclinarse hacia el lado contralateral mientras camina | |
| 4 puntos | Incapacidad para caminar espontáneamente, pérdida del conocimiento | |
Tabla 1: Puntuación de Longa para el éxito del modelo. Sistema de puntuación de Longa utilizado para determinar el éxito del modelo.
| Pruebas | Puntos | ||
| Criar al ratón por la cola | 3 | ||
| Flexión de la extremidad anterior | 1 | ||
| Flexión de la extremidad posterior | 1 | ||
| La cabeza se movió >10° al eje vertical en 30 segundos | 1 | ||
| Ratón andante en el suelo | 3 | ||
| Caminar normal | 0 | ||
| Incapacidad para caminar derecho | 1 | ||
| Dando vueltas hacia el lado parético | 2 | ||
| Cayendo al lado parético | 3 | ||
| Prueba de equilibrio de viga | 6 | ||
| Se equilibra con una postura firme | 0 | ||
| Agarra el lado de la viga | 1 | ||
| Abraza la viga y 1 extremidad cae de la viga | 2 | ||
| Abraza la viga y 2 extremidades caen de la viga, o gira sobre la viga [>30 s] | 3 | ||
| Intenta mantener el equilibrio en la viga pero se cae [>20 s] | 4 | ||
| Intenta mantener el equilibrio en la viga pero se cae [>10 s] | 5 | ||
| Se cae, no intenta mantener el equilibrio o colgarse de la viga [<10 s] | 6 | ||
| Ausencia de reflejos | 2 | ||
| Reflejo del pabellón auricular (la cabeza se sacude al tocar el meato auditivo) | 1 | ||
| Reflejo corneal (un parpadeo al tocar ligeramente la córnea con algodón) | 1 | ||
Tabla 2: Puntuaciones de gravedad neurológica modificadas (mNSS). Puntuaciones de gravedad neurológica modificadas (mNSS) utilizadas para evaluar la gravedad neurológica.
Discusión
Este estudio demuestra un método simple y rentable para fabricar filamento, lo que confirma su viabilidad en la creación de un modelo MCAO. La longitud de la capa de silicona del filamento se puede ajustar según las necesidades experimentales, lo que ofrece una flexibilidad adicional. La preparación de un émbolo de filamento de 5 mm logró una tasa de éxito del 100% sin que se produjera hemorragia subaracnoidea (HSA) en ratones. En el grupo que utilizó émbolos de filamento de 10 mm, hubo casos de HSA, mientras que el resto de los ratones mostraron un infarto claro en la región MCA. Un paso crítico en la reducción de la HSA fue retraer ligeramente el filamento al encontrar resistencia durante el procedimiento. En el experimento preliminar, casi la mitad de los ratones sin este ajuste experimentaron SAH cuando se utilizó un filamento de silicona recubierto de 5 mm. El filamento encontró resistencia al llegar a la arteria cerebral anterior del ratón12. Por lo tanto, cualquier ligero cambio en la posición del ratón antes de retirar el filamento puede romper el vaso sanguíneo. Retraer ligeramente el filamento puede bloquear eficazmente el origen del MCA al tiempo que evita que la punta del filamento entre en el ACA y cause SAH.
Al emplear filamentos de 10 mm, se observó una mayor incidencia de HAS, que podría atribuirse a la menor flexibilidad del filamento debido al aumento de la longitud del recubrimiento de silicona. Esta rigidez puede hacer que el filamento perfore los vasos al encontrar resistencia durante la inserción. Además, la duración quirúrgica fue mayor para el grupo de 10 mm, lo que concuerda con la mayor dificultad de manipular filamentos recubiertos de silicona más largos, lo que resultó en tiempos de operación prolongados. Esto indica que las longitudes más cortas de los filamentos recubiertos de silicona no sólo pueden garantizar una alta tasa de éxito en el modelado, sino también reducir la complejidad quirúrgica y la aparición de complicaciones postoperatorias.
El hallazgo de que el uso de filamentos recubiertos de silicona de 5 mm y 10 mm en los ratones modelo MCAO no muestra diferencias significativas en las áreas de infarto cerebral y las puntuaciones de comportamiento sugiere que, bajo ciertas condiciones, la longitud del recubrimiento de silicona en el filamento puede tener un impacto mínimo en los resultados experimentales. Sin embargo, dentro de cada grupo, hubo diferencias notables en las áreas de infarto cerebral. En el grupo de 5 mm, tres de cada cinco ratones exhibieron áreas de infarto más grandes, incluidas regiones como el tálamo, el hipotálamo y el hipocampo, mientras que otros tenían áreas de infarto más pequeñas. La distribución de los tamaños de infarto en el grupo de 10 mm fue similar a la del grupo de 5 mm, lo que puede estar relacionado a la variabilidad anatómica de la vasculatura cerebral de los ratones 15,16. Un factor contribuyente conocido es la variación en la permeabilidad de la arteria comunicante posterior (PcomA)16. Las PcomAs son las principales arterias colaterales después de la MCAO inducida por el filamento, irrigando áreas como el hipocampo y el tálamo17. Sin embargo, aproximadamente el 90% de los ratones C57BL/6 exhiben PcomAs17 subdesarrollado o ausente, y la proporción de ratones con áreas de infarto más grandes en cada grupo se acerca a este porcentaje. Los ratones con PcomAs subdesarrollados o ausentes, además de MCA, también tienen obstruido el suministro de sangre de la arteria cerebral posterior (PCA) en el modelo MCAO, lo que lleva a áreas de infarto más grandes12. Un estudio utilizó filamentos más cortos recubiertos de silicona (2 mm) para evitar la obstrucción del suministro de sangre de PCA, pero esto redujo significativamente la tasa de éxito del modelo18. Se han observado variaciones en la distancia anatómica entre el MCA y el PCA en la unión que forma el Círculo de Willis en diferentes cepas de ratones y categorías de peso19. En consecuencia, para garantizar el éxito del modelado y la estabilidad del tamaño del infarto dentro de las cohortes, es fundamental preparar filamentos recubiertos de silicona de longitudes personalizadas que se adapten a las variaciones anatómicas específicas en la vasculatura cerebral de los ratones a través de diferentes cepas y pesos corporales. El método de producción de filamentos descrito en este artículo facilita dicha investigación.
Alrededor del 65% de los incidentes de accidente cerebrovascular isquémico se acompañan de pérdida temporal o permanente de la visión, generalmente atribuida a la afección de la radiación óptica o de la corteza visual20,21. Sin embargo, los pacientes con accidente cerebrovascular también conllevan un mayor riesgo de isquemia aguda de la retina22,23. En la actualidad, no existen modelos animales experimentales claros de accidente cerebrovascular isquémico que incluyan isquemia de retina. En ratones que utilizaron filamentos de 10 mm, tres ratones experimentaron un blanqueamiento ipsilateral de la pupila después de la inserción del filamento, que se resolvió unos 5 minutos después de que se retirara el filamento (Figura 7). Este fenómeno indica la oclusión de la arteria oftálmica después de la inserción del filamento, pero esto no se observó en ratones con filamentos de 5 mm. Actualmente, no existe consenso sobre el origen de la arteria oftálmica en animales de experimentación. Algunos estudios sugieren que, al igual que en los humanos, la arteria oftálmica (OA) en ratones C57BL/6J se origina en la arteria carótida interna 24,25,26. Otras investigaciones postulan que, al igual que en las ratas, la artrosis de ratón se origina en la arteria pterigopalatina (PPA)27. Por lo tanto, teniendo en cuenta la variabilidad en el origen de la OA del ratón, el blanqueamiento de la pupila observado en algunos ratones del grupo de 10 mm podría deberse a esta variabilidad. En estos ratones, las arterias oftálmicas que se originan a partir del PPA experimentan un suministro de sangre insuficiente debido a la oclusión en el inicio de la arteria por el filamento recubierto de silicona de 10 mm al insertarse, lo que resulta en el blanqueamiento de la pupila. No se produjo este fenómeno en el grupo de 5 mm, probablemente porque la longitud más corta de la silicona era insuficiente para bloquear el PPA.
Aunque este estudio proporciona un método eficaz para la producción de filamentos y valida su eficacia experimentalmente, ofreciendo una estrategia para la preparación individualizada de filamentos, también tiene algunas limitaciones. El recubrimiento de silicona de los filamentos artesanales no se aplica de manera uniforme, lo que da como resultado una forma cilíndrica irregular. Durante el proceso de fabricación, la jeringa debe operarse a una velocidad constante para evitar inconsistencias en el recubrimiento de silicona en la parte delantera y trasera del filamento. Herramientas asequibles y un proceso fácil de seguir hacen que sea factible para los principiantes practicar el modelo MCAO con filamentos artesanales. Las investigaciones futuras podrían explorar mejoras en el diseño de filamentos, como la optimización de materiales o el ajuste de dimensiones, para reducir la incidencia de complicaciones y mejorar la reproducibilidad del modelo. Además, tener en cuenta las diferencias anatómicas para lograr un modelo más estable será crucial para comprender mejor los mecanismos y las estrategias de tratamiento de las enfermedades cerebrovasculares isquémicas.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo fue apoyado por la Fundación Médica Wu Jieping (320.6750.161290).
Materiales
| Name | Company | Catalog Number | Comments |
| 10 mL Syringe | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 2,3,5-Triphenyltetrazolium Chloride (TTC) | Sigma-Aldrich | G3005 | Dye for TTC staining |
| 24-well culture plate | Corning | CLS3527 | Vessel for TTC staining |
| 26 G syringe needle | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 4% paraformaldehyde | Servicebio | G1101 | Tissue fixation |
| 6-0 nylon suture | Haidike Medical Products Co., Ltd. | Materials for making filaments | |
| Anesthesia system for isoflurane | Rwd Life Science Co., Ltd. | R610 | Anesthetized animal |
| Bipolar electrocoagulation generator | Yirun Medical Instrument Co., Ltd. | ZG300 | Equipment for surgery |
| Constant temperature water bath | Spring Instrument Co., Ltd. | HH-M6 | TTC staining |
| Eye ointment | Guangzhou Pharmaceutical | H44023098 | Material for surgery |
| Heat blanket | ZH Biomedical Instrument Co., Ltd. | Maintain body temperatur | |
| Isoflurane | Rwd Life Science Co., Ltd. | R510-22-10 | Anesthetized animal |
| Meloxicam | Boehringer-Ingelheim | J20160020 | Analgesia for animal |
| Microsurgical artery clamp | Shanghai Jinzhong Surgical Instruments Co., Ltd. | W40130 | Instrument for surgery |
| Microsurgical hemostatic clamp forceps | Shanghai Jinzhong Surgical Instruments Co., Ltd. | M-W-0022 | Instrument for surgery |
| Microsurgical instruments set | Rwd Life Science Co., Ltd. | SP0009-R | Equipment for surgery |
| Mouse thermometer | Hubei Dasjiaer Biotechnology | FT3400 | Intraoperative temperature monitoring |
| Pentobarbital sodium | Sigma-Aldrich | P3761 | Euthanized animal |
| Shaver | Joyu Electrical Appliances | PHC-920 | Equipment for surgery |
| Silicone Sealant | Kafuter | K-704 | Materials for making filaments |
| Stereomicroscope | Rwd Life Science Co., Ltd. | 77001S | Equipment for surgery |
| Suture thread with needle (3-0) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | F404SUS302 | Equipment for surgery |
Referencias
- Collaborators GBDS. Global, regional, and national burden of stroke and its risk factors, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet Neurol. 20 (10), 795-820 (2021).
- Kleindorfer, D. O., et al. Guideline for the prevention of stroke in patients with stroke and transient ischemic attack: A guideline from the American Heart Association/American Stroke Association. Stroke. 52 (7), e364-e467 (2021).
- Saini, V., Guada, L., Yavagal, D. R. Global epidemiology of stroke and access to acute ischemic stroke interventions. Neurology. 97 (20 Suppl 2), S6-S16 (2021).
- Hill, M. D., Coutts, S. B. Alteplase in acute ischaemic stroke: The need for speed. Lancet. 384 (9958), 1904-1906 (2014).
- Asif, K. S., et al. Mechanical thrombectomy global access for stroke (mt-glass): A mission thrombectomy (mt-2020 plus) study. Circulation. 147 (16), 1208-1220 (2023).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Des Devel Ther. 9, 3445-3454 (2015).
- Ringelstein, E. B., et al. Type and extent of hemispheric brain infarctions and clinical outcome in early and delayed middle cerebral artery recanalization. Neurology. 42 (2), 289-298 (1992).
- Shaik, N. F., Regan, R. F., Naik, U. P. Platelets as drivers of ischemia/reperfusion injury after stroke. Blood Adv. 5 (5), 1576-1584 (2021).
- Zhang, S. R., et al. Large-scale multivariate analysis to interrogate an animal model of stroke: Novel insights into poststroke pathology. Stroke. 52 (11), 3661-3669 (2021).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, Y., Ito, A., Takai, K., Saito, N. Blocking pterygopalatine arterial blood flow decreases infarct volume variability in a mouse model of intraluminal suture middle cerebral artery occlusion. J Neurosci Methods. 174 (1), 18-24 (2008).
- Yuan, F., et al. Optimizing suture middle cerebral artery occlusion model in c57bl/6 mice circumvents posterior communicating artery dysplasia. J Neurotrauma. 29 (7), 1499-1505 (2012).
- Bieber, M., et al. Validity and reliability of neurological scores in mice exposed to middle cerebral artery occlusion. Stroke. 50 (10), 2875-2882 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), e3564(2012).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Mccoll, B. W., Carswell, H. V., Mcculloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond mca territory after intraluminal filament occlusion in c57bl/6j mice. Brain Res. 997 (1), 15-23 (2004).
- Liu, Z., et al. Optimisation of a mouse model of cerebral ischemia-reperfusion to address issues of survival and model reproducibility and consistency. Comput Intell Neurosci. 2022, 7594969(2022).
- Ward, R., Collins, R. L., Tanguay, G., Miceli, D. A quantitative study of cerebrovascular variation in inbred mice. J Anat. 173, 87-95 (1990).
- Hanna, K. L., Hepworth, L. R., Rowe, F. Screening methods for post-stroke visual impairment: A systematic review. Disabil Rehabil. 39 (25), 2531-2543 (2017).
- Rowe, F. J. Stroke survivors' views and experiences on impact of visual impairment. Brain Behav. 7 (9), e00778(2017).
- Scoles, D., Mcgeehan, B., Vanderbeek, B. L. The association of stroke with central and branch retinal arterial occlusion. Eye (Lond). 36 (4), 835-843 (2022).
- Kim, Y. D., et al. Cerebral magnetic resonance imaging of coincidental infarction and small vessel disease in retinal artery occlusion. Sci Rep. 11 (1), 864(2021).
- Emiroglu, M. Y., et al. Effects of obstructive carotid artery disease on ocular circulation and the safety of carotid artery stenting. Heart Lung Circ. 26 (10), 1069-1078 (2017).
- Cotofana, S., Lachman, N. Arteries of the face and their relevance for minimally invasive facial procedures: An anatomical review. Plast Reconstr Surg. 143 (2), 416-426 (2019).
- Xu, X., et al. Dibazol-induced relaxation of ophthalmic artery in C57bl/6J mice is correlated with the potency to inhibit voltage-gated ca(2+) channels. Exp Eye Res. 231, 109468(2023).
- Justic, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados