Method Article
Filamento rivestito in silicone artigianale per topi modelli di occlusione dell'arteria cerebrale media
In questo articolo
Riepilogo
Questo protocollo descrive un metodo semplice per la creazione di filamenti rivestiti per il modello di occlusione dell'arteria cerebrale media (MCAO) nei topi utilizzando silicone, suture di nylon e aghi per siringa. Questo metodo consente la produzione di filamenti con un diametro costante e varie lunghezze di avvolgimento del silicone su misura per le esigenze sperimentali.
Abstract
Con l'invecchiamento della popolazione globale, l'ictus ischemico è diventato la seconda causa di disabilità e mortalità in tutto il mondo, ponendo un onere immenso sia sulla società che sulle famiglie. Sebbene trattamenti come la trombolisi endovenosa e gli interventi endovascolari possano migliorare sostanzialmente gli esiti per i pazienti con ictus ischemico acuto, solo una piccola percentuale di individui beneficia di queste terapie. Per far progredire la nostra comprensione della malattia e scoprire trattamenti più efficaci, i ricercatori sviluppano e perfezionano continuamente modelli animali. Tra questi, il modello di occlusione dell'arteria cerebrale media (MCAO) si distingue come il modello più comunemente utilizzato nella ricerca sulle malattie cerebrovascolari. Il filamento utilizzato in questo modello è fondamentale per il suo sviluppo. Questo protocollo delinea un metodo per creare filamenti con diametri coerenti e lunghezze variabili di rivestimento in silicone. Il modello MCAO prodotto utilizzando questo metodo nei topi C57 ha dimostrato un elevato successo e coerenza, offrendo uno strumento prezioso per indagini su misura nelle malattie cerebrovascolari ischemiche.
Introduzione
L'ictus è una delle cause più diffuse di mortalità e disabilità in tutto il mondo. Gli ictus ischemici ed emorragici sono i principali tipi di evento cerebrovascolare, con ictus ischemici che rappresentano circa l'87% dei casi 1,2,3. Attualmente, esistono due modalità di trattamento per i pazienti con ictus ischemico: terapia farmacologica con attivatore tissutale ricombinante del plasminogeno (rtPA) e trombectomia meccanica. Tuttavia, la finestra terapeutica ristretta e gli ampi criteri di esclusione limitano l'applicazione di questi trattamenti, a beneficio solo di una minoranza di pazienti. Ciò sottolinea la necessità di continuare gli sforzi per migliorare le terapie per l'ictus ischemico 4,5. I modelli in vitro sono inadeguati per replicare le complesse risposte fisiopatologiche a seguito di un ictus, rendendo i modelli animali una componente indispensabile della ricerca preclinica sull'ictus. L'ischemia cerebrale focale umana è più frequentemente causata dall'occlusione trombotica o embolica dell'arteria cerebrale media (MCA), il che rende altamente rilevanti i modelli di roditori progettati per simulare l'occlusione MCA (MCAO)6.
Il modello MCAO indotto da filamenti, il più ampiamente adottato nella ricerca sull'ictus, facilita l'occlusione all'inizio dell'arteria cerebrale media (MCA) e la successiva riperfusione, portando a estese infarti nelle aree sottocorticali e corticali del cervello. Il vantaggio di questo modello risiede nella sua capacità di ripristinare il flusso sanguigno dopo aver indotto un'ischemia focale, parallelamente ai processi fisiopatologici osservati nell'ictus umano7. Inoltre, il modello simula il danno da riperfusione, un fattore critico nell'entità del danno8. Tuttavia, il modello MCAO presenta dei limiti, tra cui la variabilità del volume dell'infarto, con la deviazione standard che in alcuni studi raggiunge potenzialmente il 64% del valore medio9. Nonostante oltre tre decenni di utilizzo, gli sforzi per migliorare l'affidabilità del modello sono in corso, ma persistono variazioni significative nel volume delle lesioni ischemiche negli studi e nei laboratori 10,11,12.
Questo articolo introduce un filamento autoprodotto per l'induzione di modelli che valutano i punteggi di deficit neurologico e le aree di infarto cerebrale. Esamina la correlazione tra le lunghezze dei filamenti rivestiti di silicone e il successo e la stabilità del modello MCAO. Questa tecnica di produzione produce filamenti con una consistenza encomiabile, contribuendo allo sviluppo di un modello MCAO relativamente stabile.
Protocollo
Tutte le procedure per gli animali hanno aderito alle procedure sperimentali e agli standard approvati dal Comitato Istituzionale per la Cura e l'Uso degli Animali dell'Ospedale Provinciale del Popolo dello Shanxi (numero di approvazione: 2024 Comitato Etico Medico Provinciale n. 64). I topi utilizzati in questo esperimento erano topi maschi C57BL/6, di 8-10 settimane, del peso di 24-26 g. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei materiali.
1. Preparazione del filamento
- Marcatura del filamento originale: avvolgere la sutura di nylon 6-0 in modo uniforme attorno a una piastra righello di plastica. Tracciare dei segni a 5 mm e 10 mm dalla testa del filamento (compreso il punto di segno di rivestimento e il punto di segno di profondità di inserimento).
- Tagliare verticalmente verso il basso con una lama per assicurarsi che entrambe le estremità siano perfettamente circolari, ottenendo un filamento iniziale lungo 2 cm (Figura 1).
- Fabbricazione del dispositivo di rivestimento: utilizzare una pinza emostatica per staccare la testa dell'ago di una siringa da 26 G, quindi lucidare il foro dell'ago in un cerchio perfetto con carta vetrata. Aspirare 2 ml di sigillante siliconico K-704 con una siringa da 10 mK e, infine, collegare la testa dell'ago alla siringa.
- Rivestimento del filamento: Inserire il filamento iniziale nel foro dell'ago preparato fino alla posizione contrassegnata di 5 mm o 10 mm. Spingere lentamente e costantemente la siringa fino a quando il filamento non è completamente rivestito sotto uno stereomicroscopio (Figura 2).
- Impostazione del filamento rivestito: Fissare il filamento rivestito in posizione verticale con del nastro adesivo e attendere circa 20 minuti affinché il silicone si solidifichi completamente.
- Sterilizzazione e confezionamento: immergere i filamenti preparati in alcol al 75%, asciugarli con un batuffolo di cotone e quindi confezionarli in provette da centrifuga da 5 ml.
2. Modello MCAO
NOTA: Gli strumenti chirurgici sono stati sterilizzati in autoclave (121 °C a 15 psi per 60 minuti). Il tavolo operatorio e le altre attrezzature sono state sanificate utilizzando etanolo al 75%. I topi sono stati digiunati per 8 ore prima dell'intervento, ma è stato loro permesso di accedere liberamente all'acqua.
- Somministrare 5 mg/kg di meloxicam per via sottocutanea per l'analgesia 60 minuti prima dell'intervento chirurgico. Collegare una coperta termica per mantenere la temperatura corporea del topo a 37 °C durante l'anestesia.
- Indurre l'anestesia con isoflurano al 4% fino a quando i movimenti spontanei e le contrazioni dei baffi cessano, quindi mantenere l'anestesia all'1,5% (seguendo i protocolli approvati istituzionalmente). Applicare l'unguento per gli occhi su entrambi gli occhi.
- Metti il topo in posizione supina, fissa la testa e gli arti, rade i peli sul collo e sulla parte superiore del torace e disinfetta la pelle con etanolo al 75% dall'interno verso l'esterno.
- Praticare un'incisione cutanea lunga 2,5 cm lungo la linea mediana del collo, dalla mascella inferiore allo sterno.
- Sezionare senza mezzi termini i muscoli del collo destro per esporre la guaina carotidea. Utilizzare una pinza oftalmica per aprire la guaina e separare l'arteria carotide comune (CCA), l'arteria carotide esterna (ECA) e l'arteria carotide interna (ICA), facendo attenzione a non disturbare il nervo vago.
- Legare temporaneamente il CCA con un nodo scorsoio prima della biforcazione e bloccare l'ICA con un morsetto microchirurgico dell'arteria.
- Cauterizzare l'arteria tiroidea superiore dall'ECA utilizzando una penna per coagulazione bipolare.
- Lasciare due fili sull'ECA per la legatura: uno sull'estremità distale per la legatura permanente e un altro sull'estremità prossimale con un nodo sciolto per un uso futuro. Praticare un'incisione di circa 0,5 mm tra le due legature sull'ECA utilizzando le forbici oftalmiche per inserire il filamento.
- Inserire il filamento rivestito di silicone da 5 mm o 10 mm nel CCA attraverso l'incisione e poi fissarlo stringendo il nodo sciolto.
- Dopo aver tagliato l'estremità distale dell'ECA e rimosso il morsetto dall'ICA, ritrarre il filamento fino alla biforcazione CCA. Quindi, capovolgere e far avanzare il filamento nell'ICA profondo finché non si avverte resistenza. Ritira leggermente il filamento e fissalo stringendo il nodo.
- Suturare la pelle dell'animale con sutura 3-0 e disinfettare la ferita con iodio. Metti il mouse in una camera di recupero per 1 ora.
- Anestetizzare nuovamente il topo, rimuovere delicatamente il filamento, legare il filo di legatura ECA che fissa il filamento e rilasciare il nodo scorsoio CCA per ripristinare il flusso sanguigno e riperfondere l'arteria cerebrale media.
- Taglia i fili in eccesso, sutura la pelle del collo e disinfetta nuovamente l'area.
3. Operazione fittizia
- Per le operazioni fittizie, inserire un filamento rivestito di silicone da 7 mm per occludere l'arteria cerebrale media destra e quindi ritirarlo immediatamente per consentire la riperfusione istantanea.
NOTA: La procedura successiva è identica a quella eseguita su animali sottoposti a ischemia cerebrale.
4. Punteggio neurologico
- Posizionare gli animali da esperimento di ciascun gruppo in campo aperto e condurre un punteggio postoperatorio comportamentale 4 ore dopo la riperfusione dell'ischemia cerebrale.
- Per una modellazione di successo, prendere in considerazione punteggi compresi tra 1 e 3. I criteri di valutazione si basano sul metodo di punteggio Longa10, come dettagliato nella Tabella 1.
- Valutare i deficit neurologici in base ai punteggi di gravità neurologica modificata (mNSS)13, con valutazioni effettuate a 24 ore e 72 ore dopo la riperfusione (vedere Tabella 2).
5. Perfusione transcardiaca
- Anestetizzare il topo con pentobarbital sodico all'1,5% (seguendo protocolli istituzionalmente approvati). Rimetti il mouse nella sua gabbia e attendi 10 minuti. Quindi, pizzica le dita dei piedi del topo per verificare l'assenza di riflessi e garantire un'anestesia profonda.
- Posizionare il mouse in posizione supina su un supporto in schiuma e fissarne gli arti.
- Tagliare la punta di un ago da 25 G per smussarlo, prevenendo la puntura della parete aortica. Collegare l'ago a una siringa riempita con 20 mL di soluzione fisiologica.
- Solleva la pelliccia del torace e usa le forbici per tagliare via la pelle per esporre il processo xifoideo. Afferrare il processo xifoideo e tagliare orizzontalmente sotto di esso per esporre il diaframma aprendo lo strato muscolare. Tagliare con cura il diaframma con le forbici, evitando danni al cuore.
- Tagliare lungo il lato esterno dello sterno per aprire la gabbia toracica su entrambi i lati, capovolgere la parete anteriore del torace e fissarla con emostatici.
- Usa un batuffolo di cotone per rimuovere il grasso alla base del cuore, esponendo la radice dell'aorta.
- Fissare il cuore con una pinza, inserire l'ago all'apice del cuore e avanzare obliquamente verso l'alto fino a quando l'ago è visibile attraverso la parete aortica. Bloccare l'ago in posizione.
- Fai un piccolo taglio nell'atrio destro per osservare il flusso sanguigno. Perfondere costantemente la soluzione salina con la siringa, osservando che il sangue esca dall'atrio destro. Una volta che l'effluente è limpido, fermare la perfusione14.
- Dopo la perfusione, decapitare il topo per raccogliere il cervello15 e metterlo in un congelatore a -20 °C per un'ulteriore lavorazione.
6. Valutazione del volume dell'infarto mediante colorazione TTC
- Congelare rapidamente i tessuti cerebrali prelevati in un congelatore a -20 °C per 20 minuti, quindi posizionarli su uno stampo per affettare il cervello pre-raffreddato e sezionarli in fette spesse 1 mm.
- Immergere le sezioni cerebrali ottenute in una soluzione TTC al 2% e incubare a 37 °C per 20 minuti.
- Immergere le fette di cervello in paraformaldeide al 4% per una notte e scattare fotografie il giorno successivo.
- Misurare l'area infartuata per ogni fetta e l'area cerebrale totale utilizzando ImageJ. Calcola il rapporto del volume dell'infarto utilizzando la formula: Volume dell'infarto % = (Somma delle aree infartuate / Somma delle aree cerebrali totali) × 100%.
Risultati
Nella creazione del modello MCAO, gli strumenti principali utilizzati per fabbricare i filamenti e i filamenti finiti sono mostrati nella Figura 3. Dopo la produzione del filamento, il modello MCAO viene stabilito inserendo il filamento attraverso l'arteria carotide esterna, con la durata dell'operazione registrata. Il successo della modellazione è definito da un punteggio Longa di 1-3 4 ore dopo il ritiro del filamento. Il peso corporeo viene monitorato quotidianamente dopo l'operazione. I deficit neurologici vengono valutati utilizzando punteggi di gravità neurologica modificati (mNSS) a 24 ore e 72 ore dopo l'operazione. Il danno ischemico viene valutato attraverso la colorazione TTC.
Nel gruppo dei filamenti da 10 mm, cinque topi su dieci hanno sperimentato un'emorragia subaracnoidea (SAH), con due di questi casi fatali. Di conseguenza, tutti e cinque i topi affetti sono stati esclusi dallo studio. Al contrario, nessuno dei topi nel gruppo del filamento da 5 mm ha sperimentato SAH. Il tasso di successo della modellazione è stato del 100% nel gruppo dei filamenti da 5 mm, significativamente più alto rispetto al tasso di successo del 50% osservato nel gruppo dei filamenti da 10 mm.
Il tempo chirurgico, definito come la durata dall'incisione cutanea all'inserimento del filamento, era significativamente più breve nel gruppo con filamenti da 5 mm rispetto al gruppo con filamenti da 10 mm (614 s ± 49,15 s contro 758 s ± 65,63 s, P < 0,01) (Figura 4A). Entrambi i gruppi di filamenti hanno mostrato una significativa riduzione del peso corporeo postoperatorio rispetto al gruppo con operazione fittizia; tuttavia, non è stata osservata alcuna differenza significativa tra le due dimensioni dei filamenti (Figura 4B).
La colorazione TTC ha confermato l'infarto cerebrale nel modello MCAO autoprodotto indotto da filamenti (Figura 5). Tre giorni dopo l'intervento, il volume dell'infarto è stato del 21,48% ± del 6,79% per il gruppo da 5 mm e del 19,85% ± 7,01% per il gruppo da 10 mm, senza differenze statistiche significative tra i due gruppi per quanto riguarda le dimensioni dell'infarto. In ciascun gruppo di topi, c'era variabilità nell'area dell'infarto cerebrale, con tre topi su cinque che mostravano un'area di infarto più grande (Figura 5B, C) e due che mostravano un'area di infarto più piccola (Figura 5E, F). La quantificazione del volume dell'infarto è mostrata nella Figura 5G.
I deficit della funzione neurologica sono stati valutati mediante punteggi mNSS nei giorni 1 e 3 post-MCAO, come mostrato nella Figura 6. In entrambi i giorni, i gruppi da 5 mm e 10 mm hanno mostrato punteggi mNSS significativamente più elevati rispetto al gruppo con operazione fittizia, senza alcuna differenza significativa osservata tra i punteggi mNSS dei gruppi da 5 mm e 10 mm.

Figura 1: Costruzione e marcatura del filamento. (A) Avvolgere la sutura in nylon 6-0 in modo uniforme attorno a una piastra righello di plastica. (B) Etichettare e affettare verticalmente la ferita per creare un filamento di 2 cm. Clicca qui per visualizzare una versione più grande di questa figura.
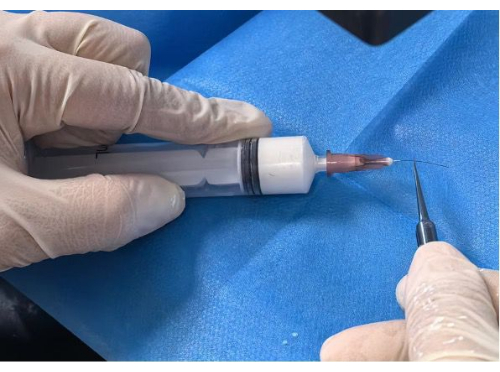
Figura 2: Rivestimento del filamento. Clicca qui per visualizzare una versione più grande di questa figura.
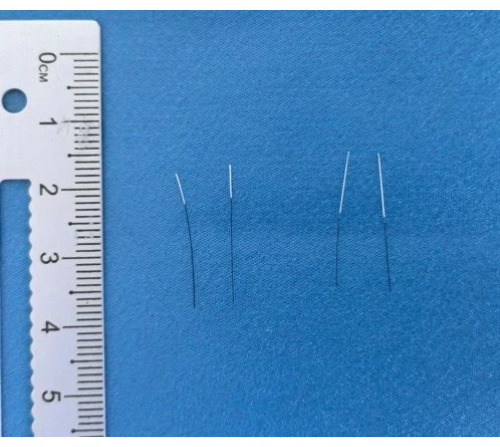
Figura 3: Filamenti finiti. Immagini dei filamenti completati dopo il rivestimento e la marcatura. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Durata dell'intervento chirurgico e peso corporeo del topo. (A) Durata dell'intervento chirurgico. (B) Peso corporeo del topo misurato prima dell'intervento chirurgico e tre giorni dopo l'intervento. Le differenze statistiche sono state analizzate utilizzando ANOVA e test post hoc di Tukey. I dati sono presentati come media ± SEM, n = 5, **P < 0,01. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Sezioni cerebrali colorate con TTC. Sezioni cerebrali rappresentative colorate con TTC che mostrano aree di tessuto sano (rosso) e danno ischemico (bianco) per i gruppi Sham (A, D), MCAO (B, E) da 5 mm e MCAO (C, F). Tre topi su cinque mostrano un'area dell'infarto più grande (B, C) e due mostrano un'area dell'infarto più piccola (E, F). (G) Quantificazione del volume dell'infarto. Le differenze statistiche sono state analizzate utilizzando ANOVA e test post hoc di Tukey. I dati sono presentati come media ± SEM, n = 5, **P < 0,01. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Punteggi neurologici post-MCAO. Punteggi neurologici registrati il 1° e il 3° giorno post-MCAO. Le differenze statistiche sono state analizzate utilizzando ANOVA e test post hoc di Tukey. I dati sono presentati come media ± SEM, n = 5, ****P < 0,001. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Sbiancamento della pupilla dopo l'inserimento del filamento. Sbiancamento della pupilla osservato dopo l'inserimento del filamento di silicone da 10 mm. Clicca qui per visualizzare una versione più grande di questa figura.
| 0 punti | Nessun sintomo di danno neurologico | |
| 1 punto | Incapacità di estendere completamente l'arto anteriore controlaterale | |
| 2 punti | Girare intorno al lato controlaterale mentre si cammina | |
| 3 punti | Appoggiarsi al lato controlaterale mentre si cammina | |
| 4 punti | Incapacità di camminare spontaneamente, perdita di coscienza | |
Tabella 1: Punteggio Longa per il successo del modello. Sistema di punteggio Longa utilizzato per determinare il successo del modello.
| Test | Scambio ferroviario | ||
| Sollevare il mouse con la coda | 3 | ||
| Flessione dell'arto anteriore | 1 | ||
| Flessione degli arti posteriori | 1 | ||
| Testa spostata di >10° rispetto all'asse verticale entro 30 secondi | 1 | ||
| Topo che cammina sul pavimento | 3 | ||
| Camminata normale | 0 | ||
| Incapacità di camminare dritto | 1 | ||
| Circolare verso il lato paretico | 2 | ||
| Caduta verso il lato paretico | 3 | ||
| Test di bilanciamento del fascio | 6 | ||
| Bilancia con postura stabile | 0 | ||
| Afferra il lato della trave | 1 | ||
| Abbraccia la trave e 1 arto cade dalla trave | 2 | ||
| Abbraccia la trave e 2 arti cadono dalla trave, o gira sulla trave [>30 s] | 3 | ||
| Tenta di bilanciarsi sulla trave ma cade [>20 s] | 4 | ||
| Tenta di bilanciarsi sulla trave ma cade [>10 s] | 5 | ||
| Cade, nessun tentativo di equilibrio o di aggrapparsi alla trave [<10 s] | 6 | ||
| Assenza di riflessi | 2 | ||
| Riflesso del padiglione auricolare (la testa trema quando tocca il meato uditivo) | 1 | ||
| Riflesso corneale (un battito di ciglia quando si tocca leggermente la cornea con del cotone) | 1 | ||
Tabella 2: Punteggi di gravità neurologica modificati (mNSS). Punteggi di gravità neurologica modificati (mNSS) utilizzati per valutare la gravità neurologica.
Discussione
Questo studio dimostra un metodo semplice ed economico per la fabbricazione del filamento, confermando la sua fattibilità nella creazione di un modello MCAO. La lunghezza del rivestimento in silicone del filamento può essere regolata in base alle esigenze sperimentali, offrendo ulteriore flessibilità. La preparazione di un embolo filamentoso da 5 mm ha raggiunto un tasso di successo del 100% senza alcuna insorgenza di emorragia subaracnoidea (SAH) nei topi. Nel gruppo che utilizzava emboli filamentosi da 10 mm, ci sono stati casi di SAH, mentre il resto dei topi ha mostrato un chiaro infarto nella regione MCA. Un passaggio fondamentale per ridurre l'SAH è stato quello di ritrarre leggermente il filamento quando ha incontrato resistenza durante la procedura. Nell'esperimento preliminare, quasi la metà dei topi senza questa regolazione ha sperimentato SAH quando è stato utilizzato un filamento di silicone rivestito da 5 mm. Il filamento ha incontrato resistenza quando ha raggiunto l'arteria cerebrale anteriore del topo12. Pertanto, qualsiasi leggero cambiamento nella posizione del topo prima di ritirare il filamento può rompere il vaso sanguigno. Ritrarre leggermente il filamento può bloccare efficacemente l'origine dell'MCA, impedendo al contempo alla punta del filamento di entrare nell'ACA e causare SAH.
Quando si utilizzano filamenti da 10 mm, è stata osservata una maggiore incidenza di SAH, che potrebbe essere attribuita alla ridotta flessibilità del filamento a causa della maggiore lunghezza del rivestimento in silicone. Questa rigidità può causare la perforazione dei recipienti da parte del filamento quando incontra resistenza durante l'inserimento. Inoltre, la durata dell'intervento chirurgico è stata più lunga per il gruppo da 10 mm, coerentemente con la maggiore difficoltà di manipolare filamenti rivestiti di silicone più lunghi, con conseguente prolungamento dei tempi operativi. Ciò indica che lunghezze più corte dei filamenti rivestiti di silicone possono non solo garantire un alto tasso di successo della modellazione, ma anche ridurre la complessità chirurgica e l'insorgenza di complicanze postoperatorie.
La scoperta che l'uso di filamenti rivestiti di silicone da 5 mm e 10 mm nei topi modello MCAO non mostra differenze significative nelle aree di infarto cerebrale e nei punteggi comportamentali suggerisce che, in determinate condizioni, la lunghezza del rivestimento in silicone sul filamento può avere un impatto minimo sui risultati sperimentali. Tuttavia, all'interno di ciascun gruppo, c'erano notevoli differenze nelle aree di infarto cerebrale. Nel gruppo da 5 mm, tre topi su cinque mostravano aree di infarto più grandi, comprese regioni come il talamo, l'ipotalamo e l'ippocampo, mentre altri avevano aree di infarto più piccole. La distribuzione delle dimensioni dell'infarto nel gruppo di 10 mm era simile a quella del gruppo di 5 mm, il che può essere correlato alla variabilità anatomica della vascolarizzazione cerebrale dei topi15,16. Un fattore che contribuisce è la variazione della pervietà dell'arteria comunicante posteriore (PcomA)16. I PcomA sono le principali arterie collaterali che seguono la MCAO indotta dal filamento, fornendo aree come l'ippocampo e il talamo17. Tuttavia, circa il 90% dei topi C57BL/6 presenta PcomAs17 sottosviluppato o assente e la percentuale di topi con aree di infarto più grandi in ciascun gruppo è vicina a questa percentuale. I topi con PcomA sottosviluppati o assenti, oltre all'MCA, hanno anche un'ostruzione dell'afflusso di sangue all'arteria cerebrale posteriore (PCA) nel modello MCAO, portando a aree di infarto più grandi12. Uno studio ha utilizzato filamenti rivestiti di silicone più corti (2 mm) per evitare di ostruire l'afflusso di sangue al PCA, ma questo ha ridotto significativamente il tasso di successo del modello18. Variazioni nella distanza anatomica tra l'MCA e il PCA nel punto di giunzione che forma il Cerchio di Willis sono state osservate in diversi ceppi di topi e categorie di peso19. Di conseguenza, per garantire il successo della modellazione e la stabilità delle dimensioni dell'infarto all'interno delle coorti, è fondamentale preparare filamenti rivestiti di silicone di lunghezze su misura che si adattino alle specifiche variazioni anatomiche del sistema vascolare cerebrale dei topi in diversi ceppi e pesi corporei. Il metodo di produzione dei filamenti descritto in questo articolo facilita tale ricerca.
Circa il 65% degli episodi di ictus ischemico sono accompagnati da perdita temporanea o permanente della vista, solitamente attribuita all'afflizione della radiazione ottica o della corteccia visiva20,21. Tuttavia, i pazienti con ictus hanno anche un rischio più elevato di ischemia retinica acuta22,23. Attualmente, non esistono chiari modelli animali sperimentali di ictus ischemico che includano l'ischemia retinica. Nei topi che utilizzavano filamenti da 10 mm, tre topi hanno sperimentato lo sbiancamento omolaterale della pupilla dopo l'inserimento del filamento, che si è risolto circa 5 minuti dopo il ritiro del filamento (Figura 7). Questo fenomeno indica l'occlusione dell'arteria oftalmica dopo l'inserimento del filamento, ma questo non è stato osservato nei topi con filamenti di 5 mm. Attualmente, non c'è consenso sull'origine dell'arteria oftalmica negli animali da esperimento. Alcuni studi suggeriscono che, come nell'uomo, l'arteria oftalmica (OA) nei topi C57BL/6J origina dall'arteria carotide interna 24,25,26. Altre ricerche ipotizzano che, come nei ratti, l'OA del topo provenga dall'arteria pterigopalatina (PPA)27. Quindi, considerando la variabilità nell'origine dell'OA del topo, lo sbiancamento della pupilla osservato in alcuni topi del gruppo dei 10 mm potrebbe essere dovuto a questa variabilità. In questi topi, le arterie oftalmiche originate dalla PPA subiscono un insufficiente afflusso di sangue a causa dell'occlusione all'inizio dell'arteria da parte del filamento rivestito di silicone da 10 mm al momento dell'inserimento, con conseguente sbiancamento della pupilla. Nessun fenomeno del genere si è verificato nel gruppo dei 5 mm, probabilmente perché la lunghezza più corta del silicone era insufficiente per bloccare il PPA.
Sebbene questo studio fornisca un metodo efficace per la produzione di filamenti e ne convalidi l'efficacia sperimentalmente, offrendo una strategia per la preparazione individualizzata dei filamenti, presenta anche alcune limitazioni. Il rivestimento in silicone sui filamenti lavorati artigianalmente non viene applicato in modo uniforme, risultando in una forma cilindrica irregolare. Durante il processo di produzione, la siringa deve essere azionata a una velocità costante per evitare incongruenze nel rivestimento in silicone nella parte anteriore e posteriore del filamento. Strumenti convenienti e un processo facile da seguire rendono possibile per i principianti esercitarsi con il modello MCAO con filamenti artigianali. La ricerca futura potrebbe esplorare miglioramenti nella progettazione dei filamenti, come l'ottimizzazione dei materiali o la regolazione delle dimensioni, per ridurre l'incidenza di complicanze e migliorare la riproducibilità del modello. Inoltre, tenere conto delle differenze anatomiche per ottenere un modello più stabile sarà fondamentale per comprendere meglio i meccanismi e le strategie di trattamento delle malattie cerebrovascolari ischemiche.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Wu Jieping Medical Foundation (320.6750.161290).
Materiali
| Name | Company | Catalog Number | Comments |
| 10 mL Syringe | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 2,3,5-Triphenyltetrazolium Chloride (TTC) | Sigma-Aldrich | G3005 | Dye for TTC staining |
| 24-well culture plate | Corning | CLS3527 | Vessel for TTC staining |
| 26 G syringe needle | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 4% paraformaldehyde | Servicebio | G1101 | Tissue fixation |
| 6-0 nylon suture | Haidike Medical Products Co., Ltd. | Materials for making filaments | |
| Anesthesia system for isoflurane | Rwd Life Science Co., Ltd. | R610 | Anesthetized animal |
| Bipolar electrocoagulation generator | Yirun Medical Instrument Co., Ltd. | ZG300 | Equipment for surgery |
| Constant temperature water bath | Spring Instrument Co., Ltd. | HH-M6 | TTC staining |
| Eye ointment | Guangzhou Pharmaceutical | H44023098 | Material for surgery |
| Heat blanket | ZH Biomedical Instrument Co., Ltd. | Maintain body temperatur | |
| Isoflurane | Rwd Life Science Co., Ltd. | R510-22-10 | Anesthetized animal |
| Meloxicam | Boehringer-Ingelheim | J20160020 | Analgesia for animal |
| Microsurgical artery clamp | Shanghai Jinzhong Surgical Instruments Co., Ltd. | W40130 | Instrument for surgery |
| Microsurgical hemostatic clamp forceps | Shanghai Jinzhong Surgical Instruments Co., Ltd. | M-W-0022 | Instrument for surgery |
| Microsurgical instruments set | Rwd Life Science Co., Ltd. | SP0009-R | Equipment for surgery |
| Mouse thermometer | Hubei Dasjiaer Biotechnology | FT3400 | Intraoperative temperature monitoring |
| Pentobarbital sodium | Sigma-Aldrich | P3761 | Euthanized animal |
| Shaver | Joyu Electrical Appliances | PHC-920 | Equipment for surgery |
| Silicone Sealant | Kafuter | K-704 | Materials for making filaments |
| Stereomicroscope | Rwd Life Science Co., Ltd. | 77001S | Equipment for surgery |
| Suture thread with needle (3-0) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | F404SUS302 | Equipment for surgery |
Riferimenti
- Collaborators GBDS. Global, regional, and national burden of stroke and its risk factors, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet Neurol. 20 (10), 795-820 (2021).
- Kleindorfer, D. O., et al. Guideline for the prevention of stroke in patients with stroke and transient ischemic attack: A guideline from the American Heart Association/American Stroke Association. Stroke. 52 (7), e364-e467 (2021).
- Saini, V., Guada, L., Yavagal, D. R. Global epidemiology of stroke and access to acute ischemic stroke interventions. Neurology. 97 (20 Suppl 2), S6-S16 (2021).
- Hill, M. D., Coutts, S. B. Alteplase in acute ischaemic stroke: The need for speed. Lancet. 384 (9958), 1904-1906 (2014).
- Asif, K. S., et al. Mechanical thrombectomy global access for stroke (mt-glass): A mission thrombectomy (mt-2020 plus) study. Circulation. 147 (16), 1208-1220 (2023).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Des Devel Ther. 9, 3445-3454 (2015).
- Ringelstein, E. B., et al. Type and extent of hemispheric brain infarctions and clinical outcome in early and delayed middle cerebral artery recanalization. Neurology. 42 (2), 289-298 (1992).
- Shaik, N. F., Regan, R. F., Naik, U. P. Platelets as drivers of ischemia/reperfusion injury after stroke. Blood Adv. 5 (5), 1576-1584 (2021).
- Zhang, S. R., et al. Large-scale multivariate analysis to interrogate an animal model of stroke: Novel insights into poststroke pathology. Stroke. 52 (11), 3661-3669 (2021).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, Y., Ito, A., Takai, K., Saito, N. Blocking pterygopalatine arterial blood flow decreases infarct volume variability in a mouse model of intraluminal suture middle cerebral artery occlusion. J Neurosci Methods. 174 (1), 18-24 (2008).
- Yuan, F., et al. Optimizing suture middle cerebral artery occlusion model in c57bl/6 mice circumvents posterior communicating artery dysplasia. J Neurotrauma. 29 (7), 1499-1505 (2012).
- Bieber, M., et al. Validity and reliability of neurological scores in mice exposed to middle cerebral artery occlusion. Stroke. 50 (10), 2875-2882 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), e3564(2012).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Mccoll, B. W., Carswell, H. V., Mcculloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond mca territory after intraluminal filament occlusion in c57bl/6j mice. Brain Res. 997 (1), 15-23 (2004).
- Liu, Z., et al. Optimisation of a mouse model of cerebral ischemia-reperfusion to address issues of survival and model reproducibility and consistency. Comput Intell Neurosci. 2022, 7594969(2022).
- Ward, R., Collins, R. L., Tanguay, G., Miceli, D. A quantitative study of cerebrovascular variation in inbred mice. J Anat. 173, 87-95 (1990).
- Hanna, K. L., Hepworth, L. R., Rowe, F. Screening methods for post-stroke visual impairment: A systematic review. Disabil Rehabil. 39 (25), 2531-2543 (2017).
- Rowe, F. J. Stroke survivors' views and experiences on impact of visual impairment. Brain Behav. 7 (9), e00778(2017).
- Scoles, D., Mcgeehan, B., Vanderbeek, B. L. The association of stroke with central and branch retinal arterial occlusion. Eye (Lond). 36 (4), 835-843 (2022).
- Kim, Y. D., et al. Cerebral magnetic resonance imaging of coincidental infarction and small vessel disease in retinal artery occlusion. Sci Rep. 11 (1), 864(2021).
- Emiroglu, M. Y., et al. Effects of obstructive carotid artery disease on ocular circulation and the safety of carotid artery stenting. Heart Lung Circ. 26 (10), 1069-1078 (2017).
- Cotofana, S., Lachman, N. Arteries of the face and their relevance for minimally invasive facial procedures: An anatomical review. Plast Reconstr Surg. 143 (2), 416-426 (2019).
- Xu, X., et al. Dibazol-induced relaxation of ophthalmic artery in C57bl/6J mice is correlated with the potency to inhibit voltage-gated ca(2+) channels. Exp Eye Res. 231, 109468(2023).
- Justic, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon