Method Article
Filament enduit de silicone fabriqué à la main pour souris Modèles d’occlusion de l’artère cérébrale moyenne
Dans cet article
Résumé
Ce protocole décrit une méthode simple de création de filaments enduits pour le modèle d’occlusion de l’artère cérébrale moyenne (MCAO) chez la souris à l’aide de silicone, de sutures en nylon et d’aiguilles de seringue. Cette méthode permet de produire des filaments d’un diamètre constant et de différentes longueurs d’emballage en silicone adaptées aux besoins expérimentaux.
Résumé
Avec le vieillissement de la population mondiale, l’AVC ischémique est devenu la deuxième cause d’invalidité et de mortalité dans le monde, faisant peser un immense fardeau sur la société et les familles. Bien que des traitements tels que la thrombolyse intraveineuse et les interventions endovasculaires puissent améliorer considérablement les résultats pour les patients ayant subi un AVC ischémique aigu, seul un petit pourcentage de personnes bénéficient de ces thérapies. Pour faire progresser notre compréhension de la maladie et découvrir des traitements plus efficaces, les chercheurs développent et perfectionnent continuellement des modèles animaux. Parmi ceux-ci, le modèle d’occlusion de l’artère cérébrale moyenne (MCAO) se distingue comme le modèle le plus couramment utilisé dans la recherche sur les maladies cérébrovasculaires. Le filament utilisé dans ce modèle est crucial pour son développement. Ce protocole décrit une méthode pour créer des filaments avec des diamètres constants et des longueurs variables de revêtement en silicone. Le modèle MCAO produit à l’aide de cette méthode chez des souris C57 a démontré un succès et une cohérence élevés, offrant un outil précieux pour des investigations sur mesure dans les maladies cérébrovasculaires ischémiques.
Introduction
L’AVC est l’une des causes les plus fréquentes de mortalité et d’invalidité dans le monde. Les accidents vasculaires cérébraux ischémiques et hémorragiques sont les principaux types d’événements cérébrovasculaires, les accidents vasculaires cérébraux ischémiques représentant environ 87 % des cas 1,2,3. À l’heure actuelle, il existe deux modalités de traitement pour les patients victimes d’un AVC ischémique : la thérapie pharmacologique par activateur tissulaire recombinant du plasminogène (rtPA) et la thrombectomie mécanique. Cependant, la fenêtre thérapeutique étroite et les critères d’exclusion étendus limitent l’application de ces traitements, ne bénéficiant qu’à une minorité de patients. Cela souligne la nécessité de poursuivre les efforts pour améliorer les traitements de l’AVC ischémique 4,5. Les modèles in vitro sont inadéquats pour reproduire les réponses physiopathologiques complexes après un AVC, ce qui fait des modèles animaux un élément indispensable de la recherche préclinique sur l’AVC. L’ischémie cérébrale focale humaine est le plus souvent causée par une occlusion thrombotique ou embolique de l’artère cérébrale moyenne (ACM), ce qui rend les modèles de rongeurs conçus pour simuler l’occlusion de l’ACM (MCAO) très pertinents6.
Le modèle MCAO induit par filament, le plus largement adopté dans la recherche sur les accidents vasculaires cérébraux, facilite l’occlusion au début de l’artère cérébrale moyenne (ACM) et la reperfusion ultérieure, entraînant des infarctus étendus dans les zones sous-corticales et corticales du cerveau. L’avantage de ce modèle réside dans sa capacité à rétablir le flux sanguin après avoir induit une ischémie focale, mettant ainsi en parallèle les processus physiopathologiques observés dans l’AVC humain7. De plus, le modèle simule une lésion de reperfusion, un facteur critique dans l’étendue des dommages8. Cependant, le modèle MCAO présente des limites, notamment la variabilité du volume de l’infarctus, l’écart-type pouvant atteindre jusqu’à 64 % de la valeur moyenne dans certaines études9. Malgré plus de trois décennies d’utilisation, des efforts sont en cours pour améliorer la fiabilité du modèle, mais des variations significatives du volume des lésions ischémiques persistent entre les études et les laboratoires 10,11,12.
Cet article présente un filament auto-fabriqué pour induire des modèles évaluant les scores de déficit neurologique et les zones d’infarctus cérébral. Il examine la corrélation entre les longueurs de filament recouvertes de silicone et le succès et la stabilité du modèle MCAO. Cette technique de production produit des filaments avec une cohérence louable, contribuant au développement d’un modèle MCAO relativement stable.
Protocole
Toutes les procédures sur les animaux ont été conformes aux procédures expérimentales et aux normes approuvées par le Comité institutionnel de soin et d’utilisation des animaux de l’Hôpital populaire provincial du Shanxi (numéro d’approbation : Comité provincial d’éthique médicale n° 64 de 2024). Les souris utilisées dans cette expérience étaient des souris mâles C57BL/6, âgées de 8 à 10 semaines et pesant de 24 à 26 g. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans la table des matériaux.
1. Préparation du filament
- Marquage du filament d’origine : Enroulez uniformément la suture en nylon 6-0 autour d’une plaque de règle en plastique. Faites des marques à 5 mm et 10 mm de la tête du filament (y compris le point de repère de revêtement et le point de repère de profondeur d’insertion).
- Coupez verticalement vers le bas à l’aide d’une lame pour vous assurer que les deux extrémités sont parfaitement circulaires, ce qui donne un filament initial de 2 cm de long (figure 1).
- Fabrication du dispositif de revêtement : à l’aide d’une pince hémostatique, cassez la tête de l’aiguille d’une seringue de 26 G, puis polissez le trou de l’aiguille en un cercle parfait avec du papier de verre. Prélevez 2 ml de mastic silicone K-704 à l’aide d’une seringue de 10 mK, puis fixez la tête de l’aiguille à la seringue.
- Enduction du filament : Insérez le filament initial dans le trou de l’aiguille préparé jusqu’à la position marquée de 5 mm ou 10 mm. Poussez lentement et régulièrement la seringue jusqu’à ce que le filament soit entièrement recouvert au stéréomicroscope (Figure 2).
- Réglage du filament enduit : Fixez le filament enduit à la verticale avec du ruban adhésif et attendez environ 20 minutes que le silicone soit complètement pris.
- Stérilisation et emballage : Faites tremper les filaments préparés dans de l’alcool à 75 %, essuyez-les avec un coton-tige, puis emballez-les dans des tubes à centrifuger de 5 ml.
2. Modèle MCAO
REMARQUE : Les outils chirurgicaux ont été stérilisés par autoclave (121 °C à 15 psi pendant 60 min). La table d’opération et d’autres équipements ont été désinfectés avec de l’éthanol à 75 %. Les souris ont été à jeun pendant 8 heures avant l’opération, mais ont laissé un accès libre à l’eau.
- Administrer 5 mg/kg de méloxicam par voie sous-cutanée pour l’analgésie 60 minutes avant la chirurgie. Connectez une couverture chauffante pour maintenir la température corporelle de la souris à 37 °C pendant l’anesthésie.
- Induire une anesthésie avec de l’isoflurane à 4 % jusqu’à ce que les mouvements spontanés et les contractions des moustaches cessent, puis maintenir l’anesthésie à 1,5 % (en suivant les protocoles approuvés par l’établissement). Appliquez une pommade pour les yeux sur les deux yeux.
- Placez la souris en position couchée, fixez sa tête et ses membres, rasez les poils de son cou et de sa poitrine et désinfectez la peau avec de l’éthanol à 75 % de l’intérieur.
- Faites une incision cutanée de 2,5 cm de long le long de la ligne médiane du cou, de la mâchoire inférieure au sternum.
- Disséquez brutalement les muscles droits du cou pour exposer la gaine carotidienne. Utilisez une pince ophtalmique pour ouvrir la gaine et séparer l’artère carotide commune (ACC), l’artère carotide externe (ECA) et l’artère carotide interne (ICA), en prenant soin d’éviter de perturber le nerf vague.
- Ligaturer temporairement l’ACC avec un nœud coulant avant la bifurcation et clamper l’ICA avec une pince artérielle microchirurgicale.
- Cautériser l’artère thyroïdienne supérieure de l’ECA à l’aide d’un stylo de coagulation bipolaire.
- Laissez deux fils sur l’ECA pour la ligature : un sur l’extrémité distale pour la ligature permanente et un autre sur l’extrémité proximale avec un nœud lâche pour une utilisation future. Faites une incision d’environ 0,5 mm entre les deux ligatures sur l’ECA à l’aide de ciseaux ophtalmiques pour insérer le filament.
- Insérez le filament recouvert de silicone de 5 mm ou 10 mm dans le CCA par l’incision, puis fixez-le en serrant le nœud lâche.
- Après avoir coupé l’extrémité distale de l’ECA et retiré la pince de l’ICA, rétractez le filament jusqu’à la bifurcation de l’ECA. Ensuite, retournez et avancez le filament dans l’ICA profond jusqu’à ce que l’on ressente une résistance. Retirez légèrement le filament et fixez-le en resserrant le nœud.
- Suturez la peau de l’animal avec une suture 3-0 et désinfectez la plaie avec de l’iode. Placez la souris dans une chambre de récupération pendant 1 h.
- Anesthésie à nouveau la souris, retire doucement le filament, attache le fil de ligature ECA fixant le filament et relâche le nœud coulant CCA pour rétablir le flux sanguin et reperfuser l’artère cérébrale moyenne.
- Coupez les fils en excès, suturez la peau du cou et désinfectez à nouveau la zone.
3. Opération fictive
- Pour les opérations simulées, insérez un filament recouvert de silicone de 7 mm pour occlure l’artère cérébrale moyenne droite, puis retirez-le immédiatement pour permettre une reperfusion instantanée.
REMARQUE : La procédure ultérieure est identique à celle effectuée sur les animaux subissant une ischémie cérébrale.
4. Neuroscore
- Placez les animaux de laboratoire de chaque groupe dans un champ ouvert et effectuez une évaluation comportementale postopératoire 4 heures après la reperfusion de l’ischémie cérébrale.
- Pour une modélisation réussie, considérez des scores compris entre 1 et 3. Les critères d’évaluation sont basés sur la méthode de notation Longa10, comme détaillé dans le tableau 1.
- Évaluer les déficits neurologiques selon les scores de gravité neurologique modifiés (mNSS)13, avec des évaluations effectuées 24 h et 72 h après la reperfusion (voir tableau 2).
5. Perfusion transcardiaque
- Anesthésier la souris avec du pentobarbital sodique à 1,5 % (en suivant les protocoles approuvés par l’établissement). Remettez la souris dans sa cage et attendez 10 min. Ensuite, pincez les orteils de la souris pour tester l’absence de réflexes et assurer une anesthésie profonde.
- Placez la souris en position couchée sur un support en mousse et fixez ses membres.
- Coupez la pointe d’une aiguille de 25 G pour l’émousser, évitant ainsi la perforation de la paroi aortique. Branchez l’aiguille à une seringue remplie de 20 ml de solution saline.
- Soulevez la fourrure du thorax et utilisez des ciseaux pour couper la peau afin d’exposer le processus xiphoïde. Saisissez le processus xiphoïde et coupez horizontalement en dessous pour exposer le diaphragme en ouvrant la couche musculaire. Coupez soigneusement le diaphragme avec des ciseaux, en évitant d’endommager le cœur.
- Coupez le long de la face externe du sternum pour ouvrir la cage thoracique des deux côtés, retournez la paroi antérieure du thorax et fixez-la avec des hémostats.
- Utilisez un coton-tige pour enlever la graisse à la base du cœur, exposant la racine de l’aorte.
- Fixez le cœur à l’aide d’une pince, insérez l’aiguille à l’apex du cœur et avancez obliquement vers le haut jusqu’à ce que l’aiguille soit visible à travers la paroi aortique. Fixez l’aiguille en place.
- Faites une petite incision dans l’oreillette droite pour observer la circulation sanguine. Perfuser régulièrement la solution saline avec la seringue, en surveillant si le sang sort de l’oreillette droite. Une fois que l’effluent est dégagé, arrêter la perfusion14.
- Après la perfusion, décapitez la souris pour récolter le cerveau15 et placez-la dans un congélateur à -20 °C pour un traitement ultérieur.
6. Évaluation du volume de l’infarctus par coloration TTC
- Congelez rapidement les tissus cérébraux obtenus dans un congélateur à -20 °C pendant 20 min, puis placez-les sur un moule à trancher le cerveau pré-refroidi et coupez-les en tranches de 1 mm d’épaisseur.
- Immerger les sections de cerveau obtenues dans une solution à 2 % de TTC et incuber à 37 °C pendant 20 min.
- Immergez les tranches de cerveau dans du paraformaldéhyde à 4 % pendant la nuit et prenez des photos le lendemain.
- Mesurez la zone infarctus de chaque tranche et la surface totale du cerveau à l’aide d’ImageJ. Calculez le rapport de volume de l’infarctus à l’aide de la formule : % de volume de l’infarctus = (Somme des zones infarctus / Somme des aires cérébrales totales) × 100 %.
Résultats
Dans la création du modèle MCAO, les principaux outils utilisés pour la fabrication des filaments et les filaments finis sont illustrés à la figure 3. Après la production du filament, le modèle MCAO est établi en insérant le filament dans l’artère carotide externe, la durée de l’opération étant enregistrée. Une modélisation réussie est définie par un score Longa de 1-3 4 h après le retrait du filament. Le poids corporel est surveillé quotidiennement après l’opération. Les déficits neurologiques sont évalués à l’aide de scores de gravité neurologique modifiés (mNSS) 24 h et 72 h après l’opération. Les lésions ischémiques sont évaluées par coloration TTC.
Dans le groupe des filaments de 10 mm, cinq souris sur dix ont présenté une hémorragie sous-arachnoïdienne (HSA), dont deux ont été mortelles. Par conséquent, les cinq souris affectées ont été exclues de l’étude. En revanche, aucune des souris du groupe des filaments de 5 mm n’a présenté de HSA. Le taux de réussite de la modélisation était de 100 % dans le groupe des filaments de 5 mm, ce qui est significativement plus élevé que le taux de réussite de 50 % observé dans le groupe des filaments de 10 mm.
Le temps chirurgical, défini comme la durée entre l’incision cutanée et l’insertion du filament, était significativement plus court dans le groupe des filaments de 5 mm que dans le groupe des filaments de 10 mm (614 s ± 49,15 s contre 758 s ± 65,63 s, P < 0,01) (figure 4A). Les deux groupes de filaments ont montré une réduction significative du poids corporel postopératoire par rapport au groupe d’opération simulée ; cependant, aucune différence significative n’a été observée entre les deux tailles de filaments (figure 4B).
La coloration TTC a confirmé l’infarctus cérébral dans le modèle MCAO induit par filament (Figure 5). Trois jours après l’opération, le volume de l’infarctus était de 21,48 % ± 6,79 % pour le groupe de 5 mm et de 19,85 % ± 7,01 % pour le groupe de 10 mm, sans différence statistique significative entre les deux groupes en ce qui concerne la taille de l’infarctus. Dans chaque groupe de souris, il y avait une variabilité dans la zone d’infarctus cérébral, trois souris sur cinq présentant une zone d’infarctus plus grande (figures 5B, C) et deux montrant une zone d’infarctus plus petite (figure 5E, F). La quantification du volume de l’infarctus est illustrée à la figure 5G.
Les déficits de la fonction neurologique ont été évalués par les scores mNSS aux jours 1 et 3 après l’ACCA, comme le montre la figure 6. Au cours des deux journées, les groupes de 5 mm et de 10 mm ont présenté des scores mNSS significativement plus élevés que le groupe d’opération simulée, et aucune différence significative n’a été observée entre les scores mNSS des groupes de 5 mm et de 10 mm.

Figure 1 : Construction et marquage du filament. (A) Enrouler uniformément la suture en nylon 6-0 autour d’une plaque de règle en plastique. (B) Étiqueter et trancher verticalement la plaie pour créer un filament de 2 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
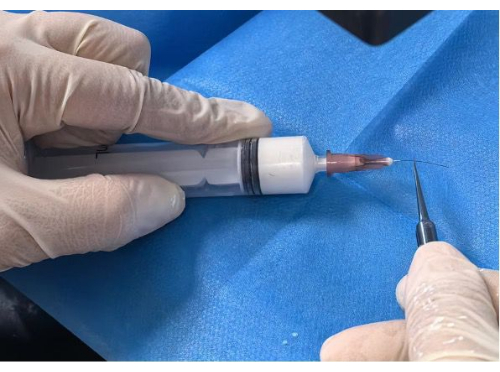
Figure 2 : Revêtement du filament. Veuillez cliquer ici pour voir une version agrandie de cette figure.
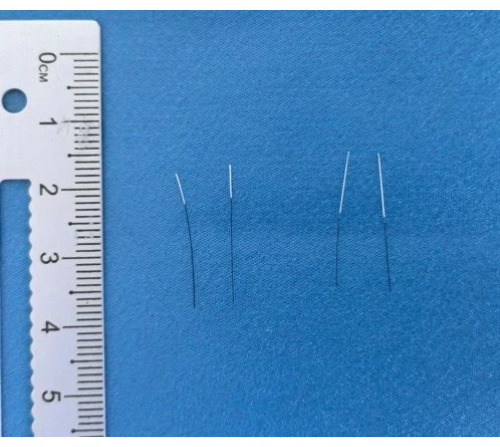
Figure 3 : Filaments finis. Images des filaments terminés après revêtement et marquage. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Durée de l’intervention chirurgicale et poids corporel de la souris. (A) Durée de l’opération. (B) Poids corporel de la souris mesuré avant l’opération et trois jours après l’opération. Les différences statistiques ont été analysées à l’aide de l’ANOVA et du test post hoc de Tukey. Les données sont présentées sous forme de moyenne ± SEM, n = 5, **P < 0,01. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Coupes de cerveau colorées par la TTC. Coupes cérébrales représentatives marquées par la TTC montrant des zones de tissus sains (rouge) et de lésions ischémiques (blanc) pour les groupes Sham (A, D), MCAO 5 mm (B, E) et MCAO 10 mm (C, F). Trois souris sur cinq présentent une zone d’infarctus plus grande (B, C) et deux présentent une zone d’infarctus plus petite (E, F). (G) Quantification du volume de l’infarctus. Les différences statistiques ont été analysées à l’aide de l’ANOVA et du test post hoc de Tukey. Les données sont présentées sous forme de moyenne ± MEB, n = 5, **P < 0,01. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Scores neurologiques post-MCAO. Scores neurologiques enregistrés le 1eret le 3e jour post-MCAO. Les différences statistiques ont été analysées à l’aide de l’ANOVA et du test post hoc de Tukey. Les données sont présentées sous forme de moyenne ± SEM, n = 5, ****P < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Blanchiment des pupilles après l’insertion du filament. Blanchiment de la pupille observé après insertion du filament de silicone de 10 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| 0 point | Aucun symptôme de lésions neurologiques | |
| 1 point | Incapacité à étendre complètement le membre antérieur controlatéral | |
| 2 points | Tourner vers le côté controlatéral en marchant | |
| 3 points | Se pencher sur le côté controlatéral en marchant | |
| 4 points | Incapacité à marcher spontanément, perte de conscience | |
Tableau 1 : Notation Longa pour la réussite du modèle. Système de notation Longa utilisé pour déterminer le succès du modèle.
| Tests | Aiguillage | ||
| Élever la souris par la queue | 3 | ||
| Flexion du membre antérieur | 1 | ||
| Flexion des membres postérieurs | 1 | ||
| La tête s’est déplacée de >10° par rapport à l’axe vertical en 30 s | 1 | ||
| Souris marchant sur le sol | 3 | ||
| Marche normale | 0 | ||
| Incapacité à marcher droit | 1 | ||
| Cercle vers le côté parétique | 2 | ||
| Tomber sur le côté parétique | 3 | ||
| Test d’équilibre du faisceau | 6 | ||
| Équilibre avec une posture stable | 0 | ||
| Poignées côté poutre | 1 | ||
| Épouse la poutre et 1 membre tombe de la poutre | 2 | ||
| Étreint la poutre et 2 membres tombent de la poutre, ou tourne sur la poutre [>30 s] | 3 | ||
| Tente de s’équilibrer sur la poutre mais tombe [>20 s] | 4 | ||
| Tente de se tenir en équilibre sur la poutre mais tombe [>10 s] | 5 | ||
| Tombe, aucune tentative d’équilibre ou de s’accrocher à la poutre [<10 s] | 6 | ||
| Absence de réflexes | 2 | ||
| Réflexe du pavillon de l’oreille (la tête secoue en touchant le méat auditif) | 1 | ||
| Réflexe cornéen (clignement des yeux lorsque l’on touche légèrement la cornée avec du coton) | 1 | ||
Tableau 2 : Scores de gravité neurologique modifiés (mNSS). Scores de gravité neurologique modifiés (mNSS) utilisés pour évaluer la gravité neurologique.
Discussion
Cette étude démontre une méthode simple et rentable pour fabriquer du filament, confirmant sa faisabilité dans la création d’un modèle MCAO. La longueur de la couche de silicone du filament peut être ajustée en fonction des besoins expérimentaux, offrant ainsi une flexibilité supplémentaire. La préparation d’une embolie filamentaire de 5 mm a permis d’obtenir un taux de réussite de 100 % sans aucune apparition d’hémorragie sous-arachnoïdienne (HSA) chez la souris. Dans le groupe utilisant des emboles de filament de 10 mm, il y avait des cas de SAH, tandis que le reste des souris présentait un infarctus clair dans la région MCA. Une étape critique pour réduire l’HSA consistait à rétracter légèrement le filament lorsqu’il rencontrait une résistance pendant la procédure. Dans l’expérience préliminaire, près de la moitié des souris sans cet ajustement ont présenté une HSA lorsqu’un filament de silicone enduit de 5 mm a été utilisé. Le filament a rencontré une résistance en atteignant l’artère cérébrale antérieure12 de la souris. Par conséquent, tout léger changement dans la position de la souris avant de retirer le filament peut rompre le vaisseau sanguin. La légère rétraction du filament peut bloquer efficacement l’origine du MCA tout en empêchant la pointe du filament de pénétrer dans l’ACA et de provoquer une HSA.
Lors de l’utilisation de filaments de 10 mm, une incidence plus élevée de SAH a été observée, ce qui pourrait être attribué à la flexibilité réduite du filament en raison de l’augmentation de la longueur du revêtement en silicone. Cette rigidité peut amener le filament à percer les vaisseaux lorsqu’il rencontre une résistance lors de l’insertion. De plus, la durée de l’intervention chirurgicale était plus longue pour le groupe de 10 mm, ce qui correspond à la difficulté accrue de manipuler des filaments plus longs recouverts de silicone, ce qui a entraîné des durées d’opération prolongées. Cela indique que des longueurs de filament recouvertes de silicone plus courtes peuvent non seulement assurer un taux élevé de réussite de la modélisation, mais également réduire la complexité chirurgicale et l’apparition de complications postopératoires.
La découverte que l’utilisation de filaments recouverts de silicone de 5 mm et 10 mm chez les souris modèles MCAO ne montre pas de différences significatives dans les zones d’infarctus cérébral et les scores comportementaux suggère que, dans certaines conditions, la longueur du revêtement de silicone sur le filament peut avoir un impact minimal sur les résultats expérimentaux. Cependant, au sein de chaque groupe, il y avait des différences notables dans les zones d’infarctus cérébral. Dans le groupe de 5 mm, trois souris sur cinq présentaient des zones d’infarctus plus grandes, y compris des régions telles que le thalamus, l’hypothalamus et l’hippocampe, tandis que d’autres avaient des zones d’infarctus plus petites. La distribution des tailles d’infarctus dans le groupe de 10 mm était similaire à celle du groupe de 5 mm, ce qui peut être lié à la variabilité anatomique du système vasculaire cérébral des souris15,16. Un facteur contributif connu est la variation de la perméabilité de l’artère communicante postérieure (PcomA)16. Les PcomAs sont les principales artères collatérales suivant la MCAO induite par le filament, alimentant des zones comme l’hippocampe et le thalamus17. Cependant, environ 90 % des souris C57BL/6 présentent un PcomAs17 sous-développé ou absent, et la proportion de souris ayant des zones d’infarctus plus grandes dans chaque groupe est proche de ce pourcentage. Les souris atteintes de PcomA sous-développé ou absent, en plus de l’ACM, ont également une obstruction de l’approvisionnement en sang de l’artère cérébrale postérieure (APC) dans le modèle MCAO, ce qui entraîne des zones d’infarctus plus grandes12. Une étude a utilisé des filaments recouverts de silicone plus courts (2 mm) pour éviter d’obstruer l’approvisionnement en sang de l’ACP, mais cela a considérablement réduit le taux de réussite du modèle18. Des variations de la distance anatomique entre le MCA et le PCA à la jonction formant le cercle de Willis ont été observées entre différentes souches de souris et différentes catégories de poids19. Par conséquent, pour assurer le succès de la modélisation et la stabilité de la taille de l’infarctus au sein des cohortes, il est essentiel de préparer des filaments recouverts de silicone de longueurs adaptées aux variations anatomiques spécifiques de la vascularisation cérébrale des souris à travers différentes souches et poids corporels. La méthode de production de filaments décrite dans cet article facilite ces recherches.
Environ 65 % des accidents vasculaires cérébraux ischémiques s’accompagnent d’une perte de vision temporaire ou permanente, généralement attribuée à une affection du rayonnement optique ou du cortex visuel20,21. Cependant, les patients victimes d’un AVC présentent également un risque plus élevé d’ischémie rétinienne aiguë22,23. À l’heure actuelle, il n’existe pas de modèles animaux expérimentaux clairs d’AVC ischémique incluant l’ischémie rétinienne. Chez les souris utilisant des filaments de 10 mm, trois souris ont présenté un blanchiment ipsilatéral de la pupille après l’insertion du filament, qui s’est résolu environ 5 minutes après le retrait du filament (Figure 7). Ce phénomène indique une occlusion de l’artère ophtalmique après l’insertion du filament, mais cela n’a pas été observé chez les souris avec des filaments de 5 mm. À l’heure actuelle, il n’existe pas de consensus sur l’origine de l’artère ophtalmique chez les animaux de laboratoire. Certaines études suggèrent que, comme chez l’homme, l’artère ophtalmique (OA) chez les souris C57BL/6J provient de l’artère carotide interne 24,25,26. D’autres recherches postulent que, comme chez les rats, l’arthrose de souris provient de l’artère ptérygo-palatine (PPA)27. Par conséquent, compte tenu de la variabilité de l’origine de l’OA de la souris, le blanchiment de la pupille observé chez certaines souris du groupe de 10 mm pourrait être dû à cette variabilité. Chez ces souris, les artères ophtalmiques provenant de l’APP subissent un apport sanguin insuffisant en raison de l’occlusion au début de l’artère par le filament recouvert de silicone de 10 mm lors de l’insertion, ce qui entraîne un blanchiment de la pupille. Aucun phénomène de ce type ne s’est produit dans le groupe de 5 mm, probablement parce que la longueur plus courte du silicone était insuffisante pour bloquer le PPA.
Bien que cette étude fournisse une méthode efficace pour la production de filaments et valide son efficacité expérimentalement, en proposant une stratégie pour la préparation individualisée des filaments, elle présente également certaines limites. Le revêtement en silicone sur les filaments fabriqués à la main n’est pas appliqué uniformément, ce qui donne une forme cylindrique irrégulière. Pendant le processus de fabrication, la seringue doit fonctionner à une vitesse constante pour éviter les incohérences dans le revêtement en silicone à l’avant et à l’arrière du filament. Des outils abordables et un processus facile à suivre permettent aux débutants de pratiquer le modèle MCAO avec des filaments artisanaux. Des recherches futures pourraient explorer des améliorations dans la conception des filaments, telles que l’optimisation des matériaux ou l’ajustement des dimensions, afin de réduire l’incidence des complications et d’améliorer la reproductibilité du modèle. De plus, la prise en compte des différences anatomiques pour obtenir un modèle plus stable sera cruciale pour mieux comprendre les mécanismes et les stratégies de traitement des maladies cérébrovasculaires ischémiques.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Ce travail a été soutenu par la Fondation médicale Wu Jieping (320.6750.161290).
matériels
| Name | Company | Catalog Number | Comments |
| 10 mL Syringe | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 2,3,5-Triphenyltetrazolium Chloride (TTC) | Sigma-Aldrich | G3005 | Dye for TTC staining |
| 24-well culture plate | Corning | CLS3527 | Vessel for TTC staining |
| 26 G syringe needle | Haidike Medical Products Co., Ltd. | Instrument for making filaments | |
| 4% paraformaldehyde | Servicebio | G1101 | Tissue fixation |
| 6-0 nylon suture | Haidike Medical Products Co., Ltd. | Materials for making filaments | |
| Anesthesia system for isoflurane | Rwd Life Science Co., Ltd. | R610 | Anesthetized animal |
| Bipolar electrocoagulation generator | Yirun Medical Instrument Co., Ltd. | ZG300 | Equipment for surgery |
| Constant temperature water bath | Spring Instrument Co., Ltd. | HH-M6 | TTC staining |
| Eye ointment | Guangzhou Pharmaceutical | H44023098 | Material for surgery |
| Heat blanket | ZH Biomedical Instrument Co., Ltd. | Maintain body temperatur | |
| Isoflurane | Rwd Life Science Co., Ltd. | R510-22-10 | Anesthetized animal |
| Meloxicam | Boehringer-Ingelheim | J20160020 | Analgesia for animal |
| Microsurgical artery clamp | Shanghai Jinzhong Surgical Instruments Co., Ltd. | W40130 | Instrument for surgery |
| Microsurgical hemostatic clamp forceps | Shanghai Jinzhong Surgical Instruments Co., Ltd. | M-W-0022 | Instrument for surgery |
| Microsurgical instruments set | Rwd Life Science Co., Ltd. | SP0009-R | Equipment for surgery |
| Mouse thermometer | Hubei Dasjiaer Biotechnology | FT3400 | Intraoperative temperature monitoring |
| Pentobarbital sodium | Sigma-Aldrich | P3761 | Euthanized animal |
| Shaver | Joyu Electrical Appliances | PHC-920 | Equipment for surgery |
| Silicone Sealant | Kafuter | K-704 | Materials for making filaments |
| Stereomicroscope | Rwd Life Science Co., Ltd. | 77001S | Equipment for surgery |
| Suture thread with needle (3-0) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | F404SUS302 | Equipment for surgery |
Références
- Collaborators GBDS. Global, regional, and national burden of stroke and its risk factors, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet Neurol. 20 (10), 795-820 (2021).
- Kleindorfer, D. O., et al. Guideline for the prevention of stroke in patients with stroke and transient ischemic attack: A guideline from the American Heart Association/American Stroke Association. Stroke. 52 (7), e364-e467 (2021).
- Saini, V., Guada, L., Yavagal, D. R. Global epidemiology of stroke and access to acute ischemic stroke interventions. Neurology. 97 (20 Suppl 2), S6-S16 (2021).
- Hill, M. D., Coutts, S. B. Alteplase in acute ischaemic stroke: The need for speed. Lancet. 384 (9958), 1904-1906 (2014).
- Asif, K. S., et al. Mechanical thrombectomy global access for stroke (mt-glass): A mission thrombectomy (mt-2020 plus) study. Circulation. 147 (16), 1208-1220 (2023).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Des Devel Ther. 9, 3445-3454 (2015).
- Ringelstein, E. B., et al. Type and extent of hemispheric brain infarctions and clinical outcome in early and delayed middle cerebral artery recanalization. Neurology. 42 (2), 289-298 (1992).
- Shaik, N. F., Regan, R. F., Naik, U. P. Platelets as drivers of ischemia/reperfusion injury after stroke. Blood Adv. 5 (5), 1576-1584 (2021).
- Zhang, S. R., et al. Large-scale multivariate analysis to interrogate an animal model of stroke: Novel insights into poststroke pathology. Stroke. 52 (11), 3661-3669 (2021).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, Y., Ito, A., Takai, K., Saito, N. Blocking pterygopalatine arterial blood flow decreases infarct volume variability in a mouse model of intraluminal suture middle cerebral artery occlusion. J Neurosci Methods. 174 (1), 18-24 (2008).
- Yuan, F., et al. Optimizing suture middle cerebral artery occlusion model in c57bl/6 mice circumvents posterior communicating artery dysplasia. J Neurotrauma. 29 (7), 1499-1505 (2012).
- Bieber, M., et al. Validity and reliability of neurological scores in mice exposed to middle cerebral artery occlusion. Stroke. 50 (10), 2875-2882 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), e3564 (2012).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Mccoll, B. W., Carswell, H. V., Mcculloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond mca territory after intraluminal filament occlusion in c57bl/6j mice. Brain Res. 997 (1), 15-23 (2004).
- Liu, Z., et al. Optimisation of a mouse model of cerebral ischemia-reperfusion to address issues of survival and model reproducibility and consistency. Comput Intell Neurosci. 2022, 7594969 (2022).
- Ward, R., Collins, R. L., Tanguay, G., Miceli, D. A quantitative study of cerebrovascular variation in inbred mice. J Anat. 173, 87-95 (1990).
- Hanna, K. L., Hepworth, L. R., Rowe, F. Screening methods for post-stroke visual impairment: A systematic review. Disabil Rehabil. 39 (25), 2531-2543 (2017).
- Rowe, F. J. Stroke survivors' views and experiences on impact of visual impairment. Brain Behav. 7 (9), e00778 (2017).
- Scoles, D., Mcgeehan, B., Vanderbeek, B. L. The association of stroke with central and branch retinal arterial occlusion. Eye (Lond). 36 (4), 835-843 (2022).
- Kim, Y. D., et al. Cerebral magnetic resonance imaging of coincidental infarction and small vessel disease in retinal artery occlusion. Sci Rep. 11 (1), 864 (2021).
- Emiroglu, M. Y., et al. Effects of obstructive carotid artery disease on ocular circulation and the safety of carotid artery stenting. Heart Lung Circ. 26 (10), 1069-1078 (2017).
- Cotofana, S., Lachman, N. Arteries of the face and their relevance for minimally invasive facial procedures: An anatomical review. Plast Reconstr Surg. 143 (2), 416-426 (2019).
- Xu, X., et al. Dibazol-induced relaxation of ophthalmic artery in C57bl/6J mice is correlated with the potency to inhibit voltage-gated ca(2+) channels. Exp Eye Res. 231, 109468 (2023).
- Justic, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon