Method Article
Создание модели травмы лицевого нерва на крысе для исследований идиопатического паралича лицевого нерва
В этой статье
Резюме
В настоящем протоколе создана модель крысы с повреждением лицевого нерва с использованием микроскопии для исследования диагностических и терапевтических механизмов идиопатического паралича лицевого нерва.
Аннотация
Идиопатический паралич лицевого нерва является наиболее распространенным типом повреждения лицевого нерва, на долю которого приходится примерно 70% случаев периферического паралича лицевого нерва. Это заболевание может не только привести к изменению выражения лица, но и сильно повлиять на психологию пациентов. В тяжелых случаях это может повлиять на нормальную работу и жизнь пациентов. Таким образом, исследования по восстановлению повреждений лицевого нерва имеют важное клиническое значение. Для того чтобы изучить механизм возникновения этого заболевания, необходимо провести соответствующие эксперименты на животных, среди которых важнейшей задачей является установление животной модели с таким же патогенезом, как у человека. Сдавливание лицевого нерва в каменистой кости, особенно нервного ствола на стыке дистального конца внутреннего слухового прохода и лабиринтного сегмента, является патогенезом идиопатического паралича лицевого нерва. Для того, чтобы смоделировать это распространенное заболевание, в данном исследовании была создана модель компрессионной травмы основного экстракраниального сегмента лицевого нерва. Неврологические повреждения оценивали с помощью поведенческого, нейроэлектрофизиологического и гистологического исследования. Наконец, постоянная сила 50 g и травма зажимом 90 с были выбраны в качестве параметров травмы для построения стабильной модели идиопатического паралича лицевого нерва.
Введение
Идиопатический паралич лицевого нерва характерен как разновидность периферического паралича лицевого нерва неясной этиологии, острого начала и самоограничивающегося течения 1,2. Этиология и патогенез идиопатического паралича лицевого нерва до сих пор неясны3. В настоящее время существуют различные методы лечения паралича лицевого нерва4, и разнообразие методов лечения отражает отсутствие оптимальных вариантов лечения. Использование методов клеточной и молекулярной биологии для изучения механизма повреждения лицевого нерва является основой для создания эффективных методов лечения паралича лицевого нерва. Поэтому особенно важна подходящая и стабильная модель повреждения лицевого нерва.
В настоящее время не существует стандартного метода для создания модели повреждения лицевого нерва. В настоящее время к методам подготовки относятся инокуляция вируса5, транссекция6, холодная стимуляция7 и компрессия8. Считается, что вирусная инфекция, нейротрофобластический вазоспазм, аутоиммунное воспаление и т.д. могут вызывать местную ишемию, дегенерацию и отек лицевого нерва 9,10,11. Более того, все вышеперечисленные факторы могут вызвать сдавливание основного ствола лицевого нерва в узком костном канале лицевого нерва12,13. Кроме того, наиболее распространенными повреждениями периферических нервов, выявленными во время хирургических процедур, были компрессия и контузия14. Основываясь на вышеизложенных теориях и клинических явлениях, мы считаем, что подготовка модели повреждения лицевого нерва через компрессионную травму является более целесообразной. Однако большинство современных методов реализации компрессионных травм не дают количественных параметров силы и времени. В этом исследовании мы количественно оценили силу и продолжительность компрессионной травмы для улучшения воспроизводимости созданной модели.
протокол
Все эксперименты на животных были одобрены и контролировались Комитетом по этике животных больницы Синьхуа при Медицинской школе Шанхайского университета Цзяотун (XHEC-F-2023-061). Для настоящего исследования использовались самцы крыс Sprague-Dawley, 200-300 г. Животные были получены из коммерческого источника (см. Таблицу материалов). Крысы были случайным образом разделены на четыре группы (n = 10): группа фиктивной хирургии, группа 30-й травмы, группа 60-й травмы и группа 90-й травмы.
1. Индукция анестезии и подготовка животных
- Носите следующие средства индивидуальной защиты (СИЗ): хирургическая маска, хирургические перчатки, одноразовый халат.
- Утяжеляют крыс и обезболивают их кетамина гидрохлоридом в дозе 50 мг/кг путем внутрибрюшинного (в/в) введения. Назначают мелоксикам (5 мг/кг; внутримышечно) для периоперационной анальгезии. Подтвердите глубину анестезии с помощью зажима пальца ноги.
- Нанесите офтальмологическую мазь на оба глаза, чтобы предотвратить высыхание.
- После анестезии поместите крыс в положение лежа и зафиксируйте голову так, чтобы левая сторона лица была вверх. Сбрейте волосы за левым ухом и продезинфицируйте кожу. Накройте крысу стерильной хирургической простыней.
2. Создание модели локальной травмы раздавливания экстракраниального ствола лицевого нерва
ПРИМЕЧАНИЕ: Стерилизуйте все оборудование перед использованием. Все операции проводились в операционной.
- Сделайте продольный разрез длиной 2 см за левым ухом и рассеките кожу и подкожную клетчатку, чтобы отделить естественный зазор между лицевыми и шейными мышцами.
- С помощью микропинцета и микроножниц полностью диссоциируйте ствол лицевого нерва между шиломастоидным отверстием и околоушной железой, с открытой длиной около 1 см.
- Используйте щипцы для количественного повреждения периферических нервов (Таблица материалов) для зажима ствола лицевого нерва и причинения травмы. Место повреждения расположите на расстоянии 0,5 см от шиломастоидного отверстия. Применяйте интенсивность травмы 50 g и время травмы 30 с, 60 с и 90 с соответственно.
- Сшивайте подкожную клетчатку и кожу шелковой нитью. Продезинфицируйте разрез.
- У крыс в контрольной группе симуляционной хирургии разрезают кожу и подкожную клетчатку после анестезии, а также обнажают и отделяют соответствующий главный ствол лицевого нерва. Далее сразу же зашивается разрез.
- Следите за здоровьем животного, поддерживайте лежачее положение грудины, содержите его в теплых условиях.
- Переместите крысу обратно в клетку после того, как крыса придет в сознание.
3. Поведенческое тестирование
Примечание: Функция лицевого нерва крыс оценивалась до операции и через 48 ч после операции (Рисунок 1). Баллы по рефлексу моргания, пальп-движению и положению кончика носа были рассчитаны15. Чем выше общий балл, тем тяжелее степень повреждения лицевого нерва (табл. 1).
- Мигающий рефлекс (BR):
- Прикрепите иглу 18 г к шприцу объемом 2 мл и вдуйте воздух в глаз крысы с расстояния 2 см. Наблюдайте за движением век и их закрытием.
- Оценка по следующим критериям: Без существенной разницы с обеих сторон: 0 баллов; Позднее закрытие пораженной стороны по сравнению со здоровой: 1 балл; Невозможность закрыть пораженное веко: 2 балла.
- Вибриссы (ВМ):
- Подсчитайте двусторонние движения щупалец крыс в течение 30 с.
- Оценка по следующим критериям: Нет существенной разницы в двустороннем движении щупалец: 0 баллов; Движение усов пораженной стороны слабее, чем у здоровой: на 1 балл; Потеря движения усов на пораженной стороне: 2 балла.
- Положение кончика носа.
- Центральный кончик носа: 0 баллов; Наклон кончика носа в здоровую сторону: 1 балл.
ПРИМЕЧАНИЕ: Общая оценка 0 баллов указывает на норму, 1-2 балла указывает на легкий паралич лицевого нерва (парез), 3-4 балла указывает на явный паралич лицевого нерва (парез), а 5 баллов указывает на полный паралич лицевого нерва15.
- Центральный кончик носа: 0 баллов; Наклон кончика носа в здоровую сторону: 1 балл.
4. Нейроэлектрофизиологическое обнаружение
ПРИМЕЧАНИЕ: Лицевая электрография (ЭНог) проводилась до травмы, сразу после операции и через 48 ч после операции (Рисунок 2, Таблица 2, Таблица 3 и Таблица 4).
- Поместите заземляющий электрод под кожу левой нижней конечности.
- Введите записывающий электрод (биполярный концентрический игольчатый электрод) в поврежденную сторону мышцы-щупальца, с глубиной проникновения 5 мм.
- Поместите электрод для стимуляции (концентрический игольчатый электрод) на мембрану лицевого нерва. Стимулируйте проксимальный и дистальный концы поврежденного лицевого нерва отдельно.
- Используйте прямоугольный импульсный ток с частотой 1 Гц, шириной волны 0,1 мс и диапазоном фильтрации 10-3000 Гц.
- Используйте стимулы 2 мА, 5 мА, 10 мА, 15 мА и 20 мА, чтобы вызвать генерацию сложного потенциала мышечного действия.
- Запишите задержку (Lm) и пиковую амплитуду (Am) M-волны.
ПРИМЕЧАНИЕ: М-волна относится к первой и наиболее очевидной зарегистрированной форме волны. Точка, в которой осциллограмма выходит за пределы базовой линии, является начальной точкой осциллограммы. Расстояние от начальной точки базовой линии до начальной точки формы сигнала равно Lm. Расстояние между самым высоким и самым низким пиками формы волны равно Am. - Делайте 5-минутный интервал между каждой стимуляцией, чтобы обеспечить восстановление нервов.
5. Гистологическое исследование
- После завершения электрофизиологических тестов используйте микропинцет для подъема нерва и микроножницы для разрезания образца нерва. Образец включает в себя ствол лицевого нерва от места повреждения до околоушной железы, которая представляет собой нервное волокно на дистальном конце места повреждения, общей длиной около 0,5 см.
- Зафиксируйте образец нерва в 4% параформальдегиде на 24 ч и приготовьте срезы, содержащие парафин16.
- Окрашивайте срезы методом окрашивания гематоксилин-эозином (H&E)16 и получайте изображения с 100-кратным и 400-кратным увеличением с помощью оптического фотографического микроскопа (рис. 3).
Примечание: После удаления образца нерва и наложения швов на кожу под анестезией, крыс усыпляли пентобарбиталом натрия (150 мг/кг; внутримышечно).
Результаты
Поведенческое тестирование
До операции показатели мигательного рефлекса, пальп-движений и положения кончика носа составляли 0 баллов у всех экспериментальных крыс, что указывает на то, что у всех крыс функция лицевого нерва не повреждена. При оценке функции лицевого нерва через 48 ч после операции было обнаружено, что индивидуальные баллы крыс в каждой группе травмы были увеличены. Более того, общая оценка увеличивалась постепенно с увеличением времени повреждения лицевого нерва (табл. 1).
Записи о лицевой активности крыс в каждой группе через 48 ч после операции показали, что симметрия лица постепенно исчезала с увеличением времени травмы. В группе травм 30-х годов лица крыс были в основном симметричными. В группах травм 60-х и 90-х годов кончик носа крыс сместился в сторону здоровой стороны (правой стороны). Этот феномен был более выражен в группе травм 90-х годов, чем в других группах (рис. 1).
Нейроэлектрофизиологическое обнаружение
Перед операцией электрофизиологические тесты показали, что стимуляция сосцевидного отверстия лицевого нерва может стабильно генерировать М-волны (рис. 2A, D, G). Сразу после операции при стимуляции проксимального конца места повреждения в группе 30-х травм регистрировались М-волны, но как Lm, так и Am удлинялись и снижались. В группах травм 60-х и 90-х годов М-волн не зарегистрировано. При стимуляции дистальной части места повреждения М-зубцы могли стабильно регистрироваться во всех трех группах повреждений, а форма волны, Lm и Am соответствовала таковой до операции (рис. 2B, E, H). Через 48 ч после операции наблюдались значительные различия между группами травмы (рис. 2C, F, I). В группе 30-х травм М-волны регистрировались как при проксимальной, так и при дистальной стимуляции. Более того, статистически значимой разницы в ЛМ до и после операции не было (см. табл. 2). В группе травмы 60-х годов М-волны при проксимальной стимуляции не регистрировались. При дистальной стимуляции у 70% крыс не регистрировались М-волны. Значительно ослабленный потенциал действия сложных мышц (CMAP) был зарегистрирован у 30% крыс. Lm и Am значительно удлинялись и снижались соответственно (см. табл. 3). В группе травм 90-х годов ни проксимальная, ни дистальная стимуляция не показали ЦМАП (см. табл. 4).
Патологоанатомическое обследование
Окрашивание H&E показало, что в группе фиктивной хирургии не было повреждений образца лицевого нерва, а морфология лицевого нерва была полной. В группе 30-х травм не наблюдалось значительного аксонального коллапса или демиелинизации дистального нерва в месте повреждения, а морфология аксонов и миелиновых оболочек была сходна с таковой в контрольной группе. Глубоко окрашенные ядра были по-прежнему равномерно распределены, и значительного увеличения их числа не наблюдалось. Как в 60-х, так и в 90-х группах травмы наблюдались изменения аксонального коллапса и демиелинизации в дистальных отделах нервов в месте повреждения с видимым отеком нервных волокон и нормальным прерыванием аксонов и миелиновых оболочек. Под мощным микроскопом (400x) было замечено, что количество глубоко окрашенных ядер в образце значительно увеличилось, а также появилось большое количество круглых ядер, которые считались инфильтрирующими макрофагами. Исходное уплощенное ядро шванновской клетки также значительно увеличилось. Указанные патологические изменения были более выражены в группе травм 90-х годов, чем в группе травм 60-х годов (рис. 3).
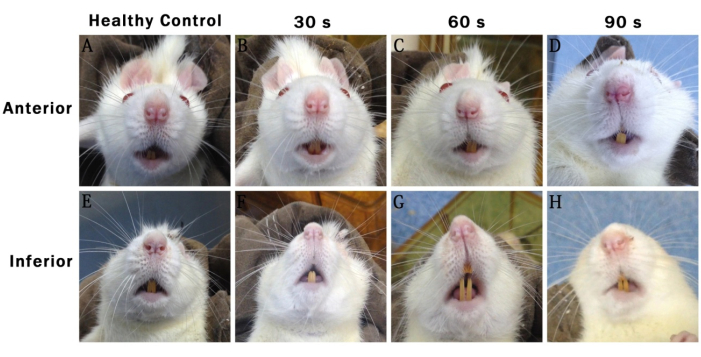
Рисунок 1: Репрезентативные фотографии, сделанные через 48 часов после операции, показывающие черты лица различных групп крыс. (A-D) Передние: показывает переднюю часть. (E-H) Нижние: показывает нижнюю часть. Здоровый контроль: группа фиктивной хирургии. 30-е годы: 30-я группа травм. 60-е годы: 60-е годы травматологической группы. 90-е годы: 90-е группа травм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Репрезентативная форма волны CMAP, индуцированная как проксимально, так и отдаленно к точке повреждения нерва в каждой группе в разное время. (A,D,G) CMAP генерируется стимуляцией в стиломастоидном отверстии перед травмой. (В,Е,Н) CMAP генерируется дистальными и проксимальными раздражителями сразу после травмы. (К,Ж,И) CMAP генерируется дистальными и проксимальными раздражителями через 48 ч после травмы. В B-C, E-F и H-I два верхних ряда волн генерировались дистальной стимуляцией, в то время как нижние три ряда волн генерировались проксимальной стимуляцией. 30-е годы: 30-я группа травм. 60-е годы: 60-е годы травматологической группы. 90-е годы: 90-е годы травматологической группы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
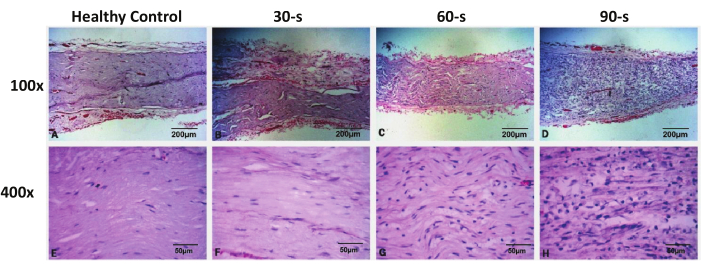
Рисунок 3: Репрезентативные окрашивающие изображения резецированных лицевых нервов в каждой группе через 48 часов после травмы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Группа фиктивной хирургии | 30-я травматологическая группа | Травматологическая группа 60-х годов | Травматологическая группа 90-х годов | |
| Мигающий рефлекс | 0 ± 0 | 0,5 ± 0,53 | 1,4 ± 0,70 | 2 ± 0 |
| Вибриссы | 0 ± 0 | 0,6 ± 0,52 | 1,0 ± 0,67 | 2 ± 0 |
| Положение кончика носа | 0 ± 0 | 0,1 ± 0,32 | 0,8 ± 0,42 | 1 ± 0 |
| Общий балл | 0 ± 0 | 1,2 ± 0,92 | 3.2 ± 1.23 | 5 ± 0 |
Таблица 1: Оценка функции лицевого нерва крыс через 48 ч после операции (n=10).
| Предоперационной | Сразу после травмы | 48 ч после травмы | |||
| Проксимальный | Дистальный | Проксимальный | Дистальный | ||
| Лм (мс) | 1.12 ± 0.09 | **1,54 ± 0,12 | 1.13 ± 0.19 | 1.13 ± 0.21 | 1.12 ± 0.13 |
| Am (mv) | 4.16 ± 0.52 | **1,36 ± 0,72 | 4,17 ± 0,63 | *3.83 ± 0.75 | *3.92 ± 1.11 |
Таблица 2: Латентность (Lm) и амплитуда (Am) М-волн в разные моменты времени в группе 30-х травм (n = 10). * указывает на статистическую разницу между группами (P < 0,05), ** указывает на значимую разницу между группами (P < 0,01). Все результаты сравнивались с предоперационными.
| Предоперационной | Сразу после травмы | 48 ч после травмы | |||
| Проксимальный | Дистальный | Проксимальный | Δ Дистальный | ||
| Лм (мс) | 1.12 ± 0.09 | / | 1.12 ± 0.21 | / | **2,04 ± 0,81 |
| Am (mv) | 4.16 ± 0.52 | / | 4.14 ± 0.56 | / | *3.92 ± 1.11 |
Таблица 3: Латентность (Lm) и амплитуда (Am) М-волн в разные моменты времени в группе травм 60-х годов (n = 10). Δ указывает на то, что только у 30% крыс (n = 3) наблюдаются М-зубцы. / указывает на то, что форма волны не появилась. * указывает на статистическую разницу между группами (P < 0,05), ** указывает на значимую разницу между группами (P < 0,01). Все результаты сравнивались с предоперационными.
| Предоперационной | Сразу после травмы | 48 ч после травмы | |||
| Проксимальный | Дистальный | Проксимальный | Δ Дистальный | ||
| Лм (мс) | 1.12 ± 0.09 | / | 1.13 ± 0.11 | / | / |
| Am (mv) | 4.16 ± 0.52 | / | 4,15 ± 0,67 | / | / |
Таблица 4: Латентность (Lm) и амплитуда (Am) М-волн в разные моменты времени в группе травм 90-х годов (n = 10). / указывает на то, что форма волны не появилась.
Обсуждение
Необходимо изучить механизм восстановления повреждения лицевого нерва у пациентов с идиопатическим параличом лицевого нерва17. Степень повреждения модели лицевого нерва должна соответствовать следующим требованиям. Во-первых, степень повреждения лицевого нерва не должна быть слишком легкой, как у Сандерленда1-й степени18, который может полностью самовосстанавливаться без медикаментозного вмешательства. Во-вторых, она не должна быть слишком тяжелой, как Сандерленд 5 степени, которая требует хирургического вмешательства. В-третьих, степень повреждения лицевого нерва должна быть стабильной и равномерной. Поэтому важно интегрировать поведенческие, электрофизиологические и гистологические тесты в качестве основы для выбора модели.
Факторами, влияющими на силу травмы от раздавливания, являются величина силы и продолжительность действия. В этом исследовании мы использовали самодельные щипцы для количественного повреждения периферических нервов, при этом усилие было задано как количественное (50 g), а время действия — как переменные (зажим в течение 30 с, 60 с и 90 с соответственно). Мы оценивали и оценивали степень паралича лицевого нерва, наблюдая за морганным рефлексом, движением вибрисс и положением кончика носа у крыс. Это похоже на шкалу Хауса-Бракмана (H-B), обычно используемую при клинической оценке19. Мы обнаружили, что средний общий балл оценки функции лицевого нерва составил 1,2 ± 0,92 балла в группе с травмой 30-х лет, что указывает на легкий паралич лицевого нерва. Когда время травмы составляло 60 с, средний общий балл составлял 3,2 ± 1,23 балла, и у крыс наблюдались явные симптомы паралича лицевого нерва, такие как исчезновение морганного рефлекса, снижение активности щупалец и изменение положения кончика носа. В группе травм 90-х годов у всех крыс наблюдался полный паралич лицевого нерва в 5 баллов.
Нейроэлектрофизиологическое обнаружение показало, что стимуляция проксимального конца сразу после травмы свидетельствовала об ослаблении проводимости в группе 30-х часов, в то время как стимуляция проксимального и дистального концов через 48 часов указывала на частичное восстановление функции проводимости. Это означало, что в момент повреждения в поврежденном лицевом нерве произошло частичное разрушение аксонов. Тем не менее, это повреждение было относительно легким, и нейропроводящая функция могла частично самовосстанавливаться. Таким образом, модель группы травмы 30-х годов не способствовала наблюдению за эффектом терапевтического вмешательства на восстановление лицевого нерва. В группе с травмой 90-х годов сразу после травмы не наблюдалось формы волны на проксимальном конце стимуляции, что указывает на то, что все аксоны в локальной области травмы утратили функцию проводимости. Тем не менее, через 48 ч на дистальном конце стимуляции не наблюдалось никакой формы волны, что указывает на то, что все нервы на дистальном конце точки стимуляции подверглись валлеровской дегенерации в течение 48 ч, и функция нервной проводимости была полностью утрачена. В это время форма волны не могла естественным образом появиться на проксимальном конце стимуляции. Таким образом, эта модель подошла для исследований идиопатического паралича лицевого нерва. В группе травмы 60-х годов мы обнаружили, что обнаруженные электрофизиологические эффекты не были стабильными и не подходили для последующих исследований.
Морфологическое исследование тканей показало, что через 48 часов после травмы в группе 30-летней травмы практически не было существенных изменений, что указывает на то, что степень повреждения была легкой и в основном была восстановлена, в соответствии с 1-й степенью по шкале Сандерленда. Как в группе 60-х годов, так и в группе 90-х годов наблюдались типичные ранние патологические изменения валлеровской дегенерации20. Среди них в группе травмы 90-х годов наблюдались более значимые изменения, такие как дезинтеграция аксонов, демиелинизация, пролиферация шванновских клеток и инфильтрация макрофагов, что указывает на более тяжелую степень повреждения в этой группе. Во всех группах повреждений не было повреждения наружной оболочки нерва и пучка; таким образом, у «Сандерленда» не было травм четвертой-пятой степени.
Хотя эта животная модель могла точно отразить характеристики паралича лицевого нерва, она не могла полностью приблизиться к фактической частоте паралича лицевого нерва у людей. По сравнению с другими методами препарирования, в этом исследовании были количественно оценены сила и время компрессии лицевого нерва, а подготовка модели была повторяемой. Эта животная модель будет полезна в диагностике и лечении идиопатического паралича лицевого нерва.
Раскрытие информации
Авторы заявили, что конкурирующих конфликтов интересов не существует.
Благодарности
Эта работа была поддержана проектными грантами от Национального фонда естественных наук Китая (82203637) и Фонда развития науки и технологий Нанкинского медицинского университета (NMUB20210220).
Материалы
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde fixing solution | Beyotime Biotechnology | P0099 | |
| Clean bench | Airtech | ||
| Electronic balance | Shanghai Precision Instrument Factory | AS909 | |
| Freezing microtome | Leica | CM1900 | |
| Hematoxylin eosin (HE) staining kit | Beyotime Biotechnology | C0105S | |
| Ketamine | Sigma | 57074-21-2 | |
| Optical photographic microscope | Olympus | IX90 | |
| Pentobarbital sodium | ChemSrc | 57-33-0 | |
| Quantitative peripheral nerve injury forceps | In-house | Patent number: CN20082015530.3 | |
| Sprague-Dawley rats | Jiangsu Jicui Yaokang Biotechnology Co., Ltd | ||
| Surgical operating microscope | OPMI 1FR proergo | ZEISS |
Ссылки
- Gagyor, I., Madhok, V. B., Daly, F., Sullivan, F. Antiviral treatment for Bell's palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 9 (9), (2019).
- Furukawa, T., et al. The use of basic fibroblast growth factor to treat intractable Bell's palsy administered via transcanal endoscopic ear surgery. Am J Otolaryngol. 45 (1), 104020(2023).
- Qin, Y., et al. To explore the pathogenesis of Bell's palsy using diffusion tensor image. Sci Rep. 13 (1), 15298(2023).
- Teixeira, L. J., Valbuza, J. S., Prado, G. F. Physical therapy for Bell's palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 12 (12), (2011).
- Mu, H., et al. The alterations and significance of intercellular adhesion molecule-1 in mouse brainstem during herpes simplex virus type 1-induced facial palsy. Appl Biochem Biotechnol. 194 (8), 3483-3493 (2022).
- Fujii, K., et al. Accelerated outgrowth in cross-facial nerve grafts wrapped with adipose-derived stem cell sheets. J Tissue Eng Regen Med. 14 (8), 1087-1099 (2020).
- Joko, T., Yamada, H., Kimura, T., Teraoka, M., Hato, N. Non-recovery animal model of severe facial paralysis induced by freezing the facial canal. Auris Nasus Larynx. 47 (5), 778-784 (2020).
- Cai, J., et al. Neuroprotective effect of brimonidine against facial nerve crush injury in rats via suppressing GFAP/PAF activation and neuroinflammation. ORL J Otorhinolaryngol Relat Spec. 83 (6), 449-456 (2021).
- Eviston, T. J., Croxson, G. R., Kennedy, P. G., Hadlock, T., Krishnan, A. V. Bell's palsy: aetiology, clinical features and multidisciplinary care. J Neurol Neurosurg Psychiatry. 86 (12), 1356-1361 (2015).
- Heckmann, J. G., Urban, P. P., Pitz, S., Guntinas-Lichius, O., Gagyor, I. The diagnosis and treatment of idiopathic facial paresis (Bell's Palsy). Dtsch Arztebl Int. 116 (41), 692-702 (2019).
- Zhang, W., et al. The etiology of Bell's palsy: a review. J Neurol. 267 (7), 1896-1905 (2020).
- Touska, P., et al. Computed tomographic features of the proximal petrous facial nerve canal in recurrent Bell's palsy. Laryngoscope Investig Otolaryngol. 6 (4), 816-823 (2021).
- Murai, A., et al. The facial nerve canal in patients with Bell's palsy: an investigation by high-resolution computed tomography with multiplanar reconstruction. Eur Arch Otorhinolaryngol. 270 (7), 2035-2038 (2013).
- Mourad, S. I., Al-Dubai, S. A., Elsayed, S. A., El-Zehary, R. R. Efficacy of platelet-rich fibrin and tacrolimus on facial nerve regeneration: an animal study. Int J Oral Maxillofac Surg. 51 (2), 279-287 (2022).
- Chen, D., Zhang, D., Xu, L., Han, Y., Wang, H. The alterations of matrix metalloproteinase-9 in mouse brainstem during herpes simplex virus type 1-induced facial palsy. J Mol Neurosci. 51 (3), 703-709 (2013).
- Hu, B., et al. Delivery of basic fibroblast growth factor through an in situ forming smart hydrogel activates autophagy in Schwann cells and improves facial nerves generation via the PAK-1 signaling pathway. Front Pharmacol. 13, 778680(2022).
- Kline, L. B., Kates, M. M., Tavakoli, M. Bell Palsy. JAMA. 326 (19), 1983(2021).
- Kamble, N., Shukla, D., Bhat, D. Peripheral nerve injuries: Electrophysiology for the neurosurgeon. Neurol India. 67 (6), 1419-1422 (2019).
- Machetanz, K., et al. Design and evaluation of a custom-made electromyographic biofeedback system for facial rehabilitation. Front Neurosci. 16, 666173(2022).
- Conforti, L., Gilley, J., Coleman, M. P. Wallerian degeneration: an emerging axon death pathway linking injury and disease. Nat Rev Neurosci. 15 (6), 394-409 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены