Method Article
Estabelecimento de Modelo de Rato de Lesão do Nervo Facial para Pesquisa de Paralisia Facial Idiopática
Neste Artigo
Resumo
O presente protocolo estabelece um modelo de lesão do nervo facial em ratos usando microscopia para investigar os mecanismos diagnósticos e terapêuticos da paralisia facial idiopática.
Resumo
A paralisia facial idiopática é o tipo mais comum de lesão do nervo facial, sendo responsável por aproximadamente 70% dos casos de paralisia facial periférica. Esta doença pode não apenas levar a uma mudança na expressão facial, mas também ter um grande impacto na psicologia dos pacientes. Em casos graves, pode afetar o trabalho normal e a vida dos pacientes. Portanto, a pesquisa sobre o reparo da lesão do nervo facial tem importante significado clínico. Para estudar o mecanismo desta doença, é necessário realizar experimentos em animais relevantes, entre os quais a tarefa mais importante é estabelecer um modelo animal com a mesma patogênese da doença humana. A compressão do nervo facial dentro do osso petroso, especialmente o tronco nervoso na junção da extremidade distal do conduto auditivo interno e do segmento labiríntico, é a patogênese da paralisia facial idiopática. Para simular essa doença comum, um modelo de lesão por compressão do segmento extracraniano principal do nervo facial foi estabelecido neste estudo. O dano neurológico foi avaliado por meio de exame comportamental, neuroeletrofisiológico e histológico. Finalmente, 50 g de força constante e lesão em pinça de 90 s foram selecionados como parâmetros de lesão para construir um modelo de paralisia facial idiopática estável.
Introdução
Como um tipo de paralisia facial periférica, a paralisia facial idiopática é característica de etiologia desconhecida, início agudo e curso autolimitado 1,2. A etiologia e a patogênese da paralisia facial idiopática ainda são incertas3. Atualmente, existem vários métodos de tratamento para a paralisia facial4, e a diversidade de tratamentos reflete a falta de opções de tratamento ideais. O uso de técnicas de biologia celular e molecular para estudar o mecanismo da lesão do nervo facial é a base para o estabelecimento de métodos eficazes de tratamento para a paralisia facial. Portanto, um modelo adequado e estável de lesão do nervo facial é particularmente importante.
Atualmente, não existe um método padrão para estabelecer um modelo de lesão do nervo facial. Os métodos de preparação atuais incluem inoculação de vírus5, transecção6, estimulação a frio7 e compressão8 métodos. Acredita-se que infecção viral, vasoespasmo neurotroflástico, inflamação autoimune, etc., podem causar isquemia local, degeneração e edema do nervo facial 9,10,11. Além disso, todos os fatores acima podem causar compressão do tronco principal do nervo facial no estreito canal ósseo do nervo facial12,13. Além disso, as lesões de nervos periféricos mais comuns identificadas durante os procedimentos cirúrgicos foram compressão econtusão14. Com base nas teorias e fenômenos clínicos acima, acreditamos que a preparação do modelo de lesão do nervo facial por meio de lesão por compressão é mais razoável. No entanto, a maioria dos métodos atuais para implementação de lesões por compressão não fornece parâmetros quantitativos de força e tempo. Neste estudo, quantificamos a força e a duração da lesão por compressão para melhorar a reprodutibilidade do modelo estabelecido.
Protocolo
Todos os experimentos com animais foram aprovados e supervisionados pelo Comitê de Ética Animal do Hospital Xinhua Afiliado à Escola de Medicina da Universidade Jiaotong de Xangai (XHEC-F-2023-061). Ratos machos Sprague-Dawley, 200-300 g, foram utilizados para o presente estudo. Os animais foram obtidos de uma fonte comercial (ver Tabela de Materiais). Os ratos foram divididos aleatoriamente em quatro grupos (n = 10): grupo de cirurgia simulada, grupo de lesão de 30 segundos, grupo de lesão de 60 segundos e grupo de lesão de 90 segundos.
1. Indução da anestesia e preparação do animal
- Use os seguintes equipamentos de proteção individual (EPI): máscara cirúrgica, luvas cirúrgicas, avental descartável.
- Pese os ratos e anestesize-os com cloridrato de cetamina na dose de 50 mg / kg por injeção intraperitoneal (i.p.). Administrar meloxicam (5 mg/kg; i.p.) para analgesia perioperatória. Confirme a profundidade da anestesia usando uma pinça no dedo do pé.
- Aplique pomada oftálmica em ambos os olhos para evitar o ressecamento.
- Após a anestesia, coloque os ratos em decúbito ventral e fixe a cabeça de forma que o lado esquerdo da face fique para cima. Raspe o cabelo atrás da orelha esquerda e desinfete a pele. Cubra o rato com o campo cirúrgico estéril.
2. Estabelecimento de um modelo de lesão por esmagamento local do tronco extracraniano do nervo facial
NOTA: Esterilize todo o equipamento antes de usar. Todas as operações foram realizadas na sala de cirurgia.
- Faça uma incisão longitudinal de 2 cm de comprimento atrás da orelha esquerda e disseque a pele e o tecido subcutâneo para separar o espaço natural entre os músculos faciais e cervicais.
- Use micropinças e microtesouras para dissociar totalmente o tronco do nervo facial entre o forame estilomastóideo e a glândula parótida, com comprimento exposto de aproximadamente 1 cm.
- Use uma pinça quantitativa de lesão do nervo periférico (Tabela de Materiais) para prender o tronco do nervo facial para causar lesão. Localize o local da lesão a 0,5 cm de distância do forame estilomastóideo. Aplique uma intensidade de lesão de 50 g e tempo de lesão de 30 s, 60 s e 90 s, respectivamente.
- Suturar o subcutâneo e a pele com fio de seda. Desinfete a incisão.
- Para ratos no grupo de controle de cirurgia simulada, corte a pele e o tecido subcutâneo após a anestesia e exponha e separe o tronco principal correspondente do nervo facial. Em seguida, suturou a incisão imediatamente.
- Monitore a saúde do animal, mantenha a decúbito esternal e mantenha-o em condições quentes.
- Mova o rato de volta para a gaiola de alojamento depois que o rato estiver consciente.
3. Teste comportamental
NOTA: A função do nervo facial dos ratos foi avaliada antes da cirurgia e 48 h após a cirurgia (Figura 1). Os escores de reflexo de piscar, movimento palpar e posição da ponta nasal foram calculados15. Quanto maior o escore total, mais grave é o grau de lesão do nervo facial (Tabela 1).
- Reflexo de piscar (BR):
- Coloque uma agulha de 18 G a uma seringa de 2 ml e sopre ar para o olho do rato a uma distância de 2 cm. Observe o movimento e o fechamento das pálpebras.
- Pontuação de acordo com os seguintes critérios: Sem diferença significativa em ambos os lados: 0 pontos; Fechamento tardio do lado afetado em comparação com o lado saudável: 1 ponto; Incapacidade de fechar a pálpebra afetada: 2 pontos.
- Movimento das vibrissas (VM):
- Conte os movimentos bilaterais dos tentáculos dos ratos em 30 s.
- Pontuação de acordo com os seguintes critérios: Sem diferença significativa no movimento bilateral dos tentáculos: 0 pontos; O movimento dos bigodes do lado afetado é mais fraco do que o do lado saudável: 1 ponto; Perda do movimento do bigode no lado afetado: 2 pontos.
- Posição da ponta nasal.
- Ponta do nariz central: 0 pontos; Ponta do nariz inclinada para o lado saudável: 1 ponto.
NOTA: Uma pontuação total de 0 pontos indica normal, 1-2 pontos indicam paralisia facial leve (paresia), 3-4 pontos indicam paralisia facial óbvia (paresia) e 5 pontos indicam paralisia facial completa15.
- Ponta do nariz central: 0 pontos; Ponta do nariz inclinada para o lado saudável: 1 ponto.
4. Detecção neuroeletrofisiológica
NOTA: A eletrografia facial (ENoG) foi realizada antes da lesão, imediatamente após a cirurgia e 48 h após a cirurgia (Figura 2, Tabela 2, Tabela 3 e Tabela 4).
- Coloque o eletrodo de aterramento sob a pele do membro inferior esquerdo.
- Insira o eletrodo de registro (eletrodo de agulha concêntrica bipolar) no lado lesionado do músculo tentáculo, com uma profundidade de penetração de 5 mm.
- Coloque o eletrodo de estimulação (eletrodo de agulha concêntrica) na membrana do nervo facial. Estimule as extremidades proximal e distal do nervo facial lesionado separadamente.
- Use uma corrente de pulso de onda quadrada com uma frequência de 1 Hz, uma largura de onda de 0.1 ms e uma faixa de filtragem de 10-3000 Hz.
- Use estímulos de 2 mA, 5 mA, 10 mA, 15 mA e 20 mA para induzir a geração de potencial de ação muscular composto.
- Registre a latência (Lm) e a amplitude de pico (Am) da onda M.
NOTA: A onda M refere-se à primeira e mais óbvia forma de onda registrada. O ponto em que a forma de onda sai da linha de base é o ponto inicial da forma de onda. A distância do ponto inicial da linha de base ao ponto inicial da forma de onda é Lm. A distância entre os picos mais altos e mais baixos da forma de onda é Am. - Deixe um intervalo de 5 minutos entre cada estimulação para garantir a recuperação do nervo.
5. Exame histológico
- Depois de concluir os testes eletrofisiológicos, use uma micropinça para levantar o nervo e uma microtesoura para cortar a amostra do nervo. O espécime inclui o tronco do nervo facial desde o ponto da lesão até a glândula parótida, que é a fibra nervosa na extremidade distal do ponto da lesão, com um comprimento total de cerca de 0,5 cm.
- Fixe a amostra do nervo em paraformaldeído a 4% por 24 h e prepare cortes embebidos em parafina16.
- Manchar os cortes com o método de coloração de hematoxilina-eosina (H&E)16 e adquirir imagens com aumento de 100x e 400x usando um microscópio óptico fotográfico (Figura 3).
NOTA: Após a remoção da peça nervosa e sutura da pele sob anestesia, os ratos foram eutanasiados com pentobarbital sódico (150 mg/kg; i.p.).
Resultados
Teste comportamental
Antes da cirurgia, os escores de reflexo de piscar, movimento palpar e posição da ponta nasal foram de 0 pontos em todos os ratos experimentais, indicando que todos os ratos tinham função do nervo facial intacta. Na avaliação da função do nervo facial 48 h após a cirurgia, verificou-se que os escores individuais dos ratos em cada grupo de lesão foram aumentados. Além disso, o escore total aumentou gradativamente com o prolongamento do tempo de lesão do nervo facial (Tabela 1).
Os registros de atividade facial dos ratos em cada grupo 48 h após a cirurgia mostraram que a simetria facial desapareceu gradualmente com o prolongamento do tempo de lesão. No grupo de lesões de 30 s, as faces dos ratos eram basicamente simétricas. No grupo de lesão de 60 e 90 de idade, a ponta nasal dos ratos se deslocou para o lado saudável (lado direito). Esse fenômeno foi mais pronunciado no grupo de lesão dos anos 90 do que nos outros grupos (Figura 1).
Detecção neuroeletrofisiológica
Antes da cirurgia, testes eletrofisiológicos descobriram que a estimulação do forame mastóideo do nervo facial poderia gerar ondas M de forma estável (Figura 2A, D, G). Imediatamente após a cirurgia, ao estimular a extremidade proximal do local da lesão, as ondas M foram registradas no grupo de lesão de 30 segundos, mas tanto Lm quanto Am foram prolongadas e diminuídas. Nos grupos de lesões de 60 e 90 anos, não foram registradas ondas M. Ao estimular a parte distal do local da lesão, as ondas M puderam ser registradas de forma estável em todos os três grupos de lesões, e a forma de onda, Lm e Am foram consistentes com as anteriores à cirurgia (Figura 2B, E, H). Às 48 h após a cirurgia, houve diferenças significativas entre os grupos de lesões (Figura 2C,F,I). No grupo de lesão de 30 segundos, as ondas M foram registradas tanto na estimulação proximal quanto na distal. Além disso, não houve diferença estatisticamente significativa em Lm antes e após a cirurgia (ver Tabela 2). No grupo de lesão de 60 anos, as ondas M não foram registradas sob estimulação proximal. Sob estimulação distal, 70% dos ratos não registraram ondas M. Um potencial de ação muscular composto significativamente enfraquecido (CMAP) foi registrado em 30% dos ratos. O Lm e o Am foram significativamente prolongados e diminuídos, respectivamente (ver Tabela 3). Para o grupo de lesão de 90 segundos, nem a estimulação proximal nem distal mostraram CMAP (ver Tabela 4).
Exame anatomopatológico
A coloração H&E mostrou que não houve dano ao espécime do nervo facial no grupo de cirurgia simulada e a morfologia do nervo facial estava completa. No grupo de lesão de 30 segundos, não houve colapso axonal significativo ou desmielinização do nervo distal no local lesado, e a morfologia dos axônios e bainhas de mielina foi semelhante à do grupo controle. Os núcleos profundamente corados ainda estavam uniformemente distribuídos e não houve aumento significativo no número. Nos grupos de lesão de 60 e 90, foram observadas alterações de colapso axonal e desmielinização nos nervos distais no local lesado, com edema visível das fibras nervosas e interrupção normal dos axônios e bainhas de mielina. Sob um microscópio de alta potência (400x), observou-se que o número de núcleos profundamente corados no espécime foi significativamente aumentado, e um grande número de núcleos redondos apareceu, que foram considerados macrófagos infiltrantes. O núcleo original da célula de Schwann achatado também aumentou significativamente. As alterações patológicas acima foram mais pronunciadas no grupo de lesão de 90 anos do que no grupo de lesão de 60 anos (Figura 3).
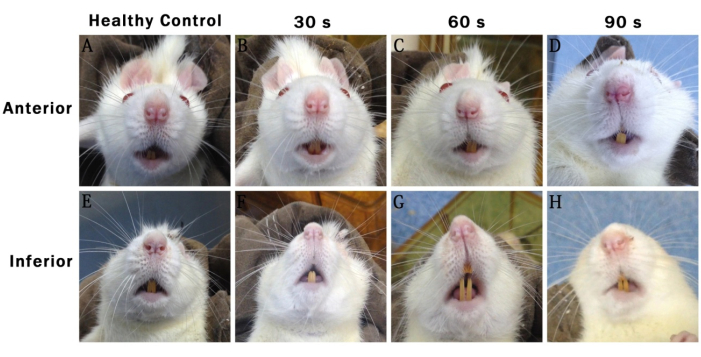
Figura 1: Fotografias representativas tiradas 48 h após a cirurgia mostrando as características faciais de diferentes grupos de ratos. (A-D) Anterior: exibe a parte frontal. (E-H) Inferior: exibe a parte inferior. Controle saudável: Grupo de cirurgia simulada. 30-s: Grupo de lesões de 30 s. Grupo de lesões de 60 anos: 60 segundos. 90 -s: Grupo de lesões dos anos 90. Clique aqui para ver uma versão maior desta figura.

Figura 2: Forma de onda representativa da CMAP induzida proximal e distante do ponto de lesão nervosa em cada grupo em momentos diferentes. (A,D,G) CMAP gerado pela estimulação no forame estilomastóideo antes da lesão. (B, E, H) CMAP gerado por estímulos distais e proximais imediatamente após a lesão. (C, F, I) CMAP gerado por estímulos distais e proximais 48 h após a lesão. No BC, EF e HI, as duas fileiras superiores de formas de onda foram geradas por estimulação distal, enquanto as três fileiras inferiores de formas de onda foram geradas por estimulação proximal. 30-s: Grupo de lesões de 30 s. Grupo de lesões de 60 anos: 60 segundos. Grupo de lesões dos anos 90. Clique aqui para ver uma versão maior desta figura.
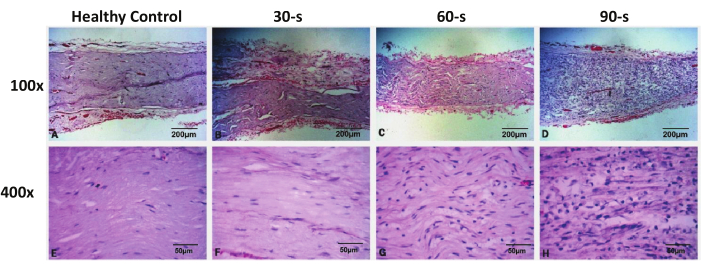
Figura 3: Imagens representativas de coloração de H & E de nervos faciais ressecados em cada grupo 48 h após a lesão. Clique aqui para ver uma versão maior desta figura.
| Grupo de cirurgia simulada | Grupo de lesões de 30 s | Grupo de lesões de 60 anos | Grupo de lesões dos anos 90 | |
| Reflexo de piscar | 0 ± 0 | 0,5 ± 0,53 | 1,4 ± 0,70 | 2 ± 0 |
| Movimento Vibrissas | 0 ± 0 | 0,6 ± 0,52 | 1,0 ± 0,67 | 2 ± 0 |
| Posição da ponta nasal | 0 ± 0 | 0,1 ± 0,32 | 0,8 ± 0,42 | 1 ± 0 |
| Pontuação total | 0 ± 0 | 1,2 ± 0,92 | 3,2 ± 1,23 | 5 ± 0 |
Tabela 1: Escore de função do nervo facial em ratos 48 h após a cirurgia (n=10).
| Pré-operatório | Imediatamente após a lesão | 48 h após a lesão | |||
| Proximal | Distal | Proximal | Distal | ||
| Lm (ms) | 1,12 ± 0,09 | **1,54 ± 0,12 | 1,13 ± 0,19 | 1,13 ± 0,21 | 1,12 ± 0,13 |
| Am (mv) | 4,16 ± 0,52 | **1,36 ± 0,72 | 4,17 ± 0,63 | *3,83 ± 0,75 | *3,92 ± 1,11 |
Tabela 2: Latência (Lm) e Amplitude (Am) das ondas M em diferentes momentos no grupo de lesão de 30 s (n = 10). * indica uma diferença estatística entre os grupos (P < 0,05), ** indica uma diferença significativa entre os grupos (P < 0,01). Todos os resultados foram comparados com os pré-operatórios.
| Pré-operatório | Imediatamente após a lesão | 48 h após a lesão | |||
| Proximal | Distal | Proximal | Δ Distal | ||
| Lm (ms) | 1,12 ± 0,09 | / | 1,12 ± 0,21 | / | **2,04 ± 0,81 |
| Am (mv) | 4,16 ± 0,52 | / | 4,14 ± 0,56 | / | *3,92 ± 1,11 |
Tabela 3: Latência (Lm) e Amplitude (Am) das ondas M em diferentes momentos no grupo de lesão de 60 s (n = 10). Δ indica que apenas 30% dos ratos (n = 3) apresentam ondas M. / indica que nenhuma forma de onda apareceu. * indica diferença estatística entre os grupos (P < 0,05), ** indica diferença significativa entre os grupos (P < 0,01). Todos os resultados foram comparados com os pré-operatórios.
| Pré-operatório | Imediatamente após a lesão | 48 h após a lesão | |||
| Proximal | Distal | Proximal | Δ Distal | ||
| Lm (ms) | 1,12 ± 0,09 | / | 1,13 ± 0,11 | / | / |
| Am (mv) | 4,16 ± 0,52 | / | 4,15 ± 0,67 | / | / |
Tabela 4: Latência (Lm) e Amplitude (Am) das ondas M em diferentes momentos no grupo de lesão de 90 s (n = 10). / indica que nenhuma forma de onda apareceu.
Discussão
É necessário estudar o mecanismo de reparo da lesão do nervo facial em pacientes com paralisia facial idiopática17. O modelo de grau de lesão do nervo facial deve atender aos seguintes requisitos. Em primeiro lugar, o grau de lesão do nervo facial não deve ser muito leve, como Sunderland Grau 1º grau18, que pode se auto-reparar completamente sem intervenção medicamentosa. Em segundo lugar, não deve ser muito grave, como o 5º grau de Sunderland, que requer intervenção cirúrgica. Em terceiro lugar, o grau de lesão do nervo facial deve ser estável e uniforme. Portanto, é importante integrar testes comportamentais, eletrofisiológicos e histológicos como base para a seleção do modelo.
Os fatores que afetam a força da lesão por esmagamento são a magnitude da força e a duração da ação. Neste estudo, utilizamos pinças quantitativas de lesão de nervos periféricos de fabricação própria, com a força definida como quantitativa (50 g) e o tempo de ação como variáveis (pinçamento por 30 s, 60 s e 90 s, respectivamente). Pontuamos e avaliamos o grau de paralisia facial observando o reflexo de piscar, o movimento das vibrissas e a posição da ponta nasal dos ratos. Isso é semelhante à escala de House Brackmann (H-B) comumente usada na avaliação clínica19. Observamos que a pontuação total média da avaliação da função do nervo facial foi de 1,2 ± 0,92 pontos no grupo de lesão de 30 segundos, indicando paralisia leve do nervo facial. Quando o tempo de lesão foi de 60 s, a pontuação total média foi de 3,2 ± 1,23 pontos, e os ratos apresentaram sintomas óbvios de paralisia facial, como desaparecimento do reflexo de piscar, diminuição da atividade dos tentáculos e mudanças na posição da ponta nasal. No grupo de lesão dos anos 90, todos os ratos apresentaram paralisia facial completa de 5 pontos.
A detecção neuroeletrofisiológica mostrou que a estimulação da extremidade proximal imediatamente após a lesão indicou condução enfraquecida no grupo de lesão de 30 segundos, enquanto a estimulação das extremidades proximal e distal após 48 h indicou recuperação parcial da função de condução. Isso significava que havia destruição axonal parcial no nervo facial danificado no momento da lesão. No entanto, esse dano foi relativamente leve e a função neurocondutora pôde se auto-reparar parcialmente. Portanto, o modelo de grupo de lesão de 30 anos não foi propício para observar o efeito da intervenção terapêutica no reparo do nervo facial. Para o grupo de lesão de 90 segundos, nenhuma forma de onda foi observada na extremidade proximal da estimulação imediatamente após a lesão, indicando que todos os axônios na área local da lesão perderam a função de condução. No entanto, nenhuma forma de onda foi observada na extremidade distal da estimulação 48 h depois, indicando que todos os nervos na extremidade distal do ponto de estimulação sofreram degeneração de Wallerian em 48 h e a função de condução nervosa foi completamente perdida. Neste momento, a forma de onda não pôde aparecer naturalmente na extremidade proximal da estimulação. Portanto, este modelo foi adequado para pesquisas de paralisia facial idiopática. Para o grupo de lesões de 60 anos, descobrimos que os efeitos eletrofisiológicos detectados não eram estáveis e não eram adequados para pesquisas subsequentes.
O exame da morfologia do tecido constatou que quase não houve mudança significativa no grupo de lesão de 30 s 48 h após a lesão, indicando que o grau de dano foi leve e basicamente reparado, de acordo com o grau 1º grau de Sunderland. Tanto o grupo de lesões dos anos 60 quanto o grupo de lesões dos anos 90 exibiram as alterações patológicas precoces típicas da degeneração walleriana20. Entre eles, o grupo de lesão dos anos 90 apresentou alterações mais significativas, como desintegração axonal, desmielinização, proliferação de células de Schwann e infiltração de macrófagos, indicando um grau mais grave de dano nesse grupo. Todos os grupos de lesão não danificaram a membrana externa do nervo e o fascículo; portanto, não houve lesão de quarto a quinto grau do Sunderland.
Embora esse modelo animal pudesse refletir com precisão as características da paralisia do nervo facial, ele não poderia se aproximar totalmente da incidência real de paralisia facial em humanos. Em comparação com outros métodos de preparação, a força e o tempo de compressão do nervo facial foram quantificados neste estudo, e a preparação do modelo foi repetível. Este modelo animal será útil no diagnóstico e tratamento da paralisia facial idiopática.
Divulgações
Os autores declararam que não existem conflitos de interesse concorrentes.
Agradecimentos
Este trabalho foi apoiado por bolsas de projeto da Fundação Nacional de Ciências Naturais da China (82203637) e da Fundação de Desenvolvimento de Ciência e Tecnologia da Universidade Médica de Nanjing (NMUB20210220).
Materiais
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde fixing solution | Beyotime Biotechnology | P0099 | |
| Clean bench | Airtech | ||
| Electronic balance | Shanghai Precision Instrument Factory | AS909 | |
| Freezing microtome | Leica | CM1900 | |
| Hematoxylin eosin (HE) staining kit | Beyotime Biotechnology | C0105S | |
| Ketamine | Sigma | 57074-21-2 | |
| Optical photographic microscope | Olympus | IX90 | |
| Pentobarbital sodium | ChemSrc | 57-33-0 | |
| Quantitative peripheral nerve injury forceps | In-house | Patent number: CN20082015530.3 | |
| Sprague-Dawley rats | Jiangsu Jicui Yaokang Biotechnology Co., Ltd | ||
| Surgical operating microscope | OPMI 1FR proergo | ZEISS |
Referências
- Gagyor, I., Madhok, V. B., Daly, F., Sullivan, F. Antiviral treatment for Bell's palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 9 (9), (2019).
- Furukawa, T., et al. The use of basic fibroblast growth factor to treat intractable Bell's palsy administered via transcanal endoscopic ear surgery. Am J Otolaryngol. 45 (1), 104020 (2023).
- Qin, Y., et al. To explore the pathogenesis of Bell's palsy using diffusion tensor image. Sci Rep. 13 (1), 15298 (2023).
- Teixeira, L. J., Valbuza, J. S., Prado, G. F. Physical therapy for Bell's palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 12 (12), (2011).
- Mu, H., et al. The alterations and significance of intercellular adhesion molecule-1 in mouse brainstem during herpes simplex virus type 1-induced facial palsy. Appl Biochem Biotechnol. 194 (8), 3483-3493 (2022).
- Fujii, K., et al. Accelerated outgrowth in cross-facial nerve grafts wrapped with adipose-derived stem cell sheets. J Tissue Eng Regen Med. 14 (8), 1087-1099 (2020).
- Joko, T., Yamada, H., Kimura, T., Teraoka, M., Hato, N. Non-recovery animal model of severe facial paralysis induced by freezing the facial canal. Auris Nasus Larynx. 47 (5), 778-784 (2020).
- Cai, J., et al. Neuroprotective effect of brimonidine against facial nerve crush injury in rats via suppressing GFAP/PAF activation and neuroinflammation. ORL J Otorhinolaryngol Relat Spec. 83 (6), 449-456 (2021).
- Eviston, T. J., Croxson, G. R., Kennedy, P. G., Hadlock, T., Krishnan, A. V. Bell's palsy: aetiology, clinical features and multidisciplinary care. J Neurol Neurosurg Psychiatry. 86 (12), 1356-1361 (2015).
- Heckmann, J. G., Urban, P. P., Pitz, S., Guntinas-Lichius, O., Gagyor, I. The diagnosis and treatment of idiopathic facial paresis (Bell's Palsy). Dtsch Arztebl Int. 116 (41), 692-702 (2019).
- Zhang, W., et al. The etiology of Bell's palsy: a review. J Neurol. 267 (7), 1896-1905 (2020).
- Touska, P., et al. Computed tomographic features of the proximal petrous facial nerve canal in recurrent Bell's palsy. Laryngoscope Investig Otolaryngol. 6 (4), 816-823 (2021).
- Murai, A., et al. The facial nerve canal in patients with Bell's palsy: an investigation by high-resolution computed tomography with multiplanar reconstruction. Eur Arch Otorhinolaryngol. 270 (7), 2035-2038 (2013).
- Mourad, S. I., Al-Dubai, S. A., Elsayed, S. A., El-Zehary, R. R. Efficacy of platelet-rich fibrin and tacrolimus on facial nerve regeneration: an animal study. Int J Oral Maxillofac Surg. 51 (2), 279-287 (2022).
- Chen, D., Zhang, D., Xu, L., Han, Y., Wang, H. The alterations of matrix metalloproteinase-9 in mouse brainstem during herpes simplex virus type 1-induced facial palsy. J Mol Neurosci. 51 (3), 703-709 (2013).
- Hu, B., et al. Delivery of basic fibroblast growth factor through an in situ forming smart hydrogel activates autophagy in Schwann cells and improves facial nerves generation via the PAK-1 signaling pathway. Front Pharmacol. 13, 778680 (2022).
- Kline, L. B., Kates, M. M., Tavakoli, M. Bell Palsy. JAMA. 326 (19), 1983 (2021).
- Kamble, N., Shukla, D., Bhat, D. Peripheral nerve injuries: Electrophysiology for the neurosurgeon. Neurol India. 67 (6), 1419-1422 (2019).
- Machetanz, K., et al. Design and evaluation of a custom-made electromyographic biofeedback system for facial rehabilitation. Front Neurosci. 16, 666173 (2022).
- Conforti, L., Gilley, J., Coleman, M. P. Wallerian degeneration: an emerging axon death pathway linking injury and disease. Nat Rev Neurosci. 15 (6), 394-409 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados