Method Article
Établissement d’un modèle de rat sur les lésions du nerf facial pour la recherche sur la paralysie faciale idiopathique
Dans cet article
Résumé
Le présent protocole établit un modèle de rat de lésion du nerf facial utilisant la microscopie pour étudier les mécanismes diagnostiques et thérapeutiques de la paralysie faciale idiopathique.
Résumé
La paralysie faciale idiopathique est le type le plus courant de lésion du nerf facial, représentant environ 70 % des cas de paralysie faciale périphérique. Cette maladie peut non seulement entraîner un changement dans l’expression faciale, mais aussi avoir un impact considérable sur la psychologie des patients. Dans les cas graves, elle peut affecter le travail et la vie normaux des patients. Par conséquent, la recherche sur la réparation des lésions du nerf facial a une importance clinique importante. Afin d’étudier le mécanisme de cette maladie, il est nécessaire de réaliser des expériences animales pertinentes, parmi lesquelles la tâche la plus importante est d’établir un modèle animal avec la même pathogenèse que la maladie humaine. La compression du nerf facial à l’intérieur de l’os pétreux, en particulier du tronc nerveux à la jonction de l’extrémité distale du conduit auditif interne et du segment labyrinthique, est la pathogenèse de la paralysie faciale idiopathique. Afin de simuler cette maladie courante, un modèle de blessure par compression du segment extracrânien principal du nerf facial a été établi dans cette étude. Les dommages neurologiques ont été évalués par un examen comportemental, neuroélectrophysiologique et histologique. Enfin, une force constante de 50 g et une blessure par pince de 90 s ont été sélectionnées comme paramètres de blessure pour construire un modèle stable de paralysie faciale idiopathique.
Introduction
En tant que type de paralysie faciale périphérique, la paralysie faciale idiopathique est caractéristique d’étiologie inconnue, d’apparition aiguë et d’évolution auto-résolutive 1,2. L’étiologie et la pathogenèse de la paralysie faciale idiopathique sont encore incertaines3. À l’heure actuelle, il existe différentes méthodes de traitement de la paralysie faciale4, et la diversité des traitements reflète le manque d’options de traitement optimales. L’utilisation de techniques de biologie cellulaire et moléculaire pour étudier le mécanisme des lésions du nerf facial est la base de l’établissement de méthodes de traitement efficaces de la paralysie faciale. Par conséquent, un modèle de lésion du nerf facial adapté et stable est particulièrement important.
À l’heure actuelle, il n’existe pas de méthode standard pour établir un modèle de lésion du nerf facial. Les méthodes de préparation actuelles comprennent l’inoculation du virus5, la transection6, la stimulation par le froid7 et la compression8. On pense que l’infection virale, le vasospasme neurotrophoblastique, l’inflammation auto-immune, etc., peuvent tous provoquer une ischémie locale, une dégénérescence et un œdème du nerf facial 9,10,11. De plus, tous les facteurs ci-dessus peuvent provoquer une compression du tronc principal du nerf facial dans le canal étroit du nerf facial osseux12,13. De plus, les lésions des nerfs périphériques les plus courantes identifiées lors des interventions chirurgicales étaient la compression et la contusion14. Sur la base des théories et des phénomènes cliniques ci-dessus, nous pensons qu’il est plus raisonnable de préparer le modèle de lésion du nerf facial par compression. Cependant, la plupart des méthodes actuelles de mise en œuvre des blessures par compression ne fournissent pas de paramètres quantitatifs de force et de temps. Dans cette étude, nous avons quantifié la force et la durée de la lésion par compression afin d’améliorer la reproductibilité du modèle établi.
Protocole
Toutes les expériences sur les animaux ont été approuvées et supervisées par le Comité d’éthique animale de l’hôpital Xinhua affilié à la faculté de médecine de l’Université Jiaotong de Shanghai (XHEC-F-2023-061). Des rats mâles Sprague-Dawley, de 200 à 300 g, ont été utilisés pour la présente étude. Les animaux ont été obtenus d’une source commerciale (voir la Table des matières). Les rats ont été divisés au hasard en quatre groupes (n = 10) : le groupe de chirurgie simulée, le groupe de blessures de 30 ans, le groupe de blessures de 60 ans et le groupe de blessures de 90 ans.
1. Induction de l’anesthésie et préparation des animaux
- Portez l’équipement de protection individuelle (EPI) suivant : masque chirurgical, gants chirurgicaux, blouse jetable.
- Pesez les rats et anesthésiez-les avec du chlorhydrate de kétamine à une dose de 50 mg/kg par injection intrapéritonéale (i.p.). Administrer du méloxicam (5 mg/kg ; i.p.) pour l’analgésie périopératoire. Confirmez la profondeur de l’anesthésie à l’aide d’un pincement des orteils.
- Appliquez une pommade ophtalmique sur les deux yeux pour éviter le dessèchement.
- Après l’anesthésie, placez les rats en position couchée et fixez la tête de manière à ce que le côté gauche du visage soit vers le haut. Rasez les poils derrière l’oreille gauche et désinfectez la peau. Couvrez le rat avec le champ chirurgical stérile.
2. Etablir un modèle local de lésion par écrasement du tronc extracrânien du nerf facial
REMARQUE : Stérilisez tout l’équipement avant utilisation. Toutes les opérations ont été effectuées dans la salle d’opération.
- Faites une incision longitudinale de 2 cm de long derrière l’oreille gauche et disséquez la peau et le tissu sous-cutané pour séparer l’espace naturel entre les muscles faciaux et cervicaux.
- À l’aide d’une micropince à épiler et de micro-ciseaux, désolidarisez complètement le tronc du nerf facial entre le foramen stylomastoïdien et la glande parotide, avec une longueur exposée d’environ 1 cm.
- Utilisez une pince quantitative pour lésions des nerfs périphériques (Table des matériaux) pour serrer le tronc du nerf facial afin de causer des blessures. Localisez le site de la blessure à 0,5 cm du foramen stylomastoïdien. Appliquez une intensité de blessure de 50 g et un temps de blessure de 30 s, 60 s et 90 s, respectivement.
- Suturez la peau sous-cutanée avec du fil de soie. Désinfectez l’incision.
- Pour les rats du groupe témoin de chirurgie simulée, coupez la peau et le tissu sous-cutané après l’anesthésie et exposez et séparez le tronc principal correspondant du nerf facial. Ensuite, suturez immédiatement l’incision.
- Surveillez la santé de l’animal, maintenez le décubitus sternal et maintenez-le dans des conditions chaudes.
- Ramenez le rat dans la cage d’hébergement une fois qu’il est conscient.
3. Tests comportementaux
REMARQUE : La fonction du nerf facial des rats a été évaluée avant la chirurgie et 48 h après la chirurgie (figure 1). Les scores du réflexe de clignement, du mouvement des palpes et de la position de la pointe nasale ont été calculés15. Plus le score total est élevé, plus le degré de lésion du nerf facial est grave (tableau 1).
- Réflexe de clignement des yeux (BR) :
- Fixez une aiguille de 18 g à une seringue de 2 ml et soufflez de l’air dans l’œil du rat à une distance de 2 cm. Observez le mouvement et la fermeture de la paupière.
- Note selon les critères suivants : Pas de différence significative des deux côtés : 0 point ; Fermeture retardée du côté affecté par rapport au côté sain : 1 point ; Incapacité à fermer la paupière affectée : 2 points.
- Mouvement des vibrisses (VM) :
- Comptez les mouvements bilatéraux des tentacules des rats en 30 s.
- Score selon les critères suivants : Aucune différence significative dans le mouvement bilatéral des tentacules : 0 point ; Le mouvement des moustaches du côté affecté est plus faible que celui du côté sain : 1 point ; Perte de mouvement des moustaches du côté affecté : 2 points.
- Position de la pointe nasale.
- Pointe centrale du nez : 0 point ; Pointe du nez penchée vers le côté sain : 1 point.
REMARQUE : Un score total de 0 point indique normal, 1-2 points indiquent une paralysie faciale légère (parésie), 3-4 points indiquent une paralysie faciale évidente (parésie) et 5 points indiquent une paralysie faciale complète15.
- Pointe centrale du nez : 0 point ; Pointe du nez penchée vers le côté sain : 1 point.
4. Détection neuroélectrophysiologique
REMARQUE : L’électrographie faciale (ENoG) a été réalisée avant la blessure, immédiatement après l’intervention chirurgicale et 48 h après l’intervention (figure 2, tableau 2, tableau 3 et tableau 4).
- Placez l’électrode de mise à la terre sous la peau du membre inférieur gauche.
- Insérez l’électrode d’enregistrement (électrode à aiguille concentrique bipolaire) dans le côté blessé du muscle tentaculaire, avec une profondeur de pénétration de 5 mm.
- Placez l’électrode de stimulation (électrode à aiguille concentrique) sur la membrane du nerf facial. Stimulez séparément les extrémités proximale et distale du nerf facial blessé.
- Utilisez un courant d’impulsion à ondes carrées avec une fréquence de 1 Hz, une largeur d’onde de 0,1 ms et une plage de filtrage de 10 à 3000 Hz.
- Utilisez des stimuli de 2 mA, 5 mA, 10 mA, 15 mA et 20 mA pour induire la génération d’un potentiel d’action musculaire composé.
- Enregistrez la latence (Lm) et l’amplitude de crête (Am) de l’onde M.
REMARQUE : L’onde M fait référence à la première forme d’onde la plus évidente enregistrée. Le point où la forme d’onde quitte la ligne de base est le point de départ de la forme d’onde. La distance entre le point de départ de la ligne de base et le point de départ de la forme d’onde est Lm. La distance entre les pics les plus élevés et les plus bas de la forme d’onde est Am. - Prévoyez un intervalle de 5 minutes entre chaque stimulation pour assurer la récupération nerveuse.
5. Examen histologique
- Après avoir terminé les tests électrophysiologiques, utilisez une micro-pince à épiler pour soulever le nerf et des micro-ciseaux pour couper l’échantillon nerveux. L’échantillon comprend le tronc du nerf facial du point de blessure à la glande parotide, qui est la fibre nerveuse à l’extrémité distale du point de blessure, d’une longueur totale d’environ 0,5 cm.
- Fixer l’échantillon nerveux dans du paraformaldéhyde à 4 % pendant 24 h et préparer des coupes16 incluses dans la paraffine.
- Colorer les sections avec la méthode de coloration à l’hématoxyline-éosine (H&E)16 et acquérir des images à un grossissement de 100x et 400x à l’aide d’un microscope photographique optique (Figure 3).
REMARQUE : Après avoir retiré l’échantillon nerveux et suturé la peau sous anesthésie, les rats ont été euthanasiés par du pentobarbital sodique (150 mg/kg ; i.p.).
Résultats
Tests comportementaux
Avant l’opération, les scores du réflexe de clignement des yeux, du mouvement des palpes et de la position de la pointe nasale étaient de 0 point chez tous les rats expérimentaux, indiquant que tous les rats avaient une fonction nerveuse faciale intacte. Dans l’évaluation de la fonction du nerf facial 48 heures après l’opération, il a été constaté que les scores individuels des rats dans chaque groupe de blessures étaient augmentés. De plus, le score total a augmenté progressivement avec l’allongement du temps de lésion du nerf facial (tableau 1).
Les enregistrements d’activité faciale des rats de chaque groupe 48 h après l’opération ont montré que la symétrie faciale disparaissait progressivement avec l’allongement du temps de blessure. Dans le groupe des blessés des années 30, les visages des rats étaient essentiellement symétriques. Dans le groupe des blessures des années 60 et 90, la pointe nasale des rats s’est déplacée vers le côté sain (côté droit). Ce phénomène était plus prononcé dans le groupe des blessés des années 90 que dans les autres groupes (figure 1).
Détection neuroélectrophysiologique
Avant l’opération, des tests électrophysiologiques ont montré que la stimulation du foramen mastoïdien du nerf facial pouvait générer de manière stable des ondes M (Figure 2A, D, G). Immédiatement après la chirurgie, lors de la stimulation de l’extrémité proximale du site de la blessure, des ondes M ont été enregistrées dans le groupe de blessure de 30 secondes, mais Lm et Am ont été prolongés et diminués. Dans les groupes de blessures des années 60 et 90, aucune onde M n’a été enregistrée. Lors de la stimulation de la partie distale du site de la lésion, les ondes M ont pu être enregistrées de manière stable dans les trois groupes de blessures, et la forme d’onde, Lm et Am étaient cohérentes avec celles d’avant la chirurgie (Figure 2B, E, H). 48 h après la chirurgie, il y avait des différences significatives entre les groupes de blessures (figures 2C, F, I). Dans le groupe blessé dans les années 30, des ondes M ont été enregistrées dans la stimulation proximale et distale. De plus, il n’y avait pas de différence statistiquement significative dans Lm avant et après la chirurgie (voir tableau 2). Dans le groupe blessé des années 60, les ondes M n’ont pas été enregistrées sous stimulation proximale. Sous stimulation distale, 70 % des rats n’ont pas enregistré d’ondes M. Un potentiel d’action musculaire composé (CMAP) significativement affaibli a été enregistré chez 30 % des rats. Les niveaux Lm et Am ont été prolongés et ont diminué de manière significative, respectivement (voir le tableau 3). Pour le groupe blessé dans les années 90, ni la stimulation proximale ni la stimulation distale n’ont montré de CMAP (voir tableau 4).
Examen pathologique
La coloration H&E a montré qu’il n’y avait pas de dommages à l’échantillon du nerf facial dans le groupe de chirurgie simulée, et que la morphologie du nerf facial était complète. Dans le groupe blessé dans les années 30, il n’y avait pas de collapsus axonal significatif ou de démyélinisation du nerf distal au site endommagé, et la morphologie des axones et des gaines de myéline était similaire à celle du groupe témoin. Les noyaux profondément colorés étaient toujours uniformément répartis, et il n’y avait pas d’augmentation significative du nombre. Dans les groupes de lésions des années 60 et 90, des changements de collapsus axonal et de démyélinisation ont été observés dans les nerfs distaux au niveau du site endommagé, avec un gonflement visible des fibres nerveuses et une interruption normale des axones et des gaines de myéline. Sous un microscope de haute puissance (400x), il a été observé que le nombre de noyaux profondément colorés dans l’échantillon était significativement augmenté, et un grand nombre de noyaux ronds sont apparus, considérés comme infiltrants de macrophages. Le noyau aplati original des cellules de Schwann s’est également considérablement élargi. Les changements pathologiques ci-dessus étaient plus prononcés dans le groupe des blessures des années 90 que dans le groupe des blessures des années 60 (figure 3).
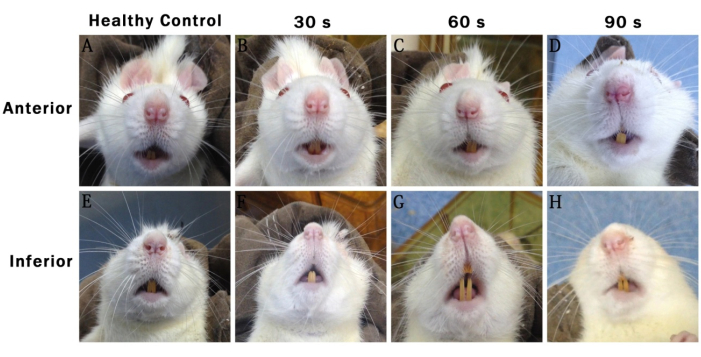
Figure 1 : Photographies représentatives prises 48 h après l’intervention montrant les traits du visage de différents groupes de rats. (A-D) Antérieur : montre la partie avant. (E-H) Inférieur : montre la partie inférieure. Contrôle sain : Groupe de chirurgie simulée. 30-S : Groupe de blessures 30-S. 60-S : Groupe de blessures des années 60. 90 -S : Groupe de blessures des années 90. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Forme d’onde représentative du CMAP induite à la fois proximale et distante au point de lésion nerveuse dans chaque groupe à différents moments. (A,D,G) CMAP généré par stimulation au foramen stylomastoïdien avant la lésion. (B, E, H) CMAP généré par des stimuli distaux et proximaux immédiatement après la blessure. (C, F, I) CMAP généré par des stimuli distaux et proximaux 48 h après la blessure. Dans les B-C, E-F et H-I, les deux rangées supérieures de formes d’onde ont été générées par stimulation distale, tandis que les trois rangées inférieures de formes d’onde ont été générées par stimulation proximale. 30-S : Groupe de blessures 30-S. 60-S : Groupe de blessures des années 60. 90-S : Groupe de blessures des années 90. Veuillez cliquer ici pour voir une version agrandie de cette figure.
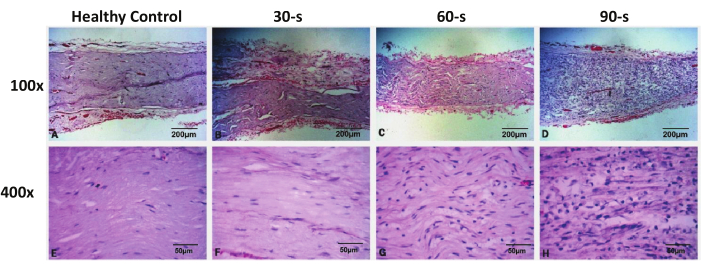
Figure 3 : Images représentatives de la coloration H&E des nerfs faciaux réséqués dans chaque groupe 48 h après la blessure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Groupe de chirurgie simulée | Groupe de blessures des années 30 | Groupe de blessures des années 60 | Groupe de blessures des années 90 | |
| Réflexe de clignement des yeux | 0 ± 0 | 0,5 ± 0,53 | 1,4 ± 0,70 | 2 ± 0 |
| Mouvement des vibrisses | 0 ± 0 | 0,6 ± 0,52 | 1,0 ± 0,67 | 2 ± 0 |
| Position de la pointe nasale | 0 ± 0 | 0,1 ± 0,32 | 0,8 ± 0,42 | 1 ± 0 |
| Note totale | 0 ± 0 | 1,2 ± 0,92 | 3,2 ± 1,23 | 5 ± 0 |
Tableau 1 : Score de la fonction du nerf facial chez le rat 48 h après la chirurgie (n = 10).
| Préopératoire | Immédiatement après une blessure | 48 h après la blessure | |||
| Proximal | Distal | Proximal | Distal | ||
| Lm (ms) | 1,12 ± 0,09 | **1,54 ± 0,12 | 1,13 ± 0,19 | 1,13 ± 0,21 | 1,12 ± 0,13 |
| Am (mv) | 4,16 ± 0,52 | **1,36 ± 0,72 | 4,17 ± 0,63 | *3,83 ± 0,75 | *3,92 ± 1,11 |
Tableau 2 : Latence (Lm) et amplitude (Am) des ondes M à différents moments dans le groupe de blessures de 30 secondes (n = 10). * indique une différence statistique entre les groupes (P < 0,05), ** indique une différence significative entre les groupes (P < 0,01). Tous les résultats ont été comparés à ceux préopératoires.
| Préopératoire | Immédiatement après une blessure | 48 h après la blessure | |||
| Proximal | Distal | Proximal | Δ Distal | ||
| Lm (ms) | 1,12 ± 0,09 | / | 1,12 ± 0,21 | / | **2,04 ± 0,81 |
| Am (mv) | 4,16 ± 0,52 | / | 4,14 ± 0,56 | / | *3,92 ± 1,11 |
Tableau 3 : Latence (Lm) et amplitude (Am) des ondes M à différents moments dans le groupe de blessures de 60 secondes (n = 10). Δ indique que seulement 30 % des rats (n = 3) présentent des ondes M. / indique qu’aucune forme d’onde n’est apparue. * indique une différence statistique entre les groupes (P < 0,05), ** indique une différence significative entre les groupes (P < 0,01). Tous les résultats ont été comparés à ceux préopératoires.
| Préopératoire | Immédiatement après une blessure | 48 h après la blessure | |||
| Proximal | Distal | Proximal | Δ Distal | ||
| Lm (ms) | 1,12 ± 0,09 | / | 1,13 ± 0,11 | / | / |
| Am (mv) | 4,16 ± 0,52 | / | 4,15 ± 0,67 | / | / |
Tableau 4 : Latence (Lm) et amplitude (Am) des ondes M à différents points dans le groupe blessé dans les années 90 (n = 10). / indique qu’aucune forme d’onde n’est apparue.
Discussion
Il est nécessaire d’étudier le mécanisme de réparation des lésions du nerf facial chez les patients atteints de paralysie faciale idiopathique17. Le degré de lésion du nerf facial doit répondre aux exigences suivantes. Tout d’abord, le degré de lésion du nerf facial ne doit pas être trop léger, comme Sunderland Grade 1st degré18, qui peut s’auto-réparer complètement sans intervention médicamenteuse. Deuxièmement, il ne doit pas être trop grave, comme Sunderland 5th degré, qui nécessite une intervention chirurgicale. Troisièmement, le degré de lésion du nerf facial doit être stable et uniforme. Par conséquent, il est important d’intégrer des tests comportementaux, électrophysiologiques et histologiques comme base de sélection du modèle.
Les facteurs affectant la force des blessures par écrasement sont l’ampleur de la force et la durée de l’action. Dans cette étude, nous avons utilisé des pinces quantitatives pour lésions des nerfs périphériques fabriquées par nos soins, avec la force définie comme quantitative (50 g) et le temps d’action comme variables (serrage pendant 30 s, 60 s et 90 s, respectivement). Nous avons noté et évalué le degré de paralysie faciale en observant le réflexe de clignement des yeux, le mouvement des vibrisses et la position de la pointe nasale des rats. Ceci est similaire à l’échelle de House Brackmann (H-B) couramment utilisée dans l’évaluation clinique19. Nous avons constaté que le score total moyen de l’évaluation de la fonction du nerf facial était de 1,2 ± 0,92 point dans le groupe blessé de 30 ans, indiquant une légère paralysie du nerf facial. Lorsque le temps de blessure était de 60 s, le score total moyen était de 3,2 ± 1,23 points, et les rats présentaient des symptômes évidents de paralysie faciale, tels que la disparition du réflexe de clignement, une diminution de l’activité des tentacules et des changements dans la position de la pointe nasale. Dans le groupe des blessés des années 90, tous les rats ont montré une paralysie faciale complète de 5 points.
La détection neuro-électrophysiologique a montré que la stimulation de l’extrémité proximale immédiatement après la blessure indiquait une conduction affaiblie dans le groupe blessé de 30 secondes, tandis que la stimulation des extrémités proximale et distale après 48 h indiquait une récupération partielle de la fonction de conduction. Cela signifiait qu’il y avait une destruction axonale partielle dans le nerf facial endommagé au moment de la blessure. Cependant, ces dommages étaient relativement bénins et la fonction neuroconductrice pouvait s’auto-réparer partiellement. Par conséquent, le modèle du groupe de blessures de 30 ans n’était pas propice à l’observation de l’effet de l’intervention thérapeutique sur la réparation du nerf facial. Pour le groupe blessé dans les années 90, aucune forme d’onde n’a été observée à l’extrémité proximale de la stimulation immédiatement après la blessure, indiquant que tous les axones de la zone locale de la blessure avaient perdu leur fonction de conduction. Cependant, aucune forme d’onde n’a été observée à l’extrémité distale de la stimulation 48 h plus tard, indiquant que tous les nerfs à l’extrémité distale du point de stimulation avaient subi une dégénérescence de Wallerian en 48 h, et que la fonction de conduction nerveuse avait été complètement perdue. À ce moment-là, la forme d’onde ne pouvait pas apparaître naturellement à l’extrémité proximale de la stimulation. Par conséquent, ce modèle convenait à la recherche sur la paralysie faciale idiopathique. Pour le groupe des blessés des années 60, nous avons constaté que les effets électrophysiologiques détectés n’étaient pas stables et ne convenaient pas à des recherches ultérieures.
L’examen de la morphologie tissulaire a révélé qu’il n’y avait presque pas de changement significatif dans le groupe de blessures de 30 secondes 48 heures après la blessure, indiquant que le degré de dommage était léger et avait été essentiellement réparé, conformément au grade 1er de Sunderland. Le groupe blessé des années 60 et le groupe blessé des années 90 présentaient les changements pathologiques précoces typiques de la dégénérescence wallérienne20. Parmi eux, le groupe des lésions des années 90 a montré des changements plus significatifs, tels que la désintégration axonale, la démyélinisation, la prolifération des cellules de Schwann et l’infiltration des macrophages, indiquant un degré de dommages plus graves dans ce groupe. Tous les groupes de lésions n’ont pas endommagé la membrane externe du nerf et le fascicule ; par conséquent, il n’y a pas eu de blessure au quatrième au cinquième degré pour Sunderland.
Bien que ce modèle animal puisse refléter avec précision les caractéristiques de la paralysie du nerf facial, il ne pouvait pas se rapprocher pleinement de l’incidence réelle de la paralysie faciale chez l’homme. Par rapport à d’autres méthodes de préparation, la force et le temps de compression du nerf facial ont été quantifiés dans cette étude, et la préparation du modèle était reproductible. Ce modèle animal sera utile dans le diagnostic et le traitement de la paralysie faciale idiopathique.
Déclarations de divulgation
Les auteurs ont déclaré qu’il n’existe aucun conflit d’intérêts concurrent.
Remerciements
Ce travail a été soutenu par des subventions de projet de la Fondation nationale des sciences naturelles de Chine (82203637) et de la Fondation pour le développement de la science et de la technologie de l’Université de médecine de Nanjing (NMUB20210220).
matériels
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde fixing solution | Beyotime Biotechnology | P0099 | |
| Clean bench | Airtech | ||
| Electronic balance | Shanghai Precision Instrument Factory | AS909 | |
| Freezing microtome | Leica | CM1900 | |
| Hematoxylin eosin (HE) staining kit | Beyotime Biotechnology | C0105S | |
| Ketamine | Sigma | 57074-21-2 | |
| Optical photographic microscope | Olympus | IX90 | |
| Pentobarbital sodium | ChemSrc | 57-33-0 | |
| Quantitative peripheral nerve injury forceps | In-house | Patent number: CN20082015530.3 | |
| Sprague-Dawley rats | Jiangsu Jicui Yaokang Biotechnology Co., Ltd | ||
| Surgical operating microscope | OPMI 1FR proergo | ZEISS |
Références
- Gagyor, I., Madhok, V. B., Daly, F., Sullivan, F. Antiviral treatment for Bell's palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 9 (9), (2019).
- Furukawa, T., et al. The use of basic fibroblast growth factor to treat intractable Bell's palsy administered via transcanal endoscopic ear surgery. Am J Otolaryngol. 45 (1), 104020(2023).
- Qin, Y., et al. To explore the pathogenesis of Bell's palsy using diffusion tensor image. Sci Rep. 13 (1), 15298(2023).
- Teixeira, L. J., Valbuza, J. S., Prado, G. F. Physical therapy for Bell's palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 12 (12), (2011).
- Mu, H., et al. The alterations and significance of intercellular adhesion molecule-1 in mouse brainstem during herpes simplex virus type 1-induced facial palsy. Appl Biochem Biotechnol. 194 (8), 3483-3493 (2022).
- Fujii, K., et al. Accelerated outgrowth in cross-facial nerve grafts wrapped with adipose-derived stem cell sheets. J Tissue Eng Regen Med. 14 (8), 1087-1099 (2020).
- Joko, T., Yamada, H., Kimura, T., Teraoka, M., Hato, N. Non-recovery animal model of severe facial paralysis induced by freezing the facial canal. Auris Nasus Larynx. 47 (5), 778-784 (2020).
- Cai, J., et al. Neuroprotective effect of brimonidine against facial nerve crush injury in rats via suppressing GFAP/PAF activation and neuroinflammation. ORL J Otorhinolaryngol Relat Spec. 83 (6), 449-456 (2021).
- Eviston, T. J., Croxson, G. R., Kennedy, P. G., Hadlock, T., Krishnan, A. V. Bell's palsy: aetiology, clinical features and multidisciplinary care. J Neurol Neurosurg Psychiatry. 86 (12), 1356-1361 (2015).
- Heckmann, J. G., Urban, P. P., Pitz, S., Guntinas-Lichius, O., Gagyor, I. The diagnosis and treatment of idiopathic facial paresis (Bell's Palsy). Dtsch Arztebl Int. 116 (41), 692-702 (2019).
- Zhang, W., et al. The etiology of Bell's palsy: a review. J Neurol. 267 (7), 1896-1905 (2020).
- Touska, P., et al. Computed tomographic features of the proximal petrous facial nerve canal in recurrent Bell's palsy. Laryngoscope Investig Otolaryngol. 6 (4), 816-823 (2021).
- Murai, A., et al. The facial nerve canal in patients with Bell's palsy: an investigation by high-resolution computed tomography with multiplanar reconstruction. Eur Arch Otorhinolaryngol. 270 (7), 2035-2038 (2013).
- Mourad, S. I., Al-Dubai, S. A., Elsayed, S. A., El-Zehary, R. R. Efficacy of platelet-rich fibrin and tacrolimus on facial nerve regeneration: an animal study. Int J Oral Maxillofac Surg. 51 (2), 279-287 (2022).
- Chen, D., Zhang, D., Xu, L., Han, Y., Wang, H. The alterations of matrix metalloproteinase-9 in mouse brainstem during herpes simplex virus type 1-induced facial palsy. J Mol Neurosci. 51 (3), 703-709 (2013).
- Hu, B., et al. Delivery of basic fibroblast growth factor through an in situ forming smart hydrogel activates autophagy in Schwann cells and improves facial nerves generation via the PAK-1 signaling pathway. Front Pharmacol. 13, 778680(2022).
- Kline, L. B., Kates, M. M., Tavakoli, M. Bell Palsy. JAMA. 326 (19), 1983(2021).
- Kamble, N., Shukla, D., Bhat, D. Peripheral nerve injuries: Electrophysiology for the neurosurgeon. Neurol India. 67 (6), 1419-1422 (2019).
- Machetanz, K., et al. Design and evaluation of a custom-made electromyographic biofeedback system for facial rehabilitation. Front Neurosci. 16, 666173(2022).
- Conforti, L., Gilley, J., Coleman, M. P. Wallerian degeneration: an emerging axon death pathway linking injury and disease. Nat Rev Neurosci. 15 (6), 394-409 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon