Method Article
Etablierung eines Modells für die Forschung zur idiopathischen Gesichtslähmung
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll etabliert ein Modell der Gesichtsnervenverletzung bei der Ratte mit Hilfe der Mikroskopie, um die diagnostischen und therapeutischen Mechanismen der idiopathischen Gesichtslähmung zu untersuchen.
Zusammenfassung
Die idiopathische Gesichtslähmung ist die häufigste Art der Gesichtsnervenverletzung und macht etwa 70 % der Fälle von peripherer Gesichtslähmung aus. Diese Krankheit kann nicht nur zu einer Veränderung des Gesichtsausdrucks führen, sondern auch die Psychologie der Patienten stark beeinflussen. In schweren Fällen kann es die normale Arbeit und das Leben der Patienten beeinträchtigen. Daher ist die Forschung zur Reparatur von Gesichtsnervenverletzungen von großer klinischer Bedeutung. Um den Mechanismus dieser Krankheit zu untersuchen, ist es notwendig, entsprechende Tierversuche durchzuführen, von denen die wichtigste Aufgabe darin besteht, ein Tiermodell mit der gleichen Pathogenese wie die menschliche Krankheit zu etablieren. Die Kompression des Nervus facialis innerhalb des Felsenbeins, insbesondere des Nervenstamms an der Verbindung des distalen Endes des Gehörgangs internus mit dem labyrinthischen Segment, ist die Pathogenese der idiopathischen Gesichtslähmung. Um diese häufige Erkrankung zu simulieren, wurde in dieser Studie ein Kompressionsverletzungsmodell des extrakraniellen Hauptsegments des Nervus facialis etabliert. Die neurologische Schädigung wurde durch verhaltensbezogene, neuroelektrophysiologische und histologische Untersuchungen beurteilt. Schließlich wurden 50 g konstante Kraft und 90 s Klemmverletzung als Verletzungsparameter ausgewählt, um ein stabiles idiopathisches Gesichtslähmungsmodell zu konstruieren.
Einleitung
Die idiopathische Gesichtslähmung ist als eine Form der peripheren Gesichtslähmung charakteristisch für unbekannte Ätiologie, akuten Beginn und selbstlimitierenden Verlauf 1,2. Die Ätiologie und Pathogenese der idiopathischen Gesichtslähmung ist noch unklar3. Derzeit gibt es verschiedene Behandlungsmethoden für die Gesichtslähmung4, und die Vielfalt der Behandlungen spiegelt den Mangel an optimalen Behandlungsmöglichkeiten wider. Der Einsatz zellular- und molekularbiologischer Techniken zur Untersuchung des Mechanismus der Gesichtsnervenverletzung ist die Grundlage für die Etablierung wirksamer Behandlungsmethoden für Gesichtslähmungen. Daher ist ein geeignetes und stabiles Modell der Gesichtsnervenverletzung besonders wichtig.
Derzeit gibt es keine Standardmethode für die Etablierung eines Modells für Gesichtsnervenverletzungen. Zu den aktuellen Präparationsmethoden gehören die Virusimpfung5, die Durchtrennung6, die Kältestimulation7 und die Kompressionsmethode8. Es wird angenommen, dass eine Virusinfektion, ein neurotrophoblastischer Vasospasmus, eine Autoimmunentzündung usw. lokale Ischämie, Degeneration und Ödeme des Gesichtsnervs verursachen können 9,10,11. Darüber hinaus können alle oben genannten Faktoren eine Kompression des Hauptstamms des Nervus facialis in dem engen knöchernen Gesichtsnervenkanal verursachen12,13. Darüber hinaus waren die häufigsten peripheren Nervenverletzungen, die bei chirurgischen Eingriffen festgestellt wurden, Kompression und Prellung14. Basierend auf den oben genannten Theorien und klinischen Phänomenen glauben wir, dass die Vorbereitung des Modells der Gesichtsnervenverletzung durch Kompressionsverletzung vernünftiger ist. Die meisten der derzeitigen Methoden zur Durchführung von Kompressionsverletzungen liefern jedoch keine quantitativen Parameter für Kraft und Zeit. In dieser Studie haben wir die Kraft und Dauer der Kompressionsverletzung quantifiziert, um die Reproduzierbarkeit des etablierten Modells zu verbessern.
Protokoll
Alle Tierversuche wurden von der Tierethikkommission des Xinhua-Krankenhauses, das der Shanghai Jiaotong University School of Medicine angegliedert ist, genehmigt und überwacht (XHEC-F-2023-061). Für die vorliegende Studie wurden männliche Sprague-Dawley-Ratten, 200-300 g, verwendet. Die Tiere wurden aus einer kommerziellen Quelle gewonnen (siehe Materialtabelle). Die Ratten wurden nach dem Zufallsprinzip in vier Gruppen (n = 10) eingeteilt: Scheinchirurgie-Gruppe, 30-s-Verletzungsgruppe, 60-s-Verletzungsgruppe und 90-s-Verletzungsgruppe.
1. Einleitung der Anästhesie und Vorbereitung der Tiere
- Tragen Sie die folgende persönliche Schutzausrüstung (PSA): OP-Maske, OP-Handschuhe, Einwegkittel.
- Wiegen Sie die Ratten und betäuben Sie sie mit Ketaminhydrochlorid in einer Dosis von 50 mg/kg durch intraperitoneale (i.p.) Injektion. Meloxicam (5 mg/kg; i.p.) zur perioperativen Analgesie verabreichen. Bestätigen Sie die Tiefe der Anästhesie mit einem Zehenkneifen.
- Tragen Sie eine Augensalbe auf beide Augen auf, um ein Austrocknen zu verhindern.
- Bringen Sie die Ratten nach der Anästhesie in die Bauchlage und fixieren Sie den Kopf so, dass die linke Gesichtshälfte nach oben zeigt. Rasieren Sie die Haare hinter dem linken Ohr ab und desinfizieren Sie die Haut. Decken Sie die Ratte mit dem sterilen OP-Tuch ab.
2. Etablierung eines lokalen Quetschverletzungsmodells des extrakraniellen Rumpfes des Nervus facialis
HINWEIS: Sterilisieren Sie alle Geräte vor dem Gebrauch. Alle Operationen wurden im Operationssaal durchgeführt.
- Machen Sie einen 2 cm langen Längsschnitt hinter dem linken Ohr und präparieren Sie die Haut und das Unterhautgewebe, um den natürlichen Spalt zwischen Gesichts- und Halsmuskulatur zu trennen.
- Verwenden Sie eine Mikropinzette und eine Mikroschere, um den Stamm des Gesichtsnervs zwischen dem Foramen stylomastoideus und der Ohrspeicheldrüse mit einer freiliegenden Länge von ca. 1 cm vollständig zu dissoziieren.
- Verwenden Sie eine quantitative Verletzungszange des peripheren Nerven (Materialtabelle), um den Stamm des Gesichtsnervs zu klemmen, um eine Verletzung zu verursachen. Lokalisieren Sie die Verletzungsstelle 0,5 cm vom Foramen stylomastoideus. Wenden Sie eine Verletzungsintensität von 50 g und eine Verletzungszeit von 30 s, 60 s bzw. 90 s an.
- Nähen Sie die Unterhaut und die Haut mit Seidenfaden. Desinfizieren Sie den Schnitt.
- Bei Ratten in der scheinchirurgischen Kontrollgruppe schneiden Sie nach der Anästhesie die Haut und das Unterhautgewebe und legen den entsprechenden Hauptstamm des Gesichtsnervs frei und trennen ihn. Als nächstes nähten Sie den Schnitt sofort.
- Überwachen Sie die Gesundheit des Tieres, halten Sie das Brustbein liegend und halten Sie es unter warmen Bedingungen.
- Bringen Sie die Ratte zurück in den Käfig, nachdem die Ratte bei Bewusstsein ist.
3. Verhaltenstests
HINWEIS: Die Funktion des Gesichtsnervs der Ratten wurde vor der Operation und 48 Stunden nach der Operation untersucht (Abbildung 1). Die Werte für den Blinzelreflex, die Palpbewegung und die Position der Nasenspitze wurden berechnet15. Je höher die Gesamtpunktzahl, desto schwerer ist der Grad der Gesichtsnervenverletzung (Tabelle 1).
- Blinzelreflex (BR):
- Befestigen Sie eine 18-G-Nadel an einer 2-ml-Spritze und blasen Sie aus einer Entfernung von 2 cm Luft in das Auge der Ratte. Beobachten Sie die Bewegung und den Verschluss der Augenlider.
- Punktzahl nach folgenden Kriterien: Kein signifikanter Unterschied auf beiden Seiten: 0 Punkte; Verzögerter Verschluss der betroffenen Seite im Vergleich zur gesunden Seite: 1 Punkt; Unfähigkeit, das betroffene Augenlid zu schließen: 2 Punkte.
- Vibrissae Bewegung (VM):
- Zählen Sie die beidseitigen Tentakelbewegungen von Ratten innerhalb von 30 s.
- Punktzahl nach folgenden Kriterien: Kein signifikanter Unterschied in der bilateralen Tentakelbewegung: 0 Punkte; Die Bewegung der Schnurrhaare der betroffenen Seite ist schwächer als die der gesunden Seite: 1 Punkt; Verlust der Schnurrhaarbewegung auf der betroffenen Seite: 2 Punkte.
- Position der Nasenspitze.
- Nasenspitze in der Mitte: 0 Punkte; Nasenspitze zur gesunden Seite geneigt: 1 Punkt.
HINWEIS: Eine Gesamtpunktzahl von 0 Punkten bedeutet normal, 1-2 Punkte weisen auf eine leichte Gesichtslähmung (Parese) hin, 3-4 Punkte auf eine offensichtliche Gesichtslähmung (Parese) und 5 Punkte auf eine vollständige Gesichtslähmung15.
- Nasenspitze in der Mitte: 0 Punkte; Nasenspitze zur gesunden Seite geneigt: 1 Punkt.
4. Neuroelektrophysiologische Detektion
HINWEIS: Die Gesichtselektrographie (ENoG) wurde vor der Verletzung, unmittelbar nach der Operation und 48 Stunden nach der Operation durchgeführt (Abbildung 2, Tabelle 2, Tabelle 3 und Tabelle 4).
- Platzieren Sie die Erdungselektrode unter der Haut der linken unteren Extremität.
- Führen Sie die Aufzeichnungselektrode (bipolare konzentrische Nadelelektrode) mit einer Eindringtiefe von 5 mm in die verletzte Seite des Tentakelmuskels ein.
- Platzieren Sie die Stimulationselektrode (konzentrische Nadelelektrode) auf der Gesichtsnervenmembran. Stimulieren Sie die proximalen und distalen Enden des verletzten Gesichtsnervs getrennt.
- Verwenden Sie einen Rechteckimpulsstrom mit einer Frequenz von 1 Hz, einer Wellenbreite von 0,1 ms und einem Filterbereich von 10-3000 Hz.
- Verwenden Sie Stimuli von 2 mA, 5 mA, 10 mA, 15 mA und 20 mA, um die Erzeugung eines zusammengesetzten Muskelaktionspotentials zu induzieren.
- Zeichnen Sie die Latenz (Lm) und die Spitzenamplitude (Am) der M-Welle auf.
HINWEIS: Die M-Welle bezieht sich auf die erste und offensichtlichste aufgezeichnete Wellenform. Der Punkt, an dem die Wellenform die Grundlinie verlässt, ist der Startpunkt der Wellenform. Der Abstand vom Startpunkt der Basislinie zum Startpunkt der Wellenform beträgt Lm. Der Abstand zwischen der höchsten und der niedrigsten Spitze der Wellenform ist Am. - Lassen Sie zwischen den einzelnen Stimulationen ein Intervall von 5 Minuten ein, um die Erholung der Nerven zu gewährleisten.
5. Histologische Untersuchung
- Verwenden Sie nach Abschluss der elektrophysiologischen Tests eine Mikropinzette, um den Nerv anzuheben, und eine Mikroschere, um die Nervenprobe zu schneiden. Die Probe umfasst den Stamm des Nervus facialis von der Verletzungsstelle bis zur Ohrspeicheldrüse, die die Nervenfaser am distalen Ende der Verletzungsstelle darstellt, mit einer Gesamtlänge von etwa 0,5 cm.
- Die Nervenprobe wird 24 h lang in 4%igem Paraformaldehyd fixiert und die in Paraffin eingebetteten Schnittevorbereitet 16.
- Die Schnitte werden mit der Hämatoxylin-Eosin-Färbemethode (H&E)16 gefärbt und mit einem optischen Fotomikroskop Bilder bei 100- und 400-facher Vergrößerung aufgenommen (Abbildung 3).
HINWEIS: Nach der Entnahme der Nervenprobe und dem Nähen der Haut unter Narkose wurden die Ratten mit Pentobarbital-Natrium (150 mg/kg; i.p.) euthanasiert.
Ergebnisse
Verhaltenstests
Vor der Operation betrugen die Werte für den Blinzelreflex, die Palpbewegung und die Position der Nasenspitze bei allen Versuchsratten 0 Punkte, was darauf hindeutet, dass alle Ratten eine intakte Funktion des Gesichtsnervs hatten. Bei der Beurteilung der Funktion des Gesichtsnervs 48 h nach der Operation wurde festgestellt, dass die individuellen Werte der Ratten in jeder Verletzungsgruppe erhöht waren. Darüber hinaus stieg die Gesamtpunktzahl mit zunehmender Verlängerung der Verletzungszeit des Gesichtsnervs allmählich an (Tabelle 1).
Die Aufzeichnungen der Gesichtsaktivität von Ratten in jeder Gruppe 48 Stunden nach der Operation zeigten, dass die Gesichtssymmetrie mit zunehmender Verlängerung der Verletzungszeit allmählich verschwand. In der 30-jährigen Verletzungsgruppe waren die Gesichter der Ratten grundsätzlich symmetrisch. In der 60er-Verletzungsgruppe und der 90er-Verletzungsgruppe verschob sich die Nasenspitze der Ratten in Richtung der gesunden Seite (rechte Seite). Dieses Phänomen war in der Verletzungsgruppe der 90er Jahre stärker ausgeprägt als in anderen Gruppen (Abbildung 1).
Neuroelektrophysiologische Detektion
Vor der Operation ergaben elektrophysiologische Tests, dass die Stimulation des Foramen mastoidoide des Gesichtsnervs stabil M-Wellen erzeugen konnte (Abbildung 2A,D,G). Unmittelbar nach der Operation, bei der Stimulation des proximalen Endes der Verletzungsstelle, wurden in der 30-jährigen Verletzungsgruppe M-Wellen aufgezeichnet, aber sowohl Lm als auch Am waren verlängert und verringert. In den Verletzungsgruppen der 60er und 90er Jahre wurden keine M-Wellen aufgezeichnet. Bei der Stimulation des distalen Teils der Verletzungsstelle konnten M-Wellen in allen drei Verletzungsgruppen stabil aufgezeichnet werden, und die Wellenformen Lm und Am stimmten mit denen vor der Operation überein (Abbildung 2B, E, H). 48 h nach der Operation zeigten sich signifikante Unterschiede zwischen den Verletzungsgruppen (Abbildung 2C,F,I). In der 30-jährigen Verletzungsgruppe wurden M-Wellen sowohl bei proximaler als auch bei distaler Stimulation aufgezeichnet. Darüber hinaus gab es keinen statistisch signifikanten Unterschied in der Lm vor und nach der Operation (siehe Tabelle 2). In der 60-jährigen Verletzungsgruppe wurden M-Wellen unter proximaler Stimulation nicht aufgezeichnet. Unter distaler Stimulation zeichneten 70% der Ratten keine M-Wellen auf. Ein signifikant geschwächtes Compound Muscle Action Potential (CMAP) wurde bei 30% der Ratten festgestellt. Die Lm und Am waren signifikant verlängert bzw. verringert (siehe Tabelle 3). Für die 90-jährige Verletzungsgruppe zeigte weder eine proximale noch eine distale Stimulation eine CMAP (siehe Tabelle 4).
Pathologische Untersuchung
Die H&E-Färbung zeigte, dass die Gesichtsnervenprobe in der Scheinoperationsgruppe nicht beschädigt war und die Morphologie des Gesichtsnervs vollständig war. In der 30-jährigen Verletzungsgruppe gab es keinen signifikanten axonalen Kollaps oder eine Demyelinisierung des distalen Nervs an der geschädigten Stelle, und die Morphologie der Axone und Myelinscheiden war ähnlich wie in der Kontrollgruppe. Die tief gefärbten Zellkerne waren immer noch gleichmäßig verteilt, und es gab keine signifikante Zunahme der Anzahl. Sowohl in der 60er- als auch in der 90er-Verletzungsgruppe wurden axonale Kollaps- und Demyelinisierungsveränderungen in den distalen Nerven an der geschädigten Stelle beobachtet, mit sichtbarer Schwellung der Nervenfasern und normaler Unterbrechung der Axone und Myelinscheiden. Unter einem Hochleistungsmikroskop (400x) wurde beobachtet, dass die Anzahl der tief gefärbten Kerne in der Probe signifikant erhöht war und eine große Anzahl von runden Kernen auftrat, die als infiltrierende Makrophagen angesehen wurden. Auch der ursprünglich abgeflachte Schwann-Zellkern wurde deutlich vergrößert. Die oben genannten pathologischen Veränderungen waren in der Verletzungsgruppe der 90er Jahre ausgeprägter als in der Verletzungsgruppe der 60er Jahre (Abbildung 3).
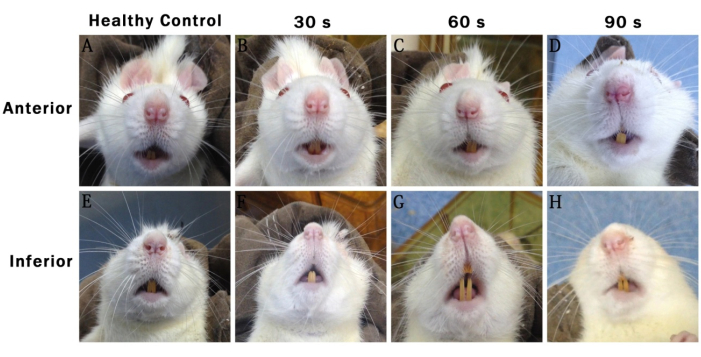
Abbildung 1: Repräsentative Fotos, die 48 Stunden nach der Operation aufgenommen wurden und die Gesichtszüge verschiedener Gruppen von Ratten zeigen. (A-D) Anterior: zeigt den vorderen Teil. (E-H) Minderwertig: zeigt den unteren Teil. Gesunde Kontrolle: Gruppe für Scheinchirurgie. 30-S: 30-S-Verletztengruppe. 60er: 60er-Verletztengruppe. 90 -S: 90er Verletzungsgruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentative Wellenform von CMAP, die sowohl proximal als auch entfernt zum Nervenverletzungspunkt in jeder Gruppe zu unterschiedlichen Zeitpunkten induziert wurde. (A,D,G) CMAP, erzeugt durch Stimulation am Foramen stylomastoideus vor der Verletzung. (B,E,H) CMAP, die durch distale und proximale Stimuli unmittelbar nach der Verletzung erzeugt wird. (C,F,I) CMAP, erzeugt durch distale und proximale Stimuli 48 h nach der Verletzung. In B-C, E-F und H-I wurden die oberen beiden Wellenformreihen durch distale Stimulation erzeugt, während die unteren drei Wellenformreihen durch proximale Stimulation erzeugt wurden. 30-S: 30-S-Verletztengruppe. 60er: 60er-Verletztengruppe. 90er: 90er-Verletztengruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
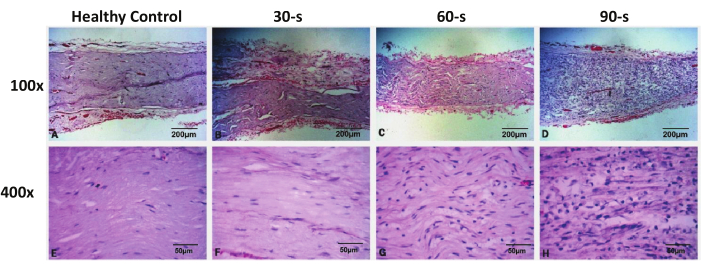
Abbildung 3: Repräsentative H&E-Färbebilder von resezierten Gesichtsnerven in jeder Gruppe 48 h nach der Verletzung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Gruppe für Scheinchirurgie | 30er Verletzungsgruppe | 60er Verletzungsgruppe | 90er-Jahre-Verletzungsgruppe | |
| Blinzelreflex | 0 ± 0 | 0,5 ± 0,53 | 1,4 ± 0,70 | 2 ± 0 |
| Vibrissae Bewegung | 0 ± 0 | 0,6 ± 0,52 | 1,0 ± 0,67 | 2 ± 0 |
| Position der Nasenspitze | 0 ± 0 | 0,1 ± 0,32 | 0,8 ± 0,42 | 1 ± 0 |
| Gesamtpunktzahl | 0 ± 0 | 1,2 ± 0,92 | 3,2 ± 1,23 | 5 ± 0 |
Tabelle 1: Score der Gesichtsnervenfunktion der Ratte 48 h nach der Operation (n=10).
| Präoperativ | Unmittelbar nach der Verletzung | 48 h nach der Verletzung | |||
| Proximal | Distal | Proximal | Distal | ||
| Lm (ms) | 1,12 ± 0,09 | 1,54 ± 0,12 | 1,13 ± 0,19 | 1,13 ± 0,21 | 1,12 ± 0,13 |
| Am (mv) | 4,16 ± 0,52 | 1,36 ± 0,72 | 4,17 ± 0,63 | *3,83 ± 0,75 | *3,92 ± 1,11 |
Tabelle 2: Latenz (Lm) und Amplitude (Am) von M-Wellen zu verschiedenen Zeitpunkten in der 30-s-Verletzungsgruppe (n = 10). * zeigt einen statistischen Unterschied zwischen den Gruppen an (P < 0,05), ** zeigt einen signifikanten Unterschied zwischen den Gruppen an (P < 0,01). Alle Ergebnisse wurden mit präoperativ verglichen.
| Präoperativ | Unmittelbar nach der Verletzung | 48 h nach der Verletzung | |||
| Proximal | Distal | Proximal | Δ Distal | ||
| Lm (ms) | 1,12 ± 0,09 | / | 1,12 ± 0,21 | / | **2,04 ± 0,81 |
| Am (mv) | 4,16 ± 0,52 | / | 4,14 ± 0,56 | / | *3,92 ± 1,11 |
Tabelle 3: Latenz (Lm) und Amplitude (Am) von M-Wellen zu verschiedenen Zeitpunkten in der 60-s-Verletzungsgruppe (n = 10). Δ zeigt an, dass nur 30% der Ratten (n = 3) M-Wellen aufweisen. / zeigt an, dass keine Wellenform angezeigt wurde. * zeigt die statistische Differenz zwischen den Gruppen an (P < 0,05), ** zeigt eine signifikante Differenz zwischen den Gruppen an (P < 0,01). Alle Ergebnisse wurden mit präoperativ verglichen.
| Präoperativ | Unmittelbar nach der Verletzung | 48 h nach der Verletzung | |||
| Proximal | Distal | Proximal | Δ Distal | ||
| Lm (ms) | 1,12 ± 0,09 | / | 1,13 ± 0,11 | / | / |
| Am (mv) | 4,16 ± 0,52 | / | 4,15 ± 0,67 | / | / |
Tabelle 4: Latenz (Lm) und Amplitude (Am) von M-Wellen zu verschiedenen Zeitpunkten in der 90er-Jahre-Verletzungsgruppe (n = 10). / zeigt an, dass keine Wellenform angezeigt wurde.
Diskussion
Es ist notwendig, den Reparaturmechanismus der Gesichtsnervenverletzung bei Patienten mit idiopathischer Gesichtslähmung zu untersuchen17. Das Modell für den Grad der Gesichtsnervenverletzung sollte die folgenden Anforderungen erfüllen. Erstens sollte der Grad der Gesichtsnervenverletzung nicht zu mild sein, wie z. B. Sunderland Grad 1st Grad18, der sich ohne medikamentöse Intervention vollständig selbst reparieren kann. Zweitens sollte es nicht zu schwerwiegend sein, wie z. B. Sunderland 5. Grades, der einen chirurgischen Eingriff erfordert. Drittens sollte der Grad der Verletzung des Gesichtsnervs stabil und gleichmäßig sein. Daher ist es wichtig, verhaltensbezogene, elektrophysiologische und histologische Tests als Grundlage für die Modellauswahl zu integrieren.
Die Faktoren, die die Stärke der Quetschverletzung beeinflussen, sind die Größe der Kraft und die Dauer der Wirkung. In dieser Studie verwendeten wir selbstgebaute quantitative Verletzungszangen für periphere Nerven, wobei die Kraft als quantitativ (50 g) und die Aktionszeit als Variablen (Klemmen für 30 s, 60 s bzw. 90 s) eingestellt wurden. Wir bewerteten und bewerteten den Grad der Gesichtslähmung, indem wir den Blinzelreflex, die Vibrissae-Bewegung und die Position der Nasenspitze der Ratten beobachteten. Dies ähnelt der Haus-Brackmann-Skala (H-B), die häufig in der klinischen Bewertung verwendet wird19. Wir fanden heraus, dass die durchschnittliche Gesamtpunktzahl der Beurteilung der Gesichtsnervenfunktion 1,2 ± 0,92 Punkte in der 30-jährigen Verletzungsgruppe betrug, was auf eine leichte Gesichtsnervenlähmung hindeutet. Bei einer Verletzungszeit von 60 Sekunden betrug die durchschnittliche Gesamtpunktzahl 3,2 ± 1,23 Punkte, und die Ratten zeigten offensichtliche Symptome einer Gesichtslähmung, wie das Verschwinden des Blinzelreflexes, verminderte Tentakelaktivität und Veränderungen in der Position der Nasenspitze. In der Verletzungsgruppe der 90er Jahre zeigten alle Ratten eine vollständige Gesichtslähmung von 5 Punkten.
Der neuro-elektrophysiologische Nachweis zeigte, dass die Stimulation des proximalen Endes unmittelbar nach der Verletzung auf eine geschwächte Überleitung in der 30-jährigen Verletzungsgruppe hindeutete, während die Stimulation der proximalen und distalen Enden nach 48 h auf eine teilweise Wiederherstellung der Leitungsfunktion hindeutete. Dies bedeutete, dass es im Moment der Verletzung zu einer teilweisen axonalen Zerstörung des geschädigten Gesichtsnervs kam. Dieser Schaden war jedoch relativ mild, und die neurokonduktive Funktion konnte sich teilweise selbst reparieren. Daher war das Modell der 30-Sekunden-Verletzungsgruppe nicht förderlich, um die Wirkung therapeutischer Interventionen auf die Reparatur des Gesichtsnervs zu beobachten. Für die 90-s-Verletzungsgruppe wurde keine Wellenform am proximalen Ende der Stimulation unmittelbar nach der Verletzung beobachtet, was darauf hindeutet, dass alle Axone im lokalen Bereich der Verletzung die Leitungsfunktion verloren hatten. 48 Stunden später wurde jedoch keine Wellenform am distalen Ende der Stimulation beobachtet, was darauf hindeutet, dass alle Nerven am distalen Ende des Stimulationspunktes innerhalb von 48 Stunden eine Wallersche Degeneration durchlaufen hatten und die Nervenleitungsfunktion vollständig verloren gegangen war. Zu diesem Zeitpunkt konnte die Wellenform nicht auf natürliche Weise am proximalen Ende der Stimulation erscheinen. Daher eignete sich dieses Modell für die Forschung zur idiopathischen Gesichtslähmung. Für die 60-jährige Verletzungsgruppe stellten wir fest, dass die detektierten elektrophysiologischen Effekte nicht stabil waren und nicht für nachfolgende Untersuchungen geeignet waren.
Die gewebemorphologische Untersuchung ergab, dass es 48 h nach der Verletzung fast keine signifikante Veränderung in der 30-s-Verletzungsgruppe gab, was darauf hindeutet, dass der Grad der Schädigung mild war und im Wesentlichen repariert worden war, in Übereinstimmung mit dem Sunderland Grad 1. Grades. Sowohl die Verletzungsgruppe der 60er Jahre als auch die Verletzungsgruppe der 90er Jahre zeigten die typischen frühen pathologischen Veränderungen der Wallerschen Degeneration20. Unter ihnen zeigte die Verletzungsgruppe der 90er Jahre signifikantere Veränderungen, wie z. B. axonalen Desintegration, Demyelinisierung, Schwann-Zellproliferation und Makrophageninfiltration, was auf einen schwereren Grad der Schädigung in dieser Gruppe hindeutet. Alle Verletzungsgruppen schädigten die äußere Membran und den Fasciculus des Nervs nicht; daher gab es bei Sunderland keine Verletzung vierten bis fünften Grades.
Obwohl dieses Tiermodell die Merkmale der Gesichtsnervenlähmung genau widerspiegeln konnte, konnte es die tatsächliche Inzidenz von Gesichtslähmungen beim Menschen nicht vollständig annähern. Im Vergleich zu anderen Präparationsmethoden wurden in dieser Studie die Kraft und der Zeitpunkt der Kompression des Gesichtsnervs quantifiziert, und die Modellpräparation war wiederholbar. Dieses Tiermodell wird bei der Diagnose und Behandlung der idiopathischen Fazialisparese hilfreich sein.
Offenlegungen
Die Autoren erklärten, dass keine konkurrierenden Interessenkonflikte bestehen.
Danksagungen
Diese Arbeit wurde durch Projektzuschüsse der National Natural Science Foundation of China (82203637) und der Science and Technology Development Foundation der Nanjing Medical University (NMUB20210220) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde fixing solution | Beyotime Biotechnology | P0099 | |
| Clean bench | Airtech | ||
| Electronic balance | Shanghai Precision Instrument Factory | AS909 | |
| Freezing microtome | Leica | CM1900 | |
| Hematoxylin eosin (HE) staining kit | Beyotime Biotechnology | C0105S | |
| Ketamine | Sigma | 57074-21-2 | |
| Optical photographic microscope | Olympus | IX90 | |
| Pentobarbital sodium | ChemSrc | 57-33-0 | |
| Quantitative peripheral nerve injury forceps | In-house | Patent number: CN20082015530.3 | |
| Sprague-Dawley rats | Jiangsu Jicui Yaokang Biotechnology Co., Ltd | ||
| Surgical operating microscope | OPMI 1FR proergo | ZEISS |
Referenzen
- Gagyor, I., Madhok, V. B., Daly, F., Sullivan, F. Antiviral treatment for Bell's palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 9 (9), (2019).
- Furukawa, T., et al. The use of basic fibroblast growth factor to treat intractable Bell's palsy administered via transcanal endoscopic ear surgery. Am J Otolaryngol. 45 (1), 104020(2023).
- Qin, Y., et al. To explore the pathogenesis of Bell's palsy using diffusion tensor image. Sci Rep. 13 (1), 15298(2023).
- Teixeira, L. J., Valbuza, J. S., Prado, G. F. Physical therapy for Bell's palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 12 (12), (2011).
- Mu, H., et al. The alterations and significance of intercellular adhesion molecule-1 in mouse brainstem during herpes simplex virus type 1-induced facial palsy. Appl Biochem Biotechnol. 194 (8), 3483-3493 (2022).
- Fujii, K., et al. Accelerated outgrowth in cross-facial nerve grafts wrapped with adipose-derived stem cell sheets. J Tissue Eng Regen Med. 14 (8), 1087-1099 (2020).
- Joko, T., Yamada, H., Kimura, T., Teraoka, M., Hato, N. Non-recovery animal model of severe facial paralysis induced by freezing the facial canal. Auris Nasus Larynx. 47 (5), 778-784 (2020).
- Cai, J., et al. Neuroprotective effect of brimonidine against facial nerve crush injury in rats via suppressing GFAP/PAF activation and neuroinflammation. ORL J Otorhinolaryngol Relat Spec. 83 (6), 449-456 (2021).
- Eviston, T. J., Croxson, G. R., Kennedy, P. G., Hadlock, T., Krishnan, A. V. Bell's palsy: aetiology, clinical features and multidisciplinary care. J Neurol Neurosurg Psychiatry. 86 (12), 1356-1361 (2015).
- Heckmann, J. G., Urban, P. P., Pitz, S., Guntinas-Lichius, O., Gagyor, I. The diagnosis and treatment of idiopathic facial paresis (Bell's Palsy). Dtsch Arztebl Int. 116 (41), 692-702 (2019).
- Zhang, W., et al. The etiology of Bell's palsy: a review. J Neurol. 267 (7), 1896-1905 (2020).
- Touska, P., et al. Computed tomographic features of the proximal petrous facial nerve canal in recurrent Bell's palsy. Laryngoscope Investig Otolaryngol. 6 (4), 816-823 (2021).
- Murai, A., et al. The facial nerve canal in patients with Bell's palsy: an investigation by high-resolution computed tomography with multiplanar reconstruction. Eur Arch Otorhinolaryngol. 270 (7), 2035-2038 (2013).
- Mourad, S. I., Al-Dubai, S. A., Elsayed, S. A., El-Zehary, R. R. Efficacy of platelet-rich fibrin and tacrolimus on facial nerve regeneration: an animal study. Int J Oral Maxillofac Surg. 51 (2), 279-287 (2022).
- Chen, D., Zhang, D., Xu, L., Han, Y., Wang, H. The alterations of matrix metalloproteinase-9 in mouse brainstem during herpes simplex virus type 1-induced facial palsy. J Mol Neurosci. 51 (3), 703-709 (2013).
- Hu, B., et al. Delivery of basic fibroblast growth factor through an in situ forming smart hydrogel activates autophagy in Schwann cells and improves facial nerves generation via the PAK-1 signaling pathway. Front Pharmacol. 13, 778680(2022).
- Kline, L. B., Kates, M. M., Tavakoli, M. Bell Palsy. JAMA. 326 (19), 1983(2021).
- Kamble, N., Shukla, D., Bhat, D. Peripheral nerve injuries: Electrophysiology for the neurosurgeon. Neurol India. 67 (6), 1419-1422 (2019).
- Machetanz, K., et al. Design and evaluation of a custom-made electromyographic biofeedback system for facial rehabilitation. Front Neurosci. 16, 666173(2022).
- Conforti, L., Gilley, J., Coleman, M. P. Wallerian degeneration: an emerging axon death pathway linking injury and disease. Nat Rev Neurosci. 15 (6), 394-409 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten