Method Article
Гибкая камера для покадровой визуализации живых клеток с помощью микроскопии со стимулированным комбинационным рассеянием света
В этой статье
Резюме
Мы сообщаем о том, что в верхней части сцены используется гибкая экологическая камера для покадровой визуализации живых клеток с использованием вертикальной вынужденной микроскопии комбинационного рассеяния света с детектированием передаваемого сигнала. Липидные капли визуализировали в клетках SKOV3, обработанных олеиновой кислотой, в течение 24 ч с интервалом времени 3 мин.
Аннотация
Микроскопия с вынужденным комбинационным рассеянием света (SRS) представляет собой технологию химической визуализации без меток. Визуализация живых клеток с помощью SRS была продемонстрирована для многих биологических и биомедицинских применений. Тем не менее, долгосрочная покадровая SRS-визуализация живых клеток не получила широкого распространения. В микроскопии SRS часто используется объектив с высокой числовой апертурой (NA) и масляный конденсатор с высоким содержанием NA для получения изображений с высоким разрешением. В этом случае зазор между объективом и конденсатором составляет всего несколько миллиметров. Поэтому большинство коммерческих сценических экологических камер не могут быть использованы для визуализации SRS из-за их большой толщины с жесткой стеклянной крышкой. В этой статье описывается конструкция и изготовление гибкой камеры, которая может быть использована для покадровой визуализации живых клеток с детектированием передаваемого сигнала SRS на вертикальной рамке микроскопа. Гибкость камеры достигается за счет использования мягкого материала – тонкой пленки натурального каучука. Новая конструкция корпуса и камеры может быть легко добавлена к существующей установке визуализации SRS. Испытания и предварительные результаты показывают, что гибкая камерная система обеспечивает стабильную, долгосрочную, покадровую SRS-визуализацию живых клеток, которая может быть использована для различных приложений биовизуализации в будущем.
Введение
Оптическая микроскопия используется для наблюдения за микроструктурами образцов. Оптическая визуализация является быстрой, менее инвазивной и менее разрушительной, чем другие технологии1. Визуализация живых клеток с помощью оптической микроскопии разработана для захвата динамики культивируемых живых клеток в течение длительного периода2. Различные типы оптических контрастов предоставляют различную информацию о биологических образцах. Например, оптическая фазовая микроскопия показывает тонкую разницу в показателях преломления в образце3. Флуоресцентная микроскопия широко используется для визуализации конкретных биомолекул или клеточных органелл. Однако широкополосные спектры возбуждения и излучения флуоресценции обычно приводят к спектральному перекрытию при выполнении многоцветной визуализации4. Флуоресцентные молекулы светочувствительны и могут быть обесцвечены после длительного периодического воздействия света. Кроме того, флуоресцентная маркировка может изменить биораспределение молекул в клетках5. Микроскопия SRS - это технология химической визуализации без меток6. Контраст SRS основан на колебательном переходе определенных химических связей. Колебательная частота химической связи часто имеет узкую спектральную полосу пропускания, что позволяет получать изображения нескольких полос комбинационного рассеяния света в одних и тех же образцах7. Микроскопия SRS — это уникальный инструмент для визуализации живых клеток, обеспечивающий множественные химические контрасты без меток8.
В то время как SRS-визуализация неокрашенных клеток использовалась для многих исследований, долгосрочная покадровая SRS-визуализация живых клеток не получила широкого распространения. Одна из причин заключается в том, что коммерческие открытые камеры не могут быть непосредственно использованы для визуализации SRS из-за их большой толщины 9,10,11,12. Эти камеры со стеклянной крышкой в основном предназначены для визуализации светлого поля или флуоресценции с использованием одного объектива с высоким уровнем NA со схемой обратного обнаружения. Тем не менее, SRS-визуализация предпочитает передаваемое обнаружение с использованием как объектива с высоким NA, так и конденсатора с высоким NA, что оставляет только очень короткий зазор (обычно несколько миллиметров) между объективом и конденсатором. Чтобы преодолеть эту проблему, мы разработали гибкую камеру с использованием мягкого материала, чтобы обеспечить покадровую SRS-визуализацию живых клеток с использованием вертикальной рамки микроскопа. В этой конструкции объектив для погружения в воду был заключен в мягкую камеру и может свободно перемещаться в трех измерениях для фокусировки и визуализации.
Оптимальная температура для культивирования большинства клеток млекопитающих составляет 37 ° C, в то время как температура в помещении всегда на 10 ° ниже. Температура выше или ниже 37 °C оказывает существенное влияние на скорость роста клеток13. Поэтому в системе визуализации живых клеток требуется контроль температуры среды клеточных культур. Известно, что температурная нестабильность приведет к проблемам с расфокусировкой при длительной визуализации14. Для достижения стабильной температуры 37 °C мы построили большую камеру корпуса, которая покрывает всю раму микроскопа, включая теплоизоляционный слой под микроскопом (рис. 1). В большой камере контроля температуры небольшая гибкая камера помогает точно поддерживать физиологическую влажность и рН за счет регулируемого воздушного потока, дополненного 5% CO 2 (рис. 2). Температура и влажность камер были измерены, чтобы подтвердить, что двухкамерная конструкция обеспечивает оптимальные условия культивирования клеток для роста клеток при длительной периодической визуализации SRS (рис. 3). Затем мы продемонстрировали применение системы для покадровой визуализации и отслеживания липидных капель (LD) в раковых клетках SKOV3 (рис. 4, рис. 5 и рис. 6).
протокол
1. Постройте экологический корпус микроскопа
ПРИМЕЧАНИЕ: Этот большой корпус микроскопа используется для контроля температуры корпуса микроскопа и среды визуализации, которая должна быть стабилизирована при 37 ° C (рис. 1A).
- Отметьте расположение ножек рамы микроскопа SRS и моторизованного столика с помощью маркера на оптическом столе. Установите две диафрагмы радужной оболочки перед сканером гальванометра микроскопа и отрегулируйте так, чтобы лазерные лучи накачки и Стокса проходили через центр диафрагмы радужной оболочки.
- Снимите рамку микроскопа и предметный столик с оптического стола.
- Положите лист силиконовой резины (размер: 31 x 29 дюймов, толщина: 1/8 дюйма) на оптический стол (рис. 1B).
- Разрежьте силиконовую резину вдоль следов с помощью ножа, удалите мелкие кусочки резины и поместите квадратные керамические листы MICA (размер: 6 x 6 дюймов, толщина: 1/4 дюйма) в те же места.
ПРИМЕЧАНИЕ: Керамика MICA - это легко обрабатываемый материал15. Он такой же твердый, как алюминий, но является отличным теплоизолятором. Керамические листы MICA использовались для остановки передачи тепла от металлической рамы микроскопа и столика к оптическому столу из нержавеющей стали. На листах MICA необходимо просверлить несколько сквозных отверстий, чтобы можно было использовать 1/4-20 винтов для крепления ножек рамы и сцены. - Переместите рамку микроскопа и предметный столик обратно на оптический стол и аккуратно выровняйте ножки на керамических листах MICA вдоль линий маркера. Используйте 1/4-20 винтов, чтобы закрепить раму и сцену на столе.
- Выровняйте оптический тракт SRS. Отрегулируйте крепления зеркал зеркала 1 и зеркала 2 так, чтобы лазерный луч проходил через центр двух предварительно установленных диафрагм радужной оболочки глаза (рис. 2).
ПРИМЕЧАНИЕ: Технические детали лабораторного микроскопа SRS, используемого для текущей работы по визуализации живых клеток, описаны ранее16. Ширина импульса насоса и пучков Стокса составляет ~3-4 пс с дисперсией стеклянных стержней. Управление системой осуществляется с помощью программного обеспечения ScanImage17 . - Поверх этого теплоизоляционного фундамента соберите экологический корпус, чтобы покрыть всю раму микроскопа, используя пять кусков больших поликарбонатных листов (размер: 31 x 29 x 28 дюймов, толщина: 0,25 дюйма).
ПРИМЕЧАНИЕ: Размер корпусной коробки определяется в зависимости от размеров рамы микроскопа и предметного столика. Переднюю панель корпуса микроскопа необходимо временно снять, чтобы установить гибкую камеру и загрузить чашку для клеточных культур.- Чтобы собрать корпус, выполните простые механические работы, включая резку, сверление и нарезание отверстий для винтов на каждом краю листов поликарбоната. Вырежьте два больших отверстия диаметром 2.6 дюйма на правом и левом листах корпуса, чтобы они соответствовали впускной и выпускной трубкам соответственно. Вырежьте небольшое отверстие диаметром 5 мм на заднем листе, чтобы лазерные лучи могли проникать в корпус.
- Заклейте края и стыки коробки с помощью ленты из алюминиевой фольги.
- Подсоедините гибкий шланг воздуховода к впускному и выпускному отверстиям коробки корпуса, чтобы обеспечить циркуляцию теплого воздуха, перекачиваемого и контролируемого модулем нагревателя. Поместите термодатчик нагревательного модуля в гибкую камеру, где клетки культивируются и визуализируются. Установите целевую температуру на 37 °C.
ПРИМЕЧАНИЕ: Диффузор можно использовать для более равномерного распределения воздушного потока в корпусе окружающей среды.
2. Соберите гибкую камеру
- Прикрепите обработанную полую цилиндрическую алюминиевую деталь 1 (материал: алюминий 6061) к носовой части объектива с помощью трех установочных винтов (рис. 2).
- Установите обработанную полую цилиндрическую алюминиевую деталь 2 на держатель образца с помощью четырех винтов 1/4-20 (рис. 2).
ПРИМЕЧАНИЕ: Держатель образца должен быть модифицирован таким образом, чтобы он мог удерживать 50-миллиметровую чашку для культивирования клеток со стеклянным дном. Просверлите сквозное отверстие в центре держателя образца с помощью пилы с отверстиями 1-7/8 дюйма. Просверлите отверстие с помощью пилы с отверстиями 50 мм и сохраняйте глубину сквозного отверстия ~ 1 мм. - Установите держатель образца с алюминиевой деталью 2 на моторизованный столик и установите его с помощью винтов.
- Поместите втулку из натуральной каучуковой пленки (толщина: 0,01 дюйма; склеена цианакрилатным клеем) между двумя обработанными алюминиевыми деталями и закрепите ее с помощью резиновых лент на каждом конце.
- Подсоедините баллон со сжатым CO2 к модулю газового смесителя, используя соответствующие трубки и соединители. Установите входное давление CO2 на уровне 20-25 фунтов на квадратный дюйм. Используйте встроенный датчик CO 2 и контроллер, чтобы модуль воздушного смесителя мог регулировать и смешивать 5% CO2 с воздушным потоком. Используйте встроенные фильтры для очистки воздушного потока.
- Используя соответствующие трубки и соединители, направьте смешанный воздух (с 5% CO2) в предварительно стерилизованную бутылку с водой, помещенную на конфорку, а затем направьте увлажненный воздух в гибкую камеру. Установите конфорку на 37 °C. Пузырьки воздушного потока в теплой воде, чтобы увеличить влажность воздушного потока.
3. Подготовка к экспериментам по покадровой визуализации SRS живых клеток
- Протрите все части гибкой камеры 70% этанолом, включая наконечник, объектив для погружения в воду и держатель образца.
- Обеззаразьте всю систему корпуса с помощью УФ-лампы, помещенной в корпус на 20-30 минут.
ПРИМЕЧАНИЕ: Не оставайтесь в лабораторном помещении во время процесса УФ-дезинфекции в целях безопасности. - Культивируют клетки SKOV3 в чашке Петри со стеклянным дном диаметром 50 мм в течение 12 ч при нормальных физиологических условиях в обычном инкубаторе.
ПРИМЕЧАНИЕ: Запустите культуру клеток SKOV318 в стандартном шкафу биобезопасности. - Отсоедините обработанную алюминиевую деталь 2 от держателя образца, открутив винты.
ПРИМЕЧАНИЕ: Это способ открыть гибкую камеру для загрузки чашки для культивирования клеток. - Загрузите чашку для культивирования клеток. Не забудьте добавить иммерсионное масло в верхнюю часть конденсатора перед установкой чашки для культивирования клеток. Снимите крышку посуды и обездвижьте посуду с помощью зажимов.
ПРИМЕЧАНИЕ: Во избежание загрязнения все операции следует выполнять в перчатках. - Опустите объектив в питательную среду для грубой фокусировки. Опустите алюминиевую деталь 2, чтобы закрыть гибкую камеру, и закрепите ее на держателе образца с помощью винтов.
ПРИМЕЧАНИЕ: Подушка из силиконовой резины толщиной 2 мм прикреплена к нижней части алюминиевой детали 2 для плотной герметизации зазора. - Установите подачу воздуха с 5% CO 2 и 19% O2 для нормальной культуры клеток со скоростью воздушного потока 200 куб. см / мин.
ПРИМЕЧАНИЕ: Можно использовать меньший расход воздуха. Это зависит от того, насколько хорошо герметична гибкая камера.
4. Проведение экспериментов по покадровой визуализации SRS с живыми клетками.
- Настройте длину волны лазера на 805 нм, чтобы нацелиться на рамановский сдвиг 2854 см-1 , который объясняется вибрацией химических связей CH2 . Используйте низкую мощность лазера, чтобы уменьшить фотоповреждение клеток. Чтобы следовать этому протоколу, используйте среднюю мощность лазера накачки ~ 15 мВт и ~ 7,5 мВт лазера Стокса (фиксированную на длине волны 1,045 нм) для длительной визуализации живых клеток.
ПРИМЕЧАНИЕ: Более высокая мощность лазера обеспечит лучшее качество изображения SRS. Однако слишком высокая мощность лазера приведет к фотоповреждению живых клеток. Существует компромисс между качеством изображения и фотоповреждением. - Отрегулируйте и сфокусируйте цель, чтобы добиться хорошей визуализации клеток SRS, используя кнопку FOCUS на панели MAIN CONTROLS программного обеспечения. Чтобы выполнить быструю фокусировку, установите число пикселей 512 × 512 пикселей с временем выдержки пикселей 4,8 мкс на панели КОНФИГУРАЦИЯ .
- Установите диапазон входного сигнала синхронизирующего усилителя (обычно 5 мВ) так, чтобы он в два раза превышал максимальное напряжение сигнала. Установите фильтр нижних частот таким образом, чтобы он совпадал со временем выдержки пикселя (4,8 мкс).
ПРИМЕЧАНИЕ: Различные лабораторные системы SRS могут использовать разные настройки сбора данных. - После достижения хорошей фокусировки установите разрешение изображения на 2,048 × 2,048 пикселей для поля зрения 175мкм2 для получения высококачественных изображений. Проверьте функцию SAVE на панели MAIN CONTROLS и проверьте канал SRS на панели CHANNELS . Установите интервал между двумя кадрами равным 180 с (3 мин) на канале MAIN CONTROLS. Установите номер сбора данных на 480 для покадровой съемки в течение 24 часов.
ПРИМЕЧАНИЕ: Более низкое разрешение изображения может быть использовано в зависимости от цели экспериментов. - Запустите автоматическое получение изображений с помощью функции LOOP на панели MAIN CONTROLS .
ПРИМЕЧАНИЕ: Проверьте, нет ли фокального дрейфа из-за нестабильности температуры в первый час съемки. Визуализация в первый час может быть нестабильной. Проверяйте фокусировку каждые 2-3 часа во время сеанса покадровой съемки. - Обработайте собранные изображения с помощью ImageJ19. Используйте следующие два метода для количественной оценки LD: (i) отношение LD к площади тела клетки и (ii) средняя интенсивность SRS для общего LD. Измерьте площадь тела клетки, установив порог и обнулив неклеточные пиксели на изображениях SRS на уровне 2,854 см-1. Измерьте площадь и интенсивность LD, установив пороговые значения и обнулив пиксели, отличные от LD, на изображениях SRS.
ПРИМЕЧАНИЕ: Более подробная информация об обработке изображений SRS была сообщена ранее16.
Результаты
Мы изготовили и собрали гибкую камерную систему для покадровой визуализации SRS (рис. 1 и рис. 2), а затем оценили производительность системы . Температура внутри корпуса микроскопа достигала ожидаемых 37 °C в течение 1 часа, что не оказывало существенного влияния на температуру в помещении (рис. 3A). Температура в гибкой камере достигала 37 °C за 1,5 ч и стабильно поддерживалась на уровне 37 °C в течение не менее 24 ч (рис. 3B). Относительная влажность в гибкой камере может достигать 85% за 1 час, а затем поддерживаться в течение не менее 24 ч (рис. 3C). Измеренные данные о температуре и влажности подтверждают, что эта система может обеспечить оптимальную среду для долгосрочного роста клеток.
Визуализация живых клеток с помощью SRS применялась во многих биологических и биомедицинских исследованиях 20,21,22,23,24. В частности, SRS-визуализация ЛД без меток в живых клетках для понимания липидного обмена при раке привлекла большое внимание16,25,26. Используя разработанную гибкую камерную систему, мы сначала выполнили покадровую SRS-визуализацию живых клеток SKOV3 в течение 24 ч с интервалом времени 3 мин (рис. 4). Видеоданные показали быстрое и активное движение внутриклеточных ЛД с временным разрешением 3 мин. К концу 24-часового сеанса визуализации клетки все еще демонстрировали нормальную морфологию и плотность, что указывает на то, что клетки были здоровы. Затем мы визуализировали клетки SKOV3, обработанные олеиновой кислотой (ОА), и отслеживали динамический процесс накопления LD в течение 10 ч (рис. 5A).
Количество LD определяли количественно в клетках SKOV3, обработанных ОА, двумя способами (отношение LD к площади тела клеток и общая интенсивность SRS LD) с использованием ImageJ19. Результаты показывают, что количество LD (по размеру и количеству) продолжало увеличиваться в течение 10 часов (рис. 5B). Мы также продемонстрировали одновременную прямую SRS-визуализацию LD (псевдозеленый цвет) и обратную двухфотонную флуоресцентную (TPF) визуализацию лизосом (псевдокрасный цвет), меченную флуоресцентным красителем DND-189 (рис. 6). Следует отметить, что двухмодальная визуализация SRS/TPF может быть использована для анализа колокализации двух клеточных компартментов. В этом эксперименте наблюдалась очень низкая степень колокализации ЛД и лизосом, на что указывали небольшие желтые области. В совокупности эти результаты показывают, что гибкая камерная система обеспечивает стабильную, долгосрочную, покадровую SRS-визуализацию живых клеток, которая может быть использована для различных приложений визуализации в будущем.
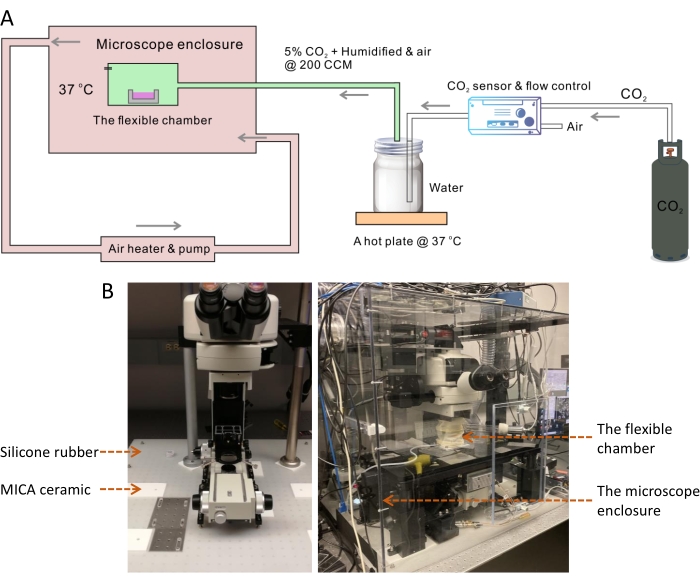
Рисунок 1: Гибкая камерная система для покадровой SRS-визуализации живых клеток. (A) Схема гибкой камерной системы для покадровой SRS-визуализации живых клеток. (B) На изображении слева показан теплоизоляционный слой с использованием листа силиконовой резины и керамических прокладок MICA под рамой микроскопа и предметным столиком. На изображении справа показан корпус микроскопа окружающей среды и гибкая камера. Сокращения: SRS = вынужденное комбинационное рассеяние; CCM = кубические сантиметры в минуту. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Схема и изображения гибкой камеры с оптическим трактом SRS, позволяющим осуществлять трехмерное свободное перемещение объектива погружения в воду для фокусировки и получения изображений. На изображениях слева показаны два обработанных алюминиевых модуля, соединенных с наконечником коммерческого объектива и модифицированным держателем образца. На нижних снимках показана сборка гибкой камерной системы. Аббревиатура: SRS = вынужденное комбинационное рассеяние. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Данные о температуре и влажности корпуса микроскопа и гибкой камеры. (A) Измеренные данные о температуре корпуса микроскопа и температуре в лабораторном помещении до 12 часов. (B) Измеренные данные о температуре (в среднем при 37°С) в гибкой камере, до 24 часов. С) измеренные данные об относительной влажности (в среднем 85%) в гибкой камере, до 24 ч. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Репрезентативные 24 кадра покадровой SRS-визуализации. Покадровая SRS-визуализация (на 2 854 см-1) живых клеток SKOV3 с использованием гибкой камеры, до 24 часов. В этом эксперименте было записано 480 кадров с фиксированным временным интервалом в 3 мин. Клетки культивировали в нормальных условиях. Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
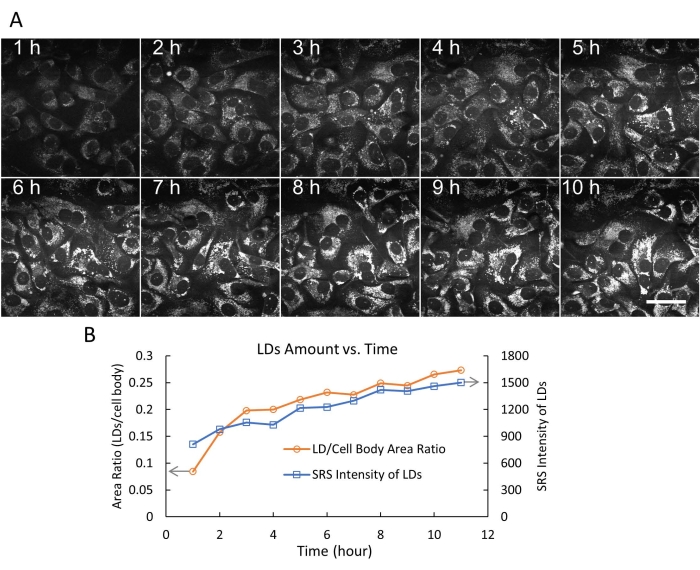
Рисунок 5: Покадровая визуализация SRS и количественное определение липидных капель. (A) Репрезентативные 10 кадров покадровой SRS-визуализации (на расстоянии 2,854 см-1) живых клеток SKOV3, обработанных 500 мкМ ОА, в течение 10 часов с использованием гибкой камеры. В этом эксперименте было записано 200 кадров с фиксированным временным интервалом в 3 мин. Масштабная линейка = 50 мкм. (B) Количество LD в зависимости от времени (0-10 ч) определяли двумя способами (отношение LD к площади тела клетки и общая интенсивность LD SRS) с использованием функции порога и функций анализа частиц в ImageJ. Сокращения: SRS = вынужденная рамановская спектроскопия; ОА = олеиновая кислота; LDs = липидные капли. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Покадровая съемка, одновременная SRS и двухфотонная флуоресцентная визуализация для LD и лизосом. Покадровая съемка, одновременная SRS (на 2,854 см-1) и двухфотонная флуоресцентная визуализация для LD (псевдоцвет зеленый) и лизосом (красный), до 2 часов. Клетки обрабатывали флуоресцентным красителем (LysoSensor DND-189, 1 мкМ) в течение 1 ч перед визуализацией. Снимки делались каждые 3 минуты. Масштабная линейка = 50 мкм. Наблюдалась низкая степень колокализации ЛД и лизосом, обозначенная желтым цветом. Сокращения: SRS = вынужденная рамановская спектроскопия; LDs = липидные капли. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Покадровая SRS-микроскопия живых клеток является альтернативным методом визуализации для отслеживания молекул без меток. По сравнению с флуоресцентной маркировкой, визуализация SRS не подвержена фотообесцвечиванию, что позволяет осуществлять долгосрочный мониторинг молекул. Однако на сегодняшний день система визуализации живых клеток на вертикальной микроскопии SRS коммерчески недоступна. В этой работе была разработана система визуализации живых клеток со стабильным корпусом микроскопа с теплоизоляцией и гибкой внутренней мягкой камерой для обеспечения передаваемой покадровой визуализации SRS. В этой установке большая коробка корпуса поддерживает стабильность температуры на уровне 37 °C, в то время как внутренняя мягкая камера подает увлажненный воздух для создания оптимальной среды для культивирования клеток. Гибкая открытая камера, продемонстрированная в этой работе, обеспечивает простой рабочий процесс для долгосрочной визуализации живых клеток SRS. Клетки, посеянные в чашку со стеклянным дном, можно сначала подготовить и культивировать в обычном инкубаторе, а затем перенести в гибкую камеру на сцене для визуализации. Альтернативным решением для выполнения визуализации SRS с живыми клетками является использование ячейки с закрытым потоком, включая платформы микрофлюидной и проточной цитометрии27,28,29,30. Возможно спроектировать проточную ячейку с меньшей толщиной. Однако культивирование клеток в перфузионной камере может быть технически сложным31.
Фокальный дрейф является распространенной проблемой при визуализацииживых клеток 32. Как многофотонный процесс, генерация сигнала SRS требует плотной фокусировки лазерных лучей и, следовательно, микроскопия SRS очень чувствительна к фокальному дрейфу. Температурная нестабильность является существенным фактором, вызывающим фокальный дрейф. Для повышения термостабильности весь микроскоп был закрыт теплоизоляционными материалами. Тем не менее, в некоторых сеансах визуализации мы все еще испытывали фокальный дрейф после 2-3 часов визуализации. Микроскопическая визуализация SRS также чувствительна к вибрации, которая может нарушить фокусировку. Антивибрационный оптический стол помогает уменьшить вибрацию для достижения стабильного изображения. Для решения проблемы фокального дрейфа в будущих экспериментах могут быть приняты технологии автофокусировки33.
Процедура дезинфекции системы визуализации имеет решающее значение для предотвращения загрязнения клеток, особенно для объекта погружения в воду, который будет напрямую контактировать со средой для культивирования клеток. Использование 70% этанола для очистки верхней части объектива должно быть безопасным. Поскольку ультрафиолетовый свет может эффективно дезинфицировать только поверхность объектов, четыре ультрафиолетовые лампы были установлены в разных местах коробки корпуса для проведения дезинфекции в этих экспериментах. Однако ультрафиолетовый свет может привести к ухудшению качества пластиковых компонентов в системе визуализации. В этом случае можно использовать алюминиевую фольгу для обертывания и покрытия пластиковых деталей. Для визуализации живых клеток настоятельно рекомендуются антибиотики (обычно 100 единиц / мл пенициллина и 100 мкг / мл стрептомицина в питательных средах).
В этих экспериментах мы визуализировали и количественно оценили LD в живых раковых клетках. Для этих экспериментов разумным был 3-минутный интервал времени. Отмечается, что временной интервал визуализации может быть изменен в зависимости от потребностей исследовательского проекта. Например, для отслеживания одного LD в живой ячейке может потребоваться интервал времени менее 1 минуты. Напротив, более длительного интервала времени в несколько минут достаточно для отслеживания медленных биологических процессов34.
Визуализация SRS использует более высокую мощность лазера для возбуждения, чем многие другие технологии оптической визуализации, что может быть сложной задачей для долгосрочной покадровой визуализации живых клеток. SRS-визуализация нативных биомолекул еще более сложна из-за крошечного рамановского поперечного сечения химических связей35. В этих экспериментах использовались лазер накачки мощностью 15 мВт на длине волны 805 нм и лазер Стокса мощностью 7,5 мВт на длине волны 1045 нм, и за 24 ч с интервалом времени 3 мин не наблюдалось значительных фотоповреждений. Использование чувствительных рамановских меток может еще больше снизить мощность лазера36.
Раскрытие информации
У авторов нет конфликтов интересов, которые необходимо раскрывать.
Благодарности
Мы хотим поблагодарить группу старших дизайнеров бакалавриата 2019 года (Сук Чул Юн, Ян Фокстон, Луи Мацца и Джеймс Уолш) в Бингемтонском университете за проектирование, изготовление и тестирование корпуса микроскопа. Мы благодарим Скотта Хэнкока, Ольгу Петрову и Фабиолу Морено Оливас из Бингемтонского университета за полезные дискуссии. Это исследование было поддержано Национальными институтами здравоохранения под номером R15GM140444.
Материалы
| Name | Company | Catalog Number | Comments |
| A lab-built SRS microscope | https://rdcu.be/cP6ve | ||
| HF2LI 50 MHz lock-in amplifer | Zurich Instruments | HF2LI | |
| Iris diaphragm | Thorlabs Inc | SM1D12 | |
| Kinematic mirror mount | Thorlabs Inc | KM100 | |
| Microscope frame | Nikon Inc | FN-1 | |
| Motorized microscopy stage | Prior Scientific | Z-Deck | |
| Oil-immersion condenser (C-AA Achromat/Aplanat, NA 1.4) | Nikon Inc | MBL71405 | |
| Water-immersion objective (CFI75 Apo 25XC W 1300) | Nikon Inc | MRD77225 | |
| Materials and parts for the microscope enclosure (31'' x 29'' x 28'' L x W x H) | |||
| Airtherm heater module | World Precision Instruments (WPI) | AIRTHERM-SAT-1W | |
| Airtherm heater controller, CO2 and humidity monitor | World Precision Instruments (WPI) | AIRTHERM-SMT-1W | |
| Air/CO2 mixer module | World Precision Instruments (WPI) | ECU-HOC-W | |
| Flexible duct hose (2-1/2'' ID, 2-3/4'' OD) | McMaster-Carr | 56675K71 | |
| High-temperature glass-mica ceramic, easy-to-machine (6'' x 6'', 1/4'' thickness) | McMaster-Carr | 8489K62 | |
| Polycarbonate sheets (thickness 0.25'') | McMaster-Carr | 8574K286 | |
| Silicone rubber sheets (36'' x 36'', thickness 1/8'') | McMaster-Carr | 5827T43 | |
| Materials and parts for the Flexible chamber | |||
| Hot plate | McMaster-Carr | 31745K11 | |
| High-purity inline filter, 1/4 NPT | McMaster-Carr | 6645T18 | |
| Hole saw (cutting diameter 1-7/8 inch) | McMaster-Carr | 4066A34 | |
| Hole saw (cutting diameter 50 mm) | McMaster-Carr | 4556A19 | |
| High-temperature silicone rubber tubing, soft, 2 mm ID, 5 mm OD | McMaster-Carr | 5054K313 | |
| Inline filter (1/4 NPT, 40 micron) | McMaster-Carr | 98385K843 | |
| Multipurpose 6061 Aluminum round tube (1/8'' wall thickness, 4'' OD) | McMaster-Carr | 9056K42 | |
| Multipurpose 6061 Aluminum round tube (3/4'' wall thickness, 3-3/4'' OD) | McMaster-Carr | 9056K47 | |
| Multipurpose 6061 Aluminum bar (12'' x 12'', thickness 1/4'') | McMaster-Carr | 8975K142 | |
| Multipurpose 6061 Aluminum bar (8'' x 8'', thickness 3/8'') | McMaster-Carr | 9246K21 | |
| Objective nosepiece (single) | Nikon Inc | FN-MN-H | |
| Sample holder (modified) | Prior Scientific | HZ202 | |
| Ultra-thin natural rubber film (thickness 0.01'') | McMaster-Carr | 8611K13 | |
| Vacuum-sealable glass jar | McMaster-Carr | 3231T44 | |
| Software | |||
| MATLAB | MathWorks | ||
| ImageJ (Fiji) | imagej.net | ||
| ScanImage | Vidrio Technologies, LLC | SRS imaging software | |
| Materials for live-cell imaging | |||
| Cover glass bottom sterile culture dishes (Dia.x H, 50 x 7 mm) | Electron Microscopy Sciences (EMS) | 70674-02 | |
| DMEM cell culture medium | ThermoFisher Scientific | 11965092 | |
| Fetal bovine serum (FBS) | ThermoFisher Scientific | 26140079 | |
| LysoSensor fluorescent dye DND-189 | ThermoFisher Scientific | L7535 (Invitrogen) | |
| Oleic acid | MilliporeSigma | 364525 | |
| SKOV3 cell line | ATCC | HTB-77 |
Ссылки
- Mertz, J. . Introduction to Optical Microscopy. , (2019).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Park, Y., Depeursinge, C., Popescu, G. Quantitative phase imaging in biomedicine. Nature Photonics. 12 (10), 578-589 (2018).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nature Biotechnology. 21 (5), 539-545 (2003).
- lamo, P., et al. Fluorescent dye labeling changes the biodistribution of tumor-targeted nanoparticles. Pharmaceutics. 12 (11), 1004 (2020).
- Cheng, J. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), aaa870 (2015).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Hill, A. H., Fu, D. Cellular imaging using stimulated Raman scattering microscopy. Analytical Chemistry. 91 (15), 9333-9342 (2019).
- Buđa, R., Vukušić, K., Tolić, I. . Methods in Cell Biology. (139), 81-101 (2017).
- Chiarelli, T. J., Grieshaber, N. A., Grieshaber, S. S. Live-cell forward genetic approach to identify and isolate developmental mutants in Chlamydia trachomatis. Journal of Visualized Experiments. (160), e61365 (2020).
- Lemon, W. C., McDole, K. Live-cell imaging in the era of too many microscopes. Current Opinion in Cell Biology. 66, 34-42 (2020).
- Birk, S. E., et al. Management of oral biofilms by nisin delivery in adhesive microdevices. European Journal of Pharmaceutics and Biopharmaceutics. 167, 83-88 (2021).
- Watanabe, I., Okada, S. Effects of temperature on growth rate of cultured mammalian cells (L5178Y). Journal of Cell Biology. 32 (2), 309-323 (1967).
- Lac, A., Lam, A. L., Heit, B. . Fluorescent Microscopy. , 57-73 (2022).
- Grossman, D. G. Machinable glass-ceramics based on tetrasilicic mica. Journal of the American Ceramic Society. 55 (9), 446-449 (1972).
- Yuan, Y., Shah, N., Almohaisin, M. I., Saha, S., Lu, F. Assessing fatty acid-induced lipotoxicity and its therapeutic potential in glioblastoma using stimulated Raman microscopy. Scientific Reports. 11 (1), 1-14 (2021).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomedical Engineering Online. 2 (1), 1-9 (2003).
- Sun, M. W., Yuan, Y. H., Lu, F. K., Di Pasqua, A. J. Physicochemical factors that influence the biocompatibility of cationic liposomes and their ability to deliver DNA to the nuclei of ovarian cancer SK-OV-3 cells. Materials. 14 (2), 416 (2021).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ozeki, Y., Itoh, K. Stimulated Raman scattering microscopy for live-cell imaging with high contrast and high sensitivity. Laser Physics. 20 (5), 1114-1118 (2010).
- Zhang, X., et al. Label-free live-cell imaging of nucleic acids using stimulated Raman scattering microscopy. ChemPhysChem. 13 (4), 1054-1059 (2012).
- Stiebing, C., et al. Real-time Raman and SRS imaging of living human macrophages reveals cell-to-cell heterogeneity and dynamics of lipid uptake. Journal of Biophotonics. 10 (9), 1217-1226 (2017).
- Miao, K., Wei, L. Live-cell imaging and quantification of PolyQ aggregates by stimulated Raman scattering of selective deuterium labeling. ACS Central Science. 6 (4), 478-486 (2020).
- Brzozowski, K., et al. Stimulated Raman scattering microscopy in chemistry and life science -Development, innovation, perspectives. Biotechnology Advances. 60, 108003 (2022).
- Hislop, E. W., Tipping, W. J., Faulds, K., Graham, D. Label-free imaging of lipid droplets in prostate cells using stimulated Raman scattering microscopy and multivariate analysis. Analytical Chemistry. 94 (25), 8899-8908 (2022).
- Chen, T., Yavuz, A., Wang, M. C. Dissecting lipid droplet biology with coherent Raman scattering microscopy. Journal of Cell Science. 135 (5), jcs252353 (2022).
- Cao, C., Zhou, D., Chen, T., Streets, A. M., Huang, Y. Label-Free digital quantification of lipid droplets in single cells by stimulated Raman microscopy on a microfluidic platform. Analytical Chemistry. 88 (9), 4931-4939 (2016).
- Zhang, C., et al. Stimulated Raman scattering flow cytometry for label-free single-particle analysis. Optica. 4 (1), 103-109 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences of the United States of America. 116 (32), 15842-15848 (2019).
- Gala de Pablo, J., Lindley, M., Hiramatsu, K., Goda, K. High-throughput Raman flow cytometry and beyond. Accounts of Chemical Research. 54 (9), 2132-2143 (2021).
- Cole, R. Live-cell imaging: the cell's perspective. Cell Adhesion & Migration. 8 (5), 452-459 (2014).
- Kreft, M., Stenovec, M., Zorec, R. Focus-drift correction in time-lapse confocal imaging. Annals of the New York Academy of Sciences. 1048 (1), 321-330 (2005).
- Firestone, L., Cook, K., Culp, K., Talsania, N., Preston Jr, K. Comparison of autofocus methods for automated microscopy. Cytometry: The Journal of the International Society for Analytical Cytology. 12 (3), 195-206 (1991).
- Van Helvert, S., Storm, C., Friedl, P. Mechanoreciprocity in cell migration. Nature Cell Biology. 20 (1), 8-20 (2018).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544 (7651), 465-470 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены