Method Article
Uma câmara flexível para imagens de células vivas com lapso de tempo com microscopia de espalhamento Raman estimulada
Neste Artigo
Resumo
Relatamos uma câmara ambiental flexível e de estágio para obtenção de imagens de lapso de tempo de células vivas usando microscopia de espalhamento Raman estimulada vertical com detecção de sinal transmitido. As gotículas lipídicas foram fotografadas em células SKOV3 tratadas com ácido oleico por até 24 h com um intervalo de tempo de 3 min.
Resumo
A microscopia de espalhamento Raman estimulado (SRS) é uma tecnologia de imagem química livre de marcação. A imagem de células vivas com SRS tem sido demonstrada para muitas aplicações biológicas e biomédicas. No entanto, a imagem de longo prazo com SRS de lapso de tempo de células vivas não tem sido amplamente adotada. A microscopia SRS geralmente usa uma objetiva de imersão em água de alta abertura numérica (NA) e um condensador de imersão em óleo de alto NA para obter imagens de alta resolução. Neste caso, o espaço entre a objetiva e o condensador é de apenas alguns milímetros. Portanto, a maioria das câmaras ambientais comerciais de topo de palco não pode ser usada para imagens SRS devido à sua grande espessura com uma cobertura de vidro rígida. Este artigo descreve o projeto e a fabricação de uma câmara flexível que pode ser usada para imagens de células vivas com lapso de tempo com detecção de sinal SRS transmitido em um quadro de microscópio vertical. A flexibilidade da câmara é alcançada usando um material macio - uma fina película de borracha natural. O novo design do gabinete e da câmara pode ser facilmente adicionado a uma configuração de imagem SRS existente. Os testes e os resultados preliminares demonstram que o sistema de câmara flexível permite imagens SRS estáveis, de longo prazo e com lapso de tempo de células vivas, que podem ser usadas para várias aplicações de bioimagem no futuro.
Introdução
A microscopia óptica é utilizada para observar as microestruturas das amostras. A imagem óptica é rápida, menos invasiva e menos destrutiva do que outras tecnologias1. A imagem de células vivas com microscopia óptica é desenvolvida para capturar a dinâmica de células vivas cultivadas por um longo período2. Diferentes tipos de contrastes ópticos fornecem informações distintas sobre amostras biológicas. Por exemplo, a microscopia óptica de fase mostra a diferença sutil nos índices de refração ao longo da amostra3. A microscopia de fluorescência é amplamente utilizada para obter imagens de biomoléculas específicas ou organelas celulares. No entanto, os espectros de excitação e emissão de fluorescência geralmente resultam em sobreposição espectral quando imagens multicoloridas são realizadas4. As moléculas fluorescentes são sensíveis à luz e podem ser branqueadas após exposição periódica à luz a longo prazo. Além disso, a marcação por fluorescência pode alterar a biodistribuição das moléculas nas células5. A microscopia SRS é uma tecnologia de imagem química livre demarcação6. O contraste do SRS depende da transição vibracional de ligações químicas específicas. A frequência vibracional de uma ligação química frequentemente exibe uma largura de banda espectral estreita, tornando viável a obtenção de imagens de múltiplas bandas Raman nas mesmas amostras7. A microscopia SRS é uma ferramenta única para imagens de células vivas, fornecendo múltiplos contrastes químicos de forma livre demarcação8.
Embora a imagem SRS de células não coradas tenha sido usada para muitos estudos, a imagem SRS de longo prazo com lapso de tempo de células vivas não foi amplamente adotada. Uma razão é que as câmaras abertas comerciais não podem ser usadas diretamente para imagens SRS devido à sua grande espessura 9,10,11,12. Essas câmaras com tampa de vidro são projetadas principalmente para imagens de campo brilhante ou fluorescência usando uma única objetiva de NA alta com um esquema de detecção para trás. No entanto, a imagem SRS prefere a detecção transmitida usando uma objetiva de NA alta e um condensador de NA alto, o que deixa apenas um intervalo muito curto (normalmente alguns milímetros) entre a objetiva e o condensador. Para superar esse problema, projetamos uma câmara flexível usando um material macio para permitir imagens SRS de lapso de tempo de células vivas usando uma estrutura de microscópio vertical. Neste projeto, a objetiva de imersão de água foi fechada na câmara mole e pode mover-se livremente em três dimensões para fins de focalização e imagem.
A temperatura ideal para o cultivo da maioria das células de mamíferos é de 37 °C, enquanto a temperatura ambiente é sempre 10 ° inferior a esta. Temperaturas superiores ou inferiores a 37 °C têm um efeito dramático na taxa de crescimento celular13. Portanto, o controle da temperatura do ambiente de cultura celular é necessário em um sistema de imagem de células vivas. Sabe-se que a instabilidade da temperatura levará a problemas de desfocalização durante exames de imagem de longo prazo14. Para alcançar um ambiente estável de 37 °C, construímos uma grande câmara de fechamento para cobrir toda a estrutura do microscópio, incluindo uma camada de isolamento térmico sob o microscópio (Figura 1). Dentro da considerável câmara de controle de temperatura, a pequena câmara flexível ajuda a manter com precisão a umidade fisiológica e o pH através do fluxo de ar regulado suplementado com 5% de CO 2 (Figura 2). A temperatura e a umidade das câmaras foram medidas para confirmar que o desenho de câmara dupla forneceu a condição ideal de cultura celular para o crescimento celular sob imagens SRS periódicas de longo prazo (Figura 3). Em seguida, demonstramos a aplicação do sistema para obtenção de imagens por lapso de tempo e rastreamento de gotículas lipídicas (DLs) em células cancerosas SKOV3 (Figura 4, Figura 5 e Figura 6).
Protocolo
1. Construa o gabinete ambiental do microscópio
NOTA: Este grande gabinete ambiental do microscópio é usado para controlar a temperatura do corpo do microscópio e o ambiente de imagem a ser estabilizado em 37 °C (Figura 1A).
- Marque a localização dos pés do quadro do microscópio SRS e do estágio motorizado usando uma caneta marcadora na mesa óptica. Monte dois Diafragmas de Íris na frente do scanner Galvanômetro do microscópio e ajuste para fazer a bomba e os feixes de laser de Stokes passarem pelo centro dos Diafragmas de Íris.
- Remova a estrutura do microscópio e o estágio da mesa óptica.
- Coloque a folha de borracha de silicone (tamanho: 31 x 29 polegadas, espessura: 1/8 polegada) sobre a mesa óptica (Figura 1B).
- Corte a borracha de silicone ao longo das marcas usando uma faca, remova pequenos pedaços de borracha e coloque as folhas de cerâmica MICA quadradas (tamanho: 6 x 6 polegadas, espessura: 1/4 polegada) nos mesmos locais.
NOTA: A cerâmica MICA é um material fácil de usinar15. É tão duro quanto o alumínio, mas é um excelente isolante térmico. Chapas cerâmicas MICA foram usadas para interromper a transferência de calor da estrutura e do estágio do microscópio metálico para a mesa óptica de aço inoxidável. Alguns furos devem ser perfurados nas folhas MICA para permitir o uso de parafusos 1/4-20 para montar os pés do quadro e do palco. - Mova a estrutura do microscópio e o palco de volta para a mesa óptica e alinhe cuidadosamente os pés nas folhas de cerâmica MICA ao longo das linhas do marcador. Use 1/4-20 parafusos para montar o quadro e o palco na mesa.
- Realinhe o caminho óptico SRS. Ajuste os suportes de espelho do Espelho 1 e do Espelho 2 para fazer o feixe de laser passar pelo centro dos dois Diafragmas de Íris pré-montados (Figura 2).
NOTA: Detalhes técnicos do microscópio SRS construído em laboratório usado para o trabalho atual de imagem de células vivas são descritos anteriormente16. A largura de pulso da bomba e dos feixes de Stokes são ~3-4 ps com dispersão de haste de vidro. O sistema é controlado usando o software ScanImage17 . - Em cima desta fundação de isolamento térmico, monte o gabinete ambiental para cobrir toda a estrutura do microscópio usando cinco peças de grandes folhas de policarbonato (tamanho: 31 x 29 x 28 polegadas, espessura: 0,25 polegadas).
NOTA: O tamanho da caixa do compartimento é determinado com base nas dimensões da estrutura do microscópio e do estágio. O painel frontal da caixa do gabinete do microscópio precisará ser removido temporariamente para instalar a câmara flexível e carregar a placa de cultura celular.- Para montar o gabinete, realize um trabalho de usinagem simples, incluindo corte, perfuração e rosqueamento de furos de parafuso em cada borda das chapas de policarbonato. Corte dois furos grandes com um diâmetro de 2,6 polegadas na direita e nas folhas esquerdas do gabinete para encaixar a tubulação de entrada e saída, respectivamente. Corte um pequeno orifício com um diâmetro de 5 mm na folha traseira para permitir que os feixes de laser entrem no compartimento.
- Sele as bordas e interfaces da caixa usando fita de alumínio.
- Conecte a mangueira flexível do duto às portas de entrada e saída da caixa do compartimento para permitir o fluxo de ar quente circulado bombeado e controlado pelo módulo aquecedor. Coloque o sensor térmico do módulo aquecedor na câmara flexível onde as células são cultivadas e fotografadas. Defina a temperatura alvo em 37 °C.
NOTA: Um difusor pode ser usado para obter uma distribuição de fluxo de ar mais uniforme no recinto ambiental.
2. Montar a câmara flexível
- Monte a peça cilíndrica oca usinada de alumínio 1 (material: alumínio 6061) no nariz da objetiva usando três parafusos ajustados (Figura 2).
- Monte a peça cilíndrica oca usinada de alumínio 2 no porta-amostras usando quatro parafusos 1/4-20 (Figura 2).
NOTA: O porta-amostras deve ser modificado de modo a conter a placa de cultura celular com fundo de vidro com tampa de 50 mm. Faça um furo no centro do porta-amostras usando uma serra de furo de 1-7/8 polegadas. Contrafure o furo usando uma serra de furo de 50 mm e mantenha a profundidade do furo de passagem ~1 mm. - Encaixe o suporte da amostra com a peça de alumínio 2 no palco motorizado e monte-o usando parafusos.
- Coloque a manga de filme de borracha natural (espessura: 0,01 polegada; colada com adesivo de cianoacrilato) entre as duas peças de alumínio usinadas e monte-a usando elásticos em cada extremidade.
- Conecte o cilindro de CO2 comprimido ao módulo misturador de gás usando tubulação e conectores adequados. Ajuste a pressão de entrada do CO2 em 20-25 psi. Use um sensor CO 2 integrado e um controlador para garantir que o módulo misturador de ar possa regular e misturar 5% de CO2 no fluxo de ar. Use filtros em linha para limpar o fluxo de ar.
- Usando tubos e conectores adequados, guie o ar misturado (com 5% de CO2) até a garrafa de água pré-esterilizada colocada na placa quente e, em seguida, guie o ar umidificado até a câmara flexível. Ajuste a placa quente a 37 °C. Borbulhe o fluxo de ar na água morna para aumentar a umidade do fluxo de ar.
3. Preparação para experimentos de imagem SRS de células vivas com lapso de tempo
- Limpe todas as partes da câmara flexível com etanol 70%, incluindo o nariz, a objetiva de imersão de água e o porta-amostras.
- Descontaminar todo o sistema de compartimento usando uma lâmpada UV colocada no compartimento por 20 a 30 min.
NOTA: Não fique na sala do laboratório durante o processo de desinfecção UV por segurança. - Cultura de células SKOV3 em uma placa de Petri com fundo de vidro de 50 mm por 12 h em condições fisiológicas normais em uma incubadora regular.
NOTA: Inicie a cultura de células SKOV318 em um gabinete de biossegurança padrão. - Desconecte a peça de alumínio usinada 2 do suporte da amostra removendo os parafusos.
NOTA: Esta é a maneira de abrir a câmara flexível para carregar a placa de cultura celular. - Carregue a placa de cultura celular. Lembre-se de adicionar óleo de imersão na parte superior do condensador antes de colocar a placa de cultura celular. Retire a tampa do prato e imobilize o prato usando os grampos.
OBS: Para evitar contaminação, todas as operações devem ser realizadas com luvas. - Abaixe a objetiva no meio de cultura celular para focalização grosseira. Abaixe a peça de alumínio 2 para fechar a câmara flexível e monte-a no suporte da amostra usando parafusos.
NOTA: Uma almofada de borracha de silicone de 2 mm é fixada na parte inferior da peça de alumínio 2 para selar bem a folga. - Ajuste a fonte de ar com 5% de CO 2 e 19% de O2 para cultura de células normais com uma taxa de fluxo de ar de 200 cc/min.
NOTA: Pode ser utilizada uma caudal de ar mais baixa. Depende de quão bem a câmara flexível é selada.
4. Conduzir experimentos de imagem SRS de células vivas com lapso de tempo
- Ajuste o comprimento de onda do laser para 805 nm para atingir o deslocamento Raman de 2854 cm-1 , que é atribuído à vibração das ligações químicas CH2 . Use baixa potência do laser para reduzir o fotodano às células. Para seguir este protocolo, use ~15 mW de potência média do laser da bomba e ~7,5 mW do laser de Stokes (fixado em 1.045 nm) para imagens de células vivas de longo prazo.
NOTA: Maior potência do laser produzirá melhor qualidade de imagem SRS. No entanto, uma potência laser muito alta induzirá fotodanos às células vivas. Há uma compensação entre qualidade de imagem e fotodanos. - Ajuste e foque o objetivo de obter uma boa imagem SRS das células usando o botão FOCUS no painel PRINCIPAIS CONTROLES do software. Para executar o foco rápido, defina o número de pixels como 512 × 512 pixels com um tempo de permanência de pixels de 4,8 μs no painel CONFIGURAÇÃO.
- Defina a faixa de entrada do amplificador de bloqueio (normalmente 5 mV) para ser o dobro da tensão máxima do sinal. Defina o filtro passa-baixa para ser o mesmo que o tempo de permanência do pixel (4,8 μs).
NOTA: Diferentes sistemas SRS criados em laboratório podem usar configurações de aquisição de dados diferentes. - Depois de alcançar um bom foco, defina a resolução de imagem para 2.048 × 2.048 pixels para um campo de visão de 175 μm2 para a aquisição de imagens de alta qualidade. Verifique a função SAVE no painel MAIN CONTROLS e verifique o canal SRS no painel CHANNELS . Defina o tempo de intervalo entre dois quadros como 180 s (3 min) no canal MAIN CONTROLS. Defina o número de aquisição como 480 para imagens de lapso de tempo ao longo de 24 horas.
NOTA: Uma resolução de imagem mais baixa pode ser usada com base no objetivo dos experimentos. - Inicie a aquisição automatizada de imagens usando a função LOOP no painel CONTROLES PRINCIPAIS .
NOTA: Verifique se há desvio focal devido à instabilidade de temperatura na primeira hora de imagem. As imagens de primeira hora podem não ser estáveis. Verifique o foco a cada 2-3 h durante a sessão de imagem de lapso de tempo. - Processe as imagens coletadas usando o ImageJ19. Use os dois métodos a seguir para quantificação de DL: (i) a razão LD/área corporal da célula e (ii) a intensidade média do SRS do total de DLs. Meça a área do corpo celular limitando e zerando os pixels não celulares nas imagens SRS em 2.854 cm-1. Meça a área e a intensidade do LD limitando e zerando os pixels não-LD nas imagens SRS.
NOTA: Mais detalhes sobre o processamento de imagens SRS foram relatados anteriormente16.
Resultados
Fabricamos e montamos o sistema de câmara flexível para obtenção de imagens SRS com lapso de tempo (Figura 1 e Figura 2) e, em seguida, avaliamos o desempenho do sistema. A temperatura no interior do compartimento ambiente do microscópio atingiu os 37 °C esperados em 1 h, o que não afetou significativamente a temperatura ambiente (Figura 3A). A temperatura na câmara flexível atingiu 37 °C em 1,5 h, mantendo-se estável a 37 °C por pelo menos 24 h (Figura 3B). A umidade relativa do ar na câmara flexível poderia chegar a 85% em 1 h, sendo então mantida por pelo menos 24 h (Figura 3C). Os dados medidos de temperatura e umidade confirmam que este sistema pode fornecer um ambiente ideal para o crescimento celular a longo prazo.
A imagem de células vivas com SRS tem sido aplicada a muitos estudos biológicos e biomédicos20,21,22,23,24. Em particular, imagens SRS de LDs livres de marcadores em células vivas para entender o metabolismo lipídico no câncer têm chamado muita atenção16,25,26. Usando o sistema de câmara flexível projetado, primeiro realizamos imagens SRS com lapso de tempo de células SKOV3 vivas por 24 h com um intervalo de tempo de 3 min (Figura 4). Os dados de vídeo mostraram o movimento rápido e ativo dos LDs intracelulares com resolução temporal de 3 min. Ao final da sessão de imagem de 24 horas, as células ainda apresentavam morfologia e densidade normais, indicando que as células estavam saudáveis. Em seguida, obtivemos imagens de células SKOV3 tratadas com ácido oleico (AO) e rastreamos o processo dinâmico de acúmulo de DL em 10 h (Figura 5A).
As quantidades de DL foram quantificadas nas células SKOV3 tratadas com AO de duas maneiras (razão LD/área corporal celular e intensidade total de SRS das DLs) usando ImageJ19. Os resultados indicam que a quantidade de GDs (em tamanho e número) continuou aumentando ao longo de 10 h (Figura 5B). Também demonstramos imagens simultâneas de LRS (pseudocor verde) e fluorescência de dois fótons (TPF) de lisossomos (pseudocor vermelha) marcados com um corante de fluorescência DND-189 (Figura 6). Nota-se que a imagem de dupla modalidade SRS/TPF pode ser usada para analisar a colocalização de dois compartimentos celulares. Neste experimento, observou-se um grau muito baixo de colocalização de DLs e lisossomos, o que foi indicado pelas pequenas regiões amarelas. Coletivamente, esses resultados demonstram que o sistema de câmara flexível permite imagens SRS estáveis, de longo prazo e com lapso de tempo de células vivas, que podem ser usadas para várias aplicações de imagem no futuro.
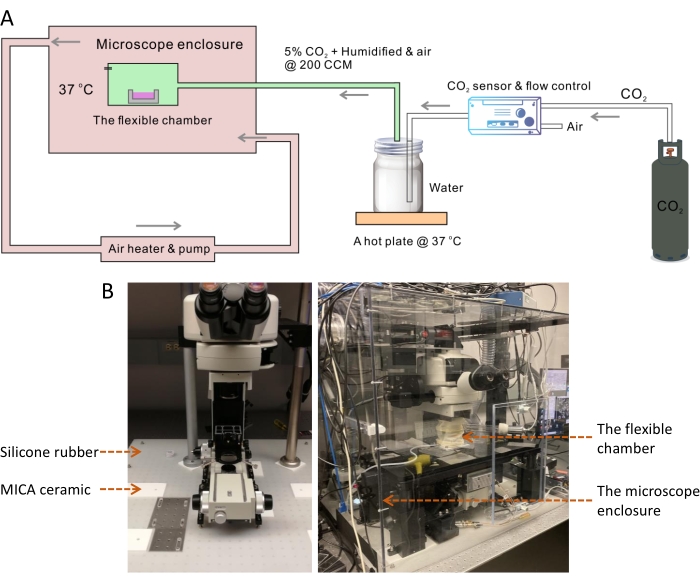
Figura 1: O sistema de câmara flexível para imagens SRS time-lapse de células vivas. (A) Esquema do sistema de câmara flexível para imagens SRS time-lapse de células vivas. (B) A imagem à esquerda mostra a camada de isolamento térmico usando uma folha de borracha de silicone e almofadas cerâmicas MICA sob a estrutura do microscópio e o palco. A imagem à direita mostra o gabinete do microscópio ambiental e a câmara flexível. Abreviações: SRS = espalhamento Raman estimulado; CCM = centímetros cúbicos por min. Clique aqui para ver uma versão maior desta figura.

Figura 2: Esquema e imagens da câmara flexível com o caminho óptico SRS, permitindo a movimentação livre tridimensional da objetiva de imersão em água para focalização e obtenção de imagens. As imagens à esquerda mostram os dois módulos de alumínio usinados conectados a um nariz de objetiva comercial e a um porta-amostras modificado. As imagens inferiores mostram o sistema de câmara flexível de montagem. Abreviação: SRS = espalhamento Raman estimulado. Clique aqui para ver uma versão maior desta figura.

Figura 3: Dados de temperatura e umidade do gabinete do microscópio e da câmara flexível. (A) Os dados de temperatura medidos do gabinete do microscópio e da temperatura ambiente do laboratório, até 12 h. (B) Os dados de temperatura medidos (média a 37 °C) dentro da câmara flexível, até 24 h. (C) Os dados de umidade relativa medidos (média de 85%) dentro da câmara flexível, até 24 h. Clique aqui para ver uma versão maior desta figura.

Figura 4: Representativo de 24 quadros de imagens SRS de lapso de tempo. Imagem SRS com lapso de tempo (a 2.854 cm-1) de células SKOV3 vivas usando a câmara flexível, até 24 h. Neste experimento, 480 quadros foram registrados com um intervalo de tempo fixo de 3 min. As células foram cultivadas em condições normais. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.
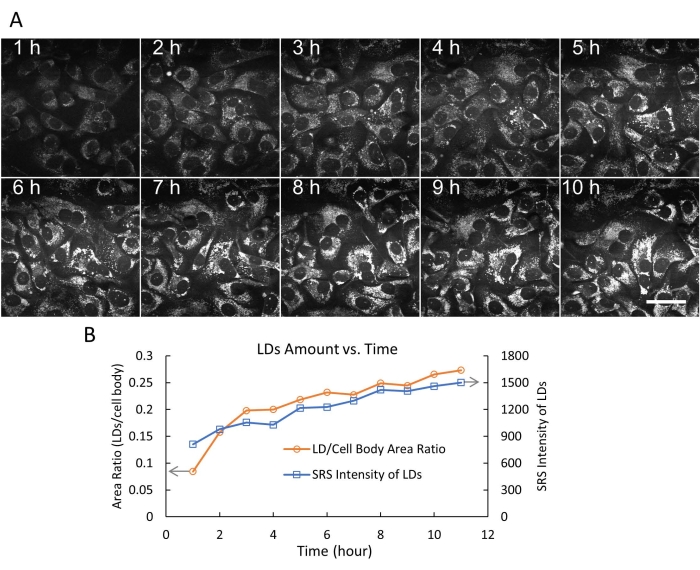
Figura 5: Imagem SRS com lapso de tempo e quantificação de gotículas lipídicas. (A) Representativos 10 quadros de imagens SRS time-lapse (a 2.854 cm-1) de células SKOV3 vivas tratadas com 500 μM OA, até 10 h, usando a câmara flexível. Neste experimento, foram registrados 200 quadros com intervalo de tempo fixo de 3 min. Barra de escala = 50 μm. (B) A quantidade de DLs versus tempo (0-10 h) foi quantificada de duas maneiras (razão LD/área corporal da célula e intensidade total de SRS dos LDs) usando a função thresholding e as funções de análise de partículas no ImageJ. Abreviações: SRS = espectroscopia Raman estimulada; OA = ácido oleico; DLs= gotículas lipídicas. Clique aqui para ver uma versão maior desta figura.

Figura 6: Time-lapse, SRS simultâneo e imagens de fluorescência de dois fótons para LDs e lisossomos. Time-lapse, SRS simultâneo (a 2.854 cm-1) e imagens de fluorescência de dois fótons para LDs (pseudocor verde) e lisossomos (vermelho), até 2 h. As células foram tratadas com um corante de fluorescência (LysoSensor DND-189, 1 μM) por 1 h antes da obtenção de imagens. As imagens foram realizadas a cada 3 min. Barra de escala = 50 μm. Observou-se baixo grau de colocalização de DLs e lisossomos, indicado com a coloração amarela. Abreviações: SRS = espectroscopia Raman estimulada; DLs= gotículas lipídicas. Clique aqui para ver uma versão maior desta figura.
Discussão
A microscopia SRS de células vivas com lapso de tempo é uma técnica alternativa de imagem para rastreamento de moléculas de maneira livre de marcação. Em comparação com a marcação por fluorescência, a imagem SRS é livre de fotoclareamento, permitindo o monitoramento de moléculas a longo prazo. No entanto, até o momento, o sistema de imagem de células vivas em uma microscopia SRS vertical não está disponível comercialmente. Neste trabalho, um sistema de imagem de células vivas com uma caixa de gabinete de microscópio com isolamento térmico estável e uma câmara macia interna flexível foi desenvolvido para permitir imagens transmitidas por lapso de tempo SRS. Nesta configuração, a grande caixa de compartimento mantém a estabilidade de temperatura em 37 °C, enquanto a câmara macia interna fornece ar umidificado para estabelecer um ambiente ideal de cultura celular. A câmara aberta flexível demonstrada neste trabalho permite um fluxo de trabalho simples para imagens SRS de longo prazo de células vivas. As células semeadas em um prato com fundo de vidro podem ser primeiro preparadas e cultivadas em uma incubadora regular antes de serem transferidas para a câmara flexível no palco para geração de imagens. Uma solução alternativa para a realização de imagens de SRS em células vivas é o uso de uma célula de fluxo fechado, incluindo as plataformas microfluídica e de citometria de fluxo27,28,29,30. É viável projetar uma célula de fluxo com uma espessura menor. No entanto, a cultura de células em câmara de perfusão pode ser tecnicamente desafiadora31.
A deriva focal é um problema comum em imagens de células vivas32. Como um processo multifóton, a geração do sinal SRS requer uma focalização apertada dos feixes de laser e, portanto, a microscopia SRS é altamente sensível à deriva focal. A instabilidade de temperatura é um fator essencial na indução de deriva focal. Para melhorar a estabilidade térmica, todo o microscópio foi fechado com materiais isolantes térmicos. No entanto, em algumas sessões de imagem, ainda experimentamos deriva focal após 2-3 h de imagem. A imagem microscópica SRS também é sensível à vibração, que pode destruir o foco. Uma mesa óptica anti-vibração ajuda a reduzir a vibração para obter imagens estáveis. Para resolver o problema da deriva focal, em experimentos futuros, tecnologias de foco automático poderão ser adotadas33.
O procedimento de desinfecção do sistema de imagem é fundamental para evitar a contaminação das células, especialmente para a objetiva de imersão em água, que entrará em contato direto com o meio de cultura celular. Deve ser seguro usar etanol 70% para limpeza da parte superior da lente. Como a luz UV só pode efetivamente desinfetar a superfície dos objetos, quatro lâmpadas UV foram montadas em locais diferentes na caixa do compartimento para realizar a desinfecção nesses experimentos. No entanto, a luz UV pode degradar os componentes plásticos no sistema de imagem. Neste caso, pode-se usar papel alumínio para envolver e cobrir as partes plásticas. Para imagens de células vivas, antibióticos (geralmente 100 unidades/mL de penicilina e 100 μg/mL de estreptomicina nos meios de cultura) são altamente recomendados.
Nós imageamos e quantificamos os LDs em células cancerosas vivas nesses experimentos. Para esses experimentos, um intervalo de tempo de 3 min foi razoável. Nota-se que o intervalo de tempo de aquisição de imagens pode ser alterado dependendo das necessidades do projeto de pesquisa. Por exemplo, para rastrear um único LD em uma célula ativa, um intervalo de tempo inferior a 1 min pode ser necessário. Em contraste, um intervalo de tempo maior, de poucos minutos, é suficiente para rastrear processos biológicos lentos34.
A imagem SRS usa maior potência de laser para excitação do que muitas outras tecnologias de imagem óptica, o que pode ser desafiador para imagens SRS de lapso de tempo de longo prazo de células vivas. A imagem SRS das biomoléculas nativas é ainda mais desafiadora devido à minúscula seção Raman das ligações químicas35. Nesses experimentos, um laser bomba de 15 mW a 805 nm e um laser de Stokes de 7,5 mW a 1.045 nm foram usados, e nenhum fotodano significativo foi observado em 24 h com um intervalo de tempo de 3 min. O uso de tags Raman sensíveis pode reduzir ainda mais a potência do laser36.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Queremos agradecer à Equipe de Design Sênior de Graduação de 2019 (Suk Chul Yoon, Ian Foxton, Louis Mazza e James Walsh) da Universidade de Binghamton pelo projeto, fabricação e teste da caixa de gabinete do microscópio. Agradecemos a Scott Hancock, Olga Petrova e Fabiola Moreno Olivas da Universidade de Binghamton pelas discussões úteis. Esta pesquisa foi apoiada pelo National Institutes of Health sob o número de prêmio R15GM140444.
Materiais
| Name | Company | Catalog Number | Comments |
| A lab-built SRS microscope | https://rdcu.be/cP6ve | ||
| HF2LI 50 MHz lock-in amplifer | Zurich Instruments | HF2LI | |
| Iris diaphragm | Thorlabs Inc | SM1D12 | |
| Kinematic mirror mount | Thorlabs Inc | KM100 | |
| Microscope frame | Nikon Inc | FN-1 | |
| Motorized microscopy stage | Prior Scientific | Z-Deck | |
| Oil-immersion condenser (C-AA Achromat/Aplanat, NA 1.4) | Nikon Inc | MBL71405 | |
| Water-immersion objective (CFI75 Apo 25XC W 1300) | Nikon Inc | MRD77225 | |
| Materials and parts for the microscope enclosure (31'' x 29'' x 28'' L x W x H) | |||
| Airtherm heater module | World Precision Instruments (WPI) | AIRTHERM-SAT-1W | |
| Airtherm heater controller, CO2 and humidity monitor | World Precision Instruments (WPI) | AIRTHERM-SMT-1W | |
| Air/CO2 mixer module | World Precision Instruments (WPI) | ECU-HOC-W | |
| Flexible duct hose (2-1/2'' ID, 2-3/4'' OD) | McMaster-Carr | 56675K71 | |
| High-temperature glass-mica ceramic, easy-to-machine (6'' x 6'', 1/4'' thickness) | McMaster-Carr | 8489K62 | |
| Polycarbonate sheets (thickness 0.25'') | McMaster-Carr | 8574K286 | |
| Silicone rubber sheets (36'' x 36'', thickness 1/8'') | McMaster-Carr | 5827T43 | |
| Materials and parts for the Flexible chamber | |||
| Hot plate | McMaster-Carr | 31745K11 | |
| High-purity inline filter, 1/4 NPT | McMaster-Carr | 6645T18 | |
| Hole saw (cutting diameter 1-7/8 inch) | McMaster-Carr | 4066A34 | |
| Hole saw (cutting diameter 50 mm) | McMaster-Carr | 4556A19 | |
| High-temperature silicone rubber tubing, soft, 2 mm ID, 5 mm OD | McMaster-Carr | 5054K313 | |
| Inline filter (1/4 NPT, 40 micron) | McMaster-Carr | 98385K843 | |
| Multipurpose 6061 Aluminum round tube (1/8'' wall thickness, 4'' OD) | McMaster-Carr | 9056K42 | |
| Multipurpose 6061 Aluminum round tube (3/4'' wall thickness, 3-3/4'' OD) | McMaster-Carr | 9056K47 | |
| Multipurpose 6061 Aluminum bar (12'' x 12'', thickness 1/4'') | McMaster-Carr | 8975K142 | |
| Multipurpose 6061 Aluminum bar (8'' x 8'', thickness 3/8'') | McMaster-Carr | 9246K21 | |
| Objective nosepiece (single) | Nikon Inc | FN-MN-H | |
| Sample holder (modified) | Prior Scientific | HZ202 | |
| Ultra-thin natural rubber film (thickness 0.01'') | McMaster-Carr | 8611K13 | |
| Vacuum-sealable glass jar | McMaster-Carr | 3231T44 | |
| Software | |||
| MATLAB | MathWorks | ||
| ImageJ (Fiji) | imagej.net | ||
| ScanImage | Vidrio Technologies, LLC | SRS imaging software | |
| Materials for live-cell imaging | |||
| Cover glass bottom sterile culture dishes (Dia.x H, 50 x 7 mm) | Electron Microscopy Sciences (EMS) | 70674-02 | |
| DMEM cell culture medium | ThermoFisher Scientific | 11965092 | |
| Fetal bovine serum (FBS) | ThermoFisher Scientific | 26140079 | |
| LysoSensor fluorescent dye DND-189 | ThermoFisher Scientific | L7535 (Invitrogen) | |
| Oleic acid | MilliporeSigma | 364525 | |
| SKOV3 cell line | ATCC | HTB-77 |
Referências
- Mertz, J. . Introduction to Optical Microscopy. , (2019).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Park, Y., Depeursinge, C., Popescu, G. Quantitative phase imaging in biomedicine. Nature Photonics. 12 (10), 578-589 (2018).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nature Biotechnology. 21 (5), 539-545 (2003).
- lamo, P., et al. Fluorescent dye labeling changes the biodistribution of tumor-targeted nanoparticles. Pharmaceutics. 12 (11), 1004 (2020).
- Cheng, J. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), aaa870 (2015).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Hill, A. H., Fu, D. Cellular imaging using stimulated Raman scattering microscopy. Analytical Chemistry. 91 (15), 9333-9342 (2019).
- Buđa, R., Vukušić, K., Tolić, I. . Methods in Cell Biology. (139), 81-101 (2017).
- Chiarelli, T. J., Grieshaber, N. A., Grieshaber, S. S. Live-cell forward genetic approach to identify and isolate developmental mutants in Chlamydia trachomatis. Journal of Visualized Experiments. (160), e61365 (2020).
- Lemon, W. C., McDole, K. Live-cell imaging in the era of too many microscopes. Current Opinion in Cell Biology. 66, 34-42 (2020).
- Birk, S. E., et al. Management of oral biofilms by nisin delivery in adhesive microdevices. European Journal of Pharmaceutics and Biopharmaceutics. 167, 83-88 (2021).
- Watanabe, I., Okada, S. Effects of temperature on growth rate of cultured mammalian cells (L5178Y). Journal of Cell Biology. 32 (2), 309-323 (1967).
- Lac, A., Lam, A. L., Heit, B. . Fluorescent Microscopy. , 57-73 (2022).
- Grossman, D. G. Machinable glass-ceramics based on tetrasilicic mica. Journal of the American Ceramic Society. 55 (9), 446-449 (1972).
- Yuan, Y., Shah, N., Almohaisin, M. I., Saha, S., Lu, F. Assessing fatty acid-induced lipotoxicity and its therapeutic potential in glioblastoma using stimulated Raman microscopy. Scientific Reports. 11 (1), 1-14 (2021).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomedical Engineering Online. 2 (1), 1-9 (2003).
- Sun, M. W., Yuan, Y. H., Lu, F. K., Di Pasqua, A. J. Physicochemical factors that influence the biocompatibility of cationic liposomes and their ability to deliver DNA to the nuclei of ovarian cancer SK-OV-3 cells. Materials. 14 (2), 416 (2021).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ozeki, Y., Itoh, K. Stimulated Raman scattering microscopy for live-cell imaging with high contrast and high sensitivity. Laser Physics. 20 (5), 1114-1118 (2010).
- Zhang, X., et al. Label-free live-cell imaging of nucleic acids using stimulated Raman scattering microscopy. ChemPhysChem. 13 (4), 1054-1059 (2012).
- Stiebing, C., et al. Real-time Raman and SRS imaging of living human macrophages reveals cell-to-cell heterogeneity and dynamics of lipid uptake. Journal of Biophotonics. 10 (9), 1217-1226 (2017).
- Miao, K., Wei, L. Live-cell imaging and quantification of PolyQ aggregates by stimulated Raman scattering of selective deuterium labeling. ACS Central Science. 6 (4), 478-486 (2020).
- Brzozowski, K., et al. Stimulated Raman scattering microscopy in chemistry and life science -Development, innovation, perspectives. Biotechnology Advances. 60, 108003 (2022).
- Hislop, E. W., Tipping, W. J., Faulds, K., Graham, D. Label-free imaging of lipid droplets in prostate cells using stimulated Raman scattering microscopy and multivariate analysis. Analytical Chemistry. 94 (25), 8899-8908 (2022).
- Chen, T., Yavuz, A., Wang, M. C. Dissecting lipid droplet biology with coherent Raman scattering microscopy. Journal of Cell Science. 135 (5), jcs252353 (2022).
- Cao, C., Zhou, D., Chen, T., Streets, A. M., Huang, Y. Label-Free digital quantification of lipid droplets in single cells by stimulated Raman microscopy on a microfluidic platform. Analytical Chemistry. 88 (9), 4931-4939 (2016).
- Zhang, C., et al. Stimulated Raman scattering flow cytometry for label-free single-particle analysis. Optica. 4 (1), 103-109 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences of the United States of America. 116 (32), 15842-15848 (2019).
- Gala de Pablo, J., Lindley, M., Hiramatsu, K., Goda, K. High-throughput Raman flow cytometry and beyond. Accounts of Chemical Research. 54 (9), 2132-2143 (2021).
- Cole, R. Live-cell imaging: the cell's perspective. Cell Adhesion & Migration. 8 (5), 452-459 (2014).
- Kreft, M., Stenovec, M., Zorec, R. Focus-drift correction in time-lapse confocal imaging. Annals of the New York Academy of Sciences. 1048 (1), 321-330 (2005).
- Firestone, L., Cook, K., Culp, K., Talsania, N., Preston Jr, K. Comparison of autofocus methods for automated microscopy. Cytometry: The Journal of the International Society for Analytical Cytology. 12 (3), 195-206 (1991).
- Van Helvert, S., Storm, C., Friedl, P. Mechanoreciprocity in cell migration. Nature Cell Biology. 20 (1), 8-20 (2018).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544 (7651), 465-470 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados