Method Article
자극 라만 산란 현미경을 사용한 타임랩스 라이브 셀 이미징을 위한 유연한 챔버
요약
우리는 전송된 신호 감지 기능이 있는 직립 자극 라만 산란 현미경을 사용하여 살아있는 세포의 타임랩스 이미징을 위한 무대 상단의 유연한 환경 챔버를 보고합니다. 지질 방울은 3분 시간 간격으로 최대 24시간 동안 올레산으로 처리된 SKOV3 세포에서 이미지화되었습니다.
초록
자극 라만 산란(SRS) 현미경은 라벨이 필요 없는 화학 이미징 기술입니다. SRS를 사용한 생세포 이미징은 많은 생물학적 및 생물 의학 응용 분야에서 입증되었습니다. 그러나, 살아있는 세포의 장기 타임랩스 SRS 이미징은 널리 채택되지 않았다. SRS 현미경은 고해상도 이미징을 달성하기 위해 높은 개구수(NA) 침수 대물렌즈와 높은 NA 오일 이멀젼 콘덴서를 사용하는 경우가 많습니다. 이 경우 대물렌즈와 콘덴서 사이의 간격은 몇 밀리미터에 불과합니다. 그러므로, 대부분의 상업적인 단계 정상 환경 약실은 단단한 유리제 덮개를 가진 그들의 큰 간격 때문에 SRS 화상 진찰을 위해 이용될 수 없습니다. 이 백서는 정립 현미경 프레임에서 전송된 SRS 신호 감지를 통해 타임랩스 라이브 셀 이미징에 사용할 수 있는 유연한 챔버의 설계 및 제작에 대해 설명합니다. 챔버의 유연성은 얇은 천연 고무 필름 인 부드러운 소재를 사용하여 달성됩니다. 새로운 인클로저 및 챔버 설계는 기존 SRS 이미징 설정에 쉽게 추가할 수 있습니다. 테스트 및 예비 결과는 플렉서블 챔버 시스템이 향후 다양한 바이오이미징 애플리케이션에 사용될 수 있는 살아있는 세포의 안정적이고 장기적인 타임랩스 SRS 이미징을 가능하게 한다는 것을 보여줍니다.
서문
광학 현미경은 샘플의 미세 구조를 관찰하는 데 사용됩니다. 광학 이미징은 다른 기술보다 빠르고, 덜 침습적이며, 덜 파괴적입니다1. 광학 현미경을 이용한 생세포 이미징은 장기간에 걸쳐 배양된 생세포의 역학을 포착하기 위해 개발되었다2. 다양한 유형의 광학 대비는 생물학적 샘플에 대한 뚜렷한 정보를 제공합니다. 예를 들어, 광학 위상 현미경은 샘플3에 걸친 굴절률의 미묘한 차이를 보여줍니다. 형광 현미경은 특정 생체 분자 또는 세포 소기관을 이미지화하는 데 널리 사용됩니다. 그러나, 형광의 광대역 여기 및 방출 스펙트럼은 일반적으로 다색 이미징이 수행될 때 스펙트럼 중첩을 초래한다4. 형광 분자는 빛에 민감하며 장기적이고 주기적으로 빛에 노출되면 표백될 수 있습니다. 또한, 형광 표지는 세포 내 분자의 생체 분포를 변화시킬 수 있다5. SRS 현미경은 무표지 화학 이미징 기술입니다6. SRS의 대비는 특정 화학 결합의 진동 전이에 의존합니다. 화학 결합의 진동 주파수는 종종 좁은 스펙트럼 대역폭을 나타내므로 동일한 샘플에서 여러 라만 대역을 이미지화하는 것이 가능합니다7. SRS 현미경은 살아있는 세포 이미징을 위한 고유한 도구로, 라벨 없는 방식으로 여러 화학적 대조를 제공합니다8.
염색되지 않은 세포의 SRS 이미징은 많은 연구에 사용되었지만 살아있는 세포의 장기 타임랩스 SRS 이미징은 널리 채택되지 않았습니다. 한 가지 이유는 상업용 개방형 챔버가 두께9,10,11,12의 크기 때문에 SRS 이미징에 직접 사용할 수 없기 때문입니다. 유리 뚜껑이 있는 이 챔버는 대부분 역방향 검출 체계와 함께 단일 높은 NA 대물렌즈를 사용하는 명시야 또는 형광 이미징을 위해 설계되었습니다. 그러나, SRS 이미징은 높은 NA 대물렌즈와 높은 NA 콘덴서를 모두 사용하는 송신 검출을 선호하며, 이는 대물렌즈와 콘덴서 사이에 매우 짧은 갭(전형적으로 수 밀리미터)만을 남긴다. 이 문제를 극복하기 위해 우리는 직립 현미경 프레임을 사용하여 살아있는 세포의 타임랩스 SRS 이미징을 가능하게 하는 부드러운 재료를 사용하여 유연한 챔버를 설계했습니다. 이 설계에서 침수 대물렌즈는 소프트 챔버에 둘러싸여 있으며 초점 및 이미징 목적을 위해 3차원으로 자유롭게 이동할 수 있습니다.
대부분의 포유류 세포를 배양하기 위한 최적의 온도는 37°C인 반면 실온은 항상 이보다 10° 낮습니다. 37°C보다 높거나 낮은 온도는 세포 성장률에 극적인 영향을 미친다13. 따라서 생세포 이미징 시스템에서는 세포 배양 환경의 온도 제어가 필요합니다. 온도 불안정은 장시간 이미징 중에 초점 흐림으로 이어지는 것으로 알려져 있다14. 안정적인 37°C 환경을 달성하기 위해 현미경 아래의 단열층을 포함하여 전체 현미경 프레임을 덮을 수 있는 대형 인클로저 챔버를 구축했습니다(그림 1). 크기가 큰 온도 제어 챔버 내에서 작고 유연한 챔버는 5%CO2로 보충된 조절된 공기 흐름을 통해 생리학적 습도와 pH를 정확하게 유지하는 데 도움이 됩니다(그림 2). 챔버의 온도 및 습도를 측정하여 이중 챔버 설계가 장기적이고 주기적인 SRS 이미징 하에서 세포 성장을 위한 최적의 세포 배양 조건을 제공하는지 확인했습니다(그림 3). 그런 다음 SKOV3 암세포에서 시간 경과 이미징 및 지질 방울(LD) 추적을 위한 시스템의 적용을 시연했습니다(그림 4, 그림 5 및 그림 6).
프로토콜
1. 현미경 환경 인클로저 구축
참고: 이 대형 현미경 환경 인클로저는 현미경 본체의 온도와 이미징 환경을 37°C에서 안정화하는 데 사용됩니다(그림 1A).
- 광학 테이블의 마커 펜을 사용하여 SRS 현미경 프레임과 전동 스테이지의 발 위치를 표시합니다. 현미경의 검류계 스캐너 앞에 두 개의 홍채 다이어프램을 장착하고 펌프와 Stokes 레이저 빔이 조리개 다이어프램의 중앙을 통과하도록 조정합니다.
- 현미경 프레임과 s를 제거합니다.tage 광학 테이블에서.
- 실리콘 고무 시트(크기: 31 x 29인치, 두께: 1/8인치)를 광학 테이블(그림 1B)에 놓습니다.
- 칼을 사용하여 표시를 따라 실리콘 고무를 자르고 작은 고무 조각을 제거한 다음 정사각형 MICA 세라믹 시트(크기: 6 x 6인치, 두께: 1/4인치)를 같은 위치에 놓습니다.
참고: MICA 세라믹은 가공하기 쉬운 소재입니다15. 알루미늄만큼 단단하지만 우수한 단열재입니다. MICA 세라믹 시트는 금속 현미경 프레임과 스테이지에서 스테인리스 스틸 광학 테이블로의 열 전달을 막는 데 사용되었습니다. 프레임과 스테이지의 발을 장착하기 위해 1/4-20 나사를 사용할 수 있도록 MICA 시트에 몇 개의 관통 구멍을 뚫어야 합니다. - 현미경 프레임과 스테이지를 광학 테이블로 다시 이동하고 마커 라인을 따라 MICA 세라믹 시트에 발을 조심스럽게 맞춥니다. 1/4-20 나사를 사용하여 프레임과 s를 장착합니다.tage 테이블 위에.
- SRS 광 경로를 다시 정렬합니다. 미러 1과 미러 2의 미러 마운트를 조정하여 레이저 빔이 미리 장착된 두 개의 조리개 다이어프램의 중앙을 통과하도록 합니다(그림 2).
참고: 현재 라이브 셀 이미징 작업에 사용되는 실험실에서 제작한 SRS 현미경의 기술적 세부 사항은 이전에16에 설명되어 있습니다. 펌프와 스톡스 빔의 펄스 폭은 유리 막대 분산으로 ~ 3-4ps입니다. 시스템은 ScanImage17 소프트웨어를 사용하여 제어됩니다. - 이 단열 기초 위에 5개의 대형 폴리카보네이트 시트(크기: 31 x 29 x 28인치, 두께: 0.25인치)를 사용하여 전체 현미경 프레임을 덮도록 환경 인클로저를 조립합니다.
참고: 인클로저 상자의 크기는 현미경 프레임과 스테이지의 크기에 따라 결정됩니다. 현미경 인클로저 상자의 전면 패널은 플렉시블 챔버를 설치하고 세포 배양 접시를 로드하기 위해 일시적으로 제거해야 합니다.- 인클로저를 조립하려면, 절단을 포함한 간단한 가공 작업 수행, 드릴링, 폴리카보네이트 시트의 각 가장자리에 나사 구멍 두드리기. 입구 및 출구 튜브에 맞도록 인클로저의 오른쪽과 왼쪽 시트에 직경 2.6인치의 큰 구멍 두 개를 자릅니다. 레이저 빔이 인클로저로 들어갈 수 있도록 후면 시트에 직경 5mm의 작은 구멍을 자릅니다.
- 알루미늄 호일 테이프를 사용하여 상자의 가장자리와 인터페이스를 밀봉합니다.
- 플렉시블 덕트 호스를 인클로저 상자의 입구 및 출구 포트에 연결하여 순환된 따뜻한 공기 흐름이 히터 모듈에 의해 펌핑되고 제어되도록 합니다. 히터 모듈의 열 센서를 세포가 배양되고 이미지화되는 유연한 챔버에 놓습니다. 목표 온도를 37°C로 설정합니다.
알림: 디퓨저는 환경 인클로저에서 보다 균일한 공기 흐름 분포를 얻기 위해 사용할 수 있습니다.
2. 플렉시블 챔버 조립
- 가공된 속이 빈 원통형 알루미늄 조각 1(재질: 알루미늄 6061)을 3개의 고정 나사를 사용하여 대물렌즈의 노즈피스에 장착합니다(그림 2).
- 4개의 1/4-20 나사를 사용하여 가공된 중공 원통형 알루미늄 조각 2를 샘플 홀더에 장착합니다(그림 2).
알림: 샘플 홀더는 50mm 커버 유리 바닥 세포 배양 접시를 고정하도록 수정해야 합니다. 1-7/8인치 구멍 톱을 사용하여 샘플 홀더 중앙에 관통 구멍을 뚫습니다. 50mm 구멍 톱을 사용하여 구멍을 카운터보어하고 관통 구멍의 깊이를 ~1mm로 유지합니다. - s를 맞춥니다.amp알루미늄 조각 2가 있는 홀더를 전동 스테이지에 장착하고 나사를 사용하여 장착합니다.
- 가공된 두 개의 알루미늄 조각 사이에 천연 고무 필름 슬리브(두께: 0.01인치, 시아노아크릴레이트 접착제로 접착)를 놓고 양쪽 끝에 고무 밴드를 사용하여 장착합니다.
- 적절한 튜브와 커넥터를 사용하여 압축된CO2 실린더를 가스 혼합기 모듈에 연결합니다. CO2 입력 압력을 20-25psi로 설정합니다. 내장된 CO2 센서와 컨트롤러를 사용하여 공기 혼합기 모듈이 5%CO2를 공기 흐름으로 조절하고 혼합할 수 있는지 확인합니다. 인라인 필터를 사용하여 공기 흐름을 청소하십시오.
- 적절한 튜브와 커넥터를 사용하여 혼합 공기(5%CO2 포함)를 핫 플레이트에 놓인 사전 멸균된 물병으로 안내한 다음 가습된 공기를 유연한 챔버로 안내합니다. 핫 플레이트를 37 °C로 설정합니다. 따뜻한 물에 공기 흐름을 거품을 일으켜 공기 흐름의 습도를 높입니다.
3. 타임랩스 생세포 SRS 이미징 실험을 위한 준비
- 노즈피스, 침지 대물렌즈 및 샘플 홀더를 포함하여 70% 에탄올로 유연한 챔버의 모든 부분을 닦습니다.
- UV 램프를 사용하여 전체 인클로저 시스템의 오염을 제거합니다.amp 20-30분 동안 인클로저에 배치합니다.
알림: 안전을 위해 UV 소독 과정에서 실험실에 머물지 마십시오. - SKOV3 세포를 일반 인큐베이터에서 정상적인 생리학적 조건 하에서 12시간 동안 50mm 유리 바닥 페트리 접시에 배양합니다.
참고: 표준 생물 안전 캐비닛에서 SKOV3 세포 배양18 을 시작합니다. - 가공된 알루미늄 조각 2를 s에서 분리합니다.amp나사를 제거하여 홀더.
참고: 이것은 세포 배양 접시를 넣기 위해 유연한 챔버를 여는 방법입니다. - 세포 배양 접시를 넣습니다. 세포 배양 접시를 놓기 전에 콘덴서 상단에 침지 오일을 추가하는 것을 잊지 마십시오. 접시의 덮개를 제거하고 클램프를 사용하여 접시를 고정합니다.
알림: 오염을 방지하려면 모든 작업을 장갑을 끼고 수행해야 합니다. - 대략적으로 초점을 맞추기 위해 대물렌즈를 세포 배양 배지로 내립니다. 알루미늄 조각 2를 내려 유연한 챔버를 둘러싸고 나사를 사용하여 샘플 홀더에 장착합니다.
알림: 알루미늄 조각 2의 바닥에 2mm 실리콘 고무 쿠션 패드가 부착되어 틈을 단단히 밀봉합니다. - 200cc/min의 공기 유량으로 일반 세포 배양을 위해 5%CO2 및 19% O2 로 공기 공급을 설정합니다.
알림: 더 낮은 공기 흐름 속도를 사용할 수 있습니다. 유연한 챔버가 얼마나 잘 밀봉되어 있는지에 달려 있습니다.
4. 타임랩스 라이브 셀 SRS 이미징 실험 수행
- 레이저 파장을 805nm로 조정하여 CH2 화학 결합의 진동에 기인하는 2854cm-1 라만 편이를 목표로 합니다. 낮은 레이저 출력을 사용하여 세포의 광손상을 줄입니다. 이 프로토콜을 따르려면 장기 라이브 셀 이미징을 위해 펌프 레이저의 평균 출력이 ~15mW이고 Stokes 레이저의 ~7.5mW(1,045nm로 고정됨)를 사용합니다.
알림: 레이저 출력이 높을수록 SRS 이미징 품질이 향상됩니다. 그러나 레이저 출력이 너무 높으면 살아있는 세포에 광손상을 유발할 수 있습니다. 이미지 품질과 사진 손상 사이에는 상충 관계가 있습니다. - 소프트웨어의 MAIN CONTROLS 패널에 있는 FOCUS 버튼을 사용하여 세포의 우수한 SRS 이미징을 얻을 수 있도록 대물렌즈를 조정하고 초점을 맞춥니다. 빠른 초점을 맞추려면 구성 패널에서 픽셀 수를 512 × 512픽셀로 설정하고 픽셀 유지 시간을 4.8μs로 설정합니다.
- 락인앰플리파이어 입력 범위(통상 5mV)를 최대 신호 전압의 두 배로 설정합니다. 저역 통과 필터를 픽셀 유지 시간(4.8μs)과 동일하게 설정합니다.
참고: 실험실에서 구축한 SRS 시스템마다 다른 데이터 수집 설정을 사용할 수 있습니다. - 초점을 잘 맞춘 후 고품질 이미지 획득을 위해 이미징 해상도를 2,048μm 2 시야각에 대해 175× 2 픽셀로 설정합니다. MAIN CONTROLS 패널에서 SAVE 기능을 확인하고 CHANNELS 패널에서 SRS 채널을 확인합니다. MAIN CONTROLS 채널에서 두 프레임 사이의 간격 시간을 180초(3분)로 설정합니다. 24시간 이상의 타임랩스 이미징을 위해 획득 번호를 480으로 설정합니다.
참고: 실험 목적에 따라 더 낮은 이미징 해상도를 사용할 수 있습니다. - MAIN CONTROLS 패널의 LOOP 기능을 사용하여 자동 이미징 수집을 시작합니다.
알림: 이미징 첫 1시간 동안 온도 불안정으로 인한 초점 드리프트가 있는지 확인하십시오. 첫 번째 시간 이미징이 안정적이지 않을 수 있습니다. 타임랩스 이미징 세션 동안 2-3시간마다 초점을 확인하십시오. - ImageJ19를 사용하여 수집된 이미지를 처리합니다. LD 정량화를 위해 다음 두 가지 방법을 사용하십시오: (i) LD/세포체 면적 비율 및 (ii) 총 LD의 평균 SRS 강도. 2,854cm-1에서 SRS 이미지의 비세포 픽셀을 임계값 및 영점 조정하여 세포체 면적을 측정합니다. SRS 이미지에서 비 LD 픽셀을 임계값화하고 영점 조정하여 LD 영역과 강도를 측정합니다.
참고: SRS 이미지 처리에 대한 자세한 내용은 이전에보고되었습니다 16.
결과
타임랩스 SRS 이미징을 위한 플렉시블 챔버 시스템을 제작 및 조립한 다음(그림 1 및 그림 2) 시스템의 성능을 평가했습니다. 현미경 환경 인클로저 내부의 온도는 1시간 이내에 예상 37°C에 도달했으며, 이는 실내 온도에 큰 영향을 미치지 않았습니다(그림 3A). 가요성 챔버 내의 온도는 1.5 시간 내에 37 °C에 도달하였고, 적어도 24 시간 동안 37 °C에서 안정적으로 유지되었다 (도 3B). 플렉시블 챔버의 상대 습도는 1시간 내에 85%에 도달할 수 있으며 최소 24시간 동안 유지될 수 있습니다(그림 3C). 측정된 온도 및 습도 데이터는 이 시스템이 장기적인 세포 성장을 위한 최적의 환경을 제공할 수 있음을 확인합니다.
SRS를 이용한 생세포 이미징은 많은 생물학적 및 생물의학 연구에 적용되어 왔다 20,21,22,23,24. 특히, 암에서 지질 대사를 이해하기 위한 살아있는 세포에서 표지가 없는 LD의 SRS 이미징은 많은 관심을 끌었다16,25,26. 설계된 유연한 챔버 시스템을 사용하여 먼저 3분의 시간 간격으로 24시간 동안 살아있는 SKOV3 세포의 타임랩스 SRS 이미징을 수행했습니다(그림 4). 비디오 데이터는 3분의 시간 분해능으로 세포내 LD의 빠르고 활동적인 움직임을 보여주었습니다. 24시간 이미징 세션이 끝날 때까지 세포는 여전히 정상적인 형태와 밀도를 보였으며 이는 세포가 건강했음을 나타냅니다. 그런 다음 올레산(OA)으로 처리된 SKOV3 세포를 이미지화하고 10시간 이내에 LD 축적의 동적 과정을 추적했습니다(그림 5A).
LD 양은 ImageJ19를 사용하여 두 가지 방법(LD의 세포 대 체면적 비율 및 LD의 총 SRS 강도)으로 OA-처리된 SKOV3 세포에서 정량화되었습니다. 결과는 LD의 양(크기 및 수)이 10시간 동안 계속 증가했음을 나타냅니다(그림 5B). 또한 형광 염료 DND-189로 표지된 리소좀(유사 적색)의 LD(유사 색상 녹색)의 전방 SRS 이미징과 역방향 이광자 형광(TPF) 이미징을 동시에 시연했습니다(그림 6). SRS/TPF 이중 양식 이미징은 두 세포 구획의 공동 국소화를 분석하는 데 사용할 수 있습니다. 이 실험에서, LD와 리소좀의 매우 낮은 정도의 colocalization이 관찰되었으며, 이는 작은 노란색 영역으로 표시되었습니다. 종합적으로, 이러한 결과는 플렉서블 챔버 시스템이 미래의 다양한 이미징 애플리케이션에 사용될 수 있는 살아있는 세포의 안정적이고 장기적인 타임랩스 SRS 이미징을 가능하게 한다는 것을 보여줍니다.
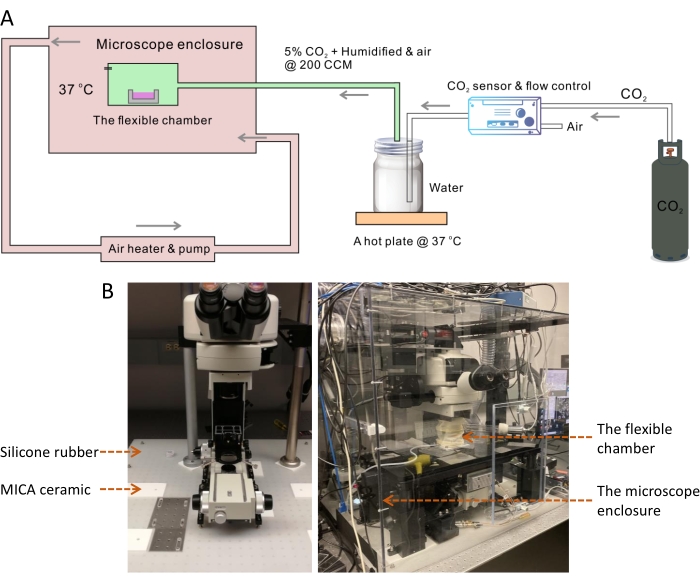
그림 1: 살아있는 세포의 타임랩스 SRS 이미징을 위한 플렉시블 챔버 시스템. (A) 살아있는 세포의 타임랩스 SRS 이미징을 위한 플렉서블 챔버 시스템의 개략도. (B) 왼쪽 이미지는 현미경 프레임과 스테이지 아래에 실리콘 고무 시트와 MICA 세라믹 패드를 사용한 단열층을 보여줍니다. 오른쪽 이미지는 환경 현미경 인클로저와 플렉시블 챔버를 보여줍니다. 약어: SRS = 자극 라만 산란; CCM = 분당 입방 센티미터 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: SRS 광학 경로가 있는 플렉시블 챔버의 개략도 및 이미지로, 초점 및 이미징을 위한 물 침지 대물렌즈의 3차원 자유로운 이동을 허용합니다. 왼쪽 이미지는 상업용 대물렌즈 노즈피스와 수정된 샘플 홀더에 연결된 두 개의 가공된 알루미늄 모듈을 보여줍니다. 하단 이미지는 조립 플렉시블 챔버 시스템을 보여줍니다. 약어: SRS = 자극 라만 산란. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 현미경 인클로저와 플렉서블 챔버의 온도 및 습도 데이터. (A) 현미경 인클로저 및 실험실 실온의 측정된 온도 데이터, 최대 12시간. (B) 플렉시블 챔버 내에서 측정된 온도 데이터(37°C에서 평균), 최대 24시간. (C) 플렉시블 챔버 내에서 측정된 상대 습도 데이터(평균 85%), 최대 24시간 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 타임랩스 SRS 이미징의 대표적인 24프레임. 유연한 챔버를 사용하여 살아있는 SKOV3 세포의 타임랩스 SRS 이미징(2,854cm-1에서), 최대 24시간. 이 실험에서는 3분의 고정된 시간 간격으로 480개의 프레임을 기록했습니다. 세포는 정상 조건 하에서 배양되었다. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
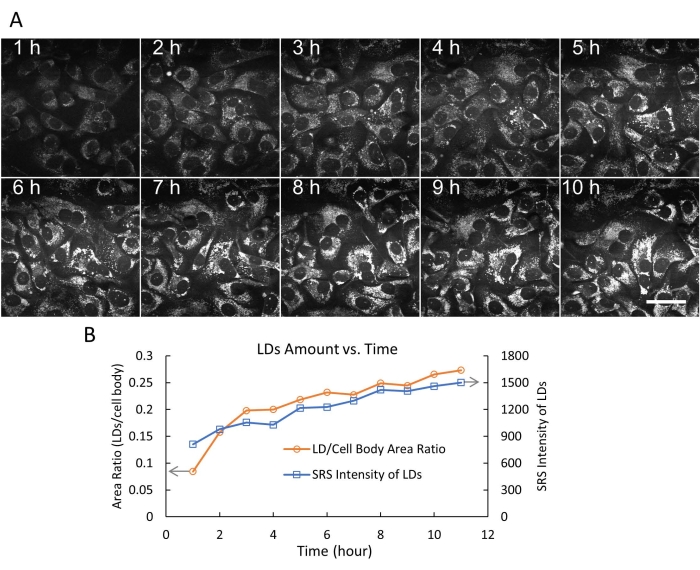
그림 5: 타임랩스 SRS 이미징 및 지질 액적 정량화. (A) 플렉시블 챔버를 사용하여 최대 10시간까지 500μM OA로 처리된 살아있는 SKOV3 세포의 대표적인 10프레임의 타임랩스 SRS 이미징(2,854cm-1에서). 이 실험에서는 3분의 고정된 시간 간격으로 200프레임을 기록했습니다. 스케일 바 = 50 μm. (B) LD 대 시간(0-10시간)의 양은 ImageJ의 임계값 함수와 입자 분석 기능을 사용하여 두 가지 방법(LD/세포 체면적 비율 및 LD의 총 SRS 강도)으로 정량화되었습니다. 약어: SRS = 자극 라만 분광법; OA = 올레산; LDs= 지질 방울. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: LD와 리소좀에 대한 타임랩스, 동시 SRS 및 이광자 형광 이미징. 최대 2시간 동안 LD(유사 녹색) 및 리소좀(빨간색)에 대한 타임랩스, 동시 SRS(2,854cm-1) 및 이광자 형광 이미징. 세포를 이미징 전에 1시간 동안 형광 염료(LysoSensor DND-189, 1μM)로 처리했습니다. 이미지는 3분마다 촬영되었습니다. 스케일 바 = 50 μm. LD와 리소좀의 낮은 수준의 colocalization이 관찰되었으며, 노란색으로 표시되었습니다. 약어: SRS = 자극 라만 분광법; LDs= 지질 방울. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
타임랩스 라이브 셀 SRS 현미경은 라벨 없는 방식으로 분자 추적을 위한 대체 이미징 기술입니다. 형광 표지와 비교하여 SRS 이미징은 광표백이 없어 분자를 장기간 모니터링할 수 있습니다. 그러나, 현재까지, 직립 SRS 현미경 상의 라이브 세포 이미징 시스템은 상업적으로 이용가능하지 않다. 이 작업에서는 안정적인 단열 현미경 인클로저 상자와 유연한 내부 소프트 챔버가 있는 라이브 셀 이미징 시스템을 개발하여 전송된 SRS 타임랩스 이미징을 가능하게 했습니다. 이 설정에서 대형 인클로저 박스는 37°C에서 온도 안정성을 유지하는 반면, 내부 소프트 챔버는 가습된 공기를 공급하여 최적의 세포 배양 환경을 구축합니다. 이 연구에서 입증된 유연한 개방 챔버는 살아있는 세포의 장기 SRS 이미징을 위한 간단한 워크플로우를 가능하게 합니다. 유리 바닥 접시에 파종된 세포는 이미징을 위해 유연한 온스테이지 챔버로 옮기기 전에 먼저 일반 인큐베이터에서 준비 및 배양할 수 있습니다. 라이브 세포 SRS 이미징을 수행하기 위한 대안적인 해결책은 마이크로유체 및 유동 세포분석 플랫폼27,28,29,30을 포함하는 폐쇄형 유동 세포를 사용하는 것이다. 더 낮은 두께의 플로우 셀을 설계하는 것이 가능합니다. 그러나, 관류실에서 세포를 배양하는 것은 기술적으로 어려울 수 있다31.
초점 드리프트는 라이브 셀 이미징(Live-cell imaging)에서 공통적인 문제이다(32). 다광자 공정으로서 SRS 신호 생성은 레이저 빔의 긴밀한 초점을 필요로 하므로 SRS 현미경은 초점 드리프트에 매우 민감합니다. 온도 불안정성은 초점 드리프트를 유도하는 데 필수적인 요소입니다. 열 안정성을 향상시키기 위해 전체 현미경을 단열재로 둘러쌌습니다. 그러나 일부 이미징 세션에서는 이미징 2-3시간 후에도 여전히 초점 드리프트를 경험했습니다. SRS 현미경 이미징은 또한 진동에 민감하여 초점을 파괴할 수 있습니다. 진동 방지 광학 테이블은 진동을 줄여 안정적인 이미징을 달성하는 데 도움이 됩니다. 초점 드리프트 문제를 해결하기 위해, 미래의 실험에서, 자동 초점 기술들이 채택될 수 있다(33).
이미징 시스템의 소독 절차는 세포의 오염을 방지하는 데 중요하며, 특히 세포 배양 배지와 직접 접촉하는 침수 대상의 경우 중요합니다. 렌즈 상단 청소를 위해 70% 에탄올을 사용하는 것이 안전해야 합니다. 자외선은 물체의 표면만 효과적으로 소독할 수 있기 때문에 이 실험에서 소독을 수행하기 위해 인클로저 상자의 다른 위치에 4개의 UV 램프를 장착했습니다. 그러나 UV 광선은 이미징 시스템의 플라스틱 구성 요소를 저하시킬 수 있습니다. 이 경우 알루미늄 호일을 사용하여 플라스틱 부품을 감싸고 덮을 수 있습니다. 생세포 이미징의 경우 항생제(일반적으로 배양 배지에 페니실린 100단위/mL 및 스트렙토마이신 100μg/mL)를 사용하는 것이 좋습니다.
우리는 이 실험에서 살아있는 암세포의 LD를 이미지화하고 정량화했습니다. 이러한 실험의 경우 3분 시간 간격이 합리적이었습니다. 이미징 시간 간격은 연구 프로젝트의 필요에 따라 변경될 수 있습니다. 예를 들어, 라이브 셀에서 단일 LD를 추적하려면 1분 미만의 시간 간격이 필요할 수 있습니다. 대조적으로, 몇 분의 더 긴 시간 간격은 느린 생물학적 과정(34)을 추적하기에 충분하다.
SRS 이미징은 다른 많은 광학 이미징 기술보다 여기를 위해 더 높은 레이저 출력을 사용하며, 이는 살아있는 세포의 장기 타임랩스 SRS 이미징에 어려울 수 있습니다. 천연 생체 분자의 SRS 이미징은 화학 결합35의 작은 라만 단면 때문에 훨씬 더 어렵습니다. 이 실험에서는 805nm에서 15mW 펌프 레이저와 1,045nm에서 7.5mW 스톡스 레이저를 사용했으며 3분 시간 간격으로 24시간 동안 상당한 광손상이 관찰되지 않았습니다. 민감한 라만 태그를 사용하면 레이저 출력이 더 감소할 수 있습니다(36).
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
현미경 인클로저 상자의 설계, 제작 및 테스트에 대해 Binghamton University의 2019년 학부 수석 디자인 팀(윤석철, Ian Foxton, Louis Mazza 및 James Walsh)에게 감사드립니다. 도움이 되는 토론을 해주신 Binghamton University의 Scott Hancock, Olga Petrova, Fabiola Moreno Olivas에게 감사드립니다. 이 연구는 수상 번호 R15GM140444에 따라 국립 보건원(National Institutes of Health)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| A lab-built SRS microscope | https://rdcu.be/cP6ve | ||
| HF2LI 50 MHz lock-in amplifer | Zurich Instruments | HF2LI | |
| Iris diaphragm | Thorlabs Inc | SM1D12 | |
| Kinematic mirror mount | Thorlabs Inc | KM100 | |
| Microscope frame | Nikon Inc | FN-1 | |
| Motorized microscopy stage | Prior Scientific | Z-Deck | |
| Oil-immersion condenser (C-AA Achromat/Aplanat, NA 1.4) | Nikon Inc | MBL71405 | |
| Water-immersion objective (CFI75 Apo 25XC W 1300) | Nikon Inc | MRD77225 | |
| Materials and parts for the microscope enclosure (31'' x 29'' x 28'' L x W x H) | |||
| Airtherm heater module | World Precision Instruments (WPI) | AIRTHERM-SAT-1W | |
| Airtherm heater controller, CO2 and humidity monitor | World Precision Instruments (WPI) | AIRTHERM-SMT-1W | |
| Air/CO2 mixer module | World Precision Instruments (WPI) | ECU-HOC-W | |
| Flexible duct hose (2-1/2'' ID, 2-3/4'' OD) | McMaster-Carr | 56675K71 | |
| High-temperature glass-mica ceramic, easy-to-machine (6'' x 6'', 1/4'' thickness) | McMaster-Carr | 8489K62 | |
| Polycarbonate sheets (thickness 0.25'') | McMaster-Carr | 8574K286 | |
| Silicone rubber sheets (36'' x 36'', thickness 1/8'') | McMaster-Carr | 5827T43 | |
| Materials and parts for the Flexible chamber | |||
| Hot plate | McMaster-Carr | 31745K11 | |
| High-purity inline filter, 1/4 NPT | McMaster-Carr | 6645T18 | |
| Hole saw (cutting diameter 1-7/8 inch) | McMaster-Carr | 4066A34 | |
| Hole saw (cutting diameter 50 mm) | McMaster-Carr | 4556A19 | |
| High-temperature silicone rubber tubing, soft, 2 mm ID, 5 mm OD | McMaster-Carr | 5054K313 | |
| Inline filter (1/4 NPT, 40 micron) | McMaster-Carr | 98385K843 | |
| Multipurpose 6061 Aluminum round tube (1/8'' wall thickness, 4'' OD) | McMaster-Carr | 9056K42 | |
| Multipurpose 6061 Aluminum round tube (3/4'' wall thickness, 3-3/4'' OD) | McMaster-Carr | 9056K47 | |
| Multipurpose 6061 Aluminum bar (12'' x 12'', thickness 1/4'') | McMaster-Carr | 8975K142 | |
| Multipurpose 6061 Aluminum bar (8'' x 8'', thickness 3/8'') | McMaster-Carr | 9246K21 | |
| Objective nosepiece (single) | Nikon Inc | FN-MN-H | |
| Sample holder (modified) | Prior Scientific | HZ202 | |
| Ultra-thin natural rubber film (thickness 0.01'') | McMaster-Carr | 8611K13 | |
| Vacuum-sealable glass jar | McMaster-Carr | 3231T44 | |
| Software | |||
| MATLAB | MathWorks | ||
| ImageJ (Fiji) | imagej.net | ||
| ScanImage | Vidrio Technologies, LLC | SRS imaging software | |
| Materials for live-cell imaging | |||
| Cover glass bottom sterile culture dishes (Dia.x H, 50 x 7 mm) | Electron Microscopy Sciences (EMS) | 70674-02 | |
| DMEM cell culture medium | ThermoFisher Scientific | 11965092 | |
| Fetal bovine serum (FBS) | ThermoFisher Scientific | 26140079 | |
| LysoSensor fluorescent dye DND-189 | ThermoFisher Scientific | L7535 (Invitrogen) | |
| Oleic acid | MilliporeSigma | 364525 | |
| SKOV3 cell line | ATCC | HTB-77 |
참고문헌
- Mertz, J. . Introduction to Optical Microscopy. , (2019).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Park, Y., Depeursinge, C., Popescu, G. Quantitative phase imaging in biomedicine. Nature Photonics. 12 (10), 578-589 (2018).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nature Biotechnology. 21 (5), 539-545 (2003).
- lamo, P., et al. Fluorescent dye labeling changes the biodistribution of tumor-targeted nanoparticles. Pharmaceutics. 12 (11), 1004 (2020).
- Cheng, J. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), aaa870 (2015).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Hill, A. H., Fu, D. Cellular imaging using stimulated Raman scattering microscopy. Analytical Chemistry. 91 (15), 9333-9342 (2019).
- Buđa, R., Vukušić, K., Tolić, I. . Methods in Cell Biology. (139), 81-101 (2017).
- Chiarelli, T. J., Grieshaber, N. A., Grieshaber, S. S. Live-cell forward genetic approach to identify and isolate developmental mutants in Chlamydia trachomatis. Journal of Visualized Experiments. (160), e61365 (2020).
- Lemon, W. C., McDole, K. Live-cell imaging in the era of too many microscopes. Current Opinion in Cell Biology. 66, 34-42 (2020).
- Birk, S. E., et al. Management of oral biofilms by nisin delivery in adhesive microdevices. European Journal of Pharmaceutics and Biopharmaceutics. 167, 83-88 (2021).
- Watanabe, I., Okada, S. Effects of temperature on growth rate of cultured mammalian cells (L5178Y). Journal of Cell Biology. 32 (2), 309-323 (1967).
- Lac, A., Lam, A. L., Heit, B. . Fluorescent Microscopy. , 57-73 (2022).
- Grossman, D. G. Machinable glass-ceramics based on tetrasilicic mica. Journal of the American Ceramic Society. 55 (9), 446-449 (1972).
- Yuan, Y., Shah, N., Almohaisin, M. I., Saha, S., Lu, F. Assessing fatty acid-induced lipotoxicity and its therapeutic potential in glioblastoma using stimulated Raman microscopy. Scientific Reports. 11 (1), 1-14 (2021).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomedical Engineering Online. 2 (1), 1-9 (2003).
- Sun, M. W., Yuan, Y. H., Lu, F. K., Di Pasqua, A. J. Physicochemical factors that influence the biocompatibility of cationic liposomes and their ability to deliver DNA to the nuclei of ovarian cancer SK-OV-3 cells. Materials. 14 (2), 416 (2021).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ozeki, Y., Itoh, K. Stimulated Raman scattering microscopy for live-cell imaging with high contrast and high sensitivity. Laser Physics. 20 (5), 1114-1118 (2010).
- Zhang, X., et al. Label-free live-cell imaging of nucleic acids using stimulated Raman scattering microscopy. ChemPhysChem. 13 (4), 1054-1059 (2012).
- Stiebing, C., et al. Real-time Raman and SRS imaging of living human macrophages reveals cell-to-cell heterogeneity and dynamics of lipid uptake. Journal of Biophotonics. 10 (9), 1217-1226 (2017).
- Miao, K., Wei, L. Live-cell imaging and quantification of PolyQ aggregates by stimulated Raman scattering of selective deuterium labeling. ACS Central Science. 6 (4), 478-486 (2020).
- Brzozowski, K., et al. Stimulated Raman scattering microscopy in chemistry and life science -Development, innovation, perspectives. Biotechnology Advances. 60, 108003 (2022).
- Hislop, E. W., Tipping, W. J., Faulds, K., Graham, D. Label-free imaging of lipid droplets in prostate cells using stimulated Raman scattering microscopy and multivariate analysis. Analytical Chemistry. 94 (25), 8899-8908 (2022).
- Chen, T., Yavuz, A., Wang, M. C. Dissecting lipid droplet biology with coherent Raman scattering microscopy. Journal of Cell Science. 135 (5), jcs252353 (2022).
- Cao, C., Zhou, D., Chen, T., Streets, A. M., Huang, Y. Label-Free digital quantification of lipid droplets in single cells by stimulated Raman microscopy on a microfluidic platform. Analytical Chemistry. 88 (9), 4931-4939 (2016).
- Zhang, C., et al. Stimulated Raman scattering flow cytometry for label-free single-particle analysis. Optica. 4 (1), 103-109 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences of the United States of America. 116 (32), 15842-15848 (2019).
- Gala de Pablo, J., Lindley, M., Hiramatsu, K., Goda, K. High-throughput Raman flow cytometry and beyond. Accounts of Chemical Research. 54 (9), 2132-2143 (2021).
- Cole, R. Live-cell imaging: the cell's perspective. Cell Adhesion & Migration. 8 (5), 452-459 (2014).
- Kreft, M., Stenovec, M., Zorec, R. Focus-drift correction in time-lapse confocal imaging. Annals of the New York Academy of Sciences. 1048 (1), 321-330 (2005).
- Firestone, L., Cook, K., Culp, K., Talsania, N., Preston Jr, K. Comparison of autofocus methods for automated microscopy. Cytometry: The Journal of the International Society for Analytical Cytology. 12 (3), 195-206 (1991).
- Van Helvert, S., Storm, C., Friedl, P. Mechanoreciprocity in cell migration. Nature Cell Biology. 20 (1), 8-20 (2018).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544 (7651), 465-470 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유