Method Article
Une chambre flexible pour l’imagerie de cellules vivantes en accéléré avec microscopie à diffusion Raman stimulée
Dans cet article
Résumé
Nous rapportons une chambre environnementale flexible au sommet de l’étage pour l’imagerie accélérée de cellules vivantes à l’aide de la microscopie à diffusion Raman stimulée verticalement avec détection de signal transmis. Des gouttelettes lipidiques ont été imagées dans des cellules SKOV3 traitées à l’acide oléique pendant 24 heures avec un intervalle de temps de 3 minutes.
Résumé
La microscopie à diffusion Raman stimulée (SRS) est une technologie d’imagerie chimique sans marquage. L’imagerie de cellules vivantes avec SRS a été démontrée pour de nombreuses applications biologiques et biomédicales. Cependant, l’imagerie SRS à long terme de cellules vivantes n’a pas été largement adoptée. La microscopie SRS utilise souvent un objectif d’immersion dans l’eau à grande ouverture numérique (NA) et un condenseur à immersion d’huile à haute NA pour obtenir une imagerie à haute résolution. Dans ce cas, l’écart entre l’objectif et le condensateur n’est que de quelques millimètres. Par conséquent, la plupart des chambres environnementales commerciales ne peuvent pas être utilisées pour l’imagerie SRS en raison de leur grande épaisseur avec un couvercle en verre rigide. Cet article décrit la conception et la fabrication d’une chambre flexible pouvant être utilisée pour l’imagerie de cellules vivantes en accéléré avec détection de signal SRS transmis sur un cadre de microscope vertical. La flexibilité de la chambre est obtenue en utilisant un matériau souple - un film mince de caoutchouc naturel. La nouvelle conception du boîtier et de la chambre peut être facilement ajoutée à une installation d’imagerie SRS existante. Les tests et les résultats préliminaires démontrent que le système de chambre flexible permet une imagerie SRS stable, à long terme et accélérée de cellules vivantes, qui peut être utilisée pour diverses applications de bioimagerie à l’avenir.
Introduction
La microscopie optique est utilisée pour observer les microstructures des échantillons. L’imagerie optique est rapide, moins invasive et moins destructrice que les autres technologies1. L’imagerie de cellules vivantes avec microscopie optique est développée pour capturer la dynamique des cellules vivantes cultivées sur une longue période2. Différents types de contrastes optiques fournissent des informations distinctes sur les échantillons biologiques. Par exemple, la microscopie optique en phase montre la différence subtile dans les indices de réfraction à travers l’échantillon3. La microscopie à fluorescence est largement utilisée pour imager des biomolécules spécifiques ou des organites cellulaires. Cependant, les spectres d’excitation et d’émission à large bande de fluorescence entraînent généralement un chevauchement spectral lorsque l’imagerie multicolore est réalisée4. Les molécules fluorescentes sont sensibles à la lumière et peuvent être blanchies après une exposition périodique à long terme à la lumière. De plus, le marquage par fluorescence peut modifier la biodistribution des molécules dans les cellules5. La microscopie SRS est une technologie d’imagerie chimique sans marquage6. Le contraste du SRS repose sur la transition vibratoire de liaisons chimiques spécifiques. La fréquence vibratoire d’une liaison chimique présente souvent une bande passante spectrale étroite, ce qui permet d’imager plusieurs bandes Raman dans les mêmes échantillons7. La microscopie SRS est un outil unique pour l’imagerie de cellules vivantes, fournissant de multiples contrastes chimiques d’une manière sans marquage8.
Alors que l’imagerie SRS de cellules non colorées a été utilisée pour de nombreuses études, l’imagerie SRS à long terme de cellules vivantes n’a pas été largement adoptée. L’une des raisons est que les chambres ouvertes commerciales ne peuvent pas être utilisées directement pour l’imagerie SRS en raison de leur grande épaisseur 9,10,11,12. Ces chambres avec un couvercle en verre sont principalement conçues pour l’imagerie en fond clair ou en fluorescence utilisant un seul objectif à haute NA avec un schéma de détection arrière. Cependant, l’imagerie SRS préfère la détection transmise utilisant à la fois un objectif NA élevé et un condenseur NA élevé, ce qui ne laisse qu’un très court espace (généralement quelques millimètres) entre l’objectif et le condensateur. Pour surmonter ce problème, nous avons conçu une chambre flexible utilisant un matériau souple pour permettre l’imagerie SRS en accéléré des cellules vivantes à l’aide d’un cadre de microscope vertical. Dans cette conception, l’objectif de trempage d’eau a été enfermé dans la chambre souple et peut se déplacer librement en trois dimensions à des fins de mise au point et d’imagerie.
La température optimale pour la culture de la plupart des cellules de mammifères est de 37 °C, tandis que la température ambiante est toujours inférieure de 10 °C. Une température supérieure ou inférieure à 37 °C a un effet dramatique sur le taux de croissance cellulaire13. Par conséquent, le contrôle de la température de l’environnement de culture cellulaire est nécessaire dans un système d’imagerie de cellules vivantes. On sait que l’instabilité de la température entraînera des problèmes de défocalisation lors de l’imagerie à long terme14. Pour obtenir un environnement stable à 37 °C, nous avons construit une grande chambre d’enceinte pour couvrir l’ensemble du cadre du microscope, y compris une couche d’isolation thermique sous le microscope (Figure 1). Dans la grande chambre de régulation de la température, la petite chambre flexible aide à maintenir avec précision l’humidité physiologique et le pH via le débit d’air régulé complété par 5% de CO 2 (Figure 2). La température et l’humidité des chambres ont été mesurées pour confirmer que la conception à double chambre fournissait les conditions de culture cellulaire optimales pour la croissance cellulaire sous imagerie SRS périodique à long terme (Figure 3). Nous avons ensuite démontré l’application du système pour l’imagerie accélérée et le suivi des gouttelettes lipidiques (LD) dans les cellules cancéreuses SKOV3 (Figure 4, Figure 5 et Figure 6).
Protocole
1. Construire l’enceinte environnementale du microscope
REMARQUE : Cette grande enceinte environnementale de microscope est utilisée pour contrôler la température du corps du microscope et de l’environnement d’imagerie à stabiliser à 37 °C (Figure 1A).
- Marquez l’emplacement des pieds du cadre du microscope SRS et de la platine motorisée à l’aide d’un marqueur sur la table optique. Montez deux diaphragmes d’iris devant le scanner Galvanomètre du microscope et ajustez-les pour que la pompe et les faisceaux laser Stokes passent par le centre des diaphragmes d’iris.
- Retirez le cadre du microscope et la platine de la table optique.
- Posez la feuille de caoutchouc de silicone (taille : 31 x 29 pouces, épaisseur : 1/8 pouce) sur la table optique (Figure 1B).
- Coupez le caoutchouc de silicone le long des marques à l’aide d’un couteau, retirez les petits morceaux de caoutchouc et placez les feuilles de céramique MICA carrées (taille: 6 x 6 pouces, épaisseur: 1/4 de pouce) aux mêmes endroits.
REMARQUE: La céramique MICA est un matériau facile à usiner15. Il est aussi dur que l’aluminium mais est un excellent isolant thermique. Des feuilles de céramique MICA ont été utilisées pour arrêter le transfert de chaleur du cadre et de l’étage métalliques du microscope à la table optique en acier inoxydable. Quelques trous traversants doivent être percés sur les tôles MICA pour permettre l’utilisation de vis 1/4-20 pour le montage des pieds du cadre et de la scène. - Déplacez le cadre du microscope et la platine vers la table optique et alignez soigneusement les pieds sur les feuilles de céramique MICA le long des lignes de marqueur. Utilisez 1/4-20 vis pour monter le cadre et la scène sur la table.
- Réalignez le chemin optique SRS. Réglez les supports de miroir du miroir 1 et du miroir 2 pour faire passer le faisceau laser par le centre des deux diaphragmes d’iris prémontés (Figure 2).
REMARQUE : Les détails techniques du microscope SRS construit en laboratoire utilisé pour les travaux actuels d’imagerie sur cellules vivantes sont décrits précédemment16. La largeur d’impulsion de la pompe et des faisceaux de Stokes est de ~3-4 ps avec dispersion de tige de verre. Le système est contrôlé à l’aide du logiciel ScanImage17 . - En plus de cette fondation d’isolation thermique, assemblez l’enceinte environnementale pour couvrir l’ensemble du cadre du microscope à l’aide de cinq grandes feuilles de polycarbonate (taille: 31 x 29 x 28 pouces, épaisseur: 0,25 pouce).
REMARQUE: La taille de la boîte de boîtier est déterminée en fonction des dimensions de l’image du microscope et de la scène. Le panneau avant de la boîte de boîtier du microscope devra être retiré temporairement pour installer la chambre flexible et charger la boîte de culture cellulaire.- Pour assembler le boîtier, effectuez des travaux d’usinage simples, y compris la coupe, le perçage et le taraudage des trous de vis sur chaque bord des feuilles de polycarbonate. Coupez deux grands trous d’un diamètre de 2,6 pouces sur les feuilles droite et gauche du boîtier pour s’adapter au tube d’entrée et de sortie, respectivement. Découpez un petit trou d’un diamètre de 5 mm sur la feuille arrière pour permettre aux faisceaux laser de pénétrer dans l’enceinte.
- Scellez les bords et les interfaces de la boîte à l’aide de ruban adhésif en aluminium.
- Connectez le tuyau flexible du conduit à l’entrée et aux orifices de sortie de la boîte de boîtier pour permettre la circulation du flux d’air chaud pompé et contrôlé par le module de chauffage. Placez le capteur thermique du module chauffant dans la chambre flexible où les cellules sont cultivées et imagées. Réglez la température cible à 37 °C.
REMARQUE: Un diffuseur peut être utilisé pour obtenir une distribution plus uniforme du flux d’air dans l’enceinte environnementale.
2. Assembler la chambre flexible
- Fixez la pièce cylindrique creuse usinée 1 (matériau : aluminium 6061) sur le nez de l’objectif à l’aide de trois vis de réglage (Figure 2).
- Montez la pièce cylindrique creuse usinée 2 sur le porte-échantillon à l’aide de quatre vis 1/4-20 (Figure 2).
NOTE: Le porte-échantillon doit être modifié pour contenir la capsule de culture cellulaire à fond de verre de 50 mm. Percez un trou traversant au centre du porte-échantillon à l’aide d’une scie à trou de 1-7/8 pouces. Contre-percer le trou à l’aide d’une scie à trou de 50 mm et conserver la profondeur du trou traversant ~1 mm. - Placez le porte-échantillon avec la pièce en aluminium 2 sur la platine motorisée et montez-le à l’aide de vis.
- Placez le manchon du film de caoutchouc naturel (épaisseur: 0,01 pouce; collé avec un adhésif cyanoacrylate) entre les deux pièces d’aluminium usinées et montez-le à l’aide d’élastiques à chaque extrémité.
- Connectez la bouteille de CO2 comprimée au module mélangeur de gaz à l’aide de tubes et de connecteurs appropriés. Réglez la pression d’entrée CO2 à 20-25 psi. Utilisez un capteur de CO 2 intégré et un contrôleur pour vous assurer que le module mélangeur d’air peut réguler et mélanger 5% de CO2 dans le flux d’air. Utilisez des filtres en ligne pour nettoyer le flux d’air.
- À l’aide de tubes et de connecteurs appropriés, guidez l’air mélangé (contenant 5 % de CO2) vers la bouteille d’eau préstérilisée placée sur la plaque chauffante, puis guidez l’air humidifié vers la chambre flexible. Régler la plaque chauffante à 37 °C. Faites des bulles sur le flux d’air dans l’eau chaude pour augmenter l’humidité du flux d’air.
3. Préparation aux expériences d’imagerie SRS sur cellules vivantes en accéléré
- Essuyez toutes les parties de la chambre flexible avec de l’éthanol à 70 %, y compris l’embout nasal, l’objectif de trempage d’eau et le porte-échantillon.
- Décontaminez l’ensemble du système d’enceinte à l’aide d’une lampe UV placée dans l’enceinte pendant 20 à 30 min.
REMARQUE: Ne restez pas dans la salle de laboratoire pendant le processus de désinfection UV pour des raisons de sécurité. - Culture de cellules SKOV3 dans une boîte de Petri à fond de verre de 50 mm pendant 12 h dans des conditions physiologiques normales dans un incubateur ordinaire.
REMARQUE: Démarrez la culture cellulaire SKOV318 dans une enceinte de biosécurité standard. - Déconnectez la pièce d’aluminium usinée 2 du porte-échantillon en retirant les vis.
REMARQUE: C’est la façon d’ouvrir la chambre flexible pour charger la boîte de culture cellulaire. - Chargez la capsule de culture cellulaire. N’oubliez pas d’ajouter de l’huile d’immersion sur le dessus du condenseur avant de placer la capsule de culture cellulaire. Retirez le couvercle du plat et immobilisez-le à l’aide des pinces.
REMARQUE: Pour éviter la contamination, toutes les opérations doivent être effectuées avec des gants. - Abaissez l’objectif dans le milieu de culture cellulaire pour une focalisation grossière. Abaissez la pièce d’aluminium 2 pour enfermer la chambre flexible et montez-la sur le porte-échantillon à l’aide de vis.
REMARQUE: Un coussin en caoutchouc de silicone de 2 mm est fixé au bas de la pièce d’aluminium 2 pour sceller hermétiquement l’espace. - Réglez l’alimentation en air avec 5% de CO 2 et 19% O2 pour une culture cellulaire normale avec un débit d’air de 200 cc / min.
REMARQUE: Un débit d’air inférieur peut être utilisé. Cela dépend de la qualité de l’étanchéité de la chambre flexible.
4. Mener des expériences d’imagerie SRS sur cellules vivantes en accéléré
- Réglez la longueur d’onde du laser à 805 nm pour cibler le décalage Raman 2854 cm-1 , qui est attribué à la vibration des liaisons chimiques CH2 . Utilisez une faible puissance laser pour réduire les photodommages aux cellules. Pour suivre ce protocole, utilisez ~15 mW de puissance moyenne du laser pompe et ~7,5 mW du laser Stokes (fixé à 1 045 nm) pour l’imagerie à long terme de cellules vivantes.
REMARQUE: Une puissance laser plus élevée donnera une meilleure qualité d’image SRS. Cependant, une puissance laser trop élevée induira des photodommages aux cellules vivantes. Il y a un compromis entre la qualité d’image et les photodommages. - Ajustez et concentrez l’objectif pour obtenir une bonne imagerie SRS des cellules à l’aide du bouton FOCUS du panneau COMMANDES PRINCIPALES du logiciel. Pour effectuer une mise au point rapide, définissez le nombre de pixels sur 512 × 512 pixels avec un temps de séjour en pixels de 4,8 μs sur le panneau CONFIGURATION .
- Réglez la plage d’entrée de l’amplificateur verrouillé (généralement 5 mV) pour qu’elle soit deux fois supérieure à la tension maximale du signal. Réglez le filtre passe-bas pour qu’il soit identique au temps de séjour des pixels (4,8 μs).
REMARQUE: Différents systèmes SRS construits en laboratoire peuvent utiliser des paramètres d’acquisition de données différents. - Après avoir obtenu une bonne mise au point, réglez la résolution d’imagerie sur 2 048 × 2 048 pixels pour un champ de vision de 175 μm2 pour l’acquisition d’images de haute qualité. Vérifiez la fonction SAVE du panneau COMMANDES PRINCIPALES et vérifiez le canal SRS du panneau CANAUX . Réglez l’intervalle de temps entre deux images sur 180 s (3 min) sur le canal MAIN CONTROLS. Définissez le numéro d’acquisition sur 480 pour l’imagerie accélérée sur 24 heures.
REMARQUE: Une résolution d’imagerie inférieure peut être utilisée en fonction de l’objectif des expériences. - Démarrez l’acquisition automatisée d’images à l’aide de la fonction LOOP du panneau MAIN CONTROLS .
REMARQUE: Vérifiez s’il y a une dérive focale due à l’instabilité de la température dans la première heure d’imagerie. L’imagerie de la première heure peut ne pas être stable. Vérifiez la mise au point toutes les 2-3 heures pendant la séance d’imagerie time-lapse. - Traitez les images collectées à l’aide d’ImageJ19. Utilisez les deux méthodes suivantes pour la quantification des DL : (i) le rapport LD/surface corporelle cellulaire, et (ii) l’intensité moyenne du SRS des LD totales. Mesurez la surface du corps cellulaire en seuillant et en mettant à zéro les pixels non cellulaires dans les images SRS à 2 854 cm-1. Mesurez la surface et l’intensité LD en établissant un seuil et en mettant à zéro les pixels non LD dans les images SRS.
REMARQUE: Plus de détails sur le traitement d’image SRS ont été signalés précédemment16.
Résultats
Nous avons fabriqué et assemblé le système de chambre flexible pour l’imagerie SRS time-lapse (Figure 1 et Figure 2), puis évalué les performances du système. La température à l’intérieur de l’enceinte environnementale du microscope a atteint les 37 °C attendus en 1 h, ce qui n’a pas affecté de manière significative la température ambiante (figure 3A). La température dans la chambre flexible a atteint 37 °C en 1,5 h, et elle a été maintenue de manière stable à 37 °C pendant au moins 24 h (figure 3B). L’humidité relative dans la chambre flexible pourrait atteindre 85% en 1 h, puis être maintenue pendant au moins 24 heures (Figure 3C). Les données de température et d’humidité mesurées confirment que ce système peut fournir un environnement optimal pour la croissance cellulaire à long terme.
L’imagerie de cellules vivantes avec SRS a été appliquée à de nombreuses études biologiques et biomédicales 20,21,22,23,24. En particulier, l’imagerie SRS des LD sans marquage dans les cellules vivantes pour comprendre le métabolisme des lipides dans le cancer a attiré beaucoup d’attention16,25,26. À l’aide du système de chambre flexible conçu, nous avons d’abord effectué une imagerie SRS accélérée de cellules SKOV3 vivantes pendant 24 heures avec un intervalle de temps de 3 minutes (Figure 4). Les données vidéo ont montré le mouvement rapide et actif des LD intracellulaires avec une résolution temporelle de 3 min. À la fin de la séance d’imagerie de 24 heures, les cellules présentaient toujours une morphologie et une densité normales, indiquant que les cellules étaient saines. Nous avons ensuite imagé des cellules SKOV3 traitées avec de l’acide oléique (OA) et suivi le processus dynamique d’accumulation de LD en 10 heures (Figure 5A).
Les quantités de DL ont été quantifiées dans les cellules SKOV3 traitées par arthrose de deux manières (rapport LD/surface corporelle cellulaire et intensité totale SRS des LD) à l’aide d’ImageJ19. Les résultats indiquent que la quantité de TA (en taille et en nombre) a continué d’augmenter pendant 10 heures (figure 5B). Nous avons également démontré l’imagerie simultanée par SRS avant des LD (pseudo couleur verte) et l’imagerie par fluorescence à deux photons (TPF) vers l’arrière des lysosomes (pseudo couleur rouge) marqués avec un colorant de fluorescence DND-189 (Figure 6). Il est à noter que l’imagerie à double modalité SRS/TPF peut être utilisée pour analyser la colocalisation de deux compartiments cellulaires. Dans cette expérience, un très faible degré de colocalisation des TA et des lysosomes a été observé, ce qui a été indiqué par les petites régions jaunes. Collectivement, ces résultats démontrent que le système de chambre flexible permet une imagerie SRS stable, à long terme et accélérée de cellules vivantes, qui peut être utilisée pour diverses applications d’imagerie à l’avenir.
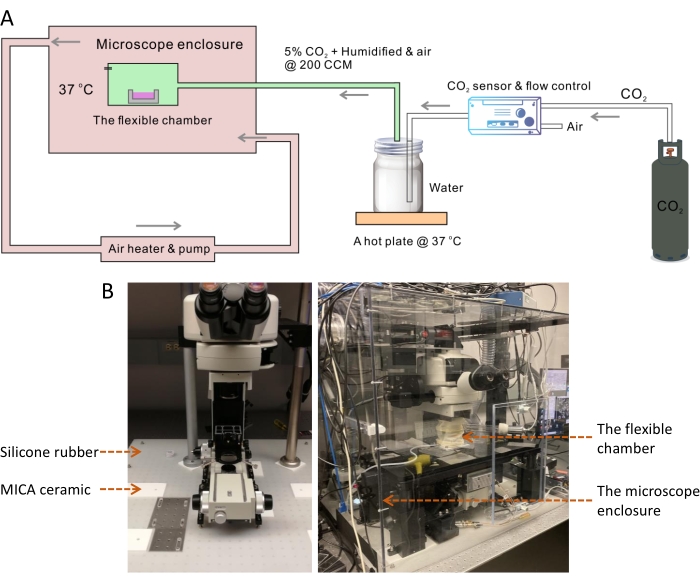
Figure 1 : Système à chambre flexible pour l’imagerie SRS en accéléré des cellules vivantes. (A) Schéma du système de chambre flexible pour l’imagerie SRS en accéléré des cellules vivantes. (B) L’image de gauche montre la couche d’isolation thermique à l’aide d’une feuille de caoutchouc de silicone et de tampons en céramique MICA sous le cadre du microscope et la scène. L’image de droite montre l’enceinte du microscope environnemental et la chambre flexible. Abréviations : SRS = diffusion Raman stimulée; CCM = centimètres cubes par min. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Schéma et images de la chambre flexible avec le chemin optique SRS, permettant un libre mouvement tridimensionnel de l’objectif de trempage d’eau pour la mise au point et l’imagerie. Les images de gauche montrent les deux modules en aluminium usinés reliés à un embout d’objectif commercial et à un porte-échantillon modifié. Les images du bas montrent le système de chambre flexible d’assemblage. Abréviation : SRS = diffusion Raman stimulée. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Données de température et d’humidité de l’enceinte du microscope et de la chambre flexible. (A) Les données de température mesurées de l’enceinte du microscope et de la température de la salle de laboratoire, jusqu’à 12 h. (B) Les données de température mesurées (moyenne à 37 °C) dans la chambre flexible, jusqu’à 24 h. (C) Les données d’humidité relative mesurées (moyenne de 85 %) à l’intérieur de la chambre flexible, jusqu’à 24 h. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : 24 images représentatives de l’imagerie SRS time-lapse. Imagerie SRS en accéléré (à 2 854 cm-1) de cellules SKOV3 vivantes à l’aide de la chambre flexible, jusqu’à 24 h. Dans cette expérience, 480 images ont été enregistrées avec un intervalle de temps fixe de 3 minutes. Les cellules ont été cultivées dans des conditions normales. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
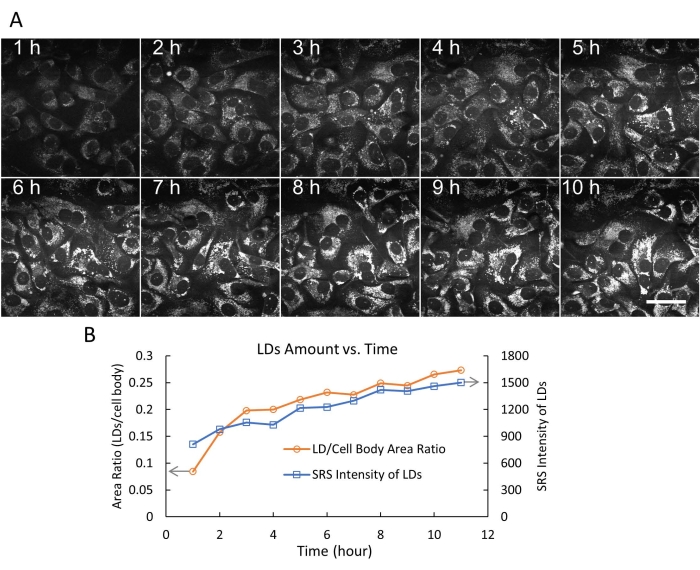
Figure 5 : Imagerie SRS en accéléré et quantification des gouttelettes lipidiques. (A) 10 images représentatives d’imagerie SRS time-lapse (à 2 854 cm-1) de cellules SKOV3 vivantes traitées avec 500 μM OA, jusqu’à 10 h, en utilisant la chambre flexible. Dans cette expérience, 200 images ont été enregistrées avec un intervalle de temps fixe de 3 minutes. Barre d’échelle = 50 μm. (B) La quantité de DL en fonction du temps (0-10 h) a été quantifiée de deux manières (rapport LD/surface corporelle cellulaire et intensité totale SRS des LD) à l’aide de la fonction de seuillage et des fonctions d’analyse des particules dans ImageJ. Abréviations : SRS = spectroscopie Raman stimulée; OA = acide oléique; LDs = gouttelettes lipidiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Imagerie accélérée, SRS simultanée et fluorescence à deux photons pour les TA et les lysosomes. Time-lapse, SRS simultané (à 2 854 cm-1) et imagerie par fluorescence à deux photons pour les LD (pseudo couleur verte) et les lysosomes (rouge), jusqu’à 2 h. Les cellules ont été traitées avec un colorant de fluorescence (LysoSensor DND-189, 1 μM) pendant 1 h avant l’imagerie. Les images ont été prises toutes les 3 minutes. Barre d’échelle = 50 μm. Un faible degré de colocalisation des LD et des lysosomes a été observé, indiqué par la couleur jaune. Abréviations : SRS = spectroscopie Raman stimulée; LDs = gouttelettes lipidiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La microscopie SRS à cellules vivantes en accéléré est une technique d’imagerie alternative pour le suivi des molécules de manière sans marquage. Par rapport au marquage par fluorescence, l’imagerie SRS est exempte de photoblanchiment, ce qui permet une surveillance à long terme des molécules. Cependant, à ce jour, le système d’imagerie de cellules vivantes sur une microscopie SRS verticale n’est pas disponible dans le commerce. Dans ce travail, un système d’imagerie de cellules vivantes avec une boîte de boîtier de microscope stable à isolation thermique et une chambre souple intérieure flexible a été développé pour permettre l’imagerie accélérée SRS transmise. Dans cette configuration, la grande boîte de confinement maintient la stabilité de la température à 37 ° C, tandis que la chambre souple interne fournit de l’air humidifié pour établir un environnement de culture cellulaire optimal. La chambre ouverte flexible démontrée dans ce travail permet un flux de travail simple pour l’imagerie SRS à long terme des cellules vivantes. Les cellules ensemencées dans un plat à fond de verre peuvent d’abord être préparées et cultivées dans un incubateur ordinaire avant d’être transférées dans la chambre flexible sur scène pour l’imagerie. Une solution alternative pour effectuer l’imagerie SRS sur cellules vivantes consiste à utiliser une cellule à flux fermé, y compris les plateformes microfluidique et cytométriqueen flux 27,28,29,30. Il est possible de concevoir une cellule d’écoulement avec une épaisseur inférieure. Cependant, la culture de cellules dans une chambre de perfusion peut être techniquement difficile31.
La dérive focale est un problème courant dans l’imagerie de cellules vivantes32. En tant que processus multiphotonique, la génération de signaux SRS nécessite une focalisation étroite des faisceaux laser et, par conséquent, la microscopie SRS est très sensible à la dérive focale. L’instabilité de la température est un facteur essentiel pour induire une dérive focale. Pour améliorer la stabilité thermique, l’ensemble du microscope a été entouré de matériaux isolants thermiques. Cependant, dans certaines séances d’imagerie, nous avons encore connu une dérive focale après 2-3 h d’imagerie. L’imagerie microscopique SRS est également sensible aux vibrations, ce qui peut détruire la mise au point. Une table optique anti-vibrations aide à réduire les vibrations pour obtenir une imagerie stable. Pour résoudre le problème de la dérive focale, dans les expériences futures, les technologies de mise au point automatique pourraient être adoptées33.
La procédure de désinfection du système d’imagerie est essentielle pour éviter la contamination des cellules, en particulier pour l’objectif d’immersion dans l’eau, qui entrera directement en contact avec le milieu de culture cellulaire. Il devrait être sûr d’utiliser de l’éthanol à 70% pour le nettoyage du dessus de la lentille. Parce que la lumière UV ne peut désinfecter efficacement que la surface des objets, quatre lampes UV ont été montées à différents endroits dans la boîte de boîtier pour effectuer la désinfection dans ces expériences. Cependant, la lumière UV peut dégrader les composants en plastique du système d’imagerie. Dans ce cas, on peut utiliser du papier d’aluminium pour envelopper et couvrir les pièces en plastique. Pour l’imagerie de cellules vivantes, les antibiotiques (habituellement 100 unités/mL de pénicilline et 100 μg/mL de streptomycine dans les milieux de culture) sont fortement recommandés.
Nous avons imagé et quantifié les TA dans les cellules cancéreuses vivantes dans ces expériences. Pour ces expériences, un intervalle de temps de 3 minutes était raisonnable. Il est à noter que l’intervalle de temps d’imagerie pourrait être modifié en fonction des besoins du projet de recherche. Par exemple, pour suivre une seule LD dans une cellule vivante, un intervalle de temps inférieur à 1 min peut être nécessaire. En revanche, un intervalle de temps plus long de quelques minutes est suffisant pour suivre les processus biologiques lents34.
L’imagerie SRS utilise une puissance laser plus élevée pour l’excitation que de nombreuses autres technologies d’imagerie optique, ce qui peut être difficile pour l’imagerie SRS à long terme de cellules vivantes. L’imagerie SRS des biomolécules natives est encore plus difficile en raison de la minuscule section transversale Raman des liaisons chimiques35. Dans ces expériences, un laser à pompe de 15 mW à 805 nm et un laser Stokes de 7,5 mW à 1 045 nm ont été utilisés, et aucun photodommage significatif n’a été observé en 24 heures avec un intervalle de temps de 3 minutes. L’utilisation de balises Raman sensibles peut réduire davantage la puissance du laser36.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous tenons à remercier l’équipe de conception principale de premier cycle 2019 (Suk Chul Yoon, Ian Foxton, Louis Mazza et James Walsh) de l’Université de Binghamton pour la conception, la fabrication et les tests de la boîte d’enceinte de microscope. Nous remercions Scott Hancock, Olga Petrova et Fabiola Moreno Olivas de l’Université de Binghamton pour leurs discussions utiles. Cette recherche a été soutenue par les National Institutes of Health sous le numéro d’attribution R15GM140444.
matériels
| Name | Company | Catalog Number | Comments |
| A lab-built SRS microscope | https://rdcu.be/cP6ve | ||
| HF2LI 50 MHz lock-in amplifer | Zurich Instruments | HF2LI | |
| Iris diaphragm | Thorlabs Inc | SM1D12 | |
| Kinematic mirror mount | Thorlabs Inc | KM100 | |
| Microscope frame | Nikon Inc | FN-1 | |
| Motorized microscopy stage | Prior Scientific | Z-Deck | |
| Oil-immersion condenser (C-AA Achromat/Aplanat, NA 1.4) | Nikon Inc | MBL71405 | |
| Water-immersion objective (CFI75 Apo 25XC W 1300) | Nikon Inc | MRD77225 | |
| Materials and parts for the microscope enclosure (31'' x 29'' x 28'' L x W x H) | |||
| Airtherm heater module | World Precision Instruments (WPI) | AIRTHERM-SAT-1W | |
| Airtherm heater controller, CO2 and humidity monitor | World Precision Instruments (WPI) | AIRTHERM-SMT-1W | |
| Air/CO2 mixer module | World Precision Instruments (WPI) | ECU-HOC-W | |
| Flexible duct hose (2-1/2'' ID, 2-3/4'' OD) | McMaster-Carr | 56675K71 | |
| High-temperature glass-mica ceramic, easy-to-machine (6'' x 6'', 1/4'' thickness) | McMaster-Carr | 8489K62 | |
| Polycarbonate sheets (thickness 0.25'') | McMaster-Carr | 8574K286 | |
| Silicone rubber sheets (36'' x 36'', thickness 1/8'') | McMaster-Carr | 5827T43 | |
| Materials and parts for the Flexible chamber | |||
| Hot plate | McMaster-Carr | 31745K11 | |
| High-purity inline filter, 1/4 NPT | McMaster-Carr | 6645T18 | |
| Hole saw (cutting diameter 1-7/8 inch) | McMaster-Carr | 4066A34 | |
| Hole saw (cutting diameter 50 mm) | McMaster-Carr | 4556A19 | |
| High-temperature silicone rubber tubing, soft, 2 mm ID, 5 mm OD | McMaster-Carr | 5054K313 | |
| Inline filter (1/4 NPT, 40 micron) | McMaster-Carr | 98385K843 | |
| Multipurpose 6061 Aluminum round tube (1/8'' wall thickness, 4'' OD) | McMaster-Carr | 9056K42 | |
| Multipurpose 6061 Aluminum round tube (3/4'' wall thickness, 3-3/4'' OD) | McMaster-Carr | 9056K47 | |
| Multipurpose 6061 Aluminum bar (12'' x 12'', thickness 1/4'') | McMaster-Carr | 8975K142 | |
| Multipurpose 6061 Aluminum bar (8'' x 8'', thickness 3/8'') | McMaster-Carr | 9246K21 | |
| Objective nosepiece (single) | Nikon Inc | FN-MN-H | |
| Sample holder (modified) | Prior Scientific | HZ202 | |
| Ultra-thin natural rubber film (thickness 0.01'') | McMaster-Carr | 8611K13 | |
| Vacuum-sealable glass jar | McMaster-Carr | 3231T44 | |
| Software | |||
| MATLAB | MathWorks | ||
| ImageJ (Fiji) | imagej.net | ||
| ScanImage | Vidrio Technologies, LLC | SRS imaging software | |
| Materials for live-cell imaging | |||
| Cover glass bottom sterile culture dishes (Dia.x H, 50 x 7 mm) | Electron Microscopy Sciences (EMS) | 70674-02 | |
| DMEM cell culture medium | ThermoFisher Scientific | 11965092 | |
| Fetal bovine serum (FBS) | ThermoFisher Scientific | 26140079 | |
| LysoSensor fluorescent dye DND-189 | ThermoFisher Scientific | L7535 (Invitrogen) | |
| Oleic acid | MilliporeSigma | 364525 | |
| SKOV3 cell line | ATCC | HTB-77 |
Références
- Mertz, J. . Introduction to Optical Microscopy. , (2019).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Park, Y., Depeursinge, C., Popescu, G. Quantitative phase imaging in biomedicine. Nature Photonics. 12 (10), 578-589 (2018).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nature Biotechnology. 21 (5), 539-545 (2003).
- lamo, P., et al. Fluorescent dye labeling changes the biodistribution of tumor-targeted nanoparticles. Pharmaceutics. 12 (11), 1004 (2020).
- Cheng, J. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), aaa870 (2015).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Hill, A. H., Fu, D. Cellular imaging using stimulated Raman scattering microscopy. Analytical Chemistry. 91 (15), 9333-9342 (2019).
- Buđa, R., Vukušić, K., Tolić, I. . Methods in Cell Biology. (139), 81-101 (2017).
- Chiarelli, T. J., Grieshaber, N. A., Grieshaber, S. S. Live-cell forward genetic approach to identify and isolate developmental mutants in Chlamydia trachomatis. Journal of Visualized Experiments. (160), e61365 (2020).
- Lemon, W. C., McDole, K. Live-cell imaging in the era of too many microscopes. Current Opinion in Cell Biology. 66, 34-42 (2020).
- Birk, S. E., et al. Management of oral biofilms by nisin delivery in adhesive microdevices. European Journal of Pharmaceutics and Biopharmaceutics. 167, 83-88 (2021).
- Watanabe, I., Okada, S. Effects of temperature on growth rate of cultured mammalian cells (L5178Y). Journal of Cell Biology. 32 (2), 309-323 (1967).
- Lac, A., Lam, A. L., Heit, B. . Fluorescent Microscopy. , 57-73 (2022).
- Grossman, D. G. Machinable glass-ceramics based on tetrasilicic mica. Journal of the American Ceramic Society. 55 (9), 446-449 (1972).
- Yuan, Y., Shah, N., Almohaisin, M. I., Saha, S., Lu, F. Assessing fatty acid-induced lipotoxicity and its therapeutic potential in glioblastoma using stimulated Raman microscopy. Scientific Reports. 11 (1), 1-14 (2021).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomedical Engineering Online. 2 (1), 1-9 (2003).
- Sun, M. W., Yuan, Y. H., Lu, F. K., Di Pasqua, A. J. Physicochemical factors that influence the biocompatibility of cationic liposomes and their ability to deliver DNA to the nuclei of ovarian cancer SK-OV-3 cells. Materials. 14 (2), 416 (2021).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ozeki, Y., Itoh, K. Stimulated Raman scattering microscopy for live-cell imaging with high contrast and high sensitivity. Laser Physics. 20 (5), 1114-1118 (2010).
- Zhang, X., et al. Label-free live-cell imaging of nucleic acids using stimulated Raman scattering microscopy. ChemPhysChem. 13 (4), 1054-1059 (2012).
- Stiebing, C., et al. Real-time Raman and SRS imaging of living human macrophages reveals cell-to-cell heterogeneity and dynamics of lipid uptake. Journal of Biophotonics. 10 (9), 1217-1226 (2017).
- Miao, K., Wei, L. Live-cell imaging and quantification of PolyQ aggregates by stimulated Raman scattering of selective deuterium labeling. ACS Central Science. 6 (4), 478-486 (2020).
- Brzozowski, K., et al. Stimulated Raman scattering microscopy in chemistry and life science -Development, innovation, perspectives. Biotechnology Advances. 60, 108003 (2022).
- Hislop, E. W., Tipping, W. J., Faulds, K., Graham, D. Label-free imaging of lipid droplets in prostate cells using stimulated Raman scattering microscopy and multivariate analysis. Analytical Chemistry. 94 (25), 8899-8908 (2022).
- Chen, T., Yavuz, A., Wang, M. C. Dissecting lipid droplet biology with coherent Raman scattering microscopy. Journal of Cell Science. 135 (5), jcs252353 (2022).
- Cao, C., Zhou, D., Chen, T., Streets, A. M., Huang, Y. Label-Free digital quantification of lipid droplets in single cells by stimulated Raman microscopy on a microfluidic platform. Analytical Chemistry. 88 (9), 4931-4939 (2016).
- Zhang, C., et al. Stimulated Raman scattering flow cytometry for label-free single-particle analysis. Optica. 4 (1), 103-109 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences of the United States of America. 116 (32), 15842-15848 (2019).
- Gala de Pablo, J., Lindley, M., Hiramatsu, K., Goda, K. High-throughput Raman flow cytometry and beyond. Accounts of Chemical Research. 54 (9), 2132-2143 (2021).
- Cole, R. Live-cell imaging: the cell's perspective. Cell Adhesion & Migration. 8 (5), 452-459 (2014).
- Kreft, M., Stenovec, M., Zorec, R. Focus-drift correction in time-lapse confocal imaging. Annals of the New York Academy of Sciences. 1048 (1), 321-330 (2005).
- Firestone, L., Cook, K., Culp, K., Talsania, N., Preston Jr, K. Comparison of autofocus methods for automated microscopy. Cytometry: The Journal of the International Society for Analytical Cytology. 12 (3), 195-206 (1991).
- Van Helvert, S., Storm, C., Friedl, P. Mechanoreciprocity in cell migration. Nature Cell Biology. 20 (1), 8-20 (2018).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544 (7651), 465-470 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon