Method Article
Una camera flessibile per l'imaging di cellule vive time-lapse con microscopia a diffusione Raman stimolata
In questo articolo
Riepilogo
Riportiamo una camera ambientale flessibile per l'imaging time-lapse di cellule vive utilizzando la microscopia a diffusione Raman stimolata verticalmente con rilevamento del segnale trasmesso. Le goccioline lipidiche sono state visualizzate in cellule SKOV3 trattate con acido oleico per un massimo di 24 ore con un intervallo di tempo di 3 minuti.
Abstract
La microscopia a diffusione Raman stimolata (SRS) è una tecnologia di imaging chimico label-free. L'imaging di cellule vive con SRS è stato dimostrato per molte applicazioni biologiche e biomediche. Tuttavia, l'imaging SRS time-lapse a lungo termine delle cellule vive non è stato ampiamente adottato. La microscopia SRS utilizza spesso un obiettivo ad immersione in acqua ad alta apertura numerica (NA) e un condensatore ad alta immersione in olio NA per ottenere immagini ad alta risoluzione. In questo caso, lo spazio tra l'obiettivo e il condensatore è solo di pochi millimetri. Pertanto, la maggior parte delle camere ambientali da palcoscenico commerciali non può essere utilizzata per l'imaging SRS a causa del loro grande spessore con una copertura di vetro rigido. Questo documento descrive la progettazione e la fabbricazione di una camera flessibile che può essere utilizzata per l'imaging di cellule vive time-lapse con rilevamento del segnale SRS trasmesso su un telaio del microscopio verticale. La flessibilità della camera si ottiene utilizzando un materiale morbido - un sottile film di gomma naturale. Il nuovo design dell'involucro e della camera può essere facilmente aggiunto a una configurazione di imaging SRS esistente. I test e i risultati preliminari dimostrano che il sistema a camera flessibile consente l'imaging SRS stabile, a lungo termine, time-lapse di cellule vive, che può essere utilizzato per varie applicazioni di bioimaging in futuro.
Introduzione
La microscopia ottica viene utilizzata per osservare le microstrutture dei campioni. L'imaging ottico è rapido, meno invasivo e meno distruttivo di altre tecnologie1. L'imaging delle cellule vive con microscopia ottica è sviluppato per catturare la dinamica delle cellule vive in coltura per un lungo periodo2. Diversi tipi di contrasti ottici forniscono informazioni distinte sui campioni biologici. Ad esempio, la microscopia ottica di fase mostra la sottile differenza negli indici di rifrazione nel campione3. La microscopia a fluorescenza è ampiamente utilizzata per visualizzare specifiche biomolecole o organelli cellulari. Tuttavia, gli spettri di eccitazione a banda larga e di emissione della fluorescenza di solito provocano sovrapposizioni spettrali quando viene eseguita l'imaging multicolore4. Le molecole fluorescenti sono sensibili alla luce e possono essere sbiancate dopo un'esposizione periodica alla luce a lungo termine. Inoltre, la marcatura a fluorescenza può modificare la biodistribuzione delle molecole nelle cellule5. La microscopia SRS è una tecnologia di imaging chimico label-free6. Il contrasto di SRS si basa sulla transizione vibrazionale di specifici legami chimici. La frequenza vibrazionale di un legame chimico spesso mostra una larghezza di banda spettrale ristretta, rendendo possibile l'immagine di più bande Raman negli stessi campioni7. La microscopia SRS è uno strumento unico per l'imaging di cellule vive, che fornisce molteplici contrasti chimici in modo label-free8.
Mentre l'imaging SRS di cellule non colorate è stato utilizzato per molti studi, l'imaging SRS time-lapse a lungo termine di cellule vive non è stato ampiamente adottato. Uno dei motivi è che le camere aperte commerciali non possono essere utilizzate direttamente per l'imaging SRS a causa del loro grande spessore 9,10,11,12. Queste camere con coperchio in vetro sono per lo più progettate per l'imaging in campo chiaro o a fluorescenza utilizzando un singolo obiettivo ad alto NA con uno schema di rilevamento all'indietro. Tuttavia, l'imaging SRS preferisce il rilevamento trasmesso utilizzando sia un obiettivo NA elevato che un condensatore ad alto NA, che lascia solo uno spazio molto breve (in genere pochi millimetri) tra l'obiettivo e il condensatore. Per ovviare a questo problema, abbiamo progettato una camera flessibile utilizzando un materiale morbido per consentire l'imaging SRS time-lapse di cellule vive utilizzando una cornice per microscopio verticale. In questo progetto, l'obiettivo di immersione dell'acqua è stato racchiuso nella camera morbida e può muoversi liberamente in tre dimensioni per scopi di messa a fuoco e imaging.
La temperatura ottimale per la coltura della maggior parte delle cellule di mammifero è di 37 °C, mentre la temperatura ambiente è sempre inferiore di 10°. Una temperatura superiore o inferiore a 37 °C ha un effetto drammatico sul tasso di crescita cellulare13. Pertanto, il controllo della temperatura dell'ambiente di coltura cellulare è richiesto in un sistema di imaging di cellule vive. È noto che l'instabilità della temperatura porterà a problemi di sfocatura durante l'imaging a lungo termine14. Per ottenere un ambiente stabile a 37 °C, abbiamo costruito una grande camera di custodia per coprire l'intera struttura del microscopio, incluso uno strato di isolamento termico sotto il microscopio (Figura 1). All'interno della camera di controllo della temperatura di grandi dimensioni, la piccola camera flessibile aiuta a mantenere con precisione l'umidità fisiologica e il pH attraverso il flusso d'aria regolato integrato con il 5% di CO 2 (Figura 2). La temperatura e l'umidità delle camere sono state misurate per confermare che il design a doppia camera forniva la condizione ottimale di coltura cellulare per la crescita cellulare nell'imaging SRS periodico a lungo termine (Figura 3). Abbiamo quindi dimostrato l'applicazione del sistema per l'imaging time-lapse e il monitoraggio delle goccioline lipidiche (LD) nelle cellule tumorali SKOV3 (Figura 4, Figura 5 e Figura 6).
Protocollo
1. Costruire l'involucro ambientale del microscopio
NOTA: Questo grande involucro ambientale del microscopio viene utilizzato per controllare la temperatura del corpo del microscopio e l'ambiente di imaging da stabilizzare a 37 °C (Figura 1A).
- Segnare le posizioni dei piedi del telaio del microscopio SRS e del palcoscenico motorizzato utilizzando un pennarello sul tavolo ottico. Montare due diaframmi dell'iride davanti allo scanner galvanometrico del microscopio e regolarli per far passare la pompa e i raggi laser Stokes attraverso il centro dei diaframmi dell'iride.
- Rimuovere la cornice del microscopio e il palcoscenico dal tavolo ottico.
- Posare il foglio di gomma siliconica (dimensioni: 31 x 29 pollici, spessore: 1/8 di pollice) sul tavolo ottico (Figura 1B).
- Tagliare la gomma siliconica lungo i segni usando un coltello, rimuovere piccoli pezzi di gomma e posizionare i fogli quadrati di ceramica MICA (dimensioni: 6 x 6 pollici, spessore: 1/4 di pollice) nelle stesse posizioni.
NOTA: La ceramica MICA è un materiale facile da lavorare15. È duro come l'alluminio ma è un eccellente isolante termico. Le lastre ceramiche MICA sono state utilizzate per fermare il trasferimento di calore dal telaio e dal palcoscenico del microscopio metallico al tavolo ottico in acciaio inossidabile. Alcuni fori passanti devono essere praticati sui fogli MICA per consentire l'uso di 1/4-20 viti per il montaggio dei piedini del telaio e del palco. - Spostare la cornice del microscopio e il palco sul tavolo ottico e allineare con cura i piedini sui fogli ceramici MICA lungo le linee di marcatura. Utilizzare 1/4-20 viti per montare il telaio e il palco sul tavolo.
- Riallineare il percorso ottico SRS. Regolare i supporti a specchio di Mirror 1 e Mirror 2 per far passare il raggio laser attraverso il centro dei due diaframmi del diaframma premontati (Figura 2).
NOTA: I dettagli tecnici del microscopio SRS costruito in laboratorio utilizzato per l'attuale lavoro di imaging delle cellule vive sono descritti in precedenza16. La larghezza dell'impulso della pompa e dei fasci Stokes è ~ 3-4 ps con dispersione dell'asta di vetro. Il sistema è controllato tramite il software ScanImage17 . - Sopra questa fondazione di isolamento termico, assemblare l'involucro ambientale per coprire l'intero telaio del microscopio utilizzando cinque pezzi di grandi lastre di policarbonato (dimensioni: 31 x 29 x 28 pollici, spessore: 0,25 pollici).
NOTA: La dimensione della scatola della custodia è determinata in base alle dimensioni del telaio del microscopio e del palcoscenico. Il pannello frontale della scatola del microscopio dovrà essere rimosso temporaneamente per installare la camera flessibile e caricare il piatto di coltura cellulare.- Per assemblare l'involucro, eseguire semplici lavori di lavorazione, tra cui taglio, foratura e maschiatura dei fori delle viti su ciascun bordo delle lastre di policarbonato. Tagliare due grandi fori con un diametro di 2,6 pollici sui fogli destro e sinistro della custodia per adattarsi rispettivamente ai tubi di ingresso e di uscita. Tagliare un piccolo foro con un diametro di 5 mm sul foglio posteriore per consentire ai raggi laser di entrare nella custodia.
- Sigillare i bordi e le interfacce della scatola utilizzando nastro di alluminio.
- Collegare il tubo flessibile del condotto alle porte di ingresso e di uscita della scatola della custodia per consentire il flusso di aria calda di circolazione pompato e controllato dal modulo riscaldatore. Posizionare il sensore termico del modulo riscaldatore nella camera flessibile in cui le celle vengono coltivate e riprese. Impostare la temperatura target a 37 °C.
NOTA: Un diffusore può essere utilizzato per ottenere una distribuzione più uniforme del flusso d'aria nell'involucro ambientale.
2. Assemblare la camera flessibile
- Montare il pezzo cilindrico cilindrico in alluminio lavorato 1 (materiale: alluminio 6061) sul nasello dell'obiettivo utilizzando tre viti di fissaggio (Figura 2).
- Montare il pezzo cilindrico cilindrico in alluminio 2 lavorato sul portacampioni utilizzando quattro viti 1/4-20 (Figura 2).
NOTA: Il portacampioni deve essere modificato per contenere il piatto di coltura cellulare con fondo di vetro di copertura da 50 mm. Praticare un foro passante al centro del portacampioni utilizzando una sega forata da 1-7/8 pollici. Profilare il foro con una sega da 50 mm e mantenere la profondità del foro passante ~1 mm. - Montare il portacampioni con il pezzo di alluminio 2 sul palco motorizzato e montarlo utilizzando viti.
- Posizionare il manicotto del film di gomma naturale (spessore: 0,01 pollici; incollato con adesivo cianoacrilato) tra i due pezzi di alluminio lavorati e montarlo utilizzando elastici a ciascuna estremità.
- Collegare la bombola di CO2 compressa al modulo miscelatore di gas utilizzando tubi e connettori appropriati. Impostare la pressione di ingresso di CO2 a 20-25 psi. Utilizzare un sensore CO 2 integrato e un controller per garantire che il modulo miscelatore dell'aria possa regolare e miscelare il 5% di CO2 nel flusso d'aria. Utilizzare filtri in linea per pulire il flusso d'aria.
- Utilizzando tubi e connettori adeguati, guidare l'aria miscelata (con il 5% di CO2) verso la bottiglia d'acqua presterilizzata posta sulla piastra calda, quindi guidare l'aria umidificata verso la camera flessibile. Impostare la piastra riscaldante a 37 °C. Bolle il flusso d'aria nell'acqua calda per aumentare l'umidità del flusso d'aria.
3. Preparazione per esperimenti di imaging SRS di cellule vive time-lapse
- Pulire tutte le parti della camera flessibile con etanolo al 70%, compreso il nasello, l'obiettivo di immersione dell'acqua e il supporto del campione.
- Decontaminare l'intero sistema di custodia utilizzando una lampada UV posizionata nella custodia per 20-30 minuti.
NOTA: Non rimanere nella stanza di laboratorio durante il processo di disinfezione UV per sicurezza. - Coltura di cellule SKOV3 in una capsula di Petri con fondo di vetro da 50 mm per 12 ore in normali condizioni fisiologiche in una normale incubatrice.
NOTA: Avviare la coltura cellulare SKOV318 in un armadio di biosicurezza standard. - Scollegare il pezzo di alluminio lavorato 2 dal portacampioni rimuovendo le viti.
NOTA: Questo è il modo per aprire la camera flessibile per caricare il piatto di coltura cellulare. - Caricare il piatto di coltura cellulare. Ricordarsi di aggiungere olio ad immersione sulla parte superiore del condensatore prima di posizionare il piatto di coltura cellulare. Rimuovere il coperchio del piatto e immobilizzare il piatto usando i morsetti.
NOTA: Per evitare la contaminazione, tutte le operazioni devono essere eseguite con i guanti. - Abbassare l'obiettivo nei terreni di coltura cellulare per una messa a fuoco grossolana. Abbassare il pezzo di alluminio 2 per racchiudere la camera flessibile e montarlo sul supporto del campione utilizzando viti.
NOTA: Un cuscino in gomma siliconica da 2 mm è fissato sul fondo del pezzo di alluminio 2 per sigillare saldamente lo spazio. - Impostare l'alimentazione dell'aria con il 5% di CO 2 e il 19% di O2 per la normale coltura cellulare con una portata d'aria di 200 cc/min.
NOTA: è possibile utilizzare una portata d'aria inferiore. Dipende da quanto bene è sigillata la camera flessibile.
4. Condurre esperimenti di imaging SRS con cellule vive time-lapse
- Sintonizzare la lunghezza d'onda del laser a 805 nm per indirizzare lo spostamento Raman di 2854 cm-1 , che è attribuito alla vibrazione dei legami chimici CH2 . Utilizzare una bassa potenza laser per ridurre il fotodanneggiamento delle cellule. Per seguire questo protocollo, utilizzare ~ 15 mW di potenza media del laser a pompa e ~ 7,5 mW del laser Stokes (fissato a 1.045 nm) per l'imaging a lungo termine delle cellule vive.
NOTA: una maggiore potenza laser produrrà una migliore qualità dell'immagine SRS. Tuttavia, una potenza laser troppo elevata indurrà danni fotografici alle cellule vive. C'è un compromesso tra qualità dell'immagine e fotodanneggiamento. - Regolare e mettere a fuoco l'obiettivo per ottenere una buona immagine SRS delle celle utilizzando il pulsante FOCUS sul pannello CONTROLLI PRINCIPALI del software. Per eseguire una messa a fuoco rapida, impostate il numero di pixel su 512 × 512 pixel con un tempo di permanenza dei pixel di 4,8 μs nel pannello CONFIGURAZIONE .
- Impostare l'intervallo di ingresso dell'amplificatore lock-in (in genere 5 mV) in modo che sia il doppio della tensione massima del segnale. Impostare il filtro passa-basso in modo che corrisponda al tempo di permanenza dei pixel (4,8 μs).
NOTA: diversi sistemi SRS costruiti in laboratorio possono utilizzare impostazioni di acquisizione dati diverse. - Dopo aver ottenuto una buona messa a fuoco, impostare la risoluzione dell'immagine su 2.048 × 2.048 pixel per un campo visivo di 175 μm2 per l'acquisizione di immagini di alta qualità. Controllare la funzione SAVE sul pannello CONTROLLI PRINCIPALI e controllare il canale SRS sul pannello CANALI . Impostate il tempo di intervallo tra due fotogrammi su 180 s (3 min) sul canale MAIN CONTROLS. Impostare il numero di acquisizione su 480 per l'imaging time-lapse nell'arco di 24 ore.
NOTA: è possibile utilizzare una risoluzione di imaging inferiore in base allo scopo degli esperimenti. - Avviare l'acquisizione automatica delle immagini utilizzando la funzione LOOP sul pannello CONTROLLI PRINCIPALI .
NOTA: verificare se c'è una deriva focale dovuta all'instabilità della temperatura nella prima ora di imaging. L'imaging della prima ora potrebbe non essere stabile. Controllare la messa a fuoco ogni 2-3 ore durante la sessione di imaging time-lapse. - Elaborare le immagini raccolte utilizzando ImageJ19. Utilizzare i seguenti due metodi per la quantificazione della LD: (i) il rapporto LD/area corporea cellulare e (ii) l'intensità media SRS delle LD totali. Misurare l'area del corpo cellulare sospendendo e azzerando i pixel non cellulari nelle immagini SRS a 2.854 cm-1. Misurare l'area LD e l'intensità sospendendo e azzerando i pixel non LD nelle immagini SRS.
NOTA: ulteriori dettagli sull'elaborazione delle immagini SRS sono stati segnalati in precedenza16.
Risultati
Abbiamo fabbricato e assemblato il sistema a camera flessibile per l'imaging SRS time-lapse (Figura 1 e Figura 2), quindi valutato le prestazioni del sistema. La temperatura all'interno dell'involucro ambientale del microscopio ha raggiunto i 37 °C previsti entro 1 ora, il che non ha influenzato significativamente la temperatura ambiente (Figura 3A). La temperatura nella camera flessibile ha raggiunto i 37 °C in 1,5 ore ed è stata mantenuta stabilmente a 37 °C per almeno 24 ore (figura 3B). L'umidità relativa nella camera flessibile potrebbe raggiungere l'85% in 1 ora, e quindi essere mantenuta per almeno 24 ore (Figura 3C). I dati misurati di temperatura e umidità confermano che questo sistema può fornire un ambiente ottimale per la crescita cellulare a lungo termine.
L'imaging di cellule vive con SRS è stato applicato a molti studi biologici e biomedici 20,21,22,23,24. In particolare, l'imaging SRS di LD label-free in cellule vive per comprendere il metabolismo lipidico nel cancro ha attirato molta attenzione16,25,26. Utilizzando il sistema a camera flessibile progettato, abbiamo prima eseguito l'imaging SRS time-lapse di cellule SKOV3 vive per 24 ore con un intervallo di tempo di 3 minuti (Figura 4). I dati video hanno mostrato il movimento rapido e attivo dei LD intracellulari con una risoluzione temporale di 3 minuti. Alla fine della sessione di imaging di 24 ore, le cellule mostravano ancora morfologia e densità normali, indicando che le cellule erano sane. Abbiamo quindi ripreso le cellule SKOV3 trattate con acido oleico (OA) e monitorato il processo dinamico di accumulo di LD entro 10 ore (Figura 5A).
Le quantità di LD sono state quantificate nelle cellule SKOV3 trattate con OA in due modi (rapporto LD / area corporea cellulare e intensità SRS totale delle LD) utilizzando ImageJ19. I risultati indicano che la quantità di LD (in termini di dimensioni e numero) ha continuato ad aumentare oltre le 10 ore (figura 5B). Abbiamo anche dimostrato l'imaging SRS simultaneo in avanti di LD (pseudo colore verde) e l'imaging a fluorescenza a due fotoni (TPF) all'indietro di lisosomi (pseudo colore rosso) marcati con un colorante a fluorescenza DND-189 (Figura 6). Si noti che l'imaging a doppia modalità SRS/TPF può essere utilizzato per analizzare la colocalizzazione di due compartimenti cellulari. In questo esperimento, è stato osservato un grado molto basso di colocalizzazione di LD e lisosomi, che è stato indicato dalle piccole regioni gialle. Collettivamente, questi risultati dimostrano che il sistema a camera flessibile consente l'imaging SRS stabile, a lungo termine e time-lapse di cellule vive, che può essere utilizzato per varie applicazioni di imaging in futuro.
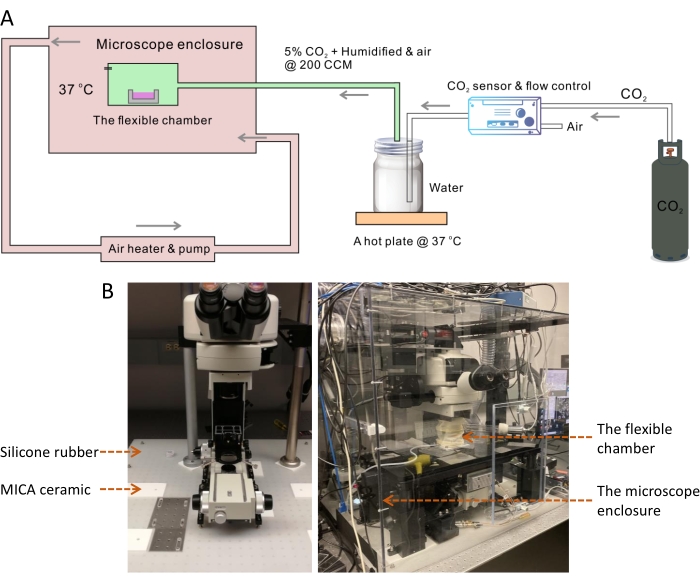
Figura 1: Il sistema a camera flessibile per l'imaging SRS time-lapse di cellule vive. (A) Schema del sistema a camera flessibile per l'imaging SRS time-lapse di cellule vive. (B) L'immagine a sinistra mostra lo strato di isolamento termico utilizzando un foglio di gomma siliconica e cuscinetti in ceramica MICA sotto la cornice del microscopio e il palco. L'immagine a destra mostra l'involucro del microscopio ambientale e la camera flessibile. Abbreviazioni: SRS = scattering Raman stimolato; CCM = centimetri cubici al minuto. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Schema e immagini della camera flessibile con il percorso ottico SRS, che consente il libero movimento tridimensionale dell'obiettivo di immersione dell'acqua per la messa a fuoco e l'imaging. Le immagini a sinistra mostrano i due moduli in alluminio lavorato collegati a un nasello per obiettivi commerciali e a un portacampioni modificato. Le immagini in basso mostrano il sistema di camere flessibili di assemblaggio. Abbreviazione: SRS = scattering Raman stimolato. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Dati di temperatura e umidità dell'involucro del microscopio e della camera flessibile. (A) I dati di temperatura misurati della custodia del microscopio e della temperatura della stanza del laboratorio, fino a 12 ore. (B) I dati di temperatura misurati (media a 37 °C) all'interno della camera flessibile, fino a 24 ore. C) i dati misurati relativi all'umidità (media dell'85%) all'interno della camera flessibile; fino a 24 h. Clicca qui per visualizzare una versione ingrandita di questa figura.

Figura 4: 24 fotogrammi rappresentativi di imaging SRS time-lapse. Imaging SRS time-lapse (a 2.854 cm-1) di cellule SKOV3 vive utilizzando la camera flessibile, fino a 24 ore. In questo esperimento, sono stati registrati 480 fotogrammi con un intervallo di tempo fisso di 3 minuti. Le cellule sono state coltivate in condizioni normali. Barra di scala = 50 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
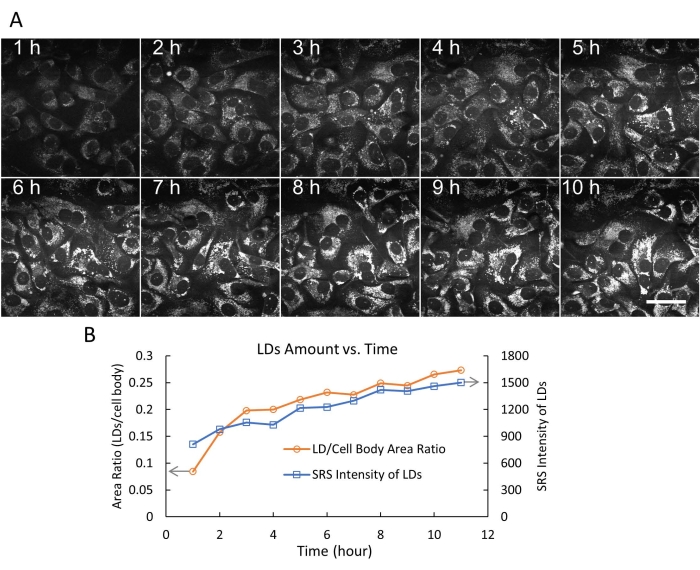
Figura 5: Imaging SRS time-lapse e quantificazione delle goccioline lipidiche. (A) 10 fotogrammi rappresentativi di imaging SRS time-lapse (a 2.854 cm-1) di cellule SKOV3 vive trattate con 500 μM OA, fino a 10 ore, utilizzando la camera flessibile. In questo esperimento, sono stati registrati 200 fotogrammi con un intervallo di tempo fisso di 3 minuti. Barra di scala = 50 μm. (B) La quantità di LD rispetto al tempo (0-10 h) è stata quantificata in due modi (rapporto LD/area corporea cellulare e intensità SRS totale delle LD) utilizzando la funzione di soglia e le funzioni di analisi delle particelle in ImageJ. Abbreviazioni: SRS = spettroscopia Raman stimolata; OA = acido oleico; LDs= goccioline lipidiche. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 6: Time-lapse, SRS simultaneo e imaging a fluorescenza a due fotoni per LD e lisosomi. Time-lapse, SRS simultaneo (a 2.854 cm-1) e imaging a fluorescenza a due fotoni per LD (pseudo colore verde) e lisosomi (rosso), fino a 2 ore. Le cellule sono state trattate con un colorante a fluorescenza (LysoSensor DND-189, 1 μM) per 1 ora prima dell'imaging. Le immagini sono state scattate ogni 3 minuti. Barra di scala = 50 μm. È stato osservato un basso grado di colocalizzazione di LD e lisosomi, indicato con il colore giallo. Abbreviazioni: SRS = spettroscopia Raman stimolata; LDs= goccioline lipidiche. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
La microscopia SRS a cellule vive time-lapse è una tecnica di imaging alternativa per il tracciamento delle molecole in modo label-free. Rispetto alla marcatura a fluorescenza, l'imaging SRS è privo di fotosbiancamento, consentendo il monitoraggio a lungo termine delle molecole. Tuttavia, ad oggi, il sistema di imaging di cellule vive su una microscopia SRS verticale non è disponibile in commercio. In questo lavoro, è stato sviluppato un sistema di imaging di cellule vive con una scatola stabile per microscopio isolato termicamente e una camera morbida interna flessibile per consentire l'imaging time-lapse SRS trasmesso. In questa configurazione, l'ampia scatola di custodia mantiene la stabilità della temperatura a 37 °C, mentre la camera morbida interna fornisce aria umidificata per stabilire un ambiente di coltura cellulare ottimale. La camera aperta flessibile dimostrata in questo lavoro consente un flusso di lavoro semplice per l'imaging SRS a lungo termine di cellule vive. Le cellule seminate in un piatto con fondo di vetro possono essere prima preparate e coltivate in una normale incubatrice prima di trasferirsi nella camera flessibile sul palco per l'imaging. Una soluzione alternativa per eseguire l'imaging SRS a cellule vive consiste nell'utilizzare una cella a flusso chiusa, comprese le piattaforme di citometria microfluidica e a flusso27,28,29,30. È possibile progettare una cella di flusso con uno spessore inferiore. Tuttavia, la coltura di cellule in una camera di perfusione può essere tecnicamente impegnativa31.
La deriva focale è un problema comune nell'imaging delle cellule vive32. Come processo multifotonico, la generazione del segnale SRS richiede una stretta focalizzazione dei raggi laser e, pertanto, la microscopia SRS è altamente sensibile alla deriva focale. L'instabilità della temperatura è un fattore essenziale nell'indurre la deriva focale. Per migliorare la stabilità termica, l'intero microscopio è stato racchiuso con materiali termoisolanti. Tuttavia, in alcune sessioni di imaging, abbiamo ancora sperimentato la deriva focale dopo 2-3 ore di imaging. L'imaging microscopico SRS è anche sensibile alle vibrazioni, che possono distruggere la messa a fuoco. Un tavolo ottico antivibrante aiuta a ridurre le vibrazioni per ottenere immagini stabili. Per risolvere il problema della deriva focale, in esperimenti futuri, potrebbero essere adottate tecnologie di messa a fuoco automatica33.
La procedura di disinfezione del sistema di imaging è fondamentale per evitare la contaminazione delle cellule, in particolare per l'obiettivo di immersione in acqua, che contatterà direttamente il terreno di coltura cellulare. Dovrebbe essere sicuro usare etanolo al 70% per la pulizia superiore della lente. Poiché la luce UV può disinfettare efficacemente solo la superficie degli oggetti, quattro lampade UV sono state montate in diverse posizioni nella scatola della custodia per eseguire la disinfezione in questi esperimenti. Tuttavia, la luce UV può degradare i componenti plastici nel sistema di imaging. In questo caso, si può usare un foglio di alluminio per avvolgere e coprire le parti in plastica. Per l'imaging delle cellule vive, gli antibiotici (di solito 100 unità / ml di penicillina e 100 μg / ml di streptomicina nei terreni di coltura) sono altamente raccomandati.
Abbiamo immaginato e quantificato le LD nelle cellule tumorali vive in questi esperimenti. Per questi esperimenti, un intervallo di tempo di 3 minuti era ragionevole. Si noti che l'intervallo di tempo di imaging potrebbe essere modificato a seconda delle esigenze del progetto di ricerca. Ad esempio, per tenere traccia di un singolo LD in una cella attiva, potrebbe essere necessario un intervallo di tempo inferiore a 1 minuto. Al contrario, un intervallo di tempo più lungo di pochi minuti è sufficiente per tracciare i processi biologici lenti34.
L'imaging SRS utilizza una potenza laser più elevata per l'eccitazione rispetto a molte altre tecnologie di imaging ottico, il che può essere difficile per l'imaging SRS time-lapse a lungo termine di cellule vive. L'imaging SRS delle biomolecole native è ancora più impegnativo a causa della minuscola sezione trasversale Raman dei legami chimici35. In questi esperimenti, sono stati utilizzati un laser a pompa da 15 mW a 805 nm e un laser Stokes da 7,5 mW a 1.045 nm e non è stato osservato alcun fotodanno significativo in 24 ore con un intervallo di tempo di 3 minuti. L'uso di tag Raman sensibili può ridurre ulteriormente la potenza del laser36.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Vogliamo ringraziare il 2019 Undergraduate Senior Design Team (Suk Chul Yoon, Ian Foxton, Louis Mazza e James Walsh) presso la Binghamton University per la progettazione, la fabbricazione e il collaudo della scatola di custodia del microscopio. Ringraziamo Scott Hancock, Olga Petrova e Fabiola Moreno Olivas della Binghamton University per le utili discussioni. Questa ricerca è stata sostenuta dal National Institutes of Health con il numero di premio R15GM140444.
Materiali
| Name | Company | Catalog Number | Comments |
| A lab-built SRS microscope | https://rdcu.be/cP6ve | ||
| HF2LI 50 MHz lock-in amplifer | Zurich Instruments | HF2LI | |
| Iris diaphragm | Thorlabs Inc | SM1D12 | |
| Kinematic mirror mount | Thorlabs Inc | KM100 | |
| Microscope frame | Nikon Inc | FN-1 | |
| Motorized microscopy stage | Prior Scientific | Z-Deck | |
| Oil-immersion condenser (C-AA Achromat/Aplanat, NA 1.4) | Nikon Inc | MBL71405 | |
| Water-immersion objective (CFI75 Apo 25XC W 1300) | Nikon Inc | MRD77225 | |
| Materials and parts for the microscope enclosure (31'' x 29'' x 28'' L x W x H) | |||
| Airtherm heater module | World Precision Instruments (WPI) | AIRTHERM-SAT-1W | |
| Airtherm heater controller, CO2 and humidity monitor | World Precision Instruments (WPI) | AIRTHERM-SMT-1W | |
| Air/CO2 mixer module | World Precision Instruments (WPI) | ECU-HOC-W | |
| Flexible duct hose (2-1/2'' ID, 2-3/4'' OD) | McMaster-Carr | 56675K71 | |
| High-temperature glass-mica ceramic, easy-to-machine (6'' x 6'', 1/4'' thickness) | McMaster-Carr | 8489K62 | |
| Polycarbonate sheets (thickness 0.25'') | McMaster-Carr | 8574K286 | |
| Silicone rubber sheets (36'' x 36'', thickness 1/8'') | McMaster-Carr | 5827T43 | |
| Materials and parts for the Flexible chamber | |||
| Hot plate | McMaster-Carr | 31745K11 | |
| High-purity inline filter, 1/4 NPT | McMaster-Carr | 6645T18 | |
| Hole saw (cutting diameter 1-7/8 inch) | McMaster-Carr | 4066A34 | |
| Hole saw (cutting diameter 50 mm) | McMaster-Carr | 4556A19 | |
| High-temperature silicone rubber tubing, soft, 2 mm ID, 5 mm OD | McMaster-Carr | 5054K313 | |
| Inline filter (1/4 NPT, 40 micron) | McMaster-Carr | 98385K843 | |
| Multipurpose 6061 Aluminum round tube (1/8'' wall thickness, 4'' OD) | McMaster-Carr | 9056K42 | |
| Multipurpose 6061 Aluminum round tube (3/4'' wall thickness, 3-3/4'' OD) | McMaster-Carr | 9056K47 | |
| Multipurpose 6061 Aluminum bar (12'' x 12'', thickness 1/4'') | McMaster-Carr | 8975K142 | |
| Multipurpose 6061 Aluminum bar (8'' x 8'', thickness 3/8'') | McMaster-Carr | 9246K21 | |
| Objective nosepiece (single) | Nikon Inc | FN-MN-H | |
| Sample holder (modified) | Prior Scientific | HZ202 | |
| Ultra-thin natural rubber film (thickness 0.01'') | McMaster-Carr | 8611K13 | |
| Vacuum-sealable glass jar | McMaster-Carr | 3231T44 | |
| Software | |||
| MATLAB | MathWorks | ||
| ImageJ (Fiji) | imagej.net | ||
| ScanImage | Vidrio Technologies, LLC | SRS imaging software | |
| Materials for live-cell imaging | |||
| Cover glass bottom sterile culture dishes (Dia.x H, 50 x 7 mm) | Electron Microscopy Sciences (EMS) | 70674-02 | |
| DMEM cell culture medium | ThermoFisher Scientific | 11965092 | |
| Fetal bovine serum (FBS) | ThermoFisher Scientific | 26140079 | |
| LysoSensor fluorescent dye DND-189 | ThermoFisher Scientific | L7535 (Invitrogen) | |
| Oleic acid | MilliporeSigma | 364525 | |
| SKOV3 cell line | ATCC | HTB-77 |
Riferimenti
- Mertz, J. . Introduction to Optical Microscopy. , (2019).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Park, Y., Depeursinge, C., Popescu, G. Quantitative phase imaging in biomedicine. Nature Photonics. 12 (10), 578-589 (2018).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nature Biotechnology. 21 (5), 539-545 (2003).
- lamo, P., et al. Fluorescent dye labeling changes the biodistribution of tumor-targeted nanoparticles. Pharmaceutics. 12 (11), 1004 (2020).
- Cheng, J. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), aaa870 (2015).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Hill, A. H., Fu, D. Cellular imaging using stimulated Raman scattering microscopy. Analytical Chemistry. 91 (15), 9333-9342 (2019).
- Buđa, R., Vukušić, K., Tolić, I. . Methods in Cell Biology. (139), 81-101 (2017).
- Chiarelli, T. J., Grieshaber, N. A., Grieshaber, S. S. Live-cell forward genetic approach to identify and isolate developmental mutants in Chlamydia trachomatis. Journal of Visualized Experiments. (160), e61365 (2020).
- Lemon, W. C., McDole, K. Live-cell imaging in the era of too many microscopes. Current Opinion in Cell Biology. 66, 34-42 (2020).
- Birk, S. E., et al. Management of oral biofilms by nisin delivery in adhesive microdevices. European Journal of Pharmaceutics and Biopharmaceutics. 167, 83-88 (2021).
- Watanabe, I., Okada, S. Effects of temperature on growth rate of cultured mammalian cells (L5178Y). Journal of Cell Biology. 32 (2), 309-323 (1967).
- Lac, A., Lam, A. L., Heit, B. . Fluorescent Microscopy. , 57-73 (2022).
- Grossman, D. G. Machinable glass-ceramics based on tetrasilicic mica. Journal of the American Ceramic Society. 55 (9), 446-449 (1972).
- Yuan, Y., Shah, N., Almohaisin, M. I., Saha, S., Lu, F. Assessing fatty acid-induced lipotoxicity and its therapeutic potential in glioblastoma using stimulated Raman microscopy. Scientific Reports. 11 (1), 1-14 (2021).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomedical Engineering Online. 2 (1), 1-9 (2003).
- Sun, M. W., Yuan, Y. H., Lu, F. K., Di Pasqua, A. J. Physicochemical factors that influence the biocompatibility of cationic liposomes and their ability to deliver DNA to the nuclei of ovarian cancer SK-OV-3 cells. Materials. 14 (2), 416 (2021).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ozeki, Y., Itoh, K. Stimulated Raman scattering microscopy for live-cell imaging with high contrast and high sensitivity. Laser Physics. 20 (5), 1114-1118 (2010).
- Zhang, X., et al. Label-free live-cell imaging of nucleic acids using stimulated Raman scattering microscopy. ChemPhysChem. 13 (4), 1054-1059 (2012).
- Stiebing, C., et al. Real-time Raman and SRS imaging of living human macrophages reveals cell-to-cell heterogeneity and dynamics of lipid uptake. Journal of Biophotonics. 10 (9), 1217-1226 (2017).
- Miao, K., Wei, L. Live-cell imaging and quantification of PolyQ aggregates by stimulated Raman scattering of selective deuterium labeling. ACS Central Science. 6 (4), 478-486 (2020).
- Brzozowski, K., et al. Stimulated Raman scattering microscopy in chemistry and life science -Development, innovation, perspectives. Biotechnology Advances. 60, 108003 (2022).
- Hislop, E. W., Tipping, W. J., Faulds, K., Graham, D. Label-free imaging of lipid droplets in prostate cells using stimulated Raman scattering microscopy and multivariate analysis. Analytical Chemistry. 94 (25), 8899-8908 (2022).
- Chen, T., Yavuz, A., Wang, M. C. Dissecting lipid droplet biology with coherent Raman scattering microscopy. Journal of Cell Science. 135 (5), jcs252353 (2022).
- Cao, C., Zhou, D., Chen, T., Streets, A. M., Huang, Y. Label-Free digital quantification of lipid droplets in single cells by stimulated Raman microscopy on a microfluidic platform. Analytical Chemistry. 88 (9), 4931-4939 (2016).
- Zhang, C., et al. Stimulated Raman scattering flow cytometry for label-free single-particle analysis. Optica. 4 (1), 103-109 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences of the United States of America. 116 (32), 15842-15848 (2019).
- Gala de Pablo, J., Lindley, M., Hiramatsu, K., Goda, K. High-throughput Raman flow cytometry and beyond. Accounts of Chemical Research. 54 (9), 2132-2143 (2021).
- Cole, R. Live-cell imaging: the cell's perspective. Cell Adhesion & Migration. 8 (5), 452-459 (2014).
- Kreft, M., Stenovec, M., Zorec, R. Focus-drift correction in time-lapse confocal imaging. Annals of the New York Academy of Sciences. 1048 (1), 321-330 (2005).
- Firestone, L., Cook, K., Culp, K., Talsania, N., Preston Jr, K. Comparison of autofocus methods for automated microscopy. Cytometry: The Journal of the International Society for Analytical Cytology. 12 (3), 195-206 (1991).
- Van Helvert, S., Storm, C., Friedl, P. Mechanoreciprocity in cell migration. Nature Cell Biology. 20 (1), 8-20 (2018).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544 (7651), 465-470 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon