Method Article
Высокомультиплексная визуализация тканей с помощью рамановых красителей
В этой статье
Резюме
Электронная предрезонансная стимуляция рамановского рассеяния (epr-SRS) радужных рамановских красителей является новой платформой для высокомаплексированной эпитопной визуализации белков. Здесь мы представляем практическое руководство, включающее подготовку антител, окрашивание образцов тканей, сборку микроскопа SRS и визуализацию тканей epr-SRS.
Аннотация
Визуализация обширного спектра специфических биомаркеров в тканях играет жизненно важную роль в изучении сложных организаций сложных биологических систем. Следовательно, технологии визуализации с высокой степенью мультиплексирования получают все большую оценку. Здесь мы описываем новую платформу высокомультиплексированной вибрационной визуализации специфических белков с сопоставимой чувствительностью со стандартной иммунофлуоресценцией с помощью электронной предрезонансной стимулированной рамановской рассеяния (epr-SRS) визуализации радужных рамановских красителей. Этот метод обходит предел спектрально-рассасываемых каналов в обычной иммунофлуоресценции и обеспечивает однократный оптический подход для опроса нескольких маркеров в тканях с субклеточным разрешением. Как правило, он совместим со стандартными тканевыми препаратами, включая параформальдегид-фиксированные ткани, замороженные ткани и формалин-фиксированные парафиновые (FFPE) ткани человека. Мы предполагаем, что эта платформа обеспечит более полную картину белковых взаимодействий биологических образцов, особенно для толстых интактных тканей. Этот протокол обеспечивает рабочий процесс от подготовки антител до окрашивания образца ткани, сборки микроскопа SRS и визуализации тканей epr-SRS.
Введение
Сложные тканевые системы состоят из различных клеточных субпопуляций, пространственные расположения и сети взаимодействия которых глубоко переплетены с их функциями и дисфункциями 1,2. Чтобы выявить архитектуру ткани и исследовать ее сложность, знание пространственных расположений белков при одноклеточном разрешении имеет важное значение. Следовательно, высоко мультиплексированные технологии визуализации белка получают все большую оценку и могут стать краеугольным камнем для изучения биологии тканей 3,4,5. Современные распространенные методы визуализации мультиплексированного белка можно разделить на две основные категории. Одним из них является серийная иммунофлуоресцентная визуализация, основанная на нескольких раундах окрашивания и визуализации тканей, а другая - визуализация массовой цитометрии в сочетании с антителами с метками тяжелых металлов 6,7,8,9,10,11,12.
Здесь представлена альтернативная стратегия визуализации белка на основе мультиплексированных антител. В отличие от распространенной модальности флуоресцентной визуализации, которая может визуализировать только 4-5 каналов одновременно из-за широкого спектра возбуждения и излучения (полная ширина при половинном максимуме (FWHM) ~ 500 см-1), рамановская микроскопия демонстрирует гораздо более узкую спектральную ширину линии (FWHM ~ 10 см-1) и, следовательно, обеспечивает масштабируемую мультиплексию. Недавно, используя узкий спектр, была разработана новая схема рамановской микроскопии, названная электронной предрезонансной стимулированной рамановской микроскопией (epr-SRS), обеспечивающая мощную стратегию для мультиплексированной визуализации13. Исследуя вибрационные режимы с электронной связью рамановских красителей, epr-SRS достигает резкого эффекта усиления в 1013 раз на рамановских поперечных сечениях и преодолевает узкое место чувствительности обычной рамановской микроскопии (рисунок 1A)13,14,15. В результате предел обнаружения epr-SRS был увеличен до суб-мкМ, что позволяет рамановскому обнаружению интересных молекулярных маркеров, таких как специфические белки и органеллы внутри клеток13,16. В частности, с использованием рамановских красителеконъюгированных антител была продемонстрирована эпр-SRS-визуализация специфических белков в клетках и тканях (называемая иммуно-эпр-СРСРС) с сопоставимой чувствительностью со стандартной иммунофлуоресценцией (рисунок 1B)13,17. Настроив длину волны насоса всего на 2 нм, сигнал epr-SRS будет полностью отключен (рисунок 1B), что демонстрирует высокий вибрационный контраст.
На стороне зонда был разработан набор радужных рамановских зондов, называемых красителями Манхэттенского рамановского рассеяния (MARS), для конъюгации антител 13,18,19,20. Эта уникальная рамановская палитра состоит из новых красителей, несущих π-сопряженные тройные связи (дополнительный материал), каждый из которых отображает один и узкий пик epr-SRS в биоортогональном спектральном диапазоне рамановского диапазона (рисунок 1C). Путем модификации структуры основного хромофора и изотопного редактирования обоих атомов тройной связи (дополнительного материала) были разработаны спектрально разделенные рамановские зонды. Используя масштабируемую мультиплексность, микроскопия epr-SRS в сочетании с палитрой красителей MARS предлагает оптическую стратегию для однократной мультиплексной визуализации белка в клетках и тканях.
Immuno-eprSRS обеспечивает альтернативную стратегию современным методам мультиплексной визуализации белка с уникальными сильными сторонами. По сравнению с флуоресцентными подходами с циклическим окрашиванием, визуализацией и удалением сигнала, эта платформа на основе комбинационного рассеяния обеспечивает однокруглое окрашивание и визуализацию. Таким образом, он обходит практическую сложность в циклических процедурах и в значительной степени упрощает протокол, тем самым открывая новые области мультиплексированной белковой визуализации. Например, используя протокол очистки тканей, адаптированный к рамановскому красителю, иммуно-eprSRS был расширен до трех измерений для картирования сильно мультиплексированного белка в толстых интактных тканях17. Более 10 белковых мишеней были визуализированы вдоль миллиметровых тканей мозга мыши17. Совсем недавно было продемонстрировано соединение иммуно-eprSRS с оптимизированной расширительной микроскопией с биомолекулами (ExM) по протоколу21, однокадровая наноразмерная визуализация нескольких мишеней22. По сравнению с визуализационной масс-спектроскопией 4,9, epr-SRS является неразрушающим и обладает внутренне оптической способностью к сечению. Кроме того, epr-SRS более экономит время при сканировании тканей. Как правило, область ткани 0,25мм2 с размером пикселя 0,5 мкм занимает всего несколько минут для изображения одного канала epr-SRS. Например, общее время визуализации четырех каналов SRS плюс четыре флуоресцентных канала на рисунке 4 составляет около 10 мин.
протокол
Протокол был проведен в соответствии с протоколом экспериментов на животных (AC-AABD1552), одобренным Институциональным комитетом по уходу за животными и их использованию в Колумбийском университете.
1. Получение раман-краситель-конъюгированных антител
- Подготовьте буфер сопряжения как ~0,1 M NaHCO3 в буфере PBS, pH = 8,3, хранить при 4 °C.
- Готовят N-гидроксисукцинимидию (NHS) эфирно-функционирующий раствор зонда MARS (дополнительный материал) в виде 3 мМ в безводном ДМСО. Синтез зондов MARS можно отнести к предыдущим отчетам 13,17,18.
ПРИМЕЧАНИЕ: Для целей хранения раствор эфира красителя NHS должен быть защищен от света и храниться при температуре -20 °C. - Растворяют твердые антитела в буфере конъюгации до концентрации 2 мг/мл. Для антител, которые растворяются в других буферах, обменивают их в буфер конъюгации до концентрации 1-2 мг/мл с центробежными фильтрами.
ПРИМЕЧАНИЕ: Для мультиплексного окрашивания предпочтительны вторичные антитела с высокой степенью перекрестной адсорбции, чтобы свести к минимуму межвидовую реактивность. Используемые вторичные антитела перечислены в Таблице 1 и Таблице материалов. - Выполните реакцию сопряжения.
- Для вторичных антител добавляют 15-кратный молярный избыток раствора красителя к раствору антител в стеклянном флаконе медленно при перемешивании. Например, в 0,5 мл 2 мг/мл раствора антител добавляют 35 мкл 3 мМ раствора красителя.
- Инкубировать реакционную смесь при комнатной температуре (РТ) с перемешиванием в течение 1 ч. Защитите реакцию от света.
- Очистка.
- Подготовьте суспензию из гелевой фильтрационной смолы (Таблица материалов) в буфере PBS, следуя шагам 1.5.2-1.5.4.
- Добавьте 10 мл порошка гелевой фильтрационной смолы в 40 мл буфера PBS внутри 50-мл пробирки.
- Держите раствор на водяной бане при температуре 90 °C в течение 1 ч.
- Декантируйте супернатант и повторно добавляйте PBS до 40 мл. Хранить навозную жижу при температуре 4 °C.
- Упакуйте столбик исключения размеров (диаметр 1 см, самотечные колонны) раствором навозной жижи высотой 10-15 см.
- Промыть и промыть колонну ~10 мл буфера PBS для дальнейшей упаковки смолы.
- Пипетка реакционной смеси сопряжения (~0,5 мл) в колонну. Немедленно добавьте 1 мл буфера PBS в качестве буфера элюирования, когда вся реакционная смесь загружена. Постоянно пополняйте буфер элюирования (PBS) в столбец.
- Соберите элюат сопряженного раствора, посмотрев на цвет на колонке (красители MARS имеют светло-зеленый до синего цвета) или измерив поглощение при 280 нм (A280).
- Концентрировать собранный раствор до 1-2 мг/мл с помощью центробежного фильтра.
- Определение концентрации и средней степени маркировки (DOL, отношение красителя к белку) путем измерения ультрафиолетово-видимого (UV-Vis) спектра сопряженного раствора с помощью считывателя нанопластин.
ПРИМЕЧАНИЕ: Дополнительный материал обеспечивает свойства MARS-красителя NHS-эфиров для расчета. Нормальный DOL для вторичного антитела составляет около 3.
2. Пробоподготовка тканей
- Параформальдегид фиксируется тканями мозга мыши.
- Обезболивают мышей (C57BL/6J, самка, 25 d после родов) изофлураном. Оцените правильную анестезию с помощью теста на щипки пальца ноги.
- Убивайте мышей путем смещения шейки матки. Перфицитируйте мышей сразу же с 4% параформальдегидом (PFA) в PBS транскардиально.
- Соберите мозг мыши, выполнив шаги 2.1.4-2.1.5
- Вырежьте вверх от ствола мозга вдоль сагиттального шва. Отойдите две половинки черепа в сторону и вычерпните мозг пинцетом.
- Зафиксируйте собранный мозг в 4% PFA в PBS при 4 °C в течение 24 ч. Затем промыть мозг в буфере PBS при 4 °C в течение 24 ч, чтобы удалить избыток PFA.
- Поместите твердую агарозу в воду до конечной концентрации 7% (мас./об.) в стакан со рыхлой крышкой. Размешайте раствор стеклянным перемешивающим стержнем. Нагрейте суспензию в микроволновой печи до тех пор, пока раствор не станет прозрачным.
- Дайте агарозе остыть до 45-55 °C.
- Налейте жидкую агарозу в небольшую камеру, затем переведите мозг из PBS в жидкую агарозу и сориентируйте его шпателем, чтобы встроить мозг. Подождите, пока ткань-агарозный блок затвердеет.
- Разделите ткань-агрозу на корональные срезы толщиной 40 мкм с помощью вибратома.
- Переложите ткань на 4-луночную пластину для последующего окрашивания. Удалите агарозу пинцетом. Промыть ткань 1 мл PBS, три раза.
- Исправлены замороженные ткани поджелудочной железы мыши.
- Фиксируют поджелудочную железу мыши в 4% PFA в PBS при 4 °C с раскачиванием в течение 16-20 ч.
- Промыть образец в 1 мл PBS (4 °C) три раза, чтобы удалить PFA.
- Вставьте образец (размером ~0,3-0,5 см) в компаундные блоки с оптимальной температурой резания (OCT). Поместите 2 капли OCT в пластиковый криомольд. Поместите ткань в правильную ориентацию и вылейте ОКТ поверх тканей, пока ни одна из тканей не останется открытой.
- Разделите поджелудочную железу до ломтиков толщиной 8 мкм и обездвижите их на тканевую связывающую стеклянную горку, храните их при -80 °C.
- Перед окрашиванием уравновешивайте образец до RT. Вымойте ткань PBS, чтобы удалить блоки OCT.
- Образцы FFPE.
- Выпекайте тканевый слайд FFPE при 60 °C в течение 10 мин.
- Депарафинизация и регидратация: Поместите образцы последовательно в следующие растворы в пробирку 50 мл на RT в течение 3 мин каждый раз с легким встряхиванием:
ксилол два раза,
этанол в два раза,
95% (об/об)этанола в деионизированной воде два раза,
70% (об/об)этанола в деионизированной воде два раза,
50% (об/об)этанола в деионизированной воде один раз,
деионизированная вода один раз. - Переведите образец в 20 мМ цитрата натрия (рН 8,0) при 100 °C в стеклянной банке. Убедитесь, что ткани погружены в раствор.
- Поставьте банку на водяную баню при температуре 60 °C на 45 минут.
- Промыть образец деионизированной водой на RT в течение 5 мин.
3. Окрашивание тканей иммуно-ЭпрСРС
- Используйте гидрофобную ручку, чтобы нарисовать границу вокруг участков ткани на слайде.
ПРИМЕЧАНИЕ: Банка для окрашивания слайдов используется для выполнения этапов инкубации ткани на слайде. Плавающие ткани (участки мозга мыши толщиной 40 мкм) окрашиваются в пластины колодца. - Инкубируют ткани с 0,3-0,5% PBST (Triton X-100 в PBS) в течение 10 мин.
- Инкубируют ткани блокирующим буфером (5% ослиная сыворотка, 0,5% Тритон Х-100 в PBS) в течение 30 мин.
- Готовят первичный окрашивающий раствор: добавляют все первичные антитела к 200-500 мкл окрашивающего буфера (2% ослиная сыворотка, 0,5% Тритон Х-100 в PBS) при желаемых концентрациях. Центрифугировать первичный окрашивающий раствор при 13 000 х г в течение 5 мин. Используйте супернатант только в том случае, если образуется осадок.
- Инкубируют ткань в растворе первичного антитела при 4 °С в течение 1-2 дней.
ПРИМЕЧАНИЕ: Для окрашивания участков ткани на слайде поместите образец в ящик для окрашивания с влажной салфеткой для поддержания влажности. - Промыть слайды три раза с 0,3-0,5% PBST на RT в течение 5 мин каждая. Используйте 1 мл PBST для плавающих тканей. Для тканей на слайде вымойте слайды в банке для окрашивания слайдов и убедитесь, что все ткани погружены в раствор.
- Инкубируют ткань в 200-500 мкл блокирующего буфера в течение 30 мин.
- Приготовьте раствор для вторичного окрашивания: добавьте все вторичные антитела (и лектины, если это необходимо) к 200-500 мкл буфера окрашивания с желаемыми концентрациями (обычно 10 мкг/мл). Центрифугируйте раствор вторичного окрашивания при 13 000 х г в течение 5 мин. Используйте супернатант только в том случае, если образуется осадок.
- Инкубируют ткани в 200-500 мкл раствора вторичных антител при 4 °С в течение 1-2 дней.
- Промыть слайды дважды с 0,3-0,5% PBST на RT в течение 5 мин каждая.
- Инкубировать с 200-500 мкл раствора DAPI в течение 30 мин.
- Трижды мойте слайды PBS на RT в течение 5 минут каждый.
- Для плавающих участков тканей переложите их на стеклянные горки с помощью пипетки, опускающей стекло. Выложите ткань тканевой щеткой и при необходимости очистите окружающую среду салфетками.
- Установите ткань в каплю антизатухающих реагентов стеклянным чехлом и закрепите ее лаком для ногтей.
4. Сборка микроскопа SRS
ПРИМЕЧАНИЕ: Коммерческая конфокальная флуоресцентная система используется в тандемной SRS-флуоресцентной визуализации. Более подробные описания можно найти в предыдущем докладе17. Этот протокол будет сосредоточен на стороне визуализации SRS с использованием узкополосного возбуждения.
- Подготовьте вибрационно-изолированный оптический стол в помещении с контролем температуры.
- Поместите синхронизированную двойную лазерную систему (насос и стокс) на оптический стол (рисунок 2А) с подключенным чиллером.
ПРИМЕЧАНИЕ: Основной лазер в двухлазерной системе обеспечивает передачу выходных импульсов на 1064 нм с шириной импульса 6 пс и частотой повторения 80 МГц. Луч Стокса исходит от фундаментального лазера. Интенсивность пучка Стокса модулировалась синусоидально встроенным электрооптическим амплитудным модулятором (ЭОМ) на частоте 8 МГц с глубиной модуляции более 90%. Другая часть фундаментального лазера удваивается по частоте до 532 нм, что дополнительно используется для синхронного засева пикосекундного оптического параметрического генератора (OPO) для получения импульсной цепи с блокировкой моды с шириной импульса 5-6 пс (луч холостого хода OPO блокируется интерферометрическим фильтром). Выходная длина волны OPO настраивается от 720-950 нм, которая служит пучком насоса. - Установите зеркала (диапазон длин волн: 750-1100 нм), дихроичные разветвители луча (DBS, 980 нм длинночастотный фильтр, прямоугольный) и объектив (ахроматический, AR-покрытие для 650-1050 нм) на соответствующие крепления. Используйте очень стабильные кинематичные зеркальные крепления для зеркал и дихроичных светоделителей.
- Измерьте высоту лазерного излучения и размеры пучка накачки и лучей Стокса. Отрегулируйте высоту зеркал и линз, чтобы свет попадал в центр всех оптических элементов.
- Поместите зеркало M1 на оптический стол и сделайте его ~45° к лазерному выходу (рисунок 2B). Используйте ручки на кинематическом креплении для регулировки наконечника и наклона. Убедитесь, что свет движется на той же высоте по длине стола и по прямой линии по отношению к столу.
- Поместите и выровняйте дихроичные светоделители (фильтры длинных частот 980 нм) и зеркала для разделения насоса и лучей Стокса (рисунок 2A-B).
- Поместите и выровняйте пары линз (L1, L2 и L3, L4) на каждом из путей луча, чтобы коллимировать лучи и расширить диаметры луча в соответствии с задним зрачком объектива (рисунок 2A-B).
- Используйте зеркала M7 и M8 для выравнивания комбинированных лазерных лучей в микроскоп (рисунок 2C). Сначала выровняйте один луч в микроскоп и используйте зеркальные пары на другом луче, чтобы обеспечить пространственное перекрытие двух лучей.
- Настройте часть обнаружения.
- Наденьте масляный конденсатор с инфракрасным покрытием (1,4 NA) для сбора поступательного насоса и пучков Стокса после прохождения через образцы (рисунок 2C).
- Установите фотодиод Si большой площади на экранированную коробку с разъемами BNC (рисунок 2E). Добавьте блок питания постоянного тока 64 В к установленному фотодиоду, чтобы увеличить его порог насыщения и пропускную способность отклика.
- Отражайте передний свет с помощью 2-дюймового зеркала. Перефокусируйте свет на фотодиод после оптического фильтра, чтобы заблокировать модулирующий луч Стокса (рисунок 2D).
- Отправьте выходной ток фотодиода на быстрый блокирующий усилитель, заканчивающийся на 50 для демодуляции сигнала. Отправьте триггер 8 МГц на усилитель блокировки в качестве опорного сигнала.
- Отправьте фазный X-компонент запирающего усилителя в аналоговую интерфейсную коробку микроскопа.
- Оптимизируйте временное перекрытие со встроенной моторизованной ступенью задержки, измерив сигнал SRS чистой жидкости D2O в микроскопе.
5. Получение и анализ изображений
- Выполняйте многоканальную визуализацию epr-SRS с последовательной настройкой длины волны насоса.
- Установите мощность лазера на Ppump = 10-40 мВт и PStokes = 40-80 мВт на лазерной панели управления.
- Установите время ожидания пикселя равным 2-4 мкс и используйте несколько кадров в среднем 10-20 кадров в программном обеспечении для микроскопии.
ПРИМЕЧАНИЕ: Избегайте комбинаторного использования высокой мощности лазера (Ppump> 40 мВт, PStokes> 80 мВт) и малого размера пикселя (<0,2 мкм), которые, вероятно, вызывают «отбеливающий эффект» рамановских красителей из-за многофотонного возбуждения. - Установите для констант времени блокирующего усилителя половину времени ожидания пикселя.
- Линейное спектральное размешивание.
ПРИМЕЧАНИЕ: epr-SRS следует строгой линейной зависимости сигнал-концентрация во всем диапазоне концентраций; таким образом, линейное спектральное размешивание эффективно для устранения любых потенциальных перекрестных помех между каналами. Для измерения N-канала epr-SRS с помощью зондов N MARS измеренные сигналы (S) могут быть выражены как S = MC, где C - концентрации зонда MARS, а M - матрица N x N , определяемая рамановскими поперечными сечениями зондов MARS.- Измерьте матрицу M на одноцветных образцах иммуно-eprSRS, маркированных различными зондами MARS.
- Использовать уравнение C = M−1· S для определения матрицы концентрации зонда MARS с мультиплексным измерением сигнала образца S.
Результаты
На рисунке 3 показаны примеры изображений epr-SRS в различных образцах, включая фиксированные клетки (рисунок 3A), параформальдегидные (PFA) фиксированные ткани мыши (рисунок 3B) и образцы человека с фиксированным парафином (FFPE). Пространственное разрешение SRS-микроскопии ограничено дифракцией, типичное боковое разрешение составляет ~ 300 нм, а осевое разрешение составляет 1-2 мкм с использованием ближнего инфракрасного света для возбуждения. В результате тонкие субклеточные структуры, такие как микротрубочки в клетках HeLa, были достоверно выявлены с помощью иммуно-эпрSRS-визуализации α-тубулина (рисунок 3A). Кроме того, epr-SRS, как правило, совместим с тканями FFPE (рисунок 3C), который является распространенной формой образцов биопсии для клинической диагностики и исследования патологии. Подобно двухфотонной флуоресцентной микроскопии, как нелинейный процесс, epr-SRS обладает возможностью оптического сечения для визуализации трехмерных паттернов с субклеточным разрешением (рисунок 3D-E).
Впервые мы продемонстрировали мультиплексную утилиту визуализации белка epr-SRS на фиксированных замороженных образцах тканей мышиных островков Лангерганса в поджелудочной железе. Выбрано несколько заинтересованных мишеней, включая экспрессию гормонов (например, инсулин, агонист глюкозы (глюкагон), полипептид поджелудочной железы (PP) и соматостатин) для классификации клеточных типов (β-клетки и не-β-клетки (α-, δ-клетки)) и факторы транскрипции, которые, как известно, связаны с гетерогенностью β клеток23. Следует отметить, что, поскольку обнаружение флуоресценции ортогонально обнаружению SRS, epr-SRS полностью совместимо с конфокальной флуоресценцией и двухфотонной флуоресценцией. В качестве доказательства концепции, 7-цветная SRS-флуоресцентная тандемная визуализация на одном островке была легко достигнута (рисунок 4) с хорошей контрастностью и правильными узорами. Мишени с низкой экспрессией, такие как фактор транскрипции Pdx1, были изображены с достаточной контрастностью.
Мы также продемонстрировали восьмицветную SRS-флуоресцентную тандемную визуализацию в тканях мозжечка мыши с фиксацией PFA (рисунок 5). С помощью установленных биомаркеров могут быть идентифицированы различные типы клеток, такие как нейроны мозжечковых гранул (NeuN), нейроны Пуркинье (Calbindin), астроциты (GFAP), олигодендроциты (MBP) и ГАМКЕРГические нейроны (рецептор ГАМК B2 ).

Рисунок 1: Микроскопия Epr-SRS для визуализации сильно мультиплексированных белков. (A) Энергетическая диаграмма для спонтанного рамановского, нерезонансного SRS и электронного предрезонансного SRS (epr-SRS). Скорость вибрационного перехода хромофоров будет увеличена в epr-SRS до 1013 раз. (B) Иммуновизуализация α-тубулина на основе эпитопа была продемонстрирована в клетках COS-7, окрашенных ATTO740 с высоким вибрационным контрастом epr-SRS. Сигнал epr-SRS полностью исчезает, когда длина волны лазера накачки отклоняется от резонанса всего на 2 нм (справа). Шкала стержней, 20 мкм. (C) Epr-SRS спектры эфирно-конъюгированных зондов MARS NHS, перечисленных в дополнительном материале. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Конструкция установки микроскопа SRS. (A) Принципиальная схема установки SRS. EOM = электрооптический модулятор, M = зеркало, L = объектив, DBS = дихроичный делитель пучка, DM = дихроичное зеркало, OB = объектив, CO = конденсатор, F = фильтр, PD = фотодиод. (B) На этой панели показана часть лазерного возбуждения. Двухцветный луч от лазерного выхода сначала отделяется, при этом каждый луч коллимируется и расширяется, а затем объединяется и направляется в корпус микроскопа. (C) На этой панели показана передаваемая коллекция с конденсатором. (D) На этой панели показана часть обнаружения SRS. Фотодиод и фильтр установлены на экранированной коробке с двумя разъемами BNC. Более низкий разъем BNC предназначен для напряжения обратного смещения, а более высокий разъем BNC предназначен для вывода сигнала тока на усилитель с фиксацией 50 Ω. (E) Эта панель показывает, как фотодиод Si установлен внутри экранированной коробки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Рамановская визуализация различных белковых маркеров с помощью иммуномаркировки. (A) Иммуно-eprSRS визуализация α-тубулина в клетках HeLa. (B) Иммуно-eprSRS визуализация NeuN в PFA-фиксированной коре головного мозга мыши. (C) Иммуно-eprSRS визуализация виментина в почечной ткани FFPE человека. (D) Объемное изображение окрашенного GFAP MARS2145 в ткани мозга мыши толщиной 100 мкм. Размер шага в z составил 2 мкм. (E) Объемно-визуализированное изображениеMARS2228 окрашенного NeuN в ткани мозга мыши толщиной 40 мкм. Размер шага в z составлял 1 мкм. Шкала стержней, 20 мкм в (A), 50 мкм в (B-C), 30 мкм в (D-E). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Репрезентативные результаты 7-цветной тандемной визуализации гормонов и факторов транскрипции на замороженной ткани островка мыши. Epr-SRS: инсулин (обнаружен Cy5, β-клеточным маркером, зеленый), Pdx1 (обнаружен MARS2228, фактор транскрипции, красный), Глюкагон (обнаружен MARS2216, маркер α-клеток, желтый), PP (обнаружен MARS2147, PP-клеточный маркер, синий). Флуоресценция: соматостатин (Alexa488, δ-клеточный маркер, оранжевый), Nkx2.2 (Cy3, фактор транскрипции, пурпурный), DAPI (ядро, темно-синий). Шкала, 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
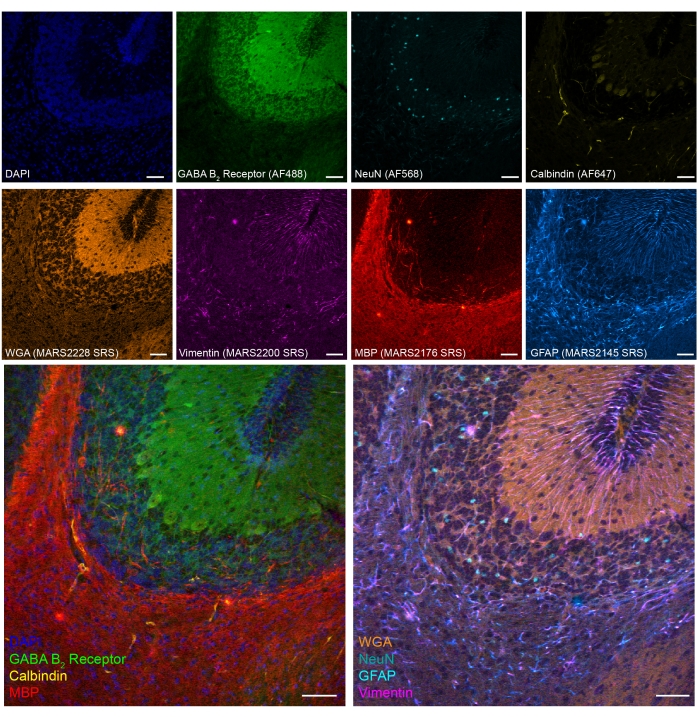
Рисунок 5: Репрезентативные результаты 8-цветной тандемной визуализации маркеров клеточного типа на участке мозга мыши с фиксацией PFA. Флуоресценция: ДНК (DAPI), ГАМК (γ-аминомасляная кислота), рецептор B 2 (ГАМКергические нейроны, Alexa Fluor 488), ядра нейронов (NeuN; нейроны, Alexa Fluor 568) и Калбиндин (нейроны Purkinje, Alexa Fluor 647); epr-SRS: агглютинин зародышей пшеницы (WGA; MARS2228), виментин (MARS2200), основной белок миелина (MBP; олигодендроциты, MARS2176) и GFAP (астроциты и нервные стволовые клетки, MARS2145). Шкала, 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Валидированные антитела к иммуно-эпрСРС. Для получения более подробной информации обратитесь к Таблице материалов. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительный материал: Свойства 8 используемых NHS-эфир-функционализированных зондов MARS. λ коэффициентыабс и возбуждения красителей MARS измеряли в растворе DMSO на спектрометре UV-Vis с использованием в качестве контейнера стеклянной кюветы 1 см. Абсолютные рамановские поперечные сечения красителей MARS определяли в DMSO путем сравнения сигнала epr-SRS красителей MARS со стандартным режимом растяжения C−O (1030 см-1) метанола. Абсолютное рамановское поперечное сечение для стандартного режима растяжения C−O (1030 см-1) метанола было зарегистрировано как 2,1 х 10-30см2 при 785 нм. Поперечное сечение 0,9 х 10-30 см2 оценивалось при длине волны насоса 860 нм путем экстраполяции. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Здесь мы представляем протокол иммуно-eprSRS, который широко применим к распространенным типам тканей, включая свежесохраненные ткани мыши, ткани человека FFPE и замороженные ткани мыши. Иммуно-eprSRS был валидирован для группы эпитопов в клетках и тканях, как указано в таблице 1. Эта платформа с одним выстрелом особенно подходит для приложений, где циклические стратегии не функционируют хорошо. Например, циклическая флуоресценция требовательна для толстых тканей, поскольку несколько раундов 3D-иммуномаркировки являются непрактичными длинными17. Также весьма вероятно внесение ошибок регистрации из-за нелинейных 3D гистологических изменений11,17. Immuno-eprSRS преодолевает практические барьеры циклической флуоресценции в таком сценарии и дает возможность выявить сети белкового взаимодействия в большом объеме17.
Текущая мультиплексность в основном ограничена наличием вторичных антител. В то время как в этом протоколе мы сосредоточились на косвенной иммуномаркировке, при которой зонды MARS конъюгируются со вторичными антителами, прямая иммуномаркировка и окрашивание лектина возможны17. После более первичной проверки антител рамановскими красителями ожидается 20 каналов с разработанными в настоящее время рамановскими красителями 13,18,24. Кроме того, визуализация очень малообильных мишеней может быть сложной задачей для epr-SRS из-за ее слегка скомпрометированной чувствительности по сравнению с конфокальной флуоресцентной системой. В связи с этим мы рекомендуем присваивать относительно низкообильные мишени более ярким красителям MARS и мишени с низкой экспрессией флуоресцентным каналам.
Важнейшим аспектом протокола является доступность приборов и зондов. С точки зрения приборов, микроскоп SRS обычно состоит из двухцветного лазерного источника с оптическим модулятором, микроскопа, фотодиодного детектора и запирающего усилителя для демодуляции25. Каждый компонент коммерчески доступен с немного более высокой общей стоимостью, чем двухфотонный лазерный сканирующий флуоресцентный микроскоп. Полностью интегрированный мультимодальный исследовательский микроскоп SRS/флуоресцентности был коммерциализирован26 с использованием аналогичного пикосекундного лазера, как здесь для возбуждения SRS и лазерных установок непрерывной волны (CW) для флуоресценции. Эта система легко применима для мультиплексной вибрационной визуализации в повседневных биологических исследованиях. С точки зрения зондов, зонды MARS еще не коммерциализированы и требуют некоторых возможностей синтеза. В качестве альтернативы, многие коммерческие фар-красные флуорофоры (см. Расширенную таблицу данных 1 в L. Wei et al. Nature 201713) могут быть использованы для epr-SRS. Тем не менее, мультиплексность может быть скомпрометирована. Более того, поскольку зонды MARS по своей природе представляют собой небольшие органические молекулы, иммуно-eprSRS похож на иммунофлуоресценцию с точки зрения окрашивания тканей. Таким образом, архив валидированных аффинных реагентов, таких как антитела в иммунофлуоресценции, может быть легко перенесен в иммуно-eprSRS приложения.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Рут А. Сингер и Ричарда К.П. Беннингера за предоставление тканей поджелудочной железы мыши. W.M. признает поддержку со стороны NIH R01 (GM128214), R01 (GM132860), R01 (EB029523) и армии США (W911NF-19-1-0214).
Материалы
| Name | Company | Catalog Number | Comments |
| 16% Paraformaldehyde, EM Grade | Electron Microscopy Sciences | 15710 | |
| α-tubulin | Abcam | ab18251 | Primary antibodies |
| α-tubulin | BioLegend | 625902 | Primary antibodies |
| β-III-tubulin | BioLegend | 657402 | Primary antibodies |
| β-III-tubulin | Abcam | ab41489 | Primary antibodies |
| β-tubulin | Abcam | ab131205 | Primary antibodies |
| Agarose, low gellling temperature | Sigma Aldrich | A9414 | For brain embedding |
| Anti-a-tubulin antibody produced in rabbit (α-tubulin) | Abcam | ab52866 | Primary antibodies |
| Anti-Calbindin antibody produced in mouse (Calbindin) | Abcam | ab82812 | Primary antibodies |
| Anti-GABA B receptor R2 antibody produced in guinea pig (GABA B receptor R2) | Millipore Sigma | AB2255 | Primary antibodies |
| Anti-GFAP antibody produced in goat (GFAP) | Thermo Scientific | PA5-18598 | Primary antibodies |
| Anti-Glucagon antibody produced in mouse (Glucagon) | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| Anti-insulin antibody produced in guinea pig (insulin) | DAKO | IR00261-2 | Primary antibodies |
| Anti-MBP antibody produced in rat (MBP) | Abcam | ab7349 | Primary antibodies |
| Anti-NeuN antibody produced in rabbit (NeuN) | Thermo Scientific | PA5-78639 | Primary antibodies |
| Anti-Pancreatic polypeptide (PP) antibody produced in goat- Pancreatic polypeptide (PP) | Sigma Aldrich | SAB2500747 | Primary antibodies |
| Anti-Pdx1 antibody produced in rabbit (Pdx1) | Milipore | 06-1379 | Primary antibodies |
| Anti-Somatostatin antibody produced in rat (Somatostatin) | Abcam | ab30788 | Primary antibodies |
| Anti-Vimentin antibody produced in chicken (Vimentin) | Abcam | ab24525 | Primary antibodies |
| Band-pass filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| BNC cable | Thorlabs | 2249-C | Coaxial Cable, BNC Male / Male |
| Broadband dielectric mirror | Thorlabs | BB1-E03 | 750 - 1100 nm |
| C57BL/6J mice | Jackson Laboratory | 000664 | |
| Centrifuge | |||
| Condenser | Olympus | oil immersion, 1.4 N.A. | |
| Cytokeratin 18 | Abcam | ab7797 | Primary antibodies |
| Cytokeratin 18 | Abcam | ab24561 | Primary antibodies |
| DC power supply | TopWard | 6302D | Bias voltage is 64 V |
| Dichroic mount | Thorlabs | KM100CL | Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Left Handed |
| Donkey anti-Chicken IgY (H+L) | Jackson ImmunoResearch | 703-005-155 | Secondary antibodies for MARS conjugation |
| Donkey anti-Goat IgG (H+L) | Jackson ImmunoResearch | 705-005-147 | Secondary antibodies for MARS conjugation |
| Donkey anti-Guinea Pig IgG (H+L) | Jackson ImmunoResearch | 706-005-148 | Secondary antibodies for MARS conjugation |
| Donkey anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-005-151 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-005-152 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rat IgG (H+L) | Jackson ImmunoResearch | 712-005-153 | Secondary antibodies for MARS conjugation |
| Donkey anti-Sheep IgG (H+L) | Jackson ImmunoResearch | 713-005-147 | Secondary antibodies for MARS conjugation |
| DPBS | Fisher Scientific | 14-190-250 | |
| EpCAM | Abcam | ab71916 | Primary antibodies |
| Ethanol | Sigma Aldrich | 443611 | |
| Fast-speed look-in amplifier | Zurich Instruments | HF2LI | DC - 50 MHz |
| FFPE Kidney Sample | USBiomax | HuFPT072 | |
| Fibrillarin | Abcam | ab5821 | Primary antibodies |
| Giantin | Abcam | ab24586 | Primary antibodies |
| Glucagon | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| H2B | Abcam | ab1790 | Primary antibodies |
| HeLa | ATCC | ATCC CCL-2 | |
| High O.D. bandpass filter | Chroma Technology | ET890/220m | Filter the Stokes beam and transmit the pump beam |
| Hydrophobic pen | Fisher Scientific | NC1384846 | |
| Insulin | ThermoFisher | 701265 | Primary antibodies |
| Integrated SRS laser system | Applied Physics & Electronics, Inc. | picoEMERALD | picoEMERALD provides an output pulse train at 1,064 nm with 6-ps pulse width and 80-MHz repetition rate, which serves as the Stokes beam. The frequency doubled beam at 532 nm is used to synchronously seed a picosecond optical parametric oscillator (OPO) to produce a mode-locked pulse train with five~6 ps pulse width (the idler beam of the OPO is blocked with an interferometric filter). The output wavelength of the OPO is tunable from 720–950 nm, which serves as the pump beam. The intensity of the 1,064-nm Stokes beam is modulated sinusoidally by a built-in EOM at 8 MHz with a modulation depth of more than 90%. The pump beam is spatially overlapped with the Stokes beam by using a dichroic mirror inside picoEMERALD. The temporal overlap between pump and Stokes pulse trains is achieved with a built-in delay stage and optimized by the SRS signal of pure D2O at the microscope. |
| Inverted laser-scanning microscope | Olympus | FV1200MPE | |
| Kinematic mirror mount | Thorlabs | POLARIS-K1-2AH | 2 Low-Profile Hex Adjusters |
| Lectin from Triticum vulgaris (wheat) | Sigma Aldrich | L0636-5 mg | |
| Long-pass dichroic beam splitter | Semrock | Di02-R980-25x36 | 980 nm laser BrightLine single-edge laser-flat dichroic beamsplitter |
| MAP2 | BioLegend | 801810 | Primary antibodies |
| Microscopy imaging software | Olympus | FluoView | |
| NanoQuant Plate | Tecan | For absorbance-based, small volume analyses in a plate reader. | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| NucBlue Fixed Cell ReadyProbes Reagent (DAPI) | Thermo Scientific | R37606 | |
| Nunc 4-Well Dishes | Fisher Scientific | 12-566-300 | |
| Objective lens | Olympus | XLPlan N | x25, 1.05-NA, MP, working distance = 2 mm |
| Paint brush | |||
| Periscope assembly | Thorlabs | RS99 | includes the top and bottom units, Ø1" post, and clamping fork. |
| pH meter | |||
| Plate reader | Tecan | Infinite 200 PRO | An easy-to-use multimode plate reader. Absorbance measurement capabilities over a spectral range of 230–1000 nm. |
| ProLong Gold antifade reagent | Thermo Scientific | P36930 | |
| PSD95 | Invitrogen | 51-6900 | Primary antibodies |
| Sephadex G-25 Medium | GE Life Sciences | 17-0033-01 | gel filtration resin for desalting and buffer exchange |
| Shielded box with BNC connectors | Pomona Electronics | 2902 | Aluminum Box With Cover, BNC Female/Female |
| Si photodiode | Thorlabs | FDS1010 | 350–1100 nm, 10 mm x 10 mm Active Area |
| Synapsin 2 | ThermoFisher | OSS00073G | Primary antibodies |
| Tissue Path Superfrost Plus Gold Slides | Fisher Scientific | 22-035813 | Adhesive slide to attract and chemically bond fresh or formalin-fixed tissue sections firmly to the slide surface (tiisue bindling glass slides) |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Vibratome | Leica | VT1000 | |
| Vimentin | Abcam | ab8069 | Primary antibodies |
| Xylenes | Sigma Aldrich | 214736 |
Ссылки
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. Journal for Immunotherapy of Cancer. 8 (1), 000155 (2020).
- Lewis, S. M., et al. Spatial omics and multiplexed imaging to explore cancer biology. Nature Methods. 18 (9), 997-1012 (2021).
- Bodenmiller, B. Multiplexed epitope-based tissue imaging for discovery and healthcare applications. Cell Systems. 2 (4), 225-238 (2016).
- Hickey, J. W., et al. Spatial mapping of protein composition and tissue organization: a primer for multiplexed antibody-based imaging. Nature Methods. , (2021).
- Lin, J. -. R., et al. Highly multiplexed immunofluorescence imaging of human tissues and tumors using t-CyCIF and conventional optical microscopes. eLife. 7, 31657 (2018).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Giesen, C., et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry. Nature Methods. 11 (4), 417-422 (2014).
- Keren, L., et al. MIBI-TOF: A multiplexed imaging platform relates cellular phenotypes and tissue structure. Science Advances. 5 (10), 5851 (2019).
- Gerdes, M. J., et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11982 (2013).
- Angelo, M., et al. Multiplexed ion beam imaging of human breast tumors. Nature Medicine. 20 (4), 436-442 (2014).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455 (2020).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544, 465 (2017).
- Wei, L., Min, W. Electronic preresonance stimulated Raman scattering microscopy. The Journal of Physical Chemistry Letters. 9 (15), 4294-4301 (2018).
- Shi, L., et al. Electronic resonant stimulated Raman scattering micro-spectroscopy. The Journal of Physical Chemistry B. 122 (39), 9218-9224 (2018).
- Fujioka, H., et al. Multicolor activatable Raman probes for simultaneous detection of plural enzyme activities. Journal of the American Chemical Society. 142 (49), 20701-20707 (2020).
- Shi, L., et al. Highly-multiplexed volumetric mapping with Raman dye imaging and tissue clearing. Nature Biotechnology. , (2021).
- Miao, Y., Qian, N., Shi, L., Hu, F., Min, W. 9-Cyanopyronin probe palette for super-multiplexed vibrational imaging. Nature Communications. 12 (1), 4518 (2021).
- Miao, Y., Shi, L., Hu, F., Min, W. Probe design for super-multiplexed vibrational imaging. Physical Biology. 16 (4), 041003 (2019).
- Qian, N., Min, W. Super-multiplexed vibrational probes: Being colorful makes a difference. Current Opinion in Chemical Biology. 67, 102115 (2022).
- Klimas, A., et al. Nanoscale imaging of biomolecules using molecule anchorable gel-enabled nanoscale in-situ fluorescence microscopy. Nature Portfolio. , (2021).
- Shi, L., et al. Super-resolution vibrational imaging using expansion stimulated Raman scattering microscopy. bioRxiv. , (2021).
- Benninger, R. K. P., Hodson, D. J. New understanding of β-cell heterogeneity and in situ islet function. Diabetes. 67 (4), 537 (2018).
- Hu, F., et al. Supermultiplexed optical imaging and barcoding with engineered polyynes. Nature Methods. 15 (3), 194-200 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- . Coherent Raman Scattering Microscope Available from: https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-cars/ (2022)
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены