Method Article
Imagem de tecido altamente multiplexado com corantes raman
Neste Artigo
Resumo
A imagem eletrônica de dispersão de Raman (epr-SRS) de corantes Raman semelhantes ao arco-íris é uma nova plataforma para imagens de proteínas à base de epítope altamente multiplexadas. Aqui, apresentamos um guia prático, incluindo preparação de anticorpos, coloração de amostras de tecido, montagem de microscópio SRS e imagem de tecido epr-SRS.
Resumo
Visualizar um vasto escopo de biomarcadores específicos em tecidos desempenha um papel vital na exploração das intrincadas organizações de sistemas biológicos complexos. Assim, tecnologias de imagem altamente multiplexadas têm sido cada vez mais apreciadas. Aqui, descrevemos uma plataforma emergente de imagem vibracional altamente multiplexada de proteínas específicas com sensibilidade comparável à imunofluorescência padrão através de imagens eletrônicas de dispersão de Raman (epr-SRS) de corantes raman semelhantes ao arco-íris. Este método contorna o limite de canais espectralmente solucionáveis na imunofluorescência convencional e fornece uma abordagem óptica de um tiro para interrogar vários marcadores em tecidos com resolução subcelular. É geralmente compatível com preparações de tecidos padrão, incluindo tecidos fixos paraformaldeído, tecidos congelados e tecidos humanos fixos de parafina (FFPE). Prevemos que esta plataforma fornecerá uma imagem mais abrangente das interações proteicas de espécimes biológicos, particularmente para tecidos intactos espessos. Este protocolo fornece o fluxo de trabalho desde a preparação de anticorpos até a coloração da amostra de tecido, ao conjunto de microscópios SRS, à imagem de tecido epr-SRS.
Introdução
Sistemas complexos de tecidos são compostos de subpopulações celulares distintas cujos locais espaciais e redes de interação estão profundamente entrelaçados com suas funções e disfunções 1,2. Para revelar a arquitetura tecidual e interrogar sua complexidade, o conhecimento dos locais espaciais das proteínas na resolução unicelular é essencial. Assim, tecnologias altamente multiplexadas de imagem de proteína têm sido cada vez mais apreciadas e podem se tornar uma pedra angular para estudar biologia tecidual 3,4,5. Os métodos atuais de imagem de proteína multiplexada comum podem ser classificados em duas categorias principais. Uma delas é a imagem de imunofluorescência em série que se baseia em múltiplas rodadas de coloração e imagem de tecido, e a outra é a citometria de massa de imagem juntamente com anticorpos marcados por metais pesados 6,7,8,9,10,11,12.
Aqui, uma estratégia alternativa para imagens proteicas baseadas em anticorpos multiplexados é introduzida. Ao contrário da modalidade de imagem de fluorescência predominante, que só pode visualizar 4-5 canais simultaneamente devido à ampla excitação e espectros de emissão (largura total à metade do máximo (FWHM) ~500 cm-1), a microscopia raman exibe largura de linha espectral muito mais estreita (FWHM ~10 cm-1) e, portanto, fornece multiplexidade escalável. Recentemente, aproveitando o espectro estreito, um novo esquema de microscopia raman chamado pré-ressonância eletrônica estimulada pela microscopia de dispersão de Raman (epr-SRS) foi desenvolvido, fornecendo uma estratégia poderosa para imagens multiplexadas13. Ao sondar os modos vibracionais acoplados eletronicamente dos corantes Raman, o epr-SRS consegue um efeito de aprimoramento drástico de 1013 vezes nas seções transversais de Raman e supera o gargalo de sensibilidade da microscopia Raman convencional (Figura 1A)13,14,15. Como resultado, o limite de detecção de epr-SRS foi empurrado para sub-μM, o que permite à detecção de Raman de marcadores moleculares interessantes, como proteínas específicas e organelas dentro das células13,16. Em particular, utilizando anticorpos conjugados por raman, a imagem epr-SRS de proteínas específicas em células e tecidos (chamadas imuno-eprSRS) foi demonstrada com sensibilidade comparável à imunofluorescência padrão (Figura 1B)13,17. Ao ajustar o comprimento de onda da bomba em apenas 2 nm, o sinal epr-SRS estará completamente desligado (Figura 1B), que apresenta alto contraste vibracional.
No lado da sonda, um conjunto de sondas Raman semelhantes ao arco-íris chamadas manhattan Raman scattering dyes (MARS) foi desenvolvido para conjugação de anticorpos 13,18,19,20. Esta paleta raman única consiste em novos corantes com laços triplos conjugados π (Material Suplementar), cada um exibindo um pico único e estreito epr-SRS na faixa espectral raman bioortogonal (Figura 1C). Modificando a estrutura do cromoforeiro central e editando isotopicamente ambos os átomos da ligação tripla (Material Suplementar), sondas Raman separadas espectralmente foram desenvolvidas. Aproveitando a multiplexidade escalável, a microscopia epr-SRS juntamente com a paleta de corante MARS oferece uma estratégia óptica para imagens de proteína multiplex de um tiro em células e tecidos.
O Immuno-eprSRS fornece uma estratégia alternativa aos métodos atuais de imagem de proteína multiplex com forças únicas. Em comparação com abordagens de fluorescência com coloração cíclica, imagem e remoção de sinal, esta plataforma baseada em Raman garante coloração e imagem de uma rodada. Portanto, contorna a complexidade prática em procedimentos cíclicos e simplifica em grande parte o protocolo, abrindo assim novos territórios de imagem de proteína multiplexada. Por exemplo, aproveitando um protocolo de limpeza de tecido sob medida raman-dye, o imuno-eprSRS foi estendido para três dimensões para mapeamento de proteínas altamente multiplexadas em tecidos intactos espessos17. Mais de 10 alvos de proteína foram visualizados ao longo de tecidos cerebrais de camundongosde espessura milimétrica 17. Mais recentemente, acoplamento do imuno-eprSRS com um protocolo otimizado de microscopia de expansão de retenção de biomolécula (ExM)protocolo 21, imagens nanoescala de um tiro de vários alvos também foram demonstradas22. Em comparação com a espectroscopia de massa de imagem 4,9, a epr-SRS é não destrutiva e tem capacidade de secção intrinsecamente óptica. Além disso, o EPR-SRS é mais eficiente no escaneamento de tecidos. Normalmente, uma região de tecido de 0,25 mm2 com um tamanho de pixel de 0,5 μm leva apenas alguns minutos para ser imagem para um único canal epr-SRS. Por exemplo, o tempo total de imagem de quatro canais SRS mais quatro canais de fluorescência na Figura 4 é de cerca de 10 minutos.
Protocolo
O protocolo foi conduzido de acordo com o protocolo experimental animal (AC-AABD1552) aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Columbia.
1. Preparação de anticorpos conjugados por Raman-corante
- Prepare o tampão de conjugação como ~0,1 M NaHCO3 em tampão PBS, pH = 8,3, armazenar a 4 °C.
- Prepare a solução de sonda MARS (Material Suplementar) com função N-hidroxisuccinimidy (NHS) como 3 mM em DMSO anidro. A síntese das sondas MARS pode ser referida a relatórios anteriores 13,17,18.
NOTA: Para fins de armazenamento, a solução de éster NHS de corante deve ser protegida contra luz e mantida a -20 °C. - Dissolva os sólidos de anticorpos no tampão de conjugação a uma concentração de 2 mg/mL. Para anticorpos que são dissolvidos em outros buffers, troque-os no tampão de conjugação para uma concentração de 1-2 mg/mL com filtros centrífugas.
NOTA: Anticorpos secundários altamente transversais são preferidos para coloração multiplex para minimizar a reatividade entre espécies. Os anticorpos secundários utilizados estão listados na Tabela 1 e Tabela de Materiais. - Faça a reação de conjugação.
- Para anticorpos secundários, adicione 15 vezes o excesso molar da solução de corante à solução de anticorpos em um frasco de vidro lentamente com agitação. Por exemplo, em solução de anticorpos de 0,5 mL 2 mg/mL, adicione 35 μL 3 mM de solução de corante.
- Incubar a mistura de reação à temperatura ambiente (RT) com agitação por 1h. Proteja a reação da luz.
- Purificação.
- Prepare o chorume da resina de filtragem de gel (Tabela de Materiais) no buffer PBS, seguindo as etapas 1.5.2-1.5.4.
- Adicione 10 mL de pó de resina de filtragem de gel em 40 mL de tampão PBS dentro de um tubo de 50 mL.
- Mantenha a solução em um banho de água de 90 °C por 1h.
- Decante o supernatante e re-adicione PBS a 40 mL. Guarde o chorume a 4 °C.
- Embale a coluna de exclusão de tamanho (1 cm de diâmetro, colunas de fluxo de gravidade) com a solução de chorume até a altura de 10-15 cm.
- Enxágüe e lave a coluna com ~10 mL de tampão PBS para embalar ainda mais a resina.
- Encobre a mistura de reação conjugal (~0,5 mL) à coluna. Adicione imediatamente 1 mL de tampão PBS como o tampão de eluição quando toda a mistura de reação estiver carregada. Rechee constantemente o tampão de eluição (PBS) na coluna.
- Colete o eluado da solução conjugada olhando para a cor na coluna (corantes MARS têm cores verde-azul claras) ou medindo a absorvância a 280 nm (A280).
- Concentre a solução coletada em 1-2 mg/mL com um filtro centrífuga.
- Determine a concentração e o grau médio de rotulagem (DOL, razão corante-proteína) medindo o espectro ultravioleta-visível (UV-Vis) da solução conjugada com um leitor de placas Nano.
NOTA: O material suplementar fornece propriedades de sísteres NHS de corante MARS para cálculo. O DOL normal para o anticorpo secundário é em torno de 3.
2. Preparação da amostra de tecido
- Paraformaldeído consertou tecidos cerebrais do rato.
- Anestesiar os camundongos (C57BL/6J, Feminino, 25 d pós-natal) com isoflurane. Avalie a anestesia adequada com um teste de beliscão do dedo do dedo do dedo.
- Mate os ratos por deslocamento cervical. Perfume os camundongos imediatamente com 4% de paraformaldeído (PFA) em PBS transcardialmente.
- Colete o cérebro do rato, seguindo as etapas 2.1.4-2.1.5
- Corte para cima do tronco cerebral ao longo da sutura sagital. Descasque as duas metades do crânio para o lado e retire o cérebro com uma pinça.
- Fixar o cérebro coletado em 4% de PFA em PBS a 4 °C por 24 h. Em seguida, lave o cérebro no tampão PBS a 4 °C por 24 horas para remover o excesso de PFA.
- Coloque uma agarose sólida na água para uma concentração final de 7% (w/v) em um béquer, com uma tampa solta. Mexa a solução com uma haste de vidro. Aqueça o chorume no micro-ondas até que a solução esteja clara.
- Deixe a agarose esfriar a 45-55 °C.
- Despeje o líquido em uma pequena câmara, depois transfira o cérebro da PBS para a ágarose líquida e oriente-o com uma espátula para incorporar o cérebro. Espere o bloco de agarose de tecido endurecer.
- Selar o tecido-agrose em fatias coronais de 40-μm de espessura usando um vibratome.
- Transfira o tecido para uma placa de 4 poços para as seguintes manchas. Remova a ágarose com uma pinça. Lave o tecido com 1 mL de PBS, três vezes.
- Tecidos de pâncreas congelados fixos.
- Fixar o pâncreas do mouse em 4% pfa em PBS a 4 °C com balanço por 16-20 h.
- Lave a amostra em 1 mL de PBS (4 °C) três vezes para remover o PFA.
- Incorpore a amostra (~0,3-0,5 cm de tamanho) em blocos compostos de temperatura de corte ideal (OCT). Coloque 2 gotas de OCT em um criomold plástico. Coloque o tecido na orientação correta e despeje OCT em cima de tecidos até que nenhum dos tecidos permaneça exposto.
- Se sectionie a pancreata a fatias de 8-μm de espessura e imobilize-as em uma lâmina de vidro de ligação de tecido, armazene-as em -80 °C.
- Antes de colorir, equilibre a amostra para RT. Lave o tecido com PBS para remover blocos OCT.
- Amostras de FFPE.
- Asse o deslizamento do tecido FFPE a 60 °C por 10 minutos.
- Desparaffinização e reidratação: Coloque amostras sequencialmente nas seguintes soluções em um tubo de 50 mL em RT por 3 minutos cada vez com leve agitação:
xileno duas vezes,
etanol duas vezes,
95% (vol/vol) etanol em água desionizada duas vezes,
70% (vol/vol) etanol em água desionizada duas vezes,
50% (vol/vol) etanol em água desionizada uma vez,
água deionizada uma vez. - Transfira a amostra para citrato de sódio de 20 mM (pH 8.0) a 100 °C em um frasco de vidro. Certifique-se de que os tecidos estão imersos na solução.
- Coloque o frasco em um banho de água de 60 °C por 45 min.
- Lave a amostra com água deionizada em RT por 5 minutos.
3. Coloração de imuno-eprSRS de tecido
- Use uma caneta hidrofóbica para desenhar um limite em torno das seções teciduais na lâmina.
NOTA: Um frasco de coloração de lâminas é usado para seguir as etapas de incubação do tecido na lâmina. Os tecidos flutuantes (seções cerebrais de camundongos de 40 μm de espessura) estão manchados em placas de poços. - Incubar os tecidos com 0,3-0,5% PBST (Triton X-100 em PBS) por 10 minutos.
- Incubar os tecidos com tampão de bloqueio (5% de soro de burro, 0,5% Triton X-100 em PBS) por 30 min.
- Prepare a solução primária de coloração: adicione todos os anticorpos primários a 200-500 μL de tampão de coloração (2% de soro de burro, 0,5% Triton X-100 em PBS) nas concentrações desejadas. Centrifugar a solução de coloração primária a 13.000 x g por 5 min. Use apenas o supernatante se precipitar a forma.
- Incubar o tecido na solução de anticorpos primários a 4 °C por 1-2 dias.
NOTA: Para colorar seções de tecido no slide, coloque a amostra em uma caixa de coloração com um lenço umedecido para manter a umidade. - Lave os slides três vezes com 0,3-0,5% PBST na RT por 5 min cada. Use 1 mL PBST para tecidos flutuantes. Para os tecidos na lâmina, lave as lâminas em um frasco de coloração de lâminas e certifique-se de que os tecidos estão todos imersos na solução.
- Incubar o tecido em 200-500 μL de tampão de bloqueio por 30 minutos.
- Prepare a solução de coloração secundária: adicione todos os anticorpos secundários (e lectinas, se necessário) a 200-500 μL de tampão de coloração com concentrações desejadas (normalmente 10 μg/mL). Centrifugar a solução de coloração secundária a 13.000 x g por 5 min. Use apenas o supernatante se precipitar a forma.
- Incubar os tecidos em 200-500 μL de solução de anticorpos secundários a 4 °C por 1-2 dias.
- Lave os slides duas vezes com 0,3-0,5% PBST na RT por 5 min cada.
- Incubar com 200-500 μL de solução DAPI por 30 min.
- Lave os slides três vezes com PBS no RT por 5 minutos cada.
- Para seções de tecido flutuante, transfira-os para lâminas de vidro com uma pipeta de queda de vidro. Espalhe o tecido com uma escova de tecido e limpe o ambiente com lenços umedecidos, se necessário.
- Monte o tecido em uma gota de reagentes antifade com uma mancha de vidro e fixe-o com esmalte.
4. Montagem de microscópio SRS
NOTA: Um sistema comercial de fluorescência consorciação é usado em imagens de srs-fluorescência em conjunto. Mais descrições podem ser encontradas em um relatório anterior17. Este protocolo se concentrará no lado de imagem SRS usando excitação de banda estreita.
- Prepare uma mesa óptica isolada de vibração em uma sala com controle de temperatura.
- Coloque um sistema de laser duplo sincronizado (bomba e Stokes) na tabela óptica (Figura 2A) com um refrigerador conectado.
NOTA: O laser fundamental no sistema de laser duplo fornece um trem de pulso de saída a 1064 nm com largura de pulso de 6 ps e taxa de repetição de 80 MHz. O raio Stokes é do laser fundamental. A intensidade do feixe de Stokes foi modulada sinusoidely por um modulador de amplitude eletro-óptica incorporado (EOM) a 8 MHz com uma profundidade de modulação de mais de 90%. A outra parte do laser fundamental é dobrada de frequência para 532 nm, que é ainda mais usada para sincronizar uma semente de picosegundos oscilador óptico (OPO) para produzir um trem de pulso bloqueado no modo com 5-6 ps de largura de pulso (o feixe ocler do OPO é bloqueado com um filtro interferométrico). O comprimento de onda de saída do OPO é t impossibilitado de 720-950 nm, que serve como o feixe da bomba. - Monte os espelhos (faixa de comprimento de onda: 750-1100 nm), divisores de feixedicróico (DBS, filtro de passagem longa de 980 nm, retangular) e lente (acrático, revestimento AR para 650-1050 nm) para suas respectivas montagens. Use suportes de espelho muito estável para os espelhos e divisores de feixedicróicos.
- Meça a altura da saída de laser e os tamanhos dos feixes da bomba e dos feixes de Stokes. Ajuste a altura dos espelhos e lentes para garantir que a luz atinja o centro de todos os elementos ópticos.
- Coloque o espelho M1 na mesa óptica e faça ~45° à saída do laser (Figura 2B). Use os botões na montagem cinemática para fazer ajustes de ponta e inclinação. Certifique-se de que a luz viaja na mesma altura ao longo do comprimento da mesa e uma linha reta em relação à mesa.
- Coloque e alinhe os divisores de feixedicróicos (filtros de passagem longa de 980 nm) e espelhos para dividir a bomba e os feixes de Stokes (Figura 2A-B).
- Coloque e alinhe pares de lentes (L1, L2 e L3, L4) em cada um dos caminhos do feixe para colidir os feixes e expandir os diâmetros do feixe para combinar com a pupila traseira do objetivo (Figura 2A-B).
- Use espelhos M7 e M8 para alinhar feixes de laser combinados no microscópio (Figura 2C). Alinhe um feixe no microscópio primeiro e use os pares de espelhos no outro feixe para garantir a sobreposição espacial dos dois feixes.
- Configure a parte de detecção.
- Coloque um condensador de óleo revestido de infravermelho (1.4-NA) para coletar a bomba para a frente e os feixes de Stokes depois de passar pelas amostras (Figura 2C).
- Monte um fotodiodo Si de grande área em uma caixa blindada com conectores BNC (Figura 2E). Adicione uma fonte de alimentação DC de 64 V ao fotodiodo montado para aumentar seu limiar de saturação e largura de banda de resposta.
- Reflita a luz para a frente com um espelho de 2 polegadas. Refoce novamente a luz no fotodiodo após um filtro óptico para bloquear o feixe de Stokes modulador (Figura 2D).
- Envie a corrente de saída do fotodiodo para um amplificador de travamento rápido terminado com 50 para demodulação de sinal. Envie um gatilho de 8 MHz para o amplificador de travamento como sinal de referência.
- Envie o componente X em fase de fase do amplificador lock-in para a caixa de interface analógica do microscópio.
- Otimize a sobreposição temporal com o estágio de atraso motorizado embutido medindo o sinal SRS de líquido D2O puro no microscópio.
5. Aquisição e análise de imagens
- Execute imagens epr-SRS multicanais com ajuste de comprimento de onda da bomba sequencial.
- Definir potência laser para bomba P = 10-40 mW e PStokes = 40-80 mW no painel de controle a laser.
- Defina o tempo de moradia dos pixels para 2-4 μs e use vários quadros em média 10-20 quadros no software de microscopia.
NOTA: Evite um uso combinatório de alta potência laser (bomba P> 40 mW, PStokes> 80 mW) e tamanho de pixel pequeno (<0,2 μm), o que provavelmente causa o "efeito branqueamento" dos corantes Raman devido à excitação multifotol. - Defina as constantes de tempo do amplificador de travamento para metade do tempo de moradia do pixel.
- Espectral linear desmcomprando.
NOTA: o epr-SRS segue uma estrita dependência linear de sinal-concentração ao longo de toda a faixa de concentração; assim, o descompramento espectral linear é eficaz para remover quaisquer possíveis conversas cruzadas entre os canais. Para a medição epr-SRS do canal N com sondas N MARS, os sinais medidos (S) podem ser expressos como S = MC, onde C é a concentração da sonda MARS, e M é uma matriz N x N determinada por seções transversais de Raman das sondas MARS.- Meça a matriz M em amostras de imuno-eprSRS de cor única rotuladas com diferentes sondas MARS.
- Equação de uso C = M−1· S para determinar a matriz de concentração da sonda MARS com medição de sinal amostral multiplex S.
Resultados
A Figura 3 mostra exemplos de imagens de epr-SRS em diferentes amostras, incluindo células fixas (Figura 3A), paraformaldeído (PFA) tecidos de camundongos fixos (Figura 3B) e amostras humanas parafina fixas em formalina (FFPE) (Figura 3C). A resolução espacial da microscopia SRS é limitada à difração, a resolução lateral típica é de ~300 nm, e a resolução axial é de 1-2 μm usando luz quase infravermelha para excitação. Como resultado, estruturas subcelulares finas, como microtúbulos em células HeLa, foram fielmente reveladas com imagens imuno-eprSRS de α-tubulina (Figura 3A). Além disso, a epr-SRS é geralmente compatível com tecidos FFPE (Figura 3C), que é uma forma comum de amostras de biópsia para diagnóstico clínico e pesquisa patológica. Semelhante à microscopia de fluorescência de dois fótons, como um processo não linear, o epr-SRS tem capacidade de seção óptica para visualizar padrões tridimensionais com resolução subcelular (Figura 3D-E).
Primeiro mostramos o utilitário de imagem de proteína multiplex de epr-SRS em amostras de tecido congelado fixo de ilhotas de camundongos de Langerhans no pâncreas. Vários alvos interessados são selecionados, incluindo expressão hormonal (por exemplo, insulina, agonista de glicose (glucagon), polipeptídeo pancreático (PP) e somatostatina) para classificação do tipo celular (β células e células não β (α- δ-células)) e fatores de transcrição que são conhecidos por estarem relacionados com β-célulasheterogeneidade 23. Note-se que, uma vez que a detecção de fluorescência é ortogonal à detecção de SRS, o epr-SRS é totalmente compatível com fluorescência confocal e fluorescência de dois fótons. Como prova de conceito, a imagem tandem SRS-fluorescência de 7 cores em uma única ilhota foi prontamente alcançada (Figura 4) com bom contraste e padrões corretos. Alvos de baixa expressão, como o fator de transcrição Pdx1, foram imagens com contraste suficiente.
Também demonstramos uma imagem tandem srs-fluorescência de oito cores em tecidos de cerebelo de camundongos fixos pfa (Figura 5). Através de biomarcadores estabelecidos, diferentes tipos de células, como neurônios de grânulo cerebelar (NeuN), neurônios Purkinje (Calbindin), astrócitos (GFAP), oligodenrócitos (MBP) e neurônios GABAérgicos (receptor GABA B2 ) podem ser identificados.

Figura 1: Microscopia de Epr-SRS para imagem de proteína altamente multiplexada. (A) Diagrama de energia para Raman espontâneo, SRS não ressonante e SRS pré-ressonante eletrônico (epr-SRS). A taxa de transição vibracional dos cromóforos será aumentada em epr-SRS em até 1013 vezes. (B) A imuno-imagem baseada em epitope de α-tubulina foi demonstrada em células COS-7 manchadas por ATTO740 com alto contraste vibracional por epr-SRS. O sinal epr-SRS desaparece completamente quando o comprimento de onda do laser da bomba está fora da ressonância por apenas 2 nm (à direita). Barras de escala, 20 μm. (C) Epr-SRS espectro de sondas MARS conjugadas pelo ér NHS, conforme listado em Material Suplementar. Clique aqui para ver uma versão maior desta figura.

Figura 2: O desenho do microscópio SRS configuração. (A) diagrama esquemático da configuração SRS. EOM = modulador eletro-óptico, M = espelho, L = lente, DBS = divisor de feixedicróico, DM = espelho dicroico, OB = lente objetiva, CO = condensador, F = filtro, PD = fotodiodo. (B) Este painel mostra a parte de excitação do laser. Feixe de dupla cor da saída de laser é primeiro separado com cada feixe sendo colidido e expandido e posteriormente combinado e direcionado para o corpo do microscópio. (C) Este painel mostra a coleção transmitida com um condensador. (D) Este painel mostra a parte de detecção do SRS. Fotodiodo e filtro são montados em caixa blindada com dois conectores femininos BNC. O conector BNC inferior é para tensão de viés reverso, e o conector BNC mais alto é para saída de sinal de corrente para amplificador de travamento terminado com 50 Ω. (E) Este painel mostra como o fotodiodo Si é montado dentro da caixa blindada. Clique aqui para ver uma versão maior desta figura.

Figura 3: Imagem de corante raman de marcadores proteicos distintos através de imunolabeling. (A) Imagem imuno-eprSRS de α-tubulina em células HeLa. (B) Imagem imuno-eprSRS de NeuN em córtex cerebral de camundongos fixos pfa. (C) Imagem imuno-eprSRS de Vimentin no tecido FFPE renal humano. (D) Imagem renderizada em volume de GFAP manchada de volume em tecido cerebral de camundongo de 100 μm de espessura. O tamanho do passo em z foi de 2 μm. (E) Imagem renderizada em volume de NEUN manchada de 40-μm de espessura. O tamanho do passo em z foi de 1 μm. Barras de escala, 20 μm em (A), 50 μm (B-C), 30 μm (D-E). Clique aqui para ver uma versão maior desta figura.

Figura 4: Resultados representativos de imagens tandem de 7 cores de hormônios e fatores de transcrição no tecido de ilhota congelada do rato. Epr-SRS: Insulina (detectada por Cy5, marcador de células β, verde), Pdx1 (detectada por MARS2228, fator de transcrição, vermelho), Glucagon (detectado por MARS2216, marcador de células α, amarelo), PP (detectado por MARS2147, marcador de células PP, azul). Fluorescência: Somatostatin (Alexa488, marcador de célula δ, laranja), Nkx2.2 (Cy3, fator de transcrição, magenta), DAPI (núcleo, azul escuro). Barra de escala, 20 μm. Por favor, clique aqui para ver uma versão maior desta figura.
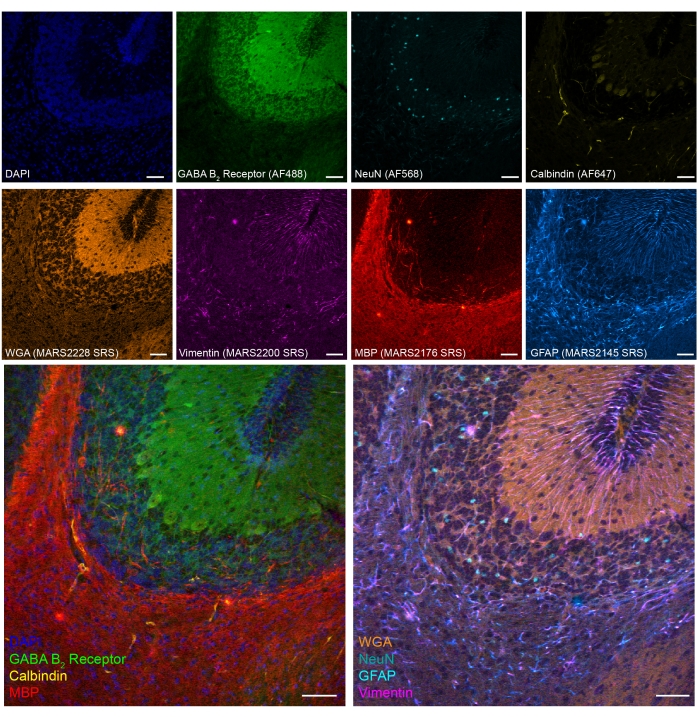
Figura 5: Resultados representativos de imagens tandem de 8 cores de marcadores do tipo celular na seção cerebral do camundongo fixado pelo PFA. Fluorescência: DNA (DAPI), GABA (γ-aminobutírico ácido) Receptor B 2 (neurônios GABAérgicos, Alexa Fluor 488), núcleos neuronais (NeuN; neurônios, Alexa Fluor 568) e Calbindin (neurônios Purkinje, Alexa Fluor 647); epr-SRS: aglutinina germe de trigo (WGA; MARS2228), Vimentin (MARS2200), proteína básica de mielina (MBP; oligodendrocitos, MARS2176) e GFAP (astrócitos e células-tronco neurais, MARS2145). Barra de escala, 50 μm. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Anticorpos validados para imuno-eprSRS. Consulte a Tabela de Materiais para obter mais detalhes. Clique aqui para baixar esta Tabela.
Material suplementar: Propriedades de 8 sondas MARS utilizadas nhs-ester-funcionalizadas. Os coeficientes deabdução e excitação de corantes MARS foram medidos na solução DMSO no espectrômetro UV-Vis usando cuvette de vidro de 1 cm como recipiente. As seções transversais absolutas de raman de corantes MARS foram determinadas em DMSO comparando o sinal epr-SRS de corantes MARS com o modo de estiramento C−O padrão (1030 cm-1) de metanol. A seção transversal raman absoluta para o modo de estiramento C−O padrão (1030 cm-1) de metanol foi relatada como 2,1 x 10-30 cm2 a 785 nm. Uma seção transversal de 0,9 x 10-30 cm2 foi estimada sob comprimento de onda da bomba de 860 nm por extrapolação. Clique aqui para baixar este Arquivo.
Discussão
Aqui, apresentamos o protocolo imuno-eprSRS que é amplamente aplicável aos tipos de tecidos comuns, incluindo tecidos de camundongos recém-preservados, tecidos humanos FFPE e tecidos de camundongos congelados. O imuno-eprSRS foi validado para um painel de epítopos em células e tecidos, conforme listado na Tabela 1. Esta plataforma de um tiro é particularmente adequada para aplicações onde estratégias cíclicas não funcionam bem. Por exemplo, a fluorescência cíclica é exigente para tecidos grossos, pois várias rodadas de imunolabeling 3D são longas nãopráticas 17. Também é muito provável que introduza erros de registro devido a alterações histológicas 3D não lineares 11,17. O Imuno-eprSRS supera barreiras práticas de fluorescência cíclica em tal cenário e traz oportunidades para revelar redes de interação proteica em um grande volume17.
A multiplexidade atual é restrita principalmente pela disponibilidade de anticorpos secundários. Enquanto neste protocolo, focamos na imunolabelação indireta, na qual as sondas MARS são conjugadas a anticorpos secundários, a imunolabelação direta e a coloração de lectina são viáveis17. Após mais validação de anticorpos primários com corantes Raman, 20 canais são esperados com corantes Raman atualmente desenvolvidos 13,18,24. Além disso, as metas de imagem muito baixas podem ser desafiadoras para a EPR-SRS devido à sua sensibilidade ligeiramente comprometida em comparação com o sistema de fluorescência confocal. Nesse sentido, recomendamos a atribuição de alvos relativamente baixos abundantes a corantes MARS mais brilhantes e alvos de baixa expressão aos canais de fluorescência.
Um aspecto crítico do protocolo é a acessibilidade de instrumentos e sondas. Em termos de instrumentação, um microscópio SRS é geralmente composto por uma fonte laser de dupla cor com um modulador óptico, um microscópio, um detector de fotodiodo e um amplificador de travamento para desmodulação25. Cada componente está comercialmente disponível com um custo total ligeiramente maior do que um microscópio de fluorescência de varredura a laser de dois fótons. Um microscópio de pesquisa de SRS/fluorescência multimodal totalmente integrado foi comercializado26 usando um laser picosegundo semelhante como aqui para excitação srs e conjuntos laser de ondas contínuas (CW) para fluorescência. Este sistema é prontamente aplicável para imagens vibracionais multiplex em pesquisas biológicas cotidianas. Em termos de sonda, as sondas MARS ainda não foram comercializadas e requerem algumas capacidades de síntese. Alternativamente, muitos fluoroforos comerciais far-red (consulte a Tabela de Dados Estendidos 1 em L. Wei et al. Nature 201713) podem ser usados para epr-SRS. No entanto, a multiplexidade pode ser comprometida. Além disso, uma vez que as sondas MARS por natureza são pequenas moléculas orgânicas, o imuno-eprSRS é semelhante à imunofluorescência em termos de coloração tecidual. Portanto, o arquivo de reagentes de afinidade validados, como anticorpos em imunofluorescência, pode ser facilmente transferido para aplicações imuno-eprSRS.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos ruth A. Singer e Richard K.P. Benninger por fornecer tecidos de pâncreas de rato. A W.M. reconhece o suporte do NIH R01 (GM128214), R01 (GM132860), R01 (EB029523) e exército dos EUA (W911NF-19-1-0214).
Materiais
| Name | Company | Catalog Number | Comments |
| 16% Paraformaldehyde, EM Grade | Electron Microscopy Sciences | 15710 | |
| α-tubulin | Abcam | ab18251 | Primary antibodies |
| α-tubulin | BioLegend | 625902 | Primary antibodies |
| β-III-tubulin | BioLegend | 657402 | Primary antibodies |
| β-III-tubulin | Abcam | ab41489 | Primary antibodies |
| β-tubulin | Abcam | ab131205 | Primary antibodies |
| Agarose, low gellling temperature | Sigma Aldrich | A9414 | For brain embedding |
| Anti-a-tubulin antibody produced in rabbit (α-tubulin) | Abcam | ab52866 | Primary antibodies |
| Anti-Calbindin antibody produced in mouse (Calbindin) | Abcam | ab82812 | Primary antibodies |
| Anti-GABA B receptor R2 antibody produced in guinea pig (GABA B receptor R2) | Millipore Sigma | AB2255 | Primary antibodies |
| Anti-GFAP antibody produced in goat (GFAP) | Thermo Scientific | PA5-18598 | Primary antibodies |
| Anti-Glucagon antibody produced in mouse (Glucagon) | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| Anti-insulin antibody produced in guinea pig (insulin) | DAKO | IR00261-2 | Primary antibodies |
| Anti-MBP antibody produced in rat (MBP) | Abcam | ab7349 | Primary antibodies |
| Anti-NeuN antibody produced in rabbit (NeuN) | Thermo Scientific | PA5-78639 | Primary antibodies |
| Anti-Pancreatic polypeptide (PP) antibody produced in goat- Pancreatic polypeptide (PP) | Sigma Aldrich | SAB2500747 | Primary antibodies |
| Anti-Pdx1 antibody produced in rabbit (Pdx1) | Milipore | 06-1379 | Primary antibodies |
| Anti-Somatostatin antibody produced in rat (Somatostatin) | Abcam | ab30788 | Primary antibodies |
| Anti-Vimentin antibody produced in chicken (Vimentin) | Abcam | ab24525 | Primary antibodies |
| Band-pass filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| BNC cable | Thorlabs | 2249-C | Coaxial Cable, BNC Male / Male |
| Broadband dielectric mirror | Thorlabs | BB1-E03 | 750 - 1100 nm |
| C57BL/6J mice | Jackson Laboratory | 000664 | |
| Centrifuge | |||
| Condenser | Olympus | oil immersion, 1.4 N.A. | |
| Cytokeratin 18 | Abcam | ab7797 | Primary antibodies |
| Cytokeratin 18 | Abcam | ab24561 | Primary antibodies |
| DC power supply | TopWard | 6302D | Bias voltage is 64 V |
| Dichroic mount | Thorlabs | KM100CL | Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Left Handed |
| Donkey anti-Chicken IgY (H+L) | Jackson ImmunoResearch | 703-005-155 | Secondary antibodies for MARS conjugation |
| Donkey anti-Goat IgG (H+L) | Jackson ImmunoResearch | 705-005-147 | Secondary antibodies for MARS conjugation |
| Donkey anti-Guinea Pig IgG (H+L) | Jackson ImmunoResearch | 706-005-148 | Secondary antibodies for MARS conjugation |
| Donkey anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-005-151 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-005-152 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rat IgG (H+L) | Jackson ImmunoResearch | 712-005-153 | Secondary antibodies for MARS conjugation |
| Donkey anti-Sheep IgG (H+L) | Jackson ImmunoResearch | 713-005-147 | Secondary antibodies for MARS conjugation |
| DPBS | Fisher Scientific | 14-190-250 | |
| EpCAM | Abcam | ab71916 | Primary antibodies |
| Ethanol | Sigma Aldrich | 443611 | |
| Fast-speed look-in amplifier | Zurich Instruments | HF2LI | DC - 50 MHz |
| FFPE Kidney Sample | USBiomax | HuFPT072 | |
| Fibrillarin | Abcam | ab5821 | Primary antibodies |
| Giantin | Abcam | ab24586 | Primary antibodies |
| Glucagon | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| H2B | Abcam | ab1790 | Primary antibodies |
| HeLa | ATCC | ATCC CCL-2 | |
| High O.D. bandpass filter | Chroma Technology | ET890/220m | Filter the Stokes beam and transmit the pump beam |
| Hydrophobic pen | Fisher Scientific | NC1384846 | |
| Insulin | ThermoFisher | 701265 | Primary antibodies |
| Integrated SRS laser system | Applied Physics & Electronics, Inc. | picoEMERALD | picoEMERALD provides an output pulse train at 1,064 nm with 6-ps pulse width and 80-MHz repetition rate, which serves as the Stokes beam. The frequency doubled beam at 532 nm is used to synchronously seed a picosecond optical parametric oscillator (OPO) to produce a mode-locked pulse train with five~6 ps pulse width (the idler beam of the OPO is blocked with an interferometric filter). The output wavelength of the OPO is tunable from 720–950 nm, which serves as the pump beam. The intensity of the 1,064-nm Stokes beam is modulated sinusoidally by a built-in EOM at 8 MHz with a modulation depth of more than 90%. The pump beam is spatially overlapped with the Stokes beam by using a dichroic mirror inside picoEMERALD. The temporal overlap between pump and Stokes pulse trains is achieved with a built-in delay stage and optimized by the SRS signal of pure D2O at the microscope. |
| Inverted laser-scanning microscope | Olympus | FV1200MPE | |
| Kinematic mirror mount | Thorlabs | POLARIS-K1-2AH | 2 Low-Profile Hex Adjusters |
| Lectin from Triticum vulgaris (wheat) | Sigma Aldrich | L0636-5 mg | |
| Long-pass dichroic beam splitter | Semrock | Di02-R980-25x36 | 980 nm laser BrightLine single-edge laser-flat dichroic beamsplitter |
| MAP2 | BioLegend | 801810 | Primary antibodies |
| Microscopy imaging software | Olympus | FluoView | |
| NanoQuant Plate | Tecan | For absorbance-based, small volume analyses in a plate reader. | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| NucBlue Fixed Cell ReadyProbes Reagent (DAPI) | Thermo Scientific | R37606 | |
| Nunc 4-Well Dishes | Fisher Scientific | 12-566-300 | |
| Objective lens | Olympus | XLPlan N | x25, 1.05-NA, MP, working distance = 2 mm |
| Paint brush | |||
| Periscope assembly | Thorlabs | RS99 | includes the top and bottom units, Ø1" post, and clamping fork. |
| pH meter | |||
| Plate reader | Tecan | Infinite 200 PRO | An easy-to-use multimode plate reader. Absorbance measurement capabilities over a spectral range of 230–1000 nm. |
| ProLong Gold antifade reagent | Thermo Scientific | P36930 | |
| PSD95 | Invitrogen | 51-6900 | Primary antibodies |
| Sephadex G-25 Medium | GE Life Sciences | 17-0033-01 | gel filtration resin for desalting and buffer exchange |
| Shielded box with BNC connectors | Pomona Electronics | 2902 | Aluminum Box With Cover, BNC Female/Female |
| Si photodiode | Thorlabs | FDS1010 | 350–1100 nm, 10 mm x 10 mm Active Area |
| Synapsin 2 | ThermoFisher | OSS00073G | Primary antibodies |
| Tissue Path Superfrost Plus Gold Slides | Fisher Scientific | 22-035813 | Adhesive slide to attract and chemically bond fresh or formalin-fixed tissue sections firmly to the slide surface (tiisue bindling glass slides) |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Vibratome | Leica | VT1000 | |
| Vimentin | Abcam | ab8069 | Primary antibodies |
| Xylenes | Sigma Aldrich | 214736 |
Referências
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. Journal for Immunotherapy of Cancer. 8 (1), 000155 (2020).
- Lewis, S. M., et al. Spatial omics and multiplexed imaging to explore cancer biology. Nature Methods. 18 (9), 997-1012 (2021).
- Bodenmiller, B. Multiplexed epitope-based tissue imaging for discovery and healthcare applications. Cell Systems. 2 (4), 225-238 (2016).
- Hickey, J. W., et al. Spatial mapping of protein composition and tissue organization: a primer for multiplexed antibody-based imaging. Nature Methods. , (2021).
- Lin, J. -. R., et al. Highly multiplexed immunofluorescence imaging of human tissues and tumors using t-CyCIF and conventional optical microscopes. eLife. 7, 31657 (2018).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Giesen, C., et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry. Nature Methods. 11 (4), 417-422 (2014).
- Keren, L., et al. MIBI-TOF: A multiplexed imaging platform relates cellular phenotypes and tissue structure. Science Advances. 5 (10), 5851 (2019).
- Gerdes, M. J., et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11982 (2013).
- Angelo, M., et al. Multiplexed ion beam imaging of human breast tumors. Nature Medicine. 20 (4), 436-442 (2014).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455 (2020).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544, 465 (2017).
- Wei, L., Min, W. Electronic preresonance stimulated Raman scattering microscopy. The Journal of Physical Chemistry Letters. 9 (15), 4294-4301 (2018).
- Shi, L., et al. Electronic resonant stimulated Raman scattering micro-spectroscopy. The Journal of Physical Chemistry B. 122 (39), 9218-9224 (2018).
- Fujioka, H., et al. Multicolor activatable Raman probes for simultaneous detection of plural enzyme activities. Journal of the American Chemical Society. 142 (49), 20701-20707 (2020).
- Shi, L., et al. Highly-multiplexed volumetric mapping with Raman dye imaging and tissue clearing. Nature Biotechnology. , (2021).
- Miao, Y., Qian, N., Shi, L., Hu, F., Min, W. 9-Cyanopyronin probe palette for super-multiplexed vibrational imaging. Nature Communications. 12 (1), 4518 (2021).
- Miao, Y., Shi, L., Hu, F., Min, W. Probe design for super-multiplexed vibrational imaging. Physical Biology. 16 (4), 041003 (2019).
- Qian, N., Min, W. Super-multiplexed vibrational probes: Being colorful makes a difference. Current Opinion in Chemical Biology. 67, 102115 (2022).
- Klimas, A., et al. Nanoscale imaging of biomolecules using molecule anchorable gel-enabled nanoscale in-situ fluorescence microscopy. Nature Portfolio. , (2021).
- Shi, L., et al. Super-resolution vibrational imaging using expansion stimulated Raman scattering microscopy. bioRxiv. , (2021).
- Benninger, R. K. P., Hodson, D. J. New understanding of β-cell heterogeneity and in situ islet function. Diabetes. 67 (4), 537 (2018).
- Hu, F., et al. Supermultiplexed optical imaging and barcoding with engineered polyynes. Nature Methods. 15 (3), 194-200 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- . Coherent Raman Scattering Microscope Available from: https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-cars/ (2022)
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados