Method Article
Imágenes de tejidos altamente multiplexados con tintes Raman
En este artículo
Resumen
La imagen electrónica de dispersión Raman estimulada por pre-resonancia (epr-SRS) de tintes Raman similares al arco iris es una nueva plataforma para imágenes de proteínas basadas en epítopos altamente multiplexados. Aquí, presentamos una guía práctica que incluye preparación de anticuerpos, tinción de muestras de tejido, ensamblaje de microscopio SRS e imágenes de tejido epr-SRS.
Resumen
La visualización de una amplia gama de biomarcadores específicos en los tejidos desempeña un papel vital en la exploración de las intrincadas organizaciones de los sistemas biológicos complejos. Por lo tanto, las tecnologías de imágenes altamente multiplexadas han sido cada vez más apreciadas. Aquí, describimos una plataforma emergente de imágenes vibratorias altamente multiplexadas de proteínas específicas con sensibilidad comparable a la inmunofluorescencia estándar a través de imágenes electrónicas de dispersión Raman estimulada por pre-resonancia (epr-SRS) de colorantes Raman similares al arco iris. Este método elude el límite de los canales resolubles espectralmente en la inmunofluorescencia convencional y proporciona un enfoque óptico de una sola toma para interrogar múltiples marcadores en tejidos con resolución subcelular. Por lo general, es compatible con preparaciones de tejidos estándar, incluidos los tejidos fijos en paraformaldehído, los tejidos congelados y los tejidos humanos incrustados en parafina fijada en formalina (FFPE). Prevemos que esta plataforma proporcionará una imagen más completa de las interacciones proteicas de especímenes biológicos, particularmente para tejidos gruesos intactos. Este protocolo proporciona el flujo de trabajo desde la preparación de anticuerpos hasta la tinción de muestras de tejido, el ensamblaje del microscopio SRS y las imágenes de tejidos epr-SRS.
Introducción
Los sistemas tisulares complejos están compuestos por distintas subpoblaciones celulares cuyas ubicaciones espaciales y redes de interacción están profundamente entrelazadas con sus funciones y disfunciones 1,2. Para revelar la arquitectura del tejido e interrogar su complejidad, el conocimiento de las ubicaciones espaciales de las proteínas a resolución de una sola célula es esencial. Por lo tanto, las tecnologías de imágenes de proteínas altamente multiplexadas han sido cada vez más apreciadas y podrían convertirse en una piedra angular para el estudio de la biología de los tejidos 3,4,5. Los métodos actuales comunes de imágenes de proteínas multiplexadas se pueden clasificar en dos categorías principales. Una es la imagen de inmunofluorescencia en serie que se basa en múltiples rondas de tinción e imágenes de tejidos, y la otra es la citometría de masa de imágenes junto con anticuerpos marcados con metales pesados 6,7,8,9,10,11,12.
Aquí, se introduce una estrategia alternativa para la obtención de imágenes de proteínas basadas en anticuerpos multiplexados. A diferencia de la modalidad de imágenes de fluorescencia prevalente, que solo puede visualizar 4-5 canales simultáneamente debido a los amplios espectros de excitación y emisión (ancho completo a la mitad del máximo (FWHM) ~ 500 cm-1), la microscopía Raman exhibe un ancho de línea espectral mucho más estrecho (FWHM ~ 10 cm-1) y, por lo tanto, proporciona una multiplexidad escalable. Recientemente, aprovechando el espectro estrecho, se ha desarrollado un nuevo esquema de microscopía Raman llamado microscopía de dispersión Raman estimulada por pre-resonancia electrónica (epr-SRS), que proporciona una poderosa estrategia para imágenes multiplexadas13. Al sondear los modos vibratorios acoplados electrónicamente de los tintes Raman, epr-SRS logra un efecto de mejora drástico de 1013 veces en las secciones transversales Raman y supera el cuello de botella de sensibilidad de la microscopía Raman convencional (Figura 1A)13,14,15. Como resultado, el límite de detección de epr-SRS se ha reducido a sub-μM, lo que permite la detección Raman de marcadores moleculares interesantes, como proteínas específicas y orgánulos dentro de las células13,16. En particular, utilizando anticuerpos conjugados con colorante Raman, se demostraron imágenes epr-SRS de proteínas específicas en células y tejidos (llamadas inmuno-eprSRS) con una sensibilidad comparable a la inmunofluorescencia estándar (Figura 1B)13,17. Al ajustar la longitud de onda de la bomba en solo 2 nm, la señal epr-SRS estará completamente apagada (Figura 1B), lo que muestra un alto contraste vibratorio.
En el lado de la sonda, se ha desarrollado un conjunto de sondas Raman similares al arco iris llamadas colorantes de dispersión Raman de Manhattan (MARS) para la conjugación de anticuerpos 13,18,19,20. Esta paleta Raman única consiste en nuevos tintes que llevan π triples enlaces conjugados (Material Suplementario), cada uno de los cuales muestra un pico epr-SRS único y estrecho en el rango espectral Bioorthogonal Raman (Figura 1C). Modificando la estructura del cromóforo central y editando isotópicamente ambos átomos del triple enlace (Material Suplementario), se han desarrollado sondas Raman separadas espectralmente. Aprovechando la multiplexidad escalable, la microscopía epr-SRS junto con la paleta de tintes MARS ofrece una estrategia óptica para imágenes de proteínas multiplex de una sola toma en células y tejidos.
Immuno-eprSRS proporciona una estrategia alternativa a los métodos actuales de imágenes de proteínas multiplex con fortalezas únicas. En comparación con los enfoques de fluorescencia con tinción cíclica, imágenes y eliminación de señales, esta plataforma basada en Raman garantiza la tinción e imágenes de una sola ronda. Por lo tanto, elude la complejidad práctica en los procedimientos cíclicos y simplifica en gran medida el protocolo, abriendo así nuevos territorios de imágenes de proteínas multiplexadas. Por ejemplo, aprovechando un protocolo de limpieza de tejidos adaptado a tinte Raman, immuno-eprSRS se ha extendido a tres dimensiones para el mapeo de proteínas altamente multiplexadas en tejidos gruesos intactos17. Se visualizaron más de 10 dianas proteicas a lo largo de tejidos cerebrales de ratón de un milímetro de grosor17. Más recientemente, también se ha demostrado el acoplamiento de inmuno-eprSRS con un protocolo optimizado de microscopía de expansión de retención de biomoléculas (ExM)21, imágenes a nanoescala de una sola toma de múltiples objetivos22. En comparación con la espectroscopia de masaspor imágenes 4,9, epr-SRS no es destructiva y tiene una capacidad de seccionamiento intrínsecamente óptica. Además, epr-SRS es más eficiente en el tiempo en la exploración de tejidos. Por lo general, una región tisular de 0,25 mm2 con un tamaño de píxel de 0,5 μm tarda solo unos minutos en obtener una imagen de un solo canal epr-SRS. Por ejemplo, el tiempo total de imagen de cuatro canales SRS más cuatro canales de fluorescencia en la Figura 4 es de aproximadamente 10 min.
Protocolo
El protocolo se llevó a cabo de acuerdo con el protocolo de experimentación animal (AC-AABD1552) aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Columbia.
1. Preparación de anticuerpos conjugados con colorante Raman
- Prepare el tampón de conjugación como ~0.1 M NaHCO3 en tampón PBS, pH = 8.3, almacenar a 4 °C.
- Prepare la solución de sonda MARS (material suplementario) con función de éster de N-hidroxisuccinimida (NHS) como 3 mM en DMSO anhidro. La síntesis de las sondas MARS puede remitirse a los informes anteriores 13,17,18.
NOTA: Para fines de almacenamiento, la solución de éster DE colorante NHS debe protegerse de la luz y mantenerse a -20 °C. - Disolver los sólidos de anticuerpos en el tampón de conjugación a una concentración de 2 mg/ml. Para los anticuerpos que se disuelven en otros tampones, cámbielos en el tampón de conjugación a una concentración de 1-2 mg/ml con filtros centrífugos.
NOTA: Se prefieren los anticuerpos secundarios altamente adsorbidos cruzados para la tinción multiplex para minimizar la reactividad entre especies. Los anticuerpos secundarios utilizados se enumeran en la Tabla 1 y en la Tabla de Materiales. - Realizar la reacción de conjugación.
- Para los anticuerpos secundarios, agregue 15 veces el exceso molar de solución de colorante a la solución de anticuerpos en un vial de vidrio lentamente con agitación. Por ejemplo, en una solución de anticuerpos de 0,5 ml a 2 mg/ml, agregue una solución de colorante de 35 μL y 3 ml.
- Incubar la mezcla de reacción a temperatura ambiente (RT) con agitación durante 1 h. Proteja la reacción de la luz.
- Purificación.
- Prepare la suspensión de resina de filtración en gel (Tabla de materiales) en tampón PBS, siguiendo los pasos 1.5.2-1.5.4.
- Agregue 10 ml de polvo de resina de filtración de gel en 40 ml de tampón PBS dentro de un tubo de 50 ml.
- Mantenga la solución en un baño de agua a 90 °C durante 1 h.
- Decantar el sobrenadante y volver a añadir PBS a 40 ml. Conservar el purín a 4 °C.
- Empaque la columna de exclusión de tamaño (1 cm de diámetro, columnas de flujo por gravedad) con la solución de lodo a la altura de 10-15 cm.
- Enjuague y lave la columna con ~ 10 ml de tampón PBS para empacar aún más la resina.
- Pipetear la mezcla de reacción de conjugación (~0.5 mL) a la columna. Agregue inmediatamente 1 ml de tampón PBS como tampón de elución cuando se cargue toda la mezcla de reacción. Rellene constantemente el búfer de elución (PBS) en la columna.
- Recoja el eluido de la solución conjugada observando el color en la columna (los tintes MARS tienen colores verde claro a azul) o midiendo la absorbancia a 280 nm (A280).
- Concentre la solución recolectada a 1-2 mg/ml con un filtro centrífugo.
- Determine la concentración y el grado medio de etiquetado (DOL, relación colorante-proteína) midiendo el espectro ultravioleta-visible (UV-Vis) de la solución conjugada con un lector de placas Nano.
NOTA: El material suplementario proporciona las propiedades de los ésteres NHS de colorante MARS para el cálculo. El DOL normal para el anticuerpo secundario es de alrededor de 3.
2. Preparación de muestras de tejido
- El paraformaldehído fijó los tejidos cerebrales del ratón.
- Anestesiar a los ratones (C57BL/6J, Hembra, 25 d postnatal) con isoflurano. Evalúe la anestesia adecuada con una prueba de pellizco del dedo del pie.
- Matar a los ratones por desplazamiento cervical. Perfundir los ratones inmediatamente con paraformaldehído al 4% (PFA) en PBS transcárdicamente.
- Recoge el cerebro del ratón, siguiendo los pasos 2.1.4-2.1.5
- Corte hacia arriba desde el tronco encefálico a lo largo de la sutura sagital. Pelar las dos mitades del cráneo hacia un lado y sacar el cerebro con una pinza.
- Fijar el cerebro recogido en 4% de PFA en PBS a 4 °C durante 24 h. Luego, lave el cerebro en tampón PBS a 4 ° C durante 24 h para eliminar el exceso de PFA.
- Coloque la agarosa sólida en agua a una concentración final del 7% (p/v) en un vaso de precipitados, con una tapa suelta. Revuelva la solución con una varilla de agitación de vidrio. Calentar la suspensión en el microondas hasta que la solución esté clara.
- Deje que la agarosa se enfríe a 45-55 °C.
- Vierta la agarosa líquida en una cámara pequeña, luego transfiera el cerebro de PBS a agarosa líquida y oriente con una espátula para incrustar el cerebro. Espere a que el bloque tejido-agarosa se endurezca.
- Seccione el tejido-agrose en rodajas coronales de 40 μm de espesor usando un vibratome.
- Transfiera el tejido a una placa de 4 pocillos para la siguiente tinción. Retire la agarosa con una pinza. Lave el tejido con 1 ml de PBS, tres veces.
- Tejidos pancreáticos de ratón congelados fijos.
- Fije la pancreata del ratón en PFA al 4% en PBS a 4 °C con balanceo durante 16-20 h.
- Lave la muestra en 1 ml de PBS (4 °C) tres veces para eliminar el PFA.
- Incruste la muestra (~ 0.3-0.5 cm de tamaño) en bloques compuestos de temperatura de corte óptima (OCT). Ponga 2 gotas de OCT en un criomold de plástico. Coloque el tejido en la orientación correcta y vierta LA OCT sobre los tejidos hasta que ninguno de los tejidos quede expuesto.
- Seccione la pancreata a rodajas de 8 μm de espesor y inmovibilícelas en un portaobjetos de vidrio de unión de tejido, guárdelas a -80 ° C.
- Antes de teñir, equilibre la muestra a RT. Lave el tejido con PBS para eliminar los bloqueos de OCT.
- Muestras de FFPE.
- Hornea el portaes de tejido FFPE a 60 °C durante 10 min.
- Desparafinación y rehidratación: Coloque las muestras secuencialmente en las siguientes soluciones en un tubo de 50 ml a RT durante 3 minutos cada vez con agitación leve:
xileno dos veces,
etanol dos veces,
95% (vol/vol) de etanol en agua desionizada dos veces,
70% (vol/vol) de etanol en agua desionizada dos veces,
50% (vol/vol) de etanol en agua desionizada una vez,
agua desionizada una vez. - Transfiera la muestra a citrato de sodio de 20 mM (pH 8.0) a 100 °C en un frasco de vidrio. Asegúrese de que los tejidos estén sumergidos en la solución.
- Coloque el frasco en un baño de agua a 60 °C durante 45 min.
- Lave la muestra con agua desionizada en RT durante 5 min.
3. Tinción de inmuno-eprSRS tisular
- Use una pluma hidrofóbica para dibujar un límite alrededor de las secciones de tejido en la diapositiva.
NOTA: Se utiliza un frasco de tinción de diapositivas para seguir los pasos de incubación del tejido en el portaobjetos. Los tejidos flotantes (secciones cerebrales de ratón de 40 μm de espesor) se tiñen en placas de pozos. - Incubar los tejidos con PBST al 0,3-0,5% (Tritón X-100 en PBS) durante 10 min.
- Incubar los tejidos con tampón de bloqueo (5% de suero de burro, 0,5% de Tritón X-100 en PBS) durante 30 min.
- Prepare la solución de tinción primaria: agregue todos los anticuerpos primarios a 200-500 μL de tampón de tinción (2% de suero de burro, 0.5% de Tritón X-100 en PBS) a las concentraciones deseadas. Centrifugar la solución de tinción primaria a 13.000 x g durante 5 min. Solo use el sobrenadante si se forman precipitados.
- Incubar el tejido en la solución primaria de anticuerpos a 4 °C durante 1-2 días.
NOTA: Para teñir secciones de tejido en la diapositiva, coloque la muestra en una caja de tinción con una toallita húmeda para mantener la humedad. - Lave las diapositivas tres veces con PBST al 0.3-0.5% en RT durante 5 minutos cada una. Use 1 ml de PBST para tejidos flotantes. Para los pañuelos en el portaobjetos, lave los portaobjetos en un frasco de tinción de portaobjetos y asegúrese de que todos los pañuelos estén sumergidos en la solución.
- Incubar el tejido en 200-500 μL de tampón de bloqueo durante 30 min.
- Preparar la solución de tinción secundaria: añadir todos los anticuerpos secundarios (y lectinas si es necesario) a 200-500 μL de tampón de tinción con las concentraciones deseadas (normalmente 10 μg/mL). Centrifugar la solución de tinción secundaria a 13.000 x g durante 5 min. Solo use el sobrenadante si se forman precipitados.
- Incubar los tejidos en 200-500 μL de solución secundaria de anticuerpos a 4 °C durante 1-2 días.
- Lave las diapositivas dos veces con PBST al 0.3-0.5% en RT durante 5 minutos cada una.
- Incubar con 200-500 μL de solución DAPI durante 30 min.
- Lave las diapositivas tres veces con PBS en RT durante 5 minutos cada una.
- Para las secciones de tejido flotantes, transfiéralas a portaobjetos de vidrio con una pipeta que deja caer vidrio. Extienda el pañuelo con un cepillo de pañuelos y limpie el entorno con toallitas si es necesario.
- Monte el tejido en una gota de reactivos antifasantes con una cubierta de vidrio y asegúrelo con esmalte de uñas.
4. Conjunto del microscopio SRS
NOTA: Un sistema de fluorescencia confocal comercial se utiliza en imágenes de fluorescencia SRS en tándem. Se pueden encontrar más descripciones en un informe anterior17. Este protocolo se centrará en el lado de las imágenes SRS utilizando excitación de banda estrecha.
- Prepare una mesa óptica aislada por vibración en una habitación con control de temperatura.
- Coloque un sistema sincronizado de doble láser (bomba y Stokes) en la mesa óptica (Figura 2A) con un enfriador conectado.
NOTA: El láser fundamental en el sistema de láser dual proporciona un tren de pulsos de salida a 1064 nm con un ancho de pulso de 6 ps y una tasa de repetición de 80 MHz. El rayo Stokes es del láser fundamental. La intensidad del haz de Stokes fue modulada sinusoidalmente por un modulador de amplitud electroóptico (EOM) incorporado a 8 MHz con una profundidad de modulación de más del 90%. La otra parte del láser fundamental se duplica en frecuencia a 532 nm, que se utiliza además para sembrar sincrónicamente un oscilador paramétrico óptico de picosegundos (OPO) para producir un tren de pulsos bloqueado por modo con un ancho de pulso de 5-6 ps (el haz de ralentí del OPO se bloquea con un filtro interferométrico). La longitud de onda de salida del OPO es sintonizable de 720-950 nm, que sirve como haz de bomba. - Monte los espejos (rango de longitud de onda: 750-1100 nm), los divisores de haz dicroico (DBS, filtro de paso largo de 980 nm, rectangular) y la lente (acromática, recubrimiento AR para 650-1050 nm) a sus respectivas monturas. Utilice soportes de espejo cinemáticos muy estables para los espejos y divisores de haz dicroico.
- Mida la altura de la salida del láser y los tamaños de haz de la bomba y los haces stokes. Ajuste la altura de los espejos y lentes para asegurarse de que la luz llegue al centro de todos los elementos ópticos.
- Coloque el espejo M1 en la mesa óptica y hágalo ~ 45 ° a la salida láser (Figura 2B). Utilice las perillas del soporte cinemático para realizar ajustes de punta e inclinación. Asegúrese de que la luz viaje a la misma altura a lo largo de la longitud de la mesa y una línea recta con respecto a la mesa.
- Coloque y alinee los divisores de haz dicroico (filtros de paso largo de 980 nm) y los espejos para dividir la bomba y los haces stokes (Figura 2A-B).
- Coloque y alinee los pares de lentes (L1, L2 y L3, L4) en cada una de las trayectorias del haz para colimar los haces y expandir los diámetros de los haces para que coincidan con la pupila posterior del objetivo (Figura 2A-B).
- Utilice espejos M7 y M8 para alinear los rayos láser combinados en el microscopio (Figura 2C). Alinee primero un haz en el microscopio y use los pares de espejos en el otro haz para garantizar la superposición espacial de los dos haces.
- Configure la parte de detección.
- Coloque un condensador de aceite con recubrimiento infrarrojo (1.4-NA) para recoger la bomba de avance y los haces stokes después de pasar a través de las muestras (Figura 2C).
- Monte un fotodiodo de Si de gran área en una caja blindada con conectores BNC (Figura 2E). Agregue una fuente de alimentación de 64 V CC al fotodiodo montado para aumentar su umbral de saturación y ancho de banda de respuesta.
- Refleja la luz hacia adelante con un espejo de 2 pulgadas. Vuelva a enfocar la luz en el fotodiodo después de un filtro óptico para bloquear el haz de Stokes modulante (Figura 2D).
- Envíe la corriente de salida del fotodiodo a un amplificador de bloqueo rápido terminado con 50 para la demodulación de la señal. Envíe un disparador de 8 MHz al amplificador de bloqueo como señal de referencia.
- Envíe el componente X en fase del amplificador de bloqueo a la caja de interfaz analógica del microscopio.
- Optimice la superposición temporal con la etapa de retardo motorizada incorporada midiendo la señal SRS del líquido puro D2O en el microscopio.
5. Adquisición y análisis de imágenes
- Realice imágenes epr-SRS multicanal con ajuste secuencial de la longitud de onda de la bomba.
- Ajuste la potencia del láser a la bomba P = 10-40 mW y PStokes = 40-80 mW en el panel de control láser.
- Establezca el tiempo de permanencia de píxeles en 2-4 μs y use múltiples fotogramas con un promedio de 10-20 fotogramas en el software de microscopía.
NOTA: Evite el uso combinatorio de alta potencia láser (bomba P> 40 mW, PStokes> 80 mW) y tamaño de píxel pequeño (<0,2 μm), que probablemente causen un "efecto blanqueador" de los tintes Raman debido a la excitación multifotónica. - Ajuste las constantes de tiempo del amplificador de bloqueo a la mitad del tiempo de permanencia de píxeles.
- Desmezcla espectral lineal.
NOTA: epr-SRS sigue una estricta dependencia lineal de señal a concentración en todo el rango de concentración; por lo tanto, la desmezcla espectral lineal es efectiva para eliminar cualquier posible diafonía entre canales. Para la medición epr-SRS de canal N con sondas N MARS, las señales medidas (S) se pueden expresar como S = MC, donde C son las concentraciones de la sonda MARS, y M es una matriz N x N determinada por secciones transversales Raman de sondas MARS.- Mida la matriz M en muestras inmuno-eprSRS de un solo color marcadas con diferentes sondas MARS.
- Usa la ecuación C = M−1· S para determinar la matriz de concentración de la sonda MARS con medición de señal de muestra multiplex S.
Resultados
La Figura 3 muestra imágenes de ejemplo de epr-SRS en diferentes muestras, incluyendo células fijas (Figura 3A), tejidos de ratón fijados en paraformaldehído (PFA) (Figura 3B) y especímenes humanos incrustados en parafina fijada en formalina (FFPE) (Figura 3C). La resolución espacial de la microscopía SRS es limitada por difracción, la resolución lateral típica es de ~ 300 nm y la resolución axial es de 1-2 μm utilizando luz infrarroja cercana para la excitación. Como resultado, las estructuras subcelulares finas, como los microtúbulos en las células HeLa, se revelaron fielmente con imágenes inmuno-eprSRS de α-tubulina (Figura 3A). Además, epr-SRS es generalmente compatible con tejidos FFPE (Figura 3C), que es una forma común de muestras de biopsia para el diagnóstico clínico y la investigación patológica. Similar a la microscopía de fluorescencia de dos fotones, como un proceso no lineal, epr-SRS tiene capacidad de seccionamiento óptico para visualizar patrones tridimensionales con resolución subcelular (Figura 3D-E).
Primero mostramos la utilidad de imagen de proteína multiplex de epr-SRS en muestras fijas de tejido congelado de islotes de ratón de Langerhans en el páncreas. Se seleccionan varios objetivos interesados, incluida la expresión hormonal (por ejemplo, insulina, agonista de la glucosa (glucagón), polipéptido pancreático (PP) y somatostatina) para la clasificación de tipo celular (células β y células no β (células α, δ)) y factores de transcripción que se sabe que están relacionados con la heterogeneidad de las células β23. Cabe destacar que, dado que la detección de fluorescencia es ortogonal a la detección de SRS, epr-SRS es totalmente compatible con la fluorescencia confocal y la fluorescencia de dos fotones. Como prueba de concepto, se lograron fácilmente imágenes en tándem de 7 colores srS-fluorescencia en un solo islote (Figura 4) con buen contraste y patrones correctos. Los objetivos de baja expresión, como el factor de transcripción Pdx1, se tomaron imágenes con suficiente contraste.
También demostramos una imagen en tándem de fluorescencia SRS de ocho colores en tejidos de cerebelo de ratón fijados con PFA (Figura 5). A través de biomarcadores establecidos, se pueden identificar diferentes tipos de células, como las neuronas granulares cerebelosas (NeuN), las neuronas de Purkinje (Calbindin), los astrocitos (GFAP), los oligodendrocitos (MBP) y las neuronas GABAérgicas (receptor GABA B2 ).

Figura 1: Microscopía Epr-SRS para imágenes de proteínas altamente multiplexadas. (A) Diagrama de energía para Raman espontáneo, SRS no resonante y SRS presonante electrónico (epr-SRS). La tasa de transición vibracional de los cromóforos se mejorará en epr-SRS hasta en 1013 veces. (B) Se demostró la inmunoimagen basada en epítopos de α-tubulina en células COS-7 teñidas por ATTO740 con alto contraste vibratorio por epr-SRS. La señal epr-SRS desaparece por completo cuando la longitud de onda del láser de la bomba está fuera de resonancia por solo 2 nm (derecha). Barras de escala, 20 μm. (C) Espectros Epr-SRS de sondas MARS conjugadas con éster NHS como se indica en Material suplementario. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: El diseño de la configuración del microscopio SRS. (A) Diagrama esquemático de la configuración del SRS. EOM = modulador electroóptico, M = espejo, L = lente, DBS = divisor de haz dicroico, DM = espejo dicroico, OB = lente objetivo, CO = condensador, F = filtro, PD = fotodiodo. (B) Este panel muestra la parte de excitación láser. El haz de doble color de la salida láser se separa primero con cada haz colimado y expandido y luego combinado y dirigido al cuerpo del microscopio. (C) Este panel muestra la colección transmitida con un condensador. (D) Este panel muestra la parte de detección de SRS. El fotodiodo y el filtro están montados en una caja blindada con dos conectores hembra BNC. El conector BNC inferior es para voltaje de polarización inversa, y el conector BNC más alto es para la salida de señal de corriente al amplificador de bloqueo terminado con 50 Ω. (E) Este panel muestra cómo se monta el fotodiodo Si dentro de la caja blindada. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Imágenes de colorantes Raman de distintos marcadores de proteínas a través del inmunoetiquetado. (A) Imágenes de inmuno-eprSRS de α-tubulina en células HeLa. (B) Imágenes inmuno-eprSRS de NeuN en la corteza cerebral de ratón fijada por PFA. (C) Imágenes inmuno-eprSRS de vimentina en tejido FFPE renal humano. (D) Imagen renderizada por volumen de GFAP teñido con MARS2145 en tejido cerebral de ratón de 100 μm de espesor. El tamaño del paso en z fue de 2 μm. (E) Imagen renderizada por volumen de NeuN teñida con MARS2228 en tejido cerebral de ratón de 40 μm de espesor. El tamaño del paso en z fue de 1 μm. Barras de escala, 20 μm in (A), 50 μm in (B-C), 30 μm in (D-E). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Resultados representativos de imágenes en tándem de 7 colores de hormonas y factores de transcripción en tejido de islotes de ratón congelados. Epr-SRS: Insulina (detectada por Cy5, marcador de células β, verde), Pdx1 (detectada por MARS2228, factor de transcripción, rojo), glucagón (detectado por MARS2216, marcador de células α, amarillo), PP (detectado por MARS2147, marcador de células PP, azul). Fluorescencia: Somatostatina (Alexa488, marcador de células δ, naranja), Nkx2.2 (Cy3, factor de transcripción, magenta), DAPI (núcleo, azul oscuro). Barra de escala, 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
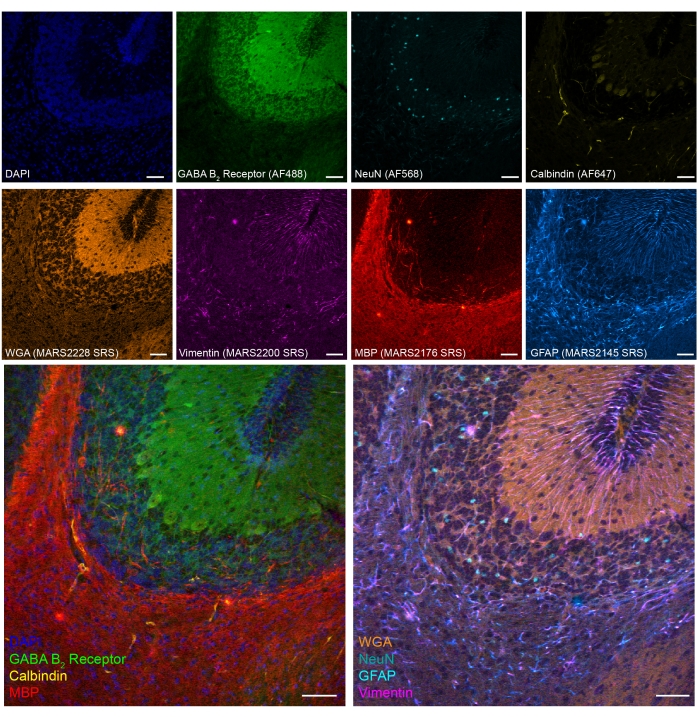
Figura 5: Resultados representativos de imágenes en tándem de 8 colores de marcadores de tipo celular en la sección cerebral de ratón fijada con PFA. Fluorescencia: ADN (DAPI), GABA (ácido γ-aminobutírico) receptor B 2 (neuronas GABAérgicas, Alexa Fluor 488), núcleos neuronales (NeuN; neuronas, Alexa Fluor 568) y Calbindina (neuronas de Purkinje, Alexa Fluor 647); epr-SRS: aglutinina de germen de trigo (WGA; MARS2228), Vimentina (MARS2200), proteína básica de mielina (MBP; oligodendrocitos, MARS2176) y GFAP (astrocitos y células madre neurales, MARS2145). Barra de escala, 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Anticuerpos validados para inmuno-eprSRS. Consulte la Tabla de materiales para obtener más detalles. Haga clic aquí para descargar esta tabla.
Material suplementario: Propiedades de 8 sondas MARS funcionalizadas con éster NHS utilizadas. λabs y los coeficientes de excitación de los colorantes MARS se midieron en solución DMSO en espectrómetro UV-Vis utilizando cubeta de vidrio de 1 cm como recipiente. Las secciones transversales Raman absolutas de los colorantes MARS se determinaron en DMSO comparando la señal epr-SRS de los colorantes MARS con el modo de estiramiento C-O estándar (1030 cm-1) de metanol. La sección transversal Raman absoluta para el modo de estiramiento C-O estándar (1030 cm-1) de metanol se informó como 2.1 x 10-30 cm2 a 785 nm. Se estimó una sección transversal de 0,9 x 10-30 cm2 por extrapolación de la longitud de onda de la bomba de 860 nm. Haga clic aquí para descargar este archivo.
Discusión
Aquí, presentamos el protocolo immuno-eprSRS que es ampliamente aplicable a los tipos de tejidos comunes, incluidos los tejidos de ratón recién conservados, los tejidos humanos FFPE y los tejidos de ratón congelados. Immuno-eprSRS ha sido validado para un panel de epítopos en células y tejidos, como se indica en la Tabla 1. Esta plataforma one-shot es particularmente adecuada para aplicaciones donde las estrategias cíclicas no funcionan bien. Por ejemplo, la fluorescencia cíclica es exigente para los tejidos gruesos, ya que las múltiples rondas de inmunoetiquetado 3D son poco prácticas y largas17. También es muy probable que introduzca errores de registro debido a cambios histológicos 3D no lineales11,17. Immuno-eprSRS supera las barreras prácticas de la fluorescencia cíclica en tal escenario y brinda oportunidades para revelar redes de interacción de proteínas a través de un gran volumen17.
La multiplexitud actual está restringida principalmente por la disponibilidad de anticuerpos secundarios. Mientras que en este protocolo, nos centramos en el inmunoetiquetado indirecto, en el que las sondas MARS se conjugan con anticuerpos secundarios, el inmunoetiquetado directo y la tinción de lectinas son factibles17. Después de una mayor validación de anticuerpos primarios con colorantes Raman, se esperan 20 canales con colorantes Raman actualmente desarrollados 13,18,24. Además, la obtención de imágenes de objetivos muy abundantes podría ser un desafío para epr-SRS debido a su sensibilidad ligeramente comprometida en comparación con el sistema de fluorescencia confocal. En este sentido, recomendamos asignar objetivos relativamente poco abundantes a colorantes MARS más brillantes y objetivos de baja expresión a canales de fluorescencia.
Un aspecto crítico del protocolo es la accesibilidad de los instrumentos y sondas. En cuanto a la instrumentación, un microscopio SRS generalmente se compone de una fuente láser de doble color con un modulador óptico, un microscopio, un detector de fotodiodos y un amplificador de bloqueo para demodulación25. Cada componente está disponible comercialmente con un costo total ligeramente más alto que un microscopio de fluorescencia de escaneo láser de dos fotones. Se ha comercializado un microscopio de investigación multimodal SRS/fluorescencia totalmente integrado26 utilizando un láser de picosegundos similar al de los conjuntos láser de excitación SRS y de onda continua (CW) para fluorescencia. Este sistema es fácilmente aplicable para imágenes vibratorias multiplex en la investigación biológica diaria. En cuanto a las sondas, las sondas MARS aún no se han comercializado y requieren algunas capacidades de síntesis. Alternativamente, muchos fluoróforos comerciales de color rojo lejano (consulte la Tabla de datos extendida 1 en L. Wei et al. Nature 201713) se pueden usar para epr-SRS. Sin embargo, la multiplexidad podría verse comprometida. Además, dado que las sondas MARS por naturaleza son pequeñas moléculas orgánicas, la inmuno-eprSRS es similar a la inmunofluorescencia en términos de tinción de tejidos. Por lo tanto, el archivo de reactivos de afinidad validados, como los anticuerpos en inmunofluorescencia, se puede transferir fácilmente a aplicaciones de inmuno-eprSRS.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Ruth A. Singer y Richard K.P. Benninger por proporcionar tejidos de páncreas de ratón. W.M. agradece el apoyo de NIH R01 (GM128214), R01 (GM132860), R01 (EB029523) y del Ejército de los Estados Unidos (W911NF-19-1-0214).
Materiales
| Name | Company | Catalog Number | Comments |
| 16% Paraformaldehyde, EM Grade | Electron Microscopy Sciences | 15710 | |
| α-tubulin | Abcam | ab18251 | Primary antibodies |
| α-tubulin | BioLegend | 625902 | Primary antibodies |
| β-III-tubulin | BioLegend | 657402 | Primary antibodies |
| β-III-tubulin | Abcam | ab41489 | Primary antibodies |
| β-tubulin | Abcam | ab131205 | Primary antibodies |
| Agarose, low gellling temperature | Sigma Aldrich | A9414 | For brain embedding |
| Anti-a-tubulin antibody produced in rabbit (α-tubulin) | Abcam | ab52866 | Primary antibodies |
| Anti-Calbindin antibody produced in mouse (Calbindin) | Abcam | ab82812 | Primary antibodies |
| Anti-GABA B receptor R2 antibody produced in guinea pig (GABA B receptor R2) | Millipore Sigma | AB2255 | Primary antibodies |
| Anti-GFAP antibody produced in goat (GFAP) | Thermo Scientific | PA5-18598 | Primary antibodies |
| Anti-Glucagon antibody produced in mouse (Glucagon) | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| Anti-insulin antibody produced in guinea pig (insulin) | DAKO | IR00261-2 | Primary antibodies |
| Anti-MBP antibody produced in rat (MBP) | Abcam | ab7349 | Primary antibodies |
| Anti-NeuN antibody produced in rabbit (NeuN) | Thermo Scientific | PA5-78639 | Primary antibodies |
| Anti-Pancreatic polypeptide (PP) antibody produced in goat- Pancreatic polypeptide (PP) | Sigma Aldrich | SAB2500747 | Primary antibodies |
| Anti-Pdx1 antibody produced in rabbit (Pdx1) | Milipore | 06-1379 | Primary antibodies |
| Anti-Somatostatin antibody produced in rat (Somatostatin) | Abcam | ab30788 | Primary antibodies |
| Anti-Vimentin antibody produced in chicken (Vimentin) | Abcam | ab24525 | Primary antibodies |
| Band-pass filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| BNC cable | Thorlabs | 2249-C | Coaxial Cable, BNC Male / Male |
| Broadband dielectric mirror | Thorlabs | BB1-E03 | 750 - 1100 nm |
| C57BL/6J mice | Jackson Laboratory | 000664 | |
| Centrifuge | |||
| Condenser | Olympus | oil immersion, 1.4 N.A. | |
| Cytokeratin 18 | Abcam | ab7797 | Primary antibodies |
| Cytokeratin 18 | Abcam | ab24561 | Primary antibodies |
| DC power supply | TopWard | 6302D | Bias voltage is 64 V |
| Dichroic mount | Thorlabs | KM100CL | Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Left Handed |
| Donkey anti-Chicken IgY (H+L) | Jackson ImmunoResearch | 703-005-155 | Secondary antibodies for MARS conjugation |
| Donkey anti-Goat IgG (H+L) | Jackson ImmunoResearch | 705-005-147 | Secondary antibodies for MARS conjugation |
| Donkey anti-Guinea Pig IgG (H+L) | Jackson ImmunoResearch | 706-005-148 | Secondary antibodies for MARS conjugation |
| Donkey anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-005-151 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-005-152 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rat IgG (H+L) | Jackson ImmunoResearch | 712-005-153 | Secondary antibodies for MARS conjugation |
| Donkey anti-Sheep IgG (H+L) | Jackson ImmunoResearch | 713-005-147 | Secondary antibodies for MARS conjugation |
| DPBS | Fisher Scientific | 14-190-250 | |
| EpCAM | Abcam | ab71916 | Primary antibodies |
| Ethanol | Sigma Aldrich | 443611 | |
| Fast-speed look-in amplifier | Zurich Instruments | HF2LI | DC - 50 MHz |
| FFPE Kidney Sample | USBiomax | HuFPT072 | |
| Fibrillarin | Abcam | ab5821 | Primary antibodies |
| Giantin | Abcam | ab24586 | Primary antibodies |
| Glucagon | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| H2B | Abcam | ab1790 | Primary antibodies |
| HeLa | ATCC | ATCC CCL-2 | |
| High O.D. bandpass filter | Chroma Technology | ET890/220m | Filter the Stokes beam and transmit the pump beam |
| Hydrophobic pen | Fisher Scientific | NC1384846 | |
| Insulin | ThermoFisher | 701265 | Primary antibodies |
| Integrated SRS laser system | Applied Physics & Electronics, Inc. | picoEMERALD | picoEMERALD provides an output pulse train at 1,064 nm with 6-ps pulse width and 80-MHz repetition rate, which serves as the Stokes beam. The frequency doubled beam at 532 nm is used to synchronously seed a picosecond optical parametric oscillator (OPO) to produce a mode-locked pulse train with five~6 ps pulse width (the idler beam of the OPO is blocked with an interferometric filter). The output wavelength of the OPO is tunable from 720–950 nm, which serves as the pump beam. The intensity of the 1,064-nm Stokes beam is modulated sinusoidally by a built-in EOM at 8 MHz with a modulation depth of more than 90%. The pump beam is spatially overlapped with the Stokes beam by using a dichroic mirror inside picoEMERALD. The temporal overlap between pump and Stokes pulse trains is achieved with a built-in delay stage and optimized by the SRS signal of pure D2O at the microscope. |
| Inverted laser-scanning microscope | Olympus | FV1200MPE | |
| Kinematic mirror mount | Thorlabs | POLARIS-K1-2AH | 2 Low-Profile Hex Adjusters |
| Lectin from Triticum vulgaris (wheat) | Sigma Aldrich | L0636-5 mg | |
| Long-pass dichroic beam splitter | Semrock | Di02-R980-25x36 | 980 nm laser BrightLine single-edge laser-flat dichroic beamsplitter |
| MAP2 | BioLegend | 801810 | Primary antibodies |
| Microscopy imaging software | Olympus | FluoView | |
| NanoQuant Plate | Tecan | For absorbance-based, small volume analyses in a plate reader. | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| NucBlue Fixed Cell ReadyProbes Reagent (DAPI) | Thermo Scientific | R37606 | |
| Nunc 4-Well Dishes | Fisher Scientific | 12-566-300 | |
| Objective lens | Olympus | XLPlan N | x25, 1.05-NA, MP, working distance = 2 mm |
| Paint brush | |||
| Periscope assembly | Thorlabs | RS99 | includes the top and bottom units, Ø1" post, and clamping fork. |
| pH meter | |||
| Plate reader | Tecan | Infinite 200 PRO | An easy-to-use multimode plate reader. Absorbance measurement capabilities over a spectral range of 230–1000 nm. |
| ProLong Gold antifade reagent | Thermo Scientific | P36930 | |
| PSD95 | Invitrogen | 51-6900 | Primary antibodies |
| Sephadex G-25 Medium | GE Life Sciences | 17-0033-01 | gel filtration resin for desalting and buffer exchange |
| Shielded box with BNC connectors | Pomona Electronics | 2902 | Aluminum Box With Cover, BNC Female/Female |
| Si photodiode | Thorlabs | FDS1010 | 350–1100 nm, 10 mm x 10 mm Active Area |
| Synapsin 2 | ThermoFisher | OSS00073G | Primary antibodies |
| Tissue Path Superfrost Plus Gold Slides | Fisher Scientific | 22-035813 | Adhesive slide to attract and chemically bond fresh or formalin-fixed tissue sections firmly to the slide surface (tiisue bindling glass slides) |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Vibratome | Leica | VT1000 | |
| Vimentin | Abcam | ab8069 | Primary antibodies |
| Xylenes | Sigma Aldrich | 214736 |
Referencias
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. Journal for Immunotherapy of Cancer. 8 (1), 000155 (2020).
- Lewis, S. M., et al. Spatial omics and multiplexed imaging to explore cancer biology. Nature Methods. 18 (9), 997-1012 (2021).
- Bodenmiller, B. Multiplexed epitope-based tissue imaging for discovery and healthcare applications. Cell Systems. 2 (4), 225-238 (2016).
- Hickey, J. W., et al. Spatial mapping of protein composition and tissue organization: a primer for multiplexed antibody-based imaging. Nature Methods. , (2021).
- Lin, J. -. R., et al. Highly multiplexed immunofluorescence imaging of human tissues and tumors using t-CyCIF and conventional optical microscopes. eLife. 7, 31657 (2018).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Giesen, C., et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry. Nature Methods. 11 (4), 417-422 (2014).
- Keren, L., et al. MIBI-TOF: A multiplexed imaging platform relates cellular phenotypes and tissue structure. Science Advances. 5 (10), 5851 (2019).
- Gerdes, M. J., et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11982 (2013).
- Angelo, M., et al. Multiplexed ion beam imaging of human breast tumors. Nature Medicine. 20 (4), 436-442 (2014).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455 (2020).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544, 465 (2017).
- Wei, L., Min, W. Electronic preresonance stimulated Raman scattering microscopy. The Journal of Physical Chemistry Letters. 9 (15), 4294-4301 (2018).
- Shi, L., et al. Electronic resonant stimulated Raman scattering micro-spectroscopy. The Journal of Physical Chemistry B. 122 (39), 9218-9224 (2018).
- Fujioka, H., et al. Multicolor activatable Raman probes for simultaneous detection of plural enzyme activities. Journal of the American Chemical Society. 142 (49), 20701-20707 (2020).
- Shi, L., et al. Highly-multiplexed volumetric mapping with Raman dye imaging and tissue clearing. Nature Biotechnology. , (2021).
- Miao, Y., Qian, N., Shi, L., Hu, F., Min, W. 9-Cyanopyronin probe palette for super-multiplexed vibrational imaging. Nature Communications. 12 (1), 4518 (2021).
- Miao, Y., Shi, L., Hu, F., Min, W. Probe design for super-multiplexed vibrational imaging. Physical Biology. 16 (4), 041003 (2019).
- Qian, N., Min, W. Super-multiplexed vibrational probes: Being colorful makes a difference. Current Opinion in Chemical Biology. 67, 102115 (2022).
- Klimas, A., et al. Nanoscale imaging of biomolecules using molecule anchorable gel-enabled nanoscale in-situ fluorescence microscopy. Nature Portfolio. , (2021).
- Shi, L., et al. Super-resolution vibrational imaging using expansion stimulated Raman scattering microscopy. bioRxiv. , (2021).
- Benninger, R. K. P., Hodson, D. J. New understanding of β-cell heterogeneity and in situ islet function. Diabetes. 67 (4), 537 (2018).
- Hu, F., et al. Supermultiplexed optical imaging and barcoding with engineered polyynes. Nature Methods. 15 (3), 194-200 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- . Coherent Raman Scattering Microscope Available from: https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-cars/ (2022)
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados