Method Article
ラマン色素による高多重化組織イメージング
要約
虹のようなラマン色素の電子事前共鳴刺激ラマン散乱(epr-SRS)イメージングは、高度に多重化されたエピトープベースのタンパク質イメージングのための新しいプラットフォームです。ここでは、抗体調製、組織サンプル染色、SRS顕微鏡アセンブリ、およびepr-SRS組織イメージングを含む実用的なガイドを紹介します。
要約
組織内の膨大な範囲の特定のバイオマーカーを視覚化することは、複雑な生物学的システムの複雑な組織を探索する上で重要な役割を果たします。したがって、高度に多重化されたイメージング技術はますます高く評価されています。ここでは、虹のようなラマン色素の電子事前共鳴刺激ラマン散乱(epr-SRS)イメージングによる標準的な免疫蛍光に匹敵する感度を持つ特定のタンパク質の高度に多重化された振動イメージングの新たなプラットフォームについて説明します。この方法は、従来の免疫蛍光におけるスペクトル的に解決可能なチャネルの限界を回避し、細胞内分解能を有する組織中の複数のマーカーを調査するためのワンショット光学的アプローチを提供する。一般に、パラホルムアルデヒド固定組織、凍結組織、およびホルマリン固定パラフィン包埋(FFPE)ヒト組織を含む標準的な組織調製物と適合性があります。このプラットフォームは、特に厚い無傷の組織について、生物学的標本のタンパク質相互作用のより包括的な全体像を提供すると想定しています。このプロトコルは、抗体調製から組織サンプル染色、SRS顕微鏡アセンブリ、epr-SRS組織イメージングまでのワークフローを提供します。
概要
複雑な組織系は、空間的位置および相互作用ネットワークがそれらの機能および機能不全と深く絡み合っている別個の細胞亜集団から構成される1,2。組織構造を明らかにし、その複雑さを調べるためには、単一細胞分解能でのタンパク質の空間的位置の知識が不可欠です。したがって、高度に多重化されたタンパク質イメージング技術はますます高く評価されており、組織生物学を研究するための礎石になる可能性があります3,4,5。現在の一般的な多重化タンパク質イメージング方法は、2つの主要なカテゴリに分類することができる。1つは、組織染色およびイメージングの複数回のラウンドに依存する連続免疫蛍光イメージングであり、もう1つは、重金属タグ付き抗体6、7、8、9、10、11、12と結合されたイメージングマスサイトメトリーである。
ここでは、多重化抗体ベースのタンパク質イメージングのための代替戦略が導入される。広い励起スペクトルと発光スペクトル(半値全幅(FWHM)〜500cm-1)のために同時に4〜5チャンネルしか視覚化できない一般的な蛍光イメージングモダリティとは異なり、ラマン顕微鏡ははるかに狭いスペクトル線幅(FWHM〜10cm-1)を示し、スケーラブルな多重性を提供します。最近、狭いスペクトルを利用することによって、電子事前共鳴刺激ラマン散乱(epr−SRS)顕微鏡法と名付けられたラマン顕微鏡の新規なスキームが開発され、多重化画像化のための強力な戦略を提供する13。epr-SRSは、ラマン色素の電子的に結合された振動モードをプローブすることにより、ラマン断面に対して10 13倍の劇的な増強効果を達成し、従来のラマン顕微鏡(図1A)13、14、15の感度ボトルネックを克服します。その結果、epr-SRSの検出限界はサブμMに押され、細胞内の特定のタンパク質や細胞小器官などの興味深い分子マーカーのラマン検出が可能となった13,16。特に、ラマン色素結合抗体を利用して、細胞および組織中の特定のタンパク質のepr-SRSイメージング(免疫-eprSRSと呼ばれる)が、標準的な免疫蛍光に対して同等の感度で実証されました(図1B)13、17。ポンプの波長をわずか2nmだけ同調させることで、epr-SRS信号は完全にオフになり(図1B)、高い振動コントラストを示します。
プローブ側では、抗体コンジュゲーション13、18、19、20のためにマンハッタンラマン散乱(MARS)色素と呼ばれる虹のようなラマンプローブのセットが開発されている。このユニークなラマンパレットは、π共役三重結合を持つ新規色素(補足資料)で構成され、それぞれが生体直交ラマンスペクトル範囲で単一の狭いepr-SRSピークを表示します(図1C)。コア発色団の構造を改変し、三重結合の両原子を同位体編集することにより(補足資料)、スペクトル的に分離されたラマンプローブが開発されている。スケーラブルな多重性を活用して、MARS色素パレットと組み合わせたepr-SRS顕微鏡は、細胞および組織におけるワンショット多重タンパク質イメージングのための光学戦略を提供します。
Immuno-eprSRSは、独自の強みを持つ現在のマルチプレックスタンパク質イメージング法に代わる戦略を提供します。周期的な染色、イメージング、シグナル除去による蛍光アプローチと比較して、このラマンベースのプラットフォームは、シングルラウンド染色とイメージングを保証します。したがって、巡回手順の実際的な複雑さを回避し、プロトコルを大幅に簡素化し、多重化タンパク質イメージングの新しい領域を開きます。例えば、ラマン色素に合わせた組織透明化プロトコルを利用して、免疫eprSRSは3次元に拡張され、厚いインタクト組織における高度に多重化されたタンパク質マッピングが可能になりました17。10以上のタンパク質標的を、厚さミリメートルのマウス脳組織に沿って可視化した17。より最近では、免疫eprSRSを最適化された生体分子保持膨張顕微鏡(ExM)プロトコル21と結合させることで、複数の標的のワンショットナノスケールイメージングも実証されている22。イメージング質量分析法4,9と比較して、epr-SRSは非破壊的であり、本質的に光学的切断能力を有する。さらに、epr-SRSは、組織スキャンにおいてより時間効率が良い。通常、ピクセルサイズが0.5μmの0.25mm2の組織領域は、単一のepr-SRSチャネルの画像化に数分しかかかりません。例えば、図4の4つのSRSチャネルと4つの蛍光チャネルの合計イメージング時間は約10分である。
プロトコル
このプロトコルは、コロンビア大学の施設動物ケアおよび使用委員会によって承認された動物実験プロトコル(AC-AABD1552)に従って実施された。
1. ラマン色素結合抗体の作製
- PBS緩衝液中に〜0.1 M NaHCO3としてコンジュゲーション緩衝液を調製し、pH=8.3、4°Cで保存する。
- N-ヒドロキシスクシンイミジ(NHS)エステル官能MARSプローブ(補足材料)溶液を無水DMSO中に3mMとして調製する。MARSプローブの合成は、先行報告13、17、18を参照することができる。
注:保存目的のために、染料NHSエステル溶液は光から保護され、-20°Cに保たれなければならない。 - 抗体固体をコンジュゲーションバッファーに2mg/mLの濃度まで溶解する。他のバッファーに溶解した抗体の場合は、遠心フィルターで 1 ~ 2 mg/mL の濃度に結合バッファーに交換します。
注:高度に交差吸着された二次抗体は、種間の反応性を最小限に抑えるためにマルチプレックス染色に好ましい。使用した二次抗体を表 1 および 材料表に列挙する。 - コンジュゲーション反応を行う。
- 二次抗体の場合、ガラスバイアル中の抗体溶液に15倍モル過剰の色素溶液を攪拌しながらゆっくりと加える。例えば、0.5 mL 2 mg/mL 抗体溶液に、3 μL 3 mM 色素溶液を加える。
- 反応混合物を室温(RT)で1時間撹拌しながらインキュベートする。反応を光から守ります。
- 浄化。
- ゲル濾過樹脂のスラリー(原料表)をPBS緩衝液中で調製し、以下の手順1.5.2~1.5.4を行う。
- 50 mL チューブ内の 40 mL の PBS バッファーに 10 mL のゲルろ過樹脂粉末を加えます。
- 溶液を90°Cの水浴中に1時間保持する。
- 上清をデカントし、PBSを40mLに再添加した。スラリーを4°Cで保存する。
- サイズ排除カラム(直径1cm、重力流カラム)にスラリー溶液を10〜15cmの高さまで充填する。
- カラムをすすぎ、約 10 mL の PBS バッファーで洗浄し、樹脂をさらにパックします。
- コンジュゲーション反応混合物(〜0.5 mL)をカラムにピペットする。全ての反応混合物がロードされたら直ちに溶出緩衝液として1mLのPBS緩衝液を加える。溶出バッファー (PBS) をカラムに常に補充してください。
- コンジュゲート溶液の溶出液を採取するには、カラム上の色(MARS色素は薄緑色から青色)を見るか、280nmでの吸光度を測定します(A280)。
- 回収した溶液を遠心フィルターで1~2mg/mLに濃縮する。
- ナノプレートリーダーでコンジュゲート溶液の紫外可視(UV-Vis)スペクトルを測定することにより、濃度および平均標識度(DOL、色素対タンパク質比)を決定する。
注 :補足材料 は、計算のためのMARS染料NHSエステルの特性を提供する。二次抗体の通常のDOLは3前後です。
2. 組織サンプル調製
- パラホルムアルデヒド固定マウス脳組織。
- マウス(C57BL/6J、雌、生後25d)をイソフルランで麻酔する。つま先ピンチテストで適切な麻酔を評価します。
- 子宮頸部変位によってマウスを殺す。PBS中の4%パラホルムアルデヒド(PFA)を経心的に直ちにマウスに灌流する。
- マウスの脳を収集し、手順2.1.4-2.1.5を実行します。
- 矢状縫合糸に沿って脳幹から上方に切断する。頭蓋骨の2つの半分を横に剥がし、ピンセットで脳をすくい取ります。
- 採取した脳をPBS中の4%PFAで4°Cで24時間固定する。その後、PBS緩衝液で脳を4°Cで24時間洗浄し、余分なPFAを除去した。
- 固体アガロースをビーカー内の最終濃度7%(w / v)の水に入れ、蓋を緩めます。ガラス製の攪拌棒で溶液を攪拌する。溶液が透明になるまでスラリーをマイクロ波で加熱する。
- アガロースを45〜55°Cまで冷却する。
- 液体アガロースを小さなチャンバーに注ぎ、PBSから液体アガロースに脳を移し、ヘラで向きを変えて脳を埋め込む。組織 - アガロースブロックが硬化するのを待ちます。
- 組織アグロスをビブラートームを用いて厚さ40μmの冠状スライスに切開する。
- 組織を4ウェルプレートに移し、以下の染色を行った。ピンセットでアガロースを取り除きます。1mLのPBSで組織を3回洗浄する。
- 凍結マウス膵臓組織を固定した。
- マウス膵臓をPBS中の4%PFAで4°Cで固定し、16〜20時間揺動させる。
- サンプルを1mLのPBS(4°C)で3回洗浄し、PFAを除去した。
- サンプル(約0.3~0.5cmのサイズ)を最適な切断温度(OCT)複合ブロックに埋め込みます。プラスチック製のクライオモールドにOCTを2滴入れます。組織を正しい向きに置き、組織のどれも露出したままにならないまで、組織の上にOCTを注ぎます。
- 膵臓を8μm厚のスライスに切開し、組織結合スライドガラス上に固定化し、-80°Cで保存する。
- 染色する前に、標本をRTに平衡化します。
- FFPE サンプル。
- FFPEティッシュスライドを60°Cで10分間焼きます。
- 脱パラフィンおよび再水和:以下の溶液にサンプルを順次入れ、RTの50mLチューブに3分間、軽度の振とうで毎回置きます。
キシレンを2回、
エタノールを2回、
脱イオン水中の95%(体積/体積)エタノールを2回、
脱イオン水中の70%(体積/体積)エタノールを2回、
脱イオン水中の50%(体積/体積)エタノールを1回、
脱イオン水を1回。 - ガラス瓶中で100°Cで20mMクエン酸ナトリウム(pH8.0)にサンプルを移す。組織が溶液に浸されていることを確認してください。
- 瓶を60°Cの水浴に45分間入れる。
- RTで脱イオン水でサンプルを5分間洗浄します。
3. 組織免疫-eprSRS染色
- 疎水性ペンを使用して、スライド上の組織切片の周りに境界を描きます。
注:スライド染色ジャーは、スライド上の組織のインキュベーションステップに従うために使用されます。浮遊組織(厚さ40μmのマウス脳切片)をウェルプレートで染色する。 - 組織を0.3〜0.5%PBST(PBS中のTriton X-100)で10分間インキュベートする。
- 組織をブロッキングバッファー(5%ロバ血清、0.5%Triton X-100 PBS中)で30分間インキュベートする。
- 一次染色液を調製する:すべての一次抗体を所望の濃度で200〜500μLの染色バッファー(2%ロバ血清、PBS中の0.5%Triton X-100)に加える。一次染色液を13,000 x g で5分間遠心分離する。沈殿物が形成された場合にのみ上澄み液を使用してください。
- 組織を一次抗体溶液中で4°Cで1〜2日間インキュベートする。
メモ:スライド上の組織切片を染色するには、湿度を維持するためにウェットワイプ付きの染色ボックスにサンプルを入れてください。 - スライドをRTで0.3~0.5% PBSTで3回、それぞれ5分間洗浄します。浮遊組織には1mLのPBSTを使用してください。スライド上の組織の場合は、スライド染色ジャーでスライドを洗浄し、組織がすべて溶液に浸されていることを確認します。
- 組織を200〜500μLのブロッキングバッファーで30分間インキュベートする。
- 二次染色液を調製する:すべての二次抗体(および必要に応じてレクチン)を所望の濃度(通常10μg/mL)の200〜500μLの染色バッファーに加える。二次染色液を13,000 x g で5分間遠心分離する。沈殿物が形成された場合にのみ上澄み液を使用してください。
- 組織を200〜500μLの二次抗体溶液中で4°Cで1〜2日間インキュベートする。
- スライドをRTで0.3~0.5% PBSTで2回、それぞれ5分間洗浄します。
- 200~500 μLのDAPI溶液と30分間インキュベートする。
- スライドをRTでPBSで3回、それぞれ5分間洗浄します。
- 浮遊組織切片の場合は、ガラス滴下ピペットでスライドガラスに移します。ティッシュブラシでティッシュを広げ、必要に応じてワイプで周囲をきれいにします。
- ガラスカバースリップで退色防止試薬の滴に組織をマウントし、マニキュアで固定します。
4. SRS顕微鏡アセンブリ
注:タンデムSRS蛍光イメージングでは、市販の共焦点蛍光システムが使用されます。さらなる説明は、以前の報告書17に見出すことができる。このプロトコルは、狭帯域励起を使用したSRSイメージング側に焦点を当てます。
- 温度制御の入った部屋に防振光学テーブルを用意する。
- 同期デュアルレーザーシステム(ポンプとストークス)を光学テーブル(図2A)に置き、チラーを接続します。
メモ:デュアルレーザシステムの基本レーザは、6psのパルス幅と80MHzの繰り返しレートで1064nmの出力パルス列を提供します。ストークスビームは基本レーザーからのものです。ストークスビームの強度は、変調深度90%を超える8MHzの内蔵電気光学振幅変調器(EOM)によって正弦波状に変調された。基本レーザの他の部分は周波数を2倍の532nmにし、さらにピコ秒光パラメトリック発振器(OPO)を同期的にシードして、5〜6psのパルス幅のモードロックパルス列を生成するために使用されます(OPOのアイドラービームは干渉フィルタでブロックされます)。OPOの出力波長は、ポンプビームとして機能する720〜950nmから調整可能です。 - ミラー(波長範囲:750-1100 nm)、ダイクロイックビームスプリッター(DBS、980 nmロングパスフィルター、長方形)、およびレンズ(無彩色、650-1050 nmのARコーティング)をそれぞれのマウントに取り付けます。ミラーとダイクロイックビームスプリッターには、非常に安定した運動学的ミラーマウントを使用してください。
- レーザー出力の高さと、ポンプとストークスビームのビームサイズを測定します。ミラーとレンズの高さを調整して、光がすべての光学素子の中心に当たるようにします。
- ミラーM1を光学テーブルの上に置き、レーザー出力に対して約45°にします(図2B)。キネマティックマウントのノブを使用して、チップとチルトを調整します。ライトがテーブルの長さに沿って同じ高さで移動し、テーブルに対して直線になるようにします。
- ダイクロイックビームスプリッタ(980nmロングパスフィルタ)とミラーを配置して位置合わせし、ポンプビームとストークスビームを分割します(図2A-B)。
- 各ビーム経路にレンズペア(L1、L2、L3、L4)を配置して位置合わせし、ビームを平行化し、対物レンズの背面瞳孔と一致するようにビーム直径を拡大します(図2A-B)。
- M7ミラーとM8ミラーを使用して、組み合わせたレーザービームを顕微鏡に合わせます(図2C)。最初に一方のビームを顕微鏡に位置合わせし、他方のビームにミラーペアを使用して、2つのビームの空間的オーバーラップを確保します。
- 検出部品を設定します。
- 赤外線コーティングされたオイルコンデンサー(1.4-NA)を装着し、試料を通過した後に順方向ポンプとストークスビームを収集します(図2C)。
- 大面積SiフォトダイオードをBNCコネクタ付きのシールドボックスに取り付けます(図2E)。実装されたフォトダイオードに64V DC電源を追加して、飽和スレッショルドと応答帯域幅を増やします。
- 2インチミラーで前方の光を反射します。光フィルタを使用して変調するストークスビームをブロックした後、光をフォトダイオードに再集束させます(図2D)。
- フォトダイオードの出力電流を、信号復調のために50で終端された高速ロックインアンプに送信します。8MHzのトリガをリファレンス信号としてロックインアンプに送信します。
- ロックインアンプの同相X成分を顕微鏡のアナログインターフェースボックスに送ります。
- 顕微鏡で純粋なD2O液体のSRS信号を測定することにより、内蔵の電動遅延ステージとの時間のオーバーラップを最適化します。
5. 画像の取得と解析
- シーケンシャルポンプ波長チューニングによるマルチチャンネルepr-SRSイメージングを実行します。
- レーザーコントロールパネルで、レーザー出力を Pポンプ = 10-40 mW、 Pストークス = 40-80 mWに設定します。
- ピクセルの滞留時間を2~4μsに設定し、顕微鏡ソフトウェアで平均10~20フレームの複数フレームを使用します。
注:多光子励起によるラマン色素の「漂白効果」を引き起こす可能性のある高レーザー出力(Pポンプ>40mW、 Pストークス<>80mW)の組み合わせ使用は避けてください。 - ロックインアンプの時定数をピクセルドウェル時間の半分に設定します。
- リニアスペクトルアンミキシング。
注:epr-SRSは、全濃度範囲にわたって厳密な線形信号対濃度依存性に従います。したがって、線形スペクトルのアンミキシングは、チャンネル間の潜在的なクロストークを除去するのに効果的です。N MARSプローブによるNチャネルepr-SRS測定の場合、測定された信号(S)はS = MCと表すことができ、ここでCはMARSプローブ濃度であり、MはMARSプローブのラマン断面によって決定されるNx N行列である。- 異なるMARSプローブで標識した単色免疫eprSRSサンプル上のマトリックス M を測定します。
- 式 C = M−1·Sは、多重試料信号測定S を用いてMARSプローブの濃度行列を決定し た。
結果
図3は、固定細胞(図3A)、パラホルムアルデヒド(PFA)固定マウス組織(図3B)、およびホルマリン固定パラフィン包埋(FFPE)ヒト試料(図3C)を含む異なる試料におけるepr-SRSの例の画像を示す。SRS顕微鏡の空間分解能は回折制限があり、典型的な横方向分解能は〜300nmであり、軸方向分解能は励起に近赤外光を使用して1〜2μmである。その結果、HeLa細胞における微小管などの微細な細胞下構造が、α-チューブリンの免疫-eprSRSイメージングにより忠実に明らかになった(図3A)。さらに、epr-SRSは一般にFFPE組織と適合性があり(図3C)、これは臨床診断および病理学研究のための生検標本の一般的な形態である。2光子蛍光顕微鏡と同様に、非線形プロセスとして、epr-SRSは細胞内分解能で3次元パターンを視覚化するための光学切片化機能を備えています(図3D-E)。
我々はまず、膵臓のランゲルハンス島のマウス膵島の固定凍結組織サンプル上で、epr-SRSの多重タンパク質イメージング有用性を示した。細胞型分類のためのホルモン発現(例えば、インスリン、グルコースアゴニスト(グルカゴン)、膵臓ポリペプチド(PP)、およびソマトスタチン)を含むいくつかの関心のある標的が選択される(β細胞および非β細胞(α細胞、δ細胞))およびβ細胞不均一性に関連することが知られている転写因子23。注目すべきは、蛍光検出はSRS検出と直交するため、epr-SRSは共焦点蛍光および2光子蛍光と完全に互換性があることです。概念実証として、単一の膵島での7色SRS蛍光タンデムイメージングは、良好なコントラストと正しいパターンで容易に達成されました(図4)。転写因子Pdx1などの低発現標的は、十分なコントラストで画像化された。
また、PFA固定マウス小脳組織における8色のSRS蛍光タンデムイメージングも実証しました(図5)。確立されたバイオマーカーを介して、小脳顆粒ニューロン(NeuN)、プルキンエニューロン(カルビンジン)、アストロサイト(GFAP)、希突起膠細胞(MBP)、およびGABA作動性ニューロン(GABAB2 受容体)などの異なる細胞型を同定することができる。

図1:高多重化タンパク質イメージングのためのEpr-SRS顕微鏡法。 (A)自発ラマン、非共鳴SRS、および電子前共鳴SRS(epr-SRS)のエネルギー図。発色団の振動転移速度は、epr-SRSにおいて最大10,13倍に増強される。(B)α-チューブリンのエピトープベースの免疫イメージングは、ATTO740によって染色されたCOS-7細胞において、epr-SRSによって高い振動コントラストを有することが実証された。epr-SRS信号は、ポンプレーザー波長がわずか2nm(右)だけオフ共振すると完全に消失します。スケールバー、20μm. (C) 補足資料に記載されているNHSエステル結合MARSプローブのEpr-SRSスペクトル。 この図の拡大版を表示するには、ここをクリックしてください。

図2:SRS顕微鏡セットアップの設計。(A)SRSセットアップの概略図。EOM = 電気光学変調器、M = ミラー、L = レンズ、DBS = ダイクロイックビームスプリッタ、DM = ダイクロイックミラー、OB = 対物レンズ、CO = コンデンサー、F = フィルター、PD = フォトダイオード。(B)このパネルは、レーザー励起部を示す。レーザー出力からのデュアルカラービームは、最初に分離され、各ビームがコリメートおよび拡張され、その後結合されて顕微鏡本体に導かれる。(C)このパネルは、コンデンサーで送信されたコレクションを示しています。(D) このパネルにはSRS検出部が表示されます。フォトダイオードとフィルタは、2つのBNCメスコネクタを備えたシールドボックスに取り付けられています。低いBNCコネクタは逆バイアス電圧用で、高いBNCコネクタは50 Ωで終端されたロックインアンプへの電流信号出力用です。(E)このパネルは、シールドボックス内にSiフォトダイオードがどのように実装されているかを示しています。この図の拡大版を表示するには、ここをクリックしてください。

図3:免疫標識による異なるタンパク質マーカーのラマン色素イメージング。 (A)HeLa細胞におけるαチューブリンの免疫-eprSRSイメージング。(B)PFA固定マウス脳皮質におけるNeuNの免疫-eprSRSイメージング。(c)ヒト腎臓FFPE組織におけるビメンチンの免疫eprSRSイメージング。(D)厚さ100μmのマウス脳組織にGFAPを染色したMARS2145の体積レンダリング画像。(E)厚さ40μmのマウス脳組織に染色されたNeuNを染色したMARS2228の体積レンダリング画像。zにおけるステップサイズは1μmであった。スケールバーは、(A)で20 μm、(B-C)で50 μm、(D-E)で30 μmです。この図の拡大版を表示するには、ここをクリックしてください。

図4:凍結マウス膵島組織上のホルモンおよび転写因子の7色タンデムイメージングの代表的な結果。 Epr-SRS:インスリン(Cy5、β細胞マーカー、緑で検出)、Pdx1(MARS2228で検出、転写因子、赤)、グルカゴン(MARS2216で検出、α細胞マーカー、黄色)、PP(MARS2147で検出、PP細胞マーカー、青)。蛍光:ソマトスタチン(Alexa488、δ細胞マーカー、オレンジ色)、Nkx2.2(Cy3、転写因子、マゼンタ)、DAPI(核、濃い青)。スケール バー、20 μm。 この図の拡大版を表示するには、ここをクリックしてください。
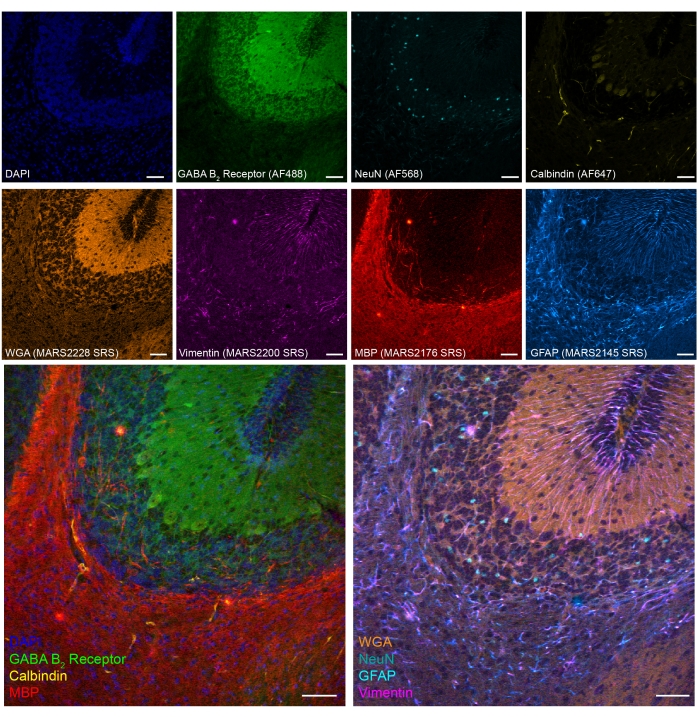
図5:PFA固定マウス脳切片上の細胞型マーカーの8色タンデムイメージングの代表的な結果。蛍光:DNA (DAPI)、GABA (γ-アミノ酪酸)B受容体2(GABA作動性ニューロン、Alexa Fluor 488)、ニューロン核(NeuN;ニューロン、Alexa Fluor 568)およびカルビンジン(プルキンエニューロン、Alexa Fluor 647);epr-SRS:小麦胚芽アグルチニン(WGA;MARS2228)、ビメンチン(MARS2200)、ミエリン塩基性タンパク質(MBP;希突起膠細胞、MARS2176)およびGFAP(アストロサイトおよび神経幹細胞、MARS2145)。スケールバー、50μm。この図の拡大版を表示するには、ここをクリックしてください。
表1:免疫eprSRSについて検証済みの抗体。 詳細については、 材料表 を参照してください。 この表をダウンロードするには、ここをクリックしてください。
補足材料:NHSエステル官能化MARSプローブを利用した8つの特性。MARS色素のλabsおよび励起係数は、容器として1cmガラスキュベットを用いたUV-Vis分光計上のDMSO溶液中で測定した。MARS色素の絶対ラマン断面は、MARS色素のepr-SRSシグナルをメタノールの標準C-Oストレッチモード(1030cm-1)と比較することによってDMSOで決定した。メタノールの標準C−Oストレッチモード(1030 cm-1)の絶対ラマン断面は、785 nmで2.1 x 10-30 cm2と報告された。0.9 x 10-30cm2の断面は、外挿によって860-nmのポンプ波長下で推定された。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここでは、新しく保存されたマウス組織、FFPEヒト組織、および凍結マウス組織を含む一般的な組織タイプに広く適用可能な免疫eprSRSプロトコルを提示する。免疫-eprSRSは、表1に列挙されているように、細胞および組織におけるエピトープのパネルについて検証されている。このワンショットプラットフォームは、サイクリック戦略がうまく機能しないアプリケーションに特に適しています。例えば、環状蛍光は、3D免疫標識の複数回のラウンドが実用的で長いため、厚い組織に対して要求されています17。また、非線形3D組織学的変化による登録誤差が生じる可能性が非常に高い11,17。Immuno-eprSRSは、このようなシナリオにおける環状蛍光の実際的な障壁を克服し、大量のタンパク質相互作用ネットワークを明らかにする機会をもたらします17。
現在の多重性は、主に二次抗体の利用可能性によって制限される。このプロトコールでは、MARSプローブを二次抗体にコンジュゲートする間接免疫標識に着目しましたが、直接免疫標識とレクチン染色が実現可能です17。ラマン色素によるより多くの一次抗体検証の後、現在開発中のラマン色素13、18、24で20チャネルが期待されている。さらに、非常に少ない豊富なターゲットのイメージングは、共焦点蛍光システムと比較して感度がわずかに損なわれるため、epr-SRSにとって困難な場合があります。この点に関して、我々は、より明るいMARS色素に比較的低豊富に豊富な標的を、蛍光チャネルに低発現の標的を割り当てることを推奨する。
プロトコルの重要な側面は、計測器とプローブのアクセシビリティです。計装面では、SRS顕微鏡は、一般に、光変調器、顕微鏡、フォトダイオード検出器、および復調のためのロックインアンプ25を備えたデュアルカラーレーザ光源から構成される。各成分は、2光子レーザー走査型蛍光顕微鏡よりもわずかに高い総コストで市販されている。SRS励起用と同様のピコ秒レーザーと蛍光用の連続波(CW)レーザーセットを用いた、完全集積型のマルチモーダルSRS/蛍光研究顕微鏡26が商品化されました。このシステムは、日常の生物学研究における多重振動イメージングに容易に適用可能である。プローブに関しては、MARSプローブはまだ商品化されておらず、いくつかの合成能力が必要です。あるいは、多くの市販の遠赤色蛍光色素(L. Wei et al. Nature 201713のExtended Data Table 1を参照)をepr-SRSに使用することができる。しかし、多重性が損なわれる可能性があります。また、MARSプローブは本質的に小さな有機分子であるため、免疫eprSRSは組織染色の点で免疫蛍光に似ています。したがって、免疫蛍光中の抗体などの検証済みのアフィニティー試薬のアーカイブは、免疫eprSRSアプリケーションに容易に移すことができます。
開示事項
著者らは開示するものは何もありません。
謝辞
マウスの膵臓組織を提供してくれたルース・A・シンガーとリチャード・K・P・ベニンガーに感謝します。W.M.は、NIH R01(GM128214)、R01(GM132860)、R01(EB029523)、および米軍(W911NF-19-1-0214)からのサポートを認めています。
資料
| Name | Company | Catalog Number | Comments |
| 16% Paraformaldehyde, EM Grade | Electron Microscopy Sciences | 15710 | |
| α-tubulin | Abcam | ab18251 | Primary antibodies |
| α-tubulin | BioLegend | 625902 | Primary antibodies |
| β-III-tubulin | BioLegend | 657402 | Primary antibodies |
| β-III-tubulin | Abcam | ab41489 | Primary antibodies |
| β-tubulin | Abcam | ab131205 | Primary antibodies |
| Agarose, low gellling temperature | Sigma Aldrich | A9414 | For brain embedding |
| Anti-a-tubulin antibody produced in rabbit (α-tubulin) | Abcam | ab52866 | Primary antibodies |
| Anti-Calbindin antibody produced in mouse (Calbindin) | Abcam | ab82812 | Primary antibodies |
| Anti-GABA B receptor R2 antibody produced in guinea pig (GABA B receptor R2) | Millipore Sigma | AB2255 | Primary antibodies |
| Anti-GFAP antibody produced in goat (GFAP) | Thermo Scientific | PA5-18598 | Primary antibodies |
| Anti-Glucagon antibody produced in mouse (Glucagon) | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| Anti-insulin antibody produced in guinea pig (insulin) | DAKO | IR00261-2 | Primary antibodies |
| Anti-MBP antibody produced in rat (MBP) | Abcam | ab7349 | Primary antibodies |
| Anti-NeuN antibody produced in rabbit (NeuN) | Thermo Scientific | PA5-78639 | Primary antibodies |
| Anti-Pancreatic polypeptide (PP) antibody produced in goat- Pancreatic polypeptide (PP) | Sigma Aldrich | SAB2500747 | Primary antibodies |
| Anti-Pdx1 antibody produced in rabbit (Pdx1) | Milipore | 06-1379 | Primary antibodies |
| Anti-Somatostatin antibody produced in rat (Somatostatin) | Abcam | ab30788 | Primary antibodies |
| Anti-Vimentin antibody produced in chicken (Vimentin) | Abcam | ab24525 | Primary antibodies |
| Band-pass filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| BNC cable | Thorlabs | 2249-C | Coaxial Cable, BNC Male / Male |
| Broadband dielectric mirror | Thorlabs | BB1-E03 | 750 - 1100 nm |
| C57BL/6J mice | Jackson Laboratory | 000664 | |
| Centrifuge | |||
| Condenser | Olympus | oil immersion, 1.4 N.A. | |
| Cytokeratin 18 | Abcam | ab7797 | Primary antibodies |
| Cytokeratin 18 | Abcam | ab24561 | Primary antibodies |
| DC power supply | TopWard | 6302D | Bias voltage is 64 V |
| Dichroic mount | Thorlabs | KM100CL | Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Left Handed |
| Donkey anti-Chicken IgY (H+L) | Jackson ImmunoResearch | 703-005-155 | Secondary antibodies for MARS conjugation |
| Donkey anti-Goat IgG (H+L) | Jackson ImmunoResearch | 705-005-147 | Secondary antibodies for MARS conjugation |
| Donkey anti-Guinea Pig IgG (H+L) | Jackson ImmunoResearch | 706-005-148 | Secondary antibodies for MARS conjugation |
| Donkey anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-005-151 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-005-152 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rat IgG (H+L) | Jackson ImmunoResearch | 712-005-153 | Secondary antibodies for MARS conjugation |
| Donkey anti-Sheep IgG (H+L) | Jackson ImmunoResearch | 713-005-147 | Secondary antibodies for MARS conjugation |
| DPBS | Fisher Scientific | 14-190-250 | |
| EpCAM | Abcam | ab71916 | Primary antibodies |
| Ethanol | Sigma Aldrich | 443611 | |
| Fast-speed look-in amplifier | Zurich Instruments | HF2LI | DC - 50 MHz |
| FFPE Kidney Sample | USBiomax | HuFPT072 | |
| Fibrillarin | Abcam | ab5821 | Primary antibodies |
| Giantin | Abcam | ab24586 | Primary antibodies |
| Glucagon | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| H2B | Abcam | ab1790 | Primary antibodies |
| HeLa | ATCC | ATCC CCL-2 | |
| High O.D. bandpass filter | Chroma Technology | ET890/220m | Filter the Stokes beam and transmit the pump beam |
| Hydrophobic pen | Fisher Scientific | NC1384846 | |
| Insulin | ThermoFisher | 701265 | Primary antibodies |
| Integrated SRS laser system | Applied Physics & Electronics, Inc. | picoEMERALD | picoEMERALD provides an output pulse train at 1,064 nm with 6-ps pulse width and 80-MHz repetition rate, which serves as the Stokes beam. The frequency doubled beam at 532 nm is used to synchronously seed a picosecond optical parametric oscillator (OPO) to produce a mode-locked pulse train with five~6 ps pulse width (the idler beam of the OPO is blocked with an interferometric filter). The output wavelength of the OPO is tunable from 720–950 nm, which serves as the pump beam. The intensity of the 1,064-nm Stokes beam is modulated sinusoidally by a built-in EOM at 8 MHz with a modulation depth of more than 90%. The pump beam is spatially overlapped with the Stokes beam by using a dichroic mirror inside picoEMERALD. The temporal overlap between pump and Stokes pulse trains is achieved with a built-in delay stage and optimized by the SRS signal of pure D2O at the microscope. |
| Inverted laser-scanning microscope | Olympus | FV1200MPE | |
| Kinematic mirror mount | Thorlabs | POLARIS-K1-2AH | 2 Low-Profile Hex Adjusters |
| Lectin from Triticum vulgaris (wheat) | Sigma Aldrich | L0636-5 mg | |
| Long-pass dichroic beam splitter | Semrock | Di02-R980-25x36 | 980 nm laser BrightLine single-edge laser-flat dichroic beamsplitter |
| MAP2 | BioLegend | 801810 | Primary antibodies |
| Microscopy imaging software | Olympus | FluoView | |
| NanoQuant Plate | Tecan | For absorbance-based, small volume analyses in a plate reader. | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| NucBlue Fixed Cell ReadyProbes Reagent (DAPI) | Thermo Scientific | R37606 | |
| Nunc 4-Well Dishes | Fisher Scientific | 12-566-300 | |
| Objective lens | Olympus | XLPlan N | x25, 1.05-NA, MP, working distance = 2 mm |
| Paint brush | |||
| Periscope assembly | Thorlabs | RS99 | includes the top and bottom units, Ø1" post, and clamping fork. |
| pH meter | |||
| Plate reader | Tecan | Infinite 200 PRO | An easy-to-use multimode plate reader. Absorbance measurement capabilities over a spectral range of 230–1000 nm. |
| ProLong Gold antifade reagent | Thermo Scientific | P36930 | |
| PSD95 | Invitrogen | 51-6900 | Primary antibodies |
| Sephadex G-25 Medium | GE Life Sciences | 17-0033-01 | gel filtration resin for desalting and buffer exchange |
| Shielded box with BNC connectors | Pomona Electronics | 2902 | Aluminum Box With Cover, BNC Female/Female |
| Si photodiode | Thorlabs | FDS1010 | 350–1100 nm, 10 mm x 10 mm Active Area |
| Synapsin 2 | ThermoFisher | OSS00073G | Primary antibodies |
| Tissue Path Superfrost Plus Gold Slides | Fisher Scientific | 22-035813 | Adhesive slide to attract and chemically bond fresh or formalin-fixed tissue sections firmly to the slide surface (tiisue bindling glass slides) |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Vibratome | Leica | VT1000 | |
| Vimentin | Abcam | ab8069 | Primary antibodies |
| Xylenes | Sigma Aldrich | 214736 |
参考文献
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. Journal for Immunotherapy of Cancer. 8 (1), 000155 (2020).
- Lewis, S. M., et al. Spatial omics and multiplexed imaging to explore cancer biology. Nature Methods. 18 (9), 997-1012 (2021).
- Bodenmiller, B. Multiplexed epitope-based tissue imaging for discovery and healthcare applications. Cell Systems. 2 (4), 225-238 (2016).
- Hickey, J. W., et al. Spatial mapping of protein composition and tissue organization: a primer for multiplexed antibody-based imaging. Nature Methods. , (2021).
- Lin, J. -. R., et al. Highly multiplexed immunofluorescence imaging of human tissues and tumors using t-CyCIF and conventional optical microscopes. eLife. 7, 31657 (2018).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Giesen, C., et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry. Nature Methods. 11 (4), 417-422 (2014).
- Keren, L., et al. MIBI-TOF: A multiplexed imaging platform relates cellular phenotypes and tissue structure. Science Advances. 5 (10), 5851 (2019).
- Gerdes, M. J., et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11982 (2013).
- Angelo, M., et al. Multiplexed ion beam imaging of human breast tumors. Nature Medicine. 20 (4), 436-442 (2014).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455 (2020).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544, 465 (2017).
- Wei, L., Min, W. Electronic preresonance stimulated Raman scattering microscopy. The Journal of Physical Chemistry Letters. 9 (15), 4294-4301 (2018).
- Shi, L., et al. Electronic resonant stimulated Raman scattering micro-spectroscopy. The Journal of Physical Chemistry B. 122 (39), 9218-9224 (2018).
- Fujioka, H., et al. Multicolor activatable Raman probes for simultaneous detection of plural enzyme activities. Journal of the American Chemical Society. 142 (49), 20701-20707 (2020).
- Shi, L., et al. Highly-multiplexed volumetric mapping with Raman dye imaging and tissue clearing. Nature Biotechnology. , (2021).
- Miao, Y., Qian, N., Shi, L., Hu, F., Min, W. 9-Cyanopyronin probe palette for super-multiplexed vibrational imaging. Nature Communications. 12 (1), 4518 (2021).
- Miao, Y., Shi, L., Hu, F., Min, W. Probe design for super-multiplexed vibrational imaging. Physical Biology. 16 (4), 041003 (2019).
- Qian, N., Min, W. Super-multiplexed vibrational probes: Being colorful makes a difference. Current Opinion in Chemical Biology. 67, 102115 (2022).
- Klimas, A., et al. Nanoscale imaging of biomolecules using molecule anchorable gel-enabled nanoscale in-situ fluorescence microscopy. Nature Portfolio. , (2021).
- Shi, L., et al. Super-resolution vibrational imaging using expansion stimulated Raman scattering microscopy. bioRxiv. , (2021).
- Benninger, R. K. P., Hodson, D. J. New understanding of β-cell heterogeneity and in situ islet function. Diabetes. 67 (4), 537 (2018).
- Hu, F., et al. Supermultiplexed optical imaging and barcoding with engineered polyynes. Nature Methods. 15 (3), 194-200 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- . Coherent Raman Scattering Microscope Available from: https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-cars/ (2022)
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved