Method Article
라만 염료를 이용한 고도의 다중화 조직 이미징
요약
무지개 유사 라만 염료의 전자 사전 공명 자극 라만 산란 (epr-SRS) 이미징은 고도로 다중화 된 에피토프 기반 단백질 이미징을위한 새로운 플랫폼입니다. 여기에서는 항체 준비, 조직 샘플 염색, SRS 현미경 어셈블리 및 epr-SRS 조직 이미징을 포함한 실용적인 가이드를 제시합니다.
초록
조직에서 특정 바이오마커의 광대 한 범위를 시각화하는 것은 복잡한 생물학적 시스템의 복잡한 조직을 탐구하는 데 중요한 역할을합니다. 따라서 고도로 다중화된 이미징 기술이 점점 더 높이 평가되고 있습니다. 여기에서, 우리는 무지개와 같은 라만 염료의 전자 사전 공명 자극 라만 산란 (epr-SRS) 이미징을 통해 표준 면역 형광에 필적하는 감도를 가진 특정 단백질의 고도로 다중화 된 진동 이미징의 새로운 플랫폼을 설명합니다. 이 방법은 종래의 면역형광에서 분광적으로 분해가능한 채널의 한계를 우회하고, 아세포 분해능을 갖는 조직에서 다중 마커를 심문하기 위한 원샷 광학 접근법을 제공한다. 일반적으로 파라포름알데히드-고정 조직, 동결 조직, 및 포르말린-고정 파라핀 포매(FFPE) 인간 조직을 포함하는 표준 조직 제제와 양립가능하다. 우리는이 플랫폼이 생물학적 표본의 단백질 상호 작용, 특히 두꺼운 손상되지 않은 조직에 대한보다 포괄적 인 그림을 제공 할 것으로 기대합니다. 이 프로토콜은 항체 준비에서 조직 샘플 염색, SRS 현미경 어셈블리, epr-SRS 조직 이미징에 이르는 워크플로우를 제공합니다.
서문
복잡한 조직 시스템은 공간적 위치와 상호 작용 네트워크가 기능 및 기능 장애 1,2와 깊이 얽혀있는 별개의 세포 하위 집단으로 구성됩니다. 조직 구조를 밝히고 복잡성을 조사하기 위해서는 단일 세포 분해능에서 단백질의 공간적 위치에 대한 지식이 필수적입니다. 따라서 고도로 다중화 된 단백질 이미징 기술은 점점 더 높이 평가되어 조직 생물학 3,4,5을 연구하기위한 초석이 될 수 있습니다. 현재의 일반적인 다중화 단백질 이미징 방법은 크게 두 가지 범주로 분류할 수 있다. 하나는 여러 차례의 조직 염색 및 이미징에 의존하는 직렬 면역 형광 이미징이고, 다른 하나는 중금속 태깅 항체 6,7,8,9,10,11,12와 결합 된 질량 세포 측정법을 이미징하는 것입니다.
여기서, 다중화된 항체 기반 단백질 이미징을 위한 대안적인 전략이 도입된다. 광범위한 여기 및 방출 스펙트럼 (절반 최대 (FWHM) ~ 500cm-1에서 전체 너비)으로 인해 4-5 채널을 동시에 시각화 할 수있는 널리 퍼진 형광 이미징 양식과 달리 라만 현미경은 훨씬 좁은 스펙트럼 선폭 (FWHM ~ 10cm-1)을 나타내므로 확장 가능한 다중성을 제공합니다. 최근에, 좁은 스펙트럼을 이용함으로써, 전자 사전 공명 자극 라만 산란 (epr-SRS) 현미경이라는 라만 현미경의 새로운 계획이 개발되어 다중화 이미징(13)에 대한 강력한 전략을 제공한다. epr-SRS는 라만 염료의 전자 결합 진동 모드를 조사함으로써 라만 단면에서 10,13배의 과감한 향상 효과를 달성하고 기존 라만 현미경의 감도 병목 현상을 극복합니다(그림 1A)13,14,15. 그 결과, epr-SRS의 검출 한계는 sub-μM로 밀려났으며, 이는 세포 내부의 특정 단백질 및 소기관과 같은 흥미로운 분자 마커의 라만 검출을 가능하게 한다(13,16). 특히, 라만 염료-접합된 항체를 이용하여, 세포 및 조직에서 특정 단백질의 epr-SRS 이미징 (면역-eprSRS로 불림)은 표준 면역형광에 대한 필적할만한 민감성으로 입증되었다 (도 1B)13,17. 펌프 파장을 2nm만 튜닝하면 epr-SRS 신호가 완전히 꺼지며(그림 1B), 높은 진동 대비를 보여줍니다.
프로브 측에서는 항체 접합을 위해 맨해튼 라만 산란 (MARS) 염료라고 불리는 무지개와 같은 라만 프로브 세트가 개발되었습니다13,18,19,20. 이 독특한 라만 팔레트는 π 공액 삼중 결합(보충 재료)을 담은 새로운 염료로 구성되며, 각각은 생체 직교 라만 스펙트럼 범위에서 단일의 좁은 epr-SRS 피크를 표시합니다(그림 1C). 코어 발색단의 구조를 변형시키고 삼중 결합(Supplementary Material)의 두 원자를 동위원소적으로 편집함으로써, 분광적으로 분리된 라만 프로브가 개발되었다. 확장 가능한 다중성을 활용하여 MARS 염료 팔레트와 결합된 epr-SRS 현미경은 세포 및 조직에서 원샷 멀티플렉스 단백질 이미징을 위한 광학 전략을 제공합니다.
Immuno-eprSRS는 독특한 강점을 가진 현재의 멀티플렉스 단백질 이미징 방법에 대한 대안적인 전략을 제공합니다. 순환 염색, 이미징 및 신호 제거를 통한 형광 접근법과 비교할 때, 이 Raman 기반 플랫폼은 단일 라운드 염색 및 이미징을 보장합니다. 따라서 순환 절차의 실질적인 복잡성을 피하고 프로토콜을 크게 단순화하여 다중화 된 단백질 이미징의 새로운 영역을 열어줍니다. 예를 들어, 라만-염료-맞춤형 조직 제거 프로토콜을 이용하여, 면역-eprSRS는 두꺼운 온전한 조직(17)에서 고도로 다중화된 단백질 매핑을 위해 세 차원으로 확장되었다. 10개 이상의 단백질 표적이 밀리미터 두께의 마우스 뇌 조직(17)을 따라 시각화되었다. 보다 최근에, 면역-eprSRS를 최적화된 생체분자-보유 확장 현미경(ExM) 프로토콜(21)과 결합시켜, 다중 표적의 원샷 나노스케일 이미징도 입증되었다(22). 이미징 질량 분광법4,9와 비교할 때, epr-SRS는 비파괴적이며 본질적으로 광학 단면화 능력을 가지고 있습니다. 또한, epr-SRS는 조직 스캔에서 더 시간 효율적입니다. 전형적으로, 0.5 μm의 픽셀 크기를 갖는0.25 mm2의 조직 영역은 단일 epr-SRS 채널에 대해 이미지화하는 데 단지 몇 분이 걸린다. 예를 들어, 도 4에서 4개의 SRS 채널과 4개의 형광 채널의 총 이미징 시간은 약 10분이다.
프로토콜
이 프로토콜은 컬럼비아 대학의 기관 동물 관리 및 사용위원회에서 승인 한 동물 실험 프로토콜 (AC-AABD1552)에 따라 수행되었습니다.
1. 라만-염료-컨쥬게이션된 항체의 제조
- 콘쥬게이션 버퍼를 PBS 완충액 중의 ∼0.1 MNaHCO3 로 제조하고, pH = 8.3, 4°C에서 보관한다.
- 무수 DMSO 중에서 3 mM로서 N-하이드록시숙신이미디(NHS) 에스테르 기능화 MARS 프로브(보충 물질) 용액을 제조하였다. MARS 프로브의 합성은 선행 보고13,17,18을 참조할 수 있다.
참고: 저장 목적을 위해, 염료 NHS 에스테르 용액은 빛으로부터 보호되어야 하고 -20°C에서 유지되어야 한다. - 항체 고체를 콘쥬게이션 완충액에 2mg/mL의 농도로 용해시킨다. 다른 완충액에 용해된 항체의 경우, 원심 필터로 1-2 mg/mL의 농도로 콘쥬게이션 버퍼로 교환하십시오.
참고: 고도로 교차-흡착된 이차 항체는 종간 반응성을 최소화하기 위해 멀티플렉스 염색에 바람직하다. 사용된 이차 항체는 표 1 및 표 물질에 열거되어 있다. - 콘쥬게이션 반응을 수행한다.
- 이차 항체의 경우, 15배 몰 과량의 염료 용액을 유리 바이알에 넣고 교반하면서 천천히 첨가한다. 예를 들어, 0.5 mL 2 mg/mL 항체 용액에 35 μL 3 mM 염료 용액을 첨가한다.
- 반응 혼합물을 1 h 동안 교반하면서 실온 (RT)에서 인큐베이션한다. 빛으로부터 반응을 보호하십시오.
- 정화.
- 겔 여과 수지의 슬러리(표 물질)를 PBS 완충액으로 제조하고, 다음 단계 1.5.2-1.5.4를 수행한다.
- 겔 여과 수지 분말 10 mL를 PBS 버퍼 40 mL에 넣고 50-mL 튜브 내부에 넣는다.
- 용액을 1 시간 동안 90 °C 수조에 보관하십시오.
- 상청액을 데칸트하고 PBS를 40 mL에 다시 첨가한다. 슬러리를 4°C에서 보관한다.
- 크기 배제 컬럼 (직경 1-cm, 중력 흐름 컬럼)을 슬러리 용액으로 10-15 cm의 높이로 포장하십시오.
- 컬럼을 헹구고 PBS 완충액∼10 mL로 세척하여 수지를 추가로 포장한다.
- 콘쥬게이션 반응 혼합물(∼0.5 mL)을 컬럼에 피펫팅한다. 모든 반응 혼합물이 로딩될 때 즉시 PBS 완충액 1 mL를 용출 완충액으로서 첨가한다. 용출 완충액(PBS)을 컬럼에 지속적으로 재충전한다.
- 콘쥬게이트 용액의 용출액을 수집하여 컬럼 상의 색상을 보고(MARS 염료는 연한 녹색에서 청색을 띠고 있음) 280 nm에서 흡광도를 측정한다(A280).
- 수집 된 용액을 원심 필터로 1-2 mg / mL로 농축하십시오.
- 나노플레이트 리더를 이용하여 접합체 용액의 농도 및 평균 표지 정도(DOL, 염료-단백질 비)를 자외선 가시광선(UV-Vis) 스펙트럼으로 측정하여 확인하였다.
참고 : 보충 자료 는 계산을 위해 MARS 염료 NHS 에스테르의 특성을 제공합니다. 이차 항체에 대한 정상 DOL은 약 3이다.
2. 조직 샘플 준비
- 파라포름알데히드는 마우스 뇌 조직을 고정시켰다.
- 마우스 (C57BL / 6J, 암컷, 출생 후 25 d)를 이소플루란으로 마취하십시오. 발가락 꼬집음 검사로 적절한 마취를 평가하십시오.
- 자궁 경부 변위로 생쥐를 죽여라. 마우스를 PBS 중의 4% 파라포름알데히드 (PFA)로 즉시 경심으로 관류시킨다.
- 2.1.4-2.1.5 단계에 따라 마우스 뇌를 수집합니다.
- 시상 봉합사를 따라 뇌 줄기에서 위쪽으로 자릅니다. 두개골의 두 반쪽을 옆으로 떼어 내고 트위저로 뇌를 훑어 내십시오.
- 수집된 뇌를 PBS 중의 4% PFA에 4°C에서 24시간 동안 고정시켰다. 이어서, 뇌를 PBS 완충액에서 4°C에서 24시간 동안 세척하여 과량의 PFA를 제거하였다.
- 단단한 아가로스를 비이커에 최종 농도 7 % (w / v)로 물에 넣고 뚜껑을 느슨하게하십시오. 유리 교반 막대로 용액을 저어줍니다. 용액이 맑아질 때까지 슬러리를 전자 레인지로 가열하십시오.
- 아가로스를 45-55°C로 냉각시킨다.
- 액체 아가로스를 작은 챔버에 붓고 PBS에서 액체 아가로오스로 뇌를 옮기고 주걱으로 방향을 잡아 뇌를 내장시킵니다. 조직 - 아가로스 블록이 경화 될 때까지 기다리십시오.
- 절편된 조직-비브라톰을 사용하여 40-μm 두께의 코로나 슬라이스로 생겨났다.
- 다음 염색을 위해 조직을 4-웰 플레이트로 옮긴다. 트위저로 아가로스를 제거하십시오. 조직을 PBS 1 mL로 세 번 세척한다.
- 고정 동결 마우스 췌장 조직.
- 마우스 췌장을 PBS 중의 4% PFA에 고정시키고 4°C에서 16-20시간 동안 흔들었다.
- 시료를 PBS 1 mL(4°C)로 세 번 세척하여 PFA를 제거하였다.
- 시료 (~ 0.3-0.5 cm 크기)를 최적 절삭 온도 (OCT) 복합 블록에 내장하십시오. OCT 2 방울을 플라스틱 냉동 금형에 넣으십시오. 조직을 올바른 방향으로 놓고 조직이 노출되지 않을 때까지 조직 위에 OCT를 붓습니다.
- 췌장을 8-μm 두께의 슬라이스로 절편하고, 이를 조직 결합 유리 슬라이드 상에 고정화시키고, 이를 -80°C에 보관한다.
- 염색하기 전에, 시편을 RT로 평형화시킨다. 조직을 PBS로 세척하여 OCT 블록을 제거한다.
- FFPE 샘플.
- FFPE 조직 슬라이드를 60°C에서 10분 동안 구우십시오.
- 탈파라핀화 및 재수화: 샘플을 RT의 50mL 튜브에 있는 다음 용액에 순차적으로 넣고 가볍게 흔들면서 매번 3분 동안 복용합니다.
자일렌 두 번,
에탄올을 두 번,
탈이온수에 95% (vol/vol) 에탄올을 두 번,
탈이온수에 70% (vol/vol) 에탄올을 두 번 넣고,
탈이온수에 50% (vol/vol) 에탄올을 한 번,
한 번 탈 이온수. - 샘플을 유리 병에서 100°C에서 20 mM 시트르산 나트륨 (pH 8.0) 내로 옮긴다. 조직이 용액에 잠겨 있는지 확인하십시오.
- 항아리를 60°C 수조에 넣고 45분 동안 수조에 넣는다.
- 샘플을 RT에서 탈이온수로 5분 동안 세척한다.
3. 조직 면역-eprSRS 염색
- 소수성 펜을 사용하여 슬라이드의 조직 섹션 주위에 경계를 그립니다.
참고: 슬라이드 염색 항아리는 슬라이드 조직의 배양 단계를 따르는 데 사용됩니다. 부유 조직 (40-μm 두께의 마우스 뇌 절편)은 웰 플레이트에서 염색됩니다. - 조직을 10분 동안 0.3-0.5% PBST (PBS 중의 트리톤 X-100)로 인큐베이션한다.
- 조직을 블로킹 완충액 (PBS 중 5% 당나귀 혈청, 0.5% 트리톤 X-100)으로 30분 동안 인큐베이션한다.
- 일차 염색 용액을 준비한다: 모든 일차 항체를 200-500 μL의 염색 완충액 (PBS 중 2% 당나귀 혈청, 0.5% 트리톤 X-100)에 원하는 농도로 첨가한다. 일차 염색 용액을 13,000 x g 에서 5분 동안 원심분리한다. 침전물이 형성되는 경우에만 상층액을 사용하십시오.
- 조직을 1-2일 동안 4°C에서 1-2일 동안 일차 항체 용액에서 인큐베이션한다.
참고: 슬라이드에서 조직 절편을 염색하려면 젖은 닦아내기로 염색 상자에 샘플을 넣어 습도를 유지하십시오. - 슬라이드를 RT에서 0.3-0.5% PBST로 각각 5분 동안 세 번 세척한다. 부유 조직에 1 mL PBST를 사용하십시오. 슬라이드의 조직의 경우 슬라이드 염색 항아리에서 슬라이드를 세척하고 조직이 모두 용액에 잠겨 있는지 확인하십시오.
- 조직을 200-500 μL의 블로킹 완충액에서 30분 동안 인큐베이션한다.
- 보조 염색 용액을 준비하십시오 : 모든 이차 항체 (및 필요한 경우 렉틴)를 원하는 농도 (일반적으로 10 μg / mL)의 염색 완충액 200-500 μL에 첨가하십시오. 보조 염색 용액을 13,000 x g 에서 5분 동안 원심분리한다. 침전물이 형성되는 경우에만 상층액을 사용하십시오.
- 조직을 200-500 μL의 이차 항체 용액으로 4°C에서 1-2일 동안 인큐베이션한다.
- 슬라이드를 RT에서 0.3-0.5% PBST로 각각 5분 동안 두 번 세척합니다.
- 200-500 μL의 DAPI 용액과 함께 30분 동안 인큐베이션한다.
- 슬라이드를 각각 5분 동안 RT에서 PBS로 세 번 세척한다.
- 떠 다니는 조직 절편의 경우 유리 떨어 뜨리는 피펫으로 유리 슬라이드로 옮깁니다. 티슈 브러시로 티슈를 펼치고 필요한 경우 물티슈로 주변을 닦으십시오.
- 유리 커버 슬립으로 퇴색 방지 시약 한 방울에 조직을 장착하고 매니큐어로 고정하십시오.
4. SRS 현미경 집합
참고: 상용 공초점 형광 시스템은 SRS-형광 이미징과 함께 사용됩니다. 더 많은 설명은 이전 보고서(17)에서 찾을 수 있다. 이 프로토콜은 협대역 여기를 사용하는 SRS 이미징 측면에 초점을 맞출 것이다.
- 온도 조절 장치가 있는 방에서 진동 분리형 광학 테이블을 준비합니다.
- 냉각기가 연결된 광학 테이블(그림 2A)에 동기화된 이중 레이저 시스템(펌프 및 스토크스)을 놓습니다.
참고: 듀얼 레이저 시스템의 기본 레이저는 1064nm에서 6ps 펄스 폭 및 80MHz 반복률로 출력 펄스 트레인을 제공합니다. 스토크스 빔은 기본 레이저에서 나온 것입니다. Stokes 빔의 강도는 90% 이상의 변조 깊이를 갖는 8MHz에서 내장된 EOM(electro-optic amplitude modulator)에 의해 정현파적으로 변조되었다. 기본 레이저의 다른 부분은 주파수가 532nm로 두 배로 증가하며, 이는 5-6ps 펄스 폭을 갖는 모드 잠금 펄스 트레인을 생성하기 위해 피코초 광학 파라메트릭 발진기(OPO)를 동기적으로 시드하는 데 더 사용됩니다(OPO의 아이들러 빔은 간섭 필터로 차단됨). OPO의 출력 파장은 펌프 빔 역할을하는 720-950nm에서 조정할 수 있습니다. - 거울 (파장 범위 : 750-1100nm), 이색성 빔 스플리터 (DBS, 980nm 장역 필터, 직사각형) 및 렌즈 (무채색, 650-1050nm의 AR 코팅)를 각각의 마운트에 장착하십시오. 거울 및 이색성 빔 스플리터에 매우 안정적인 운동학 거울 마운트를 사용하십시오.
- 레이저 출력의 높이와 펌프와 스토크스 빔의 빔 크기를 측정합니다. 거울과 렌즈의 높이를 조정하여 빛이 모든 광학 요소의 중심에 닿을 수 있도록하십시오.
- 미러 M1을 광학 테이블 위에 놓고 레이저 출력에 ~45°로 만듭니다(그림 2B). 운동학 마운트의 손잡이를 사용하여 팁과 기울기를 조정하십시오. 빛이 테이블 길이를 따라 동일한 높이로 이동하고 테이블에 대해 직선으로 이동하는지 확인하십시오.
- 이색성 빔 스플리터(980nm 장역 필터)와 거울을 배치하고 정렬하여 펌프와 스토크스 빔을 분할합니다(그림 2A-B).
- 렌즈 쌍(L1, L2 및 L3, L4)을 각 빔 경로에 배치하고 정렬하여 빔을 시준하고 빔 직경을 확장하여 목표물의 후방 동공과 일치시킵니다(그림 2A-B).
- M7 및 M8 미러를 사용하여 결합된 레이저 빔을 현미경에 정렬합니다(그림 2C). 먼저 한 빔을 현미경에 맞추고 다른 빔의 미러 쌍을 사용하여 두 빔의 공간적 겹침을 보장하십시오.
- 감지 부품을 설정합니다.
- 적외선 코팅 오일 콘덴서(1.4-NA)를 착용하여 시편을 통과한 후 전진 펌프와 스토크스 빔을 수집합니다(그림 2C).
- 대면적 Si 광 다이오드를 BNC 커넥터가 있는 차폐 박스에 장착합니다(그림 2E). 실장형 광 다이오드에 64V DC 전원 공급 장치를 추가하여 포화 임계값 및 응답 대역폭을 늘립니다.
- 2인치 거울로 앞으로 나아가는 빛을 반사합니다. 광 필터 후 광 다이오드에 조명의 초점을 다시 맞추어 변조 스톡스 빔을 차단합니다(그림 2D).
- 광 다이오드의 출력 전류를 신호 복조를 위해 50으로 종단된 고속 록인 앰프로 보냅니다. 8MHz 트리거를 잠금 증폭기에 기준 신호로 보냅니다.
- 잠금 증폭기의 동위상 X 구성 요소를 현미경의 아날로그 인터페이스 상자로 보냅니다.
- 현미경에서 순수한D2O액체의 SRS 신호를 측정하여 내장 된 전동 지연 단계와의 시간적 중첩을 최적화하십시오.
5. 이미지 수집 및 분석
- 순차적 펌프 파장 튜닝으로 다중 채널 epr-SRS 이미징을 수행합니다.
- 레이저 제어 패널에서 레이저 파워를 P 펌프 = 10-40 mW 및 P 스토크스 = 40-80 mW로 설정하십시오.
- 픽셀 유지 시간을 2-4μs로 설정하고 현미경 소프트웨어에서 일반적으로 평균 10-20프레임의 여러 프레임을 사용합니다.
참고: 다중 광자 여기로 인해 라만 염료의 '표백 효과'를 일으킬 가능성이 높은 레이저 전력 (P펌프> 40mW> P스톡스< 80m) 및 작은 픽셀 크기 (0.2 μm)의 조합 사용을 피하십시오. - 잠금 증폭기의 시간 상수를 픽셀 유지 시간의 절반으로 설정합니다.
- 선형 스펙트럼 혼합 해제.
참고: epr-SRS는 전체 농도 범위에 걸쳐 엄격한 선형 신호 대 농도 의존성을 따릅니다. 따라서, 선형 스펙트럼 언믹싱은 채널 사이의 잠재적인 교차 회담을 제거하는 데 효과적이다. N MARS 프로브를 사용한 N 채널 epr-SRS 측정의 경우, 측정된 신호(S)는 S = MC로 표현될 수 있으며, 여기서 C는 MARS 프로브 농도이고, M은 MARS 프로브의 라만 단면에 의해 결정된 NxN 매트릭스이다.- 상이한 MARS 프로브로 표지된 단색 면역-eprSRS 샘플에서 매트릭스 M 을 측정한다.
- 사용 방정식 C = M−1· S는 멀티플렉스 샘플 신호 측정 S를 갖는 MARS 프로브의 농도 매트릭스를 결정 한다.
결과
도 3은 고정된 세포(도 3A), 파라포름알데히드(PFA)-고정된 마우스 조직(도 3B), 및 포르말린-고정 파라핀 포매(FFPE) 인간 표본(도 3C)을 포함하는 상이한 샘플에서의 epr-SRS의 예시적인 이미지를 도시한다. SRS 현미경의 공간 분해능은 회절 제한이며, 일반적인 측방향 분해능은 ~ 300nm이며, 축 분해능은 여기를 위해 근적외선을 사용하는 1-2 μm입니다. 그 결과, HeLa 세포에서 미세소관과 같은 미세한 세포내 구조는 α-튜불린의 면역-eprSRS 영상화로 충실하게 밝혀졌다(도 3A). 더욱이, epr-SRS는 일반적으로 FFPE 조직과 양립할 수 있으며(도 3C), 이는 임상 진단 및 병리학 연구를 위한 생검 표본의 일반적인 형태이다. 이광자 형광 현미경과 유사하게, 비선형 공정으로서 epr-SRS는 세포 내 분해능으로 3차원 패턴을 시각화하기 위한 광학 단면화 기능을 가지고 있습니다(그림 3D-E).
우리는 먼저 췌장에서 랑게르한스의 마우스 섬의 고정 동결 조직 샘플에 epr-SRS의 멀티플렉스 단백질 이미징 유틸리티를 선보였습니다. 몇몇 관심있는 표적이 선택되며, 세포형 분류를 위한 호르몬 발현 (예를 들어, 인슐린, 글루코스 작용제 (glucagon), 췌장 폴리펩티드 (PP), 및 소마토스타틴) (β-세포 및 비-세포(β-, α-cells)) 및 δ-세포 이질성과 관련되는 것으로 공지되어 있는 전사 인자23을 포함β다. 참고로, 형광 검출은 SRS 검출에 직교하기 때문에, epr-SRS는 공초점 형광 및 이광자 형광과 완전히 양립가능하다. 개념 증명으로서, 단일 섬에서 7색 SRS-형광 탠덤 이미징은 양호한 콘트라스트와 정확한 패턴으로 쉽게 달성되었습니다(그림 4). 전사 인자 Pdx1과 같은 저발현 표적은 충분한 대조를 가지고 영상화되었다.
우리는 또한 PFA 고정 마우스 소뇌 조직에서 여덟 가지 컬러 SRS-형광 탠덤 이미징을 시연했습니다 (그림 5). 확립된 바이오마커를 통해, 상이한 세포 유형, 예컨대 소뇌 과립 뉴런 (NeuN), 퍼킨제 뉴런 (칼빈딘), 성상세포 (GFAP), 희소돌기아교세포 (MBP), 및 GABAergic 뉴런 (GABAB2 수용체)이 확인될 수 있다.

그림 1: 고도로 다중화된 단백질 이미징을 위한 Epr-SRS 현미경 . (A) 자발적 라만, 비공진 SRS 및 전자 사전 공진 SRS(epr-SRS)에 대한 에너지 다이어그램. 발색단의 진동 전이 속도는 epr-SRS에서 최대 1013 배까지 향상됩니다. (b) 에피토프-기반 면역-α-튜불린의 영상화는 epr-SRS에 의한 높은 진동 콘트라스트와 함께 ATTO740에 의해 염색된 COS-7 세포에서 입증되었다. epr-SRS 신호는 펌프 레이저 파장이 2nm(오른쪽)에 불과하여 오프 공명일 때 완전히 사라집니다. 스케일 바, 20 μm. (C) 보충 재료에 열거된 바와 같은 NHS 에스테르-컨쥬게이션된 MARS 프로브의 Epr-SRS 스펙트럼. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: SRS 현미경 셋업의 설계. (A) SRS 셋업의 개략도. EOM = 전기 광학 변조기, M = 미러, L = 렌즈, DBS = 이색성 빔 스플리터, DM = 이색성 미러, OB = 대물 렌즈, CO = 응축기, F = 필터, PD = 광 다이오드. (B) 이 패널은 레이저 여기 부분을 보여준다. 레이저 출력의 이중 컬러 빔은 먼저 각 빔이 시준되고 확장되고 나중에 결합되어 현미경 몸체로 향하게되면서 분리됩니다. (C) 이 패널은 콘덴서와 함께 전송 된 컬렉션을 보여줍니다. (d) 이 패널은 SRS 검출 부분을 나타낸다. 광 다이오드와 필터는 두 개의 BNC 암 커넥터가 있는 차폐 박스에 장착됩니다. 낮은 BNC 커넥터는 역방향 바이어스 전압용이고, 더 높은 BNC 커넥터는 50 Ω로 종단된 록인 증폭기로 전류 신호 출력을 위한 것입니다. (E) 이 패널은 Si 광 다이오드가 차폐 박스 내부에 어떻게 장착되는지 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 면역표지를 통한 뚜렷한 단백질 마커의 라만 염료 이미징. (A) HeLa 세포에서 α-튜불린의 면역-eprSRS 영상화. (b) PFA 고정 마우스 뇌 피질에서 NeuN의 면역-eprSRS 영상화. (c) 인간 신장 FFPE 조직에서 비멘틴의 면역-eprSRS 영상화. (d) 100-μm 두께의 마우스 뇌 조직에서 GFAP를 염색한 MARS2145의 부피 렌더링 이미지. z에서의 스텝 크기는 2 μm였다. (E) 40-μm 두께의 마우스 뇌 조직에서 NeuN으로 염색된 MARS2228의 부피-렌더링된 이미지. z에서의 단계 크기는 1 μm였다. 스케일 바는, 20 μm in (A), 50 μm in (B-C), 30 μm in (D-E). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: 냉동 마우스 췌도 조직에 대한 호르몬 및 전사 인자의 7-컬러 탠덤 이미징의 대표적인 결과. Epr-SRS: 인슐린 (Cy5, β세포 마커, 녹색으로 검출), Pdx1 (MARS2228에 의해 검출, 전사 인자, 적색), 글루카곤 (MARS2216에 의해 검출, α 세포 마커, 노란색), PP (MARS2147, PP 세포 마커, 파란색으로 검출됨). 형광: 소마토스타틴 (알렉사488, δ세포 마커, 오렌지), Nkx2.2 (Cy3, 전사 인자, 마젠타), DAPI (핵, 진한 파란색). 스케일 바, 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
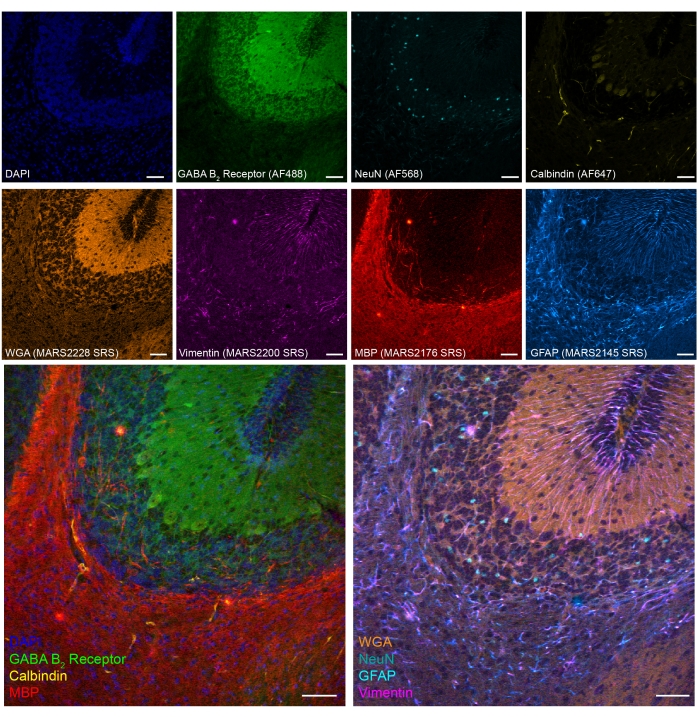
도 5: PFA 고정 마우스 뇌 절편에서 세포형 마커의 8색 탠덤 이미징의 대표적인 결과. 형광: DNA (DAPI), GABA (γ-아미노부티르산) B 수용체 2 (GABAergic 뉴런, 알렉사 플루오르 488), 뉴런 핵 (NeuN; 뉴런, 알렉사 플루오르 568) 및 칼빈딘 (퍼킨제 뉴런, 알렉사 플루오르 647); epr-SRS: 밀 배아 아글루티닌 (WGA; MARS2228), 비멘틴 (MARS2200), 미엘린 염기성 단백질 (MBP; 희소 돌기아교세포, MARS2176) 및 GFAP (성상 세포 및 신경 줄기 세포, MARS2145). 스케일 바, 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 면역-eprSRS에 대한 검증된 항체. 자세한 내용은 자료표를 참조하십시오. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
보충 자료: 8개의 특성은 NHS 에스테르 작용화 MARS 프로브를 이용했다. MARS 염료의 λabs 및 여기 계수는 용기로서 1-cm 유리 큐벳을 사용하여 UV-Vis 분광계 상의 DMSO 용액에서 측정하였다. MARS 염료의 절대 라만 단면은 MARS 염료의 epr-SRS 신호를 메탄올의 표준 C-O 스트레치 모드 (1030 cm-1)와 비교하여 DMSO에서 결정하였다. 메탄올의 표준 C-O 스트레치 모드 (1030 cm-1)에 대한 절대 라만 단면은 785 nm에서 2.1 x 10-30 cm2로 보고되었다. 0.9 x 10-30 cm2의 단면을 외삽에 의해 860-nm 펌프 파장 하에서 추정하였다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에서, 우리는 갓 보존된 마우스 조직, FFPE 인간 조직 및 동결된 마우스 조직을 포함하는 일반적인 조직 유형에 광범위하게 적용 가능한 면역-eprSRS 프로토콜을 제시한다. 면역-eprSRS는 표 1에 열거된 바와 같이 세포 및 조직에서 에피토프의 패널에 대해 검증되었다. 이 원샷 플랫폼은 순환 전략이 잘 작동하지 않는 응용 분야에 특히 적합합니다. 예를 들어, 순환 형광은 3D 면역 표지의 다중 라운드가 비실용적 인 긴17이기 때문에 두꺼운 조직에 대해 요구된다. 또한 비선형 3D 조직학적 변화(11,17)로 인해 등록 오류가 발생할 가능성이 매우 높습니다. Immuno-eprSRS는 이러한 시나리오에서 순환 형광의 실질적인 장벽을 극복하고 대량에 걸쳐 단백질 상호 작용 네트워크를 밝힐 수있는 기회를 제공합니다17.
현재의 다중성은 주로 이차 항체의 가용성에 의해 제한된다. 이 프로토콜에서 우리는 MARS 프로브가 이차 항체에 접합되는 간접 면역 표지에 초점을 맞추었지만 직접 면역 표지 및 렉틴 염색이 가능합니다17. 라만 염료를 사용한 더 많은 일차 항체 검증 후, 현재 개발 된 라만 염료 13,18,24로 20 채널이 예상됩니다. 더욱이, 매우 낮은 풍부 표적을 이미징하는 것은 공초점 형광 시스템에 비해 약간 손상된 감도로 인해 epr-SRS에 대해 어려울 수 있습니다. 이와 관련하여, 우리는 상대적으로 낮은 풍부 표적을 더 밝은 MARS 염료에 할당하고 저발현 표적을 형광 채널에 할당하는 것이 좋습니다.
프로토콜의 중요한 측면은 기기와 프로브의 접근성입니다. 계측 측면에서 SRS 현미경은 일반적으로 광 변조기, 현미경, 광 다이오드 검출기 및 복조(25)를 위한 록인 증폭기를 갖는 이중 컬러 레이저 소스로 구성된다. 각 구성 요소는 이광자 레이저 스캐닝 형광 현미경보다 약간 높은 총 비용으로 상용화되어 있습니다. 완전히 통합된 멀티모달 SRS/형광 연구 현미경은 SRS 여기 및 형광을 위한 연속파(CW) 레이저 세트를 위해 여기와 유사한 피코초 레이저를 사용하여 상용화되었다(26 ). 이 시스템은 일상적인 생물학적 연구에서 멀티플렉스 진동 이미징에 쉽게 적용할 수 있습니다. 프로브 측면에서 MARS 프로브는 아직 상용화되지 않았으며 일부 합성 기능이 필요합니다. 대안적으로, 많은 상업적 원-적색 형광단(L. Wei et al. Nature 201713의 확장 데이터 표 1 참조)이 epr-SRS에 사용될 수 있다. 그러나 다중성이 손상 될 수 있습니다. 더욱이, MARS 프로브는 본질적으로 작은 유기 분자이기 때문에, 면역-eprSRS는 조직 염색의 관점에서 면역형광과 유사하다. 따라서, 면역형광에서 항체와 같은 검증된 친화성 시약의 아카이브는 면역-eprSRS 응용분야로 용이하게 전달될 수 있다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
마우스 췌장 조직을 제공해주신 Ruth A. Singer와 Richard K.P. Benninger에게 감사드립니다. W.M.은 NIH R01 (GM128214), R01 (GM132860), R01 (EB029523) 및 미국 육군 (W911NF-19-1-0214)의 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 16% Paraformaldehyde, EM Grade | Electron Microscopy Sciences | 15710 | |
| α-tubulin | Abcam | ab18251 | Primary antibodies |
| α-tubulin | BioLegend | 625902 | Primary antibodies |
| β-III-tubulin | BioLegend | 657402 | Primary antibodies |
| β-III-tubulin | Abcam | ab41489 | Primary antibodies |
| β-tubulin | Abcam | ab131205 | Primary antibodies |
| Agarose, low gellling temperature | Sigma Aldrich | A9414 | For brain embedding |
| Anti-a-tubulin antibody produced in rabbit (α-tubulin) | Abcam | ab52866 | Primary antibodies |
| Anti-Calbindin antibody produced in mouse (Calbindin) | Abcam | ab82812 | Primary antibodies |
| Anti-GABA B receptor R2 antibody produced in guinea pig (GABA B receptor R2) | Millipore Sigma | AB2255 | Primary antibodies |
| Anti-GFAP antibody produced in goat (GFAP) | Thermo Scientific | PA5-18598 | Primary antibodies |
| Anti-Glucagon antibody produced in mouse (Glucagon) | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| Anti-insulin antibody produced in guinea pig (insulin) | DAKO | IR00261-2 | Primary antibodies |
| Anti-MBP antibody produced in rat (MBP) | Abcam | ab7349 | Primary antibodies |
| Anti-NeuN antibody produced in rabbit (NeuN) | Thermo Scientific | PA5-78639 | Primary antibodies |
| Anti-Pancreatic polypeptide (PP) antibody produced in goat- Pancreatic polypeptide (PP) | Sigma Aldrich | SAB2500747 | Primary antibodies |
| Anti-Pdx1 antibody produced in rabbit (Pdx1) | Milipore | 06-1379 | Primary antibodies |
| Anti-Somatostatin antibody produced in rat (Somatostatin) | Abcam | ab30788 | Primary antibodies |
| Anti-Vimentin antibody produced in chicken (Vimentin) | Abcam | ab24525 | Primary antibodies |
| Band-pass filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| BNC cable | Thorlabs | 2249-C | Coaxial Cable, BNC Male / Male |
| Broadband dielectric mirror | Thorlabs | BB1-E03 | 750 - 1100 nm |
| C57BL/6J mice | Jackson Laboratory | 000664 | |
| Centrifuge | |||
| Condenser | Olympus | oil immersion, 1.4 N.A. | |
| Cytokeratin 18 | Abcam | ab7797 | Primary antibodies |
| Cytokeratin 18 | Abcam | ab24561 | Primary antibodies |
| DC power supply | TopWard | 6302D | Bias voltage is 64 V |
| Dichroic mount | Thorlabs | KM100CL | Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Left Handed |
| Donkey anti-Chicken IgY (H+L) | Jackson ImmunoResearch | 703-005-155 | Secondary antibodies for MARS conjugation |
| Donkey anti-Goat IgG (H+L) | Jackson ImmunoResearch | 705-005-147 | Secondary antibodies for MARS conjugation |
| Donkey anti-Guinea Pig IgG (H+L) | Jackson ImmunoResearch | 706-005-148 | Secondary antibodies for MARS conjugation |
| Donkey anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-005-151 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-005-152 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rat IgG (H+L) | Jackson ImmunoResearch | 712-005-153 | Secondary antibodies for MARS conjugation |
| Donkey anti-Sheep IgG (H+L) | Jackson ImmunoResearch | 713-005-147 | Secondary antibodies for MARS conjugation |
| DPBS | Fisher Scientific | 14-190-250 | |
| EpCAM | Abcam | ab71916 | Primary antibodies |
| Ethanol | Sigma Aldrich | 443611 | |
| Fast-speed look-in amplifier | Zurich Instruments | HF2LI | DC - 50 MHz |
| FFPE Kidney Sample | USBiomax | HuFPT072 | |
| Fibrillarin | Abcam | ab5821 | Primary antibodies |
| Giantin | Abcam | ab24586 | Primary antibodies |
| Glucagon | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| H2B | Abcam | ab1790 | Primary antibodies |
| HeLa | ATCC | ATCC CCL-2 | |
| High O.D. bandpass filter | Chroma Technology | ET890/220m | Filter the Stokes beam and transmit the pump beam |
| Hydrophobic pen | Fisher Scientific | NC1384846 | |
| Insulin | ThermoFisher | 701265 | Primary antibodies |
| Integrated SRS laser system | Applied Physics & Electronics, Inc. | picoEMERALD | picoEMERALD provides an output pulse train at 1,064 nm with 6-ps pulse width and 80-MHz repetition rate, which serves as the Stokes beam. The frequency doubled beam at 532 nm is used to synchronously seed a picosecond optical parametric oscillator (OPO) to produce a mode-locked pulse train with five~6 ps pulse width (the idler beam of the OPO is blocked with an interferometric filter). The output wavelength of the OPO is tunable from 720–950 nm, which serves as the pump beam. The intensity of the 1,064-nm Stokes beam is modulated sinusoidally by a built-in EOM at 8 MHz with a modulation depth of more than 90%. The pump beam is spatially overlapped with the Stokes beam by using a dichroic mirror inside picoEMERALD. The temporal overlap between pump and Stokes pulse trains is achieved with a built-in delay stage and optimized by the SRS signal of pure D2O at the microscope. |
| Inverted laser-scanning microscope | Olympus | FV1200MPE | |
| Kinematic mirror mount | Thorlabs | POLARIS-K1-2AH | 2 Low-Profile Hex Adjusters |
| Lectin from Triticum vulgaris (wheat) | Sigma Aldrich | L0636-5 mg | |
| Long-pass dichroic beam splitter | Semrock | Di02-R980-25x36 | 980 nm laser BrightLine single-edge laser-flat dichroic beamsplitter |
| MAP2 | BioLegend | 801810 | Primary antibodies |
| Microscopy imaging software | Olympus | FluoView | |
| NanoQuant Plate | Tecan | For absorbance-based, small volume analyses in a plate reader. | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| NucBlue Fixed Cell ReadyProbes Reagent (DAPI) | Thermo Scientific | R37606 | |
| Nunc 4-Well Dishes | Fisher Scientific | 12-566-300 | |
| Objective lens | Olympus | XLPlan N | x25, 1.05-NA, MP, working distance = 2 mm |
| Paint brush | |||
| Periscope assembly | Thorlabs | RS99 | includes the top and bottom units, Ø1" post, and clamping fork. |
| pH meter | |||
| Plate reader | Tecan | Infinite 200 PRO | An easy-to-use multimode plate reader. Absorbance measurement capabilities over a spectral range of 230–1000 nm. |
| ProLong Gold antifade reagent | Thermo Scientific | P36930 | |
| PSD95 | Invitrogen | 51-6900 | Primary antibodies |
| Sephadex G-25 Medium | GE Life Sciences | 17-0033-01 | gel filtration resin for desalting and buffer exchange |
| Shielded box with BNC connectors | Pomona Electronics | 2902 | Aluminum Box With Cover, BNC Female/Female |
| Si photodiode | Thorlabs | FDS1010 | 350–1100 nm, 10 mm x 10 mm Active Area |
| Synapsin 2 | ThermoFisher | OSS00073G | Primary antibodies |
| Tissue Path Superfrost Plus Gold Slides | Fisher Scientific | 22-035813 | Adhesive slide to attract and chemically bond fresh or formalin-fixed tissue sections firmly to the slide surface (tiisue bindling glass slides) |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Vibratome | Leica | VT1000 | |
| Vimentin | Abcam | ab8069 | Primary antibodies |
| Xylenes | Sigma Aldrich | 214736 |
참고문헌
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. Journal for Immunotherapy of Cancer. 8 (1), 000155 (2020).
- Lewis, S. M., et al. Spatial omics and multiplexed imaging to explore cancer biology. Nature Methods. 18 (9), 997-1012 (2021).
- Bodenmiller, B. Multiplexed epitope-based tissue imaging for discovery and healthcare applications. Cell Systems. 2 (4), 225-238 (2016).
- Hickey, J. W., et al. Spatial mapping of protein composition and tissue organization: a primer for multiplexed antibody-based imaging. Nature Methods. , (2021).
- Lin, J. -. R., et al. Highly multiplexed immunofluorescence imaging of human tissues and tumors using t-CyCIF and conventional optical microscopes. eLife. 7, 31657 (2018).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Giesen, C., et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry. Nature Methods. 11 (4), 417-422 (2014).
- Keren, L., et al. MIBI-TOF: A multiplexed imaging platform relates cellular phenotypes and tissue structure. Science Advances. 5 (10), 5851 (2019).
- Gerdes, M. J., et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11982 (2013).
- Angelo, M., et al. Multiplexed ion beam imaging of human breast tumors. Nature Medicine. 20 (4), 436-442 (2014).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455 (2020).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544, 465 (2017).
- Wei, L., Min, W. Electronic preresonance stimulated Raman scattering microscopy. The Journal of Physical Chemistry Letters. 9 (15), 4294-4301 (2018).
- Shi, L., et al. Electronic resonant stimulated Raman scattering micro-spectroscopy. The Journal of Physical Chemistry B. 122 (39), 9218-9224 (2018).
- Fujioka, H., et al. Multicolor activatable Raman probes for simultaneous detection of plural enzyme activities. Journal of the American Chemical Society. 142 (49), 20701-20707 (2020).
- Shi, L., et al. Highly-multiplexed volumetric mapping with Raman dye imaging and tissue clearing. Nature Biotechnology. , (2021).
- Miao, Y., Qian, N., Shi, L., Hu, F., Min, W. 9-Cyanopyronin probe palette for super-multiplexed vibrational imaging. Nature Communications. 12 (1), 4518 (2021).
- Miao, Y., Shi, L., Hu, F., Min, W. Probe design for super-multiplexed vibrational imaging. Physical Biology. 16 (4), 041003 (2019).
- Qian, N., Min, W. Super-multiplexed vibrational probes: Being colorful makes a difference. Current Opinion in Chemical Biology. 67, 102115 (2022).
- Klimas, A., et al. Nanoscale imaging of biomolecules using molecule anchorable gel-enabled nanoscale in-situ fluorescence microscopy. Nature Portfolio. , (2021).
- Shi, L., et al. Super-resolution vibrational imaging using expansion stimulated Raman scattering microscopy. bioRxiv. , (2021).
- Benninger, R. K. P., Hodson, D. J. New understanding of β-cell heterogeneity and in situ islet function. Diabetes. 67 (4), 537 (2018).
- Hu, F., et al. Supermultiplexed optical imaging and barcoding with engineered polyynes. Nature Methods. 15 (3), 194-200 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- . Coherent Raman Scattering Microscope Available from: https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-cars/ (2022)
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유