Method Article
Децеллюляризация для получения высокосохранившегося бесклеточного матрикса кожи человека для регенеративной медицины
* Эти авторы внесли равный вклад
В этой статье
Резюме
Децеллюляризированная кожа человека пригодна для регенерации тканей. Основной проблемой децеллюляризации является сохранение нативной архитектуры, а также соответствующего содержания структурных белков, гликозаминогликанов (ГАГ) и факторов роста. Предлагаемый метод позволяет проводить быструю и эффективную децеллюляризацию, получая децеллюляризованную кожу с хорошо сохранившимися нативными чертами.
Аннотация
Внеклеточный матрикс (ВКМ) обеспечивает биофизические и биохимические стимулы для поддержки самообновления, пролиферации, выживания и дифференцировки окружающих клеток благодаря содержанию в нем разнообразных биологически активных молекул. Благодаря этим характеристикам ВКМ в последнее время считается перспективным кандидатом на создание биологических каркасов для ускорения регенерации тканей. Новые исследования показали, что децеллюляризованные ткани человека могут напоминать нативную ВКМ по своим структурным и биохимическим профилям, сохраняя трехмерную (3D) архитектуру и содержание фундаментальных биологических молекул. Следовательно, децеллюляризованная ВКМ может быть использована для содействия ремоделированию тканей, восстановлению и функциональной реконструкции многих органов. Выбор подходящей процедуры децеллюляризации имеет решающее значение для получения бесклеточных тканей, сохраняющих характеристики идеального микроокружения для клеток.
Описанный здесь протокол представляет собой подробное пошаговое описание метода децеллюляризации для получения воспроизводимой и эффективной бесклеточной биологической ВКМ. Фрагменты кожи пациентов, перенесших пластическую операцию, были уменьшены и децеллюляризированы с помощью комбинации додецилсульфата натрия (SDS), Triton X-100 и антибиотиков. Чтобы обеспечить регулярный и однородный транспорт раствора по образцам, они были заключены в закладные кассеты для обеспечения защиты от механических повреждений. После процедуры децеллюляризации белоснежный цвет фрагментов кожи свидетельствовал о полной и успешной децеллюляризации. Кроме того, децеллюляризированные образцы показали неповрежденную и хорошо сохранившуюся архитектуру. Полученные результаты свидетельствуют о том, что предложенный метод децеллюляризации был эффективным, быстрым и воспроизводимым, а также защищал образцы от архитектурных повреждений.
Введение
ЭКМ служит каркасом для клеток, поддерживая их через сложную архитектуру, поддерживаемую различными компонентами, и является одним из основных факторов, ответственных за механические свойства сердцаи функцию сердечной ткани. Все больше данных свидетельствуют о том, что ВКМ играет активную роль в ремоделировании тканей, что делает традиционное предположение о том, что ВКМ является пассивным компонентом, устаревшим 3,4,5,6. Роль ECM заключается в предоставлении биофизических и биохимических сигналов резидентным клеткам. Хорошо известно, что эти сигналы могут влиять на многие фундаментальные особенности поведения клеток, влияя на их сократительную функцию, пролиферацию, миграцию и потенциал дифференцировки 7,8,9. Таким образом, ECM все чаще используется в тканевой инженерии и регенеративной медицине в качестве инструмента терапевтической поддержки 9,10,11,12,13.
ВКМ состоит из нескольких белков, таких как коллаген, эластин, фибронектин, протеогликан и ламинин, а также связанных с ВКМ факторов роста, все они участвуют в механизмах регенерации, таких как набор, миграция и дифференцировка клеток, а также выравниваниеи пролиферация клеток. Механические свойства тканей также имеют большое значение в физиопатологии органов. Действительно, изменения механических свойств часто связаны с возникновением и развитием нескольких заболеваний. Причина заключается в том, что при модификации ВКМ сигналы, поступающие из окружающей среды, вызывают изменения в экспрессии генов и белков, что приводит к функциональным нарушениям 15,16.
Регенеративная терапия для восстановления органов в настоящее время сосредоточена на воспроизведении сложного микроокружения нативной ткани для исцеления органа, в котором организм не справляется. Несмотря на быстрый темп развития многих подходов к тканевой инженерии, ткани до сих пор не могут быть точно воспроизведены во всей их полноте и сложности с помощью искусственных процедур. До сих пор в основном использовались синтетические материалы, поскольку они могут быть соответствующим образом настроены для моделирования механических и биохимических свойств клеточного микроокружения. Тем не менее, у них есть ограничения, такие как невозможность имитировать многочисленные взаимодействия внутри нативной ткани, стоимость технологий для их производства и тот факт, что они менее естественны и биосовместимы, чем нативные ткани. Кроме того, их состав, в первую очередь по белкам и растворимым факторам, сильно отличается от природного, который крайне сложно воспроизвести20.
Передовой подход в регенеративной медицине для сокращения разрыва между нуждающимися пациентами и трансплантацией органов заключается в производстве каркасов из децеллюляризованного внеклеточного матрикса (d-ECM) и повторном заселении их соответствующими типами клеток для регенерации поврежденных органов. Децеллюляризация – это процесс, при котором ВКМ выделяется из нативных клеток и генетического материала для получения естественного и биомиметического каркаса, способного избежать иммунного ответа и отторжения после имплантации у пациентов 21,22,23. Полученный таким образом ВКМ может быть затем повторно заселен для получения функциональной ткани. Основной проблемой при разработке d-ECM является метод. Для любого метода децеллюляризации основной целью остается сохранение нативного состава ECM, жесткости и 3D-структуры, и все стратегии имеют как преимущества, так и недостатки. Поскольку удаление клеточного содержимого и ДНК из ткани требует использования химических или физических агентов или их комбинации, каждая процедура децеллюляризации в разной степени вызывает нарушение ВКМ. Следовательно, крайне важно свести к минимуму повреждение ECM 24,25,26.
Использование нативной ЭКМ в качестве платформы для восстановления нативной ЭКМ in vitro крайне желательно. С этой целью было применено несколько протоколов децеллюляризации к широкому спектру тканей 27,28,29,30. Фактически, с ранних стадий исследований децеллюляризации и разработки ВКМ, некоторые ткани, такие как артерии, аортальные клапаны и периферические нервы как животных, так и человека, были децеллюляризованы, а некоторые д-ВКМ все еще коммерчески доступны и используются для замены тканей или заживления ран 31,32,33. В последнее время человеческая кожа также стала подходящим кандидатом для производства децеллюляризованных каркасов для восстановления сердца благодаря своему составу и механическим свойствам, способным повышать регенеративный потенциал сердечных клеток-предшественников (КПК) и адаптироваться к сердечной сократимости. В этой статье описывается простой и быстрый протокол производства децеллюляризованных скаффолдов из кожи взрослого человека, позволяющий разработать d-ECM с хорошо сохранившейся архитектурой.
протокол
Образцы из человеческих тканей были собраны в соответствии с принципами Хельсинкской декларации и с соблюдением рекомендаций Университетской больницы «Федерико II». Все пациенты, участвующие в данном исследовании, предоставили письменные формы согласия.
1. Приготовление растворов
- Приготовление 1200 мл 1% раствора децеллюляризующего
- Приготовьте 600 мл 2% раствора Triton X-100, отмерив 588 мл воды двойной дистилляции в мерном цилиндре и переложив его в стакан объемом 1 л. С помощью серологической пипетки добавьте в стакан 12 мл Triton X-100 и полоску для перемешивания. Поместите стакан на магнитную мешалку и перемешайте раствор до полного растворения Triton X-100.
- Прекратите агитацию. Снимите стержень с помощью ретривера. Хранить при комнатной температуре.
- Приготовьте 600 мл 2% раствора SDS, отмерив 550 мл дважды дистиллированной воды в мерном цилиндре и переложив его в стакан объемом 1 л.
- Взвесьте 12 г порошка SDS в пластиковой лодке для взвешивания и переложите его в стакан, содержащий воду двойной дистилляции, на шаге 1.1.3.
ПРИМЕЧАНИЕ: Шаг 1.1.4 должен быть выполнен под химическим капюшоном, и пользователь должен быть одет в средства индивидуальной защиты. - Добавьте мешалку, поместите стакан на магнитную мешалку и перемешайте раствор до полного растворения паспорта безопасности.
- Прекратите процесс агитации. Снимите стержень с помощью ретривера.
- Перелейте раствор в градуированный цилиндр и отрегулируйте объем до 600 мл, добавив воду двойной дистилляции.
- Налить 2% раствор Triton X-100, приготовленный на шаге 1.1.1, в баллон объемом 2 л.
- Влейте 2% раствор SDS, приготовленный с этапами 1.1.3-1.1.7, в тот же цилиндр объемом 2 л до получения общего объема 1200 мл.
- Накройте парапленкой и аккуратно перемешайте путем инверсии до получения однородного раствора.
- Перелейте смешанный раствор в бутылку объемом 2 л с помощью воронки во избежание образования пены. Хранить раствор при температуре +4 °C.
- Приготовление 1x фосфатно-солевого буфера (PBS)
- Приготовьте 500 мл 1 фосфатно-солевого буфера (PBS) путем растворения 0,1 г одноосновного фосфата калия, 0,1 г хлорида калия, 4,0 г хлорида натрия и 0,575 г двухосновного фосфата натрия двухосновного. Проверьте значение pH (7,4).
- Хранить при температуре +4 °C до использования.
- Приготовление раствора антибиотика
- Взвесьте 625 г амфотерицина В в пластиковой лодке для взвешивания.
- Пипетка нанесите 8 мл смеси пенициллина и стрептомицина (ручка/стрептококка) в пробирку объемом 15 мл.
- Добавьте взвешенный амфотерицин В в смесь шприц/стрептококк и отрегулируйте объем до 10 мл, добавив пенициллин и смесь стрептомицина (ручка/стрептококка). Закройте тюбик крышкой и растворите амфотерицин В, энергично встряхивая.
2. День 1 – начало процедуры децеллюляризации.
- Налейте 400 мл децеллюляризующего раствора в стакан объемом 500 мл.
- Добавьте 2,0 мл раствора антибиотика.
3. Подготовка образцов кожи
- Промойте образец человеческой кожи из брюшной полости пациентов, перенесших абдоминопластику, в пластиковом лотке, перевернув его вверх дном в 0,9% изотоническом физиологическом растворе NaCl для удаления избытка крови и других биологических жидкостей.
- Удалите волосы с помощью тонких щипцов, а жир — с помощью больших хирургических ножниц.
- Поместите образец кожи на препарирующую доску и препарируйте его с помощью скальпеля, используя градуировки на препарирующей доске в качестве ориентира, чтобы получить фрагменты размером 3 см х 2,5 см (длина по ширине), избегая шрамов и грязных или обожженных участков ткани.
- Поместите каждый фрагмент в встраиваемую кассету, закройте ее и убедитесь, что все кассеты надежно заблокированы, чтобы избежать утечки образца во время процедуры децеллюляризации.
- Поместите не более четырех встраиваемых кассет с образцами в стакан с децеллюляризующим раствором. Добавьте полосу перемешивания. Накройте алюминиевой фольгой, написав сверху всю информацию для идентификации пробы и время начала процедуры.
- Поместите стакан на магнитную мешалку и начните перемешивание со скоростью вращения 150 об/мин. Прекратите агитацию. Снимите алюминиевую фольгу, закрывающую стакан, и выньте встраиваемые кассеты с помощью длинных щипцов.
ПРИМЕЧАНИЕ: После прекращения перемешивания проверьте прозрачность раствора. Изменяйте продолжительность перемешивания (менее или более 8 часов) в зависимости от степени помутнения из-за выделения клеточного мусора. - Поместите каждую кассету в чашку диаметром 100 мм. Замените децеллюляризующий раствор, повторив шаги 3,5-3,6 в течение ночи.
4. День 2 - проверка состояния образцов кожи.
- Прекратите процесс агитации. Снимите алюминиевую фольгу, закрывающую стакан, и выньте встраиваемые кассеты с помощью длинных щипцов.
- Поместите каждую кассету в чашку диаметром 100 мм и откройте ее. Проверьте цвет образца.
ПРИМЕЧАНИЕ: Образцы могут демонстрировать изменение цвета с естественного бежевого на белоснежный. - Удалите остатки волос и отделите эпидермис от дермы. Замените децеллюляризующий раствор, повторив шаги 3.5-3.6.
- Прекратите перемешивание через 8 ч. Повторяйте шаги 4.1-4.2 до тех пор, пока образец не станет белоснежным. Прекратите процедуру децеллюляризации.
ПРИМЕЧАНИЕ: При необходимости время воздействия моющих средств может быть увеличено. - Отмерьте 400 мл 1x PBS в цилиндре объемом 500 мл, налейте его в стакан объемом 500 мл и добавьте 2 мл смеси Pen Strep/Amphotericin B. Добавьте полосу перемешивания.
- Поместите не более четырех кассет с образцами в каждый стакан с раствором 1x PBS/антибиотиков. Накрываем алюминиевой фольгой и записываем всю информацию сверху, как в пункте 3.5.
- Поместите стакан на магнитную мешалку и начните перемешивание со скоростью вращения 150 об/мин в течение ночи при комнатной температуре.
5. День 3 - окончательная промывка образцов
- Прекратите агитацию. Замените 1x раствор PBS на 400 мл воды двойной дистилляции. Добавьте полосу перемешивания. Накрываем алюминиевой фольгой и пишем всю информацию сверху, как в пункте 3.5.
- Поместите стакан на магнитную мешалку и начните перемешивание со скоростью вращения 150 об/мин в течение 30 минут.
- Прекратите процесс агитации. Снимите алюминиевую фольгу, закрывающую стакан, и выньте встраиваемые кассеты с помощью длинных щипцов.
- Поместите каждую встраиваемую кассету, содержащую децеллюляризованный образец кожи, в чашку диаметром 100 мм. Откройте кассеты и аккуратно высушите образцы кожи, промокнув их лабораторными салфетками.
- Поместите каждый децеллюляризованный образец кожи в лодку для взвешивания, предварительно помеченную информацией о образце. Накройте лодку алюминиевой фольгой и напишите всю информацию сверху, чтобы идентифицировать образец. Хранить при температуре -80 °C.
Результаты
Целью протокола было получение образца кожи d-ECM из биологической ткани, сохраняя хорошо организованную 3D-структуру и хорошо сохраняющееся содержание биологических молекул (рис. 1). Этот метод в первую очередь основан на постоянном перемешивании образцов в растворе, содержащем комбинацию двух моющих средств, Triton X-100 и SDS, что позволяет сохранить биологические и структурные особенности, характерные для нативной ткани, и сократить время воздействия в процессе децеллюляризации. После получения образцы промывали и подготавливали к процедуре, получая чистые фрагменты кожи размером 3 см х 2,5 см, свободные от волос или жировой ткани (рис. 2 и рис. 3). Использование встраиваемых кассет позволило свести к минимуму разрушение тканей (рис. 3), в результате чего образцы получили более неповрежденную архитектуру. Децеллюляризированная кожа не показала признаков значительных механических или химических повреждений после макроскопического наблюдения. Эпидермис был отслоен во время процедуры децеллюляризации (рис. 4А,Б), и образцы изменили цвет от бежевого, характерного для всей нативной ткани, до белоснежного, что свидетельствует о полной и успешной децеллюляризации (рис. 4В).

Рисунок 1: Рабочий процесс протокола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Репрезентативные изображения подготовки образца кожи при получении. (A) Входящий образец. (В, В) Макроскопическая оценка образца, размещенного на препарирующей доске. (Д-Ж) Удаление жировой ткани с помощью больших хирургических ножниц. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Рассечение образца кожи и помещение его в закладные кассеты. (A) Волосы удаляются тонкими щипцами. (В-Е) Образцы кожи препарируют с помощью скальпеля с получением фрагментов размером 3 см х 2,5 см для установки в закладные кассеты. (Ф, Г) Фрагмент обшивки помещен в встраиваемую кассету. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
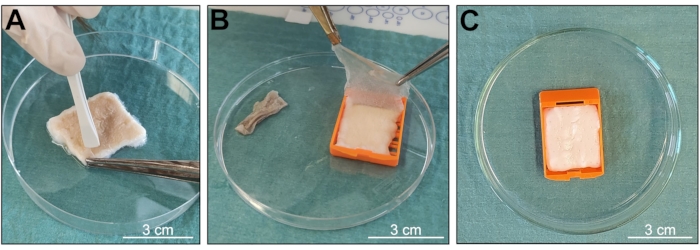
Рисунок 4: Проверка состояния образца во время децеллюляризации. (А, Б) Отслоение эпидермиса от дермы. (В) Изменение цвета образца, указывающее на возникновение децеллюляризации. Масштабные линейки = 3 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
Обсуждение
Несмотря на то, что описанный выше протокол был оптимизирован и улучшен по сравнению с ранее опубликованными протоколами, он представляет собой несколько критических шагов, требующих внимания и точности. Необходимо избегать образования пены во время приготовления децеллюляризующего раствора, чтобы предотвратить неправильное разбавление моющих средств. Эту проблему можно решить, осторожно выливая растворы и заставляя их течь вдоль внутренней стороны цилиндра. Кроме того, необходимо соблюдать осторожность при ручном удалении жировой ткани из образцов, так как децеллюляризация с использованием моющих средств, таких как Triton X-100 и SDS, не устраняет жир, а липидные остатки могут негативно повлиять на эффективность метода. Еще одним важным этапом является удаление эпидермиса из образцов. Во время децеллюляризации эпидермис постепенно отделяется от поверхности кожи. На этом этапе крайне важно отклеивать его щипцами только после того, как он будет полностью смыт, что позволит избежать разрыва или измельчения и попадания мусора в образцы.
Данный протокол направлен на снижение воздействия децеллюляризации на образцы с помощью двух основных стратегий: сокращение времени воздействия процедуры за счет использования двух моющих средств в комбинации28,35,36 и защита образцов от механических повреждений путем помещения их в встраиваемые кассеты37. Кроме того, процедура дала успешные результаты при применении к образцам, отличным от кожи, таким как миокард и кровеносные сосуды человека и свиньи. Оценка эффективности описанного здесь протокола в первую очередь осуществляется путем макроскопического наблюдения образцов, которое показало бы заметное изменение цвета, от бежевого до белоснежного. Конечно, для оценки качества d-ECM необходимо оценить некоторые другие аспекты, такие как удаление клеточного мусора и остаточного генетического материала, сохранение структурных белков и содержания биомолекул, а также сохранение механических свойств, как описано в других разделах 34,37,38. Удаление клеточного мусора и генетического материала имеет решающее значение для снижения иммуногенности конструкции. Таким образом, некоторые критерии оценки эффективности удаления этих компонентов хорошо известны в литературе: d-ECM должен содержать не более 50 нг двухцепочечной ДНК (dsDNA)39 на мг сухого веса ECM, и ни один ядерный материал не должен быть виден под микроскопом.
Чтобы соответствовать этим критериям, необходимо провести оценку остаточного содержания ДНК и окрашивание гематоксилином и эозином, как описано в Di Meglio et al.38 для подтверждения макроскопических данных. Кроме того, оценка сохранности ВКМ путем обнаружения структурных белков, таких как коллаген, фибронектин и ламинин, вместе с гликозаминогликанами и факторами роста, также является целесообразной34. Наконец, механические свойства d-ECM должны соответствовать механическим свойствам нативной ткани40. Несмотря на то, что эффективность и целесообразность этой процедуры были продемонстрированы для получения желаемой децеллюляризованной ткани, метод имеет некоторые ограничения. Например, он позволяет децеллюляризировать только несколько образцов за раз (по 4 для каждого стакана), что приводит к значительным потерям растворов. С одной стороны, использование встраиваемых кассет помогает защитить и сохранить образцы; С другой стороны, это вынуждает операторов децеллюляризировать только образцы небольших размеров, которые помещаются в кассеты. Еще одним ограничением является возможность микробной контаминации полученного d-ECM. Несмотря на то, что процедура включает в себя добавление антибиотиков, настоятельно рекомендуется стерилизовать d-ECM с помощью ультрафиолета перед использованием. Наконец, инкубации, необходимые на протяжении всей процедуры, должны быть точно рассчитаны и организованы для оптимального управления временем.
Этот протокол был разработан для устранения недостатков, обнаруженных при тестировании других протоколов в лаборатории. Существующие протоколы допускают различную степень децеллюляризации, не гарантируя адекватной целостности ткани, что приводит к значительной потере основных биологических молекул и механических свойств41. Сохранение структуры и состава ВКМ после децеллюляризации является фундаментальным аспектом, поскольку d-ВКМ может выступать в качестве каркаса, который после повторного заселения будет поддерживать клеточные регенеративные механизмы в органе. Оптимизируя процесс децеллюляризации, биологические каркасы, полученные из кожи человека, могут быть использованы в регенеративной медицине, помогая свести к минимуму разрыв между донорами и пациентами, нуждающимися в трансплантации органов. Кроме того, достижения в методах рецеллюляризации и применение индуцированных плюрипотентных стволовых клеток человека улучшат распределение соответствующих типов клеток42,43 для обеспечения процессарегенерации 44.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Никакой
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl isotonic Physiological solution | Sigma-Aldrich | S8776 | 0.9% in water |
| 1 L beaker | VWR | 511-0318 | Clean and autoclave before use |
| 10 mL serological pipet | Falcon | 357551 | Sterile, polystyrene |
| 100 mm plates | Falcon | 351029 | Treated, sterile cell culture dish |
| 15 mL sterile tubes | Falcon | 352097 | Centrifuge sterile tubes, polypropylene |
| 1 L graduated cylinder | VWR | 612-1524 | Clean and autoclave before use |
| 2 L bottle | VWR | 215-1596 | Clean and autoclave before use |
| 25 mL serological pipet | Falcon | 357525 | Sterile, polystyrene |
| 2 L graduated cylinder | VWR | 612-3072 | Clean and autoclave before use |
| 500 mL beaker | VWR | 511-0317 | Clean and autoclave before use |
| Amphotericin B | Sigma-Aldrich | Y0000005 | Powder |
| Dissecting board | VWR | 100498-398 | Made of high-density polyethylene. |
| Dissecting scalpel | VWR | 233-5526 | Sterile and disposable |
| Embedding cassettes | Diapath | 070191 | External dimensions: 40x26x7 mm (WxDxH) |
| Fine forceps | VWR | 232-1317 | Clean and autoclave before use |
| Funnel | VWR | 221-1861 | Clean and autoclave before use |
| Hexagonal weighing boats size M | Sigma-Aldrich | Z708585 | Hexagonal, polystyrene, 51 mm Bottom I.D., 64 mm Top I.D. |
| Hexagonal weighing boats size S | Sigma-Aldrich | Z708577 | Hexagonal, polystyrene, 25 mm Bottom I.D., 38 mm Top I.D. |
| Large surgical scissors | VWR | 233-1211 | Clean and autoclave before use |
| Long forceps | VWR | 232-0096 | Clean and autoclave before use |
| Penicillin and Streptomycin | Sigma-Aldrich | P4333-100ml | Stabilized, with 10.000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered. Store at -20°C. The solution should be aliquoted into smaller working volumes to avoid repeated freeze/thaw cycles Solution. |
| Pipette gun | Eppendorf | 613-2795 | Eppendorf Easypet® 3 |
| Plastic tray | VWR | BELAH162620000 | Corrosion-proof polypropylene plastic tray |
| Potassium Chloride | Sigma-Aldrich | P9333 | Powder |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5665 | Powder |
| Sodium Chloride | Sigma-Aldrich | S7653 | Powder |
| Sodium Dodecyl Sulfate | Sigma-Aldrich | 62862 | Powder |
| Sodium Phosphate Dibasic | Sigma-Aldrich | 94046 | Powder |
| Spatula | VWR | RSGA038.210 | Clean and autoclave before use |
| Spoon | VWR | 231-1314 | Clean and autoclave before use |
| Stir bar | VWR | 442-0362 | Clean and autoclave before use |
| Stir bar retriever | VWR | 89026-262 | Molded in pure, FDA-approved PTFE |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Liquid |
Ссылки
- Daley, W. P., Peters, S. B., Larsen, M. Extracellular matrix dynamics in development and regenerative medicine. Journal of Cell Science. 121 (3), 255-264 (2008).
- Lu, P., Takai, K., Weaver, V. M., Werb, Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harbor Perspectives in Biology. 3 (12), 005058 (2011).
- Dobaczewski, M., Gonzalez-Quesada, C., Frangogiannis, N. G. The extracellular matrix as a modulator of the inflammatory and reparative response following myocardial infarction. Journal of Molecular and Cellular Cardiology. 48 (3), 504-511 (2010).
- Frangogiannis, N. G. Matricellular proteins in cardiac adaptation and disease. Physiological Reviews. 92 (2), 635-688 (2012).
- Etoh, T., et al. Myocardial and interstitial matrix metalloproteinase activity after acute myocardial infarction in pigs. American Journal of Physiology-Heart and Circulating Physiology. 281 (3), 987-994 (2001).
- Ma, Y., et al. Myofibroblasts and the extracellular matrix network in post-myocardial infarction cardiac remodeling. Pflügers Archiv: European Journal of Physiology. 466 (6), 1113-1127 (2014).
- Fong, A. H., et al. Three-dimensional adult cardiac extracellular matrix promotes maturation of human induced pluripotent stem cell-derived cardiomyocytes. Tissue Engineering. Part A. 22 (15-16), 1016-1025 (2016).
- Atance, J., Yost, M. J., Carver, W. Influence of the extracellular matrix on the regulation of cardiac fibroblast behavior by mechanical stretch. Journal of Cell Physiology. 200 (3), 377-386 (2004).
- Belviso, I., et al. The microenvironment of decellularized extracellular matrix from heart failure myocardium alters the balance between angiogenic and fibrotic signals from stromal primitive cells. International Journal of Molecular Sciences. 21 (21), 7903 (2020).
- Badylak, S. F. Regenerative medicine and developmental biology: The role of the extracellular matrix. The Anatomical Record. 287 (1), 36-41 (2005).
- Volpato, F. Z., Führmann, T., Migliaresi, C., Hutmacher, D. W., Dalton, P. D. Using extracellular matrix for regenerative medicine in the spinal cord Using extracellular matrix for regenerative medicine in the spinal cord. Biomaterials. 34 (21), 4945-4955 (2013).
- Martino, M. M., et al. Extracellular matrix and growth factor engineering for controlled angiogenesis in regenerative medicine. Frontiers in Bioengineering and Biotechnology. 3, 45 (2015).
- Hussey, G. S., Keane, T. J., Badylak, S. F. The extracellular matrix of the gastrointestinal tract: a regenerative medicine platform. Nature Reviews: Gastroenterology Hepathology. 14, 540-552 (2017).
- Sheng, Y., Fei, D., Leiiei, G., Xiaosong, G. Extracellular matrix scaffolds for tissue engineering and regenerative medicine. Current Stem Cell Research and Therapy. 12 (3), 233-246 (2017).
- Rozario, T., De Simone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Developmental Biology. 341 (1), 126-140 (2010).
- Takawale, A., Sakamuri, S. S. V. P., Kassiri, Z. Extracellular matrix communication and turnover in cardiac physiology and pathology. Comprehensive Physiology. 5 (2), 687-719 (2015).
- Li, L., Zhao, Q., Kong, W. Extracellular matrix remodeling and cardiac fibrosis. Matrix Biology. 68-69, 490-506 (2018).
- DeQuach, J. A., et al. Simple and high yielding method for preparing tissue specific extracellular matrix coatings for cell culture. PLoS ONE. 5 (9), 13039 (2010).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissue: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Tukmachev, D., et al. Injectable extracellular matrix hydrogels as scaffolds for spinal cord injury repair. Tissue Engineering. Part A. 22 (3-4), 306-317 (2016).
- Shoichet, M. S. Polymer scaffolds for biomaterials applications. Macromolecules. 43 (2), 581-591 (2010).
- Taylor, D. A., et al. Decellularized matrices in regenerative medicine. Acta Biomaterialia. 74, 74-89 (2018).
- Gilpin, A., Yang, Y. Decellularization strategies for regenerative medicine: From processing techniques to applications. BioMed Research International. 2017, 9831534 (2017).
- Heath, D. E. A review of decellularized extracellular matrix biomaterials for regenerative engineering applications. Regenerative Engineering and Translational Medicine. 5 (2), 155-166 (2019).
- Hoshiba, T., et al. Decellularized extracellular matrix as an in vitro model to study the comprehensive roles of the ECM in stem cell differentiation. Stem Cell International. 2016, 6397820 (2016).
- Keane, T. J., Swinehart, I. T., Badylak, S. F. Methods of tissue decellularization used for preparation of biologic scaffolds and in vivo relevance. Methods. 84, 5-34 (2015).
- Cerbotari, S., et al. Detergent decellularization of heart valves for tissue engineering: Toxicological effects of residual detergents on human endothelial cells. Artificial Organs. 34 (3), 206-210 (2010).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B. E., et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Calle, E. A., Petersen, T. H., Niklason, L. E. Procedure for lung engineering. Journal of Visualized Experiments. (49), e2651 (2011).
- Zeltinger, J., Landeen, L. K., Alexander, H. G., Kidd, I. D., Sibanda, B. Development and Characterization of Tissue-Engineered Aortic Valves. Tissue engineering. Part A. 7 (1), 9-22 (2001).
- Dahl, S., et al. Decellularized native and engineered arterial scaffolds for transplantation. Cell Transplantation. 12 (6), 659-666 (2003).
- Belviso, I., et al. Decellularized human dermal matrix as a biological scaffold for cardiac repair and regeneration. Frontiers inTissue Engineering and Regenerative Medicine. 8, 229 (2020).
- Greco, K. V., et al. Characterisation of porcine dermis scaffolds decellularised using a novel non-enzymatic method for biomedical applications. Journal of Biomaterials Applications. 30 (2), 239-253 (2015).
- Brouki, M. P., et al. Decellularization and preservation of human skin: A platform for tissue engineering and reconstructive surgery. Methods. 171, 62-67 (2020).
- Carbonaro, D., et al. A low-cost scalable 3D-printed sample-holder for agitation-based decellularization of biological tissues. Medical Engineering & Physics. 85, 7-15 (2020).
- Di Meglio, F., et al. Optimization of human myocardium decellularization method for the construction of implantable patches. Tissue Engineering. Part C Methods. 23 (9), 525-539 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Putame, G., et al. Compact and tunable stretch bioreactor advancing tissue engineering implementation. Application to engineered cardiac constructs. Medical Engineering & Physics. 84, 1-9 (2020).
- Parmaksiz, M., Dogan, A., Odabas, S., Elçin, A. E., Elçin, Y. M. Clinical applications of decellularized extracellular matrices for tissue engineering and regenerative medicine. Biomedical Materials. 11 (2), 022003 (2016).
- Sacco, A. M., et al. Diversity of dermal fibroblasts as major determinant of variability in cell reprogramming. Journal of Cellular and Molecular Medicine. 23 (6), 4256-4268 (2019).
- Belviso, I., et al. Isolation of adult human dermal fibroblasts from abdominal skin and generation of induced pluripotent stem cells using a non-integrating method. Journal of Visualized Experiments: JoVE. (155), e60629 (2020).
- Belviso, I., Di Meglio, F., Romano, V., Montagnani, S., Castaldo, C. Non-modified RNA-based reprogramming of human dermal fibroblasts into induced pluripotent stem cells. Methods in Molecular Biology. , (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены