Method Article
Décellularisation pour la préparation d’une matrice cutanée acellulaire humaine hautement préservée pour la médecine régénérative
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La peau humaine décellularisée convient à la régénération des tissus. Un problème majeur de la décellularisation est la préservation de l’architecture native, ainsi que le contenu approprié des protéines structurelles, des glycosaminoglycanes (GAG) et des facteurs de croissance. La méthode proposée permet une décellularisation rapide et efficace, produisant une peau décellularisée avec des caractéristiques natives bien préservées.
Résumé
La matrice extracellulaire (ECM) fournit des stimuli biophysiques et biochimiques pour soutenir l’auto-renouvellement, la prolifération, la survie et la différenciation des cellules environnantes en raison de sa teneur en diverses molécules bioactives. En raison de ces caractéristiques, l’ECM a récemment été considéré comme un candidat prometteur pour la création d’échafaudages biologiques visant à stimuler la régénération des tissus. Des études émergentes ont démontré que les tissus humains décellularisés pourraient ressembler à l’ECM native dans leurs profils structurels et biochimiques, préservant l’architecture tridimensionnelle (3D) et le contenu des molécules biologiques fondamentales. Par conséquent, la MEC décellularisée peut être utilisée pour favoriser le remodelage tissulaire, la réparation et la reconstruction fonctionnelle de nombreux organes. Le choix de la procédure de décellularisation appropriée est crucial pour obtenir des tissus acellulaires qui conservent les caractéristiques du microenvironnement idéal pour les cellules.
Le protocole décrit ici fournit une description détaillée, étape par étape, de la méthode de décellularisation pour obtenir une MEC biologique acellulaire reproductible et efficace. Des fragments de peau de patients subissant une chirurgie plastique ont été réduits et décellularisés à l’aide d’une combinaison de dodécylsulfate de sodium (SDS), de Triton X-100 et d’antibiotiques. Pour favoriser le transport régulier et homogène de la solution à travers les échantillons, ceux-ci ont été enfermés dans des cassettes d’enrobage afin d’assurer une protection contre les agressions mécaniques. Après la procédure de décellularisation, la couleur blanche comme neige des fragments de peau indiquait une décellularisation complète et réussie. De plus, les échantillons décellularisés ont montré une architecture intacte et bien conservée. Les résultats suggèrent que la méthode de décellularisation proposée était efficace, rapide et reproductible et protégeait les échantillons des dommages architecturaux.
Introduction
L’ECM sert d’échafaudage pour les cellules, les soutenant à travers une architecture complexe maintenue par différents composants, et c’est l’un des principaux facteurs responsables des propriétés mécaniques du cœur et de la fonction du tissu cardiaque 1,2. De plus en plus de preuves suggèrent que l’ECM joue un rôle actif dans le remodelage des tissus, ce qui rend obsolète l’hypothèse conventionnelle selon laquelle l’ECM est un composant passif 3,4,5,6. Le rôle de l’ECM est de fournir des signaux biophysiques et biochimiques aux cellules résidentes. Il est bien établi que ces signaux peuvent influencer de nombreux comportements cellulaires fondamentaux, affectant leur fonction contractile, leur prolifération, leur migration et leur potentiel de différenciation 7,8,9. Ainsi, l’ECM est de plus en plus utilisée dans l’ingénierie tissulaire et la médecine régénérative en tant qu’outil de soutien thérapeutique 9,10,11,12,13.
L’ECM se compose de plusieurs protéines telles que le collagène, l’élastine, la fibronectine, le protéoglycane et la laminine, ainsi que de facteurs de croissance liés à l’ECM, tous impliqués dans les mécanismes de régénération, tels que le recrutement, la migration et la différenciation cellulaires, ainsi que l’alignement et la prolifération cellulaires14. Les propriétés mécaniques des tissus ont également une grande importance dans la physiopathologie des organes. En effet, les modifications des propriétés mécaniques sont souvent associées à l’apparition et à l’évolution de plusieurs maladies. La raison réside dans le fait que lorsque l’ECM est modifiée, les signaux provenant de l’environnement induisent des changements dans l’expression des gènes et des protéines, conduisant à une déficience fonctionnelle15,16.
Les thérapies régénératives pour la réparation des organes se concentrent actuellement sur la reproduction du microenvironnement sophistiqué du tissu natif pour guérir l’organe où le corps échoue. Malgré le rythme rapide de nombreuses approches d’ingénierie tissulaire, les tissus ne peuvent toujours pas être reproduits avec précision dans leur intégralité et leur complexité par des procédures artificielles. Les matériaux synthétiques ont été largement utilisés jusqu’à présent, car ils peuvent être ajustés de manière appropriée pour simuler les propriétés mécaniques et biochimiques du microenvironnement cellulaire. Néanmoins, ils ont des limites, telles que l’incapacité d’imiter les nombreuses interactions au sein du tissu natif, le coût des technologies pour les produire et le fait qu’ils sont moins naturels et biocompatibles que les tissus natifs 17,18,19. De plus, leur composition, principalement en termes de protéines et de facteurs solubles, diffère considérablement de la composition naturelle, qui est extrêmement difficile à reproduire20.
L’approche de pointe en médecine régénérative pour réduire l’écart entre les patients dans le besoin et les greffes d’organes consiste à produire des échafaudages faits de matrice extracellulaire décellularisée (d-ECM) et à les repeupler avec les types de cellules appropriés pour régénérer les organes endommagés. La décellularisation est le processus dans lequel l’ECM est isolé de ses cellules natives et de son matériel génétique pour produire un échafaudage naturel et biomimétique, capable d’éviter la réponse immunitaire et le rejet une fois implanté chez les patients 21,22,23. L’ECM ainsi obtenue peut ensuite être repeuplée pour produire du tissu fonctionnel. L’enjeu majeur lors du développement d’un d-ECM est la méthode. Pour toute technique de décellularisation, l’objectif principal reste la préservation de la composition ECM native, de la rigidité et de la structure 3D, et toutes les stratégies présentent à la fois des avantages et des inconvénients. Étant donné que l’élimination du contenu cellulaire et de l’ADN du tissu nécessite l’utilisation d’agents chimiques ou physiques, ou la combinaison des deux, chaque procédure de décellularisation provoque, à des degrés divers, la perturbation de l’ECM. Par conséquent, il est crucial de minimiser les dommages à l’ECM 24,25,26.
L’utilisation de l’ECM native comme plate-forme pour la reconstitution de l’ECM native in vitro est hautement souhaitable. À cette fin, plusieurs protocoles de décellularisation ont été appliqués à un large éventail de tissus 27,28,29,30. En fait, depuis les premières étapes de la recherche sur la décellularisation et du développement de la MEC, plusieurs tissus, tels que les artères, les valves aortiques et les nerfs périphériques des animaux et des humains, ont été décellularisés, et certains d-ECM sont encore disponibles dans le commerce et utilisés pour le remplacement des tissus ou la cicatrisation des plaies31,32,33. Récemment, la peau humaine est également apparue comme un candidat approprié pour produire des échafaudages décellularisés pour la réparation cardiaque en raison de sa composition et de ses propriétés mécaniques, capables de stimuler le potentiel de régénération des cellules progénitrices cardiaques (CPC) et de s’adapter à la contractilité cardiaque34. Cet article décrit un protocole simple et rapide pour produire des échafaudages décellularisés à partir de peau humaine adulte, permettant le développement d’un d-ECM avec une architecture bien préservée.
Protocole
Les échantillons de tissus humains ont été collectés conformément aux principes de la Déclaration d’Helsinki et en respectant les directives de l’hôpital universitaire « Federico II ». Tous les patients participant à cette étude ont fourni des formulaires de consentement écrits.
1. Préparation des solutions
- Préparation de 1200 mL de solution décellularisante à 1 %
- Préparez 600 mL de solution Triton X-100 à 2 % en mesurant 588 mL d’eau doublement distillée dans un cylindre gradué et en le transférant dans un bécher de 1 L. À l’aide d’une pipette sérologique, ajouter 12 mL de Triton X-100 et une barre d’agitation dans le bécher. Placez le bécher sur un agitateur magnétique et mélangez la solution jusqu’à ce que le Triton X-100 soit complètement dissous.
- Arrêtez l’agitation. Retirez la barre d’agitation à l’aide d’un récupérateur de barre d’agitation. Conserver à température ambiante.
- Préparez 600 mL de solution SDS à 2 % en mesurant 550 mL d’eau doublement distillée dans un cylindre gradué et en le transférant dans un bécher de 1 L.
- Pesez 12 g de poudre SDS dans un bateau de pesée en plastique et transférez-le dans le bécher contenant l’eau distillée deux fois à l’étape 1.1.3.
REMARQUE : L’étape 1.1.4 doit être effectuée sous une cagoule chimique, et l’utilisateur doit porter un équipement de protection individuelle. - Ajoutez un agitateur, placez le bécher sur un agitateur magnétique et mélangez la solution jusqu’à ce que la FDS soit complètement dissoute.
- Arrêtez le processus d’agitation. Retirez la barre d’agitation à l’aide d’un récupérateur de barre d’agitation.
- Transférez la solution dans un cylindre gradué et ajustez le volume à 600 ml en ajoutant de l’eau distillée deux fois.
- Verser la solution Triton X-100 à 2 % préparée à l’étape 1.1.1 dans une bouteille de 2 L.
- Verser la solution de SDS à 2 % préparée aux étapes 1.1.3 à 1.1.7 dans la même bouteille de 2 L pour obtenir un volume total de 1200 mL.
- Couvrir de parafilm et mélanger délicatement par inversion pour obtenir une solution homogène.
- Transférez la solution mélangée dans une bouteille de 2 L à l’aide d’un entonnoir pour éviter la formation de mousse. Conserver la solution à +4 °C.
- Préparation de 1x solution saline tamponnée au phosphate (PBS)
- Préparez 500 ml de solution saline tamponnée au phosphate (PBS) en dissolvant 0,1 g de phosphate de potassium monobasique, 0,1 g de chlorure de potassium, 4,0 g de chlorure de sodium et 0,575 g de phosphate de sodium dibasique dans de l’eau stérile bidistillée. Vérifiez la valeur du pH (7,4).
- Conserver à +4 °C jusqu’à utilisation.
- Préparation de la solution antibiotique
- Peser 625 μg d’amphotéricine B dans un bateau de pesée en plastique.
- Pipeter 8 mL d’un mélange de pénicilline et de streptomycine (stylo/streptocoque) dans un tube de 15 mL.
- Ajouter l’amphotéricine B pesée au mélange stylo/streptocoque et ajuster le volume à 10 ml en ajoutant le mélange de pénicilline et de streptomycine (stylo/streptocoque). Boucher le tube et dissoudre l’amphotéricine B en secouant vigoureusement.
2. Jour 1 - démarrez la procédure de décellularisation.
- Versez 400 ml de la solution décellularisante dans un bécher de 500 ml.
- Ajouter 2,0 ml de la solution antibiotique.
3. Préparation des échantillons de peau
- Lavez l’échantillon de peau humaine de l’abdomen des patients subissant une abdominoplastie dans un plateau en plastique en le mettant à l’envers et en le retournant dans une solution physiologique isotonique de NaCl à 0,9 % pour éliminer l’excès de sang et d’autres fluides biologiques.
- Épilez les cheveux à l’aide d’une pince fine et de graisse à l’aide de gros ciseaux chirurgicaux.
- Placez l’échantillon de peau sur la planche de dissection et disséquez-le à l’aide d’un scalpel, avec les graduations sur la planche de dissection comme référence pour obtenir des fragments de 3 cm x 2,5 cm (longueur par largeur), en évitant les cicatrices et les zones sales ou brûlées du tissu.
- Placez chaque fragment dans une cassette d’enrobage, fermez-la et assurez-vous que toutes les cassettes sont correctement verrouillées pour éviter les fuites de l’échantillon pendant la procédure de décellularisation.
- Placez un maximum de quatre cassettes d’enrobage avec des échantillons dans un bécher avec la solution de décellularisation. Ajoutez une barre d’agitation. Couvrir d’une feuille d’aluminium, en inscrivant sur le dessus toutes les informations permettant d’identifier l’échantillon et l’heure de début de la procédure.
- Placez le bécher sur l’agitateur magnétique et démarrez l’agitation à une vitesse de rotation de 150 tr/min. Arrêtez l’agitation. Retirez la feuille d’aluminium recouvrant le bécher et retirez les cassettes d’enrobage à l’aide d’une longue pince.
REMARQUE : Après avoir arrêté l’agitation, vérifiez la clarté de la solution. Modifier la durée de l’agitation (moins ou plus de 8 heures) en fonction du degré de l’opacification due à la libération de débris cellulaires. - Placez chaque cassette dans une parabole de 100 mm. Remplacez la solution décellularisante en répétant les étapes 3.5-3.6 pendant la nuit.
4. Jour 2 - vérifiez l’état des échantillons de peau.
- Arrêtez le processus d’agitation. Retirez la feuille d’aluminium recouvrant le bécher et retirez les cassettes d’enrobage à l’aide d’une longue pince.
- Placez chaque cassette dans une parabole de 100 mm et ouvrez-la. Vérifiez la couleur de l’échantillon.
REMARQUE : Les échantillons peuvent montrer un changement de couleur du beige indigène au blanc comme neige. - Supprimez les poils résiduels et détachez l’épiderme du derme. Remplacez la solution décellularisante en répétant les étapes 3.5-3.6.
- Arrêtez l’agitation après 8 h. Répétez les étapes 4.1 et 4.2 jusqu’à ce que l’échantillon apparaisse blanc comme neige. Arrêtez la procédure de décellularisation.
REMARQUE : Le temps d’exposition à l’action des détergents peut être prolongé si nécessaire. - Mesurez 400 ml de 1x PBS dans un cylindre de 500 ml, versez-le dans un bécher de 500 ml et ajoutez 2 ml du mélange streptocoque/amphotéricine B. Ajoutez une barre d’agitation.
- Placez un maximum de quatre cassettes contenant les échantillons dans chaque bécher avec la solution 1x PBS/antibiotiques. Couvrir d’une feuille d’aluminium et écrire toutes les informations sur le dessus comme à l’étape 3.5.
- Placez le bécher sur un agitateur magnétique et démarrez l’agitation à une vitesse de rotation de 150 tr/min pendant la nuit, à température ambiante.
5. Jour 3 - un lavage final des échantillons
- Arrêtez l’agitation. Remplacez la solution 1x PBS par 400 mL d’eau doublement distillée. Ajoutez une barre d’agitation. Couvrir de papier d’aluminium et écrire toutes les informations sur le dessus comme à l’étape 3.5.
- Placez le bécher sur un agitateur magnétique et démarrez l’agitation à une vitesse de rotation de 150 tr/min pendant 30 min.
- Arrêtez le processus d’agitation. Retirez la feuille d’aluminium recouvrant le bécher et retirez les cassettes d’enrobage à l’aide d’une longue pince.
- Placez chaque cassette d’enrobage contenant l’échantillon de peau décellularisée dans une boîte de 100 mm. Ouvrez les cassettes et séchez délicatement les échantillons de peau en les tamponnant sur des lingettes de laboratoire.
- Placez chaque échantillon de peau décellularisée dans un bateau de pesée préalablement étiqueté avec les informations sur l’échantillon. Couvrez le bateau de papier d’aluminium et écrivez toutes les informations sur le dessus pour identifier l’échantillon. Conserver à - 80 °C.
Résultats
L’objectif du protocole était d’obtenir un échantillon de d-ECM cutané à partir de tissus biologiques, en maintenant une structure 3D bien organisée et un contenu bien préservé des molécules biologiques (Figure 1). Cette méthode est principalement basée sur l’agitation constante des échantillons dans une solution contenant la combinaison de deux détergents, Triton X-100 et SDS, préservant ainsi les caractéristiques biologiques et structurelles typiques du tissu natif et réduisant le temps d’exposition pendant le processus de décellularisation. À la réception, les échantillons ont été lavés et préparés pour l’intervention, obtenant des fragments de peau propre de 3 cm x 2,5 cm, exempts de poils ou de tissu adipeux (figures 2 et 3). L’utilisation de cassettes d’enrobage a permis de minimiser la rupture tissulaire (Figure 3), ce qui a permis d’obtenir des échantillons avec une architecture plus intacte. La peau décellularisée n’a pas montré de signes de dommages mécaniques ou chimiques importants après observation macroscopique. L’épiderme a été détaché pendant la procédure de décellularisation (Figure 4A, B), et les échantillons ont changé de couleur du beige, typique de l’ensemble du tissu natif, au blanc neige, indiquant une décellularisation complète et réussie (Figure 4C).

Figure 1 : Flux de travail du protocole. Cliquez ici pour afficher une version agrandie de cette figure.

Figure 2 : Images représentatives de la préparation de l’échantillon de peau à la réception. (A) Échantillon entrant. (B, C) Évaluation macroscopique de l’échantillon placé sur la planche de dissection. (D-F) Élimination du tissu adipeux à l’aide de gros ciseaux chirurgicaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Dissection et placement de l’échantillon de peau dans les cassettes d’enrobage. (A) Épilation à l’aide de pinces fines. (B-E) Des échantillons de peau sont disséqués à l’aide d’un scalpel afin d’obtenir des fragments de 3 cm x 2,5 cm à insérer dans les cassettes d’enrobage. (F, G) Fragment de peau placé dans la cassette d’encastrement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
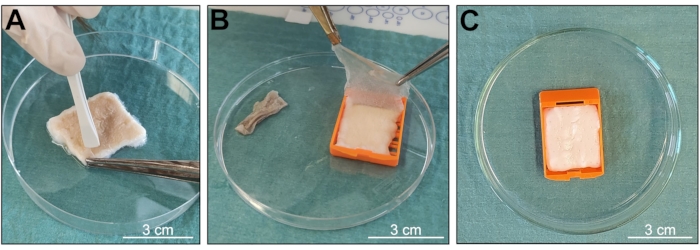
Figure 4 : Vérification de l’état de l’échantillon lors de la décellularisation. (A, B) Décollement de l’épiderme du derme. (C) Changement de couleur de l’échantillon indiquant l’apparition d’une décellularisation. Barres d’échelle = 3 cm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
Bien que le protocole décrit ci-dessus ait été optimisé et amélioré par rapport aux protocoles précédemment publiés, il présente quelques étapes critiques qui nécessitent attention et précision. La formation de mousse doit être évitée lors de la préparation de la solution de décellularisation pour éviter une dilution incorrecte des détergents. Cela pourrait être résolu en versant doucement les solutions et en les faisant couler le long de la face intérieure du cylindre. De plus, des précautions doivent être prises lors de l’élimination manuelle du tissu adipeux des échantillons, car la décellularisation à l’aide de détergents, tels que Triton X-100 et SDS, n’élimine pas la graisse, et les restes lipidiques pourraient affecter négativement l’efficacité de la méthode. Une autre étape critique est l’élimination de l’épiderme des échantillons. Lors de la décellularisation, l’épiderme se détache progressivement de la surface de la peau. Dans cette phase, il est crucial de ne le décoller à l’aide d’une pince que lorsqu’il est complètement balayé, évitant ainsi de le déchirer ou de le déchiqueter et de provoquer le piégeage de débris dans les échantillons.
Ce protocole se concentre sur la réduction de l’impact de la décellularisation sur les échantillons par deux stratégies principales : la réduction du temps d’exposition à la procédure par l’utilisation de deux détergents en combinaison 28,35,36 et la protection des échantillons contre les agressions mécaniques en les enfermant dans des cassettes d’enrobage 37. De plus, la procédure a donné des résultats positifs lorsqu’elle a été appliquée à des échantillons autres que la peau, tels que le myocarde et les vaisseaux sanguins humains et porcins. L’évaluation de l’efficacité du protocole décrit ici se fait principalement par une observation macroscopique des échantillons, qui montrerait un changement remarquable de couleur, du beige au blanc comme neige. Certes, d’autres aspects doivent être évalués pour évaluer la qualité de la d-ECM, tels que l’élimination des débris cellulaires et du matériel génétique résiduel, la préservation des protéines structurelles et du contenu des biomolécules, et la conservation des propriétés mécaniques, comme décrit ailleurs 34,37,38. L’élimination des débris cellulaires et du matériel génétique est cruciale pour réduire l’immunogénicité de la construction. Par conséquent, certains critères d’évaluation de l’efficacité de l’élimination de ces composants sont bien établis dans la littérature : la d-ECM ne doit pas avoir plus de 50 ng d’ADN double brin (ADNdb)39 par mg de poids sec de la MEC, et aucune matière nucléaire ne doit être visible au microscope.
Pour répondre à ces critères, une évaluation de la teneur en ADN résiduel et une coloration à l’hématoxyline et à l’éosine doivent être effectuées, comme décrit par Di Meglio et coll.38 pour étayer les données macroscopiques. De plus, l’évaluation de la préservation de la MEC en détectant des protéines structurelles, telles que le collagène, la fibronectine et la laminine, ainsi que des glycosaminoglycanes et des facteurs de croissance, est également appropriée34. Enfin, les propriétés mécaniques de la d-ECM doivent correspondre à celles du tissu natif40. Bien qu’il ait été démontré que l’efficacité et la faisabilité de cette procédure permettent d’obtenir des tissus décellularisés souhaitables, la méthode présente certaines limites. Par exemple, il ne permet la décellularisation que de quelques échantillons à la fois (4 pour chaque bécher), ce qui entraîne un gaspillage considérable de solutions. D’une part, l’utilisation de cassettes d’enrobage permet de protéger et de préserver les échantillons ; D’autre part, cela oblige les opérateurs à ne décellulariser que des échantillons de petites tailles qui rentrent dans les cassettes. Une autre limitation est la possibilité d’une contamination microbienne du d-ECM obtenu. Bien que la procédure implique l’ajout d’antibiotiques, il est fortement recommandé de stériliser le d-ECM par UV avant de l’utiliser. Enfin, les incubations nécessaires tout au long de la procédure doivent être calculées et organisées avec précision pour gérer le temps de manière optimale.
Ce protocole a été développé pour remédier aux inconvénients observés lors de la mise à l’essai d’autres protocoles en laboratoire. Les protocoles existants permettent un degré variable de décellularisation sans garantir une intégrité adéquate du tissu, entraînant ainsi une perte considérable de molécules biologiques essentielles et de propriétés mécaniques41. La préservation de la structure et de la composition de l’ECM après la décellularisation sont des aspects fondamentaux, car la d-ECM peut agir comme un échafaudage qui, une fois repeuplé, soutiendra les mécanismes de régénération cellulaire au sein de l’organe. En optimisant le processus de décellularisation, des échafaudages biologiques dérivés de la peau humaine peuvent être utilisés en médecine régénérative, contribuant ainsi à minimiser l’écart entre les donneurs et les patients nécessitant une greffe d’organe. De plus, les progrès réalisés dans les méthodes de recellularisation et les applications de cellules souches pluripotentes induites humaines amélioreront la distribution des types de cellules appropriés42,43 pour permettre le processus de régénération44.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Aucun
matériels
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl isotonic Physiological solution | Sigma-Aldrich | S8776 | 0.9% in water |
| 1 L beaker | VWR | 511-0318 | Clean and autoclave before use |
| 10 mL serological pipet | Falcon | 357551 | Sterile, polystyrene |
| 100 mm plates | Falcon | 351029 | Treated, sterile cell culture dish |
| 15 mL sterile tubes | Falcon | 352097 | Centrifuge sterile tubes, polypropylene |
| 1 L graduated cylinder | VWR | 612-1524 | Clean and autoclave before use |
| 2 L bottle | VWR | 215-1596 | Clean and autoclave before use |
| 25 mL serological pipet | Falcon | 357525 | Sterile, polystyrene |
| 2 L graduated cylinder | VWR | 612-3072 | Clean and autoclave before use |
| 500 mL beaker | VWR | 511-0317 | Clean and autoclave before use |
| Amphotericin B | Sigma-Aldrich | Y0000005 | Powder |
| Dissecting board | VWR | 100498-398 | Made of high-density polyethylene. |
| Dissecting scalpel | VWR | 233-5526 | Sterile and disposable |
| Embedding cassettes | Diapath | 070191 | External dimensions: 40x26x7 mm (WxDxH) |
| Fine forceps | VWR | 232-1317 | Clean and autoclave before use |
| Funnel | VWR | 221-1861 | Clean and autoclave before use |
| Hexagonal weighing boats size M | Sigma-Aldrich | Z708585 | Hexagonal, polystyrene, 51 mm Bottom I.D., 64 mm Top I.D. |
| Hexagonal weighing boats size S | Sigma-Aldrich | Z708577 | Hexagonal, polystyrene, 25 mm Bottom I.D., 38 mm Top I.D. |
| Large surgical scissors | VWR | 233-1211 | Clean and autoclave before use |
| Long forceps | VWR | 232-0096 | Clean and autoclave before use |
| Penicillin and Streptomycin | Sigma-Aldrich | P4333-100ml | Stabilized, with 10.000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered. Store at -20°C. The solution should be aliquoted into smaller working volumes to avoid repeated freeze/thaw cycles Solution. |
| Pipette gun | Eppendorf | 613-2795 | Eppendorf Easypet® 3 |
| Plastic tray | VWR | BELAH162620000 | Corrosion-proof polypropylene plastic tray |
| Potassium Chloride | Sigma-Aldrich | P9333 | Powder |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5665 | Powder |
| Sodium Chloride | Sigma-Aldrich | S7653 | Powder |
| Sodium Dodecyl Sulfate | Sigma-Aldrich | 62862 | Powder |
| Sodium Phosphate Dibasic | Sigma-Aldrich | 94046 | Powder |
| Spatula | VWR | RSGA038.210 | Clean and autoclave before use |
| Spoon | VWR | 231-1314 | Clean and autoclave before use |
| Stir bar | VWR | 442-0362 | Clean and autoclave before use |
| Stir bar retriever | VWR | 89026-262 | Molded in pure, FDA-approved PTFE |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Liquid |
Références
- Daley, W. P., Peters, S. B., Larsen, M. Extracellular matrix dynamics in development and regenerative medicine. Journal of Cell Science. 121 (3), 255-264 (2008).
- Lu, P., Takai, K., Weaver, V. M., Werb, Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harbor Perspectives in Biology. 3 (12), 005058(2011).
- Dobaczewski, M., Gonzalez-Quesada, C., Frangogiannis, N. G. The extracellular matrix as a modulator of the inflammatory and reparative response following myocardial infarction. Journal of Molecular and Cellular Cardiology. 48 (3), 504-511 (2010).
- Frangogiannis, N. G. Matricellular proteins in cardiac adaptation and disease. Physiological Reviews. 92 (2), 635-688 (2012).
- Etoh, T., et al. Myocardial and interstitial matrix metalloproteinase activity after acute myocardial infarction in pigs. American Journal of Physiology-Heart and Circulating Physiology. 281 (3), 987-994 (2001).
- Ma, Y., et al. Myofibroblasts and the extracellular matrix network in post-myocardial infarction cardiac remodeling. Pflügers Archiv: European Journal of Physiology. 466 (6), 1113-1127 (2014).
- Fong, A. H., et al. Three-dimensional adult cardiac extracellular matrix promotes maturation of human induced pluripotent stem cell-derived cardiomyocytes. Tissue Engineering. Part A. 22 (15-16), 1016-1025 (2016).
- Atance, J., Yost, M. J., Carver, W. Influence of the extracellular matrix on the regulation of cardiac fibroblast behavior by mechanical stretch. Journal of Cell Physiology. 200 (3), 377-386 (2004).
- Belviso, I., et al. The microenvironment of decellularized extracellular matrix from heart failure myocardium alters the balance between angiogenic and fibrotic signals from stromal primitive cells. International Journal of Molecular Sciences. 21 (21), 7903(2020).
- Badylak, S. F. Regenerative medicine and developmental biology: The role of the extracellular matrix. The Anatomical Record. 287 (1), 36-41 (2005).
- Volpato, F. Z., Führmann, T., Migliaresi, C., Hutmacher, D. W., Dalton, P. D. Using extracellular matrix for regenerative medicine in the spinal cord Using extracellular matrix for regenerative medicine in the spinal cord. Biomaterials. 34 (21), 4945-4955 (2013).
- Martino, M. M., et al. Extracellular matrix and growth factor engineering for controlled angiogenesis in regenerative medicine. Frontiers in Bioengineering and Biotechnology. 3, 45(2015).
- Hussey, G. S., Keane, T. J., Badylak, S. F. The extracellular matrix of the gastrointestinal tract: a regenerative medicine platform. Nature Reviews: Gastroenterology Hepathology. 14, 540-552 (2017).
- Sheng, Y., Fei, D., Leiiei, G., Xiaosong, G. Extracellular matrix scaffolds for tissue engineering and regenerative medicine. Current Stem Cell Research and Therapy. 12 (3), 233-246 (2017).
- Rozario, T., De Simone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Developmental Biology. 341 (1), 126-140 (2010).
- Takawale, A., Sakamuri, S. S. V. P., Kassiri, Z. Extracellular matrix communication and turnover in cardiac physiology and pathology. Comprehensive Physiology. 5 (2), 687-719 (2015).
- Li, L., Zhao, Q., Kong, W. Extracellular matrix remodeling and cardiac fibrosis. Matrix Biology. 68-69, 490-506 (2018).
- DeQuach, J. A., et al. Simple and high yielding method for preparing tissue specific extracellular matrix coatings for cell culture. PLoS ONE. 5 (9), 13039(2010).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissue: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Tukmachev, D., et al. Injectable extracellular matrix hydrogels as scaffolds for spinal cord injury repair. Tissue Engineering. Part A. 22 (3-4), 306-317 (2016).
- Shoichet, M. S. Polymer scaffolds for biomaterials applications. Macromolecules. 43 (2), 581-591 (2010).
- Taylor, D. A., et al. Decellularized matrices in regenerative medicine. Acta Biomaterialia. 74, 74-89 (2018).
- Gilpin, A., Yang, Y. Decellularization strategies for regenerative medicine: From processing techniques to applications. BioMed Research International. 2017, 9831534(2017).
- Heath, D. E. A review of decellularized extracellular matrix biomaterials for regenerative engineering applications. Regenerative Engineering and Translational Medicine. 5 (2), 155-166 (2019).
- Hoshiba, T., et al. Decellularized extracellular matrix as an in vitro model to study the comprehensive roles of the ECM in stem cell differentiation. Stem Cell International. 2016, 6397820(2016).
- Keane, T. J., Swinehart, I. T., Badylak, S. F. Methods of tissue decellularization used for preparation of biologic scaffolds and in vivo relevance. Methods. 84, 5-34 (2015).
- Cerbotari, S., et al. Detergent decellularization of heart valves for tissue engineering: Toxicological effects of residual detergents on human endothelial cells. Artificial Organs. 34 (3), 206-210 (2010).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B. E., et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Calle, E. A., Petersen, T. H., Niklason, L. E. Procedure for lung engineering. Journal of Visualized Experiments. (49), e2651(2011).
- Zeltinger, J., Landeen, L. K., Alexander, H. G., Kidd, I. D., Sibanda, B. Development and Characterization of Tissue-Engineered Aortic Valves. Tissue engineering. Part A. 7 (1), 9-22 (2001).
- Dahl, S., et al. Decellularized native and engineered arterial scaffolds for transplantation. Cell Transplantation. 12 (6), 659-666 (2003).
- Belviso, I., et al. Decellularized human dermal matrix as a biological scaffold for cardiac repair and regeneration. Frontiers inTissue Engineering and Regenerative Medicine. 8, 229(2020).
- Greco, K. V., et al. Characterisation of porcine dermis scaffolds decellularised using a novel non-enzymatic method for biomedical applications. Journal of Biomaterials Applications. 30 (2), 239-253 (2015).
- Brouki, M. P., et al. Decellularization and preservation of human skin: A platform for tissue engineering and reconstructive surgery. Methods. 171, 62-67 (2020).
- Carbonaro, D., et al. A low-cost scalable 3D-printed sample-holder for agitation-based decellularization of biological tissues. Medical Engineering & Physics. 85, 7-15 (2020).
- Di Meglio, F., et al. Optimization of human myocardium decellularization method for the construction of implantable patches. Tissue Engineering. Part C Methods. 23 (9), 525-539 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Putame, G., et al. Compact and tunable stretch bioreactor advancing tissue engineering implementation. Application to engineered cardiac constructs. Medical Engineering & Physics. 84, 1-9 (2020).
- Parmaksiz, M., Dogan, A., Odabas, S., Elçin, A. E., Elçin, Y. M. Clinical applications of decellularized extracellular matrices for tissue engineering and regenerative medicine. Biomedical Materials. 11 (2), 022003(2016).
- Sacco, A. M., et al. Diversity of dermal fibroblasts as major determinant of variability in cell reprogramming. Journal of Cellular and Molecular Medicine. 23 (6), 4256-4268 (2019).
- Belviso, I., et al. Isolation of adult human dermal fibroblasts from abdominal skin and generation of induced pluripotent stem cells using a non-integrating method. Journal of Visualized Experiments: JoVE. (155), e60629(2020).
- Belviso, I., Di Meglio, F., Romano, V., Montagnani, S., Castaldo, C. Non-modified RNA-based reprogramming of human dermal fibroblasts into induced pluripotent stem cells. Methods in Molecular Biology. , (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon