Method Article
재생 의학을 위한 고도로 보존된 인간 무세포 피부 매트릭스의 준비를 위한 탈세포화(Decellularization for the Preparation of highly Preserved Human Acellular Skin Matrix for Regenerative Medicine)
* 이 저자들은 동등하게 기여했습니다
요약
탈세포화된 인간 피부는 조직 재생에 적합합니다. 탈세포화(decellularization)의 주요 문제는 구조 단백질, 글리코사미노글리칸(glycosaminoglycans, GAG) 및 성장 인자(growth factor)의 적절한 함량과 함께 네이티브 구조를 보존하는 것입니다. 제안된 방법은 빠르고 효과적인 탈세포화를 가능하게 하여 잘 보존된 본래 특징을 가진 탈세포화된 피부를 생성합니다.
초록
세포외 기질(ECM)은 다양한 생체 활성 분자의 함량으로 인해 주변 세포의 자가 재생, 증식, 생존 및 분화를 지원하기 위해 생물물리학적, 생화학적 자극을 제공합니다. 이러한 특성으로 인해 ECM은 최근 조직 재생을 촉진하기 위한 생물학적 골격을 만들 수 있는 유망한 후보로 간주되고 있습니다. 새로운 연구에 따르면 탈세포화된 인간 조직은 3차원(3D) 구조와 기본 생물학적 분자의 내용을 보존하면서 구조적 및 생화학적 프로필에서 네이티브 ECM과 유사할 수 있음을 보여주었습니다. 따라서 탈세포화된 ECM은 많은 장기의 조직 리모델링, 복구 및 기능적 재건을 촉진하는 데 사용할 수 있습니다. 적절한 탈세포화 절차를 선택하는 것은 세포에 이상적인 미세환경의 특성을 유지하는 무세포 조직을 얻는 데 중요합니다.
여기에 설명된 프로토콜은 재현 가능하고 효과적인 cell-free 생물학적 ECM을 얻기 위한 탈세포화 방법에 대한 자세한 단계별 설명을 제공합니다. 성형 수술을 받은 환자의 피부 조각을 도데실황산나트륨(SDS), 트리톤 X-100 및 항생제의 조합을 사용하여 축소하고 탈세포화했습니다. 샘플을 통한 용액의 규칙적이고 균일한 운반을 촉진하기 위해, 기계적 모욕으로부터 보호하기 위해 임베딩 카세트로 동봉되었습니다. 탈세포화 시술 후 피부 조각의 백설공주는 완전하고 성공적인 탈세포화를 나타냅니다. 또한 탈세포화된 샘플은 손상되지 않고 잘 보존된 구조를 보여주었습니다. 결과는 제안된 탈세포화 방법이 효과적이고 빠르며 재현 가능하고 구조적 손상으로부터 샘플을 보호한다는 것을 시사합니다.
서문
ECM은 세포의 골격 역할을 하여 다양한 구성 요소로 유지되는 복잡한 구조를 통해 세포를 지원하며, 심장 및 심장 조직 기능의 기계적 특성을 담당하는 주요 요인 중 하나입니다 1,2. ECM이 조직 리모델링에 적극적인 역할을 한다는 증거가 증가함에 따라 ECM이 수동 구성 요소라는 기존의 가정은 더 이상 쓸모가 없어졌습니다 3,4,5,6. ECM의 역할은 상주 세포에 생물물리학적, 생화학적 신호를 제공하는 것입니다. 이러한 신호가 많은 근본적인 세포 행동에 영향을 미쳐 수축 기능, 증식, 이동 및 분화 가능성에 영향을 미칠 수 있다는 것은 잘 알려져 있습니다 7,8,9. 따라서 ECM은 조직 공학 및 재생 의학에서 치료 지원 도구로 점점 더 많이 사용되고 있습니다 9,10,11,12,13.
ECM은 콜라겐(collagen), 엘라스틴(elastin), 피브로넥틴(fibronectin), 프로테오글리칸(proteoglycan), 라미닌(laminin)과 같은 여러 단백질과 ECM 결합 성장 인자로 구성되며, 모두 세포 모집, 이동, 분화, 세포 정렬 및 증식과 같은 재생 메커니즘에 관여합니다14. 조직의 기계적 특성은 또한 장기의 생리 병리학에 큰 관련이 있습니다. 실제로, 기계적 특성의 변화는 종종 여러 질병의 발병 및 진화와 관련이 있습니다. 그 이유는 ECM이 수정될 때 환경에서 오는 신호가 유전자 및 단백질 발현의 변화를 유도하여 기능 장애를 유발한다는 사실에 있습니다15,16.
장기 복구를 위한 재생 요법은 현재 신체가 고장난 장기를 치유하기 위해 천연 조직의 정교한 미세 환경을 복제하는 데 중점을 두고 있습니다. 많은 조직 공학 접근 방식의 빠른 속도에도 불구하고 조직은 여전히 인위적인 절차로 전체와 복잡성을 정확하게 재현할 수 없습니다. 합성 물질은 세포 미세환경의 기계적 및 생화학적 특성을 시뮬레이션하기 위해 적절하게 조정할 수 있기 때문에 지금까지 주로 사용되었습니다. 그럼에도 불구하고, 그들은 토착 조직 내의 수많은 상호 작용을 모방할 수 없다는 점, 이를 생산하는 데 드는 기술 비용, 그리고 토착 조직보다 자연스럽고 생체 적합성이 떨어진다는 사실과 같은 한계가 있습니다 17,18,19. 또한, 주로 단백질과 용해성 인자의 측면에서 이들의 구성은 자연적인 것과 크게 다르며, 이는 복제가 극히 어렵다20.
도움이 필요한 환자와 장기 이식 사이의 격차를 줄이기 위한 재생 의학의 최첨단 접근 방식은 탈세포화된 세포외 기질(d-ECM)로 만든 골격을 만들고 손상된 장기를 재생하기 위해 적절한 세포 유형으로 다시 채우는 것입니다. 탈세포화(Decellularization)는 ECM을 고유 세포 및 유전 물질로부터 분리하여 자연적이고 생체 모방적인 골격을 생성하는 과정으로, 환자에게 이식되면 면역 반응 및 거부 반응을 피할 수 있습니다 21,22,23. 이렇게 얻은 ECM은 그런 다음 기능적 조직을 생성하기 위해 다시 채워질 수 있습니다. d-ECM을 개발할 때 가장 큰 문제는 방법입니다. 모든 탈세포화 기술의 주요 목표는 기본 ECM 구성, 강성 및 3D 구조를 보존하는 것이며 모든 전략에는 장점과 단점이 모두 있습니다. 조직에서 세포 함량과 DNA를 제거하려면 화학적 또는 물리적 제제의 사용 또는 이 둘의 조합이 필요하기 때문에 각 탈세포화 절차는 ECM의 정도가 다르지만 파괴를 일으킵니다. 따라서 ECM 24,25,26의 손상을 최소화하는 것이 중요합니다.
in vitro에서 native ECM을 재구성하기 위한 플랫폼으로 native ECM을 활용하는 것이 매우 바람직합니다. 이를 위해 여러 탈세포화 프로토콜이 광범위한 조직에 적용되었습니다 27,28,29,30. 실제로, 탈세포화 연구 및 ECM 개발의 초기 단계부터 동물과 인간의 동맥, 대동맥 판막 및 말초 신경과 같은 여러 조직이 탈세포화되었으며, 일부 d-ECM은 여전히 상업적으로 이용 가능하며 조직 교체 또는 상처 치유에 사용됩니다 31,32,33. 최근에는 인간의 피부도 심장전구세포(CPC)의 재생 전위를 높이고 심장 수축성에 적응할 수 있는 구성 및 기계적 특성으로 인해 심장 복구를 위한 탈세포화된 골격을 생산할 수 있는 적합한 후보로 부상하고 있습니다34. 이 논문은 성인 인간 피부에서 탈세포화된 스캐폴드를 생산하는 간단하고 빠른 프로토콜에 대해 설명하여 잘 보존된 아키텍처를 가진 d-ECM을 개발할 수 있도록 합니다.
프로토콜
인체 조직의 표본은 헬싱키 선언의 원칙에 따라 수집되었으며 대학 병원 "Federico II" 지침을 준수했습니다. 이 연구에 참여한 모든 환자는 서면 동의서를 제공했습니다.
1. 솔루션 준비
- 1200mL의 1% 탈세포화 용액 준비
- 눈금이 매겨진 실린더에서 588mL의 이중 증류수를 계량하고 1L 비커에 옮겨 600mL의 2% Triton X-100 용액을 준비합니다. 혈청학적 피펫을 사용하여 Triton X-100 12mL와 교반 막대를 비커에 추가합니다. 비커를 자석 교반기에 놓고 Triton X-100이 완전히 용해될 때까지 용액을 혼합합니다.
- 동요를 멈추십시오. 교반 막대 리트리버를 사용하여 교반 막대를 제거합니다. 실온에서 보관하십시오.
- 눈금이 매겨진 실린더에서 550mL의 이중 증류수를 계량하여 600L 비커에 옮겨 2% SDS 용액 600mL를 준비합니다.
- 플라스틱 계량 보트에 SDS 분말 12g의 무게를 측정하고 1.1.3단계에서 이중 증류수가 들어 있는 비커로 옮깁니다.
알림: 1.1.4단계는 화학 물질 후드 아래에서 수행해야 하며 사용자는 개인 보호 장비를 착용해야 합니다. - 교반 막대를 추가하고 비커를 자석 교반기에 놓고 SDS가 완전히 용해될 때까지 용액을 혼합합니다.
- 교반 과정을 중지하십시오. 교반 막대 리트리버를 사용하여 교반 막대를 제거합니다.
- 용액을 눈금이 매겨진 실린더로 옮기고 이중 증류수를 추가하여 부피를 600mL로 조정합니다.
- 1.1.1단계에서 준비한 2% Triton X-100 용액을 2L 실린더에 붓습니다.
- 1.1.3-1.1.7단계에서 준비한 2% SDS 용액을 동일한 2L 실린더에 붓고 총 부피 1200mL를 얻습니다.
- 파라필름으로 덮고 반전으로 부드럽게 혼합하여 균일한 용액을 얻습니다.
- 거품 형성을 방지하기 위해 깔때기를 사용하여 혼합 용액을 2L 병으로 옮깁니다. 용액을 +4 °C에서 보관하십시오.
- 1x 인산염 완충 식염수(PBS)의 제조
- 인산칼륨 일염기성 0.1g, 염화칼륨 0.1g, 염화나트륨 4.0g, 이염기성 인산나트륨 0.575g을 멸균 이중 증류수에 용해하여 1x 인산완충식염수(PBS) 500mL를 준비합니다. pH 값(7.4)을 확인합니다.
- 사용할 때까지 +4 °C에서 보관하십시오.
- 항생제 용액의 제조
- 플라스틱 계량 보트에서 625μg의 암포테리신 B의 무게를 잰다.
- 페니실린과 스트렙토마이신(펜/연쇄상구균) 혼합물 8mL를 15mL 튜브에 피펫팅합니다.
- 칭량된 암포테리신 B를 펜/연쇄상구균 혼합물에 첨가하고 페니실린과 스트렙토마이신(펜/연쇄상구균) 혼합물을 첨가하여 부피를 10mL로 조정합니다. 튜브에 뚜껑을 씌우고 세게 흔들어 암포테리신 B를 녹입니다.
2. 1일차 - 탈세포화 절차를 시작합니다.
- 탈세포화 용액 400mL를 500mL 비커에 붓습니다.
- 항생제 용액 2.0mL를 추가합니다.
3. 피부 샘플의 준비
- 복부 성형술을 받는 환자의 복부에서 채취한 인체 피부 샘플을 플라스틱 트레이에 0.9% NaCl 등장성 생리학적 용액으로 꽁꽁 묶고 거꾸로 뒤집어 과도한 혈액 및 기타 생물학적 체액을 제거합니다.
- 큰 수술 용 가위를 사용하여 미세한 집게를 사용하여 머리카락과 지방을 제거하십시오.
- 피부 샘플을 해부판에 놓고 메스를 사용하여 해부하고, 해부판의 눈금을 참조하여 조직의 흉터와 더럽거나 화상을 입은 부분을 피하면서 3cm x 2.5cm 조각(너비 기준)을 얻습니다.
- 각 단편을 임베딩 카세트에 넣고 닫은 다음 탈세포화 절차 중 샘플의 누출을 방지하기 위해 모든 카세트가 적절하게 잠겨 있는지 확인합니다.
- 최대 4개의 임베딩 카세트를 s와 함께 놓습니다.amp탈세포화 용액이 있는 비커에 넣습니다. 교반 막대를 추가합니다. 알루미늄 호일로 덮고 샘플과 절차 시작 시간을 식별하기 위한 모든 정보를 상단에 씁니다.
- 비커를 자석 교반기에 놓고 150rpm의 회전 속도로 교반을 시작합니다. 동요를 멈추십시오. 비커를 덮고 있는 알루미늄 호일을 제거하고 긴 집게로 임베딩 카세트를 꺼냅니다.
알림: 교반을 멈춘 후 용액의 투명도를 확인하십시오. 세포 파편의 방출로 인한 흐림의 정도에 따라 교반 기간(8시간 미만 또는 초과)을 수정합니다. - 각 카세트를 100mm 접시에 넣습니다. 하룻밤 동안 3.5-3.6단계를 반복하여 탈세포화 용액을 교체합니다.
4. 2일차 - 피부 샘플의 상태를 확인합니다.
- 교반 과정을 중지하십시오. 비커를 덮고 있는 알루미늄 호일을 제거하고 긴 집게로 임베딩 카세트를 꺼냅니다.
- 각 카세트를 100mm 접시에 넣고 엽니다. 샘플의 색상을 확인하십시오.
참고: 샘플은 기본 베이지색에서 백설공주로 색상 변화를 보일 수 있습니다. - 잔여 털을 제거하고 진피에서 표피를 분리합니다. 3.5-3.6단계를 반복하여 탈세포화 용액을 교체합니다.
- 8시간 후에 교반을 멈추십시오. 샘플이 백설 공주처럼 보일 때까지 4.1-4.2 단계를 반복합니다. 탈세포화 절차를 중지합니다.
알림: 필요한 경우 세제의 작용에 노출되는 시간을 연장할 수 있습니다. - 500mL 실린더에서 1x PBS 400mL를 측정하고 500mL 비커에 붓고 Pen Strep/Amphotericin B 혼합물 2mL를 추가합니다. 교반 막대를 추가합니다.
- 샘플이 포함된 최대 4개의 카세트를 배치합니다.amp1x PBS/항생제 용액이 있는 각 비커에 넣습니다. 알루미늄 호일로 덮고 3.5단계와 같이 상단에 모든 정보를 적습니다.
- 비커를 자기 교반기에 놓고 실온에서 밤새 150rpm의 회전 속도로 교반을 시작합니다.
5. 3일차 - 샘플의 최종 세척
- 동요를 멈추십시오. 1x PBS 용액을 400mL의 이중 증류수로 교체합니다. 교반 막대를 추가합니다. 알루미늄 호일로 덮고 3.5단계와 같이 맨 위에 모든 정보를 씁니다.
- 비커를 자기 교반기에 놓고 150분 동안 30rpm의 회전 속도로 교반을 시작합니다.
- 교반 과정을 중지하십시오. 비커를 덮고 있는 알루미늄 호일을 제거하고 긴 집게로 임베딩 카세트를 꺼냅니다.
- 탈세포화된 피부 샘플이 들어 있는 각 임베딩 카세트를 100mm 접시에 놓습니다. 카세트를 열고 실험실 물티슈에 두드려 피부 샘플을 부드럽게 말리십시오.
- 탈세포화된 각 피부 샘플을 샘플에 대한 정보가 미리 태그된 계량 보트에 넣습니다. 알루미늄 호일로 보트를 덮고 샘플을 식별하기 위해 상단에 모든 정보를 쓰십시오. -80 °C에서 보관하십시오.
결과
이 프로토콜의 목적은 잘 조직된 3D 구조와 잘 보존된 생물학적 분자 함량을 유지하면서 생물학적 조직에서 skin d-ECM 샘플을 얻는 것이었습니다(그림 1). 이 방법은 주로 Triton X-100 및 SDS의 두 가지 세제가 결합된 용액에서 샘플을 지속적으로 교반하는 것을 기반으로 하여 천연 조직의 전형적인 생물학적 및 구조적 특성을 보존하고 탈세포화 과정에서 노출 시간을 줄입니다. 수령 시, 샘플을 세척하고 절차를 위해 준비하여 머리카락이나 지방 조직이 없는 3cm x 2.5cm의 깨끗한 피부 조각을 얻었습니다(그림 2 및 그림 3). 임베딩 카세트를 사용하여 조직 파괴를 최소화할 수 있었으며(그림 3), 그 결과 보다 온전한 구조를 가진 샘플을 얻을 수 있었습니다. 탈세포화된 피부는 거시적 관찰 후 심각한 기계적 또는 화학적 손상의 징후를 보이지 않았습니다. 탈세포화 절차 중에 표피가 분리되었고(그림 4A, B), 샘플의 색이 전체 고유 조직의 전형적인 베이지색에서 백설공주로 변하여 완전하고 성공적인 탈세포화를 나타냅니다(그림 4C).

그림 1: 프로토콜 워크플로우. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 수령 시 피부 시료 준비의 대표 이미지.(A) 입고되는 시료. (나, 다) 해부 보드에 놓인 샘플의 거시적 평가. (D-F) 큰 외과 용 가위를 사용하여 지방 조직을 제거합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 피부 샘플 해부 및 임베딩 카세트에서의 배치.(A) 가는 집게로 제거한 모발. (B-E) 메스를 사용하여 피부 샘플을 해부하여 임베딩 카세트에 맞는 3cm x 2.5cm 조각을 얻었습니다. (여, 지) 임베딩 카세트에 삽입된 피부 조각. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
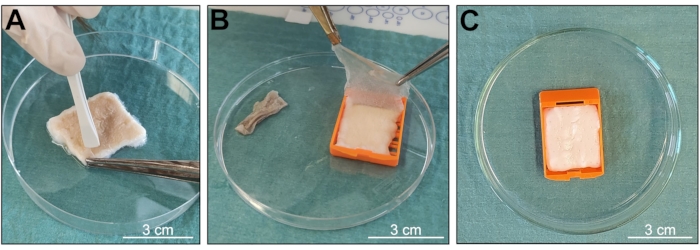
그림 4: 탈세포화(decellularization) 중 시료 상태 확인. (가, 나) 진피에서 표피가 분리됩니다. (C) 탈세포화의 발생을 나타내는 샘플 색상 변화. 눈금 막대 = 3cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
위에서 설명한 프로토콜은 이전에 발표된 프로토콜에 비해 최적화되고 개선되었지만, 주의와 정밀도가 필요한 몇 가지 중요한 단계를 제시합니다. 세제의 잘못된 희석을 방지하기 위해 탈세포화 용액을 준비하는 동안 거품 형성을 피해야 합니다. 이것은 용액을 부드럽게 붓고 실린더 내부를 따라 흐르게 함으로써 해결할 수 있습니다. 또한 Triton X-100 및 SDS와 같은 세제를 사용한 탈세포화는 지방을 제거하지 않으며 지질 잔여물이 방법의 효과에 부정적인 영향을 미칠 수 있으므로 샘플에서 지방 조직을 수동으로 제거할 때 주의해야 합니다. 또 다른 중요한 단계는 샘플에서 표피를 제거하는 것입니다. 탈세포화가 진행되는 동안 표피는 피부 표면에서 점차 분리됩니다. 이 단계에서는 완전히 쓸어낸 후에만 집게로 벗겨내는 것이 중요하므로 찢어지거나 파쇄되어 샘플 내에 파편이 갇히는 것을 방지할 수 있습니다.
이 프로토콜은 두 가지 주요 전략에 의해 샘플에 대한 탈세포화의 영향을 줄이는 데 중점을 둡니다: 28,35,36 조합으로 두 개의 세제를 사용하여 절차에 대한 노출 시간을 단축하고 임베딩 카세트(37)에 둘러싸서 샘플을 기계적 모욕으로부터 보호합니다. 또한, 이 절차는 인간 및 돼지 심근 및 혈관과 같은 피부 이외의 샘플에 적용했을 때 성공적인 결과를 얻었습니다. 여기에 설명된 프로토콜의 효과에 대한 평가는 주로 샘플의 거시적 관찰에 의해 수행되며, 이는 베이지색에서 백설공주에 이르기까지 현저한 색상 변화를 보여줍니다. 확실히, 다른 곳에서 기술된 바와 같이, 세포 파편 및 잔류 유전 물질의 제거, 구조 단백질 및 생체 분자 함량의 보존, 기계적 특성의 유지와 같은 d-ECM의 품질을 평가하기 위해 몇 가지 다른 측면을 평가해야 합니다 34,37,38. 세포 파편과 유전 물질의 제거는 구조물의 면역원성을 줄이는 데 중요합니다. d-ECM은 ECM 건조 중량 mg당 50ng 이하의 이중 가닥 DNA(dsDNA)39를 가져야 하며, 현미경으로 볼 수 있는 핵 물질이 없어야 합니다.
이러한 기준을 충족하려면 거시적 데이터를 뒷받침하기 위해 Di Meglio et al.38 에 설명된 대로 잔류 DNA 함량 평가 및 헤마톡실린 및 에오신 염색을 수행해야 합니다. 또한, 콜라겐(collagen), 피브로넥틴(fibronectin), 라미닌(laminin)과 같은 구조 단백질을 글리코사미노글리칸(glycosaminoglycans) 및 성장 인자(growth factor)와 함께 검출하여 ECM 보존을 평가하는 것도 적절하다34. 마지막으로, d-ECM의 기계적 특성은 천연 조직40의 기계적 특성과 일치해야 합니다. 이 절차의 효능 및 타당성이 바람직한 탈세포화된 조직을 수득하는 것으로 입증되었지만, 이 방법에는 몇 가지 한계가 있습니다. 예를 들어, 한 번에 몇 개의 샘플만 탈세포화할 수 있으므로(각 비커당 4개) 상당한 용액 낭비가 발생합니다. 한편으로는, 임베딩 카세트를 사용하면 샘플을 보호하고 보존하는 데 도움이 됩니다. 다른 한편으로는, 작업자가 카세트에 맞는 작은 크기의 샘플만 탈세포화하도록 강제합니다. 또 다른 한계는 얻어진 d-ECM의 미생물 오염 가능성입니다. 이 절차에는 항생제 첨가가 포함되지만 사용하기 전에 UV로 d-ECM을 살균하는 것이 좋습니다. 마지막으로, 전체 절차에 걸쳐 필요한 배양은 시간을 최적으로 관리할 수 있도록 정확하게 계산되고 구성되어야 합니다.
이 프로토콜은 실험실에서 다른 프로토콜을 테스트하는 동안 관찰된 단점을 해결하기 위해 개발되었습니다. 기존 프로토콜은 조직의 적절한 무결성을 보장하지 않고 다양한 정도의 탈세포화를 허용하므로 필수 생물학적 분자 및 기계적 특성의 상당한 손실을 수반합니다41. 탈세포화 후 ECM 구조 및 조성의 보존은 d-ECM이 일단 다시 채워지면 기관 내의 세포 재생 메커니즘을 지원하는 골격 역할을 할 수 있기 때문에 기본적인 측면입니다. 탈세포화 과정을 최적화함으로써 인간 피부에서 유래한 생물학적 골격을 재생 의학에 활용할 수 있어 장기 이식이 필요한 기증자와 환자 간의 격차를 최소화하는 데 도움이 될 수 있습니다. 또한, 재세포화(recellularization) 방법의 발전 및 인간 유도 만능 줄기세포 유래 세포의 응용은 적절한 세포 유형(42,43)의 분포를 개선하여 재생 과정(44)을 가능하게 할 것이다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
없음
자료
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl isotonic Physiological solution | Sigma-Aldrich | S8776 | 0.9% in water |
| 1 L beaker | VWR | 511-0318 | Clean and autoclave before use |
| 10 mL serological pipet | Falcon | 357551 | Sterile, polystyrene |
| 100 mm plates | Falcon | 351029 | Treated, sterile cell culture dish |
| 15 mL sterile tubes | Falcon | 352097 | Centrifuge sterile tubes, polypropylene |
| 1 L graduated cylinder | VWR | 612-1524 | Clean and autoclave before use |
| 2 L bottle | VWR | 215-1596 | Clean and autoclave before use |
| 25 mL serological pipet | Falcon | 357525 | Sterile, polystyrene |
| 2 L graduated cylinder | VWR | 612-3072 | Clean and autoclave before use |
| 500 mL beaker | VWR | 511-0317 | Clean and autoclave before use |
| Amphotericin B | Sigma-Aldrich | Y0000005 | Powder |
| Dissecting board | VWR | 100498-398 | Made of high-density polyethylene. |
| Dissecting scalpel | VWR | 233-5526 | Sterile and disposable |
| Embedding cassettes | Diapath | 070191 | External dimensions: 40x26x7 mm (WxDxH) |
| Fine forceps | VWR | 232-1317 | Clean and autoclave before use |
| Funnel | VWR | 221-1861 | Clean and autoclave before use |
| Hexagonal weighing boats size M | Sigma-Aldrich | Z708585 | Hexagonal, polystyrene, 51 mm Bottom I.D., 64 mm Top I.D. |
| Hexagonal weighing boats size S | Sigma-Aldrich | Z708577 | Hexagonal, polystyrene, 25 mm Bottom I.D., 38 mm Top I.D. |
| Large surgical scissors | VWR | 233-1211 | Clean and autoclave before use |
| Long forceps | VWR | 232-0096 | Clean and autoclave before use |
| Penicillin and Streptomycin | Sigma-Aldrich | P4333-100ml | Stabilized, with 10.000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered. Store at -20°C. The solution should be aliquoted into smaller working volumes to avoid repeated freeze/thaw cycles Solution. |
| Pipette gun | Eppendorf | 613-2795 | Eppendorf Easypet® 3 |
| Plastic tray | VWR | BELAH162620000 | Corrosion-proof polypropylene plastic tray |
| Potassium Chloride | Sigma-Aldrich | P9333 | Powder |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5665 | Powder |
| Sodium Chloride | Sigma-Aldrich | S7653 | Powder |
| Sodium Dodecyl Sulfate | Sigma-Aldrich | 62862 | Powder |
| Sodium Phosphate Dibasic | Sigma-Aldrich | 94046 | Powder |
| Spatula | VWR | RSGA038.210 | Clean and autoclave before use |
| Spoon | VWR | 231-1314 | Clean and autoclave before use |
| Stir bar | VWR | 442-0362 | Clean and autoclave before use |
| Stir bar retriever | VWR | 89026-262 | Molded in pure, FDA-approved PTFE |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Liquid |
참고문헌
- Daley, W. P., Peters, S. B., Larsen, M. Extracellular matrix dynamics in development and regenerative medicine. Journal of Cell Science. 121 (3), 255-264 (2008).
- Lu, P., Takai, K., Weaver, V. M., Werb, Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harbor Perspectives in Biology. 3 (12), 005058(2011).
- Dobaczewski, M., Gonzalez-Quesada, C., Frangogiannis, N. G. The extracellular matrix as a modulator of the inflammatory and reparative response following myocardial infarction. Journal of Molecular and Cellular Cardiology. 48 (3), 504-511 (2010).
- Frangogiannis, N. G. Matricellular proteins in cardiac adaptation and disease. Physiological Reviews. 92 (2), 635-688 (2012).
- Etoh, T., et al. Myocardial and interstitial matrix metalloproteinase activity after acute myocardial infarction in pigs. American Journal of Physiology-Heart and Circulating Physiology. 281 (3), 987-994 (2001).
- Ma, Y., et al. Myofibroblasts and the extracellular matrix network in post-myocardial infarction cardiac remodeling. Pflügers Archiv: European Journal of Physiology. 466 (6), 1113-1127 (2014).
- Fong, A. H., et al. Three-dimensional adult cardiac extracellular matrix promotes maturation of human induced pluripotent stem cell-derived cardiomyocytes. Tissue Engineering. Part A. 22 (15-16), 1016-1025 (2016).
- Atance, J., Yost, M. J., Carver, W. Influence of the extracellular matrix on the regulation of cardiac fibroblast behavior by mechanical stretch. Journal of Cell Physiology. 200 (3), 377-386 (2004).
- Belviso, I., et al. The microenvironment of decellularized extracellular matrix from heart failure myocardium alters the balance between angiogenic and fibrotic signals from stromal primitive cells. International Journal of Molecular Sciences. 21 (21), 7903(2020).
- Badylak, S. F. Regenerative medicine and developmental biology: The role of the extracellular matrix. The Anatomical Record. 287 (1), 36-41 (2005).
- Volpato, F. Z., Führmann, T., Migliaresi, C., Hutmacher, D. W., Dalton, P. D. Using extracellular matrix for regenerative medicine in the spinal cord Using extracellular matrix for regenerative medicine in the spinal cord. Biomaterials. 34 (21), 4945-4955 (2013).
- Martino, M. M., et al. Extracellular matrix and growth factor engineering for controlled angiogenesis in regenerative medicine. Frontiers in Bioengineering and Biotechnology. 3, 45(2015).
- Hussey, G. S., Keane, T. J., Badylak, S. F. The extracellular matrix of the gastrointestinal tract: a regenerative medicine platform. Nature Reviews: Gastroenterology Hepathology. 14, 540-552 (2017).
- Sheng, Y., Fei, D., Leiiei, G., Xiaosong, G. Extracellular matrix scaffolds for tissue engineering and regenerative medicine. Current Stem Cell Research and Therapy. 12 (3), 233-246 (2017).
- Rozario, T., De Simone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Developmental Biology. 341 (1), 126-140 (2010).
- Takawale, A., Sakamuri, S. S. V. P., Kassiri, Z. Extracellular matrix communication and turnover in cardiac physiology and pathology. Comprehensive Physiology. 5 (2), 687-719 (2015).
- Li, L., Zhao, Q., Kong, W. Extracellular matrix remodeling and cardiac fibrosis. Matrix Biology. 68-69, 490-506 (2018).
- DeQuach, J. A., et al. Simple and high yielding method for preparing tissue specific extracellular matrix coatings for cell culture. PLoS ONE. 5 (9), 13039(2010).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissue: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Tukmachev, D., et al. Injectable extracellular matrix hydrogels as scaffolds for spinal cord injury repair. Tissue Engineering. Part A. 22 (3-4), 306-317 (2016).
- Shoichet, M. S. Polymer scaffolds for biomaterials applications. Macromolecules. 43 (2), 581-591 (2010).
- Taylor, D. A., et al. Decellularized matrices in regenerative medicine. Acta Biomaterialia. 74, 74-89 (2018).
- Gilpin, A., Yang, Y. Decellularization strategies for regenerative medicine: From processing techniques to applications. BioMed Research International. 2017, 9831534(2017).
- Heath, D. E. A review of decellularized extracellular matrix biomaterials for regenerative engineering applications. Regenerative Engineering and Translational Medicine. 5 (2), 155-166 (2019).
- Hoshiba, T., et al. Decellularized extracellular matrix as an in vitro model to study the comprehensive roles of the ECM in stem cell differentiation. Stem Cell International. 2016, 6397820(2016).
- Keane, T. J., Swinehart, I. T., Badylak, S. F. Methods of tissue decellularization used for preparation of biologic scaffolds and in vivo relevance. Methods. 84, 5-34 (2015).
- Cerbotari, S., et al. Detergent decellularization of heart valves for tissue engineering: Toxicological effects of residual detergents on human endothelial cells. Artificial Organs. 34 (3), 206-210 (2010).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B. E., et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Calle, E. A., Petersen, T. H., Niklason, L. E. Procedure for lung engineering. Journal of Visualized Experiments. (49), e2651(2011).
- Zeltinger, J., Landeen, L. K., Alexander, H. G., Kidd, I. D., Sibanda, B. Development and Characterization of Tissue-Engineered Aortic Valves. Tissue engineering. Part A. 7 (1), 9-22 (2001).
- Dahl, S., et al. Decellularized native and engineered arterial scaffolds for transplantation. Cell Transplantation. 12 (6), 659-666 (2003).
- Belviso, I., et al. Decellularized human dermal matrix as a biological scaffold for cardiac repair and regeneration. Frontiers inTissue Engineering and Regenerative Medicine. 8, 229(2020).
- Greco, K. V., et al. Characterisation of porcine dermis scaffolds decellularised using a novel non-enzymatic method for biomedical applications. Journal of Biomaterials Applications. 30 (2), 239-253 (2015).
- Brouki, M. P., et al. Decellularization and preservation of human skin: A platform for tissue engineering and reconstructive surgery. Methods. 171, 62-67 (2020).
- Carbonaro, D., et al. A low-cost scalable 3D-printed sample-holder for agitation-based decellularization of biological tissues. Medical Engineering & Physics. 85, 7-15 (2020).
- Di Meglio, F., et al. Optimization of human myocardium decellularization method for the construction of implantable patches. Tissue Engineering. Part C Methods. 23 (9), 525-539 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Putame, G., et al. Compact and tunable stretch bioreactor advancing tissue engineering implementation. Application to engineered cardiac constructs. Medical Engineering & Physics. 84, 1-9 (2020).
- Parmaksiz, M., Dogan, A., Odabas, S., Elçin, A. E., Elçin, Y. M. Clinical applications of decellularized extracellular matrices for tissue engineering and regenerative medicine. Biomedical Materials. 11 (2), 022003(2016).
- Sacco, A. M., et al. Diversity of dermal fibroblasts as major determinant of variability in cell reprogramming. Journal of Cellular and Molecular Medicine. 23 (6), 4256-4268 (2019).
- Belviso, I., et al. Isolation of adult human dermal fibroblasts from abdominal skin and generation of induced pluripotent stem cells using a non-integrating method. Journal of Visualized Experiments: JoVE. (155), e60629(2020).
- Belviso, I., Di Meglio, F., Romano, V., Montagnani, S., Castaldo, C. Non-modified RNA-based reprogramming of human dermal fibroblasts into induced pluripotent stem cells. Methods in Molecular Biology. , (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유